Evaluation of Cardiac Contractility Modulation Therapy in 2D Human Stem Cell-Derived Cardiomyocytes
In This Article
Summary
Here, we demonstrate a non-invasive cardiac medical device contractility evaluation method using 2D human induced pluripotent stem cell-derived cardiomyocyte (hiPSC-CM) monolayers, plated on a flexible substrate, coupled with video-based microscopy. This tool will be useful for the in vitro evaluation of the contractile properties of cardiac electrophysiology devices.
Abstract
Human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs) are currently being explored for multiple in vitro applications and have been used in regulatory submissions. Here, we extend their use to cardiac medical device safety or performance assessments. We developed a novel method to evaluate cardiac medical device contractile properties in robustly contracting 2D hiPSC-CMs monolayers plated on a flexible extracellular matrix (ECM)-based hydrogel substrate. This tool enables the quantification of the effects of cardiac electrophysiology device signals on human cardiac function (e.g., contractile properties) with standard laboratory equipment. The 2D hiPSC-CM monolayers were cultured for 2-4 days on a flexible hydrogel substrate in a 48-well format.
The hiPSC-CMs were exposed to standard cardiac contractility modulation (CCM) medical device electrical signals and compared to control (i.e., pacing only) hiPSC-CMs. The baseline contractile properties of the 2D hiPSC-CMs were quantified by video-based detection analysis based on pixel displacement. The CCM-stimulated 2D hiPSC-CMs plated on the flexible hydrogel substrate displayed significantly enhanced contractile properties relative to baseline (i.e., before CCM stimulation), including an increased peak contraction amplitude and accelerated contraction and relaxation kinetics. Furthermore, the utilization of the flexible hydrogel substrate enables the multiplexing of the video-based cardiac-excitation contraction coupling readouts (i.e., electrophysiology, calcium handling, and contraction) in healthy and diseased hiPSC-CMs. The accurate detection and quantification of the effects of cardiac electrophysiological signals on human cardiac contraction is vital for cardiac medical device development, optimization, and de-risking. This method enables the robust visualization and quantification of the contractile properties of the cardiac syncytium, which should be valuable for nonclinical cardiac medical device safety or effectiveness testing. This paper describes, in detail, the methodology to generate 2D hiPSC-CM hydrogel substrate monolayers.
Introduction
As the United States population ages, the number of heart failure patients continues to rise, along with the direct medical costs1,2. There is a critical need to develop novel therapies to treat heart failure and innovative nonclinical methodologies to test such therapies. Human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs) have been proposed as an in vitro tool to aid the therapeutic development process and have been used in regulatory submissions3,4. However, their widespread use has been limited for contractility studies due to the lack of robust contractile properties when plated in standard rigid 2D culture conditions (i.e., conventional tissue culture plastic or glass)5,6,7,8. We previously demonstrated the utility of plating isolated single hiPSC-CMs on a flexible hydrogel substrate to generate robust visible contractile properties9. We showed that isolated hiPSC-CMs have comparable contractile properties to those of freshly isolated adult rabbit ventricular cardiomyocytes. Moreover, we demonstrated the utility of this method for assessing the contractile responses to pharmacological agents7. Furthermore, other studies have applied this technology to mechanistic assessments for basic science and disease modeling10,11,12. Here, this methodology has been extended to 2D hiPSC-CM monolayers, and its utility in evaluating physiologically relevant cardiac contractility modulation (CCM) medical device electrical signals in vitro is demonstrated.
CCM is an intracardiac heart failure therapy in which non-excitatory electrophysiological signals are delivered to the myocardium during the absolute refractory period of the cardiac cycle13,14. Reproducible methods to evaluate CCM in human cardiac cell models are lacking. Previous work has employed various cardiac cell models to evaluate the CCM contractile response. We demonstrated in vitro that freshly isolated rabbit ventricular cardiomyocytes respond to CCM stimulation by a transient increase in calcium and contraction amplitude15. Another study in isolated canine ventricular cardiomyocytes demonstrated CCM-induced enhancement of the intracellular calcium transient amplitude16. However, the majority of CCM studies have used ex vivo and in vivo animal preparations. These studies are difficult to correlate with each other because they apply a variety of CCM pulse parameters and species17. One study in an isolated rabbit papillary model revealed increased CCM-induced contractility8,18, and an array of whole heart studies have demonstrated CCM-induced enhancement of contractile function19,20,21. These studies have provided important mechanistic insight. However, there is a lack of reproducible human models for in vitro cardiac EP contractile studies including CCM. Toward that end, we have developed several 2D and 3D hiPSC models and demonstrated CCM-induced enhancement of contractile properties in a parameter-dependent manner. Moreover, the CCM-induced inotropic effects have been found to be in part mediated by neuronal input and β-adrenergic signaling8,17,22. Still, more needs to be known about the mechanisms of CCM therapy, and utilizing contracting human cardiomyocytes can assist in achieving this outcome. As such, there is a significant need to develop human nonclinical tools to evaluate novel CCM devices and signals, quicken the regulatory process, reduce the burden on animal models, and aid device developer decision-making8,17,23,24. It is important to develop easy, do-it-yourself protocols that can be transferred to any laboratory and that use standard equipment and low cell requirements to reduce the costs. This method elucidates the effects of CCM stimulation on human cardiomyocyte function and provides important insights on CCM safety or effectiveness17. Here, we describe the method for generating 2D hiPSC-CM monolayers on a flexible hydrogel substrate to produce a standardized nonclinical tool to quantify acute cardiac electrophysiology medical device (i.e., CCM) contractile responses in health and disease.
Protocol
1. Preparation of the plates and media
NOTE: A typical extracellular matrix (ECM)-based hydrogel aliquot is ~200 µL in a sterile 1.5 mL tube stored at −20 °C.
- In a sterile tissue culture hood, prepare a sterile 6-well plate by transferring 2 mL of 0.1% gelatin (Table of Materials) to each well. Place the lid on the 6-well plate, and allow the coated plate to incubate at 37 °C for a minimum of 1 h.
- One day before seeding the hiPSC-CMs on the flexible hydrogel substrate, thaw a hydrogel (Table of Materials) aliquot in the refrigerator on ice.
- Prepare the cardiomyocyte medium (Table of Materials) by mixing 500 mL of RPMI 1640, 10 mL of 50x B-27 Supplement, and 5 mL of penicillin-streptomycin9.
2. Seeding of cryopreserved hiPSC-CMs
- Two days before seeding the hiPSC-CMs on the flexible hydrogel substrate, pre-plate the hiPSC-CMs on 0.1% gelatin-coated sterile 6-well plates. Thaw the hiPSC-CMs using a standard thawing protocol9,25.
- Then, plate 1,500,000 total hiPSC-CMs (Table of Materials) per well according to the manufacturer's instructions (Figure 1A)26.
- Culture the hiPSC-CMs in standard cardiomyocyte medium for 2-4 days to allow the hiPSC-CMs to recover from the cryopreservation at 37 °C and 5% CO2. Refresh the spent medium with 100% cardiomyocyte medium every 48 h.
3. Dissociation and counting of the pre-plated hiPSC-CMs
- Check the status of the hiPSC-CMs before dissociation. Evaluate the health of the hiPSC-CMs, ensuring viability and stable beating.
NOTE: The purity of the hiPSC-CM population is important (e.g., >90% cardiac troponin T)7. A cardiomyocyte selection method (e.g., metabolic selection or sorting) is recommended to reduce the disruption of the hydrogel substrate by non-cardiomyocyte cells25,26. - Wash the hiPSC-CMs 2x with 4 mL per well of D-PBS without CaCl2 or MgCl2 (Table of Materials). Aspirate the D-PBS, add 1 mL of room temperature dissociation reagent to each well, and then incubate for 15 min at 37 °C.
- Add 10 mL of cardiomyocyte medium to a sterile 15 mL conical tube.
- Dissociate the hiPSC-CMs from the 6-well plate with a 1,000 µL pipette (Figure 1B). Add the cell suspension to the 15 mL conical tube26.
- Rinse the well with 1 mL of fresh cardiomyocyte medium to collect any residual hiPSC-CMs, and add them to the 15 mL conical tube. Bring the final volume of the conical tube to 15 mL.
- Centrifuge for 5 min (200 × g). Remove the supernatant up to the 1 mL mark. Resuspend the cells in cardiomyocyte medium to a final volume of 5 mL.
- Count the hiPSC-CMs with a manual or automated cell counter.
- Incubate the hiPSC-CM suspension at room temperature while the flexible hydrogel substrates are being prepared (30 min maximum).
4. Preparation of the flexible hydrogel substrates
- Prepare a 20 µL pipette set at 1 µL, 20 µL pipette tips (e.g., 20 µL), and a sterile 48-well glass bottom plate. Ensure that a stopwatch/timer is ready ahead of making the hydrogel substrates.
- In the sterile tissue culture hood, mix the ECM-based hydrogel substrate by gently tapping the tube, and immediately place it back on ice.
- Then, start the stopwatch/timer immediately before the first hydrogel substrate is plated-this is time zero.
- Pipette 1 µL of the hydrogel substrate up and down ~3x to chill the pipette tip. Apply ~1 µL of the undiluted hydrogel substrate horizontally to the bottom of each well of the 48-well plate (Figure 1C, Figure 2A, and Figure 3A), holding the pipette at a 45° angle. Plate all the hydrogel substrates in the same orientation in each well (Figure 2 and Figure 3) to help identify the substrate when performing the experiments at 40x magnification7,9,17,27.
NOTE: Each ~1 µL line is one hydrogel substrate (Figure 3). Typically, it takes ~5 min to prepare 48 wells. The use of a horizontally tilted microplate stand (e.g., 30°) may enable a better view of the bottom of the well and the hydrogel substrate. Be sure to go the entire length of the well (i.e., from left to right). Short hydrogel substrates may be too thick, thus reducing the substrate stability. Do not allow the hydrogel substrate to dry in the pipette tip. If this occurs, quickly switch to a new tip, and immediately continue. Alternatively, chilled pipette tips can be used. The ECM-based hydrogel substrate may quickly polymerize when it is not on ice. The preparation of several wells at a time (e.g., 10) is suggested. Additionally, practicing in a mock 48-well plate is recommended. - Place the lid on the 48-well plate, and allow the hydrogel substrates to incubate for 8-10 min at room temperature in the sterile tissue culture hood before adding the cells (Figure 2B).
NOTE: It is important to adhere to the suggested incubation times. An incubation time of more than 10 min will lead to stiff hydrogel substrates and no visible contractions. An incubation time of less than 8 min may lead to substrates that collapse. - Immediately seed the hiPSC-CMs dropwise directly onto the hydrogel substrates, with ~30,000 viable hiPSC-CMs per well in a low medium volume of ~200 µL of cardiomyocyte medium, using a 1,000 µL pipette (Figure 2B and Figure 3B).
NOTE: This process halts the hydrogel substrate polymerization and ensures the hiPSC-CMs are on the substrate7,9,17,27. - Place the lid on the plate, and allow the hiPSC-CMs to incubate undisturbed for 10-15 min at room temperature (Figure 2C) in the sterile tissue culture hood to enable the hiPSC-CMs to adhere to the hydrogel substrate.
- Gently add ~100 µL of fresh cardiomyocyte medium to each well (final volume: ~300 µL per well). Place the lid on the plate, and transfer to an incubator at 37 °C, 5% CO2 for 2-4 days. Refresh the 100% medium every 24 h before the contraction experiments are performed.
NOTE: Visually inspect the hiPSC-CMs for the correct morphology; immediately after plating, the hiPSC-CMs should appear round (Figure 3B). By day 2 after seeding, a confluent 2D hiPSC-CM monolayer syncytium will be observed (Figure 3C) (Supplemental Video S1) with robust visible contraction (Supplemental Video S2).
5. Contraction recording and analysis
- Prepare the CCM assay medium, which is Tyrode's solution containing the following (in mmol/L): CaCl2 0.5, NaCl 134, KCl 5.4, MgCl2 1, glucose 10, and HEPES 10, with the pH adjusted to 7.4 with NaOH, and equilibrate to 37 °C in a water bath.
NOTE: Submaximal extracellular calcium (0.5 mM) is used to enhance the CCM assay window. - Turn on the microscope and environmental control chamber to equilibrate to 37 °C and 5% CO2.
- Remove the cardiomyocyte medium from the 48-well plate, and gently rinse each well twice with 600 µL of CCM assay medium.
- Add 300 µL of CCM assay medium per well, and place the 48-well plate on the microscope in the environmental control chamber. Insert the electrodes, and equilibrate the cells for 5 min.
- Use video-based microscopy to record the contraction videos. Open the video recording software, and set a frame rate of 100 frames/s. Select a region of interest (ROI) near the center of the hiPSC-CM monolayer.
NOTE: Do not select an ROI near the edge of the hiPSC-CM monolayers as this may be unstable for contractile recordings. - Then, field stimulate the cells with a commercial pulse generator (Table of Materials) to electrically pace the 2D hiPSC-CM monolayers. Pace the hiPSC-CMs at 1.5x threshold at 1 Hz with baseline pulse parameters (e.g., monophasic square wave pacing pulses with a 2 ms stimulus pulse duration of ~14 V/cm)17.
- Record the baseline, pacing only (i.e., before the CCM) (Figure 1D) contraction video for a minimum of five beats17,28.
- Then, stimulate the hiPSC-CM monolayer with an experimental electrical signal (Figure 1D). To follow this protocol, use the standard CCM stimulation parameters: two symmetrical biphasic pulses of 5.14 ms phase duration (20.56 ms total duration), ~28 V/cm (phase amplitude), zero interphase interval, and a 30 ms delay (i.e., time from the end of the pacing pulse to the beginning of the CCM pulse) (Figure 1D)29,30, and record the CCM-induced contraction video for a minimum of five beats.
- Turn off the CCM signal, stimulate with a baseline pacing pulse, and record a contraction video of the recovery period (i.e., after the CCM) for a minimum of five beats.
- Use standard contraction software to automatically analyze the contraction videos and quantify the key contractile properties (e.g., the contraction amplitude, contraction slope, relaxation slope, time to peak, time to baseline 90%, and contraction duration 50%)7,17,31,32.
- Use the 2D hiPSC-CMs on the flexible hydrogel substrate for contractile experiments from days 2-14 after plating on the substrate.
Results
Described in this protocol is a simple, robust tool to generate visibly contracting 2D hiPSC-CM monolayers on a flexible hydrogel substrate. The measurement of the contractile properties is accomplished with video-based recording coupled with contractility analysis software. This enables the quantification of key parameters of cardiomyocyte contractility, including the contraction amplitude, contraction slope, relaxation slope, time to peak, time to baseline 90%, and contraction duration 50%. The model is used to characterize the baseline contractile properties of hiPSC-CMs (Figure 4) from various "healthy" donors and can be extended to the evaluation of cardiac electrophysiology medical device signals (i.e., CCM). The application of the standard CCM stimulation parameters (Figure 1D)29,30 resulted in enhanced contractile properties in vitro (Figure 5 and Table 1)17.
We further demonstrated that this method can be used to evaluate the effects of the modulation of extracellular calcium concentrations on human contractile properties with and without CCM stimulation (Figure 6)17. The expected baseline calcium dependence of contraction was observed7,17, as well as a CCM-induced increase in calcium sensitivity at the level of the cardiomyocyte monolayer. In addition, the pharmacological interrogation of the β-adrenergic signaling pathway (Figure 7) revealed that the CCM-induced inotropic effects were in part mediated by β-adrenergic signaling17. Moreover, this tool can be expanded to patient-specific disease cardiomyocytes, including those of dilated cardiomyopathy (DCM)33,34,35 (Figure 8), to understand the effect of CCM in the context of disease states; indeed, enhanced contractile amplitude and accelerated contraction and relaxation kinetics were observed at the CCM "dose" tested here (Figure 8). While we have a CCM-mimicking device in our laboratory, the methodology used here is not specific to that system and could be applied to other cardiac electrophysiology devices.
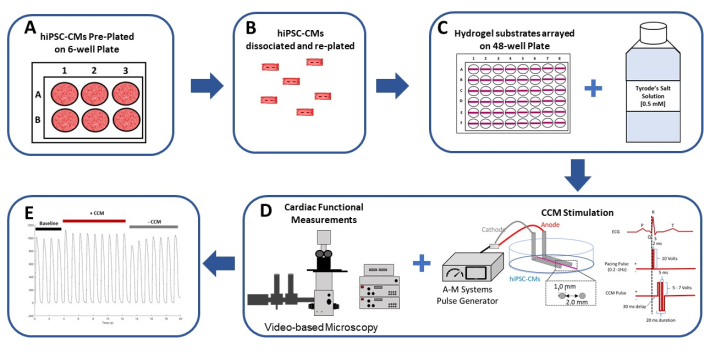
Figure 1: Schematic summary of the 2D hiPSC-CM in vitro CCM model. (A) The hiPSC-CMs are pre-plated in monolayer format on gelatin (0.1%)-coated 6-well plates. (B) After 2 days in culture, the hiPSC-CMs are dissociated and prepared for plating on a flexible hydrogel substrate. (C) The isolated hiPSC-CMs are plated at a high density on hydrogel substrates arrayed in a 48-well format (left) and are assayed in (0.5 mM) extracellular calcium Tyrode's solution (right). (D) A commercial pulse generator and standard clinical CCM pulse parameters29,30 (right) are used to stimulate the hiPSC-CMs; the cardiac function is assessed by video-based analysis (left). (E) Representative contraction recordings before CCM (baseline: 5 V), during CCM (CCM: 10 V), and after CCM (recovery: 5 V). This figure has been reprinted from Feaster et al.17. Abbreviations: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; CCM = cardiac contractility modulation. Please click here to view a larger version of this figure.
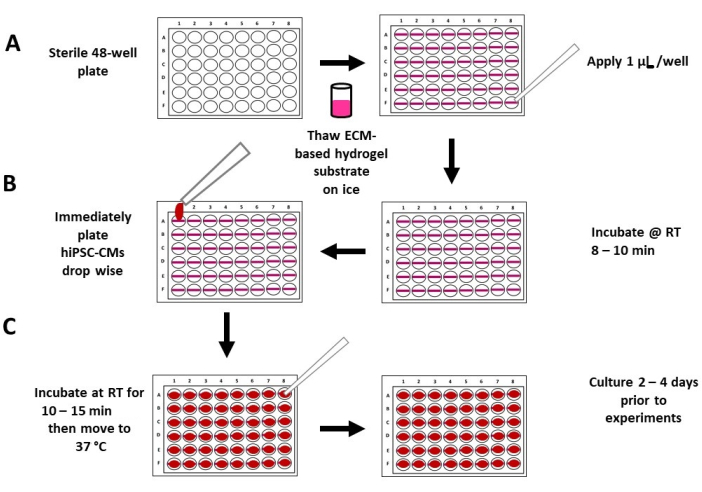
Figure 2: Schematic of the flexible hydrogel substrate plating and seeding. (A) Completely thawed, undiluted ECM-based hydrogel substrate is applied to a sterile 48-well plate (left panel), with 1 µL of hydrogel substrate per well (right panel). (B) The hydrogel substrate is allowed to incubate at room temperature for 8-10 min (right panel), followed by plating the high-density hiPSC-CMs in a low medium volume (~200 µL) (left panel). (C) After 10-15 min of incubation, medium is added to each well (left panel), and the plates are moved to a standard tissue culture incubator (right panel). Abbreviations: ECM = extracellular matrix, hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; RT = room temperature. Please click here to view a larger version of this figure.
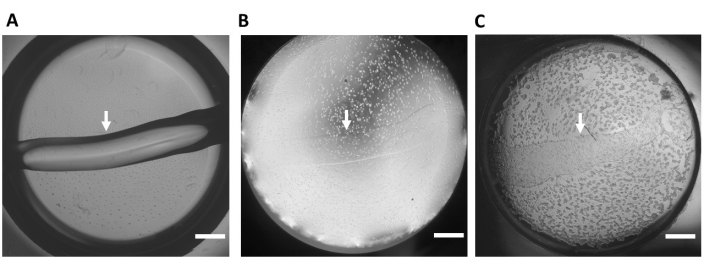
Figure 3: Extracellular matrix-based hydrogel substrate. (A) Representative hydrogel substrate (no cells) in one well of a 48-well glass bottom plate immediately after the substrate is applied to the well. (B) Time 0 after the hiPSC-CMs are seeded. (C) Time 24 h after the hiPSC-CMs are seeded. This panel was reprinted from Feaster et al.17. The white arrows indicate the edge of the hydrogel substrate, 4x magnification. Scale bar = 1 mm. Abbreviation: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte. Please click here to view a larger version of this figure.
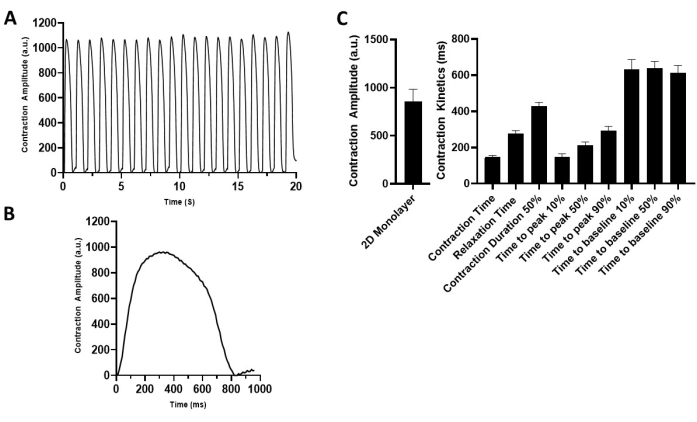
Figure 4: Characterization of the 2D hiPSC-CM monolayer contractile properties. (A) Representative contraction recording of the 2D hiPSC-CMs paced at 1 Hz (5 V). (B) Representative contraction traces depicting one contraction cycle. (C) Summary bar graphs. The data are mean ± SEM. n = 18. Abbreviation: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte. Please click here to view a larger version of this figure.
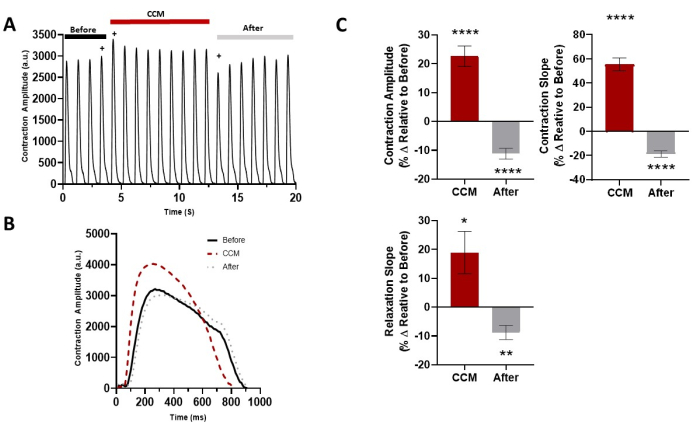
Figure 5: Acute effect of CCM on the 2D hiPSC-CM contractile properties. (A) Representative contraction recording for before CCM (5 V), during CCM (10 V), and after CCM (5 V). (B) Representative contraction traces of the immediate effects (i.e., last before-CCM beat, first CCM beat, and first after-CCM beat, indicated by +). (C) Summary bar graphs of the immediate effects. Percent change, data are mean ± SEM. n = 23. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. This figure has been reprinted from Feaster et al.17. Abbreviations: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; CCM = cardiac contractility modulation. Please click here to view a larger version of this figure.
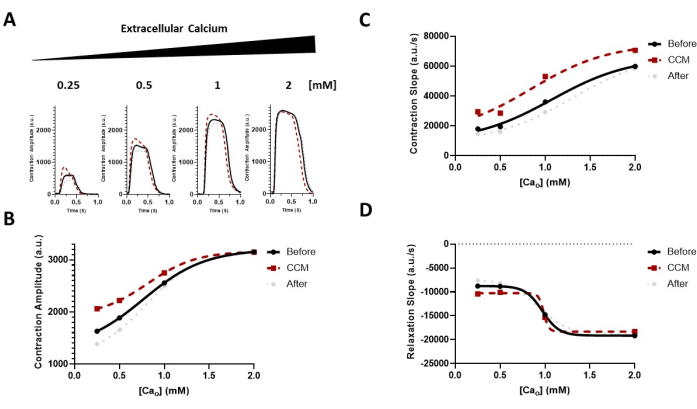
Figure 6: Effect of extracellular calcium modulation on the CCM response. (A) Representative contraction traces of the immediate effects for each group before CCM (5 V), during CCM (10 V), and after CCM (5 V); the hiPSC-CMs were exposed to increasing concentrations of extracellular calcium (Cao) of 0.25-2 mM. (B-D) Transformed data (sigmoidal) to guide the eye demonstrating the effect of CCM on the calcium sensitivity of the contractile properties (i.e., the amplitude and kinetics) (hill slope = 1.0). n = 6-8 per group. This figure has been reprinted from Feaster et al.17. Abbreviations: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; CCM = cardiac contractility modulation. Please click here to view a larger version of this figure.
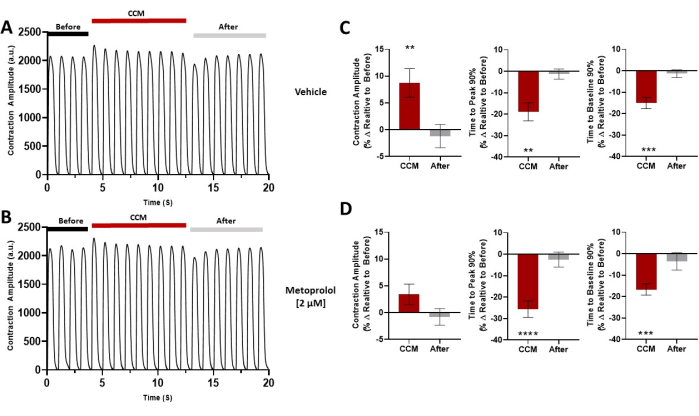
Figure 7: Pharmacological challenge. Representative contraction traces for each group before CCM (5 V), during CCM (10 V), and after CCM (5V); the hiPSC-CMs were pretreated with (A) vehicle or (B) metoprolol (2 µM). (C,D) Summary bar graphs for each condition. Percent change, data are mean ± SEM. n = 10 per group. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. This figure has been reprinted from Feaster et al.17. Abbreviations: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; CCM = cardiac contractility modulation. Please click here to view a larger version of this figure.
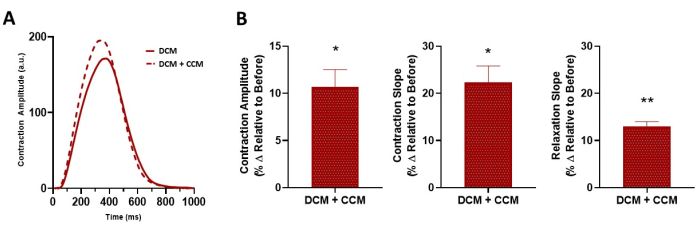
Figure 8: Acute effect of CCM on the contractile properties of diseased 2D hiPSC-CMs. (A) Representative contraction trace for DCM L35P, control baseline (before, 6 V), and DCM L35P plus CCM (10 V). (B) Summary bar graphs. Percent change, data are mean ± SEM. n = 3. *p < 0.05, **p < 0.01. Abbreviations: hiPSC-CM = human induced pluripotent stem cell-derived cardiomyocyte; CCM = cardiac contractility modulation; DCM = dilated cardiomyopathy. Please click here to view a larger version of this figure.
Supplemental Video S1: Timelapse of the hiPSC-CMs on the extracellular matrix-based hydrogel. Two-dimensional hiPSC-CMs plated on the flexible hydrogel substrate; Time: 0-90 h; one well of a 48-well glass bottom plate; 4x magnification. The hiPSC-CMs form a horizontal monolayer syncytium (i.e., left to right). Scale bar = 1 mm. Please click here to download this Video.
Supplemental Video S2: hiPSC-CMs on the extracellular matrix-based hydrogel. Two-dimensional hiPSC-CMs plated on the flexible hydrogel substrate; Time: ~24 h; one well of a 48-well glass bottom plate; 4x magnification. The hiPSC-CMs form monolayer morphology and show robust contraction at ~24 h post plating. Scale bar = 1 mm. This video is from Feaster et al.17. Please click here to download this Video.
| Parameter | CCM | After |
| Amplitude | 16 ± 4%** | 4 ± 5% |
| Time to Peak 50% | -20 ± 9%* | 7 ± 5% |
| Time to Peak 90% | -22 ± 8%* | 6 ± 5% |
| Time to Baseline 50% | -8 ± 5% | 4 ± 4% |
| Time to Baseline 90% | -12 ± 6%* | 5 ± 5% |
| Contraction Duration 10% | -13 ± 6% | 3 ± 5% |
| Contraction Duration 50% | -6 ± 5 % | 3 ± 5% |
| Contraction Duration 90% | 0 ± 5% | 3 ± 4% |
| N | 23 | 23 |
Table 1: Contractile properties. Percent change relative to before CCM (5 V); the data are mean ± SEM for all the beats in each group during CCM (10 V) and after CCM (5 V). n = 23. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. This table has been reprinted from Feaster et al.17.
Discussion
The protocol outlined herein describes a method to generate robustly contracting 2D hiPSC-CM monolayers on a flexible extracellular matrix (ECM)-based hydrogel substrate with commercial reagents7,17. The hiPSC-CMs seeded on the flexible hydrogel substrate remain viable and have enhanced contractile properties7. This technique relies on standard laboratory equipment and capabilities7. There are several critical steps in the protocol, including in relation to working with the ECM-based hydrogel substrate, that require careful attention to detail. One potential issue is the presence of serum in the medium. This may result in the hiPSC-CMs forming networks (e.g., endothelial/vascular networks) instead of a confluent monolayer sheet; hence, a serum-free medium is recommended during the establishment of the flexible hydrogel hiPSC-CM monolayers (i.e., day 0 to day 4). Likewise, preparing too many hydrogel substrates at one time may result in poor or uneven substrates due to operator fatigue. While it is important to work quickly, the integrity of each hydrogel substrate is critical. Similarly, one should carefully seed the hiPSC-CMs and change the medium; this should not be done forcefully. When changing the medium, it should be added gently from the top edge of the well so as not to disrupt the hydrogel substrate or the cells. As with standard 2D hiPSC-CM cultures (i.e., conventional tissue culture plastic or glass), plating at a low density will result in incomplete monolayer formation. It is important to visually inspect the hiPSC-CMs to confirm that they are on the hydrogel substrate and to use a timer to ensure accurate timing. Furthermore, culturing the 2D hiPSC-CM monolayers for more than 14 days on the hydrogel substrate may result in monolayer disruption, based on the ECM properties and instructions from the manufacturer of the substrate.
There are several limitations to the current method that have to be considered. First, the cells used in this protocol were from a commercial hiPSC-CMs provider, and those cells form a syncytium of electrically coupled cells. The syncytium contains a mixture of hiPSC-CMs from all three cardiac subtypes (i.e., ventricular, atrial, and nodal)17. Studies may benefit from a subtype-exclusive hiPSC-CM population (i.e., 100% ventricular or 100% atrial). Second, this method only used hiPSC-CMs, while non-myocytes, including cardiac fibroblasts, endothelial cells, and neurons, may enhance hiPSC-CM functionality22,36. Third, 2D hiPSC-CMs display several features of relatively immature cardiomyocytes, including spontaneous beating, amorphic morphology, and lack of an inotropic response8,37. Fourth, while this protocol produces robustly contracting 2D hiPSC-CM monolayers, it is likely that functionally enhanced 3D hiPSC-CM models such as engineered cardiac tissues (ECTs) will result in an enhanced CCM-induced contractile response under physiological calcium concentrations8,38. Finally, the protocol described here is designed for a 48-well format. However, with optimization and the inclusion of automation, this can be scaled to a high-throughput format (e.g., 96-well or 384-well plates).
The current gold standard for hiPSC-CM studies is conventional rigid 2D culture conditions (i.e., tissue culture plastic or glass). While useful for electrophysiology3 and calcium handling39 studies, the conventional methodology results in minimal contractile properties5,6,7. As a result, conventional rigid 2D culture conditions are not amenable to the assessment of CCM contractile effects8. Functionally enhanced 3D hiPSC-CM ECT methods38 are technically challenging, time-consuming, and require sophisticated equipment that is not readily available in every laboratory. In this protocol, we describe a simple methodology to generate robustly contracting 2D hiPSC-CM monolayers in a shorter timeframe than 3D ECT methods or long-term, conventional 2D methods7,40,41. Moreover, the reagents used here are commercially available, including the hydrogel substrate and the hiPSC-CMs, and both have considerable lot-to-lot consistency. While we used removable platinum wire electrodes (interelectrode distance: 2.0 mm, width: 1.0 mm), various electrode materials and configurations are amenable to CCM contractile assessments in vitro8,15,17,18,22. Likewise, there are multiple automated software available that enable the analysis of contraction videos7,31,32.
The majority of nonclinical methods to evaluate cardiac medical device contractility rely largely on costly in vivo animal models (e.g., dogs or pigs) and technically challenging papillary muscle strips (e.g., rabbits)18. This paper described a human in vitro model to evaluate the effects of cardiac electrophysiology medical device signals on contractility. This tool could reduce the dependence on animal studies and be useful for the in vitro evaluation of the contractile properties of cardiac electrophysiology devices.
Disclosures
This article reflects the views of the authors and should not be construed to represent the U.S. Food and Drug Administration's views or policies. The mention of commercial products, their sources, or their use in connection with the material reported herein is not to be construed as either an actual or implied endorsement of such products by the Department of Health and Human Services. The authors declare no competing interests for this work.
Acknowledgements
This work was supported in part by an appointment to the Research Participation Program at the Center for Devices and Radiological Health administered by the Oak Ridge Institute for Science and Education through an interagency agreement between the U.S. Department of Energy and the U.S. Food and Drug Administration. The authors thank Richard Gray, Trent Robertson, and Anna Avila for their suggestions and technical assistance. The study was funded through the U.S. Food and Drug Administration, Office of Science and Engineering Laboratories.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1% Gelatin | STEMCELL Technologies | 7903 | Pre-plating Culture Substrate |
| 48-well Plate | MatTek | P48G-1.5-6-F | Hydrogel Substrate hiPSC-CM Culture, Glass |
| 6-well Plate | Thermofisher | 140675 | hiPSC-CM Culture, Plastic |
| B-27 Supplement, with insulin | Invitrogen | 17504-044 | Cardiomyocyte Media |
| Calcium Chloride dihydrate (CaCl2) | Fisher Scientific | c70-500 | Tyrode’s solution |
| CellOPTIQ Platform and Software | Clyde Biosciences | Contraction Recording and Analysis | |
| Conical tube 15 mL | Corning | 352099 | hiPSC-CM Dissociation |
| Digital CMOS Camera | Hamamatsu | C11440-42U30 | Contraction Video Recording |
| D-PBS | Life Technologies | 14190-144 | Cell Wash |
| Environmental Control Chamber | OKOLAB INC | H201-K-FRAME | Environmental Regulation |
| Glucose | Sigma-Aldrich | G8270-1kg | Tyrode’s solution |
| Hemocytometer | Fisher Scientific | 22-600-107 | hiPSC-CM Counting |
| HEPES | Sigma-Aldrich | H3375 | Tyrode’s solution |
| iCell Cardiomyocytes Plating Medium | Fujifilm Cellular Dynamic, Inc. | M1001 | hiPSC-CM Plating Media |
| iCell Cardiomyocytes2, 01434 | Fujifilm Cellular Dynamic, Inc. | R1017 | hiPSC-CMs |
| Incubator (37 °C, 5% CO2) | Thermofisher | 50116047 | Maintain hiPSC-CMs |
| Inverted Microscope | Olympus | IX73 | Imaging hiPSC-CMs |
| Magnesium Chloride hexahydrate (MgCl2) | Fisher Scientific | m33-500 | Tyrode’s solution |
| Matrigel Growth Factor Reduced Basement Membrane Matrix | Corning | 356230 | Flexible Hydrogel Substrate |
| Microcentrifuge tubes 1.5 ml | Fisher Scientific | 05-408-129 | Hydrogel Substrate Aliquot |
| Model 4100 Isolated High Power Stimulator | AM-Systems | Model 4100 | Pulse Generator |
| MyCell Cardiomyocytes DCM LMNA L35P, 01016 | Fujifilm Cellular Dynamic, Inc. | R1153 | DCM hiPSC-CMs |
| Pen-Strep | Invitrogen | 15140-122 | Cardiomyocyte Media |
| Pipette L-20 | Rainin | 17014392 | Plating Hydrogel Substrate |
| Pipette P1000 | Fisher Scientific | F123602G | |
| Pipette tips, 1000 ul | Fisher Scientific | 02-707-509 | |
| Pipette tips, 20 ul | Rainin | GPS-L10S | Making Hydrogel Substrate |
| Potassium Chloride (KCl) | Fisher Scientific | P330-500 | Tyrode’s solution |
| RPMI 1640, with glucose | Invitrogen | 11875 | Cardiomyocyte Media |
| Sodium Chloride (NaCl) | Fisher Scientific | s641-212 | Tyrode’s solution |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | Tyrode’s solution |
| Stimulation Electrodes | Pacing and CCM Stimulation | ||
| Stopwatch/Timer | Fisher Scientific | 02-261-840 | Plating Hydrogel Substrate |
| Trypan Blue Stain | Life Technologies | T10282 | hiPSC-CM Counting |
| TrypLE Express | Life Technologies | 12605-010 | hiPSC-CM Dissociation |
References
- Jackson, S. L., et al. National burden of heart failure events in the United States, 2006 to 2014. Circulation: Heart Failure. 11 (12), 004873 (2018).
- Cook, C., Cole, G., Asaria, P., Jabbour, R., Francis, D. P. The annual global economic burden of heart failure. International Journal of Cardiology. 171 (3), 368-376 (2014).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Yang, X., Ribeiro, A. J. S., Pang, L., Strauss, D. G. Use of human iPSC-CMs in nonclinical regulatory studies for cardiac safety assessment. Toxicology Sciences. 190 (2), 117-126 (2022).
- Zuppinger, C. 3D cardiac cell culture: A critical review of current technologies and applications. Frontiers in Cardiovascular Medicine. 6, 87 (2019).
- Huethorst, E., et al. Conventional rigid 2D substrates cause complex contractile signals in monolayers of human induced pluripotent stem cell-derived cardiomyocytes. The Journal of Physiology. 600 (3), 483-507 (2022).
- Feaster, T. K., et al. Matrigel mattress: A method for the generation of single contracting human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 117 (12), 995-1000 (2015).
- Feaster, T. K., et al. Acute effects of cardiac contractility modulation stimulation in conventional 2D and 3D human induced pluripotent stem cell-derived cardiomyocyte models. Frontiers in Physiology. 13, 1023563 (2022).
- Feaster, T. K. . Implementation of human-induced pluripotent stem cell-derived cardiomyocyte to model excitation-contraction coupling in health and disease. , (2015).
- Cadar, A. G., et al. Real-time visualization of titin dynamics reveals extensive reversible photobleaching in human induced pluripotent stem cell-derived cardiomyocytes. American Journal of Physiology-Cell Physiology. 318 (1), 163-173 (2020).
- Parikh, S. S., et al. Thyroid and glucocorticoid hormones promote functional T-tubule development in human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 121 (12), 1323-1330 (2017).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Campbell, C. M., Kahwash, R., Abraham, W. T. Optimizer Smart in the treatment of moderate-to-severe chronic heart failure. Future Cardiology. 16 (1), 13-25 (2020).
- PMA P180036. FDA Summary of Safety and Effectiveness Data. Food and Drug Administration Available from: https://www.accessdata.fda.gov/cdrh_docs/pdf18/P180036B.pdf (2019)
- Blinova, K., et al. Acute effects of nonexcitatory electrical stimulation during systole in isolated cardiac myocytes and perfused heart. Physiological Reports. 2 (8), 12106 (2014).
- Sabbah, H. N., et al. Cardiac contractility modulation with the impulse dynamics signal: Studies in dogs with chronic heart failure. Heart Failure Reviews. 6 (1), 45-53 (2001).
- Feaster, T. K., Casciola, M., Narkar, A., Blinova, K. Acute effects of cardiac contractility modulation on human induced pluripotent stem cell-derived cardiomyocytes. Physiological Reports. 9 (21), 15085 (2021).
- Brunckhorst, C. B., Shemer, I., Mika, Y., Ben-Haim, S. A., Burkhoff, D. Cardiac contractility modulation by non-excitatory currents: Studies in isolated cardiac muscle. European Journal of Heart Failure. 8 (1), 7-15 (2006).
- Mohri, S., et al. Cardiac contractility modulation by electric currents applied during the refractory period. American Journal of Physiology-Heart and Circulatory Physiology. 282 (5), 1642-1647 (2002).
- Mohri, S., et al. Electric currents applied during refractory period enhance contractility and systolic calcium in the ferret heart. American Journal of Physiology-Heart and Circulatory Physiology. 284 (4), 1119-1123 (2003).
- Burkhoff, D., et al. Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo. Heart Failure Reviews. 6 (1), 27-34 (2001).
- Narkar, A., Feaster, T. K., Casciola, M., Blinova, K. Human in vitro neurocardiac coculture (ivNCC) assay development for evaluating cardiac contractility modulation. Physiological Reports. 10 (21), 15498 (2022).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Blinova, K., et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells. Current Protocols in Human Genetics. 87, 1-15 (2015).
- Cadar, A. G., Feaster, T. K., Durbin, M. D., Hong, C. C. Production of single contracting human induced pluripotent stem cell-derived cardiomyocytes: Matrigel mattress technique. Current Protocols in Stem Cell Biology. 42, 1-7 (2017).
- Narkar, A., Willard, J. M., Blinova, K. Chronic cardiotoxicity assays using human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs). International Journal of Molecular Sciences. 23 (6), 3199 (2022).
- OPTIMIZER® Smart Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2020/05/13-290-008-01-US-Rev-01-OPT-Smart-IPG-IFU.pdf (2018)
- OPTIMIZER™ Smart Mini Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2021/02/13-290-011-EU-Rev-00-OPTIMIZER-Smart-Mini-IPG-IFU-EU.pdf (2019)
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), 5-16 (2018).
- Grune, T., Ott, C., Haseli, S., Hohn, A., Jung, T. The "MYOCYTER" - Convert cellular and cardiac contractions into numbers with ImageJ. Scientific Reports. 9, 15112 (2019).
- Masarone, D., et al. Use of cardiac contractility modulation as bridge to transplant in an obese patient with advanced heart failure: A case report. Frontiers in Cardiovascular Medicine. 9, 833143 (2022).
- Nadeem, M., Tariq, E. F., Aslam, H. M., Illahi, Y., Shah, R. All-cause mortality outcomes of usage of cardiac contractility modulation in patients with dilated cardiomyopathy ineligible for cardiac re-synchronization therapy: An updated meta-analysis of randomized controlled trials. Cureus. 12 (9), 10627 (2020).
- Manganelli, G., et al. Use of cardiac contractility modulation in an older patient with non-ischemic dilated cardiomyopathy: A case report. Clinics and Practice. 11 (4), 835-840 (2021).
- Mannhardt, I., et al. Automated contraction analysis of human engineered heart tissue for cardiac drug safety screening. Journal of Visualized Experiments. (122), e55461 (2017).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
- Feric, N. T., et al. Engineered cardiac tissues generated in the Biowire™ II: A platform for human-based drug discovery. Toxicology Sciences. 172 (1), 89-97 (2019).
- Hwang, H. S., et al. Human induced pluripotent stem cell (hiPSC) derived cardiomyocytes to understand and test cardiac calcium handling: A glass half full. Journal of Molecular and Cellular Cardiology. 89, 379-380 (2015).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Stoehr, A., et al. Automated analysis of contractile force and Ca2+ transients in engineered heart tissue. American Journal of Physiology-Heart and Circulatory Physiology. 306 (9), 1353-1363 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved