Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
सीनिडेरियन मॉडल जीव क्लिटिया हेमिसफेरिका का उपयोग करके विवो में उपकला घाव भरने की विशेषता
यह पेपर एक जीवित क्लिटिया हेमिसफेरिका मेडुसा के उपकला में घाव बनाने और विवो में उच्च रिज़ॉल्यूशन पर छवि घाव भरने की एक विधि का वर्णन करता है। इसके अतिरिक्त, घाव भरने के दौरान उपकला कोशिकाओं और बाह्य मैट्रिक्स में सिग्नलिंग प्रक्रियाओं को परेशान करने के लिए रंजक और दवाओं को पेश करने की एक तकनीक प्रस्तुत की गई है।
त्वचा से आंखों और आंतों तक सभी जानवरों के अंग, उपकला कोशिकाओं की चादरों से ढके होते हैं जो उन्हें संक्रमण से बचाते हुए होमियोस्टैसिस को बनाए रखने की अनुमति देते हैं। इसलिए, यह आश्चर्य की बात नहीं है कि उपकला घावों की मरम्मत करने की क्षमता सभी मेटाज़ोन्स के लिए महत्वपूर्ण है। कशेरुक में उपकला घाव भरने में अतिव्यापी प्रक्रियाएं शामिल हैं, जिसमें भड़काऊ प्रतिक्रियाएं, वैस्कुलराइजेशन और पुन: उपकलाकरण शामिल हैं। इन प्रक्रियाओं के विनियमन में उपकला कोशिकाओं, पड़ोसी कोशिकाओं और बाह्य मैट्रिक्स (ईसीएम) के बीच जटिल बातचीत शामिल है; ईसीएम में संरचनात्मक प्रोटीन, नियामक प्रोटीन और सक्रिय छोटे अणु होते हैं। यह जटिलता, इस तथ्य के साथ कि अधिकांश जानवरों में अपारदर्शी ऊतक और दुर्गम ईसीएम होते हैं, जीवित जानवरों में घाव भरने का अध्ययन करना मुश्किल हो जाता है। उपकला घाव भरने पर बहुत काम इसलिए ऊतक संस्कृति प्रणालियों में किया जाता है, जिसमें एक कृत्रिम मैट्रिक्स पर एक मोनोलेयर के रूप में एक एकल उपकला कोशिका-प्रकार चढ़ाया जाता है। क्लिटिया हेमिसफेरिका (क्लिटिया) इन अध्ययनों के लिए एक अद्वितीय और रोमांचक पूरक प्रदान करता है, जिससे उपकला घाव भरने को एक प्रामाणिक ईसीएम के साथ एक बरकरार जानवर में अध्ययन करने की अनुमति मिलती है। क्लिटिया का एक्टोडर्मल एपिथेलियम बड़े स्क्वैमस उपकला कोशिकाओं की एक एकल परत है, जो जीवित जानवरों में अंतर हस्तक्षेप कंट्रास्ट (डीआईसी) माइक्रोस्कोपी का उपयोग करके उच्च-रिज़ॉल्यूशन इमेजिंग की अनुमति देता है। प्रवासी फाइब्रोब्लास्ट्स, वास्कुलचर या भड़काऊ प्रतिक्रियाओं की अनुपस्थिति विवो में पुन: उपकलाकरण में महत्वपूर्ण घटनाओं को विच्छेदित करना संभव बनाती है। विभिन्न प्रकार के घावों के उपचार का विश्लेषण किया जा सकता है, जिसमें एकल-कोशिका माइक्रोघाव, छोटे और बड़े उपकला घाव और घाव शामिल हैं जो तहखाने की झिल्ली को नुकसान पहुंचाते हैं। लैमेलिपोडिया गठन, पर्स स्ट्रिंग संकुचन, सेल स्ट्रेचिंग और सामूहिक सेल माइग्रेशन सभी इस प्रणाली में देखे जा सकते हैं। इसके अलावा, विवो में सेल: ईसीएम इंटरैक्शन और सेलुलर प्रक्रियाओं को संशोधित करने के लिए ईसीएम के माध्यम से औषधीय एजेंटों को पेश किया जा सकता है। यह काम लाइव क्लिटिया में घाव बनाने, उपचार की फिल्मों को कैप्चर करने और ईसीएम में अभिकर्मकों को माइक्रोइंजेक्ट करके उपचार तंत्र की जांच करने के तरीकों को दिखाता है।
उपकला कोशिकाओं की चादरें सभी मेटाज़ोन्स की बाहरी सतह को कवर करती हैं, आंतरिक अंगों को पंक्तिबद्ध करती हैं, और पशु शरीर को असतत डिब्बों में विभाजित करती हैं। एपिथेलियम आंतरिक शरीर को बाहरी वातावरण से भी अलग करता है और इसे नुकसान और संक्रमण से बचाता है। इसलिए, उपकला परतों का आगमन बहुकोशिकीय जानवरों के विकास का एक अनिवार्य हिस्सा था, और उपकला परतें कशेरुक से लेकर सबसे बेसल मेटाज़ोन्स1 तक सभी जानवरों में देखी जाती हैं। कुछ अंगों का एपिथेलियम एक एकल मोनोलेयर है, जैसे कि फेफड़ों की वायु थैली, रक्त वाहिकाओं और आंत2 में, साथ ही साथ अकशेरुकी जीवों के एपिडर्मिस में जैसे कि प्लेनेरिया और सीनिडेरियन3। अन्य ऊतकों में, जैसे कि कशेरुक की त्वचा4 और कॉर्निया5, उपकला को स्तरीकृत किया जाता है, जिसका अर्थ है कि कई उपकला कोशिका परतें2 हैं। सभी मामलों में, सबसे बेसल उपकला परत तहखाने की झिल्ली से चिपकी होती है, एक प्रोटीन शीट जो बाह्य मैट्रिक्स (ईसीएम) 6,7,8 का एक विशेष क्षेत्र बनाती है।
एक निरंतर उपकला शीट को फिर से बनाने के लिए एपिथेलियम में दरारों की तेजी से मरम्मत की जानी चाहिए। उपकला को नुकसान प्राकृतिक प्रक्रियाओं के दौरान होता है, जैसे कि आंत में उपकला कोशिकाओं का बहाव, 9,10 और सूजन या शारीरिक आघात के परिणामस्वरूप। जब एक एकल उपकला कोशिका क्षतिग्रस्त हो जाती है, तो इसे या तो खुद की मरम्मत करनी चाहिए या आसपास की कोशिकाओं को एक दूसरे से जुड़ने और छेद11,12 को बंद करने की अनुमति देने के लिए समाप्त कर दिया जाना चाहिए। एकल कोशिका के आकार से बड़े घावों में, उपकला कोशिकाओं को एक दूसरे तक पहुंचने और शीट13 की मरम्मत करने के लिए आगे बढ़ना चाहिए। यह कोशिका प्रसार द्वारा प्राप्त किया जा सकता है यदि अंतराल छोटे हैं या घाव के अंतर को बंद करने के लिए घाव के किनारे से उपकला कोशिकाओं के प्रवास की आवश्यकता हो सकती है; इस बाद की प्रक्रिया को पुन: उपकलाकरण14,15 कहा जाता है। भ्रूण के ऊतकों में, उपकला कोशिकाएं फैलती हैं और घावों को बंद करने के लिए पलायन करती हैं या घाव मार्जिन पर कोशिकाओं के बीच बनने वाले एक्टोमायोसिन केबलों के संकुचन से अंतर में खींची जाती हैं, पर्स स्ट्रिंग16 के समान एक तंत्र में। कई वयस्क ऊतकों में, पुन: उपकलाकरण में सुसंगत सेल शीट का प्रवास शामिल है, जहां कोशिकाएं पड़ोसी कोशिकाओं 14,17,18 के साथ अपने जंक्शनों को बनाए रखती हैं। अन्य ऊतकों में, कोशिका: कोशिका कनेक्शन विघटित हो जाते हैं और उपकला कोशिकाएं मेसेनकाइमल कोशिकाओं की तरह अधिक व्यवहार करती हैं, जो पुन: उपकलाकरण 14,19,20,21 के दौरान घाव क्षेत्र में समन्वित लेकिन स्वतंत्र तरीके से चलती हैं।
एपिथेलियल सेल आंदोलनों को माइग्रेटिंग कोशिकाओं के बीच और कोशिकाओं और ईसीएम के बीच जटिल बातचीत द्वारा नियंत्रित किया जाता है। जबकि उपकला कोशिकाओं के घाव-सक्रियण और बाद के प्रवास के तंत्र को संबोधित करने वाले प्रयोगात्मक साहित्य की एक जबरदस्त मात्रा है, अभी भी बहुत कुछ खोजा जाना बाकी है। उदाहरण के लिए, प्रारंभिक संकेत जो एक घाव के जवाब में उपकला कोशिकाओं को स्थानांतरित करने के लिए सक्रिय करता है, निश्चित रूप से पहचाना नहीं गया है 22, न ही यह पूरी तरह से समझा जाता है कि घाव 22,23,24,25,26,27 के निकटतम उपकला कोशिकाओं के पक्ष में लैमेलिपोडिया बनाने के लिए एक्टिन को कैसे पुन: तैनात किया जाता है।. सामूहिक कोशिका प्रवास के लिए घाव पर कोशिकाओं से जानकारी की आवश्यकता होती है जिसे घाव से बाहर की कोशिकाओं के साथ साझा किया जाता है, और संचार मार्ग अभीभी स्पष्ट नहीं है। सेल: सेल जंक्शन और सेल: ईसीएम अटैचमेंट को अलग किया जाना चाहिए और सुधार किया जाना चाहिए क्योंकि शीट में कोशिकाएं खुद को पुनर्व्यवस्थित करती हैं, लेकिन इस प्रक्रिया का विनियमन खराब समझा जाता है14,29। इन और अन्य संबंधित प्रश्नों पर प्रगति करना न केवल एक मौलिक जैविक समस्या के रूप में महत्वपूर्ण है, बल्कि सही घाव भरने के नैदानिक महत्व के कारण भी महत्वपूर्ण है। रोग जो उपकला कोशिकाओं की सही ढंग से पलायन करने की क्षमता से समझौता करते हैं, वे पुराने घावों में परिणाम देते हैं; एक उदाहरण आनुवंशिक बीमारी एपिडर्मोलिसिस बुलोसा है, जहां ईसीएम के लिए उपकला कोशिकाओं के लगाव में शामिल जीन उत्परिवर्तित होते हैं, जिसके परिणामस्वरूप नाजुक त्वचा होती है जो छीलती है और फफोले होती है। प्राकृतिक रूप से उम्र बढ़ने वाले ऊतकों30,31 में पुन: उपकलाकरण भी समझौता किया जाता है। इसलिए घाव भरने के परिणामों में सुधार के लिए हस्तक्षेप विकसित करने के लिए एक बेहतर समझ आवश्यक है।
घाव भरने में उपकला कोशिका प्रवास का अध्ययन इन विट्रो दृष्टिकोण और मॉडल जीवों दोनों का उपयोग करके किया गया है। घाव भरने और सेल माइग्रेशन के तंत्र के अधिकांश अध्ययन ऊतक संस्कृति में किए गए हैं, जहां एक एकल उपकला कोशिका प्रकार के मोनोलेयर एक सब्सट्रेट पर उगाए जाते हैं जो ईसीएम के लिए विकल्प होता है। सेल मोनोलेयर को विशिष्ट आकृतियों और आकारों के अंतराल बनाने के लिए या तो खरोंच या स्टैंसिल के साथ उगाया जाता है और फिर32,33,34 देखा जाता है। इन विट्रो मॉडल सेल व्यवहार के एक आदर्श विज़ुअलाइज़ेशन की अनुमति देता है, साथ ही सब्सट्रेट के गुणों को बदलने का अवसर, कोशिकाओं को दवाओं और अजैविक और जैविक कारकों को उजागर करने के लिए, और संरचनाओं के साथ कोशिकाओं को स्थानांतरित करने के लिए जो रुचि के विभिन्न जीनों को व्यक्त या दबाते हैं। हालांकि, यह न्यूनीकरणवादी दृष्टिकोण विवो संदर्भ में उपकला कोशिका व्यवहार में शामिल कुछ महत्वपूर्ण मापदंडों को पकड़ने में विफल हो सकता है, जिसमें ईसीएम11 में होने वाले विभिन्न सेल प्रकारों और सिग्नलिंग घटनाओं के बीच संचार शामिल है। विवो मॉडल में एक घाव का प्रामाणिक संदर्भ प्रदान करता है, जिसमें कई सेल प्रकार, अतिव्यापी सिग्नलिंग मार्ग और एक जटिल ईसीएम35 होता है। घाव भरने के अध्ययन के लिए ऐसा एक मॉडल माउस19 है, जिसमें हाल की प्रगति ने शोधकर्ताओं कोजीवित जानवरों में पूर्ण मोटाई के घावों के उपचार के दौरान एपिडर्मल कोशिकाओं का निरीक्षण करने की अनुमति दी है। हालांकि, विवो सिस्टम में माउस और अन्य पुन: उपकलाकरण का अध्ययन करने के लिए चुनौतियां पेश करते हैं। सबसे पहले, एक प्राकृतिक संदर्भ में सेल व्यवहार को देखने का बड़ा लाभ कशेरुक घाव भरने के दौरान होने वाली अस्थायी रूप से अतिव्यापी घटनाओं की जटिलता से संतुलित होता है, जिसमें रक्त के थक्के, प्रतिरक्षा कोशिकाओं की भर्ती और सूजन, फाइब्रोब्लास्ट की भर्ती, और सेल डी-भेदभाव, पुन: वैस्कुलराइजेशन और ईसीएम के रीमॉडेलिंग शामिल हैं। इसके अलावा, अपारदर्शी ऊतक इमेजिंग को मुश्किल बनाते हैं। ड्रोसोफिला लार्वा और ज़ेब्राफिश एपिडर्मिस सिस्टम37,38 ने अपनी सापेक्ष सादगी के कारण इनमें से कुछ कठिनाइयों को दूर कियाहै।
हमारी प्रयोगशाला ने हाल ही में उपकला घाव भरने का अध्ययन करने के लिए एक नया मॉडल पेश किया: हाइड्रोज़ोन सीनिडेरियन क्लिटिया हेमिसफेरिका (क्लिटिया) 40 का मेडुसा (जेलीफिश) रूप। क्लिटिया एक उभरता हुआ मॉडल जीव है जिसमें पूरी तरह से अनुक्रमित और एनोटेटेड जीनोम 41, एकल कोशिका आरएनएसेक ट्रांसस्क्रिप्टम42, और जीनोम संशोधन (म्यूटेनेसिस और ट्रांसजेनेसिस) 43,44,45 के लिए प्रोटोकॉल हैं। निडारियन उपकला परतों वाले सबसे पुराने विलुप्त वंशों में से एक हैं, इसलिए निडारियन घाव भरने को समझना पैतृक मार्गों में अंतर्दृष्टि प्रदान करता है जो उपकला अखंडता सुनिश्चित करते हैं। उन मार्गों के लिए जिन्हें जीवन के पूरे पेड़ में संरक्षित किया गया है, क्लिटिया उपकला कोशिका गतिशीलता और विवो में घाव भरने के कार्यात्मक विनियमन का अध्ययन करने के लिए एक रोमांचक नई प्रणाली प्रदान करता है।
क्लिटिया मेडुसा (एक्सअम्ब्रेला) की ऊपरी सतह को कवर करने वाला एपिथेलियम पारदर्शी, स्क्वैमस उपकला कोशिकाओं का एक मोनोलेयर है जो लगभग 50 μm चौड़ा 1-2 μm मोटा है (चित्र 1)। वे मेसोग्लिया नामक एक ईसीएम से जुड़े होते हैं - जेलीफिश की "जेली"। मेसोग्लिया अन्य जानवरों 46,47,48 में पाए जाने वाले ईसीएम के समान है, जिसमें कशेरुक भी शामिल है, इसमें एक तहखाने की झिल्ली 40 है, और यह पूरी तरह से पारदर्शी है। क्लिटिया मेडुसा में उपकला परत को आसानी से खरोंच या घायल किया जा सकता है (नीचे देखें)। एपिथेलियम और ईसीएम की सादगी और पारदर्शिता उपचार के दौरान कोशिकाओं और उनके आंदोलनों की उच्च रिज़ॉल्यूशन इमेजिंग की अनुमति देती है। हाल ही में, कामरान एट अल ने क्लिटिया एपिथेलियम में छोटे घावों के उपचार को विस्तार से40 में चित्रित किया। यह प्रदर्शित किया गया था कि क्लिटिया में उपचार लैमेलिपोडिया-आधारित सेल-क्रॉलिंग, सेल प्रसार और सामूहिक सेल माइग्रेशन के साथ-साथ पर्स स्ट्रिंग क्लोजर के माध्यम से होता है जो भ्रूण प्रणालियों के लिए अधिक विशिष्ट है (हालांकि पहले कॉर्निया49 जैसे वयस्क पशु संरचनाओं में देखा गया था)। क्लिटिया घाव भरना बेहद तेज है, जैसा कि अन्य प्रणालियों में देखा गया है जिनमें भड़काऊ प्रतिक्रिया40,50 की कमी है। क्लिटिया एक्सअम्ब्रेला में उपचार पूरी तरह से मौजूदा उपकला कोशिकाओं के आंदोलनों पर निर्भर है - कोई भी कोशिका ईसीएम के माध्यम से घाव स्थल तक प्रसार या पलायन नहीं करती है (पूरक मूवी 1)। इन सभी निष्कर्षों से पता चलता है कि क्लिटिया उपकला घाव भरने का अध्ययन करने के लिए एक उपयोगी मॉडल प्रणाली है। दरअसल, घाव भरने के दौरान क्लिटिया में उपकला कोशिकाओं की इमेजिंग की आसानी ने यह खोज की कि उपकला कोशिका लैमेलिपोडिया उजागर ईसीएम के क्षेत्रों में फैली हुई है और फैली हुई है जब तक कि एक बरकरार तहखाने की झिल्ली है; यदि तहखाने की झिल्ली क्षतिग्रस्त हो जाती है, तो उपकला उपचार पर्स स्ट्रिंग तंत्र40 में बदल जाता है। यह लैमेलिपोडिया-आधारित क्रॉलिंग बनाम पर्स स्ट्रिंग क्लोजर द्वारा बंद करने के निर्णय को अंतर्निहित तंत्र का पहला प्रदर्शन था, जो उपचार में विशिष्ट सेल: ईसीएम इंटरैक्शन के महत्व पर प्रकाश डालता है और उनके प्राकृतिक संदर्भ में कोशिकाओं का अवलोकन करता है।
नीचे, एकल-कोशिका माइक्रोघाव, छोटे घाव जो मुख्य रूप से सेल फैलने से बंद हो जाते हैं, और बड़े घाव जिन्हें बंद करने के लिए सामूहिक सेल माइग्रेशन की आवश्यकता होती है, बनाने और इमेजिंग के लिए प्रोटोकॉल का वर्णन किया गया है। इसके अलावा, ईसीएम और उपकला कोशिकाओं में छोटे अणुओं की शुरूआत के लिए एक प्रोटोकॉल का वर्णन किया गया है, जिससे घाव भरने के कथित नियामक मार्गों के प्रयोगात्मक गड़बड़ी की अनुमति मिलती है।
1. पशु संस्कृति
- माइक्रोस्कोप स्लाइड पर क्लिटिया पॉलीप कॉलोनियों को बनाए रखें और एक ज़ेबराफ़िश प्रणाली में 18 डिग्री सेल्सियस पर कृत्रिम समुद्री जल (एएसडब्ल्यू) में मेडुसे को बनाए रखें, जिसमें पॉलीप कॉलोनियों के लिए 2 एल ज़ेबराफ़िश टैंक और मेडुसे के लिए कस्टम-निर्मित 5 एल स्यूडो-क्रीसेल टैंक (पूरक चित्र 1)51) हैं। एएसडब्ल्यू में विआयनीकृत (डीआई) एच2ओ में 4% तत्काल महासागर होते हैं।
- जानवरों को प्रतिदिन 2-3 दिन के आर्टेमिया के साथ खिलाएं जैसा कि51 में वर्णित है।
नोट: घाव भरने की इमेजिंग आसान है यदि जानवरों को हाल ही में खिलाया नहीं गया है, क्योंकि दृश्य के क्षेत्र में आंत से कम मलबा जारी किया गया है। - स्थापित पॉलीप कॉलोनियों से बेबी मेडुसे को आवश्यकतानुसार इकट्ठा करें, कॉलोनियों को रात भर 1 एल एएसडब्ल्यू से भरे 2 एल बीकर में रखकर इकट्ठा करें। सभी घाव भरने के प्रयोगों के लिए 2-3 सप्ताह की मादा मेडुसे का उपयोग करें। क्लिटिया के प्रसार का विस्तार से कहीं और वर्णन किया गयाहै।
2. चोट लगना
- कोशिकाओं के भीतर और बीच माइक्रोवाउंड बनाना (20-500 μm2)
- एक बड़ा उद्घाटन (0.5-0.7 सेमी व्यास) बनाने के लिए कैंची के साथ नोक को काटकर एक संशोधित ट्रांसफर पिपेट बनाएं।
नोट: जानवर को किसी भी नुकसान से बचने के लिए पिपेट में उद्घाटन पर्याप्त चौड़ा होना चाहिए। - संशोधित ट्रांसफर पिपेट का उपयोग करके, मेडुसा को एक अवसाद स्लाइड पर रखें, जिसमें मेडुसा एक्सअम्ब्रेला ऊपर की ओर हो, जिसमें जानवर को कवर करने के लिए पर्याप्त एएसडब्ल्यू हो।
- जानवर और छवि पर तुरंत एक कवरस्लिप रखें (इमेजिंग के विवरण के लिए नीचे देखें)। कवरस्लिप मेसोग्लिया को संपीड़ित करता है, और संपीड़ित ऊतक का पलटाव एक बल बनाता है जो कोशिकाओं कोथोड़ा अलग करता है। यह तुरंत प्रत्येक कोशिका के बीच अंतराल और कुछ कोशिकाओं के भीतर क्षति के रूप में प्रकट होता है (चित्रा 1 बी, बी', चित्रा 2, और चित्रा 3 ए-सी)।
- एक बड़ा उद्घाटन (0.5-0.7 सेमी व्यास) बनाने के लिए कैंची के साथ नोक को काटकर एक संशोधित ट्रांसफर पिपेट बनाएं।
- छोटे उपकला घाव ों का निर्माण (0.02-0.125 मिमी2)
- एक संशोधित ट्रांसफर पिपेट (ऊपर के रूप में) का उपयोग करके, मेडुसा को एक अवसाद स्लाइड पर रखें जिसमें मेडुसा एक्सब्रेला ऊपर की ओर हो।
- 200 μL पिपेट टिप का उपयोग करके, धीरे से मेडुसा की सतह को खरोंचें। कोमल खरोंच भी तहखाने की झिल्ली में रिप्स बना सकती है, जो आसानीसे स्पष्ट होती है। इमेजिंग के लिए जानवर को कवरस्लिप के साथ कवर करें। वैकल्पिक रूप से, कवरस्लिप का प्लेसमेंट कभी-कभी खरोंच के बिना भी छोटे उपकला घाव बनाने के लिए पर्याप्त होता है (चित्रा 1 सी, सी', चित्रा 2, और चित्रा 3 ए-सी)।
नोट: मेडुसा की सतह को खरोंचते समय नीचे न दबाएं, क्योंकि यह ईसीएम को नुकसान पहुंचाता है और एक अनियमित सतह बनाता है - अनियमित सतह पर पलायन करने वाली उपकला कोशिकाओं को ध्यान में रखना अधिक कठिन होता है।
- बड़े उपकला घाव ों का निर्माण (0.5-0.9 मिमी2)
- माइक्रोपिपेट पुलर और ग्लास केशिका ट्यूब (चरण 5.2) का उपयोग करके एक माइक्रोइंजेक्शन सुई बनाएं। खाली माइक्रोइंजेक्शन सुई को माइक्रोमैनिपुलेटर से चिपके हुए माइक्रोइंजेक्टर धारक में रखें। सुई की नोक को काट लें ताकि उद्घाटन लगभग 20-40 μm हो।
नोट: बड़े उपकला घावों के लिए कटी हुई सुइयों को प्रयोगों के बीच स्थिरता बढ़ाने के लिए संग्रहीत और पुन: उपयोग किया जा सकता है। - माइक्रोइंजेक्टर पर पकड़ दबाव को शून्य पर सेट करें, और इजेक्ट दबाव को लगभग 20 पीएसआई पर सेट करें। माइक्रोइंजेक्टर को हवा की 2 एस पल्स देने के लिए सेट करें।
नोट: सुई खोलने के व्यास के आधार पर इजेक्ट दबाव को समायोजित करने की आवश्यकता हो सकती है (यानी, छोटी युक्तियां उच्च दबाव का उपयोग करेंगी, जबकि बड़ी युक्तियां कम दबाव का उपयोग करेंगी)। - मेडुसा को एक विच्छेदन दायरे के चरण पर एक अवसाद स्लाइड पर एक्सब्रेला के साथ रखें, जिसमें जानवर को कवर करने के लिए पर्याप्त एएसडब्ल्यू हो। माइक्रोमैनिपुलेटर का उपयोग करके, माइक्रोइंजेक्शन सुई टिप को समायोजित करें ताकि यह पानी के ठीक ऊपर हो। ऐसा करने के लिए, टिप को सावधानी से पानी में डुबोएं (पानी पिपेट टिप में प्रवेश कर सकता है), फिर इसे वापस ले लें ताकि यह मेडुसा की उपकला सतह के करीब हो।
नोट: टिप को मेडुसा के एक चतुर्थांश पर स्थित किया जाना चाहिए। मेडुसा की रेडियल नहरें मेडुसा बेल को चार अलग-अलग क्वाड्रंट में विभाजित करती हैं। एक क्वाड्रंट को लक्षित करने से क्लीनर इमेजिंग होगी, क्योंकि गोनैड्स और रेडियल नहरों को घाव क्षेत्र से बाहर रखा गया है। - इंजेक्टर पर स्टार्ट दबाकर पल्स एयर। टिप की चौड़ाई के आधार पर पल्स को एक ही स्थान पर दो से चार बार दोहराएं। बड़े सुझावों के लिए कम दालों की आवश्यकता होती है।
नोट: हवा की नाड़ी के कारण पानी / मेडुसा में एक इंडेंट दिखाई देना चाहिए। - घायल जानवर को बड़े घावों की इमेजिंग के लिए एक कवरस्लिप के साथ कवर करें (चित्रा 1 डी, डी')।
- उपकला घाव भरने की इमेजिंग के लिए नीचे दिए गए चरणों (अनुभाग 3) का पालन करें।
- माइक्रोपिपेट पुलर और ग्लास केशिका ट्यूब (चरण 5.2) का उपयोग करके एक माइक्रोइंजेक्शन सुई बनाएं। खाली माइक्रोइंजेक्शन सुई को माइक्रोमैनिपुलेटर से चिपके हुए माइक्रोइंजेक्टर धारक में रखें। सुई की नोक को काट लें ताकि उद्घाटन लगभग 20-40 μm हो।
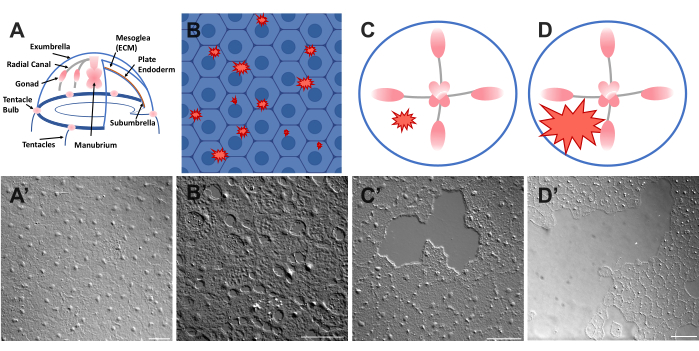
चित्रा 1: क्लिटिया मेडुसा में बरकरार और घायल एक्सब्रेला एपिथेलियल परत। (ए) क्लिटिया मेडुसा शरीर का कार्टून ग्राफिक। (A') बरकरार मेडुसा एक्सअम्ब्रेला एपिथेलियम ऊपर से देखा गया। (बी) नीले रंग में उपकला कोशिकाओं के साथ एकल-कोशिका माइक्रोवाउंड (लाल टैग किए गए आकार) का कार्टून। (B') एकल कोशिका माइक्रोघाव। (सी) एक छोटे उपकला घाव का कार्टून (लाल जालीदार आकार)। (C') छोटे उपकला घाव। (डी) एक बड़े उपकला घाव का कार्टून (लाल जालीदार आकार)। (D') बड़ा उपकला घाव। सभी छवियां डीआईसी माइक्रोस्कोपी का उपयोग करके प्राप्त की गई थीं। (A'-C') में स्केल सलाखों: 50 μm. स्केल बार (D'): 100 μm. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
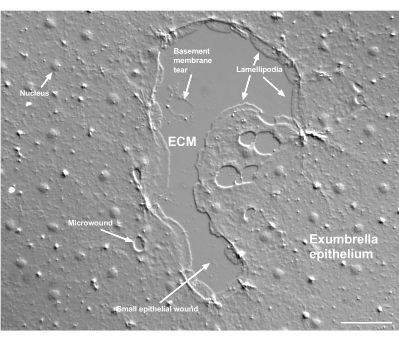
चित्रा 2: कई आकार के घाव और एक क्षतिग्रस्त तहखाने झिल्ली। एक विशिष्ट छोटा एक्सअम्ब्रेला एपिथेलियल घाव दिखाया गया है, जिसमें लेबल लैमेलिपोडिया का संकेत देते हैं जो सीमांत कोशिकाओं से बनते हैं। इसके अलावा, उपकला कोशिकाओं के भीतर और बीच में माइक्रोघाव देखे जाते हैं। घाव के ऊपरी हिस्से में छोटे तहखाने की झिल्ली के आंसू पर ध्यान दें। फिल्म 4 इस घाव के उपचार को दिखाती है। स्केल बार: 50 μm. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
3. इमेजिंग उपकला घाव भरने
- सुनिश्चित करें कि माइक्रोस्कोप को कोहलर रोशनी53 के लिए संरेखित किया गया है और इसे विभेदक हस्तक्षेप कंट्रास्ट (डीआईसी) माइक्रोस्कोपी54 के लिए सही ढंग से स्थापित किया गया है। उपकला कोशिकाएं मानक प्रकाशिकी (चित्रा 3 डी, ई) के साथ लगभग अदृश्य हैं।
- एक्सब्रेला पर फोकस समायोजित करें। यद्यपि यह एक पतली परत है, हेक्सागोनल कोशिकाओं को स्पष्ट होना चाहिए।
नोट: एक्सअम्ब्रेला और सबअम्ब्रेला को एक मोटी मेसोग्लिया द्वारा अलग किया जाता है जो ऊर्ध्वाधर तंतुओं द्वारा समर्थित होता है। सबम्ब्रेलर कोशिकाएं रेडियल नहरों के समान फोकल प्लेन में होती हैं। यदि शुरू में सबम्ब्रेलर परत पर ध्यान केंद्रित किया जाता है, तो एक्सब्रेला खोजने तक मेसोग्लिया और ऊर्ध्वाधर फाइबर के माध्यम से धीरे-धीरे फोकस को समायोजित करें। - छवि बनाने के लिए घाव को मैन्युअल रूप से पहचानें। बड़े घावों के लिए, 10x उद्देश्य का उपयोग करें। छोटे घावों और एकल-कोशिका घावों के लिए, 20x उद्देश्य का उपयोग करें।
- एक प्रोग्राम शुरू करें जो वास्तविक समय में एक फिल्म के रूप में छवियों को एकत्र करता है या जो नियमित अंतराल पर छवियों की एक श्रृंखला एकत्र करता है। यह सुनिश्चित करने के लिए प्रगति की निगरानी करें कि घाव क्षेत्र दृश्य के क्षेत्र से बाहर नहीं निकलता है और रुचि की कोशिकाएं फोकस में रहती हैं।
- एकल-कोशिका घाव एक मिनट के भीतर बंद हो जाते हैं; इसलिए, एक फिल्म के साथ उनके समापन की छवि बनाएं।
- छोटे घावों के लिए सेल गतिशीलता के विवरण को पकड़ने के लिए, लगभग हर 10 सेकंड में चित्र एकत्र करें। आकार के आधार पर छोटे घावों को बंद करने में 20-50 मिनट लगते हैं।
- 45 मिनट से अधिक समय तक अनसील स्लाइड्स को चित्रित न करें, क्योंकि समय के साथ स्लाइड से पानी के वाष्पीकरण से जानवरों की मृत्यु हो जाती है और कोशिकाएं टूट जाती हैं।
- लंबे समय तक अवलोकन के लिए, वाष्पीकरण को कम करने के लिए पेट्रोलियम जेली के साथ कवरस्लिप के चारों ओर सील करें।
नोट: कुछ मेडुसा स्लाइड पर पल्स कर सकते हैं, जो इमेजिंग में हस्तक्षेप करता है। इस मामले में, एएसडब्ल्यू में पीएच 7.5 में समायोजित 1% एथिल 3-एमिनोबेंजोएट मीथेनसल्फोनेट (ट्राइकेन) के 1:10 कमजोर पड़ने में जानवरों को एक प्रभावी एनेस्थेटिक के रूप में कार्य करता है और 1 घंटे की समय सीमा में उपचार पर कोई स्पष्ट प्रभाव नहीं पड़ता है। हालांकि, अगर ट्राइकेन में कई घंटों तक छोड़ दिया जाए तो जानवर मर जाएंगे।

चित्रा 3: एक्सब्रेब्रेलर एपिथेलियम में एक छोटा घाव बनाना। (ए) एक छोटा उपकला घाव बनाने के लिए 200 μL पिपेट टिप के साथ एक्सब्रेब्रेला का कोमल खरोंच। (बी) कवरस्लिप रखना कभी-कभी छोटे उपकला घावों को बनाने के लिए पर्याप्त होता है। (सी) मेडुसा एक अवसाद स्लाइड पर लगाया गया। (डी) डीआईसी प्रकाशिकी के बिना छोटे उपकला घाव की छवि और डीआईसी प्रकाशिकी के साथ (ई)। स्केल सलाखों: 50 μm कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
4. विश्लेषण
- छवि फ़ाइलें तैयार करना
नोट: छवि फ़ाइलों को संसाधित करने के लिए, अद्यतन बायोफॉर्मेट प्लगइन्स के साथ फिजी / इमेजजे का उपयोग करें।- छवि स्टैक को पंजीकृत करने से पहले पैमाने को सही पिक्सेल प्रति माइक्रोन अनुपात में सेट करें; > सेट स्केल का विश्लेषण करें। डाउनस्ट्रीम विश्लेषण में वास्तविक आकार माप निकालने के लिए यह आवश्यक है।
- अक्सर, जानवर माइक्रोस्कोप स्लाइड पर थोड़ा बहता है; इसलिए, फिल्मों में बहाव को खत्म करने के लिए, एसआईएफटी के साथ फिजी प्लगइन रैखिक स्टैक संरेखण का उपयोग करके छवियों को पंजीकृत करें। एसआईएफटी के साथ रैखिक स्टैक संरेखण > प्लगइन्स > पंजीकरण।
- पंजीकृत स्टैक को .avi फ़ाइल के रूप में सहेजें। फ़ाइल > > AVI के रूप में सहेजें... पॉप-अप में, फ्रेम दर सेट करें (एनिमेटेड आंकड़े यहां 10 एफपीएस पर सेट हैं) और ओके पर क्लिक करें। घाव भरने का विश्लेषण करने के लिए इस आउटपुट का उपयोग करें।
- घाव क्षेत्र का विश्लेषण
- ImageJ में लासो उपकरण का उपयोग करके, सेल किनारों का पता लगाकर घाव की रूपरेखा तैयार करें। घाव क्षेत्र को मापें जो अभी कमांड + एम या सीटीआरएल + एम के साथ उल्लिखित था।
- हर 10 फ्रेम में घाव क्षेत्र माप दोहराएं। फिजी / इमेजजे से माप को तब प्रिज्म 9 (चित्रा 4) का उपयोग करके प्लॉट किया जा सकता है।
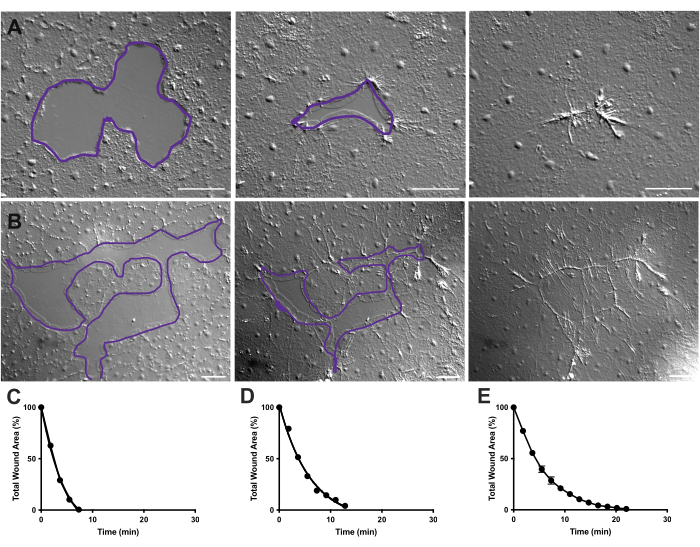
चित्रा 4: छोटे उपकला घावों में घाव क्षेत्र का विश्लेषण। (ए) 10 मिनट से अधिक एक छोटे उपकला घाव भरने का उदाहरण। (बी) 21 मिनट से अधिक एक अलग उपकला घाव भरने का उदाहरण। ए, बी में बैंगनी रूपरेखा फिजी / इमेजजे में लासो टूल का उपयोग करके घाव क्षेत्रों के माप के बराबर है। (सी) ए में समय के साथ घाव क्षेत्र की सामान्यीकृत कमी। (डी) बी में समय के साथ घाव क्षेत्र की सामान्यीकृत कमी। (ई) 14 छोटे घावों के लिए समय के साथ घाव क्षेत्र की औसत कमी। n = 14. त्रुटि पट्टियाँ माध्य ± SEM के आसपास केंद्रित हैं. स्केल सलाखों: 50 μm कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
5. मेसोगल इंजेक्शन
- इंजेक्शन डिश बनाना
- वजन के आधार पर 10 भागों के आधार से 1 भाग इलाज एजेंट के अनुपात में पीडीएमएस बेस और इलाज एजेंट के संयोजन से पॉलीडिमिथाइलसिलोक्सेन (पीडीएमएस) तैयार करें। बेस और इलाज एजेंट को पूरी तरह से मिलाने के लिए जोर से हिलाएं।
- बुलबुले को हटाने के लिए, मिश्रण को 15 मिनट के लिए वैक्यूम कक्ष में रखें। मोल्ड को रखने के लिए मिश्रण को माइक्रोसेंट्रीफ्यूज ट्यूब कैप के साथ 60 मिमी पेट्री डिश में डालें। तुरंत मोल्ड को ट्यूब कैप पर 45 डिग्री तिरछा और जगह में टेप पर रखें। मोल्ड तीन स्टैक्ड, ऑफसेट ग्लास स्लाइड है जो अंतिम इंजेक्शन डिश में लकीरें बनाने के लिए एक साथ चिपकाए गए हैं।
- इलास्टोमर को ठीक करने के लिए पूरे पकवान, मोल्ड और मिश्रण को 2 घंटे के लिए 60 डिग्री सेल्सियस पर ओवन में रखें। एक पूर्ण इंजेक्शन डिश के लिए मोल्ड को हटा दें।
- माइक्रोपिपेट पुलिंग
- एक माइक्रोइलेक्ट्रोड पुलर का उपयोग करके, एक पुलिंग प्रोग्राम डिज़ाइन करें। उच्च वेग के साथ एक-चरण यी प्रोग्राम का उपयोग करें। गर्मी लगभग ग्लास रैंप परीक्षण परिणाम55,56 है। लंबे समय तक लगातार टेपर्स के लिए परिणामी माइक्रोपिपेट की जांच करें।
नोट: 1.0 मिमी बाहरी व्यास, 0.75 मिमी आंतरिक व्यास और 10 सेमी लंबाई के साथ पतली दीवार ग्लास बोरोसिलिकेट केशिकाओं का उपयोग करें।
- एक माइक्रोइलेक्ट्रोड पुलर का उपयोग करके, एक पुलिंग प्रोग्राम डिज़ाइन करें। उच्च वेग के साथ एक-चरण यी प्रोग्राम का उपयोग करें। गर्मी लगभग ग्लास रैंप परीक्षण परिणाम55,56 है। लंबे समय तक लगातार टेपर्स के लिए परिणामी माइक्रोपिपेट की जांच करें।
- रंगों और दवाओं का इंजेक्शन
- एक माइक्रोइंजेक्शन सुई बनाएं (जैसा कि ऊपर बताया गया है)।
- मेडुसा में इंजेक्शन के लिए डाई या दवा की अतिरिक्त मात्रा के साथ एक लंबी पिपेट टिप का उपयोग करके माइक्रोइंजेक्शन सुई को बैकफिल करें।
नोट: क्लिटिया के लिए, डाइमिथाइल सल्फोक्साइड (डीएमएसओ) को एएसडब्ल्यू के साथ <1:100 कमजोर पड़ने पर रखा जाना चाहिए, क्योंकि उच्च डीएमएसओ सांद्रता घाव भरने में बाधा डालती है। यदि एक स्पष्ट समाधान इंजेक्ट किया जाता है, तो फास्ट ग्रीन एफसीएफ समाधान (एएसडब्ल्यू में 0.1% फास्ट ग्रीन एफसीएफ का 1:100 कमजोर पड़ना) इंजेक्शन तरल की कल्पना करने के लिए जोड़ा जा सकता है। - ऊपर दिए गए एक संशोधित ट्रांसफर पिपेट का उपयोग करके, एक मेडुसा को पीडीएमएस इंजेक्शन डिश में रखा जाता है, जिसमें जानवर को कवर करने के लिए पर्याप्त एएसडब्ल्यू होता है (चित्रा 5 सी)। डिश को विच्छेदन दायरे के मंच पर रखें।
नोट: अतिरिक्त एएसडब्ल्यू को सीमित करना मेडुसा को डिश में तैरने से रोकता है और अधिक सफल इंजेक्शन की अनुमति देता है। - माइक्रोइंजेक्शन सुई टिप पर ध्यान केंद्रित करें और इसे मेडुसा के पास पानी में आगे बढ़ाएं। माइक्रोमैनिपुलेटर के साथ, सुई को डिश में तब तक दबाएं जब तक कि यह झुक न जाए और टूट न जाए। यह टिप ओपनिंग लगभग 10-20 μm है।
नोट: इस सुई का उपयोग उस दिन एक ही डाई / दवा इंजेक्शन के लिए बार-बार किया जा सकता है। प्रत्येक दिन और अलग-अलग रंगों / दवाओं के लिए एक ताजा टिप का उपयोग करने की सिफारिश की जाती है। - माइक्रोमैनिपुलेटर का उपयोग करके, एक्सब्रेला को घुमाए बिना उप-छतरी के माध्यम से सुई की नोक को मेसोग्लिया में डालें।
नोट: एपिथेलियम का एक सिकुड़ना / मोड़ना ध्यान देने योग्य होगा। एक बार जब सुई को मेडुसा में डाला जाता है, तो क्रेसिंग/फोल्डिंग बंद हो जाती है। - माइक्रोइंजेक्टर पर, होल्ड प्रेशर को शून्य और इजेक्शन प्रेशर को ≤20 पीएसआई पर सेट करें। एक या दो क्वाड्रंट में इंजेक्ट करें, प्रत्येक को डाई या ड्रग के एक स्थान से भरें, जो उस क्वाड्रंट के क्षेत्रफल का लगभग 1/4 है।
नोट: मेडुसा के आकार के आधार पर, एकल इंजेक्शन स्पॉट में बड़े या छोटे वॉल्यूम उपयुक्त हैं। मेडुसा को ओवरफिल करने से एपिथेलियम को अत्यधिक नुकसान होता है और यहां तक कि जानवर की मृत्यु भी हो जाती है। - डाई या दवा को किस तरह से इंजेक्ट किया जा रहा है, इसके आधार पर, जानवरों को डाई या दवा प्रसार और इनक्यूबेशन की अनुमति देने के लिए ताजा एएसडब्ल्यू के बीकर में रखा जाता है।
- इमेजिंग के लिए, एक संशोधित ट्रांसफर पिपेट का उपयोग करके मेडुसा को एक अवसाद स्लाइड पर माउंट करें, जानवर को स्थिति दें ताकि एक्सब्रेला ऊपर की ओर हो (चित्रा 5)। इंजेक्शन अभिकर्मक के प्रभाव का परीक्षण करने के लिए जानवरों को इस स्तर पर घायल किया जा सकता है।
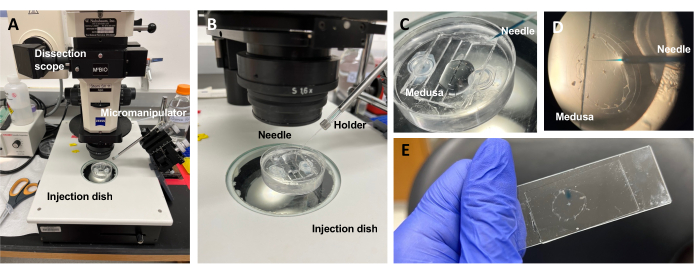
चित्रा 5: ईसीएम में रंजक या दवाओं को पेश करने के लिए इंजेक्शन सेटअप। (ए) इंजेक्शन सेटअप। (बी) माइक्रोइंजेक्शन सुई अभिविन्यास (डिश में जानवर के सापेक्ष लगभग 45 डिग्री कोण) दिखाने वाले इंजेक्शन सेटअप का क्लोज-अप। (सी) इंजेक्शन के लिए एएसडब्ल्यू की थोड़ी मात्रा में मेडुसा के साथ सिलिकॉन इंजेक्शन डिश का क्लोज-अप। (डी) फास्ट ग्रीन एफसीएफ से भरी एक माइक्रोइंजेक्शन सुई सबअम्ब्रेला के माध्यम से मेडुसा के मेसोग्लिया में प्रवेश करती है। (ङ) माउंटेड मेडुसा में फास्ट ग्रीन एफसीएफ का इंजेक्शन लगाया जाना। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
उपरोक्त प्रोटोकॉल का पालन करते हुए, एकल-कोशिका माइक्रोघाव, छोटे घाव और बड़े घावों की छवि बनाई गई थी। छवि फ़ाइलों के पंजीकृत ढेर .avi फ़ाइलों के रूप में सहेजे गए थे।
मूवी 1 में, माइक्रोवाउंड को कोशिकाओं के बीच और भीतर बंद होते देखा जा सकता है (चित्रा 1 और चित्रा 2)। बंद होने के दौरान छोटे लैमेलिपोडिया देखे जाते हैं, इसके बाद संकुचन और उपचार होता है। मलबे को बाहर रखा जाता है और पानी में छोड़ दिया जाता है। उपचार एक मिनट या उससे कम समय में पूरा हो जाता है।
मूवी 2 और 3 में, विभिन्न आकृतियों के छोटे घाव लैमेलिपोडिया के गठन, लैमेलिपोडियाल संपर्कों के विस्तार और घाव मार्जिन पर कोशिकाओं के प्रसार के माध्यम से ठीक हो जाते हैं, जैसा कि पहले वर्णित40 (चित्रा 1 और चित्रा 2)। सीमांत कोशिकाओं के पीछे स्तरों में कोशिकाएं इस आकार के घावों के उपचार में भाग नहीं लेती हैं और न ही सामूहिक सेल माइग्रेशन होता है। उपकला अंतराल के तेजी से और प्रगतिशील बंद होने के बाद नवगठित घाव सीम40 के साथ ऊतक संकुचन होता है। समय के साथ मूल क्षेत्र के प्रतिशत के रूप में व्यक्त इन दो घावों के उपचार की सामान्यीकृत दर दिखाई गई है (चित्रा 4 सी, डी)। जबकि घाव बंद होने की गतिशीलता में कुछ परिवर्तनशीलता है, 0.02-0.125 मिमी2 से लेकर विभिन्न आकारों के 14 घावों के लिए समय के साथ प्रतिशत क्षेत्र बंद होने का औसत अनुपचारित जानवरों में घाव भरने के लिए एक औसत वक्र की स्थापना की अनुमति देता है (चित्रा 4 ई)।
तहखाने की झिल्ली को नुकसान स्पष्ट रूप से देखा जा सकता है जब यह होता है (चित्रा 2)। मूवी 4 में, एक छोटे से घाव के मार्जिन पर कोशिकाएं जिसमें क्षतिग्रस्त क्षेत्र के चारों ओर तहखाने की झिल्ली की क्षति फैली हुई है, और गैप क्लोजर एक पर्स स्ट्रिंग संकुचन के साथ पूरा होता है।
यदि ऊतक निर्जलित है या मरम्मत के लिए बहुत क्षतिग्रस्त है, तो सेल आंदोलन बंद हो सकते हैं, या कोशिकाओं की पूरी शीट फट सकती है (मूवी 5 और मूवी 6)। यह आमतौर पर इमेजिंग की लंबी अवधि (45 मिनट या उससे अधिक) के बाद होता है। यदि इमेजिंग में सेल फटना जल्दी होता है, तो नमूना छोड़ दिया जाता है।
जैसा कि मूवी 7 में दिखाया गया है, बड़े घाव कई चरणों में ठीक हो जाते हैं। सबसे पहले, मार्जिन पर संकुचन के कारण घाव का किनारा चिकना और नियमित हो जाता है, जैसा किपहले बताया गया था। फिर, लैमेलिपोडिया को घाव के मार्जिन पर कोशिकाओं से बनते देखा जाता है, जिसमें लैमेलिपोडिया आसन्न लैमेलिपोडिया के साथ संपर्क को अधिकतम करने के लिए आगे बढ़ता है। घाव मार्जिन पर कोशिकाओं में नाभिक की ट्रैकिंग और सीमांत कोशिकाओं के पीछे कई स्तरों से पता चलता है कि सामूहिक सेल माइग्रेशन40 द्वारा बड़े अंतराल बंद हो जाते हैं। कोशिकाएं कभी अलग नहीं होती हैं, लेकिन एक शीट के रूप में एक साथ चलती हैं।
रंगों और औषधीय एजेंटों की शुरूआत जैविक तंत्र के विच्छेदन के लिए एक शक्तिशाली उपकरण हो सकती है। कई पदार्थों को क्लिटिया (नहीं दिखाया गया) से बाहर रखा गया है, संभवतः बलगम परत के कारण जो जानवर की सतह को कोट करता है। हालांकि, माइक्रोइंजेक्शन का उपयोग ईसीएम में अणुओं को सीधे पेश करने, ईसीएम संरचना को बाधित करने या ईसीएम में नियामक गतिविधियों को परेशान करने के लिए किया जा सकता है। इसके अलावा, रंजक और अन्य अणु बेसल साइड से उपकला कोशिकाओं में प्रवेश करने में सक्षम हैं। उदाहरण के लिए, चित्र 6 में होचस्ट के साथ परमाणु धुंधलापन, एफएम 1-43 के साथ झिल्ली धुंधला होना, और इन अभिकर्मकों को ईसीएम में माइक्रोइंजेक्ट किए जाने के बाद साइटोक्लासिन बी द्वारा लैमेलिपोडिया गठन का निषेध दिखाया गया है। घायल होने से पहले ईसीएम और उपकला कोशिकाओं में इन अणुओं का परिचय उन प्रयोगों की अनुमति देता है जो उपचार प्रक्रिया पर औषधीय उपकरणों के प्रभाव का परीक्षण करते हैं।
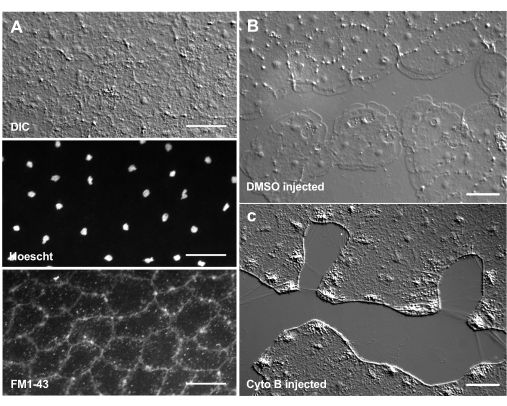
चित्रा 6: रंजक या औषधीय एजेंटों के माइक्रोइंजेक्शन के बाद मेडुसा की उपकला कोशिकाएं। (ए ) उपकला कोशिकाओं को 20 μM Hoechst (नाभिक) और 50 μM FM1-43 (झिल्ली) के साथ इंजेक्शन के 5 मिनट बाद शीर्ष पैनल में दिखाया गया। (बी, सी) 1: 1,000 डीएमएसओ नियंत्रण ( बी ) या 100 μM Cytochalasin B (C) के साथ इंजेक्शन के बाद घाव भरने। इंजेक्शन के 15 मिनट बाद घाव किए गए थे। चित्र घायल होने के 5 मिनट बाद लिए गए थे। लैमेलिपोडिया का गठन साइटोक्लासिन बी द्वारा बाधित होता है। घाव क्षेत्र में कोशिकाओं के बीच अक्सर देखे जाने वाले स्पष्ट "फाइबर" को तहखाने की झिल्ली को फैलाने वाले तनाव का परिणाम माना जाता है - वे फैलोइडिन के साथ दाग नहीं करते हैं (दिखाया नहीं गया है)। स्केल सलाखों: 50 μm. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
मूवी 1: सिंगल सेल माइक्रोवाउंड हीलिंग की टाइम-लैप्स फिल्म। समय बीत गया: 20 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 50 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
मूवी 2: एक छोटे उपकला घाव भरने की टाइम-लैप्स फिल्म। समय बीत गया: 9 मिनट 54 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 50 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
मूवी 3: एक छोटे से उपकला घाव भरने की टाइम-लैप्स फिल्म। यह घाव मूवी 2 में घाव की तुलना में बड़ा और अधिक अनियमित आकार का है। समय बीत गया: 20 मिनट 54 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 50 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
मूवी 4: एक छोटे से घाव की टाइम-लैप्स फिल्म और एक तहखाने की झिल्ली के आंसू के साथ एक माइक्रोवंड उपचार। लैमेलिपोडिया तहखाने की झिल्ली के चारों ओर फैल गया, हालांकि वे ईसीएम के बाकी हिस्सों पर आगे बढ़ सकते हैं। एक बार जब तहखाने की झिल्ली की क्षति के साथ घाव का क्षेत्र घिरा हुआ है, तो एक पर्स स्ट्रिंग संकुचन क्षेत्र पर कोशिकाओं को खींचता है। समय बीत गया: 19 मिनट 4 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 50 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
फिल्म 5: एक छोटे उपकला घाव में कोशिकाएं मर रही हैं। पशु के निर्जलीकरण के कारण कोशिका मृत्यु की संभावना है। समय बीत गया: 4 मिनट 24 सेकंड फ्रेम दर: 10 एफपीएस। स्केल बार: 100 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
फिल्म 6: एक छोटा उपकला घाव उपचार को पूरा करने में विफल रहता है। समय बीत गया: 42 मिनट 32 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 50 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
फिल्म 7: बड़े उपकला घाव उपचार। समय बीत गया: 25 मिनट 29 सेकंड। फ्रेम दर: 10 एफपीएस। स्केल बार: 100 μm. कृपया इस फिल्म को डाउनलोड करने के लिए यहां क्लिक करें।
पूरक चित्र 1: क्लिटिया टैंक आयाम योजनाबद्ध। कस्टम-निर्मित क्लिटिया टैंक का 3 डी विज़ुअलाइज़ेशन। (ए) सामने और पीछे का दृश्य। (बी) साइड व्यू। हरे रंग में दिखाए गए टुकड़े में कट-आउट नायलॉन जाल से ढका हुआ है। पानी जाल के ऊपर सीधे टैंक में प्रवेश करता है, जाल पर झाड़ू लगाता है और एक गोलाकार प्रवाह बनाता है। नीले रंग में दिखाए गए अंतिम टुकड़े में छेद के माध्यम से पानी सिस्टम से बाहर निकलता है। कृपया इस फ़ाइल को डाउनलोड करने के लिए यहाँ क्लिक करें.
पूरक मूवी 1: क्लिटिया में एककोशिकीय बाह्य मैट्रिक्स। क्लिटिया का जेड-स्टैक कॉन्फोकल माइक्रोस्कोपी का उपयोग करके लिया गया। स्टैक शुरू में एक्सअम्ब्रेला पर केंद्रित होता है और फिर ईसीएम के माध्यम से प्लेट एंडोडर्म और सबअम्ब्रेला में हर 10 μm स्कैन करता है। डीआईसी (बाएं) और होचस्ट परमाणु धुंधला (दाएं) का उपयोग करने वाली छवियां ईसीएम में कोशिकाओं की कमी को प्रदर्शित करती हैं। स्केल बार: 100 μm. कृपया इस फ़ाइल को डाउनलोड करने के लिए यहाँ क्लिक करें.
यहां, क्लिटिया में विवो में इमेजिंग घावों के लिए कार्यप्रणाली प्रस्तुत की गई है, जो एक अपेक्षाकृत नया अकशेरुकी मॉडल जीव40,43,58 है। ऐसे कई कारक हैं जो इस प्रणाली को एक अद्वितीय और शक्तिशाली अनुसंधान उपकरण बनाते हैं, जो घाव भरने और पुन: उपकलाकरण का अध्ययन करने के लिए उपयोग किए जाने वाले अन्य मॉडलों से अलग हैं। सबसे पहले, मोनोलेयर एपिथेलियम एक पारदर्शी ईसीएम से जुड़ा होता है, इसलिए इन विट्रो ऊतक संस्कृति परख (चित्रा 1, चित्रा 2, चित्रा 3, चित्रा 4) जैसा दिखता है। जैसा कि इन विट्रो परख ों में, कोशिकाओं को उच्च रिज़ॉल्यूशन पर चित्रित किया जा सकता है। हालांकि, ऊतक संस्कृति के विपरीत, एक प्रामाणिक सेलुलर वातावरण और ईसीएम है, ताकि घाव भरने को एक जीवित घायल जानवर में होने वाली जटिल सिग्नलिंग घटनाओं के संदर्भ में देखा जा सके। दूसरा, क्लिटिया में भड़काऊ प्रतिक्रियाओं, प्रवासी फाइब्रोब्लास्ट, वाहिका और रक्त की कमी होती है। यह घाव भरने के दौरान अधिक जटिल वयस्क जानवरों में होने वाली अतिव्यापी घटनाओं की अनुपस्थिति में विवो में पुन: उपकलाकरण प्रक्रिया काअध्ययन करने की अनुमति देता है। तीसरा, ईसीएम एककोशिकीय (पूरक मूवी 1) और बड़ा है, जो माइक्रोइंजेक्शन सुई (चित्रा 5 और चित्रा 6) के साथ आसान पहुंच की अनुमति देता है। इस दृष्टिकोण का उपयोग करके, शोधकर्ता औषधीय अभिकर्मकों के प्रभाव का परीक्षण कर सकते हैं जो विवो में घाव भरने पर ईसीएम संरचना या सिग्नलिंग को परेशान करते हैं। अभिकर्मकों को उपकला कोशिकाओं में भी पेश किया जा सकता है, और विवो घाव भरने में उनके प्रभाव का आकलन किया जा सकता है। चौथा, ऐसे प्रोटोकॉल हैं जो क्लिटिया प्रणाली 42,43,44,45 में उत्परिवर्ती और ट्रांसजेनिक जानवरों को बनाने के लिए मौजूद हैं। विवो में घाव भरने को इसलिए जानवरों में रुचि के जीन की बढ़ी हुई / कम अभिव्यक्ति के साथ देखा जा सकता है।
इस तकनीक में कई महत्वपूर्ण कदम हैं। सबसे पहले, जैसा कि चित्रा 3 में दिखाया गया है, एक माइक्रोस्कोप का उपयोग करना आवश्यक है जो डीआईसी माइक्रोस्कोपी के लिए सही ढंग से कॉन्फ़िगर किया गया है क्योंकि सपाट, पारदर्शी उपकला कोशिकाएं मानक प्रकाश माइक्रोस्कोपी के साथ लगभग अदृश्य हैं। जानवरों को धीरे से घाव करने के लिए कौशल विकसित करना भी महत्वपूर्ण है ताकि ईसीएम को प्रभावित किए बिना उपकला क्षतिग्रस्त हो जाए। ईसीएम में माइक्रोइंजेक्टिंग सामग्री के लिए एक समान सौम्य स्पर्श आवश्यक है, क्योंकि इंजेक्शन के दौरान जानवर को व्यापक नुकसान घाव भरने के बाद के विश्लेषण से समझौता कर सकता है। जबकि इन तकनीकों के लिए एक सीखने की अवस्था है, यहां तक कि शुरुआती छात्रों ने उन्हें मलामी प्रयोगशाला में जल्दी से महारत हासिल की है। दरअसल, इन प्रोटोकॉल का उपयोग शिकागो विश्वविद्यालय में स्नातक प्रयोगशाला पाठ्यक्रमों में सेल माइग्रेशन का प्रदर्शन करने के लिए किया गया है।
इष्टतम इमेजिंग के लिए, यह महत्वपूर्ण है कि जानवर हिलता नहीं है और चुना हुआ घाव क्षेत्र दृश्य के क्षेत्र से बाहर नहीं निकलता है। यदि जानवर स्पंदन कर रहे हैं, तो वर्णित ट्राइकेन के साथ उपचार बहुत प्रभावी है। बहने के लिए, नमूने को मैन्युअल रूप से पुनर्स्थापित करना अक्सर आवश्यक होता है। इन आंदोलनों को फिजी / इमेजजे में पंजीकरण फ़ंक्शन का उपयोग करके अंतिम फिल्म से हटाया जा सकता है।
इस प्रणाली के साथ एक सीमा यह है कि समान घाव बनाना संभव नहीं है, क्योंकि घाव यहां वर्णित तरीकों का उपयोग करके आकार और आकार दोनों में भिन्न होते हैं। इसलिए, घाव बंद होने या सेल माइग्रेशन की सटीक दर की मात्रा निर्धारित करना मुश्किल हो सकता है। कार्बन अनाज जैसे स्थितिगत मार्कर एक घायल जानवर में उजागर ईसीएम से चिपक जाते हैं और बड़े घावों में सामूहिक सेल प्रवास की दर को मापने के लिए इस्तेमाल किया जा सकता है (दिखाया नहीं गया)। छोटे घाव बंद करने के विश्लेषण के लिए, यहां तक कि परिवर्तनीय घाव के आकार और आकार के साथ, इस आकार के घावों के बीच बंद होने की दरों की एक सीमित सीमा है (चित्रा 4)। इसलिए मात्रात्मक रूप से प्रोत्साहक या दमनकारी औषधीय अभिकर्मकों के प्रभावों का पता लगाना संभव है।
जबकि यह काम केवल डीआईसी माइक्रोस्कोपी का उपयोग करके घाव भरने के लक्षण वर्णन का वर्णन करता है, उसी दृष्टिकोण का उपयोग प्रतिदीप्ति या कॉन्फोकल माइक्रोस्कोपी का उपयोग करके उपचार की छवि बनाने के लिए किया जा सकता है। इसमें सहायता के लिए, ट्रांसजेनिक जानवरों को उत्पन्न करने के लिए प्रोटोकॉल हैं जिसमें विभिन्न सेलुलर और बाह्य प्रोटीन फ्लोरोसेंटली लेबल किए जाते हैं। डीआईसी और प्रतिदीप्ति के साथ समवर्ती इमेजिंग, औषधीय एजेंटों या उत्परिवर्ती लाइनों का उपयोग करके घाव भरने की गड़बड़ी के साथ संयुक्त, उपकला में घाव भरने की प्रक्रिया को कम करने वाले तंत्र को समझने के लिए एक शक्तिशाली दृष्टिकोण होगा।
खुलासा करने के लिए कुछ भी नहीं।
ई.ई.एल.एल. को राष्ट्रीय विज्ञान फाउंडेशन पीआरएफबी 2011010 से अनुदान द्वारा समर्थित किया जाता है। हम अपनी क्लिटिया कॉलोनियों को स्थापित करने में हमारी मदद करने के लिए त्सुयोशी मोमोसे और एवलिन हौलिस्टन को धन्यवाद देना चाहते हैं, जीन-बैपटिस्ट रेनियर को माइक्रोवाउंड उपचार छवियों के संग्रह के लिए, हैरी किरियाज़ेस को छद्म-क्रीसेल टैंक ों के निर्माण के लिए, और एलिजाबेथ बाल्डो को क्लिटिया निवास स्थान को बनाए रखने के लिए। चित्र 1B BioRender.com के साथ बनाया गया था।
| Name | Company | Catalog Number | Comments |
| 20500 ACE EKE Microscope Fiber Optic Light Source | Kramer Scientific Corporation | ||
| AxioCam 506 mono | ZEISS | 426557-0000-000-MA285 | |
| Capillary tubes | World Precision Instruments | TW1004 | |
| Cytochalasin B | Abcam | ab143482 | |
| Depression slides | Amscope | BS-C12 | |
| DMR with DIC options and fluorescence halogen lamp | Leica | ||
| Ethyl 3-aminobenzoate methanesulfonate | Sigma Aldrich | E10521-10G | |
| Fast Green FCF | Thermo Scientific | A16520-06 | |
| FM1-43 | Biotium | 70022 | Excitation/Emission: 480/598 nm |
| Hoechst 33342 | Thermo Scientific | 62249 | Excitation/Emission: 361/497 nm |
| imageJ | NIH | ||
| Microloader tips (0.5-10 μL /2-20 μL) | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | 3301R / M3301L | |
| Microscope Cover Glass (22X40-1.5) | Fisherbrand | 12-544-BP | |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB085713A | |
| PicoNozzle v2 | World Precision Instruments | 5430-ALL | |
| Pipette puller | Sutter Instrument Co | P-97 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Polycarbonate vacuum, desiccator | Bel-art | F42025-0000 | |
| Prism 9 | GraphPad | ||
| STEMI Sv11 Dissection scope | ZEISS | STEMI SV11 | |
| SYLGARD 184 | Dow Silicones | 1024001 | |
| Transfer pipettes | Fisherbrand | 13-711-7M | |
| Z-Hab mini system | Pentair | ||
| ZEN Microscopy software | Zeiss |
- Tyler, S. Epithelium-the primary building block for metazoan complexity. Integrative and Comparative Biology. 43 (1), 55-63 (2003).
- Kurn, H., Daly, D. T. Histology, Epithelial Cell. StatPearls. , (2022).
- Schempp, C., Emde, M., Wölfle, U. Dermatology in the Darwin anniversary. Part 1: Evolution of the integument. Journal of the German Society of Dermatology. 7 (9), 750-757 (2009).
- Lopez-Ojeda, W., Pandey, A., Alhajj, M., Oakley, A. M. Anatomy, Skin (Integument). StatPearls. , (2022).
- Bukowiecki, A., Hos, D., Cursiefen, C., Eming, S. A. Wound-healing studies in cornea and skin: parallels, differences and opportunities. International Journal of Molecular Sciences. 18 (6), 1257 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hynes, R. O. The evolution of metazoan extracellular matrix. The Journal of Cell Biology. 196 (6), 671-679 (2012).
- Fidler, A. L., et al. Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. eLife. 6, 24176 (2017).
- Bullen, T. F., et al. Characterization of epithelial cell shedding from human small intestine. Laboratory Investigation; a Journal of Technical Methods and Pathology. 86 (10), 1052-1063 (2006).
- Watson, A. J. M., et al. Epithelial barrier function in vivo is sustained despite gaps in epithelial layers. Gastroenterology. 129 (3), 902-912 (2005).
- Sonnemann, K. J., Bement, W. M. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annual Review of Cell and Developmental Biology. 27, 237-263 (2011).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair. BioArchitecture. 1 (3), 114-121 (2011).
- Fenteany, G., Janmey, P. A., Stossel, T. P. Signaling pathways and cell mechanics involved in wound closure by epithelial cell sheets. Current Biology. 10 (14), 831-838 (2000).
- Pastar, I., et al. Epithelialization in wound healing: a comprehensive review. Advances in Wound Care. 3 (7), 445-464 (2014).
- Rousselle, P., Braye, F., Dayan, G. Re-epithelialization of adult skin wounds: Cellular mechanisms and therapeutic strategies. Advanced Drug Delivery Reviews. 146, 344-365 (2019).
- Bement, W. M., Forscher, P., Mooseker, M. S. A novel cytoskeletal structure involved in purse string wound closure and cell polarity maintenance. The Journal of Cell Biology. 121 (3), 565-578 (1993).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective Cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Li, L., He, Y., Zhao, M., Jiang, J. Collective cell migration: Implications for wound healing and cancer invasion. Burns & Trauma. 1 (1), 21-26 (2015).
- Bornes, L., Windoffer, R., Leube, R. E., Morgner, J., van Rheenen, J. Scratch-induced partial skin wounds re-epithelialize by sheets of independently migrating keratinocytes. Life Science Alliance. 4 (1), 202000765 (2021).
- Theveneau, E., Mayor, R. Collective cell migration of epithelial and mesenchymal cells. Cellular and Molecular Life Sciences. 70 (19), 3481-3492 (2013).
- Haensel, D., Dai, X. Epithelial-to-mesenchymal transition in cutaneous wound healing: where we are and where we are heading. Developmental Dynamics. 247 (3), 473-480 (2018).
- Cordeiro, J. V., Jacinto, A. The role of transcription-independent damage signals in the initiation of epithelial wound healing. Nature Reviews. Molecular Cell Biology. 14 (4), 249-262 (2013).
- Abreu-Blanco, M. T., Watts, J. J., Verboon, J. M., Parkhurst, S. M. Cytoskeleton responses in wound repair. Cellular and Molecular Life Sciences. 69 (15), 2469-2483 (2012).
- Klarlund, J. K., Block, E. R. Free edges in epithelia as cues for motility. Cell Adhesion & Migration. 5 (2), 106-110 (2011).
- Enyedi, B., Niethammer, P. Mechanisms of epithelial wound detection. Trends in Cell Biology. 25 (7), 398-407 (2015).
- Niethammer, P. The early wound signals. Current Opinion in Genetics & Development. 40, 17-22 (2016).
- Jacinto, A., Martinez-Arias, A., Martin, P. Mechanisms of epithelial fusion and repair. Nature Cell Biology. 3 (5), 117-123 (2001).
- Mayor, R., Etienne-Manneville, S. The front and rear of collective cell migration. Nature reviews. Molecular Cell Biology. 17 (2), 97-109 (2016).
- Gupta, S., Yap, A. S. How adherens junctions move cells during collective migration. Faculty Reviews. 10, 56 (2021).
- Blair, M. J., Jones, J. D., Woessner, A. E., Quinn, K. P. Skin structure-function relationships and the wound healing response to intrinsic aging. Advances in Wound Care. 9 (3), 127-143 (2020).
- Falanga, V., et al. Chronic wounds. Nature Reviews. Disease Primers. 8 (1), 50 (2022).
- Liang, C. -. C., Park, A. Y., Guan, J. -. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Jonkman, J. E. N., et al. An introduction to the wound healing assay using live-cell microscopy. Cell Adhesion & Migration. 8 (5), 440-451 (2014).
- Poujade, M., et al. Collective migration of an epithelial monolayer in response to a model wound. Proceedings of the National Academy of Sciences. 104 (41), 15988-15993 (2007).
- Masson-Meyers, D. S., et al. Experimental models and methods for cutaneous wound healing assessment. International Journal of Experimental Pathology. 101 (1-2), 21-37 (2020).
- Park, S., et al. Tissue-scale coordination of cellular behaviour promotes epidermal wound repair in live mice. Nature Cell Biology. 19 (2), 155-163 (2017).
- Tsai, C. -. R., Wang, Y., Galko, M. J. Crawling wounded: molecular genetic insights into wound healing from Drosophila larvae. The International Journal of Developmental Biology. 62 (6-7-8), 479-489 (2018).
- Richardson, R., et al. Adult zebrafish as a model system for cutaneous wound-healing research. The Journal of Investigative Dermatology. 133 (6), 1655-1665 (2013).
- Erickson, J. R., Echeverri, K. Learning from regeneration research organisms: The circuitous road to scar free wound healing. Developmental Biology. 433 (2), 144-154 (2018).
- Kamran, Z., et al. In vivo imaging of epithelial wound healing in the cnidarian Clytia hemisphaerica demonstrates early evolution of purse string and cell crawling closure mechanisms. BMC Developmental Biology. 17 (1), 17 (2017).
- Chari, T., et al. Whole-animal multiplexed single-cell RNA-seq reveals transcriptional shifts across Clytia medusa cell types. Science Advances. 7 (48), (2021).
- Weissbourd, B., et al. A genetically tractable jellyfish model for systems and evolutionary neuroscience. Cell. 184 (24), 5854-5868 (2021).
- Momose, T., et al. High doses of CRISPR/Cas9 ribonucleoprotein efficiently induce gene knockout with low mosaicism in the hydrozoan Clytia hemisphaerica through microhomology-mediated deletion. Scientific Reports. 8 (1), 11734 (2018).
- Houliston, E., Leclère, L., Munro, C., Copley, R. R., Momose, T. Past, present and future of Clytia hemisphaerica as a laboratory jellyfish. Current Topics in Developmental Biology. 147, 121-151 (2022).
- Schmid, V., et al. The extracellular matrix (mesoglea) of hydrozoan jellyfish and its ability to support cell adhesion and spreading. Hydrobiologia. 216 (1), 3-10 (1991).
- Day, R. M., Lenhoff, H. M. Hydra mesoglea: a model for investigating epithelial cell-basement membrane interactions. Science. 211 (4479), 291-294 (1981).
- Zhang, X., et al. The collagens of hydra provide insight into the evolution of metazoan extracellular matrices. The Journal of Biological Chemistry. 282 (9), 6792-6802 (2007).
- Danjo, Y., Gipson, I. K. Actin 'purse string' filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111 (22), 3323-3332 (1998).
- Arenas Gómez, C. M., Sabin, K. Z., Echeverri, K. Wound healing across the animal kingdom: Crosstalk between the immune system and the extracellular matrix. Developmental Dynamics. 249 (7), 834-846 (2020).
- Lechable, M., et al. An improved whole life cycle culture protocol for the hydrozoan genetic model Clytia hemisphaerica. Biology Open. 9 (11), (2020).
- Casares, L., et al. Hydraulic fracture during epithelial stretching. Nature Materials. 14 (3), 343-351 (2015).
- Wayne, R. Chapter 4 - Bright-Field Microscopy. Light and Video Microscopy (Third Edition). , 95-116 (2019).
- Murphy, D. B., Davidson, M. W. . Fundamentals of Light Microscopy and Electronic Imaging: Second Edition. , (2012).
- . Micropipette Techniques for Electrophysiology Available from: https://www.sutter.com/micropipette/cookbook.html (2022)
- Brown, A. L., Johnson, B. E., Goodman, M. B. Making patch-pipettes and sharp electrodes with a programmable puller). Journal of Visualized Experiments. (20), e939 (2008).
- Klarlund, J. K. Dual modes of motility at the leading edge of migrating epithelial cell sheets. Proceedings of the National Academy of Sciences. 109 (39), 15799-15804 (2012).
- Houliston, E., Momose, T., Manuel, M. Clytia hemisphaerica: a jellyfish cousin joins the laboratory. Trends in Genetics. 26 (4), 159-167 (2010).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: a cellular perspective. Physiological Reviews. 99 (1), 665-706 (2019).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved