EpCAM和细胞角蛋白在正常人和小鼠血液和骨髓中表达上皮细胞的证据
In This Article
Summary
本文提出了一种可重复的方法,使用流式细胞术和免疫荧光显微镜对正常人和小鼠血液和骨髓中上皮细胞的存在有了新的发现。Krt1-14;mTmG转基因小鼠用作 体内 方法以证实这些发现。
Abstract
已在癌症和其他疾病患者的血液和骨髓中鉴定出上皮细胞。然而,健康个体的血液和骨髓中正常上皮细胞的存在尚未以一致的方式确定。这里介绍的是一种使用流式细胞术和免疫荧光(IF)显微镜从健康人和鼠血液和骨髓(BM)中分离上皮细胞的可重复方法。首先使用上皮细胞粘附分子(EpCAM)通过流式细胞术 鉴定 和分离健康个体的上皮细胞。这些EpCAM+细胞使用免疫荧光显微镜证实在Krt1-14;mTmG转基因小鼠中表达角蛋白。人类血液样本±0.0004个EpCAM+细胞中有0.18%(SEM;n = 7个生物学重复,4个实验重复)。在人BM中,3.53%±0.006(SEM;n = 3个生物学重复,4个实验重复)的单核细胞为EpCAM+。在小鼠血液中,EpCAM+细胞占0.45%±0.0006(SEM;n = 2个生物学重复,4个实验重复),在小鼠BM中,EpCAM+占5.17%±0.001(SEM;n = 3个生物学重复,4个实验重复)。在小鼠中,所有EpCAM+细胞对全细胞角蛋白具有免疫反应,如IF显微镜确定的那样。使用Krt1-14;mTmG转基因小鼠证实结果,低(每分析10 6个细胞8.6 个天然GFP +细胞;0.085%的活细胞),但正常鼠BM中存在的GFP+细胞数量显着(p <0.0005),与多个阴性对照相比,这不是随机性的结果。此外,小鼠血液中的EpCAM+细胞比CD45 +细胞更具异质性(BM为0.58%;血液中为0.13%)。这些观察结果得出结论,表达细胞角蛋白的细胞在来自人和鼠血液和BM的单核细胞中可重复检测到。我们展示了一种组织采集,流式细胞术和免疫染色的方法,可用于鉴定和确定健康个体中这些全细胞角蛋白上皮细胞的功能。
Introduction
上皮细胞存在于我们身体和环境之间的物理屏障中,能够识别并响应其微环境的变化1。它们具有增殖的干细胞生态位,提供了一种翻转新组织和修复损伤的方法2。我们的实验室研究皮肤毛囊中的干细胞;皮肤是研究上皮组织和干细胞增殖的良好模型,因为它很容易看到并且细胞不断更新。上皮癌是最常见的癌症形式,可能是由于皮肤等上皮组织是抵御环境致癌物的第一道防线,导致高更新率和上皮细胞增殖3。大多数皮肤表皮,即顶层保护层,由角质形成细胞组成,角质形成细胞表达不同类型的角蛋白以提供支持和结构4。上皮癌患者通常在其血液和骨髓中存在上皮细胞,这些细胞也表达角蛋白。液体活检是一种检测和监测不同体液中这些上皮细胞的非侵入性方法5。循环上皮细胞,也称为循环肿瘤细胞(CTC),存在于外周血中,可以作为癌症预后的生物标志物,并指导个体化治疗。CTC还可以指示疾病进展,治疗效果和患者总生存率5,6。
上皮细胞粘附分子(EpCAM)是CTC的临床标志物,可以识别癌症患者的上皮起源肿瘤。EpCAM在细胞粘附,迁移,信号传导,增殖和分化中发挥作用6。对于被归类为 CTC 的循环上皮细胞,其细胞角蛋白 8、18 和 19 必须呈阳性,CD45(一种常见的白细胞标志物6)必须呈阴性。CTC 通常通过首先用磁性微珠去除 CD45,然后使用免疫荧光显微镜7 检测 EpCAM 和细胞角蛋白 19 来识别。检测CTC的主要限制是其罕见性;它们占血液中所有细胞的不到0.01%,很少有细胞在循环中存活到遥远的器官8,9,10。在设计实验和技术时必须考虑分离和鉴定这些细胞,因为它们的稀有性质。目前,只有一种美国食品和药物管理局(FDA)批准的自动单细胞分选机用于鉴定CTC,它使用EpCAM作为其生物标志物。其他方法包括磁珠分离和流式细胞术,或这些方法的组合。需要具有更高灵敏度和特异性的新技术来检测罕见的CTC11。
流式细胞术是检测血液、骨髓和其他组织样本中稀有细胞群的首选方法。这些稀有细胞可以包括干细胞、循环内皮细胞、CTC 和残留疾病细胞。流式细胞术可以定量测量每种细胞类型,并对这些细胞进行分类以进行进一步测试7,9。进行增量计数以确保对这些稀有细胞的准确评估。使用门控将细胞排除在进一步分析之外的能力是在分析细胞时提高特异性的一种方法。流式细胞术的局限性在于分析大样品所需的时间以及缺乏细胞身份的视觉确认。为了克服这个问题,对分选的细胞进行了免疫荧光显微镜检查以确认其身份。
以前,我们的实验室已经表明,在小鼠中,骨髓细胞被招募并导致皮肤肿瘤12。这些骨髓来源的细胞对全细胞角蛋白和表皮细胞角蛋白呈阳性。为了进一步阐明上皮干细胞、骨髓来源细胞和表达细胞角蛋白的细胞在肿瘤进展中的作用,在正常小鼠和人类血液和骨髓样本中寻找EpCAM+细胞角蛋白阳性细胞。与大多数实验一样,这种方法是通过多次迭代开发的。以前,转基因小鼠与增量计数一起用于在骨髓12中寻找表达K14GFP的细胞。随着更多的细胞计数,能够鉴定出具有代表性的稀有细胞群,如代表性结果部分中的 图1 所示。研究正常血液和骨髓中上皮细胞的基本原理是基于关于CTCs的早期文献,其中正常健康供体具有EpCAM+细胞的背景水平13。如前所述,EpCAM表征通常从CD45的耗竭开始。这一步被省略了,因为一些造血细胞具有EpCAM和细胞角蛋白表达,原因不明,需要进一步研究。因此,根据EpCAM的存在与否对细胞进行分选,而不考虑细胞谱系,然后对细胞角蛋白进行免疫染色。下面的方案和 图2 所示的工作流程描述了一种使用流式细胞术与补偿和对照、统计方法和免疫荧光成像来分离和鉴定这些罕见的上皮细胞群的技术。
Protocol
所有动物方案均由明尼苏达大学机构动物护理和使用委员会根据NIH和联邦指南批准。新鲜的人类血液和骨髓是从商业来源购买的。该公司根据批准的IRB协议从艾滋病毒,乙型肝炎,丙型肝炎阴性的捐赠者那里收集了样本,并进行了COVID-19筛查。所有样品在由公司发货之前首先进行了去识别化和匿名化处理。由于这些是商业获得的,因此不需要IRB批准。
1. 溶液的制备
注意:所有溶液必须在无菌环境中的生物罩中制备。获得生物安全2级(BSL2)认证,用于人体血液和骨髓的工作。
- 通过将 1 mL 庆大霉素和 5 mL 胎牛血清 (FBS) 加入 500 mL 汉克平衡盐溶液 (HBSS) 中来制备骨髓收获溶液。
- 通过将 50 mL FBS 加入 500 mL HBSS 来制备染色缓冲液。
- 通过将 10 mL 的 10x 裂解缓冲液与 90 mL 无菌水混合来制备 1x 裂解缓冲液。
2. 准备引擎盖
- 打开引擎盖,让它运行几分钟以获得适当的气流。
- 收集所有材料以进行骨髓收获。用70%乙醇将它们喷洒在引擎盖内以保持无菌环境。每次在将双手放入引擎盖之前喷洒双手。
- 将高压灭菌的托盘与高压灭菌的剪刀、组装好的手术刀、镊子和弯曲的镊子一起放入装有 70% 乙醇的小杯中,以保持无菌。
- 将 10 mL 骨髓收获溶液添加到一个 50 mL 离心管中,并将其标记为“四肢”。将另一个 50 mL 离心管标记为“骨髓”。
- 将 10 mL 骨髓收获溶液吸入注射器中,然后连接 26 G 针头。
3. 从小鼠身上采集骨髓
- 使用CO2 窒息对小鼠实施安乐死。死亡是通过没有心跳和捏脚以确保没有反应来确认的。颈椎脱位可作为完全安乐死的次要手段。
- 将鼠标放入 500 mL 容器中,并添加足够的碘以覆盖小鼠的一半。轻轻摇晃并旋转容器以确保彻底覆盖。用去离子水冲洗。再进行一次碘洗涤,然后按照相同的步骤用70%乙醇洗涤两次。
- 将鼠标放在引擎盖中,然后将其背放在托盘上。抓住后腿并将它们拉开,直到感觉到爆裂声;这是将腿与脊柱分开。
- 在靠近腹股沟区域的小鼠皮肤上做一个 1 厘米的切口。将一把闭合的剪刀插入切口,然后在皮肤下打开剪刀,将其与腹膜分开。
- 在大腿周围切割腿上的皮肤,然后将腿部的皮肤切下来,露出肌肉和骨骼。
- 通过切开髋关节来移除后腿,确保不要切开股骨。将四肢放入标有“四肢”的管中 当两条腿被移除时,将鼠标放入胴体袋中并将其放入冰箱。
注意:切割前应先感觉到髋骨以引导剪刀并避免切割股骨,因为大部分骨髓是从股骨获得的。 - 开始用剪刀沿着其中一条肢体切割肌肉、组织和脂肪。平行于骨骼切割。然后,使用手术刀去除剩余的脂肪或肌肉,使用垂直刮骨的运动。
- 正确清洁骨头后,将膝盖处的股骨和胫骨分开。使用手术刀在没有可见骨髓的股骨和胫骨两端切口。
- 将准备好的注射器和针头插入骨头。如果有阻力,从骨头末端再切一点,直到没有更多的阻力。
- 将骨头放在标有“骨髓”的管子上方时,通过骨排出骨髓采集溶液,将骨髓冲洗到管中。在骨头的另一端重复以获得骨髓的其余部分,直到骨头看起来全白或空。
- 对所有剩余的骨骼和四肢重复步骤 7-9;所有骨髓将被冲洗到同一个锥形管中。
- 使用空的 10 mL 注射器和 20 G 针头,通过在注射器中上下抽取骨髓 5-10 次来分解管中的骨髓团块。
- 将无菌 40 μm 过滤器添加到干净的 50 mL 离心管中,并用 1 mL 骨髓收获溶液冲洗。然后,过滤骨髓以去除任何剩余的团块。将此管标记为“过滤骨髓”。
- 将过滤后的骨髓存放在冰箱或冰上直至使用。应在收获当天使用。如果不在同一天使用,请使用冷冻防腐剂冷冻细胞,例如二甲基亚砜(DMSO)。
注意:这些实验中的所有废物都应妥善处理在生物危害废物容器中。所有锐器都应放入正确标记的生物危害锐器容器中。
4.骨髓红细胞溶解
- 在室温下以170× g 离心骨髓细胞10分钟。抽真空并处理上清液。将细胞重悬于10mL的1x红细胞裂解缓冲液中,孵育4分钟。
- 加入 30 mL Dulbecco 磷酸盐缓冲盐水 (DPBS) 以停止裂解缓冲液的反应。在室温下以170× g 离心细胞8分钟。抽真空并处理上清液。重悬于10-20 mL染色缓冲液中。
5. 细胞计数
- 将500μl细胞与9.5mL骨髓收获溶液混合以获得1:20稀释度。
注意:这将用于细胞计数,不需要保持无菌。 - 从 1:20 稀释液中抽出 200 μL 细胞,将它们加入 200 μL 台盼蓝中,并充分混合。
- 将混合物加入血细胞计数器中,并计数两侧的活细胞和死细胞。使用以下表( 如补充文件1所示)和公式计算原始细胞悬液:
每毫升细胞数: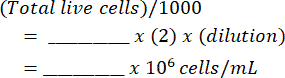
细胞总数: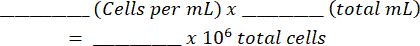
- 根据制造商的抗体稀释建议,在 4 °C 下以 170 x g 旋转细胞 10 分钟,然后重悬至每 1 mL 10 x 10 6 个细胞(每 100 μL 1x 106 个细胞)的浓度。
- 继续进行流式细胞术(步骤8)。
6. 从小鼠身上采集血液
- 使用CO2 气体或颈椎脱位对小鼠实施安乐死。
- 使用将 26 G 针头连接到涂有 0.5 M 乙二胺四乙酸 (EDTA) 的 1 mL 注射器上,以 45° 角进行心脏抽血。
- 旋转血液并重悬于培养基或染色缓冲液中。
注意:在红细胞裂解和细胞计数后,细胞将被旋转并重悬至染色缓冲液中的最终浓度。 - 进行红细胞裂解(步骤4)。
- 进行细胞计数(步骤5)。
- 继续进行流式细胞术(步骤8)。
7. 处理人体血液和骨髓样本
- 在佩戴个人防护设备的同时,在BSL2认证的头罩下执行所有程序。
- 收集前一天晚上的样本并进行红细胞裂解。确保样本在冰上过夜运送单核样本之前进行去识别化和匿名化处理。
- 到达后,在4°C下以170× g 旋转活细胞10分钟。
注意:这些是BSL2样品,必须遵循当地准则。 - 将细胞重悬于培养基或染色缓冲液中。
注意:用染色缓冲液进行细胞计数后,应将细胞旋转并重悬至最终浓度。 - 进行细胞计数(步骤5)。
- 继续进行流式细胞术(步骤8)。
8. 流式细胞术
- 染色
- 根据所使用的染色面板将细胞分成单独标记的管中,包括补偿对照(未染色、同种型对照、单染色和荧光减去 [FMO])。冷冻任何剩余的细胞或将其用于荧光激活细胞分选。有关所用抗体稀释液的染色组合示例,请参见 表1 。
注意:对于每添加一个额外的荧光基团,必须添加与剩余荧光团组合的FMO以及该荧光团的单一染色剂。同种型对照可用于阻断非特异性染色。每种使用的新抗体应用样品滴定以获得最佳稀释度。 - 根据制造商推荐的稀释度添加抗体,并通过轻弹试管底部充分混合。抗体浓度通常为每100μL1 x 106 个细胞,抗体和对照品稀释液如 表1所示。抗体与荧光团偶联,必须避光。
注意:最好使用与藻红蛋白(PE)偶联的EpCAM,以可视化低细胞群(滴定为每100万个细胞3-5μL,如 表1所示)。PE-CD49f用作单染色PE对照(每100万个细胞20μL),因为这些细胞比PE-EpCAM更普遍,因此更容易用于补偿。 - 在黑暗中在4°C孵育30分钟。
- 孵育后,将试管带回BSL2罩中,并向每个试管中加入1 mL染色缓冲液。
- 然后,将试管在4°C下以170× g 离心5-10分钟。
- 离心后,将带盖的管和细胞带回BSL2罩并吸出上清液。确保在每个试管之间更换吸液管的吸液管尖端,以防止交叉污染。
- 将细胞沉淀重悬于 1 mL 染色缓冲液中,轻弹试管底部进行混合。
- 通过重复步骤8.1.4-8.1.7再洗涤细胞两次。
注意:请勿使用移液器重悬,以免丢失细胞。 - 在流式细胞术前重悬于500 μL染色缓冲液中以进行最终重悬。根据制造商的建议添加 4′,6-二脒基-2-苯基吲哚 (DAPI) 或死细胞鉴别器。
- 根据所使用的染色面板将细胞分成单独标记的管中,包括补偿对照(未染色、同种型对照、单染色和荧光减去 [FMO])。冷冻任何剩余的细胞或将其用于荧光激活细胞分选。有关所用抗体稀释液的染色组合示例,请参见 表1 。
- 流式细胞仪
- 设置机器后,使用控件和FMO设置补偿和门。使用Hank的平衡盐溶液(HBSS)作为鞘液,以帮助支持脆弱的细胞。如果 HBSS 不可用,请使用 PBS。
注意:使用的流式细胞仪和软件列在 材料表中。 - 一次加载一个样本,并收集 50,000、100,000、500,000 和 100 万个事件的数据点。将试管放在冰上或冷藏直至使用。
注意:收集时可以设置时间限制,以确保样品活力。 - 将细胞收集到 15 mL 离心管中含有 10% FBS 的 3 mL RPMI 中。
- 如果对 EpCAM+ 细胞进行免疫荧光,请使用流式细胞仪将 800 至 1,000 个细胞分选到 8 孔载玻片的每个孔中。
- 将EpCAM-细胞群分选到单独的载玻片上,作为阴性对照,用于染色免疫荧光。
注意:细胞也可以分选到含有FBS的15 mL管中,并使用细胞离心机或移液管旋转到载玻片上,以防止细胞爆裂。 - 将载玻片固定在-20°C的50%甲醇/ 50%丙酮混合物中10分钟。将载玻片储存在-20°C直至用免疫荧光染色。
- 设置机器后,使用控件和FMO设置补偿和门。使用Hank的平衡盐溶液(HBSS)作为鞘液,以帮助支持脆弱的细胞。如果 HBSS 不可用,请使用 PBS。
- 流式细胞术分析
- 打开许可的流式细胞术分析软件。
- 从流式细胞仪采集的带有对照和样品的负荷流式细胞术标准品(FCS)文件。
- 单击“ 创建组 ”并使用关键字将示例和控件放入组中。
注意:使用“无染色”对照在流式细胞术分析软件中进行门控,如图 3所示。 - 双击 无污渍对照 样品以打开未染色的图表。
- 将图形 y 轴设置为 SSC-A,将 x 轴设置为 FSC-A(侧向散射区域按前向散射区域),指示像元大小和内部复杂性。
- 单击左上面板中的多边形形状,然后在单元格周围创建一个门。确保排除外围的细胞,因为这些细胞很可能是碎片。将此门标记为“细胞”,如图 3A所示。
- 对单元格进行门控后,在多边形形状内双击以在新窗口中打开另一个图形。
- 将新图形的 y 轴设置为 SSC-A,将 x 轴设置为 SSC-W,以进行双峰区分。单击多边形形状并在单个单元格周围创建一个矩形。将此标记为“单细胞”,如图 3B所示。
- 对单元格进行门控后,在多边形形状内双击以在新窗口中打开另一个图形。
- 将 y 轴设置为 FSC-A,将 x 轴设置为 DAPI-A(或使用的任何死细胞鉴别器)。
- 在图形左侧的 DAPI 负像元周围创建一个多边形门。标记这些“活细胞”,如图 3C所示。
- 对单元格进行门控后,在多边形形状内双击以在新窗口中打开另一个图形。
- 将y轴设置为SSC-A,将x轴设置为EpCAM-PE(或任何用于识别EpCAM细胞的荧光团)。左边的细胞是EpCAM阴性。如果右侧显示任何细胞,则它们是EpCAM阳性。
- 使用 EpCAM-PE 图形创建一个多边形门,该门不包括左侧的单元格,仅包含右侧的空白区域。将多边形内右侧的空白区域标记为“EpCAM”,如图 3D 所示。
注意:这是无污渍控制,因此不应有 EpCAM 表达式。使用无染色对照确定哪些细胞为 EpCAM 阳性。这样就完成了补偿的门控策略,因此此时所有图形都可能关闭。 - 在工作区页面上,突出显示带有“细胞”、“单细胞”、“活细胞”和“EpCAM”的无染色谱系。右键单击并选择 将分析复制到分组。这会将设门策略复制到先前创建的组中所有其他加载的样本。如果最初未创建组,则可以通过选择左上角的“创建组”立即 创建组 。
- 浏览组中的示例并检查之前绘制的多边形门,以确保它们适合所有示例和控件。这将提供百分比数和单元格数。
- 单击“工作区”上方左上角的布局编辑器按钮 L 。然后可以使用布局编辑器排列和导出这些图形。
- 免疫荧光试剂的制备
- 通过混合 1 g 牛血清白蛋白 (BSA)、2 g 脱脂牛奶、10 mL 10x 三缓冲盐水 (TBS)、100 μL 吐温和 90 mL 蒸馏水制备抗体稀释剂。
- 通过混合 50 mL 的 20x TBS、950 mL 蒸馏水和 200 μL 吐温来制备 TBST。
- 通过将 1 mL NHS 与 9 mL 抗体稀释剂混合来制备 10% 正常马血清 (NHS)(步骤 8.4.1)。
- 通过将 1 mL 10% NHS 与 9 mL TBST 混合来制备 1% NHS。
- 免疫荧光染色
- 从-20°C取出载玻片,并让它们升温至室温。
- 在蒸馏水中洗涤载玻片三次,每次5分钟。
- 在室温下在抗体稀释剂中的10%NHS中封闭载玻片1小时(步骤8.4.3)。
- 在TBST中将一抗(全细胞角蛋白)在1%NHS中稀释至1:750(步骤8.4.4)。将载玻片在稀释的一抗中在4°C孵育过夜。
- 第二天,用1x洗涤缓冲液(PBS或TBST)洗涤载玻片三次,每次5分钟。
- 在TBST中将二抗在1%NHS中稀释至1:1,000(步骤8.4.4)。将载玻片在稀释的二抗中在室温下孵育1小时。
- 用1x洗涤缓冲液洗涤载玻片三次,每次5分钟。使用带有DAPI的硬性安装介质安装和盖玻片。使用棉签轻轻地滚出盖玻片下的任何气泡。
Representative Results
使用这些方法,可视化正常人和小鼠的血液和骨髓中罕见的上皮细胞群。通过如上所述的适当补偿和对照,无论计数多少细胞,小鼠骨髓中4%-5%的细胞的结果一致为EpCAM+,如图4和图5所示。在小鼠血液样本中,不到0.5%的细胞是EpCAM+,如图6所示。在人骨髓样本中,2%-5%的细胞是EpCAM+,如图7和图8所示。虽然2%-5%是一个很大的范围,但随着计数的增加,每个供体中的百分比是一致的。在人类血液样本中,大约0.3%的细胞是EpCAM+,如图9所示。我们的对照样品(无染色、同种型对照和FMO)产生的EpCAM+假阳性结果很少,如图4和图7所示。将来自EpCAM+和EpCAM-组的细胞分选到载玻片上,在EpCAM+样品中显示全细胞角蛋白染色呈阳性,在EpCAM-样品中显示全细胞角蛋白染色呈阴性,如图10所示。这些结果表明,实验设计得当且可重复。
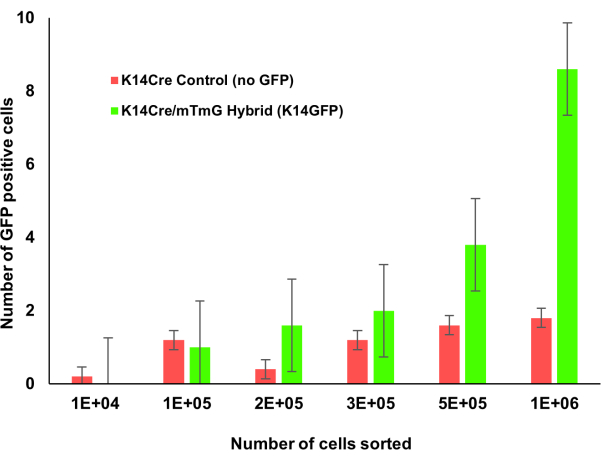
图1:具有骨髓增量计数的Krt14Cre;mTmG转基因小鼠。 Krt1-14;mTmG小鼠骨髓增量计数。GFP阳性细胞表明角蛋白14表达,并使用流式细胞术进行鉴定。随着更多的骨髓细胞被计数,这个角蛋白14阳性细胞群更容易识别。 请点击此处查看此图的大图。

图 2:EpCAM+ 和细胞角蛋白 + 细胞的工作流程。 首先使用荧光激活细胞分选(FACS)对骨髓和血细胞进行分选,以分离EpCAM+和EpCAM-细胞。这些细胞被分选到两个不同的试管中,以及两个不同的载玻片上。使用细胞离心机将分选到试管中的细胞旋转到载玻片上。然后使用泛细胞角蛋白一抗对载玻片进行染色,然后用二抗染色。使用荧光显微镜分析载玻片以观察全细胞角蛋白的表达。 请点击此处查看此图的大图。
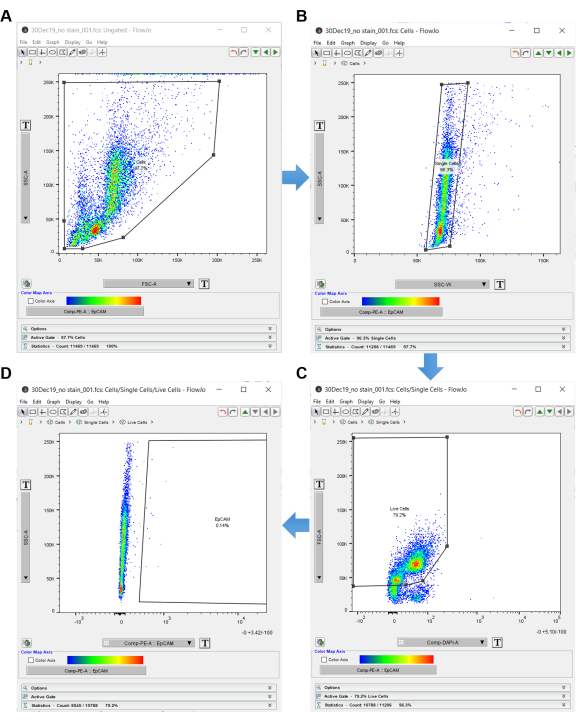
图 3:流式细胞术分析软件。 使用分析软件分析流式细胞术数据时,使用无染色对照来选择感兴趣的细胞。首先用SSC-A和FSC-A选择细胞,它们显示了细胞的内部复杂性和大小。(A)在单元格周围绘制多边形门。(B)通过SSC-W门控SSC-A获得单细胞。(C)活细胞是通过门控FSC-A与DAPI获得的。(D)通过EpCAM阴性细胞右侧的门控排除EpCAM阴性细胞。 请点击此处查看此图的大图。
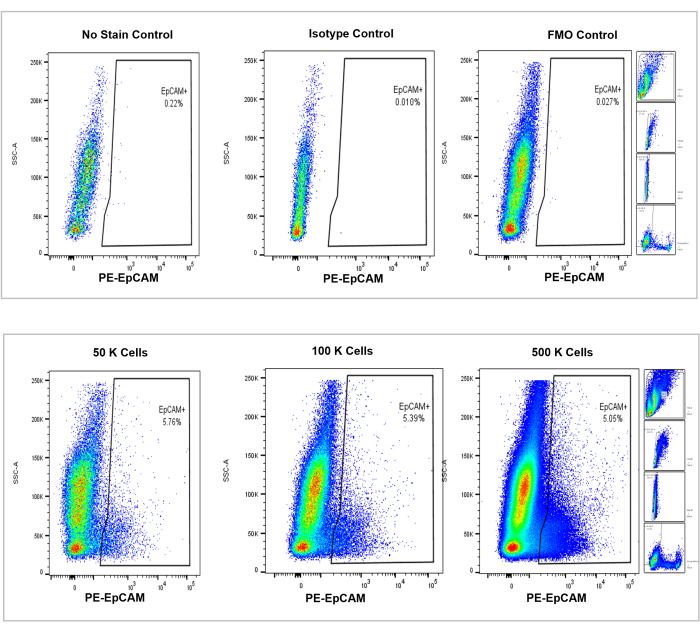
图 4:小鼠骨髓中 EpCAM+ 细胞的流式细胞术分析。 无染色、同种型和 FMO 的对照显示在顶部面板中,底部面板显示了 50,000、100,000 和 500,000 个细胞的增量计数。这些图表可视化了计数百分比的一致性,尽管计数的总单元格总体上有所增加。右侧的图框显示了门控策略,如前面的流式细胞术分析部分所述,如图 3所示。 请点击此处查看此图的大图。
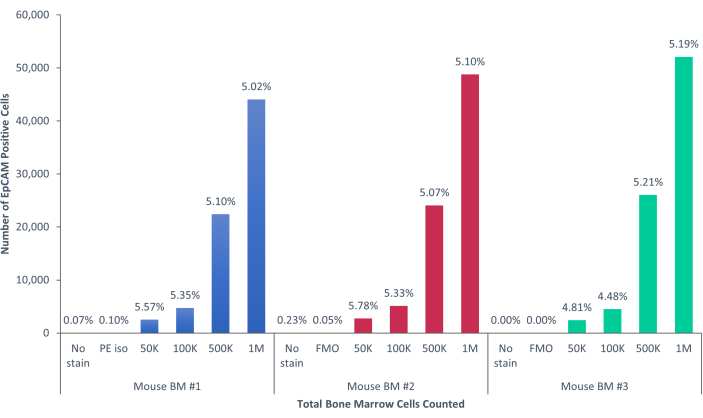
图 5:小鼠骨髓中的 EpCAM+ 细胞占群体的 5.17% ± 0.001%。 分析了三只小鼠的骨髓细胞。为了适当的科学严谨性,包括适当的控制。由于小鼠在遗传上相同,阳性细胞的百分比在样本中保持一致。请点击此处查看此图的大图。
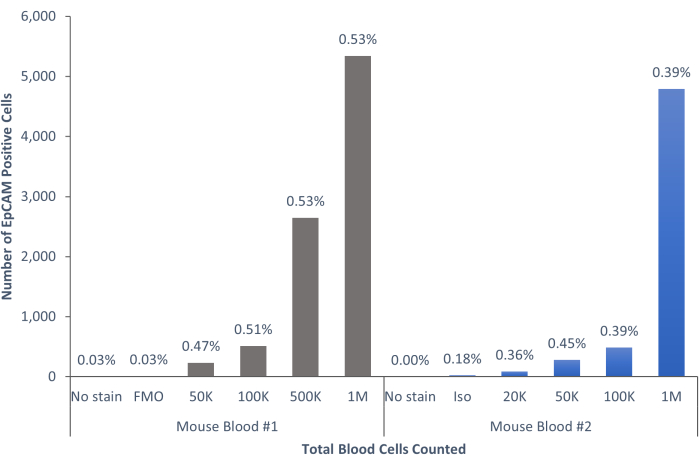
图6:小鼠血液中的EpCAM+细胞占群体的0.45%±0.0006%。 分析两只小鼠的血细胞。包括对照以表明遵循了正确的程序以产生结论性结果。 请点击此处查看此图的大图。
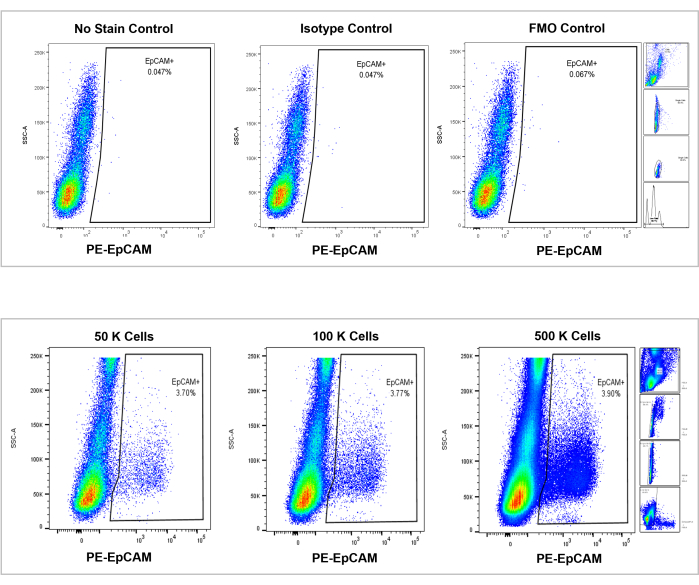
图 7:EpCAM+ 人骨髓的流式细胞术分析。 无染色、同种型和FMO的对照显示在顶部面板中,50,000、100,000和500,000个细胞的增量计数显示在底部面板中。这些图表可视化了计数百分比的一致性,尽管计数的总单元格总体增加。右侧的图框显示了门控策略,如前面的流式细胞术分析部分所述,如图 3所示。 请点击此处查看此图的大图。

图8:人骨髓中的EpCAM+细胞占人口的3.53%±0.006%。 分析了三种不同的人骨髓样本。包括对科学严谨性的适当控制。阳性细胞的百分比由于人类之间的遗传异质性而变化。 请点击此处查看此图的大图。
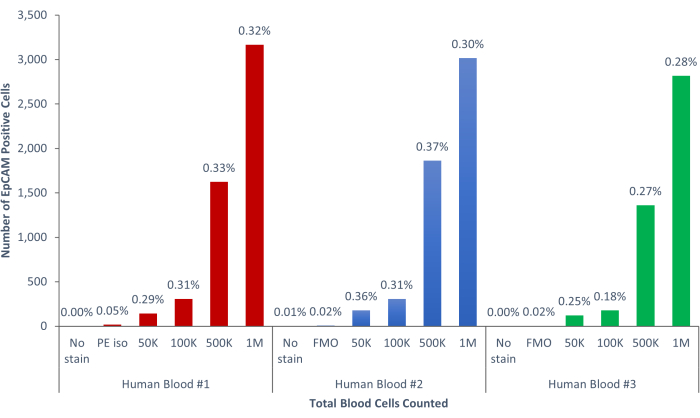
图9:人类血液中的EpCAM+细胞占人口的0.18%±0.0004%。 分析了三种不同的人类血液样本。包括对科学严谨性的适当控制。 请点击此处查看此图的大图。
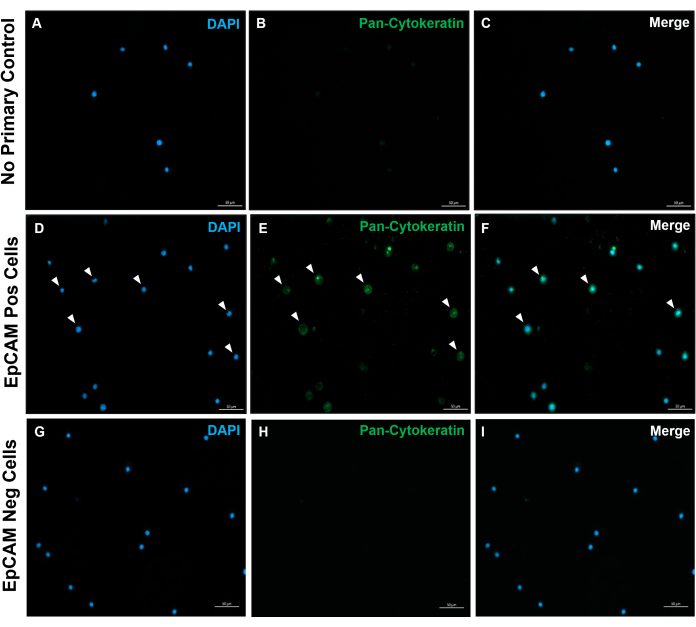
图10:EpCAM+和EpCAM载玻片的免疫荧光。 FACS用于分离EpCAM+和EpCAM-细胞。使用DAKO全细胞角蛋白抗体对泛细胞角蛋白进行染色。未在正常血清中使用一抗对照,因为全细胞角蛋白是一种多克隆抗体。这些结果证实了FACS的准确性。 请点击此处查看此图的大图。
| 人体骨髓或血液 | |||
| 抗体 | 管# | # 个单元格 | AB Conc |
| 未染色 | 1 | 1x106 | X |
| 仅限 DAPI | 2 | 1x106 | 1uL/mL |
| PE 同种型对照 | 3 | 1x106 | 1 uL |
| CD49f-PE 单染色控制 | 4 | 1x106 | 20 uL in 100uL 每 1x106 |
| EpCAM-PE 低滴定 | 5 | 1x106 | 每 1x10 6 中 3 uL 100uL |
| EpCAM-PE 培养基滴定 | 6 | 1x106 | 每 1x10 6 中的 100uL 中为 4 uL |
| EpCAM-PE 高滴定 | 7 | 1x106 | 5 uL in 100uL 每 1x106 |
| 幻灯片上的 EpCAM-PE 高排序 | 8 | 10x106 | 50 uL 1 mL |
表1:流式细胞术染色面板。 用于血液或骨髓单核细胞的流式细胞术染色组合示例。包括的对照包括仅DAPI,未染色对照和PE单染色对照(PE-CD49f用作更好的阳性对照)。荧光减一不包括在此面板中,因为它只是一种颜色(PE)。添加更多荧光基团颜色时,例如异硫氰酸荧光素 (FITC) 或别藻蓝蛋白 (APC),应通过为每个 FMO 对照排除一个荧光团来包括 FMO。
补充文件1:使用血细胞计数器进行活细胞计数。 请点击此处下载此文件。
Discussion
文献中有一些证据表明骨髓中存在上皮细胞。以前,论文通常研究上皮细胞在疾病和损伤中的作用,例如在肝脏,肺,胃肠道(GI)中,胸腺和皮肤14,15,16,17。然而,关于健康个体骨髓中这些上皮细胞的存在知之甚少。本文旨在建立一种可重复的方法,目的是从正常血液和骨髓中鉴定和分离上皮细胞。这种方法将推动该领域向前发展,以确定为什么存在上皮细胞以及在没有疾病的情况下它们在血液和骨髓中的作用;也许这些细胞是正常组织维护的一部分或在受伤时激活。骨髓是干细胞的储存库;然而,目前尚不清楚这些上皮细胞的谱系可能是什么。最近的一篇论文讨论了胸腺中骨髓来源的上皮细胞,其首先表达EpCAM和造血标志物CD45,然后在损伤15后随着时间的推移失去CD45表达。我们实验室的研究还证实,在没有损伤的情况下,健康血液和骨髓中存在CD45 + EpCAM+细胞12。然而,这些细胞的作用尚未确定。
需要一种可重复的方法来检查健康骨髓内的上皮细胞。所描述的方法将有助于在正常状态下进一步表征这些细胞。这种方法有一些重要的步骤来保持重现性。该方案中最关键的步骤之一是在从小鼠身上采集骨髓的同时,在罩内保持无菌环境。如果从多只小鼠身上收获,则通过为每只小鼠使用新的针头和注射器来避免样品之间的交叉污染。这也确保了样品是干净的,没有任何可能影响结果的污染物。此外,应增加每增加一只小鼠的制备注射器和标记锥形管的数量。另一个重要步骤是冲洗骨骼,直到明显的白色,以确保大部分骨髓细胞已被去除;在更纯的样品中,检测稀有细胞的机会增加。进行了修改以优化红细胞裂解方案;测试了几种裂解缓冲液,以找到具有始终如一高活力的正确缓冲液,因为在此步骤中几乎一半的细胞丢失了。可能需要优化不同的试剂和孵育期,以改善其他环境中的结果。
该协议的最大限制是使用流式细胞术来寻找稀有细胞群。如前所述,添加对照和增量计数有助于提高分析的特异性和准确性。另一个限制是必须事先确定感兴趣的人群的适当标记。因此,需要了解关键标志物、流式细胞术抗体以及与目标物种兼容的抗体。
这些方法是对现有方法的改进,因为它们允许以现有自动CTC分离器和单细胞RNA测序的一小部分成本进行单细胞分析。此外,流式细胞术更容易获得。与先前使用磁性微珠分离的报道结果相比,FACS保持了更高的细胞活力。最后,这些技术允许分离细胞以进行下游分析,例如批量RNA测序,scRNA测序或细胞培养。
Disclosures
没有已知的利益冲突。
Acknowledgements
Josh Monts,荷美尔研究所核心设施流式细胞仪技术员
托德·舒斯特,荷美尔研究所核心设施经理
德里克·戈登,罗格斯大学统计学家
我们要感谢来自新墨西哥州圣达菲Clarus编辑服务的Karen Klein的编辑协助。
这项工作得到了美国国立卫生研究院国家关节炎、肌肉骨骼和皮肤病研究所的部分支持,奖励号为 R21 AR075281,以及明尼苏达大学研究副校长办公室的研究、艺术和奖学金补助金(提案 #324240)。我们非常感谢荷美尔研究所的支持。
Materials
| Name | Company | Catalog Number | Comments |
| 40 μm Cell Strainer | Falcon | 352340 | Used to filter out any large clumps of cells from bone marrow |
| 5 mL Polystyrene Round-bottom tube | Falcon | 352054 | Tubes used for flow cytometry |
| 500 mL jar with lid | Nalgene | 11-823-32 | Used to wash the mouse |
| 190 proof Ethanol | Decon laboratories Inc | 2801 | Diluted to 70% with dH2O |
| Alexa Fluor 488 Goat anti-rabbit IgG (H+L) | Invitrogen | A11008 | Dilution: 1:1000 |
| Brightline Hemacytometer | Hausser Scientific | 02-671-10 | Used to count alive cells |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | Component of antibody diluent |
| Characterized Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | Component of staining buffer and harvesting solution |
| Curity gauze sponges | Covidien | 2187 | Used to keep a clean work area when harvesting limbs and bone marrow |
| Curved Forceps | Miltex | 18-784 | Used during harvest |
| Cytokeratin, Wide Spectrum Screening | Dako | Z0622 | Dilution 1:750 *Now discontinued |
| Dulbecco's Phosphate Buffered Saline (DPBS 1x) | Gibco | 14190-144 500mL | Used to stop the red blood cell lysis reaction |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E9884-100G | Used at 0.5 M |
| Gentamicin sulfate | Lonza | 17-518Z | Component of harvesting solution |
| Hank's Balanced Salt Solution (HBSS 1x) | Gibco | 14175-095 500mL | Component of harvesting solution and staining buffer solution |
| Luer-Lok tip 10 mL syringe | Becton, Dickinson and Co | 309604 | Used with 26G needle to flush bones, used with 20G needle to break up clumps |
| Magic touch 2 ice bucket | BelArt | M16807-2001 | Used to store the specimens on ice |
| Nonfat dry milk | Apex | 20-241 | Component of Antibody Diluent |
| Normal horse serum | Vector | ZE0122 | Component of Antibody Diluent |
| PE anti-human CD 326 (EpCAM) | Biolegend | 324206 | Dilution: 5 µl in 100 µl per 1x106 cells |
| PE anti-mouse CD 326 (EpCAM) | Biolegend | 118205 | Dilution: 3 µl in 100 µl per 1x106 cells |
| PE mouse IgG2b, κ isotype control | Biolegend | 400313 | Dilution: 1 µl in 100 µl per 1x106 cells |
| PE rat anti-human CD49f | BD Biosciences | 555763 | Dilution: 20 µl in 100 µl per 1x106 cells |
| PE rat IgG2am, κ Isotype control | Biolegend | 400508 | Dilution: 1 µl in 100 µl per 1x106 cells |
| Polypropylene Conical Centrifuge Tubes 50 mL | Basix | 14-955-240 | Used in the centrifuge |
| Povidone-Iodine Scrub | Aplicare | 82-227 | Antiseptic used to sterilize the mice |
| PrecisionGlide Needle 20G x 1 1/2 | Becton, Dickinson and Co | 305176 | 20G needle used to break up bone marrow clumps |
| PrecisionGlide Needle 26G x 1/2 | Becton, Dickinson and Co | 305111 | 26G needle used to flush bone marrow from bones |
| PTFE Printed Slides | Electron Microscopy Services | 63422-06 | 8 well slides cells sorted onto for immunofluorescence |
| RBC Lysis buffer 10X | Invitrogen | 00-4300-54 | Dilution 1:10 using sterile deionized water |
| Scissors | Roboz | RS-6762 | Used during harvest |
| Stainless steel surgical blade #4 | Bard-Parker | 371222 | Used during harvest |
| Sterile tray | Polar ware | 10F | Used during harvest |
| StretchEase Powder-free nitrile examination gloves | Denville Scientific | G4161 | Used during harvest |
| Surgical Scalpel handle #4 | Fischer | 12-000-164 | Used with surgical blade |
| TBS 20x | Thermo | Component of TBST, used at 1X | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | Used to count dead cells. Filtered with .45 µm |
| Tween 20 | Sigma Aldrich | P1379-500mL | Component of TBST |
| Tweezers | Miltex | 6-8 | Used during harvest |
| Vectashield Vibrance Antifade Mounting Medium with DAPI | Vector | H-1800 | Nuclear stain for immunofluorescence |
References
- Larsen, S. B., Cowley, C. J., Fuchs, E. Epithelial cells: liaisons of immunity. Current Opinion in Immunology. 62, 45-53 (2020).
- Blanpain, C., Fuchs, E. Plasticity of epithelial stem cells in tissue regeneration. Science. 344 (6189), 1242281 (2014).
- Coradini, D., Casarsa, C., Oriana, S. Epithelial cell polarity and tumorigenesis: New perspectives for cancer detection and treatment. Acta Pharmacologica Sinica. 32 (5), 552-564 (2011).
- Dmello, C., et al. Multifaceted role of keratins in epithelial cell differentiation and transformation. Journal of Biosciences. 44 (2), 33 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid biopsy: General concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Eslami-S, Z., Cortés-Hernández, L. E., Alix-Panabières, C. Epithelial cell adhesion molecule: an anchor to isolate clinically relevant circulating tumor cells. Cells. 9 (8), 1836 (2020).
- Morris, R. J. Circulating tumor cells: quintessential precision oncology presenting challenges for biology. NPJ Precision Oncology. 1 (1), 16 (2017).
- Lin, D., et al. Circulating tumor cells: biology and clinical significance. Signal Transduction and Targeted Therapy. 6 (1), 404 (2021).
- Spence, M., Adai, S., Landon, T., Richter, G. Few and far between: Tools and strategies for rare-event detection using flow cytometry. BioprobesJournal of Cell Biology. 71, 14-18 (2015).
- Yu, M., Stott, S., Toner, M., Maheswaran, S., Haber, D. A. Circulating tumor cells: approaches to isolation and characterization. Journal of Cell Biology. 192 (3), 373-382 (2011).
- Ye, Q., Ling, S., Zheng, S., Xu, X. Liquid biopsy in hepatocellular carcinoma: circulating tumor cells and circulating tumor DNA. Molecular Cancer. 18 (1), 114 (2019).
- Park, H., et al. marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Marsman, W. A., et al. Epithelial cells in bone marrow: do they matter. Gut. 54 (12), 1821-1822 (2005).
- Borue, X., et al. marrow-derived cells contribute to epithelial engraftment during wound healing. The American Journal of Pathology. 165 (5), 1767-1772 (2004).
- Chakrabarti, S., et al. marrow-derived cells contribute to the maintenance of thymic stroma including TECs. Journal of Immunology Research. 2022, 6061746 (2022).
- Krause, D. S., et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 105 (3), 369-377 (2001).
- Wong, A. P., et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 293 (3), L740-L752 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved