Method Article
实时测量人诱导多能干细胞来源心肌细胞中的钙和收缩力参数
摘要
本文描述了一种使用基于光学的平台在人诱导的多能干细胞衍生心肌细胞中进行收缩性和钙测量的既定方法。该平台使研究人员能够以快速且可重复的方式研究突变的影响以及对各种刺激的反应。
摘要
人诱导的多能干细胞衍生心肌细胞(hiPSC-CMs)是研究突变介导的心肌细胞功能变化以及确定应激源和药物干预效果的有力工具。在这项研究中,证明了这种基于光学的系统是评估2D中hiPSC-CMs功能参数的有力工具。通过使用该平台,可以在保存完好的温度环境中对不同的板布局进行配对测量。此外,该系统为研究人员提供了即时数据分析。
本文描述了一种测量未修饰的hiPSC-CMs收缩力的方法。在37°C下测量收缩动力学,基于相对于在250 Hz采样频率下弛豫时拍摄的参考帧的像素相关性变化。此外,可以通过用钙敏感荧光团(如Fura-2)加载细胞来同时测量细胞内钙瞬变。使用超开关,可以在直径为50μm的照明点上进行比例钙测量,对应于收缩性测量的面积。
引言
心力衰竭是全世界死亡的主要原因。2019年,心血管疾病在全球造成1860万人死亡,比过去十年增加了17.1%1。尽管研究人员努力确定预防和治疗心力衰竭的药物靶点,但患者的预后仍然很差2。动物模型相对于人类的病理生理学差异可能是心力衰竭治疗优化成功有限的潜在因素之一3。需要额外的类人模型来模拟疾病并测试新型药物化合物的毒性和有效性。
人诱导的多能干细胞来源心肌细胞(hiPSC-CMs)是确定应激源、缺血、代谢改变或致病基因变异诱导的细胞病理机制以及药物干预的有效性和毒性的有力工具4。为了确定对hiPSC-CMs功能特性的影响,需要一种高速系统,以无偏和可重复的方式测量细胞收缩的收缩和舒张特性。当前研究的总体目标是证明基于光学的系统是对hiPSC-CMs的功能参数进行实时分析的强大工具。
目前,有多个平台可以评估hiPSC-CMs的收缩性。然而,目前的系统要么读数慢,要么所需的细胞数量可能是一个挑战。无标签视频测量系统5、6 依赖于对视频的事后分析,这需要大量的存储空间,并且在视频采集过程中缺乏直接反馈。此外,很难实现足够的时间和空间分辨率,并可能导致欠采样。确定心肌细胞特性的其他方法,例如带有荧光报告基因的成簇规则间隔短回文重复序列(CRISPR)/ Cas9编辑的hiPSC-CMs7 可能会干扰细胞的基因稳定性,并且需要专门的实验室专业知识。
为了克服上述限制,本研究开发并引入了一种独特的基于光学的测量系统。该平台只需在任何所需的板格式上重新镀层,即可对未修饰的hiPSC-CM进行收缩性测量,而不受板尺寸限制。此外,实时测量允许直接观察和分析hiPSC-CMs的功能参数,从而提供即时调整和优化方案的实验设置。此外,每个测量的位置都被存储,这使得可以对同一样品进行配对测量,从而提高实验的能力。
为了演示基于光学的系统,在对照hiPSC-CM生产线上进行了收缩性测量。该对照hiPSC系由具有正常核型8的健康男性供体的真皮成纤维细胞产生。在37 °C下测量收缩动力学,基于在250 Hz采样频率下弛豫期间相对于参考系的像素相关性变化。由于收缩的确切开始并不总是明确确定的,因此将达到峰值高度的20%的时间点(到峰值的时间20%)作为测量峰值时间的起点。通过这样做,在一个样本中发现该参数的变异性较小。同样,由于难以评估信号返回基线的确切时刻,因此使用从峰值达到基线返回基线的80%(到基线的时间80%)来描述松弛时间。
总体收缩性测量包括静息跳动频率,从20%峰值到峰值收缩的时间(TP.Con),以及从峰值收缩到基线80%的时间(TB.骗局80)(图1B)。为了测试应激源的效果,将细胞与异丙肾上腺素(ISO)一起孵育。此外,与收缩性测量巧合的是,通过在250 Hz的采样频率下加载Fura-2-乙酰氧基甲酯(Fura-2 AM)来测量Ca2 +瞬变。 使用超开关的比例Ca2+测量9在直径为50μm的照明区域上进行,对应于收缩性测量的区域。Ca 2+测量数据表示为Ca2+瞬态(TP.Ca)中从20%峰到峰的时间,以及从峰值到基线80%的时间(TB.Ca80)(图1C)。使用快速、自动的数据分析工具来生成每个区域的平均收缩和钙动力学参数。
研究方案
1. 细胞培养基和试剂的制备
- 通过将 1 mL B27 补充剂 (50x) 添加到 49 mL RPMI1640中来制备 hiPSC-CM 培养基。
- 首先将 5 mL 敲除血清替代品加入 45 mL hiPSC-CM 培养基中,制备重镀培养基。然后,加入 22.5 μL Y-27632 ROCK 抑制剂(1:2,000 稀释度;储备浓度:10 mM)并充分混合。
- 准备基底膜包被板,如下所述:
- 在冰箱或冰盒中解冻一瓶基底膜过夜。
- 用适量的杜尔贝克改良鹰培养基/火腿F12(DMEM/F12)稀释基底膜。由于每批基底膜具有不同的浓度,因此计算达到 1 mg/1 mL 稀释度所需的 DMEM/F12 量。制作0.5或1mL等分试样,在-20°C下储存。
注意:步骤 1.3.2 需要在流罩内的冰上完成。 - 解冻基底膜的 0.5 mL 等分试样,并用 6 mL DMEM/F12 稀释。充分混合。
- 通过在 24 孔板中移液 250 μL 稀释的基底膜/孔来涂覆板。根据不同孔板格式的每个孔的表面积进行计算,例如,6 孔板中的 1 mL/孔。
- 将板在37°C培养箱中孵育1小时。
- 根据制造商手册,通过将Fura-2 AM溶解在二甲基亚砜(DMSO)中来制备Fura-2 AM等分试样,以制备1 mM等分试样。将等分试样储存在-20°C。
2. 培养 hiPSC-CMs
- 在37°C水浴中解冻一瓶hiPSC-CMs。将小瓶的解冻内容物转移到 15 mL 管中。以滴加方式向细胞中加入 10 mL 重镀培养基。
- 以100× g离心细胞5分钟。
- 除去上清液并加入 1 mL 重镀培养基。轻轻上下移液以重悬沉淀并去除任何细胞团块。
- 使用血细胞计数器或自动细胞计数器计数细胞数量。
- 从孵育板上取出基底膜并用重镀介质代替。
- 将细胞密度适于适当的细胞密度接种在涂有基底膜的 6/12/24/48/96 孔板上(例如,24 孔板中的 250,000 个细胞/孔)。
注意:对于Ca 2 + 瞬态实验,将细胞铺在玻璃底板上。 - 第二天用hiPSC-CM培养基替换培养基,随后在24孔板中每隔一天使用0.5 mL /孔更新培养基。
- 一旦hiPSC-CMs从解冻和重新铺板中恢复(在本方案中重新铺板后3-5天),执行收缩力测量。
注意:在细胞重镀不均匀的情况下,一组细胞可能不与其余重铺板细胞接触,并可能显示一些不规则或不同步的跳动模式。为避免异步,建议在每个孔中均匀分布细胞和同步的良好连接的单层hiPSC-CM。
3. 收缩力测量
- 打开基于光学的测量系统、显微镜发光二极管 (LED) 光源和计算机(参见 材料表)。
- 打开程序并打开一个新文件。在屏幕左上角的 "文件" 下,单击" 新建"。
- 单击"收集",选择"实验",然后选择"iPSC + 钙"。
- 打开气候控制设备。将温度设置为 37 °C,将CO 2 水平设置为 5%。
- 用 Tyrode 溶液(24 孔板中的 0.5 mL/孔)替换 hiPSC-CM 培养基。用气候控制盖更换板盖。
注意:如果需要执行钙瞬态测量,请用Fura-2 AM加载电池,如第4节所述。 - 一旦气候控制装置显示温度为 37 °C,将板放入基于光学的测量系统内。
注意:收缩是使用明场条件测量的。 - 点击 打开单元格查找器 在工具栏下,然后等待弹出新屏幕。在屏幕的右上角,选择 板格式 和 孔。
- 选择一个孔,选择 孔内的一个区域以观察同步收缩和松弛,按 开始,单击 添加测量。在设置中选择 测量的持续时间 (每个区域 10 秒)。立即放弃异步收缩测量并选择新区域。
注意:实时收缩瞬变可以在监视器上看到。对于同步收缩,观察到平滑的连续瞬态,而对于异步收缩,观察到小的额外峰值。 - 根据井的大小测量井内的多个区域。例如,要遵循这项研究,请在 24 孔板中测量每孔 10 个区域。如果只需要基线测量并且没有计划测试任何化合物,请从步骤3.13继续。
- 测量孔内区域后,按 完成 并打开基于光学的测量仪器,将应力源/化合物添加到孔中(例如, 500 nM ISO,溶解在 Tyrode中)。
- 根据感兴趣的化合物选择孵育时间(在此协议中使用ISO2分钟)。
- 单击自动测量以允许基于光学的测量仪器在执行基线测量的相同区域执行测量,从而在孔内进行配对 测量 。
- 完成孔中的所有测量后,按 完成 。
- 从屏幕右上角选择下一个井。
- 继续测量所有需要的孔。
- 测量完所有必需的孔后,单击 停止 并保存文件。
注意:气候控制用于保持稳定的 CO2。这允许以高速方式测量化合物/应激源对hiPSC-CM的影响。
4. 钙瞬态测量
- 准备37°C泰罗德溶液。
- 将Fura-2 AM等分试样溶解在Tyrode溶液中,以便将终浓度为1μM Fura-2 AM添加到细胞中。
注意:使用 Fura-2 AM 时,请确保流罩中的灯已关闭,以尽量减少光线暴露。 - 吸出培养基并用含有Fura-2 AM的Tyrode溶液代替。
- 在培养箱或基于光学的测量系统中在37°C孵育15分钟。
- 取出含有Fura-2 AM的Tyrode溶液,然后用新鲜的Tyrode溶液洗涤2x。最后,将细胞在Tyrode溶液中在37°C下再孵育5分钟,以使Fura-2AM脱酯化。
- 将板放在基于光学的测量系统中并开始测量,如第 3 节所述。
注意:在步骤 4.6 中。通过与收缩测量同时开始测量,记录比例钙瞬变:在100μm光斑中以340nm和385nm激发;在 510 ± 40 nm 处收集的发射。除了收缩力痕迹外,屏幕上还将出现实时比例钙瞬变。
5. 数据分析
- 要分析数据,请单击桌面上的 细胞求解器 。
- 单击 导入 并选择要分析的文件。
- 程序执行分析后,观察屏幕上出现的接受(蓝色)和拒绝(红色)瞬变(图1A)。
注意:此处使用了以下默认抑制标准,由信噪比(SNR)和拟合优度(R 2)定义:R 2>0.9和SNR >4表示收缩瞬变,R2>0.5和SNR >3表示钙瞬变。用户可以根据测量质量、细胞质量和研究人员的主要结果来调整这些排斥标准。例如,如果研究人员的兴趣主要是松弛动力学,则可以降低峰值变量的时间标准。如果获得非常强的钙瞬变,则可能必须提高SNR以排除噪声较大的数据。 - 单击 导出 并勾选平均瞬态数据。检查电子表格中显示的分析数据。
- 关闭计算机和所有其他仪器。
结果
按照该协议,进行了收缩性,Ca2 + 瞬变和对hiPSC-CMs中化合物的反应的测量。通过使用这种基于光学的测量系统,可以简单地将hiPSC-CMs重新镀在所需的板上,并且可以进行收缩性测量。通过计算相对于参考帧的像素相关性,在 100 μm x 100 μm 感兴趣区域 (ROI) 中以每秒 250 帧的速度测量收缩性。系统在舒张末期自动检测参考系。在收缩测量的同时,记录比例钙瞬变。
在这项研究中,使用三轮不同的分化作为三个生物学重复。对于每批分化,测量三口井作为技术重复。这项研究是使用24孔板进行的,并测量了每个孔内的10个区域。测量后,使用CytoSolver程序立即分析数据。报告了以下参数:静息跳动频率,TP。骗局和结核病。对照hiPSC-CMs的Con80(图2A-C)。为了可视化每个上述参数的数据变异性,每个孔内的测量值和每轮分化的三个孔的平均值表示为超图10。为了更好地评估每轮微分和三轮数据的变化,计算了每个参数的方差系数(图2D)。如图2D所示,对应于一个生物重复的技术重复值彼此落在非常接近的范围内(即低方差系数),这说明了该方法的稳健性。
此应用程序非常适合测试药物效果。在这里,测试了500nM ISO(一种非选择性β-肾上腺素能受体激动剂)对对照hiPSC-CMs收缩力的影响。已知这种化合物可以增加心率并发挥积极的促甲状腺作用.如图3A所示,ISO显著提高了所有孔的跳动频率。ISO也增加了动力学,这在TP的降低中很明显。骗局和结核病。缺点80(图 3B,C)。总体而言,在用ISO孵育时,所有孔的跳动频率均显着增加,收缩和弛豫时间减少,这表明该平台记录了对该化合物的预期响应。
在进行收缩力测量的同时,还进行了钙测量。与收缩性数据(图2)相同,hiPSC-CMs的钙测量数据如图 4所示。TB.Ca80 比分离的大鼠或小鼠心肌细胞慢得多,这部分是由于物种和心率差异11,以及hiPSC-CMs中由于肌浆网内的钙动力学较低和钙处理蛋白的表达低于原代细胞而导致的未成熟钙处理12.与收缩性数据类似,计算了钙测量的方差系数,并且在技术和生物学重复中显示出低变异性(图4C)。
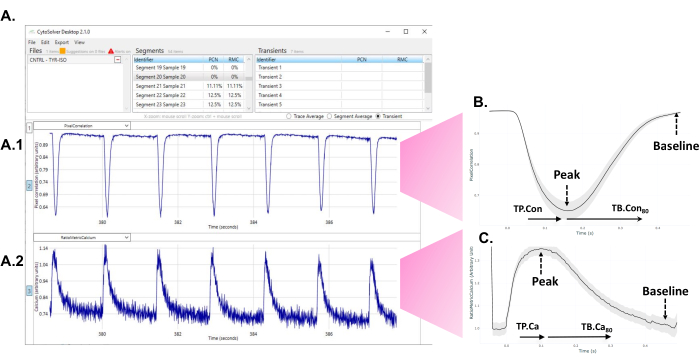
图 1:实验后立即使用 CytoSolver 瞬态分析工具分析数据。 (A)在井内测量的一个区域的可接受瞬态(全部为蓝色)的示例。图A1描绘了收缩瞬变。图A2代表钙瞬变。(B)在一轮分化的三口井中测量获得的平均收缩瞬态。从每个单个或平均瞬态,数据从不同时间点到峰值(TP.缺点)和到基线的时间(TB.Con)的收缩瞬态可以提取。由于收缩的确切开始并不总是明确确定的,因此以峰值时间20%作为测量峰值时间的起点。同样,信号返回基线的确切时刻也很难评估。因此,到基线80%的时间用于描述松弛时间。在这里,TP。缺点(达到峰值的时间 - 达到峰值的时间 20%)和 TB。使用Con 80(到基线的时间80% - 达到峰值的时间)。(C)从一轮分化的三口井测量中获得的平均钙瞬态数据。从每个单个或平均钙瞬变中,可以提取钙瞬变到峰值(TP.Ca)和到基线时间(TB.Ca)的不同时间点的数据。对于达到峰值的时间测量,起点是达到峰值的时间 20%,对于到基线的时间,终点是到基线的时间 80%。在本研究中,使用了 TP.Ca(达到峰值的时间 - 达到峰值的时间 20%)和 TB.Ca 80(到基线的时间 80% - 达到峰值的时间)。请点击此处查看此图的大图。
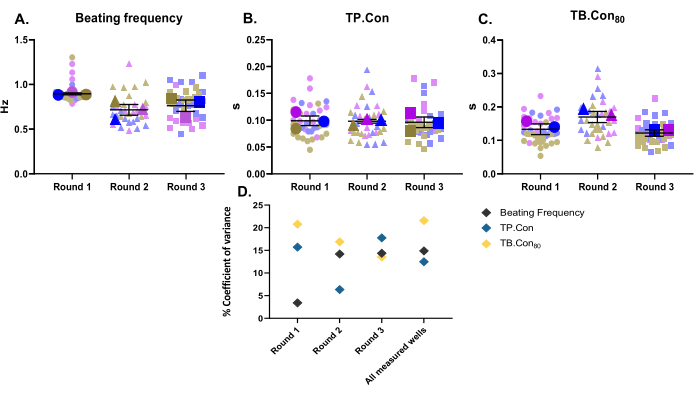
图2:对三轮不同的分化进行的基线收缩力测量。 每轮分化三个生物重复和三个孔(即三个技术重复)。每轮分化的三个主要符号代表每口井内测量区域的平均值(褪色背景符号)。数据显示为 SEM ±平均值。 有关静息跳动频率的数据以赫兹表示,TP 的数据以赫兹表示。骗局和结核病。Con80,数据以秒为单位。(一)静息跳动频率。(B) 达到峰值的时间(TP.缺点)。(C) 达到基线的时间 80% (TB.缺点80)。(D)为了评估每轮获得的数据之间的差异以及所有三轮分化之间的差异,使用每口井的平均值计算方差百分比系数。 请点击此处查看此图的大图。
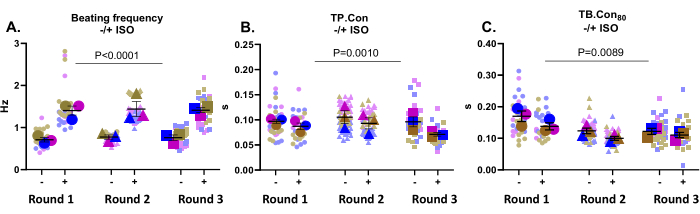
图 3:在基线 (-) 和用 ISO (+) 孵育后的收缩力测量,用于三轮分化。 (A)静息跳动频率(-)和用500nM ISO(+)孵育后的跳动频率。(B) 达到峰值的时间(TP.缺点)在基线和用ISO孵育后的测量。(C) 达到基线的时间 80% (TB.Con80)在基线和用ISO孵育后的测量。为了评估ISO对收缩性参数的影响,进行了双向方差分析与邦弗朗尼校正。数据显示为平均± SEM。 有关静息搏动频率的数据以赫兹和 TP 表示。骗局和结核病。Con80,数据以秒为单位表示。请点击此处查看此图的大图。
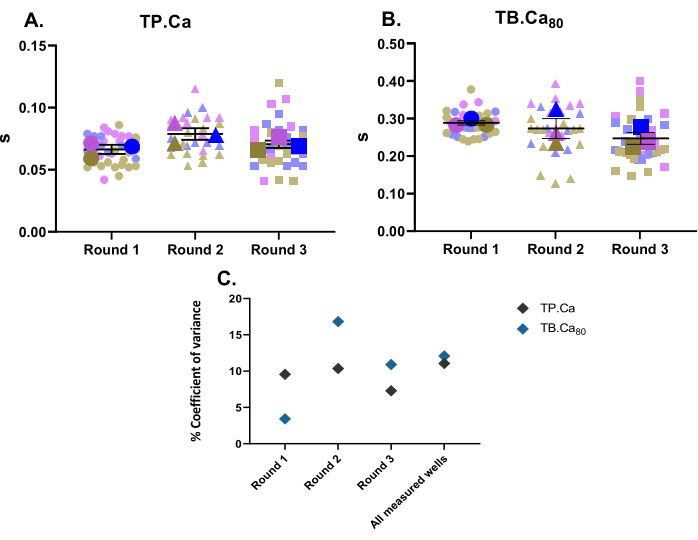
图4:三轮分化对三口井进行的基线钙瞬态测量 。 (A)达到峰值的时间(TP.Ca)和(B)到基线的时间80%(TB.Ca80)的钙瞬变。数据显示为 SEM ±平均值,TP.Ca 和TB.Ca 80 个数据以秒为单位表示。(C)为了评估每轮获得的数据之间的差异以及所有三轮分化之间的差异,使用每口井的平均值计算方差百分比系数。 请点击此处查看此图的大图。
讨论
在这项研究中,描述了一种对hiPSC-CMs进行收缩力和钙瞬时测量的方法,并研究应激源/药物对这些细胞的影响。收缩性测量,比例钙测量和对ISO的反应在三轮不同的分化中进行,作为生物学重复。对于每个生物重复,在三个孔上进行测量作为技术重复。以这种方式进行测量的原因是为了确保可以评估样品和平台的生物变异性和技术变异性。除了考虑适当数量的生物学和技术重复外,hiPSC-CM培养条件对于获得持续和可靠的结果可以发挥重要作用。在测量过程中,必须符合标准,例如hiPSC-CMs的年龄、培养基的组成、重铺条件和化合物孵育时间。在这项研究中,在一个井中两次测量11个区域,每次10秒,平均需要568±24秒。这包括 79 ± 11 秒的 ISO 孵育时间。这归结为每孔大约 10 分钟,这应该使研究人员能够在 ~4 小时内测量完整的 24 孔板。气候控制用于保持稳定的CO2。这允许以高速方式测量化合物/应激源对hiPSC-CM的影响。
为了测量iPSC-CMs的收缩功能,有几种现有的系统依赖于光遗传学13或无标记视频显微镜5,6。光遗传学系统非常复杂,需要特殊技术才能获得电物理和/或收缩力数据。其他系统依赖于视频的事后分析,这需要大量的存储空间,并且在视频采集过程中缺乏直接反馈。此外,很难实现足够的时间和空间分辨率,这可能会导致欠采样。同样,带有荧光报告基因7的CRISPR / CAS-9编辑的hiPSC-CMs可能会对心肌细胞行为产生不良影响。使用荧光染料进行收缩-弛豫测量也是一种优雅的方法,但限制了对同一样品进行较长时间的实验14。
然而,这种基于光学的测量平台可用于测量收缩-弛豫时间,而无需使用任何荧光染料或侵入性方法。然而,由于像素相关性不能提供空间信息,该方法不能用于测量收缩强度,而只能可靠地检测收缩和松弛速度的变化。引入的测量系统是温度控制的,可以以每秒>200帧的分辨率实时获取钙和收缩力数据。此外,每个测量的位置都被存储,这使得配对测量成为可能,从而提高实验的能力。此外,该平台为研究人员提供了存储数据并在实验后立即分析数据的能力。总体而言,这种基于光学的测量系统被证明是研究细胞病理机制的一种有前途的方法,可以评估化合物对hiPSC-CMs功能的影响,并且有助于药物筛选的临床前过程。
披露声明
EM是CytoCypher BV的员工。MH是CytoCypher BV的首席执行官。其余作者声明,该研究是在没有任何商业或财务关系的情况下进行的,这些关系可以解释为潜在的利益冲突。
致谢
这项研究部分由Eurostars grant Estars2 113937 CARDIOMYO(EM&DK)和NWO-VICI grant 91818602(JV)资助。
材料
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
参考文献
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。