Mediciones en tiempo real de parámetros de calcio y contractilidad en cardiomiocitos derivados de células madre pluripotentes inducidas humanas
En este artículo
Resumen
Aquí, se describe un método establecido para realizar mediciones de contractilidad y calcio en cardiomiocitos derivados de células madre pluripotentes inducidas humanas utilizando una plataforma basada en óptica. Esta plataforma permite a los investigadores estudiar el efecto de las mutaciones y la respuesta a diversos estímulos de forma rápida y reproducible.
Resumen
Los cardiomiocitos derivados de células madre pluripotentes inducidas humanas (hiPSC-CM) representan una poderosa herramienta para estudiar los cambios mediados por mutaciones en la función de los cardiomiocitos y definir los efectos de los factores estresantes y las intervenciones farmacológicas. En este estudio, se demuestra que este sistema basado en óptica es una poderosa herramienta para evaluar los parámetros funcionales de hiPSC-CMs en 2D. Mediante el uso de esta plataforma, es posible realizar mediciones emparejadas en un entorno de temperatura bien conservado en diferentes diseños de placas. Además, este sistema proporciona a los investigadores un análisis instantáneo de los datos.
En este trabajo se describe un método para medir la contractilidad de las hiPSC-MC no modificadas. La cinética de contracción se mide a 37 °C en función de los cambios de correlación de píxeles en relación con un marco de referencia tomado en relajación a una frecuencia de muestreo de 250 Hz. Además, las mediciones simultáneas de los transitorios de calcio intracelular se pueden adquirir cargando la célula con un fluoróforo sensible al calcio, como Fura-2. Utilizando un hiperinterruptor, se pueden realizar mediciones radiométricas de calcio en un punto de iluminación de 50 μm de diámetro, correspondiente al área de las mediciones de contractilidad.
Introducción
La insuficiencia cardíaca es la principal causa de muerte en todo el mundo. En 2019, las enfermedades cardiovasculares causaron 18,6 millones de muertes en todo el mundo, lo que refleja un aumento del 17,1% en la última década1. A pesar de los esfuerzos de los investigadores por identificar dianas farmacológicas para prevenir y curar la insuficiencia cardíaca, los resultados de los pacientes siguen siendo deficientes2. La diferencia en la fisiopatología de los modelos animales con respecto a los humanos podría ser uno de los factores subyacentes en el limitado éxito de la optimización de la terapia de la insuficiencia cardíaca3. Se justifican modelos similares a los humanos adicionales para modelar la enfermedad y probar la toxicidad y eficacia de los nuevos compuestos farmacológicos.
Los cardiomiocitos derivados de células madre pluripotentes inducidas humanas (hiPSC-MC) representan una poderosa herramienta para definir los mecanismos patológicos celulares inducidos por factores estresantes, isquemia, metabolismo alterado o variantes genéticas patógenas, y la eficacia y toxicidad de las intervenciones farmacológicas4. Para definir los efectos sobre las propiedades funcionales de las MC-hiPSC, se justifica un sistema de alta velocidad que mida las propiedades sistólicas y diastólicas de las contracciones celulares de manera imparcial y reproducible. El objetivo general del presente estudio es demostrar que un sistema basado en la óptica es una herramienta poderosa para realizar análisis en tiempo real de los parámetros funcionales de las hiPSC-CM.
En la actualidad, existen múltiples plataformas para evaluar la contractilidad de las MC-hiPSC. Sin embargo, los sistemas actuales ofrecen una lectura lenta o el número requerido de celdas puede ser un desafío. Los sistemas de medición de vídeo sin etiquetas5,6 se basan en el análisis post-hoc de los vídeos, que requiere mucho almacenamiento y carece de retroalimentación directa durante la adquisición de vídeo. Además, es difícil lograr una resolución temporal y espacial suficiente, y puede dar lugar a un submuestreo. Otros métodos para determinar las propiedades de los cardiomiocitos, como las repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR)/HiPSC-CMeditadas por Cas9 7 con reporteros fluorescentes, pueden interferir con la estabilidad génica de las células y requieren experiencia de laboratorio especializada.
Para superar las limitaciones mencionadas anteriormente, se desarrolló e introdujo en este estudio un sistema de medición único basado en la óptica. Esta plataforma permite realizar mediciones de contractilidad en hiPSC-CM no modificados simplemente rechapándolos en cualquier formato de placa requerido, sin ninguna limitación en el tamaño de la placa. Además, las mediciones en tiempo real permiten la observación directa y el análisis de los parámetros funcionales de las hiPSC-CM y, por lo tanto, proporcionan un entorno experimental para ajustar y optimizar instantáneamente los protocolos. Además, se almacena la ubicación de cada medición, lo que permite realizar mediciones emparejadas en la misma muestra, aumentando así la potencia de los experimentos.
Para demostrar el sistema basado en la óptica, se realizaron mediciones de contractilidad en una línea de control hiPSC-CM. Esta línea de control hiPSC se generó a partir del fibroblasto dérmico de un donante masculino sano con cariotipo8 normal. La cinética de contracción se midió a 37 °C, basándose en los cambios de correlación de píxeles en relación con un marco de referencia tomado durante la relajación a una frecuencia de muestreo de 250 Hz. Como el inicio exacto de la contracción no siempre se puede determinar de forma inequívoca, se tomó como punto de partida para las mediciones del tiempo hasta el pico el 20% del punto máximo el punto de tiempo en el que se alcanzó el 20% de la altura máxima (tiempo hasta el pico 20%). De este modo, se encontró una menor variabilidad para este parámetro dentro de una muestra. Del mismo modo, dado que el momento exacto en el que la señal vuelve a la línea basal es difícil de evaluar, se utilizó el tiempo que tardó en alcanzar el 80% del retorno a la línea basal desde el pico (tiempo hasta la línea basal 80%) para describir el tiempo de relajación.
Las mediciones generales de la contractilidad incluyeron frecuencias de batido en reposo, el tiempo desde el pico del 20% hasta la contracción del pico (TP. Con), y el tiempo transcurrido desde el pico de contracción hasta el 80% del valor basal (TB. Con80) (Figura 1B). Para probar el efecto de un factor estresante, las células se incubaron con isoprenalina (ISO). Además, coincidiendo con las mediciones de contractilidad, los transitorios de Ca 2+ se midieron cargando las células con éster Fura-2-acetoximetílico (Fura-2 AM) a una frecuencia de muestreo de 250 Hz. Las mediciones radiométricas de Ca 2+ 9 utilizando un hiperinterruptor se realizaron en un área de iluminación de 50 μm de diámetro, correspondiente al área de las mediciones de contractilidad. Los datos de medición de Ca 2+ se representan como el tiempo transcurrido desde el pico del 20% hasta el pico en el transitorio de Ca2+ (TP.Ca) y el tiempo desde el pico hasta el 80% de la línea de base (TB.Ca80) (Figura 1C). Se utilizó una herramienta de análisis de datos rápida y automática para obtener parámetros cinéticos contráctiles y de calcio promedio para cada área.
Protocolo
1. Preparación de medios y reactivos de cultivo celular
- Prepare los medios hiPSC-CM añadiendo 1 ml de suplemento de B27 (50x) a 49 ml de RPMI1640.
- Prepare el medio de recubrimiento agregando primero 5 mL de reemplazo de suero knockout a 45 mL de medio hiPSC-CM. A continuación, añadir 22,5 μL de inhibidor de Y-27632 ROCK (dilución 1:2.000; concentración de existencias: 10 mM) y mezclar bien.
- Prepare las placas recubiertas de membrana basal como se describe a continuación:
- Descongele un frasco de membrana basal durante la noche en el refrigerador o en una caja de hielo.
- Diluir la membrana basal con una cantidad adecuada de medio de Eagle modificado de Dulbecco/F12 de Ham (DMEM/F12). Como cada lote de membrana basal tiene una concentración diferente, calcule la cantidad de DMEM/F12 necesaria para alcanzar una dilución de 1 mg/1 ml. Hacer alícuotas de 0,5 o 1 ml para almacenar a -20 °C.
NOTA: El paso 1.3.2 debe realizarse sobre hielo dentro de una campana de flujo. - Descongelar la alícuota de 0,5 mL de membrana basal y diluirla con 6 mL de DMEM/F12. Homogeneizar.
- Cubra la placa pipeteando 250 μL de membrana basal/pocillo diluido en una placa de 24 pocillos. Calcule en función del área de superficie de cada pocillo para diferentes formatos de placa, por ejemplo, 1 ml/pocillo en una placa de 6 pocillos.
- Incubar la placa durante 1 h en una incubadora a 37 °C.
- Prepare las alícuotas de Fura-2 AM disolviendo Fura-2 AM en dimetilsulfóxido (DMSO), de acuerdo con el manual del fabricante para preparar alícuotas de 1 mM. Almacenar las alícuotas a -20 °C.
2. Cultivo de hiPSC-MCs
- Descongelar un vial de hiPSC-CM en un baño de agua a 37 °C. Transfiera el contenido descongelado del vial a un tubo de 15 ml. Agregue 10 ml del medio de recubrimiento gota a gota a las células.
- Centrifugar las células durante 5 min a 100 × g.
- Retire el sobrenadante y agregue 1 ml de medio de recubrimiento. Pipetear suavemente hacia arriba y hacia abajo para volver a suspender el gránulo y eliminar los grumos celulares.
- Use un hemocitómetro o un contador de células automatizado para contar el número de células.
- Retire la membrana basal de la placa incubada y reemplácela con el medio de rechapado.
- Aplique las células con una densidad celular adecuada en una placa de 6/12/24/48/96 pocillos recubierta con membrana basal (p. ej., 250.000 células/pocillo en una placa de 24 pocillos).
NOTA: Para experimentos transitorios de Ca2+ , coloque las células en placas con fondo de vidrio. - Reemplace el medio con medio de cultivo hiPSC-CM al día siguiente y, posteriormente, refresque el medio cada dos días usando 0,5 ml/pocillo en una placa de 24 pocillos.
- Realizar las mediciones de contractilidad una vez que los hiPSC-CM se hayan recuperado de la descongelación y el replateado (3-5 días después del replateado en este protocolo).
NOTA: En caso de resiembra desigual de las células, es posible que un grupo de células no esté en contacto con el resto de las células replantadas y pueda mostrar algún patrón de batido irregular o no sincronizado. Para evitar la asincronía, se recomienda tener una distribución uniforme de las células y una monocapa sincronizada y bien conectada de hiPSC-CM en cada pocillo.
3. Mediciones de contractilidad
- Encienda el sistema de medición basado en la óptica, la fuente de luz del diodo emisor de luz (LED) del microscopio y la computadora (consulte la tabla de materiales).
- Abra el programa y abra un nuevo archivo. En Archivo , en la parte superior izquierda de la pantalla, haga clic en Nuevo.
- Haga clic en Recopilar, elija Experimentos y luego seleccione "iPSC + Calcio".
- Encienda el dispositivo de control de clima. Ajuste la temperatura a 37 °C y el nivel deCO2 al 5%.
- Sustituya el medio de cultivo hiPSC-CM por una solución de Tyrode (0,5 ml/pocillo en una placa de 24 pocillos). Vuelva a colocar la tapa de la placa con la tapa del control de clima.
NOTA: Si es necesario realizar mediciones transitorias de calcio, cargue las celdas con Fura-2 AM, como se describe en la sección 4. - Coloque la placa dentro del sistema de medición basado en óptica una vez que el dispositivo de control de clima muestre que la temperatura es de 37 °C.
NOTA: La contracción se mide utilizando condiciones de campo claro. - Haga clic en Abrir buscador de celdas debajo de la barra de herramientas y espere a que aparezca una nueva pantalla. En la parte superior derecha de la pantalla, seleccione el formato de la placa y el pozo.
- Seleccione un pozo, elija un área dentro del pozo para observar la contracción y relajación sincronizadas, presione el botón de inicio, haga clic en Agregar medición. Seleccione la duración de las mediciones en los ajustes (10 s por área). Descarte inmediatamente las mediciones de contracción asíncronas y seleccione una nueva área.
NOTA: Los transitorios de contractilidad en tiempo real se pueden ver en el monitor. En el caso de las contracciones sincronizadas, se observa un transitorio suave y continuo, mientras que en el caso de las contracciones asíncronas, se observan pequeños picos adicionales. - Mida varias áreas dentro del pozo dependiendo del tamaño del pozo. Por ejemplo, para seguir este estudio, mida 10 áreas por pocillo en una placa de 24 pocillos. En caso de que solo se necesiten mediciones de referencia y no haya ningún plan para probar ningún compuesto, continúe desde el paso 3.13.
- Después de medir las áreas dentro de un pozo, presione completar y abra el instrumento de medición basado en óptica para agregar el estresor/compuesto al pozo (por ejemplo, ISO de 500 nM, disuelto en Tyrode).
- Elegir el tiempo de incubación en función del compuesto de interés (2 min con ISO en este protocolo).
- Haga clic en medición automática para permitir que el instrumento de medición basado en óptica realice mediciones en las mismas áreas donde se realizaron las mediciones de referencia, lo que da como resultado mediciones emparejadas dentro del pozo.
- Presione completar una vez que se hayan realizado todas las mediciones en el pozo.
- Elija el siguiente pozo en la parte superior derecha de la pantalla.
- Continúe con las mediciones para todos los pozos requeridos.
- Haga clic en detener una vez que se hayan medido todos los pozos necesarios y guarde el archivo.
NOTA: El climatizador se utiliza para mantener estable elCO2. Esto permite medir el efecto de los compuestos/factores estresantes en las hiPSC-CM de una manera rápida.
4. Mediciones transitorias de calcio
- Preparar una solución de Tyrode a 37 °C.
- Disolver las alícuotas de Fura-2 AM en una solución de Tyrode de modo que se añada una concentración final de 1 μM de Fura-2 AM a las células.
NOTA: Mientras usa Fura-2 AM, asegúrese de que las luces de la campana de flujo estén apagadas para minimizar la exposición a la luz. - Aspire el medio y reemplácelo con una solución Tyrode que contenga Fura-2 AM.
- Incubar durante 15 min a 37 °C en una incubadora o en el sistema de medición basado en la óptica.
- Retire la solución Tyrode que contiene Fura-2 AM y, posteriormente, lave 2 veces con una solución Tyrode fresca. Finalmente, incubar las células en solución de Tyrode durante otros 5 minutos a 37 °C para permitir la desesterificación de Fura-2 AM.
- Coloque la placa dentro del sistema de medición basado en óptica e inicie las mediciones, como se describe en la sección 3.
NOTA: En el paso 4.6. Al iniciar las mediciones simultáneamente con las mediciones de contracción, se registra un transitorio de calcio radiométrico: excitación a 340 nm y 385 nm en un punto de 100 μm; Emisión recogida a 510 ± 40 nm. Además de las trazas de contractilidad, aparecerán en la pantalla transitorios de calcio ratiométricos en tiempo real.
5. Análisis de datos
- Para analizar los datos, haga clic en CytoSolver en el escritorio.
- Haga clic en importar y seleccione los archivos que desea analizar.
- Después de que el programa haya realizado el análisis, observe los transitorios aceptados (azul) y rechazados (rojo) que aparecen en la pantalla (Figura 1A).
NOTA: En este caso, se utilizaron los siguientes criterios de rechazo predeterminados, definidos por la relación señal/ruido (SNR) y la bondad de ajuste (R 2): R 2 > 0,9 y SNR > 4 para transitorios de contracción, y R2 > 0,5 y SNR > 3 para transitorios de calcio. Estos criterios de rechazo pueden ser ajustados por el usuario en función de la calidad de las mediciones, la calidad de las células y el resultado primario para el investigador. Por ejemplo, si el interés del investigador es principalmente la cinética de relajación, los criterios podrían reducirse para las variables de tiempo hasta el pico. Si se obtienen transitorios de calcio muy fuertes, es posible que sea necesario aumentar la SNR para excluir los datos más ruidosos. - Haga clic en exportar y marque para obtener los datos transitorios promedio. Inspeccione los datos analizados presentados en una hoja de cálculo.
- Apague la computadora y todos los demás instrumentos.
Resultados
Siguiendo este protocolo, se realizaron mediciones de contractilidad, transitorios de Ca2+ y respuesta a un compuesto en hiPSC-MCs. Mediante el uso de este sistema de medición basado en la óptica, los hiPSC-CM podrían simplemente replatearse en las placas requeridas y se podrían realizar las mediciones de contractilidad. La contractilidad se mide en una región de interés (ROI) de 100 μm x 100 μm a 250 fotogramas por segundo calculando la correlación de píxeles con respecto a un fotograma de referencia. El sistema detecta automáticamente el sistema de referencia al final de la diástole. Simultáneamente con las mediciones de contracción, se registra un transitorio de calcio radiométrico.
En este estudio, se utilizaron tres rondas diferentes de diferenciación como tres réplicas biológicas. Para cada lote de diferenciación, se midieron tres pozos como réplicas técnicas. Este estudio se realizó utilizando placas de 24 pocillos y se midieron 10 áreas dentro de cada pocillo. Después de las mediciones, se utilizó el programa CytoSolver para analizar inmediatamente los datos. Se reportaron los siguientes parámetros: la frecuencia de batido en reposo, TP. Con y tuberculosis. Con80 de los hiPSC-CM de control (Figura 2A-C). Para visualizar la variabilidad de los datos para cada parámetro mencionado, las mediciones dentro de cada pozo y los valores promedio de tres pozos para cada ronda de diferenciación se presentan como supergráficos10. Para evaluar mejor la variabilidad de los datos para cada ronda de diferenciación y entre las tres rondas, se calculó el coeficiente de varianza (Figura 2D) para cada parámetro. Como se muestra en la Figura 2D, los valores de las réplicas técnicas correspondientes a una réplica biológica se encuentran dentro de un rango muy cercano entre sí (es decir, bajo coeficiente de varianza), lo que ilustra la robustez de este método.
Esta aplicación es muy adecuada para probar los efectos de los medicamentos. Aquí, se probó el efecto de 500 nM ISO, un agonista no selectivo del receptor β-adrenérgico, sobre la contractilidad de las hiPSC-MCs de control. Se sabe que este compuesto aumenta la frecuencia cardíaca y ejerce un efecto lusittrópico positivo. Como se muestra en la Figura 3A, ISO aumentó significativamente la frecuencia de batido en todos los pozos. ISO también aumentó la cinética, lo que se evidenció en una disminución de la TP. Estafa y tuberculosis. Con80 (Figura 3B,C). En general, tras la incubación con ISO, la frecuencia de batido se incrementó significativamente en todos los pocillos, junto con una reducción en el tiempo de contracción y relajación, lo que indicó que la respuesta esperada a este compuesto fue registrada por esta plataforma.
Paralelamente a las mediciones de contractilidad, también se realizaron mediciones de calcio. De la misma manera que los datos de contractilidad (Figura 2), los datos de medición de calcio de las hiPSC-CM se representan en la Figura 4. El TB.Ca80 es considerablemente más lento que en cardiomiocitos aislados de rata o ratón, lo que se explica en parte por las diferencias entre especies y frecuencia cardíaca11, así como por el manejo inmaduro de calcio en las MC-hiPSC debido a una menor dinámica del calcio dentro del retículo sarcoplásmico y una menor expresión de proteínas de manejo de calcio en comparación con las células primarias12. De manera similar a los datos de contractilidad, se calculó el coeficiente de varianza para las mediciones de calcio, y muestra una baja variabilidad dentro de las réplicas técnicas y biológicas (Figura 4C).
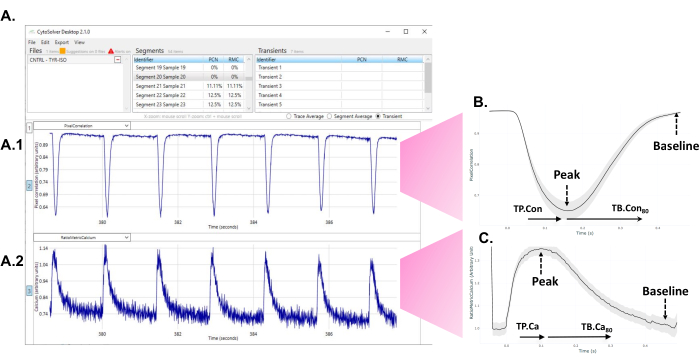
Figura 1: Uso inmediato de la herramienta de análisis de transitorios CytoSolver después del experimento para analizar los datos. (A) Un ejemplo de los transitorios aceptados (todos en azul) de un área medida dentro de un pozo. El panel A1 representa los transitorios contráctiles. El panel A2 representa los transitorios de calcio. (B) Transitorio de contractilidad promedio obtenido a partir de mediciones en tres pocillos de una ronda de diferenciación. A partir de cada transitorio único o promedio, los datos de diferentes puntos de tiempo hasta el pico (TP. Con) y el tiempo hasta el inicio (TB. Con) de la contractilidad transitoria. Como el inicio exacto de la contracción no siempre se puede determinar de forma inequívoca, el tiempo hasta el pico del 20% se toma como punto de partida para las mediciones del tiempo hasta el pico. Del mismo modo, el momento exacto en el que la señal vuelve a la línea de base es difícil de evaluar. Por lo tanto, el tiempo hasta la línea de base del 80% se utiliza para describir el tiempo de relajación. Aquí, TP. Con (tiempo hasta el pico - tiempo hasta el pico 20%) y TB. Se utiliza Con 80 (tiempo hasta la línea de base80% - tiempo hasta el pico). (C) Datos transitorios promedio de calcio obtenidos de mediciones en tres pocillos de una ronda de diferenciación. A partir de cada transitorio de calcio único o promedio, se pudieron extraer datos de diferentes puntos de tiempo de tiempo hasta el pico (TP.Ca) y tiempo hasta la línea de base (TB.Ca) de transitorios de calcio. Para las mediciones de tiempo hasta el pico, el punto de partida es el tiempo hasta el pico del 20 %, y para el tiempo hasta la línea de base, el punto final es el tiempo hasta la línea de base del 80 %. En este estudio, se utilizan TP.Ca (tiempo hasta el pico - tiempo hasta el pico 20%) y TB.Ca 80 (tiempo hasta la línea de base 80% - tiempo hasta el pico). Haga clic aquí para ver una versión más grande de esta figura.
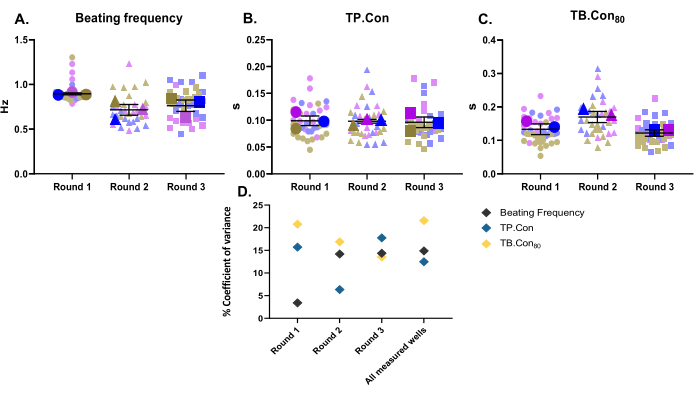
Figura 2: Mediciones de contractilidad basal realizadas en tres rondas diferentes de diferenciación. Tres réplicas biológicas y tres pocillos para cada ronda de diferenciación (es decir, tres réplicas técnicas). Tres símbolos principales para cada ronda de diferenciación representan el valor promedio de las áreas medidas (los símbolos de fondo en colores difuminados) dentro de cada pozo. Los datos se muestran como media ± SEM. Los datos relativos a la frecuencia de batido en reposo se representan en hercios y para TP. Estafa y tuberculosis. Con80, los datos están en segundos. (A) Frecuencia de batido en reposo. (B) Tiempo hasta el pico (TP. Contra). (C) Tiempo hasta la línea de base 80% (TB. Con80). (D) Para evaluar la variación entre los datos obtenidos en cada ronda y entre las tres rondas de diferenciación, se calculó el porcentaje de coeficiente de varianza utilizando los valores promedio de cada pozo. Haga clic aquí para ver una versión más grande de esta figura.
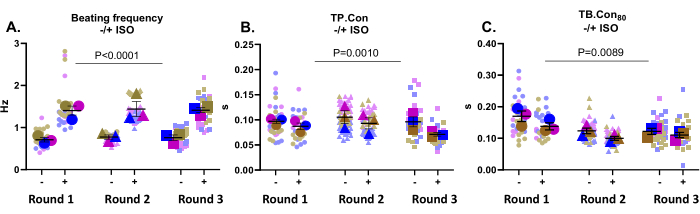
Figura 3: Mediciones de contractilidad al inicio (-) y después de la incubación con ISO (+) en tres pocillos de tres rondas de diferenciación. (A) La frecuencia de batido en reposo (-) y la frecuencia de batido después de la incubación con ISO (+) de 500 nM. (B) Tiempo hasta el pico (TP. Con) mediciones al inicio y después de la incubación con ISO. (C) Tiempo hasta la línea de base 80% (TB. Con80) al inicio y después de la incubación con ISO. Para evaluar el efecto de la ISO sobre los parámetros de contractilidad, se realizó un Anova de dos vías con corrección de Bonferroni. Los datos se muestran como media ± SEM. Los datos relativos a la frecuencia de batido en reposo se representan en hercios y para TP. Estafa y tuberculosis. Con80, los datos se representan en segundos. Haga clic aquí para ver una versión más grande de esta figura.
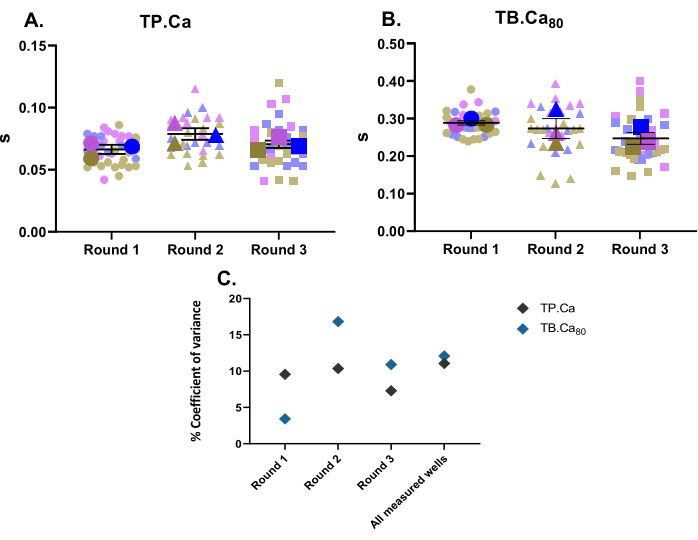
Figura 4: Mediciones transitorias de calcio de referencia realizadas en tres pocillos a partir de tres rondas de diferenciación . (A) Tiempo hasta el pico (TP.Ca) y (B) Tiempo hasta el inicio 80% (TB.Ca80) de los transitorios de calcio. Los datos se muestran como media ± SEM. TP.Ca y TB.Ca80 datos se representan en segundos. (C) Para evaluar la variación entre los datos obtenidos en cada ronda y entre las tres rondas de diferenciación, se calculó el porcentaje de coeficiente de varianza utilizando el valor promedio de cada pozo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este estudio, se describe un método para realizar mediciones transitorias de contractilidad y calcio en hiPSC-MCs y estudiar el efecto de los estresores/fármacos en estas células. Las mediciones de contractilidad, las mediciones radiométricas de calcio y la respuesta a ISO se realizaron en tres rondas diferentes de diferenciación como réplicas biológicas. Para cada réplica biológica, se realizaron mediciones en tres pozos como réplicas técnicas. La razón para realizar las mediciones de esta manera fue garantizar que se pudiera evaluar la variabilidad biológica y la variabilidad técnica de la muestra y la plataforma. Además de considerar el número adecuado de réplicas biológicas y técnicas, la condición de cultivo de hiPSC-MC podría desempeñar un papel importante para lograr resultados constantes y robustos. Es importante ser coherente con los criterios, como la edad de las MC-hiPSC, la composición del medio, las condiciones de resiembra y el tiempo de incubación del compuesto durante las mediciones. En este estudio, se necesitó un promedio de 568 ± 24 s para medir 11 áreas dos veces durante 10 s en un pocillo. Esto incluye un tiempo de incubación ISO de 79 ± 11 s. Esto se reduce a aproximadamente 10 minutos por pocillo, lo que debería permitir a los investigadores medir una placa completa de 24 pocillos en ~4 h. El control de clima se utiliza para mantener estable elCO2. Esto permite medir el efecto de los compuestos/factores estresantes en las hiPSC-CM de una manera rápida.
Para medir la función contráctil de las iPSC-MCs, existen varios sistemas basados en la optogenética13 o en la microscopía basada en vídeo sin marcadores 5,6. Los sistemas optogenéticos son bastante complejos y requieren técnicas especiales para obtener datos electrofísicos y/o de contractilidad. Otros sistemas se basan en el análisis post-hoc de los vídeos, que requiere mucho almacenamiento y carece de retroalimentación directa durante la adquisición de vídeos. Además, es difícil lograr una resolución temporal y espacial suficiente, lo que puede dar lugar a un submuestreo. Del mismo modo, las hiPSC-CM editadas con CRISPR/CAS-9 con reporteros fluorescentes7 pueden introducir efectos no deseados en el comportamiento de los cardiomiocitos. El uso de colorantes fluorescentes para mediciones de contracción-relajación también es un enfoque elegante, pero limita la realización de experimentos en la misma muestra durante un período más largo14.
Sin embargo, esta plataforma de medición basada en la óptica podría utilizarse para medir los tiempos de contracción-relajación sin utilizar ningún colorante fluorescente ni métodos invasivos. Sin embargo, como la correlación de píxeles no proporciona información espacial, este método no se puede utilizar para medir la fuerza de la contracción, sino que solo puede detectar de forma fiable los cambios en la velocidad de contracción y relajación. El sistema de medición introducido está controlado por temperatura y puede adquirir datos de calcio y contractilidad en tiempo real a una resolución de >200 fotogramas por segundo. Además, se almacena la ubicación de cada medición, lo que permite realizar mediciones emparejadas, lo que aumenta la potencia de los experimentos. Además, esta plataforma proporciona a los investigadores la capacidad de almacenar datos y analizarlos instantáneamente después del experimento. En general, este sistema de medición basado en la óptica muestra ser un método prometedor para estudiar los mecanismos patológicos celulares, puede evaluar el efecto de los compuestos sobre la funcionalidad de las hiPSC-CM y puede ser útil en el proceso preclínico en el cribado de fármacos.
Divulgaciones
EM es un empleado de CytoCypher BV. MH es el director ejecutivo de CytoCypher BV. El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Agradecimientos
Esta investigación ha sido financiada en parte por la subvención Eurostars Estars2 113937 CARDIOMYO (EM & DK), y la subvención NWO-VICI 91818602 (JV).
Materiales
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
Referencias
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados