Поддержание и оценка различных типов тканей и клеток глаза с помощью новой системы Pumpless Fluidics
In This Article
Summary
Анализ живых тканей в режиме реального времени позволяет получить важные функциональные и механические данные. В этом документе описываются протоколы и критические переменные, обеспечивающие точную и воспроизводимую генерацию данных с помощью новой многоканальной системы гидродинамики, не требующей накачки, которая поддерживает и оценивает широкий спектр моделей тканей и клеток.
Abstract
Многие модели in vitro , используемые для исследования функции тканей и клеточной биологии, требуют потока среды для обеспечения адекватной оксигенации и оптимальных клеточных условий, необходимых для поддержания функции и жизнеспособности. С этой целью мы разработали многоканальную систему проточной культуры для поддержания тканей и клеток в культуре и непрерывной оценки функции и жизнеспособности с помощью встроенных датчиков и/или сбора фракций утечки. Система сочетает в себе 8-канальное непрерывное оптическое измерение скорости потребления кислорода со встроенным коллектором фракций для одновременного измерения скорости выработки метаболитов и секреции гормонов. Несмотря на то, что он способен поддерживать и оценивать широкий спектр тканевых и клеточных моделей, включая островки, мышцы и гипоталамус, здесь мы опишем его принципы работы и экспериментальные препараты/протоколы, которые мы использовали для исследования биоэнергетической регуляции изолированной сетчатки мыши, пигментного эпителия сетчатки мыши (RPE)-хориоидной склеры и культивируемых клеток RPE человека. Инновации в конструкции системы, такие как безнасосный поток жидкости, значительно упростили работу многоканальной проточной системы. Показаны видеоролики и изображения, которые иллюстрируют, как собрать, подготовить инструмент к эксперименту и загрузить различные модели тканей/клеток в перифузионные камеры. Кроме того, излагаются и обсуждаются рекомендации по выбору условий для протокольных и тканеспецифичных экспериментов, включая установление правильного соотношения скорости потока к ткани для получения последовательных и стабильных условий культивирования и точного определения норм расхода и производства. Сочетание оптимального ухода за тканями и оценки нескольких параметров в режиме реального времени позволяет получить высокоинформативные наборы данных, которые будут иметь большое значение для исследований в области физиологии глаза и разработки лекарств для лечения нарушений зрения.
Introduction
Перифузионные системы имеют долгую историю в медико-биологических науках. В частности, для изучения секреторной функции островками они были использованы для характеристики кинетики секреции инсулина в ответ на секретагоги1. В дополнение к сбору фракций оттока для последующего анализа гормонов и метаболитов были установлены датчики реального времени, преимущественно для определения потребления кислорода 2,3,4. Широкомасштабные усилия по лучшему пониманию механизмов, опосредующих заболевания глаз, были ограничены отсутствием физиологически значимых методов оценки метаболической регуляции и дисрегуляции различных изолированных компонентов глаза, включая сетчатку, пигментный эпителиальный (РПЭ) сетчатки-сосудисто-склеру и культивируемые клетки РПЭ. Статические системы, предназначенные для культивируемых клеток, были адаптированы для ткани5, но ткани требуют потока для адекватной оксигенации. Проточные системы успешно и точно и воспроизводимо измеряют реакцию в режиме реального времени на скорость потребления кислорода (OCR) сетчаткой и РПЭ-склерой-склерой, а ткани остаются метаболически стабильными в течение более 8 ч, что позволяет создавать высокоинформативные протоколы, включающие несколько тестовых соединений 4,6,7,8,9 . Тем не менее, исторически сложилось так, что эксплуатация гидродинамических систем требовала специального оборудования и обученного технического персонала нестандартизированным методологиям. Такие системы не были приняты в качестве стандартной методологии в большинстве лабораторий. BaroFuse — это недавно разработанная жидкостная система, которая полагается не на насосы, а на давление газа для прохождения потока через несколько каналов и камер для тканей (рис. 1). Каждый канал непрерывно контролируется на предмет оптического распознавания символов, а отток собирается с помощью пластинчатого коллектора фракций для последующего анализа содержимого. Важно отметить, что тканевые перифузионные камеры для инструмента предназначены для размещения тканей различной геометрии и размеров.
Сердцем прибора является система гидродинамики, в которой поток направляется из герметичного резервуара под давлением через трубки малого внутреннего диаметра (ID) (обеспечивающие наиболее значительное сопротивление потоку в контуре жидкости) в камеры из стеклоткани, в которых находится ткань. Давление в модуле резервуара среды (MRM) подается регуляторами низкого и высокого давления, подключенными к газовому баллону, содержащему смесь газов (обычно 21% O 2, 5% CO 2, баланс N2), а резервуар герметизирован сверху модулем перифузионной камеры (PCM), в котором находятся узлы тканевой камеры (TCA). Расход регулируется длиной и внутренним диаметром резистивных трубок и настройкой давления регулятора низкого давления. Выпускные трубки, соединенные с верхней частью тканевых камер, подают жидкость либо в контейнер для отходов (который непрерывно взвешивается для автоматического определения расхода), либо в лунки 96-луночного планшета, управляемого фракционным коллектором. Система детектирования O2 измеряет срок службыO2-чувствительного красителя, нанесенного на внутреннюю сторону каждой из камер стеклянной ткани, расположенных ниже по потоку ткани. Эта информация затем используется для непрерывного вычисления OCR. Вся система гидродинамики находится в корпусе с регулируемой температурой, а газгольдер и сборник фракций являются основными компонентами прибора (рис. 2A). Наконец, программное обеспечение, на котором работает прибор, служит для управления его работой (включая подготовку и синхронизацию вводимых испытуемых соединений, систему измерения расхода и синхронизацию фракционного коллектора), а также для обработки и построения графиков данных OCR и других дополнительных измерений.
В данной работе мы описываем протоколы использования системы флюидики для анализа и оценки OCR и скорости продукции лактата (LPR) для различных изолированных компонентов глаза. LPR — это параметр, отражающий скорость гликолита, который в значительной степени комплементарен OCR, где пара отвечает за две основные ветви производства энергии из углеводов в клетке10. Поскольку подготовка ткани и ее загрузка в тканевые камеры лучше всего изучаются при просмотре процедуры, видео поможет проиллюстрировать несколько важных шагов, выполняемых во время настройки и операции, которые нелегко передать только с помощью текста.
Описание протокола разбито на 8 разделов, которые соответствуют разным фазам эксперимента (рис. 2Б): 1. предопытная подготовка; 2. приготовление/уравновешивание перифузата; 3. настройка прибора; 4. уравновешивание тканей; 5. протокол эксперимента; 6. поломка прибора; 7. Обработка данных; и 8. анализы фракций оттока.
Protocol
Все процедуры забора тканей у крыс и мышей были одобрены Комитетом по уходу за животными и их использованию при Вашингтонском университете.
1. Предопытная подготовка
ПРИМЕЧАНИЕ: Следующие задания выполняются не менее чем за сутки до начала эксперимента.
- Разработка протокола эксперимента
- Распределение тканей по каналам: Выберите модель ткани или клетки, которая будет размещена в 3 из 4 каналов с каждой стороны MRM. По одной тканевой камере с каждой стороны запускается без ткани, которая будет использоваться для коррекции исходного уровня.
- Расположите образцы, используя одну из двух типичных конструкций - различные протоколы тестовых соединений с каждой стороны (например, каналы на одной стороне MRM принимают тестовые соединения, в то время как каналы на другой стороне действуют как контрольные); один и тот же протокол введения тестового соединения с обеих сторон MRM, но разные ткани или модель ткани по сравнению с контрольной группой с обеих сторон MRM.
- Выбор скорости потока и количества тканей для оптимального измерения оптического распознавания символов: Регулируйте скорость потока до тех пор, пока изменение коэффициента жизненного цикла, умноженное на 100, не составит примерно 3.
ПРИМЕЧАНИЕ: Типичное количество ткани и соответствующие скорости потока приведены в таблице 1 для компонентов глаза, где прибор лучше всего функционирует при скорости потока в диапазоне от 6 до 80 мкл/мин/канал. - Расчет требуемого объема носителя/буфера: Рассчитайте объем носителя, который должен быть добавлен к каждой вставке MRM в начале эксперимента, как
ОбъемMRM = 30 мл + Продолжительность протокола (в мин) x Расход (в мл/мин) x 4 канала (уравнение 1)
Например, при 0,01 мл/мин MRM начальным объемом 60 мл позволит использовать протокол в течение 12,5 ч (где 30 мл будут исчерпаны, а 30 мл останутся), тогда как при 0,04 мл/мин 90 млMRM начального объема позволит использовать протокол на 6 ч (с оставшимся 30 мл). - Протокол введения тестовых соединений: Выберите испытуемые соединения для оценки, концентрацию для тестирования (обычно выбираемую для получения почти максимального отклика или в качестве зависимостей от концентрации) и продолжительность воздействия. Учитывайте растворимость и составляйте запасы в желаемом растворителе, таком как вода, ДМСО или этанол.
- Выберите время инъекций и последующих инъекций таким образом, чтобы реакция достигла устойчивого состояния до добавления следующего препарата. При повторении протоколов подбирайте время инъекций таким образом, чтобы можно было усреднить несколько временных курсов.
ПРИМЕЧАНИЕ: Соединения, используемые здесь, взяты из предыдущего митохондриального (Mito) стресс-теста 11 , и как олигомицин, так и карбонилцианид 4-(трифторметокси)фенилгидразон (FCCP) требуют ДМСО как в исходных растворах, так и в конечном перифузате. - Время отбора проб на выходе: Выберите желаемые интервалы сбора фракций (от 1 до 60 мин/образец), при которых выбирается более высокая частота выборки для быстрых изменений, а более длительные интервалы времени выбираются по мере приближения к установившемуся режиму. Используйте достаточный объем лунки (от 0,3 до 1,5 мл), чтобы избежать переполнения во время интервала отбора проб (выбирайте объемы, превышающие расход x интервал времени).
ПРИМЕЧАНИЕ: Время отбора проб будет варьироваться в зависимости от выбора протокола, но для стресс-теста Mito мы обычно используем 5-минутные интервалы во время базового уровня и 15-минутные интервалы во время инъекций (-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, где каждый раз является началом интервала отбора проб). - Введите выбранные значения для тестовых соединений и сбора дробей, описанные выше, в пользовательский интерфейс (UI), который генерирует графическое представление этой информации. Экспортируйте и распространяйте файлы для групповой оценки и обсуждений (дополнительный рисунок 1).
- Разложите по полочкам принадлежности и расходные материалы
- Перечислите расходные материалы, предоставленные и предварительно упакованные производителем, которые включают: TCA (упаковка из 8 штук), выпускные трубки (упаковка из 8 пробирок), трубки для впрыска тестового состава (2), щипцы, зажимы для трубок (3), MRM, вкладыши MRM (2), мешалки (2) и продувочные трубки в сборе (размещены в шкафу биологической безопасности).
- Не используйте повторно одноразовые детали, контактирующие с жидкостью, так как это приведет к увеличению количества неудачных экспериментов. Повторно используйте щипцы и мешалки, очищая и автоклавируя их между экспериментами.
2. Приготовление и уравновешивание перифузата (время: 30 мин, не включая время инкубации)
- Приготовьте среду или бикарбонатный буфер Кребса-Рингера (KRB) накануне, основываясь на расчетах из уравнения 1, обычно 200 мл, а затем инкубируйте в течение ночи в инкубаторе с температурой 39 °C/5% CO2 в колбах для культур тканей T225, не более 90 мл в каждой колбе.
- При использовании промышленно приготовленного KRB или среды (подогретой до комнатной температуры) приготовьте перифузат утром в день эксперимента и поместите в инкубатор с 5%-нымСО2 не менее чем на 1 ч. Все растворы готовят асептически.
ПРИМЕЧАНИЕ: Все жидкости и части жидкостной системы, контактирующие с жидкостью, стерильны в начале эксперимента. Однако сборка системы и загрузка ткани осуществляется открытым воздухом.
3. Уравновешивание температуры и растворенного газа для настройки прибора (Время: 75 мин)
- Крепление насосно-компрессорных труб к MRM
- Поместите MRM и пакет жидкости на стол рядом с прибором. Убедитесь, что зажимы для трубок (3), мешалки (2) и щипцы уже находятся на лотке для инструментов.
- Поместите неиспользованную вставку MRM с мешалкой с каждой стороны MRM (см. рисунок 3).
- Прикрепите TCA к отверстиям для впрыска на обоих концах MRM так, чтобы конец трубки располагался непосредственно над мешалкой. Убедитесь, что более длинный из двух узлов впрыска тестовой смеси находится на задней стороне MRM.
- Затем присоедините линию подачи газа и узел продувочных трубок к задним и передним свободным отверстиям соответственно (см. Рисунок 4A).
- Размещение узлов MRM/трубок в корпусе
- Поместите MRM (с прикрепленными трубками в сборе) в нагреватель MRM (Рисунок 4B).
- Поместите четыре трубки в пазы стенок в основании корпуса (по две с каждой стороны) так, чтобы они выступали наружу корпуса после установки среднего корпуса.
- Закрепите MRM между зажимами, затянув два колеса на стойке детектора.
- Подайте более длинный узел впрыска тестовой смеси, выступающий из задней части корпуса, через две направляющие труб сбоку корпуса так, чтобы отверстие трубок было направлено вперед (Рисунок 4C).
- Зажмите каждый из закрытых узлов впрыска тестовой смеси.
- Сборка корпуса и активация регуляторов температуры
- Переведите удлинитель, который подает питание на все электрические устройства в корпусе, в положение ON. Вентилятор на стойке датчика включится, и контроллер температуры MRM должен загореться, показывая установленное значение 38 °C (рис. 5).
- Включите мешалки на 70 об/мин с помощью пользовательского интерфейса, чтобы убедиться, что мешалки вращаются плавно. После правильного перемешивания выключите мешалки.
- Поместите среднюю часть корпуса поверх основания.
- Подсоедините кабель в средней части корпуса к кабелю от электрической коробки, чтобы включить питание на рычажный переключатель регулятора температуры окружающей среды и подать питание на нагреватель температуры окружающей среды.
- Накройте корпус крышкой, и дисплей верхнего регулятора температуры (регулятора температуры окружающей среды) загорится и покажет 36 °C. Запустите таймер на 30 минут, время, необходимое для того, чтобы нагреватель MRM достиг заданной температуры.
- Вставка TCA в PCM
- Используйте инструмент для вставки TCA, чтобы вставить каждый из 8 TCA в отверстия PCM, сильно нажимая на адаптер лицевой стороной инструмента для вставки до тех пор, пока верхняя часть втулки трубки, обернутой вокруг тканевой камеры, не коснется поверхности, очерчивая отверстия в PCM.
- Полностью вставьте один TCA, прежде чем вставлять следующий. Отложите частично собранный PCM в сторону рядом с распоркой PCM и 6 винтами.
ПРИМЕЧАНИЕ: Неполное введение ТСА предотвратит достижение заданного давления в головном пространстве, и перифузат не будет течь.
- Заполнение двух вкладышей в MRM предварительно уравновешенным перифузатом
- Для этого через 30 минут после сборки корпуса и достижения температуры MRM перенесите предварительно уравновешенный перифузат в предварительно нагретую вставку MRM, осторожно дозируя жидкость по бокам с помощью пипетки объемом 50 мл.
ПРИМЕЧАНИЕ: Эти шаги, а также шаги, описанные в разделе 3.6, должны быть выполнены немедленно, чтобы избежать переноса газа между перифузатом в MRM и атмосферой.
- Для этого через 30 минут после сборки корпуса и достижения температуры MRM перенесите предварительно уравновешенный перифузат в предварительно нагретую вставку MRM, осторожно дозируя жидкость по бокам с помощью пипетки объемом 50 мл.
- Сборка MRM/PCM для создания газонепроницаемого уплотнения и позиционирование детектораO2
- Установите PCM на MRM, вставив трубки сопротивления TCA, исходящие из нижней части PCM, во вставки MRM, по 4 с каждой стороны делителя MRM. Расположите PCM таким образом, чтобы тканевые камеры могли упираться в детекторO2 после его позиционирования.
- Закрепите PCM и опорную скобу PCM 6 винтами с помощью электрической отвертки.
- Закрепите TCA внутри опорных ребер PCM с помощью эластичной ленты, натянутой вокруг ребер PCM на уровне резиновых прокладок (Рисунок 6).
- Расположите детектор O2 на подставке детектора так, чтобы его лицевая сторона упиралась в ребра PCM. Убедитесь, что пары светодиод/фотоприемник совпадают сО2-чувствительным красителем в камерах тканей. При необходимости отрегулируйте боковые направляющие детектора Ø2, ослабив установочные винты со стороны держателя детектораØ2.
- Установите крышку на корпус.
- Уравновешивание газа в головном пространстве в МРМ перифузатом
- Когда клапан высокого давления полностью закреплен и закрыт, откройте вентиль бензобака, повернув вентиль баллона в верхней части бака против часовой стрелки.
- Отрегулируйте регулятор высокого давления до давления 10 фунтов на квадратный дюйм с помощью ручки на регуляторе.
- Создайте давление в MRM, установив регулятор низкого давления на 1,0 фунта на квадратный дюйм (Рисунок 7A).
- Разжмите продувочную трубку (Рисунок 7B), чтобы газ из бака заменил воздух в свободном пространстве MRM (инжекторы испытательного компаунда остаются зажатыми) в течение 15 минут. Подтвердите поток газа, погрузив конец продувочной трубки в стакан с водой, чтобы наблюдать за пузырьками.
- После подтверждения потока запустите детекторO2 , как описано ниже в разделе 3.8.
- Через 15 минут включите мешалку на 70 об/мин и оставьте работать до конца эксперимента. Еще через 15 минут зажмите узел продувочной трубки (Рисунок 7C).
- Снизьте давление на регуляторе низкого давления до рабочего давления, которое обеспечивает желаемый расход жидкости (как указано на экспериментальной упаковке - обычно в пределах 0,5-0,7 фунта на квадратный дюйм). Если скорость потока превышает 20 мкл/мин, временно установите давление на 0,3 фунта на квадратный дюйм, чтобы дать время загрузить ткань без переполнения камер. В этом нет необходимости, если ткань загружается в течение 15 минут после установки зажима.
ПРИМЕЧАНИЕ: Не позволяйте буферу стекать по внешней стороне тканевой камеры, так как жидкость может мешать восприятиюO2 .
- Запуск детектораО2
- Активируйте программное обеспечение детектора O2 на ноутбуке, нажав на значок с надписью «Детектор кислорода».
- Как только программа откроется (дополнительный рисунок 2), убедитесь, что выбран правильный COM-порт. При необходимости COM-порт можно определить, отключив и подключив детектор O2 к компьютеру, чтобы отобразился номер порта. Если COM-порт отключен во время работы приложения, то приложение необходимо закрыть и снова открыть перед использованием.
- Нажмите «Пуск», затем «Запись» (и сохраните данные в папке резервной копии). Затем нажмите кнопку График.
- Измените среднее значение в левом нижнем углу графика жизненного цикла на 5 (что указывает программе рассчитать скользящую среднюю с 5 последовательными точками). По прошествии минуты и отображения первой точки данных на экране графика нажмите кнопку Автомасштабирование.
4. Период нагрузки и равновесия тканей (Время: 90 мин)
- Позиционирование фритты в тканевых камерах
- Снимите крышку и средние части корпуса.
- После того, как перифузат в тканевых камерах поднимется выше верхней части предварительно расположенной фритты, надавите на фритту с помощью фритты, слегка постукивая по верхней части фритты, чтобы удалить все пузырьки воздуха, которые образовались под или внутри фритты.
- Расположите фритты примерно на 0,25 дюйма выше дна тканевой камеры.
- Загрузка ткани в тканевые камеры
- Как только уровень среды достигнет 0,5 дюйма от верха, загрузите ткань в камеру.
- Нагрузка на сетчатку или РПЭ-склероидную склеру: Соберите сетчатку или РПЭ-склеру, как описано в 6. Чтобы загрузить ткань, используйте щипцы с тонким концом, чтобы аккуратно поместить ткань в каждую камеру, стараясь не свернуть ткань, и используйте салфетку, чтобы жидкость из тканевой камеры не капала на датчикO2 . Понаблюдайте за тем, как ткань опускается к фритте и на нее.
ПРИМЕЧАНИЕ: Между забором ткани и загрузкой ткани в камеры убедитесь, что травма ткани предотвращена, не оставляйте ткань в буфере/среде на основе бикарбоната вне инкубатора более чем на 10 минут и убедитесь, что ткань купается в достаточном количестве буфера/среды (не менее 1 мл/10 мг ткани), чтобы предотвратить гипоксию ткани и предотвратить воздействие воздуха. - Загрузка ячеек РПЭ на мембраны трансвелла: Подготовьте ячейки РПЭ, как описано ранее 12 и в Дополнительном файле 1. Пассажные клетки с использованием 0,25% трипсина-ЭДТА и семян на полиэтилентерефталате, фильтры с трековым травлением (вставки для клеточных культур, размер пор 0,4 мм) при минимальной концентрации 2,0 x 105 клеток/см2. В день эксперимента разрежьте мембраны на три полоски одинаковой ширины и нагрузите щипцами в тканевые камеры (см. рис. 8А).
- Присоединение выпускных трубок к тканевым камерам
- Извлеките узлы отводящих трубок из упаковки и поместите сепаратор отводящих трубок на кромку средней части корпуса так, чтобы переходники для отводящих трубок находились внутри корпуса (Рисунок 8B, C).
- Стараясь не надавливать слишком сильно на ТЦА (иначе они оторватся от МРМ), прикрепите переходники дренажных трубок к верхней части ТЦА тканевых камер (Рисунок 8D). Установите на место середину корпуса и снова подсоедините кабель контроля температуры окружающей среды.
- Перед заменой крышки корпуса убедитесь, что компоненты жидкостной системы внутри корпуса, включая детекторO2 , PCM, камеры для тканей, выпускные трубки, MRM и нагреватель, расположены правильно, как показано на рисунке 8E.
- Установите на место крышку корпуса. Пропустите восемь выпускных трубок через направляющий рычаг сборника фракций.
- Активация сборщика фракций
- Убедитесь, что сборник фракций расположен по центру относительно правой стенки корпуса и держателя выпускной трубки: левая опора основания сборника фракций должна упираться в край стенки корпуса.
- На ноутбуке нажмите ярлык пользовательского интерфейса , и откроется страница с информацией об эксперименте (дополнительный рисунок 3 вверху).
- Заполните информацию в соответствующих полях на странице с информацией об эксперименте (это можно сделать до начала эксперимента), а затем щелкните страницу Flow & Fraction Collector вверху (дополнительный рисунок 3 , внизу).
- Настройка параметров для автоматического измерения расхода
- Выберите желаемое время интегрирования в раскрывающемся меню времени сбора выборки в верхней средней части, которое уравновешивает желаемую точность (которая пропорциональна времени интегрирования) и временное разрешение.
- Если в эксперименте не будет собрано ни одной фракции оттока, то нажмите кнопку «Пуск» и перейдите к разделу 4.7. Если будут собираться фракции оттока, то выполните действия, описанные в разделе 4.6.
- Сбор фракций оттока
- В программном обеспечении пользовательского интерфейса установите флажок Собирать дроби? на странице «Информация об эксперименте» или на странице «Сборщик потоков и фракций». Затем нажмите кнопку Compute FC Settings .
- Когда откроется новое окно, заполните время первой закачки в протоколе (определяется как время = 0) и расход на канал, а также временные интервалы для каждой пробы. Затем нажмите кнопку Вычислить.
- После того, как интервалы сбора будут проверены, нажмите « Создать и начать».
- Измерение расхода для отдельных каналов (опция)
- Если необходимо измерить расход отдельных каналов (которые в нормальных условиях изменяются всего на несколько процентов), взвесьте восемь (или меньше) пробирок для микроцентрифуг и запишите их вес.
- Установите держатель пробирок, содержащий предварительно взвешенные пробирки для микроцентрифуг, на каретку пластины. Нажмите «Измерить расход вручную » в разделе «Другие утилиты».
- Выберите продолжительность измерения и нажмите кнопку Создать шаблон. Закройте окно и нажмите кнопку Начать. Сборник фракций будет собирать жидкость из выпускных трубок в течение всего времени измерения, а затем манипулятор вернется в исходное положение.
- Взвесьте пробирки микрофуги после сбора и используйте разницу в весе, деленную на продолжительность измерения, для расчета расхода (где 1 мг = 1 мкл).
- Стабилизация базового уровня
- После того, как ткань и/или клетки были загружены в тканевые камеры, дайте системе уравновеситься в течение 90 минут, чтобы установить плоский базовый уровень потребленияO2 , после чего можно вводить первое испытуемое соединение (считается временем = 0).
- За 30 минут до первой инъекции введите среднее значение последних 3 FR на канал на странице впрыска для приготовления инъекций тестового соединения.
5. Протокол эксперимента (Время: 2-6 ч)
ПРИМЕЧАНИЕ: После стабилизации базового уровня следующими задачами являются впрыскивание испытуемых соединений и замена пластин на сборнике фракций, если будет использоваться более одной.
- Приготовление испытуемого состава для инъекций
- Введите названия соединений, желаемые концентрации (конечные и исходные растворы) и время впрыска испытуемых соединений в таблицу в пользовательском интерфейсе на странице Впрыск. Подтвердите информацию, отображаемую в программе, включая объемы в MRM, оставшиеся во время инъекций, и количество исходного раствора, которое необходимо ввести для достижения желаемых концентраций (дополнительный рисунок 4).
- Чтобы рассчитать, сколько перифузата и запаса необходимо для инъекции, заполните белые поля таблицы впрыска и нажмите кнопку Рассчитать. Используя расчетные значения, перед впрыском разбавляют исходный раствор испытуемого соединения перифузатом так, чтобы объем вводимого состава составлял 5% от объема в МРМ после впрыска.
- Приготовьте каждую испытуемую смесь, смешав исходный раствор и перифузат. Загрузите шприцы не менее чем за 10 минут до времени инъекции и держите в инкубаторе CO2 (при температуре 37-40 °C) до тех пор, пока они не будут готовы к инъекции.
- Инъектирование тестовых соединений
- Подсоедините шприц, содержащий испытуемое соединение, к линиям для инъекций (Рисунок 9A). Разжмите мягкую трубку, ведущую к линии впрыска, и медленно вводите испытуемые соединения (Рисунок 9B) со скоростью примерно 3 мл/мин. Снова зажмите трубку на линии инъекции, а затем извлеките шприц (Рисунок 9C); Повторите то же самое для другой стороны MRM.
- После введения каждого тестового соединения подготовьте каждое последующее тестовое соединение для инъекции в соответствии со страницей инъекции пользовательского интерфейса.
- Определение входящего сигналаO2 для каждого канала
- В конце каждого эксперимента вводят ингибитор дыхания KCN (3 мМ), чтобы определить входящий сигнал времени жизни для каждого канала, который используется для коррекции изменения базового срока службы датчика и немитохондриального потребления кислорода.
6. Окончание эксперимента и разрушение системы (Время: 30 мин)
- Сохранение данных о кислороде
- Нажмите кнопку «Сохранить » в левом верхнем углу окна графика в программном обеспечении детектора кислорода; Назовите файл и сохраните его в папке, где он будет храниться. Нажмите кнопку «Остановить запись » в главном окне, чтобы сохранить файл резервной копии.
- Сохранение файла экспериментальной информации пользовательского интерфейса
- Нажмите кнопку Сохранить профиль в левом верхнем углу страницы общего пользовательского интерфейса. Назовите файл и сохраните его в папке, где будет храниться файл. На странице дробей и потоков пользовательского интерфейса щелкните раскрывающееся меню Сервис и выберите Сохранить. Сохраните сгенерированное имя или выберите другое и сохраните файл там, где хотите. При необходимости есть файлы резервных копий, к которым можно получить доступ и сохранить.
- Разборка инструмента
- Поскольку KCN является летучим, утилизируйте сборки жидкостей в вытяжном шкафу; вылейте среду из лотка для отходов MRM и FC в контейнер для отходов и тщательно промойте вкладыши MRM и мешалки водой. Содержимое контейнера для отходов (содержащего KCN) высыпать в маркированный контейнер для химических отходов для последующей утилизации по химической безопасности. Перед следующим экспериментом тщательно очистите и автоклавируйте мешалки и щипцы.
7. Обработка данных (Время: 15-45 мин)
- Откройте приложение обработчика данных на компьютере Mac или PC. Выберите файл данных .csv, созданный экспериментом. Если протокол этого эксперимента похож на ранее проанализированный эксперимент, выберите этот файл настроек и нажмите кнопку Следующий шаг. В противном случае просто нажмите кнопку Следующий шаг , чтобы начать ввод параметров эксперимента.
- Заполните различные параметры эксперимента. При определении контрольной точки времени выберите момент времени непосредственно перед тем, как KCN вступит в силу и значения Lifetime уменьшатся. Выберите эту точку с помощью ползунка или введя значение времени в поле.
- Нажмите кнопку Рассчитать, чтобы построить графики OCR в соответствии с уравнением 2:
OCR = ([O2]вход - [O2]выход) x FR = (217 нмоль/мл - [O2]выход) x FR/тканевая основа (уравнение 2)
где концентрация О2 в KRB при равновесии с 21%O2 при 37 °C составляет 217 нмоль/мл, FR – скорость потока (в мл/мин), тканевая основа – количество ткани, загруженной в камеру (т.е. количество клеток сетчатки, РПЭ-хориоз-склеры или РПЭ). - Сохраните графики в виде файлов .pdf, нажав кнопку «Экспорт графика ». Постройте график OCR либо в виде абсолютных значений, либо в виде доли стационарного значения, установив флажки, соответствующие тестовому соединению, которое должно быть установлено в 1 на странице настроек редактирования.
8. Анализы фракций оттока
- Если образцы не могут быть взяты сразу после эксперимента, поместите планшеты при температуре 4 °C, если анализ проводится на следующий день, или заморозьте, если они хранятся дольше. Если планшеты замерзли, то образцы размораживают при 4 °C (чтобы образцы оставались холодными).
- После того, как анализы выполнены на выбранных фракциях утечки, столбцы данных (по одному на канал) вводятся в файл .csv с временем (в мин) в крайнем левом столбце и концентрацией в правом (в нмоль/мл или нг/мл); Ссылка в программе обработки данных при нажатии загружает шаблон.
- Загрузите этот файл в обработчик данных, чтобы рассчитать и построить график данных.
Representative Results
Чтобы проиллюстрировать разрешение данных, полученных из изолированных компонентов глаза, OCR и LPR измеряли с тремя типами тканей (сетчатка, клетки RPE-choroid-склеры и RPE) в соответствии с широко используемым протоколом (митохондриальный стресс-тест10; Рисунок 10, Рисунок 11 и Рисунок 12). Количество ткани, используемой для каждой ткани, показано в таблице 1. Данные были обработаны и построены с помощью программного пакета, который был разработан для системы fluidics. Подготовка сетчатки и РПЭ-скуроидной склеры относительно проста и занимает менее 20 минут для каждого типа ткани. OCR был постоянным в течение всего времени введения исследуемых соединений, что указывает на стабильное здоровье и функцию ткани и подтверждает валидность метода (рис. 10). После валидации для каждого типа тканей мы не обнаружили необходимости проводить контроль, в котором не вводились тестовые соединения для каждого эксперимента. В соответствии с данными, полученными с использованием более традиционных методов перифузии 6,8,13, снижение OCR в ответ на олигомицин и увеличение OCR в ответ на FCCP. Изменения LPR были противоположны тем, которые наблюдались для OCR: олигомицин увеличивал LPR, который затем снижался (но незначительно) в ответ на FCCP (рис. 11). Для сравнения статистической значимости эффекта каждого последовательного испытуемого соединения были проведены t-критерии (которые рассчитываются автоматически программным обеспечением, поставляемым в комплекте с прибором). Поскольку цель статьи состояла в том, чтобы описать, как использовать этот метод, количество выполненных репликаций не всегда было достаточно высоким, чтобы обеспечить статистическую значимость. В целом, однако, когда количество репликаций составляло 3 или более, влияние FCCP и олигомицина как на OCR, так и на LPR было значительным.
Клетки RPE ранее не анализировались с помощью проточных систем, но реагировали аналогично RPE-choroid-scler (что согласуется с мнением о том, что большая часть OCR обусловлена клетками RPE; Рисунок 11). Эти наглядные примеры подчеркивают способность системы поддерживать жизнеспособность тканей, что отражается стабильностью оптического распознавания символов в каналах управления, а также высоким отношением сигнал/шум при изменениях оптического распознавания символов величины, индуцированной олигомицином и FCCP, которая составляла более 100 к 1. Кроме того, анализы фракций оттока могут быть использованы для корреляции скорости поглощения или образования широкого спектра соединений, обменивающихся с внеклеточной жидкостью, которые являются комплементарными для оптического распознавания символов (в данном случае LPR). Эти особенности прибора позволили провести точную количественную оценку характерных различий в тканевых реакциях между типами тканей, проводимую параллельно. OCR с помощью клеток RPE-choroid-sclera и RPE последовательно более чувствительны к олигомицину, чем клетки сетчатки (рис. 11 и рис. 12), хотя для РПЭ-склероидной склеры продолжительность воздействия FCCP была недостаточной для достижения устойчивого состояния. Момент, который следует учитывать, возник при использовании ДМСО в качестве растворителя. При более высоких концентрациях (0,2%) ДМСО оказывал преходящее влияние на оптическое распознавание текста сетчатки (предположительно, отражая эффект изменения осмотического давления, вызванного влиянием ДМСО на проницаемость мембраны).
Исходя из предположения, что KCN полностью ингибирует дыхание своим прямым действием на цитохром-с-оксидазу, OCR в конце воздействия KCN устанавливается равным 0, и все значения OCR рассчитываются на основе изменения относительно значения KCN. OCR может происходить независимо от дыхательной цепи и цитохром-с-оксидазы. Тем не менее, величина этого вклада в общее оптическое распознавание символов, как правило, не превышает нескольких процентов (данные не показаны), а длительный период времени, в течение которого ткань подвергается воздействию KCN, гарантирует, что субстраты оксидаз, которые не являются частью цепи переноса электронов, истощены.
Статистический анализ
Были показаны одиночные эксперименты, как показано на рисунках, но с несколькими каналами, которые были усреднены. Затем данные были представлены в виде среднего значения ± стандартной ошибки (SE; рассчитывается как SD/√n).
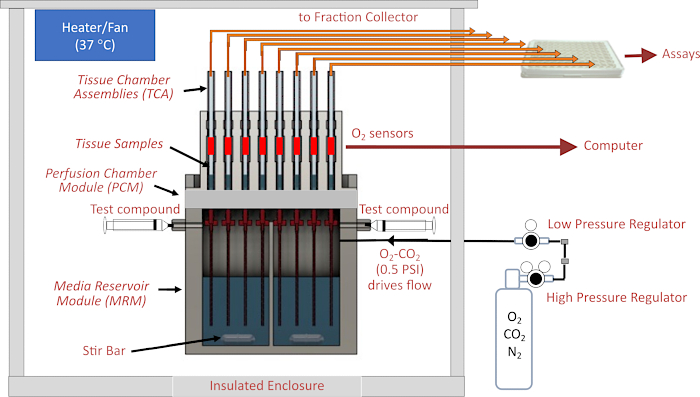
Рисунок 1. Схема системы гидродинамики/оценки. Основные компоненты включают в себя корпус, элементы контроля температуры, системы гидродинамики и тканевой камеры, регулирование давления газа в головном пространстве над перифузатом, контроль коллектора фракций/расхода, а также детекторыO2 . Сокращения: MRM = модуль резервуара среды, PCM = модуль перифузионной камеры, TCA = узел тканевой камеры. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2. (А) Изображение основных компонентов прибора. Основные компоненты состоят из газгольдера (регуляторов давления), корпуса, сборника фракции и компьютера. (Б) Экспериментальная блок-схема, показывающая основные категории шагов и время, необходимое для их выполнения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3. Вид на MRM. MRM показан со вставкой MRM (слева) и мешалками (справа), размещенными в нижней части вставок MRM (расположенных с каждой стороны разделителя MRM). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4. Сборка насосно-компрессорных труб и сборка трубок для продувки в MRM. (A) Испытайте узел нагнетательной трубки соединения и узел трубки продувки, прикрепленные к портам MRM. (В-В) Узел впрыска испытательного компаунда и узел продувочной трубки (B) размещены в канавке в передней части корпуса (C). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5. Включение регулятора температуры MRM. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 6. Тканевые камеры и бензобак. Размещение детектора O2 на подставке детектора (которая также поддерживает MRM и PCM) и размещение ленты вокруг ребер PCM, которые помогают закрепить камеры тканей на месте. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 7. (А) Регуляторы высокого и низкого давления на бензобаке. (В-В) Продувочная трубка. Продувочная трубка позволяет свободному пространству в MRM очищаться от воздуха и заполняться газом из расходного бака. На рисунках показана открытая продувочная трубка (B) и закрытая продувочная трубка (C). Узел впрыска тестового компаунда остается закрытым в течение всего процесса продувки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 8. Тканевая камера и настройка оттока. (A) Размеры мембраны Transwell после того, как она разрезана на три полосы одинаковой ширины. (B) Многотрубная опора для вылива. (C) Многотрубная опора для отвода, расположенная на кромке корпуса, с переходниками трубок рядом с тканевыми камерами. (D) Изображение выпускных трубок в сборе, прикрепленных к тканевым камерам. (E) Вид с высоты птичьего полета на корпус без крышки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 9. Впрыск компаунда в МРМ. Введение испытуемого соединения через инъекционный порт в MRM с помощью шприца объемом 5 мл. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
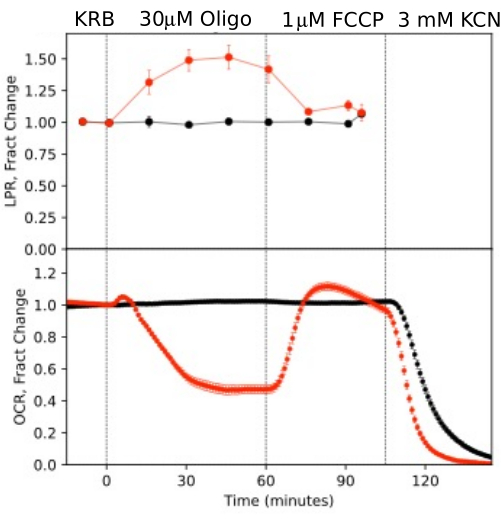
Рисунок 10. Кривые OCR и LPR в ответ на испытуемые соединения. OCR и LPR по сетчатке, выделенной у мышей (1 сетчатка/канал) в ответ на присутствие или отсутствие (контроль) исследуемых соединений по показаниям. Каждая кривая представляет собой среднее арифметическое 6 повторений из одного эксперимента (столбцы ошибок являются SE; p-значения вычисляются путем выполнения парного t-критерия, сравнивающего значения установившегося состояния для каждого тестового агента с значениями предыдущего тестового агента). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
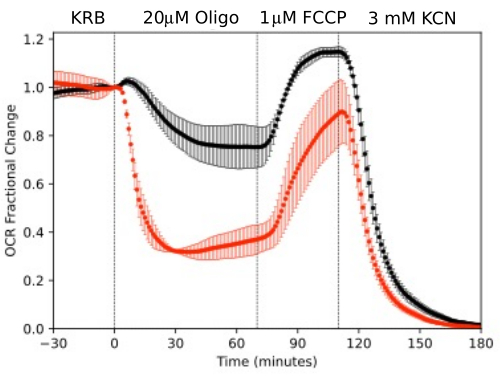
Рисунок 11. Кривые оптического распознавания символов. OCR с помощью РПЭ-склеры-склеры и сетчатки, выделенных у мышей (1 сетчатка или 2 РПЭ-склероид-склера/канал), измеренных параллельно в ответ на тестируемые соединения, как указано. Данные представляют собой среднее значение репликаций из одного эксперимента (n = 2 и 4 для RPE-скуроидной склеры и сетчатки соответственно; p-значения рассчитываются путем выполнения парного t-критерия, сравнивающего значения в установившемся состоянии для каждого тест-агента с значениями предыдущего тест-агента). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
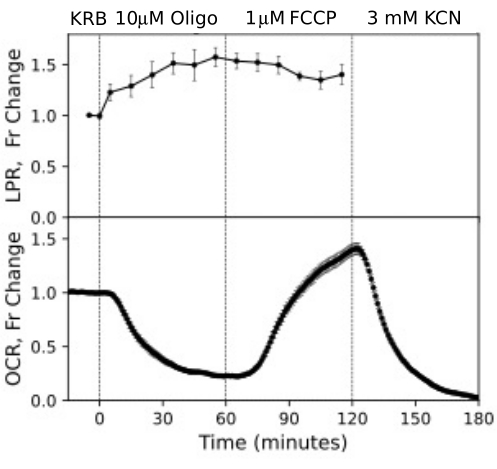
Рисунок 12. Кривые OCR и LPR из ячеек RPE. OCR и LPR из ячеек RPE, прикрепленных к трансвелл-мембранам, которые были разрезаны на полоски и загружены в перифузионные камеры. Данные представляют собой среднее значение репликаций из одного эксперимента (n = 3, с 1,5 мембранами на канал (360 000 клеток/канал); p-значения вычисляются путем выполнения парного t-критерия, сравнивающего значения стационарного состояния для каждого тест-агента с значениями предыдущего тестового агента). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| ТКАНЬ/КЛЕТКА | Сумма/канал | РАСХОД: мл/мин |
| Сетчатка (мышь) | 1 | 0.025 |
| RPE-choroid-scler (мышь) | 2 | 0.02 |
| Ячейки РПЭ на мембранах Transwell | 360 000 ячеек (4 x 1/3 фильтрующие полоски) | 0.016 |
Таблица 1. Рекомендуемые эксплуатационные характеристики для различных тканей.
Дополнительный рисунок 1. Графическое представление экспериментального дизайна. Сроки и состав воздействия исследуемых соединений, а также сроки сбора фракций. Приращение концентрации (Conc Inc) - это изменение концентрации, которое должно быть реализовано. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2. Пользовательский интерфейс при запуске. Пользовательский интерфейс стартового окна программного обеспечения для обнаружения Ø2, которое отслеживаетØ2 в тканевых камерах, вставленных в PCM. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3. Пользовательский интерфейс для настройки эксперимента. Пользовательский интерфейс для ввода экспериментальной информации (слева) и выбора времени сбора фракций утечки (справа). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4. Пользовательский интерфейс страницы внедрения. Страница впрыска, на которой рассчитываются объемы впрыска на основе желаемых концентраций испытуемого соединения и объема, оставшегося в MRM. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Методы подготовки образцов тканей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
В связи с важностью биоэнергетики во всех аспектах функционирования клеток и поддержания различных компонентов глаза, существует острая потребность в методах изучения его регуляции. В частности, нервная сетчатка и РПЭ зависят от метаболизма как для генерации энергии, так и для внутри- и межклеточной передачи сигналов14,15,16,17. Из-за своей высокой окислительной способности изолированные ткани глаза плохо поддерживаются в статических условиях18,19, и поэтому для изучения изолированных компонентов глаза требуются проточные системы, способные как поддерживать, так и оценивать метаболические процессы. Система гидродинамики была разработана для получения данных OCR и LPR из широкого спектра типов тканей, и в этой статье мы представили подробные протоколы, которые, как было установлено, дают оптимальные результаты.
Основным фактором, определяющим получение надежных данных с использованием проточной системы, является предварительное уравновешивание среды/буфера на основеСО2 при 39 °C (чтобы гарантировать, что перифузат не будет перенасыщен растворенным газом, который будет дегазироваться во время эксперимента). В частности, среда или буфер KRB, хранящиеся при 4 °C, будут перенасыщены относительно 37 °C и будут дегазироваться во время эксперимента, если время предварительного уравновешивания будет недостаточным. Кроме того, ткань, загруженная в тканевые камеры, не должна быть травмирована из-за неправильной изоляции ткани из-за разрыва или неполного отделения ткани, или из-за слишком длительного воздействия атмосферного воздуха на ткань в небольшом количестве буфера на основе бикарбоната. Контроль температуры, стабильность потока и надежность обнаруженияO2 имеют небольшую изменчивость, и эти факторы не вносят существенного вклада в частоту отказов.
Прибор имеет восемь проточных каналов/тканевых камер, которые работают одновременно, которые подаются перифузатом из двух резервуаров, по четыре тканевые камеры для каждого резервуара. Для получения наиболее точных временных ходов OCR кинетические кривые корректируются камерами, которые не загружены тканями. Таким образом, типичный протокол эксперимента включает в себя две группы по три тканевые камеры. Протоколы, как правило, делятся на две категории: во-первых, это различные протоколы тестовых соединений с каждой стороны (например, лекарство/транспортное средство с одной стороны MRM и просто транспортное средство с другой); Во-вторых, один и тот же протокол введения тестового соединения с обеих сторон MRM, но с разной тканью или моделью ткани с каждой стороны MRM. В этой работе эффекты олигомицина и FCCP на сетчатку сравнивали с OCR тканями, которые не подвергались воздействию каких-либо тестируемых соединений, и две ткани были одновременно оценены в соответствии с одним и тем же протоколом и условиями для выявления тканеспецифичного поведения. Последнее было проиллюстрировано в данном исследовании тем, что в том же эксперименте параллельно был показан увеличенный динамический диапазон скорости метаболизма РПЭ-хориоз-склеры относительно сетчатки. В других отчетах описывается более широкий спектр дизайнов исследований, включая измерение влияния различных уровнейO2 на OCR и LPR, а также зависимости от концентрации топлива, лекарств и токсинов20,21. Кроме того, несмотря на то, что мы ограничили анализ фракций оттока измерением лактата и расчетом LPR, информативность эксперимента значительно возрастает, если анализируются несколько соединений и классов соединений во фракциях оттока, таких как гормоны, нейротрансмиттеры, клеточные сигналы и метаболиты, которые могут выходить из клеток20,22. 23. См.
Нагрузка изолированной сетчатки или RPE-choroid-scler проста, и после выделения эти ткани просто помещаются в верхнюю часть тканевых камер с помощью щипцов и опускаются вниз к фрите. Клетки RPE, культивируемые на фильтрующих вставках, развивают соответствующую поляризацию и маркеры зрелости RPE через 4-8 недель в культуре. Нецелесообразно удалять РПЭ для анализа живых клеток после присоединения к трансвелловой мембране, если необходимо поддерживать зрелость и поляризацию РПЭ24. Перифузионная камера может вмещать полоски трансвелловой мембраны, которые разрезаются скальпелем при погружении в буфер и быстро вводятся в тканевые камеры. Несмотря на то, что режущие фильтрующие полоски были помещены в статическую систему24, не существует другого метода флюидики для оценки этих важных типов ячеек. Реакция клеток RPE была быстрой и более динамичной, чем у сетчатки или сосудистой оболочки глаза, вероятно, отчасти из-за непосредственного доступа как к апикальной, так и к базальной сторонам клеток RPE, сконфигурированных в виде монослоя на мембранной вставке.
Еще одним фактором, гарантирующим наивысший уровень сигнал/шум, является выбор оптимального соотношения тканей, загруженных в перифузионные камеры, к скорости потока. Слишком малая ткань по отношению к скорости потока приводит к разнице в концентрации растворенногоO2 между входящим и исходящим потоком, которая очень мала и ее трудно надежно измерить. Напротив, если поток слишком медленный, то концентрацияО2 становится настолько низкой, что на ткани воздействует гипоксия. Тем не менее, поток жидкости, управляемый давлением газа, может поддерживаться при расходе до 5 мл/мин, требуя лишь небольшого количества ткани для точных измерений OCR и LPR. В экспериментах, показанных здесь, использовалось около 20 мл/мин/канал, что подходило либо для одной сетчатки, либо для двух RPE-choroid-склер, либо для 360 000 клеток RPE. Чтобы свести к минимуму системные эффекты, которые задерживают и рассеивают воздействие на ткань введенного испытуемого соединения, поставляются камеры тканей различных размеров, чтобы количество ткани (и скорость потока) соответствовали соответствующему размеру камеры.
Данные анализа, представленные в этой статье, были представлены двумя способами: абсолютной величиной по отношению к скорости или дробными изменениями относительно стационарного или базового уровня. Основное внимание было уделено иллюстрации измерения реакции на испытуемые соединения. Тем не менее, система флюидики хорошо подходит для оценки и сравнения эффектов обработки тканей перед перифузионным анализом, таких как генетические модификации. Проверка того, отличается ли лечение от контроля, является наиболее надежной, если анализируется влияние лечения на нормализованную реакцию исследуемых соединений. Если для анализа требуются абсолютные величины, статистическая мощность анализа образцов, подвергшихся предварительной обработке, максимальна, если их оценка и контроль проводятся в одном и том же перифузионном эксперименте.
За исключением мешалки, все детали, контактирующие с жидкостью, поставляются производителем в качестве расходных материалов и стерилизуются. Эти детали не следует использовать повторно, так как эксперименты иногда могут быть потеряны из-за неполной очистки и загрязненных поверхностей. Система в начале настройки стерильна. Тем не менее, среда добавляется в MRM, и ткань загружается в камеры в нестерильных условиях. Мы измерили оптическое распознавание символов в системе, которая собрана из стерильных деталей, но где сам эксперимент проводится в нестерильных условиях. Бактериям требуется около 14 часов, чтобы накопиться до такой степени, чтобы получить измеримые OCR (неопубликованные результаты). Если используются протоколы, которые длятся менее 10 часов или около того, то накопление бактерий и любые последствия из-за них будут незначительными.
Многие исследователи используют приборы, которые предназначены для измерения оптического распознавания символов при статической инкубации монослоя клеток с относительно высокой пропускной способностью25,26. В отличие от этого, прибор для флюидики, который мы протестировали и описали в этой статье, поддерживает ткань, обеспечивая адекватную доставкуO2, что имеет решающее значение для больших расстояний диффузии, присутствующих в образцах ткани. Кроме того, он способен собирать дроби, что позволяет оценивать несколько параметров параллельно с оптическим распознаванием символов, что значительно расширяет возможности изучения взаимосвязей между ними. Наконец, можно контролировать концентрацию растворенных газов (таких как O2 иCO2), что увеличивает продолжительность экспериментов со средами на основе бикарбоната и буфером, позволяя пользователю изучать эффектыO2. Следует отметить, что ограничением для обеих методик является невозможность изучения вымывания испытуемых соединений, функциональность, которой обладают другие перифузионные системы 4,27,28. Еще одним фактором, который следует учитывать при определении оптимального метода анализа, является тот факт, что в жидкостных системах используется больше сред и тестовых соединений, чем в статических системах. Однако дополнительные расходы сведены к минимуму с помощью существующих жидкостных систем из-за низких скоростей потока, которые могут использоваться в системе.
В целом, приведено подробное описание протоколов проведения экспериментов с новым инструментом для оценки потока/оценки. Данные, полученные с помощью сетчатки и РПЭ-скуроидной склеры, повторяют предыдущие результаты, полученные с помощью систем, которые гораздо сложнее в использовании (и не всегда доступны). Также было продемонстрировано, что система может поддерживать и оценивать клетки RPE, прикрепленные к трансвелл-мембранам, очень важную клеточную модель, которая ранее не анализировалась с помощью проточных систем из-за хрупкости клеток. Основные части протокола состоят из 75-минутного времени настройки, за которым следует 90-минутный период равновесия, и экспериментального протокола, что делает его пригодным для рутинного использования в лабораториях, которые не специализируются на работе с жидкостными системами. Несмотря на то, что мы сосредоточились на измерении острой реакции тканей на тестируемые соединения, система очень подходит для сравнения тканей из различных источников, таких как животные модели или модели клеток, которые были генетически изменены или подверглись тестовому лечению/условиям. Кроме того, объем анализов, которые могут быть проведены на фракциях оттока, широк и включает метаболиты, клеточные сигнальные молекулы и секретируемые гормоны/нейротрансмиттеры, а также многокомпонентный анализ, полученный с помощью масс-спектрометрии как для фракций, так и для тканей.
Disclosures
I.R.S., M.G. и K.B. имеют финансовые связи с компанией EnTox Sciences, Inc. (Мерсер-Айленд, штат Вашингтон), производителем/дистрибьютором перифузионной системы BaroFuse, описанной в данном исследовании. Все остальные авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Это исследование финансировалось грантами Национальных институтов здравоохранения (R01 GM148741 I.R.S.), U01 EY034591, R01 EY034364, BrightFocus Foundation, Research to Prevent Blindness (J.R.C.) и R01 EY006641, R01 EY017863 и R21 EY032597 (J.B.H.).
Materials
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
References
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606 (2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917 (2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716 (2021).
- Stryer, L. . Biochemistry. , (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899 (2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492 (2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846 (2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842 (2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved