Простое создание васкуляризированной остеогенной ниши костного мозга с использованием предварительно изготовленных гидрогелей из полиэтиленгликоля (ПЭГ) в микропланшете для визуализации
In This Article
Summary
Модель сосудистой ниши костного мозга in vitro создается путем посева мезенхимальных и эндотелиальных клеток на предварительно отлитые 3D-гидрогели ПЭГ. Эндотелиальные сети, компоненты ECM и активность ALP в нишах варьируются в зависимости от используемого фактора роста. Платформа может быть использована для продвинутых моделей рака.
Abstract
Кость и костный мозг являются высоко васкуляризированными и структурно сложными органами и являются местами образования рака и метастазов. Крайне желательны модели in vitro , воспроизводящие специфические функции костей и костного мозга, включая васкуляризацию, которые совместимы с скринингом лекарств. Такие модели могут преодолеть разрыв между упрощенными, структурно нерелевантными двумерными (2D) моделями in vitro и более дорогими, этически сложными моделями in vivo . В этой статье описывается контролируемый трехмерный (3D) анализ совместной культуры на основе инженерных матриц из поли (этиленгликоля) (ПЭГ) для создания васкуляризированных остеогенных ниш костного мозга. Матричная конструкция PEG позволяет разрабатывать 3D-клеточные культуры с помощью простого этапа посева клеток, не требующего инкапсуляции, что позволяет разрабатывать сложные системы совместного культивирования. Кроме того, матрицы прозрачны и предварительно отлиты на 96-луночные пластины со стеклянным дном, что делает систему пригодной для микроскопии. Для анализа, описанного здесь, сначала культивируют мезенхимальные стромальные клетки, полученные из костного мозга человека (hBM-MSCs), до тех пор, пока не будет сформирована достаточно развитая сеть 3D-клеток. Впоследствии добавляются GFP-экспрессирующие эндотелиальные клетки пупочной вены человека (HUVEC). Развитие культуры сопровождается светлопольной и флуоресцентной микроскопией. Наличие сети hBM-MSC поддерживает образование сосудистых структур, которые в противном случае не сформировались бы и остаются стабильными в течение как минимум 7 дней. Степень образования сосудистой сети может быть легко определена количественно. Эта модель может быть настроена на остеогенную нишу костного мозга путем дополнения питательной среды костным морфогенетическим белком 2 (BMP-2), который способствует остеогенной дифференцировке hBM-МСК, оцениваемой по повышенной активности щелочной фосфатазы (ЩФ) на 4-й и 7-й день совместной культуры. Эта клеточная модель может быть использована в качестве платформы для культивирования различных раковых клеток и изучения того, как они взаимодействуют с сосудистыми нишами, специфичными для костей и костного мозга. Кроме того, он подходит для автоматизации и анализа с высоким содержанием, что означает, что он позволит проводить скрининг лекарств от рака в условиях культуры с высокой воспроизводимостью.
Introduction
Кость и костный мозг являются структурно и функционально сложными органами, занимающими центральное место в здоровье человека. Это отражается в существовании отдельных ниш, которые регулируют кроветворение и поддержание костной ткани1. В настоящее время широко признано, что в здоровом костном мозге поддержание и расширение гемопоэтических и скелетных стволовых клеток, а также их потомства контролируется отдельными нишами. Эти ниши включают различные типы клеток, включая остеолинейные клетки, мезенхимальные стволовые клетки, эндотелиальные и периваскулярные клетки, нейрональные и глиальные клетки, адипоциты, остеокласты, макрофаги и нейтрофилы2. Неудивительно, что эти в основном сосудисто-ассоциированные ниши также участвуют в развитии различных типов лейкемии3 и являются местом метастазирования различных видов рака4. Из-за своей специфической роли в формировании кости, ремоделировании и поддержании кости (костного мозга) сосудистая сеть, связанная с костью, имеет различные специализированные структуры, отличные от сосудистой сети, обнаруженной в других частях тела 5,6,7. Таким образом, антиангиогенные или сосудисто-модулирующие препараты, применяемые системно, могут оказывать различное действие в этих специализированных средах8. Поэтому очень желательны модели для исследования молекулярных механизмов, участвующих в поддержании физиологических свойств кости и костного мозга, регенерации костей и костного мозга, а также реакции на терапевтическое лечение.
Классические двумерные (2D) тканевые культуры и исследования in vivo с использованием животных моделей дали бесценное представление о роли различных клеток и молекулярных игроков, участвующих в развитии кости и костного мозга 9,10. Модели, которые позволяют проводить высокопроизводительные эксперименты с соответствующими клетками человека, могут улучшить наше понимание того, как модулировать выбранные параметры в этих очень сложных системах.
В последнее десятилетие для создания 3D-моделей тканей использовались принципы, полученные с помощью тканевой инженерии11,12. Они в основном основывались на инкапсуляции тканезависимых клеток в биоматериалы для создания 3D-моно- или кокультур13. Среди наиболее часто используемых биоматериалов - фибрин14, коллаген 15 и матригель16,17, все из которых обладают высокой биосовместимостью и обеспечивают соответствующие условия для роста многих типов клеток. Эти биоматериалы обладают способностью генерировать модели in vitro, которые повторяют ключевые аспекты различных сосудистых ниш, обнаруженных in vivo18. Кроме того, использование микрофлюидных устройств для создания перфузированных моделей сосудистой кости и костного мозга способствовало созданию моделей in vitro более высокой сложности 19,20,21,22.
Сложность контроля состава и инженерных свойств встречающихся в природе биоматериалов вдохновила на разработку синтетических аналогов, которые могут быть рационально спроектированы с предсказуемыми физическими, химическими и биологическими свойствами23,24. Мы разработали полностью синтетические сшитые гидрогели на основе сшитого поли(этиленгликоля) (ПЭГ) фактора XIII (FXIII), которые функционализированы пептидами RGD и сайтами расщепления матриксной металлопротеазы (MMP) для облегчения прикрепления и ремоделирования клеток25,26. Модульная конструкция этих биоматериалов успешно использована для оптимизации условий формирования 3D васкуляризированных моделей костей и костного мозга27,28.
Для тестирования большего количества различных условий культивирования и новых терапевтических средств требуются модели с более высокой пропускной способностью. Недавно мы показали, что сшивание FXIII нашего гидрогеля ПЭГ можно контролировать с помощью электрохимического процесса, так что образуется углубленный градиент жесткости гидрогеля29. Когда клетки добавляются поверх таких гидрогелей, они мигрируют внутрь и постепенно превращаются в тесно взаимосвязанные3D-сотовые сети 30. Устранение необходимости инкапсулировать клетки в гидрогель, который обычно присутствует с другими 3D-каркасами, не только упрощает экспериментальный дизайн, но и позволяет последовательно добавлять различные типы клеток в разные моменты времени для создания сложных систем совместного культивирования. Эти гидрогели доступны в предварительно отлитом виде на 96-луночные пластины со стеклянным дном, что позволяет создавать 3D-культуры как вручную, так и с помощью автоматизированных протоколов посева клеток. Оптическая прозрачность гидрогелей ПЭГ делает платформу совместимой с микроскопией.
Здесь мы представляем простой метод создания и характеристики васкуляризированных остеогенных ниш в рамках этой готовой к использованию синтетической платформы plug-and-play. Показано, что развитие сосудистых сетей может быть стимулировано фактором роста, обычно используемым для индукции остеогенеза in vitro, костным морфогенетическим белком-2 (BMP-2), в то время как остеогенная дифференцировка может быть предотвращена добавлением фактора роста фибробластов 2 (FGF-2)27,31. Сформированные сети отличаются по сравнению с FGF-2-стимулированными сетями с точки зрения общего внешнего вида, а также распределения ячеек и ECM. Кроме того, мы контролировали остеогенную индукцию, используя щелочную фосфатазу в качестве маркера. Мы демонстрируем повышенную экспрессию этого маркера с течением времени и сравниваем экспрессию с таковой в стимулированных сетях FGF-2 с использованием качественных и количественных методов. Наконец, мы демонстрируем пригодность сгенерированных ниш этой модели для двух потенциальных применений. Во-первых, мы провели экспериментальный анализ чувствительности к лекарственным средствам, добавив бевацизумаб в предварительно сформированные ниши и отслеживая деградацию сосудистых сетей в его присутствии. Во-вторых, мы добавили клетки рака молочной железы MDA-MB-231 и остеосаркомы U2OS в предварительно сформированные остеогенные ниши, показывая, что ниши могут быть использованы для изучения взаимодействия между раковыми клетками и окружающей их средой.
Protocol
На рисунке 1 показаны следующие разделы протокола.
1. Создание 3D-стромальной монокультуры
- Приготовьте суспензию клеток hBM-MSC.
- Выращивайте hBM-МСК до уровня слияния 70-90% в MEMα с добавлением 10% FBS, 1% пенициллина-стрептомицина и 5 нг/мл FGF-2 в инкубаторе при 37 ° C и 5% CO2 в увлажненной атмосфере. Ячейки могут быть использованы до прохода 6.
- Промойте клетки PBS и отсоедините их, используя 0,05% трипсина-ЭДТА в течение 3-5 минут при 37 ° C. Остановите процесс отслойки промыванием базальной средой (MEMα с добавлением 10% FBS и 1% пенициллина-стрептомицина). Соберите взвешенные клетки в коническую центрифужную пробирку объемом 50 мл.
- Подсчитайте клетки с помощью гематоцитометра или автоматического счетчика клеток и определите общее количество клеток в суспензии.
- Гранулируйте ячейки центрифугированием при 200 x g в течение 5 мин. Аккуратно удалите надосадочную жидкость.
- Ресуспендируют клетки в соответствующем объеме базальной среды до достижения концентрации 1 х 10,7 клеток/мл исходного раствора.
- Подготовьте конические центрифужные пробирки объемом 50 мл, содержащие необходимый объем базальной среды, дополненный соответствующими факторами роста (FGF-2 и BMP-2 в определенных концентрациях, например, 0 нг/мл, 25 нг/мл, 50 нг/мл, 100 нг/мл или 200 нг/мл). На одну лунку требуется 200 мкл. Если посев ячеек должен выполняться с использованием автоматизированного обработчика жидкости, также учитывайте мертвый объем прибора. Для ручного посева клеток достаточно превышения объема на 10%.
- Добавьте hBM-МСК из исходного раствора в разведении 1:66,67 до достижения концентрации 1,5 х10,5 клеток/мл.
- Подготовьте тарелку к посеву.
- Снимите полипропиленовую клейкую пленку, покрывающую 96-луночную гидрогелевую пластину.
- Тщательно аспирируйте буфер для хранения, покрывающий гидрогели. Для этой задачи используйте шайбу для микропластин; Тем не менее, возможна ручная обработка.
- При использовании ручного аспиратора или многоканальной пипетки прижмите наконечник к стенке колодца и медленно двигайтесь вниз к краю внутренней лунки, одновременно аспирируя буфер. Это позволит избежать повреждения поверхности гидрогеля.
- При использовании автоматической пластинчатой мойки устанавливайте аспирационные форсунки на расстоянии не менее 3,8 мм от пластинчатого носителя (это соответствует 0,8 мм от внутреннего кольца гидрогелевой пластины) и по направлению к краю скважины. Обратитесь к руководству производителя для получения более подробных инструкций и чертежей 96-луночной гидрогелевой пластины.
- Добавьте 200 мкл / лунку клеточной суспензии, приготовленной на этапе 1.1.7 после тщательного перемешивания, чтобы обеспечить однородное распределение клеток. Во время посева, чтобы избежать неравномерного осаждения клеток в одном участке субстрата, не наклоняйте пластину. Для ручного посева периодически перемешивайте клеточную суспензию (после посева трех лунок), чтобы смесь оставалась однородной. Для автоматизированного посева смешайте серологической пипеткой непосредственно перед дозированием, чтобы дозировать объемы, содержащие равное количество клеток.
- Поддерживайте культуры при температуре 37 °C и 5% CO2 в увлажненной атмосфере.
- Наблюдайте за развитием культур с помощью светлопольной микроскопии с 5-кратным объективом по желанию. Получите контрольные изображения примерно через 30 минут после посева, чтобы оценить количество добавленных ячеек.
2. Создание 3D-культуры стромально-эндотелиальных клеток
- Приготовьте клеточную суспензию GFP-HUVEC.
- Приготовьте колбы для культуры HUVEC, покрыв раствором, состоящим из 150 мкг/мл коллагена крысиного хвоста I в 0,02 М уксусной кислоты в течение 30 мин при 37 °C. Перед использованием один раз смойте PBS.
- Вырастите GFP-HUVEC до уровня слияния 80%-100% в EGM-2 с добавлением 10% FBS в инкубаторе при 37 °C и 5% CO2 в увлажненной атмосфере. Ячейки могут быть использованы до прохода 7.
- Промойте клетки PBS и отсоедините их, используя 0,05% трипсина-ЭДТА в течение 2-3 минут при 37 ° C. Остановите процесс отслойки промыванием базальной средой (MEMα с добавлением 10% FBS и 1% пенициллина-стрептомицина). Соберите взвешенные клетки в коническую центрифужную пробирку объемом 50 мл.
- Подсчитайте клетки с помощью гематоцитометра или автоматического счетчика клеток и определите общее количество клеток, присутствующих в суспензии.
- Гранулируйте ячейки центрифугированием при 200 x g в течение 5 мин. Аккуратно удалите надосадочную жидкость.
- Ресуспендируют клетки в соответствующем объеме базальной среды до достижения концентрации 1 х 10,7 клеток/мл исходного раствора.
- Подготовьте конические центрифужные пробирки объемом 50 мл, содержащие требуемый объем базальной среды, дополненный соответствующими факторами роста (FGF-2 и BMP-2 в определенных концентрациях, например, 0 нг/мл, 25 нг/мл, 50 нг/мл, 100 нг/мл или 200 нг/мл), как описано для hBM-MSCs на этапе 1.1.6.
- Добавляют GFP-HUVEC из исходного раствора в разведении 1:66,67 для достижения концентрации 1,5 x 10,5 клеток/мл, как описано для hBM-MSCs на этапе 1.1.7.
- Аспирируют среду из пластины, содержащей стромальную монокультуру, как описано для удаления буфера на шаге 1.2.2.
- Добавьте 200 мкл/лунку суспензии клеток GFP-HUVEC, приготовленной на этапе 2.1.8, как описано для добавления hBM-MSC на этапе 1.3.
- Инкубировать при 37 °C и 5%CO2 в увлажненной атмосфере. Меняйте среду каждые 3-4 дня.
- Следите за развитием культуры с помощью светлопольной и флуоресцентной микроскопии с использованием 5-кратного объектива по желанию. Сохраняйте культуры до 4-го или 7-го дня совместного культивирования для ранних или промежуточных характеристик, соответственно, или по желанию.
3. Процедура характеристики 1: Количественная оценка формирования сети эндотелиальных клеток
- В желаемые моменты времени получите сигнал GFP от GFP-HUVEC с помощью флуоресцентной микроскопии, используя настройки, подходящие для количественной оценки (т. е. наилучшую фокусировку, высокую контрастность и низкое увеличение [например, 5x] для больших полей зрения).
- Предварительно обработайте все изображения, полученные в один и тот же день (например, с помощью Fiji32), чтобы еще больше повысить контрастность. Обратите внимание, что сигнал GFP может становиться тусклее со временем культивирования; Поэтому изображения, полученные в разные дни, могут нуждаться в разной обработке.
- Если вы используете Fiji или ImageJ, откройте все изображения канала GFP за один и тот же момент времени и откройте меню «Яркость и контрастность ». Выберите изображение, представляющее промежуточное состояние (не самый тусклый и не самый яркий сигнал), и автоматически отрегулируйте контрастность, выбрав « Авто». Выберите «Задать» и установите флажок « Распространить на все другие открытые изображения».
- Визуально оцените, подходит ли автоматически выбранный диапазон для всех изображений текущего момента времени, и вручную повторно настройте и повторно распространите на все изображения по мере необходимости.
- Сохраните скорректированные изображения в виде файлов TIF и повторите шаги 3.2.1 и 3.2.2 для других полученных моментов времени.
- Примените медианный фильтр размытия (например, радиус 3 для изображений 2048x2048) ко всем изображениям, чтобы избежать распознавания артефактов ниже по течению и, таким образом, облегчить точную идентификацию сети. Уменьшите размер путем объединения (2x2) и сохраните все предварительно обработанные изображения в виде файлов RGB Color TIF в оттенках серого в папке для количественной оценки. Эти шаги можно выполнить вручную или в пакетном режиме с помощью макросов, которыми авторы поделятся по запросу.
- Проанализируйте все образы в папке, созданной на шагах 3.1-3.3, используя режим пакетной обработки в анализаторе ангиогенеза для ImageJ33. Обратите внимание, что в зависимости от размера изображений и доступной рабочей памяти это может занять несколько минут на одно изображение.
- Проверьте результаты количественной оценки, изучив наложения распознанных структур и исходных изображений. Если алгоритм распознает искусственные структуры, где на исходном изображении видно только несколько клеток или их нет, настройте параметры предварительной обработки и повторно проанализируйте исходные изображения или исключите такие проблемные области и/или воспроизведите изображения из анализа.
- Нормализуйте полученные значения до площади 1 мм 2 путем умножения значений каждого образца на отношение анализируемой области к 1 мм2 . Этот шаг имеет особое значение, если используются изображения разного размера.
- Извлеките из анализа различные параметры сети, такие как общая длина сети, количество соединений, количество сегментов, количество изолированных сегментов, интервал ветвления и средний размер ячейки, и используйте их для характеристики эндотелиальной сети в разные моменты времени и в разных условиях культивирования.
4. Процедура определения характеристик 2: Оценка осаждения ECM
- В желаемые конечные моменты времени оцените осаждение ECM с помощью иммунофлуоресценции. Добавляют первичные антитела против различных молекул ECM в 100 мкл питательной среды в течение последних 6 ч культивирования или после фиксации, как описано ниже.
- Промойте культуры один раз 200 мкл / лунку PBS в течение 5 минут при RT и зафиксируйте их 100 мкл / лунку 4% параформальдегида под химическим вытяжным шкафом в течение 30 минут при RT. Обратите внимание, что рекомендуется фиксировать все лунки пластины одновременно, так как окружающие культуры могут быть повреждены на этом этапе. Промойте фиксированные культуры 200 мкл / лунку PBS при RT три раза в течение 5 минут каждый раз и храните при 4 ° C в 200 мкл / лунку PBS или сразу переходите к следующему этапу.
- Перед инкубацией с первичными антителами против молекул ECM после фиксации инкубируют фиксированные культуры с 200 мкл / лунку 1% BSA в PBS в качестве блокирующего раствора в течение 30 мин при RT.
- Аспирируйте блокирующий раствор и инкубируйте со 100 мкл / лункой раствора первичного антитела в 1% BSA в PBS в течение ночи при 4 ° C. Промыть 200 мкл / лунку PBS три раза в течение 5 мин, не менее 3 ч и 5 мин, соответственно, при RT.
ПРИМЕЧАНИЕ: Длительный этап промывки необходим для полной диффузии несвязанного антитела из гидрогеля.
- Аспирируйте блокирующий раствор и инкубируйте со 100 мкл / лункой раствора первичного антитела в 1% BSA в PBS в течение ночи при 4 ° C. Промыть 200 мкл / лунку PBS три раза в течение 5 мин, не менее 3 ч и 5 мин, соответственно, при RT.
- Для облегчения проникновения вторичного окрашивающего раствора, в том числе внутриклеточных противопятен, проводят пермеабилизацию культур с использованием 0,3% Тритона Х-100 и 1% БСА в ПБС в течение 30-90 мин при РТ в зависимости от клеточной плотности культур.
ПРИМЕЧАНИЕ: Для окрашивания внутриклеточных молекул на основе антител этот этап следует выполнять перед инкубацией с первичным антителом, описанным на этапе 4.1.2. - По желанию готовят вторичные окрашивающие растворы, содержащие соответствующие вторичные антитела и контрокрасители (например, ядерное окрашивание, такое как DAPI, и цитоскелетное окрашивание, такое как фаллоидин-родамин).
- Приготовьте окрашивающий буфер, состоящий из 0,1% Triton X-100, 1% BSA в PBS и противокрасителей (например, 1 мкг/мл DAPI и 1:4000 фаллоидина-родамина), и добавьте соответствующие вторичные антитела в рекомендуемых разведениях.
- Добавьте 100 мкл / лунку вторичного окрашивающего раствора и выдерживайте в течение ночи при 4 ° C. Аналогично процедуре после первичной инкубации антител, промывание 200 мкл / лунка PBS три раза в течение 5 мин, не менее 3 ч и 5 мин, соответственно, при RT.
- Для 3D-разрешения структур получите конфокальные стопки, начиная со дна стекла с шагом z 2,5 мкм, достигающего конечной высоты 500 мкм, используйте 10-кратный объектив и 0,75-кратный цифровой зум. Чтобы создать 3D-реконструкцию сигнала GFP и F-актина на Фиджи, установите пороговое значение для каждого канала отдельно перед созданием композита и генерацией реконструкции с помощью Fiji 3D Viewer.
- Для визуализации депонированного ECM из иммуноокрашиваний приобретите конфокальные стеки высотой 100 мкм с z-шагом 5 мкм, 10-кратный объектив и 1,5-кратный цифровой зум. Создавайте проекции максимальной интенсивности и регулируйте яркость и контрастность для каждого канала отдельно на Фиджи перед созданием композита.
- Выполняют прямое окрашивание цветом внеклеточной среды.
- Добавьте 200 мкл / лунку окрашивающего раствора Picrosirius Red в лунки, фиксируемые параформальдегидом, и инкубируйте в течение 1 ч при RT.
- Затем пять раз промойте окрашенные лунки дистиллированной водой, а затем промывайте два раза в день или каждый второй день в течение 3-4 дней, наблюдая за очисткой цвета образца. Держите пластины при температуре 4 °C во время длительных этапов стирки (т. е. всего, что превышает 6 часов).
- Получайте изображения окрашенных образцов с помощью светлопольного микроскопа, оснащенного цветной камерой, и поддерживайте равный баланс белого в разных условиях. Чтобы получить обзор образцов, используйте небольшое увеличение (например, 2,5x) для сканирования всей скважины. Если микроскоп не поставляется с программным обеспечением, поддерживающим автоматическое сшивание, сделайте это вручную (например, с помощью Pairwise Stitching на Фиджи34).
ПРИМЕЧАНИЕ: Лунки, ранее использовавшиеся для иммунофлуоресценции, могут быть использованы для этого при условии завершения получения флуоресцентного изображения. - Выполните те же действия, что и для окрашивания Picrosirius Red в шагах 4.2.1-4.2.3, чтобы выполнить окрашивание, промывку и визуализацию Alizarin Red.
5. Процедура характеристики 3: Оценка остеогенной дифференциации путем мониторинга активности ЩФ
- В разные моменты окончания культивирования (например, на 4-й и 7-й день совместной культуры) количественно оценивают активность ALP с помощью окрашивания 5-бром-4-хлор-3-индолилфосфатом (BCIP)/нитросиним тетразолием (NBT).
- Перед инкубацией с раствором субстрата BCIP/NBT промойте культуры один раз 200 мкл / лунку PBS, который следует готовить в соответствии с инструкциями производителя. Инкубировать при 37 °C, периодически контролируя развитие цвета. Как только цвет начнет развиваться в неостеогенных условиях, немедленно промойте один раз 200 мкл / лунку PBS перед фиксацией 4% параформальдегидом, как описано на шаге 4.1.1.
- Получите цветные изображения окрашенных образцов, как описано на шаге 4.2.3 для окрашивания Picrosirius Red.
- В разные моменты окончания культивирования (например, на 4-й и 7-й день совместной культуры) количественно оцените активность ЩФ в лизатах клеток.
- Трижды промывают культуры 200 мкл на лунку PBS перед инкубацией с 200 мкл на лунку 0,25% трипсина-ЭДТА при 37 ° C. Каждые 10 минут перемешивайте культуры, энергично пипетируя вверх и вниз, чтобы облегчить пищеварение, и контролируйте морфологию культуры с помощью стандартного микроскопа для клеточных культур.
- Как только жидкая одноклеточная суспензия без удлиненных клеточных структур в лунках получена (обычно через 20-30 минут), перенесите образцы в пробирки объемом 2 мл, добавьте 200 мкл базальной среды МСК для ингибирования трипсина и центрифугу при 500 x g в течение 5 мин, чтобы гранулировать извлеченные клетки. Сцедите надосадочную жидкость и заморозьте гранулы при -80 °C или приступайте непосредственно к шагу 5.2.3.
- Гранулы клеток, полученные на стадии 5.2.2, размораживают, и инкубируют с 500 мкл лизисного буфера, состоящего из 0,56 М 2-амино-2-метил-1-пропанола, 0,2% Triton X-100, pH 10, в течение 30 мин на льду. Затем центрифугу при 16 100 x g в течение 10 мин при 4 ° C и держите образцы на льду. После измерений, описанных на этапе 5.2.7, заморозьте образцы при -20°С или -80°С или непосредственно продолжайте количественное определение ДНК, как описано на этапе 5.2.8.
ПРИМЕЧАНИЕ: Буфер для лизиса можно приготовить заранее, стерильно отфильтровать и хранить при температуре 4 °C. - Приготовьте реагент ALP, состоящий из 20 мМ гексагидрата динатриевой соли динатриевой соли 4-нитрофенилфосфата и 4 мМ MgCl2 в буфере для лизиса.
ПРИМЕЧАНИЕ: Лучше всего готовить этот раствор свежим в день количественного определения. - Не нарушая гранулированный мусор, распределите 50 мкл надосадочной жидкости клеточного лизата, приготовленной на этапе 5.2.3, в лунки стандартной, прозрачной 96-луночной пластины для культивирования тканей в двух экземплярах. Добавьте буфер лизиса в две скважины в качестве холостых регуляторов.
- С помощью многоканальной пипетки добавьте 50 мкл / лунку реагента ALP в лунки, заполненные на шаге 5.2.5. Коротко встряхните пластину и выдержите при температуре 37 °C в течение 10 минут в защищенном от света месте. Лунки с более высокой активностью ЩФ будут казаться желтыми. Остановите реакцию, добавив 100 мкл / лунку 1 М NaOH с помощью многоканальной пипетки.
- Считывание оптической плотности на длине волны 410 нм с помощью считывателя пластин. Усредните технические дубликаты и вычтите среднее значение пустых элементов управления.
- Выполните количественное определение ДНК, чтобы нормализовать активность ЩФ, определенную на предыдущих шагах, по отношению к общему количеству клеток. Здесь описан метод, основанный на измерениях флуоресценции, но любой другой метод количественного определения ДНК в клеточных лизатах совместим с анализом. Подготовьте реагенты и стандарты ДНК, необходимые для количественного определения ДНК, используя коммерчески доступные наборы в соответствии с инструкциями производителей.
ПРИМЕЧАНИЕ: Рекомендуется использовать буфер лизиса для приготовления стандартов ДНК. - Если образцы, используемые для количественного определения ALP, описанного на этапе 5.2.3, были заморожены, разморозьте их, центрифугу при 16 100 x g в течение 2 мин при 4 °C и поместите их на лед. Не нарушая гранулированный мусор, распределите 50 мкл надосадочной жидкости клеточного лизата в лунки черной 96-луночной пластины в двух экземплярах. Заморозьте образцы при температуре -20 °C или -80 °C и при необходимости повторите количественное определение ALP и ДНК. Добавьте стандарты ДНК в двух экземплярах.
- С помощью многоканальной пипетки добавьте 50 мкл окрашивающего агента ДНК, инкубируйте и считайте интенсивность флуоресценции в соответствии с инструкциями производителя. Используя значения стандартной кривой, определите и примените преобразование измеренных значений интенсивности в концентрации ДНК.
- Нормализуйте значения ALP, полученные на шаге 5.2.7, разделив их на соответствующую концентрацию ДНК каждого образца.
6. Применение 1: Проведение анализов на чувствительность к лекарственным средствам
- Когда эндотелиальные сети полностью развиты (обычно на 4-й день кокультур стромально-эндотелиальных клеток), добавьте антиангиогенные соединения, такие как бевацизумаб, в культуры в свежей питательной среде и проверьте их активность с течением времени и в различных условиях (например, при различных концентрациях FGF-2 или BMP-2).
- До этого момента готовят свежую питательную среду, содержащую те же факторы роста, которые использовались для соответствующих культур.
- Готовят контрольный раствор, состоящий из разбавителя интересующего соединения (например, для бевацизумаба: 60 мг/мл α-дигидрата трегалозы, 0,4 мг/мл Tween20, 5,8 мг/мл фосфата натрия, одноосновного и моногидрата, и 1,2 мг/мл двуосновного фосфата натрия, безводного), и стерильно фильтруют его.
- Добавляют интересующее соединение в желаемой концентрации (например, 10 мкг/мл бевацизумаба) и равный объем контрольного раствора в питательную среду, предназначенную для условий испытания и контроля, соответственно.
- До этого момента готовят свежую питательную среду, содержащую те же факторы роста, которые использовались для соответствующих культур.
- Аспирируют среду из культуры и добавляют 200 мкл на лунку среды, только что приготовленной на этапе 6.1.1. Инкубируют в течение времени, подходящего для испытуемого соединения (например, для бевацизумаба: 2 дня). Наблюдайте за развитием культуры и характеризуйте эндотелиальные сети, как описано в разделе 3. Оцените эффективность соединения в ингибировании ангиогенеза или абляции предварительно сформированных структур с использованием изображений GFP и количественных параметров сети, извлеченных из анализа, описанного на шаге 3.7.
7. Приложение 2: Создание передовых систем совместного культивирования с различными типами раковых клеток
- На 4-й день совместного культивирования, когда эндотелиальные сети в основном установлены, добавляют другие типы клеток, такие как раковые клетки MDA-MB-231 или U2OS, к культурам в свежей питательной среде.
- Пометьте раковые клетки с помощью совместимого с клетками живого красителя в соответствии с инструкциями производителя, чтобы иметь возможность отличить их от меченных GFP HUVEC и немеченых hBM-MSC в кокультурах.
- Готовят суспензию раковых клеток в концентрации 1,5 х 10,4 клеток/мл в свежей питательной среде, содержащей те же факторы роста, которые использовались для соответствующих культур до этого момента.
- Следите за развитием культуры и локализацией раковых клеток по желанию.
ПРИМЕЧАНИЕ: В зависимости от типа рака, активности и окружающей среды, им может потребоваться несколько дней, чтобы достичь сосудистых структур в кокультурах стромально-эндотелиальных клеток (например, 2 дня для MDA-BM-231 и U2OS). Следовательно, покадровая визуализация для визуализации взаимодействия раковых и сосудистых клеток должна быть рассчитана соответствующим образом.
Representative Results
Посевы сосудистых ниш были установлены путем последовательного посева hBM-MSC и GFP-HUVEC на предварительно изготовленные гидрогели на основе ПЭГ с градиентом жесткости в 96-луночной пластине для визуализации (рис. 1). Культуры контролировали в продольном направлении с помощью живой эпифлуоресцентной микроскопии и дополнительно характеризовали в выбранные моменты времени. Внеклеточный компартмент оценивали с помощью прямого окрашивания цветом и окрашивания на основе антител. Активность ЩФ была количественно определена после извлечения и лизиса клеток из образовавшихся ниш. Кроме того, мы демонстрируем пригодность этой платформы для анализов чувствительности к антиангиогенным лекарственным средствам и в качестве основы для моделей совместного культивирования рака.
Кокультуры hBM-МСК и GFP-экспрессирующих HUVEC были установлены путем посева 3 x 104 клеток/лунка в отсутствие факторов роста или в присутствии FGF-2 или BMP-2 в дозе 50 нг/мл, как описано в протоколе. С самого начала различия между культурами можно было наблюдать как на изображениях яркого поля, так и на флуоресцентных изображениях, показывающих только GFP-HUVEC (рис. 2A). Наблюдая за одними и теми же участками в продольном направлении, можно отметить различия в развитии культур, такие как более быстрое развитие в присутствии FGF-2. Как правило, культуры казались менее развитыми в отсутствие какого-либо фактора роста, с меньшим количеством распространяющихся клеток любого типа и наличием бесклеточных областей. Напротив, снимки светлого поля показали наиболее плотные культуры в присутствии БМП-2. Однако сосудистые сети формировались как в условиях, содержащих фактор роста, так и наиболее обширные и взаимосвязанные сети формировались с FGF-2. Эти наблюдаемые различия также могут быть количественно оценены с помощью анализатора ангиогенеза для ImageJ. Действительно, общая протяженность сети была самой высокой при наличии FGF-2 и наименьшей при отсутствии факторов роста (рис. 2B). Количество развязок, указывающих на точки разветвления в сетях, соответствовало той же тенденции, что и общая длина (рис. 2C). И наоборот, в обоих условиях, содержащих фактор роста, было значительно меньше изолированных сегментов, что указывает на более высокую взаимосвязь, чем в условиях без какого-либо фактора роста (рис. 2D). Кроме того, 3D-конфокальная визуализация показала более сильное проникновение эндотелиальных клеток с точки зрения глубины в состоянии, стимулированном FGF-2 (рис. 2E).
Кокультуры hBM-MSC/GFP-HUVEC выдерживали в течение 7 дней в присутствии FGF-2 или BMP-2, а затем фиксировали и окрашивали для компонентов ECM. Иммуноцитохимическое окрашивание с последующей конфокальной лазерной сканирующей микроскопией показало поразительные различия в морфологии культуры в зависимости от типа добавки фактора роста (рис. 3А). При FGF-2 культура была организована в конденсированные микрососудистые структуры, которые были плотными как в эндотелиальных, так и в мезенхимальных клетках, тогда как в присутствии BMP-2 hBM-MSC охватывали гораздо большую площадь, о чем свидетельствуют более обширные F-актин-положительные и GFP-отрицательные области. Белки ECM фибронектин и коллаген I были локализованы аналогичным образом, в то время как ламинин и коллаген IV были более сконцентрированы вокруг эндотелиальных структур. Однако эта повышенная концентрация вокруг эндотелиальных структур была гораздо более выражена в присутствии FGF-2, чем в присутствии BMP-2. В дополнение к окрашиванию на основе антител были выполнены прямые цветные окрашивания для оценки общего фиброзного состояния ECM (окрашивание Picrosirius red; Рисунок 3Б), а также осаждение Ca на ECM (окрашивание Alizarin Red; Рисунок 3В) образовавшихся ниш. Окрашивание Picrosirius Red было более сильным и обширным в нишах, культивируемых с помощью БМП-2, и окрашивание Alizarin Red следовало той же тенденции.
Затем культуры были охарактеризованы с точки зрения их остеогенного потенциала путем оценки активности ALP как раннего остеогенного маркера. На 4-й и 7-й день совместного культивирования клетки извлекали из ниш путем переваривания гидрогелей с трипсином. Для количественной оценки активности ЩФ извлеченные клетки лизировали и проводили анализ pNPP. Полученные значения были нормализованы по отношению к общей ДНК для каждого образца, чтобы учесть потенциальные различия в количестве клеток в разных условиях. Действительно, можно было наблюдать небольшие различия между содержанием ДНК в условиях, и наименьшее количество клеток было извлечено из состояния без какого-либо фактора роста (не показано). Нормализованная активность ЩФ, однако, сильно варьировалась в зависимости от условий, с тенденцией к увеличению активности с более высокими концентрациями BMP-2 и плато при 100 нг / мл (рис. 4A, B). Самые низкие уровни активности были выявлены для состояния, содержащего 50 нг/мл FGF-2. Хотя сходные тенденции можно было наблюдать для обоих оцениваемых моментов времени, все значения значительно увеличивались с течением времени в культуре с 4-го по 7-й день. В дополнение к количественному анализу активность ALP может быть качественно визуализирована с помощью прямого окрашивания цвета на основе преобразования субстрата BCIP/NBT. Более обширное и более интенсивное фиолетовое окрашивание наблюдалось в присутствии БМП-2 по сравнению с FGF-2 (рис. 4C).
Чтобы продемонстрировать два потенциальных применения охарактеризованных остеогенных ниш, было проведено исследование чувствительности к лекарственным средствам и совместные культуры рака. Для анализа лекарственной чувствительности бевацизумаб или контрольный раствор, состоящий из разбавителя препарата бевацизумаб, добавляли в питательную среду, содержащую свежий BMP-2. На 4-й день, когда в присутствии 50 нг/мл БМП-2 формировали установленные сети, во время регулярной смены среды добавляли либо контрольный раствор, либо бевацизумаб-содержащую среду, а культуры контролировали с помощью флуоресцентной визуализации. Добавление 10 мкг/мл бевацизумаба приводило к втягиванию или абляции ранее сформированной сети, в то время как контрольное условие все еще включало обширные сети через 2 дня после смены среды (рис. 5A, B). Эти изменения также могут быть количественно оценены путем отслеживания общей длины сетей с помощью анализатора ангиогенеза для ImageJ на флуоресцентных изображениях, получаемых ежедневно (рис. 5C). Альтернативно, бевацизумаб или любое другое соединение также могут быть добавлены с начала совместной культуры для оценки их влияния на формирование сетей. В случае бевацизумаба это полностью ингибировало образование эндотелиальных сетей (не показано).
Для второго применения клетки рака молочной железы MDA-MB-231 или остеосаркомы U2OS добавляли к кокультурам 4-го дня при плотности 1,5 x 103 клеток/лунка в свежей питательной среде, содержащей 50 нг/мл BMP-2. Чтобы отличить их от меченных GFP HUVEC и немеченых hBM-MSCs, раковые клетки инкубировали с CellTrace FarRed непосредственно перед посевом в остеогенные ниши. Посевы контролировали с помощью флуоресцентной микроскопии; Вначале большинство раковых клеток локализовалось у поверхности субстрата, но через 2 дня их можно было обнаружить в непосредственной близости от слоев, содержащих сосудистые кокультуры. Таким образом, 2-й день был выбран в качестве отправной точки для покадровой микроскопии, чтобы показать динамику взаимодействия между раковыми клетками и клетками в сосудистой нише. Интересно, что клетки MDA-MB-231 можно было увидеть как приближающимися, так и удаляющимися от эндотелиальных структур и, таким образом, возможно, исследовали или реконструировали окружающую среду (рис. 5D). Используя CellTrace FarRed в качестве метки для раковых клеток, GFP в качестве метки для HUVEC и дополнительного окрашивания для F-актина, все типы клеток можно было различить с помощью конфокальной лазерной сканирующей микроскопии (рис. 5E).
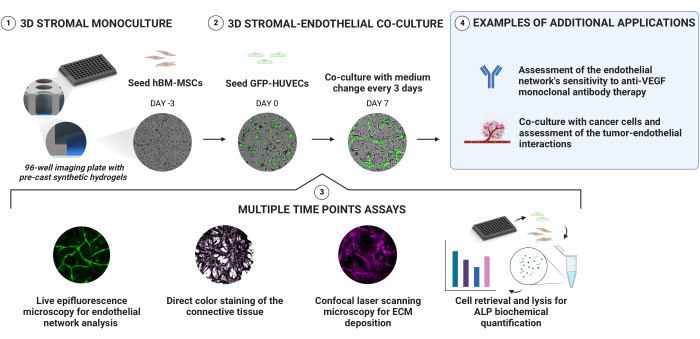
Рисунок 1: Простой подход к надежной генерации васкуляризированных остеогенных ниш. Сборные синтетические гидрогели с глубоким градиентом жесткости позволяют создавать 3D-культуры путем последовательного посева клеток без необходимости прямой инкапсуляции. hBM-MSCs предварительно культивируют в течение 3 дней перед добавлением GFP-экспрессирующих HUVEC. Мониторинг культур осуществляется путем получения сигналов светлого поля и GFP в продольном направлении. В определенные моменты времени ниши дополнительно оцениваются на предмет их осаждения ECM и остеогенного состояния. Активность щелочной фосфатазы оценивается с помощью прямого окрашивания цвета и извлечения клеток из ниш и проведения анализа pNPP на лизатах клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
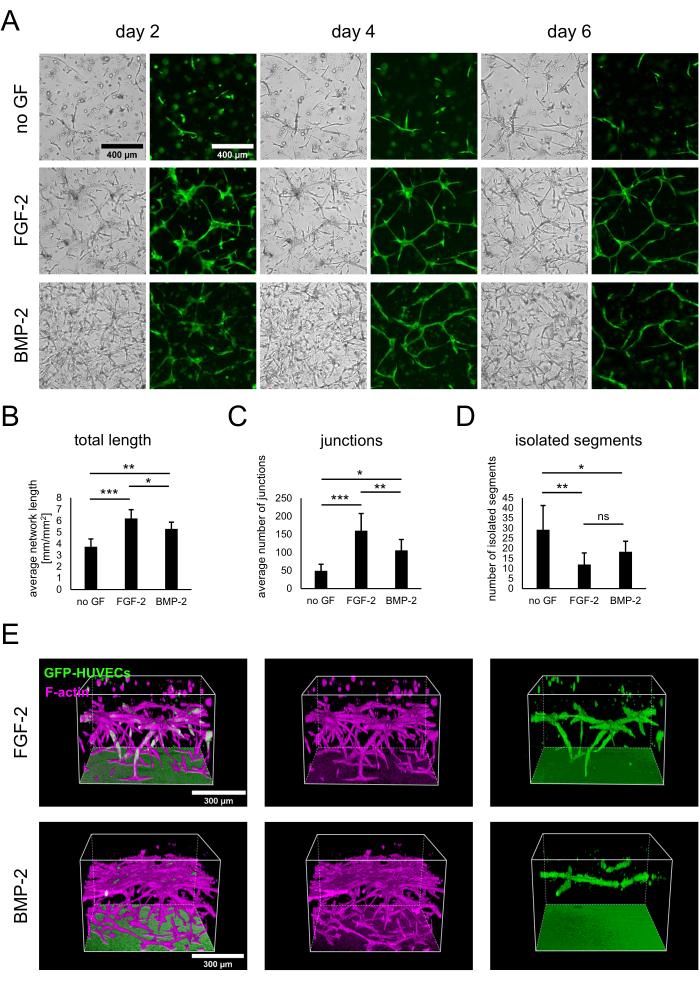
Рисунок 2: Стимуляция сосудистых сетей с помощью FGF-2 или BMP-2. (A) Изображения светлого поля и флуоресценции (GFP) были получены на 2-й, 4-й и 6-й день совместной культуры клеток, выращенных в отсутствие факторов роста или в присутствии FGF-2 или BMP-2, оба при 50 нг / мл. Масштабная линейка: 400 мкм. (B-D) Количественные параметры сетей GFP-HUVEC, визуализированные на 4-й день совместного культивирования, проанализированные с помощью анализатора ангиогенеза для ImageJ. Данные представлены в виде среднего ± стандартного отклонения. Статистический анализ проводился с помощью GraphPad Prism 9.5.1. Обычный односторонний ANOVA с тестом множественных сравнений Даннетта был выполнен с n ≥ 4; * P < 0,05; ** P < 0,01; P < 0,001. (E) Трехмерные реконструкции, полученные из конфокальных стеков (общая высота: 547,5 мкм; шаг z: 2,5 мкм) сигналов GFP и F-актина для условий стимуляции FGF-2- (верхний ряд) и BMP-2- (нижний ряд). Масштабная линейка: 300 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
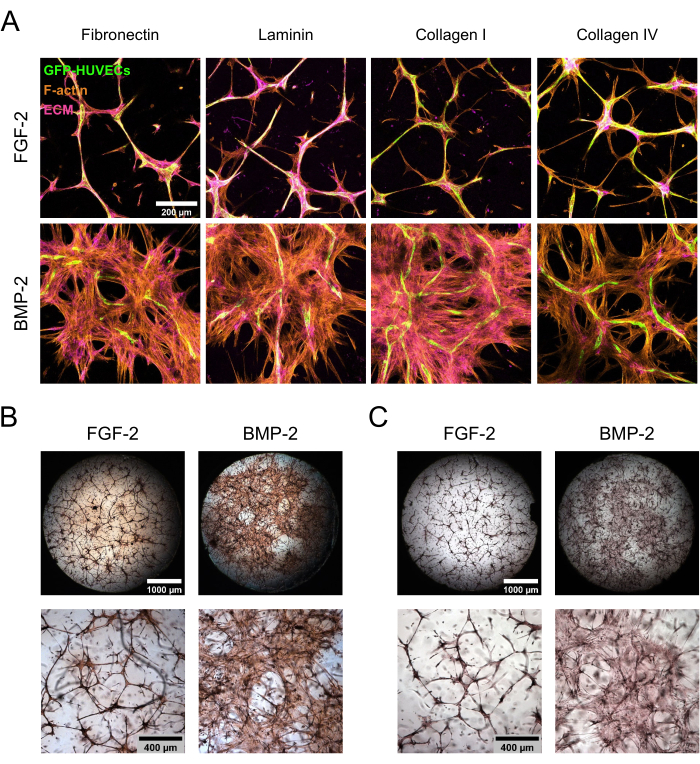
Рисунок 3: Индукция делокализованного распространения hBM-MSC и осаждения ECM с помощью BMP-2. (А-С) 7-дневные кокультуры, выращенные в присутствии FGF-2 или BMP-2, подвергали (A) иммунофлуоресценции или (B, C) прямому окрашиванию цветом. (A) Культуры окрашивали на F-актин и белки ECM фибронектин, ламинин, коллаген I и коллаген IV. На изображениях изображены проекции максимальной интенсивности конфокальных стеков (общая высота: 100 мкм; шаг z: 5 мкм). Масштабная линейка: 200 мкм. (B,C) Культуры окрашивали с использованием (B) Picrosirius Red и (C) Alizarin Red. В верхнем ряду изображены сшитые, сплошные обзоры изображений, полученных при 2,5-кратном увеличении (масштабная линейка: 1000 мкм), а в нижнем ряду изображено одно поле зрения, полученное при 5-кратном увеличении (масштабная линейка: 400 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
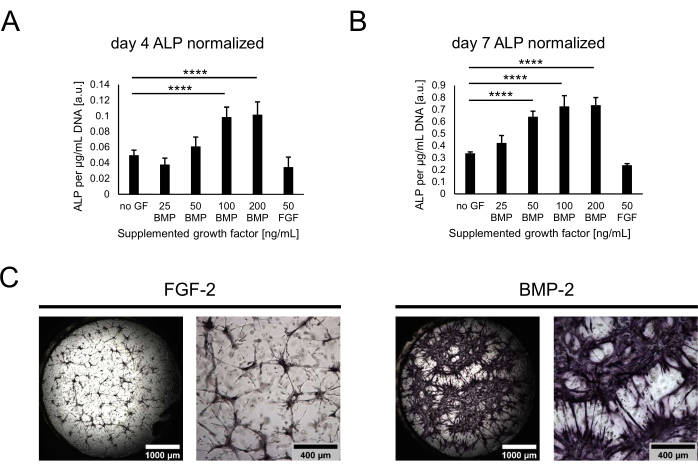
Рисунок 4: Биохимическая оценка активности ЩФ, индуцированной BMP-2, путем прямого окрашивания цвета. (А, Б) Активность ЩФ определяли в клеточных лизатах культур, выращенных в отсутствие факторов роста или в присутствии BMP-2 в различных концентрациях или FGF-2 в дозе 50 нг/мл в течение (А) 4 дней или (В) 7 дней совместной культуры. Показано, что активность ALP нормализована к содержанию ДНК каждого образца лизата. Данные представлены в виде среднего ± стандартного отклонения. Статистический анализ проводился с помощью GraphPad Prism 9.5.1. Обычный односторонний ANOVA с тестом множественных сравнений Даннетта был выполнен с n = 5; P < 0,0001. (C) Прямое окрашивание активности ALP в нишах, выращенных в присутствии 50 нг/мл FGF-2 или BMP-2 в течение 7 дней совместного культивирования. Изображения с левой стороны изображают сшитые сшитые обзоры изображений, полученных при 2,5-кратном увеличении (масштабная линейка: 1000 мкм), в то время как изображения с правой стороны изображают одно поле зрения, полученное при 5-кратном увеличении (масштабная линейка: 400 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
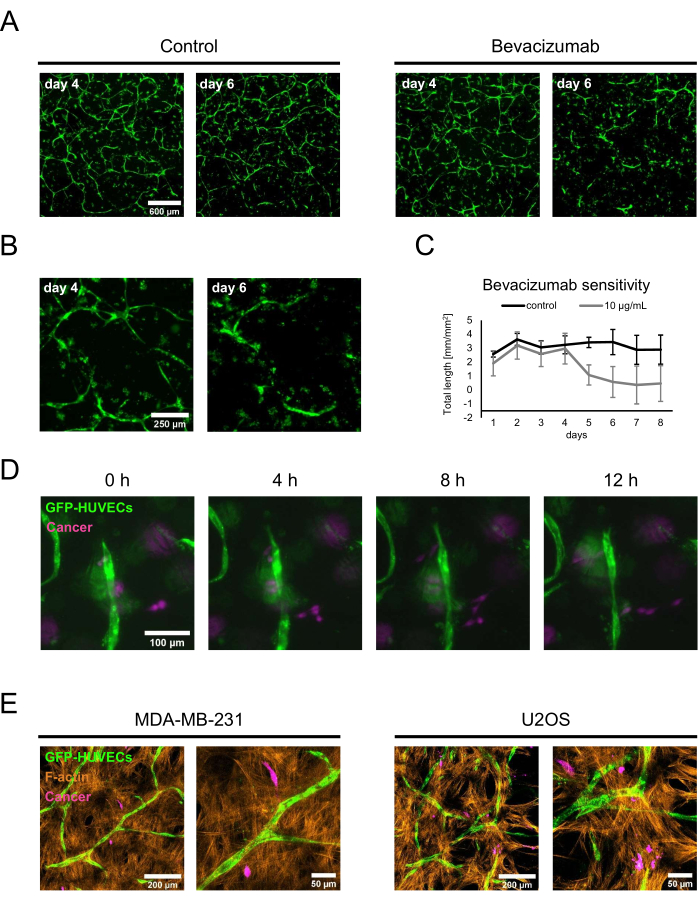
Рисунок 5: Использование остеогенных, васкуляризированных ниш в продвинутых моделях рака. (A) Сигналы GFP культур, выращенных в присутствии BMP-2, визуализировали на 4-й день совместной культуры до добавления контрольного раствора (слева) или бевацизумаба в дозе 10 мкг/мл (справа) в течение 2 дней, после чего культуры снова визуализировали (6-й день совместной культуры). Масштабная линейка: 600 мкм. (B) Изображения культур, обработанных бевацизумабом, с большим увеличением показаны в A. Масштабная линейка: 250 мкм. (C) Общая длина эндотелиальных сетей, показанная в А, была количественно определена с помощью анализатора ангиогенеза для ImageJ на основе изображений, получаемых ежедневно; n ≥ 3. (D) Клетки рака молочной железы MDA-MB-231, меченные CellTrace FarRed, были добавлены к 4-дневным кокультурам, выращенным в присутствии BMP-2, и покадровые изображения были получены, начиная с 2 дней после добавления раковых клеток. Масштабная линейка: 100 мкм. (E) Проекции максимальной интенсивности конфокальных стеков (общая высота: 70 мкм; z-шаг: 2,4 мкм) тройных кокультур, генерируемых, как описано в D , и фиксированных и окрашенных для F-актина. Слева: ниши с клетками рака молочной железы MDA-MB-231; справа: ниши с клетками остеосаркомы U2OS. Масштабные линейки для изображений слева: 200 мкм; Масштабные линейки для изображений справа: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Здесь мы описываем протокол для создания in vitro модели высоковаскуляризированных ниш кости и костного мозга в полностью синтетической и контролируемой матрице на основе 3D PEG, которая имеет множество применений в исследованиях биологии костей и костного мозга, тканевой инженерии и исследованиях рака. Эта модель основана на синтетическом гидрогеле на основе ПЭГ, который функционализирован пептидами RGD и участками расщепления MMP и отлит с углубленным градиентом плотности на 96-луночных пластинах30 для визуализации со стеклянным дном. Было показано, что эта платформа plug-and-play позволяет создавать тесно взаимосвязанные 3D-сотовые сети без необходимости инкапсуляции клеток в гидрогель. Подобно ранее описанному протоколу инкапсуляции клеток, в этой работе мы показываем ремоделирование субстрата с помощью присущего клетке ECM28 для создания микроокружения, специфичного для клеточного типа. Таким образом, с помощью этого метода скрининговые анализы лекарств и анализы с высоким содержанием могут быть легко выполнены в высоковоспроизводимых органотипических условиях 3D-культивирования. 96-луночные пластины со стеклянным дном и оптически прозрачные гидрогели делают платформу совместимой с автоматизацией работы с жидкостями и высокопроизводительной микроскопией.
Первым шагом в создании остеогенной сосудистой ниши костного мозга является предварительное культивирование hBM-МСК на гидрогеле ПЭГ в течение не менее 3 дней. За это время они прикрепляются к гидрогелю, проникают в него и начинают устанавливать межклеточные контакты и осаждение ECM. Перед посевом hBM-MSC буфер хранения должен быть удален. Поскольку гидрогель находится внутри внутреннего отверстия в стандартной лунке 96-луночной пластины для визуализации, можно безопасно вставлять аспирационный наконечник вдоль боковой стороны лунки до тех пор, пока он не коснется внутреннего кольца лунки. Вакуумный насос можно использовать для аспирации, если он установлен на минимально возможную силу всасывания. В качестве альтернативы для аспирации буфера из гидрогелевой пластины можно использовать автоматическую пластинчатую мойку с высотой сопла, отрегулированной, по меньшей мере, на 0,8 мм над внутренним колодезным кольцом. Использование автоматизации для работы с жидкостями может свести к минимуму повреждение поверхности гидрогеля и привести к более высокой воспроизводимости получаемых культур. Небольшие дефекты на поверхности гидрогеля становятся видимыми, как только клетки оседают на гидрогеле и появляются на более низкой плоскости фокуса в дефектных областях гидрогеля. Таким образом, получение эталонных изображений в день 0 служит хорошим контролем качества однородности засева клеток и целостности поверхности гидрогеля. В то время как небольшие дефекты поверхности гидрогеля не препятствуют дальнейшему использованию лунки, клетки имеют тенденцию группироваться на дефектных участках и могут превращаться в нерепрезентативные узоры или быстрее достигать нижнего стекла, где они превращаются в монослой. Эти артефакты должны быть отмечены при использовании/оценке этих скважин. Аналогичные соображения применимы к любым изменениям среды, выполняемым в течение всего периода анализа.
Второй этап протокола включает добавление GFP-HUVEC к предварительно сформированной монокультуре hBM-MSC (день 0 совместной культуры). ECM, депонированный hBM-MSC, обеспечивает отличный каркас для роста эндотелиальных клеток, которые в этой работе, даже в присутствии среды, кондиционированной hBM-MSC, могли образовывать только круглые клеточные кластеры на гидрогелях (не показаны). При посеве на культуры hBM-MSC HUVEC интегрируются и образуют микрососудоподобные структуры, сравнимые с теми, которые наблюдаются в кокультурах, полученных путем инкапсуляции клеток27,28. Как правило, хорошо развитые 3D-микрососудистые сети образуются в течение 4 дней после совместного культивирования, и это можно продольно контролировать с помощью GFP-меченных HUVEC. Эти структуры могут поддерживаться в течение не менее 7 дней в культуре, что означает, что есть достаточно времени, чтобы следить за изменениями в организации сосудистой сети в ответ на лечение, например, для скрининга антиангиогенных препаратов. Морфологические элементы эндотелиальной сети могут быть количественно определены в пакетном режиме путем сегментации изображений GFP с использованием хорошо зарекомендовавших себя инструментов, таких как плагин Angiogenesis Analyzer ImageJ33, и их параметры могут быть использованы для оценки, например, эффективности лекарственного средства и фармакодинамики.
Одним из существенных преимуществ описанной клеточной модели для многих потенциальных применений является ее пластичность. Простое дополнение питательной среды различными факторами роста может изменить внешний вид совместной культуры. Например, присутствие BMP-2 на протяжении всего периода моно- и кокультуры создает остеогенную сосудистую нишу, демонстрирующую повышенную активность ЩФ, внеклеточное отложение кальция, а также сборку и осаждение ECM. Напротив, в присутствии FGF-2 остеогенные маркеры отсутствуют, и кокультура образует меньше латеральных клеточных ассоциаций, но показывает более выраженный рост 3D-клеток. Тот факт, что FGF-2 подавляет активность ЩФ, в то время как БМП-2 вызывает более сильную активность ЩФ по сравнению с отсутствием лечения фактором роста, согласуется с предыдущими наблюдениями27. Тем не менее, несмотря на эти большие различия в стромальном компоненте hBM-MSC, протяженность микрососудистой сети была очень похожа для двух состояний, обработанных фактором роста в этой работе. В контрольных культурах образовалось лишь несколько коротких сосудистых сетей, представляющих, возможно, плохо васкуляризированную нишу костного мозга. Это говорит о том, что, просто изменив тип, концентрацию и время добавления факторов роста в культуральную среду, можно получить ряд четко определенных васкуляризированных ниш костного мозга, которые потребуются для сравнительных исследований. Однако для обеспечения воспроизводимых результатов важно отметить, что прогрессирование и морфология культуры могут варьироваться в зависимости от истории используемых клеток (например, номера прохода и метода отслойки, используемого во время рутинного поддержания культуры), и рекомендуется контролировать такие факторы во время дизайна анализа.
Здесь, в качестве первого применения этой модели, мы демонстрируем чувствительность сконструированных микрососудистых сетей к лечению бевацизумабом 10 мкг/мл. Примечательно, что важно подтвердить, что используемый алгоритм может точно распознавать эндотелиальную сеть, поскольку артефакты часто генерируются на изображениях со слабо развитыми сетями. В этом случае параметры, используемые для обработки изображений (до и во время сегментации), должны быть точно настроены, часто методом проб и ошибок.
В качестве второго приложения мы представляем продвинутую модель совместной культуры, образованную последовательным посевом мезенхимальных, эндотелиальных и раковых клеток. Эта модель позволяет изучать взаимодействия между раковыми клетками, стромой и сосудистой сетью костного мозга, которые могут быть важными факторами во время метастазирования. Кроме того, эта модель может быть использована для скрининга лекарств и тестирования соединений с мишенями, выходящими за рамки ангиогенеза.
В 2D-культурах клетки не получают физиологических сигналов микросреды, не приобретают естественную клеточную морфологию и, следовательно, дифференцируются по-разному по сравнению с клетками в нативных3D-средах 35. При выращивании в инженерных 3D-гидрогелях клетки на ранней стадии депонируют врожденный ECM, который обеспечивает места адгезии и может быть активно реконструирован28,36. Здесь, чтобы создать упрощенную 3D-модель для скрининговых приложений, сосудообразующие клетки были высажены на поверхность инженерных гидрогелей и позволили создать сосудистые сети при отсутствии перфузии. Оценки на основе визуализации проводились на 2D-проекциях эндотелиальных клеток, вносящих вклад в сосудистые структуры. Однако только конфокальные изображения выявили менее выраженное врастание 3D-сосудистых сетей в образцах, стимулированных BMP-2, по сравнению с образцами, стимулированными FGF-2. Это говорит о том, что длина сформированных сосудистых структур была недооценена, в то время как их связность была завышена. Кроме того, взаимодействие между периваскулярными и эндотелиальными клетками и образованием сосудистого просвета не исследовалось. Эти аспекты, особенно с точки зрения ответных мер по лечению наркомании, потребуют дальнейшего внимания. Наконец, было бы желательно усовершенствовать протоколы, позволяющие сначала создавать обширные 3D-сосудистые сети и только затем индуцировать их остеогенную дифференцировку для создания более физиологических моделей костей и костного мозга.
В целом, представленная здесь модель очень универсальна и может быть легко адаптирована к конкретным приложениям. Например, можно использовать мезенхимальные и эндотелиальные клетки из разных источников. Известно, что МСК жировой ткани и МСК пуповины экспрессируют различные ангиогенные факторы по сравнению с БМ-МСК, и они могут быть легко замещены в качестве альтернативного стромального компонента37. Эндотелиальные клетки, выделенные из уже определенных ниш костного мозга, также могут быть использованы вместо HUVEC. Можно также установить совместную культуру с полученными от пациента, соответствующими мезенхимальными и эндотелиальными клетками костного мозга для применения в персонализированной медицине, как недавно было предложено для васкуляризированных мышечных кокультур38. Кроме того, конструкция гидрогелевой пластины позволяет проводить продольный мониторинг культуры как с помощью светлопольной, так и с флуоресцентной микроскопии, что дает пользователю возможность сократить или продлить время культивирования в зависимости от применения. В качестве альтернативы, плотность клеток, используемых для посева, может быть соответствующим образом скорректирована для ускорения или задержки формирования клеточной сети, если требуется более короткое или более длительное время наблюдения, чем указано в этом протоколе. В любом случае, необходимо соблюдать осторожность, чтобы избежать разрастания клеток в листовидные структуры, что может привести к сокращению гидрогеля и, в конечном итоге, к отслоению клеток.
Наконец, с использованием этой модели можно проводить широкий спектр анализов. В дополнение к иммунофлуоресценции и микроскопии, выполняемым в живых или фиксированных культурах, 3D-культуры могут быть ферментативно переварены, а клетки могут быть извлечены и подвергнуты любому типу биохимического анализа. Здесь мы демонстрируем определение активности ALP и количественное определение содержания ДНК в лизатах клеток с помощью колориметрических/флуорометрических анализов, но система совместима со многими другими методами, включая ПЦР, РНК-секвенирование и протеомику. Если чувствительность желаемого анализа не очень высока, можно объединить образцы из более чем одной лунки, чтобы увеличить количество образца, доступного для анализа. Если желаемое применение требует более быстрого растворения геля, орбитальное встряхивание пластины может быть применено в сочетании с меньшими объемами пищеварительного раствора для обеспечения образования вихрей в лунках, предполагая, что все лунки на пластине будут использоваться таким образом (живые культуры чувствительны к такому жесткому обращению). Таким образом, мы представляем здесь протокол, который, если он используется, как описано, гарантирует создание модели in vitro , которая повторяет ключевые аспекты остеогенных сосудистых ниш, но также достаточно универсальна, чтобы ее можно было модифицировать для индивидуальных применений.
Disclosures
Ectica Technologies AG является производителем гидрогелевой скважины 3DProSeed и имеет коммерческие интересы. Бенджамин Р. Симона и Мартин Эрбар являются акционерами Ectica Technologies AG.
Acknowledgements
Авторы хотели бы поблагодарить Риккардо Урбана за техническую помощь с устройствами для обработки жидкостей и Роди Одабаси за поддержку в проведении эпифлуоресцентной микроскопии. Эта работа финансировалась Швейцарским национальным научным фондом (гранты No 310030E_202429 и 205321__204318) и Ectica Technologies AG.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
References
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved