Ex Vivo Cultura de Perfusão de Grandes Vasos Sanguíneos em Biorreator Impresso em 3D
* These authors contributed equally
In This Article
Summary
Este protocolo apresenta a instalação e operação de um biorreator impresso em 3D recentemente desenvolvido para a cultura ex vivo de vasos sanguíneos em perfusão. O sistema foi projetado para ser facilmente adotado por outros usuários, prático, acessível e adaptável a diferentes aplicações experimentais, como biologia básica e estudos farmacológicos.
Abstract
A doença vascular constitui a base da maioria das doenças cardiovasculares (DCV), que continuam sendo a principal causa de mortalidade e morbidade em todo o mundo. Intervenções cirúrgicas e farmacológicas eficazes para prevenir e tratar a doença vascular são urgentemente necessárias. Em parte, a escassez de modelos translacionais limita a compreensão dos processos celulares e moleculares envolvidos na doença vascular. Biorreatores de cultura de perfusão ex vivo fornecem uma plataforma ideal para o estudo de grandes vasos animais (incluindo humanos) em um ambiente dinâmico controlado, combinando a facilidade de cultivo in vitro e a complexidade do tecido vivo. A maioria dos biorreatores é, no entanto, de fabricação personalizada e, portanto, de difícil adoção, limitando a reprodutibilidade dos resultados. Este trabalho apresenta um sistema impresso em 3D que pode ser facilmente produzido e aplicado em qualquer laboratório biológico, e fornece um protocolo detalhado para sua configuração, possibilitando a operação dos usuários. Este inovador e reprodutível sistema de cultura de perfusão ex vivo permite o cultivo de vasos sanguíneos por até 7 dias em condições fisiológicas. Esperamos que a adoção de um biorreator de perfusão padronizado possa apoiar uma melhor compreensão dos processos fisiológicos e patológicos em grandes vasos sanguíneos de animais e acelerar a descoberta de novas terapêuticas.
Introduction
A parede vascular existe em estado estacionário reativo, o que garante tanto responsividade a estímulos externos (i.e., mudança de pressão, vasoconstritores) quanto uma superfície consistente e não ativadora, impedindo a coagulação sanguínea e a infiltração de células inflamatórias1. Em resposta a estímulos dependentes do envelhecimento e do estilo de vida e mediante dano direto, a parede vascular ativa processos de remodelação como reestenose e aterosclerose, que são conhecidos contribuintes para doenças cardiovasculares (DCV) comuns, como acidente vascular cerebral isquêmico e infarto do miocárdio2. Embora abordagens intervencionistas, como revascularização percutânea e implante de stent, estejam disponíveis para combater manifestações avançadas de doença vascular, elas são conhecidas por provocar mais danos vasculares, muitas vezes levando à recorrência. Além disso, apenas estão disponíveis soluções preventivas e em fase inicial limitadas. A compreensão dos mecanismos que mantêm a homeostase da parede vascular e impulsionam sua disfunção está no cerne do desenvolvimento de novas curas3.
Apesar do constante desenvolvimento e avanços na biologia molecular e engenharia de tecidos, os estudos em animais continuam sendo um componente crucial dos estudos de biologia vascular. Estudos in vivo em animais têm fornecido enorme insight sobre os mecanismos da homeostase e patologia vascular; no entanto, esses procedimentos são caros, têm rendimento relativamente baixo e apresentam problemas éticos substanciais. Além disso, animais de pequeno porte são pouco representativos da fisiologia vascular humana, e experimentos com animais maiores são muito mais caros e criam considerações éticas adicionais 4,5. Com a crescente demanda por soluções farmacêuticas e médicas para uma população em rápido envelhecimento, as desvantagens do uso de animais são ampliadas, impactando a reprodutibilidade, confiabilidade e transferibilidade dos resultados para o cuidado do paciente6.
Os sistemas in vitro oferecem uma plataforma simplificada para o estudo de mecanismos básicos, mas não conseguem recapitular a complexidade de todo o tecido, as interações entre as células e a matriz extracelular e as forças mecânicas, que são determinantes críticos no desenvolvimento de doenças vasculares7.
Estudos ex vivo realizados em tecidos inteiros mantidos em ambientes artificialmente controlados mimetizam a complexidade in vivo, ao mesmo tempo em que permitem investigações de rendimento relativamente alto8. Dada a capacidade de controlar de perto as condições de cultivo e o ambiente, os modelos ex vivo permitem uma ampla gama de estudos complexos e fornecem uma alternativa adequada para reduzir o uso de procedimentos animais em biologia vascular. As culturas estáticas dos anéis vasculares ofereceram informações interessantes, mas falharam em incorporar o elemento hemodinâmico crucial9. De fato, o estudo do sistema vascular ex vivo apresenta desafios específicos relacionados às muitas forças dinâmicas que se aplicam às células dentro da parede dos vasos sanguíneos. Estímulos como fluxo luminal, turbulência, tensão de cisalhamento, pressão e deformação da parede afetam significativamente a fisiopatologia tecidual10,11,12.
Os biorreatores de perfusão são essenciais para o estudo da homeostase e remodelamento vascular em resposta a lesões ou alterações hemodinâmicas13. Além disso, a cultura de perfusão pode ser utilizada para melhorar a maturação e a durabilidade dos vasos sanguíneos manipulados por tecidos (TEBVs), fornecendo alternativas adequadas para enxertos vasculares14.
Os biorreatores de perfusão comercialmente disponíveis são limitados em flexibilidade e adaptabilidade e são dispendiosos. Muitos dos biorreatores desenvolvidos internamente são difíceis de replicar em outros laboratórios, devido às descrições limitadas e à indisponibilidade de componentes especialmente fabricados 7,8,9,10,11,12. Para superar essas limitações, desenvolvemos recentemente um novo biorreator (EasyFlow), que é econômico de produzir, acomoda uma variedade de tecidos e permite modificações relativamente simples para se adaptar a diferentes demandas de pesquisa13. A pastilha é impressa em 3D e se encaixa como em uma tampa de um tubo de centrífuga padrão de 50 mL. Seu design modular e fabricação de impressão 3D o tornam acessível e reprodutível em diferentes laboratórios, bem como facilmente modificável para se adaptar a diferentes necessidades científicas. Este protocolo descreve a montagem e operação básica do sistema de biorreator em ambiente de perfusão arterial.
Protocol
Este protocolo descreve a montagem e utilização de um sistema composto por duas pastilhas EasyFlow (biorreator): uma representando a câmara de reação (C), contendo a amostra da artéria perfundida, e outra funcionando como reservatório médio (R) (Figura 1 e Figura 2A). As artérias carótidas foram obtidas de leitões machos e fêmeas (6-12 kg) com 4-6 semanas de idade no The Pirbright Institute, Reino Unido. Os procedimentos com animais foram realizados de acordo com o Home Office Animals (Scientific Procedures) Act (1986) (ASPA) e aprovados pelo Animal Welfare and Ethical Review Board (AWERB) do The Pirbright Institute. Os animais foram alojados de acordo com o Código de Práticas para o Alojamento e Cuidados com os Animais Criados. Todos os procedimentos foram conduzidos por titulares de Licença Pessoal treinados e competentes sob a Licença de Projeto PPL70/8852. Os leitões foram abatidos de acordo com o método do esquema um, sob o ASPA.
1. Fabricação de pastilhas
- Fabricar a pastilha por impressão 3D, utilizando o modelo 3D fornecido (Arquivo Suplementar 1).
NOTA: A modelagem 3D permite alterações fáceis no projeto para se adaptar a novas aplicações. Materiais alternativos e técnicas alternativas de fabricação também podem ser usados para produzir a pastilha. Devido à complexa estrutura interna, a sinterização seletiva a laser e a estereolitografia são alternativasapropriadas 15. A poliamida 12 (PA12; ver Tabela de Materiais) é um bom material candidato devido ao seu desempenho superior em termos de retenção de líquidos e resistência a ciclos repetidos de esterilização por calor16. - Fabricar as juntas de silicone e as arruelas de policarbonato por corte a laser17, utilizando os desenhos fornecidos no Arquivo Suplementar 2.
NOTA: O corte a laser é facilmente terceirizado e um método de fabricação barato. As arruelas podem ser fabricadas em aço inoxidável, proporcionando um componente mais resistente para uso repetido. Todos os outros componentes são itens disponíveis comercialmente. Uma lista completa dos materiais necessários é fornecida na Tabela 1. Os detalhes comerciais dos itens estão incluídos na Tabela de Materiais.
2. Esterilização, montagem e escorvamento de dispositivos
- Esterilizar todos os componentes seguindo as instruções da Tabela 1.
- Em condições de fluxo laminar, montar dois insertos fabricados (etapa 1), como mostra a Figura 1A.
- Monte o sistema de perfusão conforme a Figura 2, seguindo os passos abaixo:
- Conecte duas válvulas de três vias conectadas à porta R1 do reservatório (porta de troca de mídia).
- Conecte a saída resultante à cabeça da bomba peristáltica usando um tubo equipado com uma válvula unidirecional (tubo de válvula unidirecional).
- Conecte o cabeçote da bomba à porta C4 da câmara de reação usando a tubulação do sistema equipada com uma válvula unidirecional.
NOTA: Este ramo pode opcionalmente ser equipado com um sensor de pressão que permite a monitorização constante. - Conecte a porta C1 da câmara de reação à tubulação de parede macia, e esta ao canal de resistência (pequeno diâmetro interno).
NOTA: O comprimento da tubulação de resistência influenciará muito a pressão presente no sistema. Isso deve ser mais bem investigado para garantir condições adequadas de perfusão. - Estender o canal de resistência com a tubulação do sistema, criando um canal de retorno e fechando o circuito de circulação luminal conectando-se ao reservatório em R5 (Figura 2C).
- Crie um canal de transbordamento conectando a câmara de reação C3 ao reservatório R3 com a tubulação do sistema.
- Conecte um filtro de ventilação através de R2.
- Crie um amortecedor de pressão conectando uma seringa contendo ar e meio à câmara de reação C6.
NOTA: A relação ar-mídia correta dependerá do amortecimento de pressão necessário.
- Primer o sistema com meio de perfusão (meio águia modificado de Dulbecco [DMEM] + 10% [v/v] soro fetal bovino [SFB] + 1% [v/v] penicilina-estreptomicina + 1% [v/v] anfotericina B + 30% [v/v] dextrano; ver Tabela de Materiais) através das portas de troca de meios e do reservatório.
NOTA: O escorvamento do sistema reduz o risco de bolhas presas no sistema e identifica possíveis vazamentos. O volume recomendado de mídia é de cerca de 100-120 mL. O volume utilizado dependerá do volume morto da tubulação utilizada para experimentação.
3. Colheita e preparação das amostras
- Coletar as artérias carótidas comuns direita e esquerda, minimizando o manuseio direto do tecidoarterial13.
- Colocar o tecido em meios de transporte a frio (DMEM + 20% [v/v] FBS + 2% [v/v] penicilina-estreptomicina + 1% [v/v] anfotericina B, ver Tabela de Materiais) para transferência.
- Em um gabinete de fluxo laminar, remova o excesso de tecido conjuntivo e corte as extremidades do tecido usando uma lâmina de bisturi. Lave o tecido duas vezes em meio de transporte frio.
- Coloque o tecido em um agitador orbital em meio de transporte por pelo menos 30 min para uma lavagem completa.
- Conectar um segmento não ramificado da artéria ao sistema do biorreator usando dois conectores luer farpados e fixá-lo no lugar usando uma ligação vascular (laços vasculares de silicone; Tabela 1).
OBS: A ligação do vaso proporciona a tensão e a retração adequadas para fixar o vaso. A secção oval previne danos teciduais. - Fluir suavemente através da artéria para verificar a patência.
- Após fixar a artéria ao inserto fabricado, preencher o espaço de reação com meios de perfusão (passo 2.4). Finalmente, preencha suavemente o circuito de circulação luminal com mídia para eliminar qualquer ar restante do sistema.
- Conectar o espaço de reação com o sistema de perfusão previamente montado (seção 2), completando a circulação.
NOTA: Recomenda-se realizar uma verificação de qualidade por imunohistoquímica do tecido processado. Isso identifica qualquer dano devido ao manuseio excessivo durante a preparação.
4. Cultura de perfusão e mudança de mídia
- Colocar o sistema de perfusão numa incubadora a 37 °C com CO2 a 5% e, em seguida, ligá-lo a uma bomba peristáltica (ver Tabela de Materiais)
- Conecte quaisquer sistemas de aquisição adicionais (facultativos), como sensores de pressão (consulte a Tabela de Materiais).
- Deixe o sistema se equilibrar durante a noite com uma baixa taxa de fluxo de meio de ~10-15 mL/min.
NOTA: Experimentos iniciais para determinar as configurações da bomba, o fluxo do meio, a pressão do sistema e as configurações ideais de amortecedores/grampos de pressão são necessários para garantir que as condições apropriadas sejam atendidas. - No dia seguinte, aumente o fluxo incrementalmente (+1 rpm a cada hora, equivalente a um aumento de ~2,5 mL/min a cada hora, no sistema atual) até que o fluxo final (35 mL/min) seja alcançado. Monitore o sistema periodicamente em busca de vazamentos.
NOTA: Para calcular o caudal exacto com base na velocidade peristáltica da bomba, os utilizadores devem primeiro efectuar uma calibração adequada da bomba18. Usando a fórmula (1), o fluxo volumétrico (Q) pode ser calculado com base no volume dispensado (V) dentro de um determinado tempo (t). Para calcular a velocidade de fluxo estimada () podemos utilizar a vazão (Q) previamente calculada e a área de secção transversa do vaso (A), descritas na equação (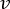 2).
2).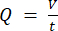 (1º)
(1º)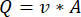 (2º)
(2º) - A cada 3 dias, trocar 50% do meio (~50 mL) conectando uma seringa preenchida com meio fresco à porta de troca do meio mais próxima da bomba e uma seringa vazia ao orifício mais próximo do reservatório para coletar o meio gasto (Figura 2).
OBS: A utilização de duas válvulas de três vias como portas de troca de meios facilita a operação contínua da perfusão durante a troca do meio. - Ao final do experimento, retirar o tecido da câmara de reação aparando as extremidades conectadas ao biorreator com tesoura cirúrgica estéril.
- Desmonte, limpe e esterilize o sistema para uso posterior.
5. Análise da amostra
- Fixar a amostra colhida em paraformaldeído (PFA) a 4% durante a noite a 4 °C.
- Incorporar o tecido em temperatura ótima de corte (OCT; ver Tabela de Materiais)19 e congelar por imersão em iso-pentano resfriado em nitrogênio líquido.
- Obter criosecções de 3-5 mm de espessura usando um criostato.
- Realizar imunohistoquímica (hematoxilina e eosina [H&E]) e/ou imunofluorescência. Siga o protocolo típico de imunofluorescência:
- Bloquear as fatias durante 1 h à temperatura ambiente com soro de cabra a 20% [v/v] em solução salina tamponada com fosfato (PBS; ver Tabela de Materiais).
- Incubar as fatias durante a noite a 4 °C com anticorpo primário de coelho contra CD31 diluído 1:50 em PBS (ver Tabela de Materiais).
- Lave três vezes com PBS por 5 min.
- Incubar durante 1 h a 37 °C com anticorpo secundário de cabra anticoelho fluorescentemente marcado diluído 1:200 em PBS e anticorpo fluorescente diretamente conjugado de actina de músculo liso α (SMA) diluído 1:200 em PBS (ver Tabela de Materiais).
- Lave três vezes com PBS por 5 min.
- Corar os núcleos com DAPI diluído 1:1.000 em PBS por 10 min à temperatura ambiente.
- Incubar com 0,1% (p/v) de Sudan Black (ver Tabela de Materiais) em etanol a 70% (v/v) durante 10 minutos à temperatura ambiente para reduzir a autofluorescência tecidual.
- Lave o tecido com água deionizada abundante. Monte as corrediças no meio de montagem.
- Obtenha imagens das amostras com um microscópio confocal de varredura a laser.
Representative Results
Este estudo estabeleceu um sistema de perfusão versátil e acessível (EasyFlow)13. O design impresso em 3D do sistema facilita a adoção do sistema por outros laboratórios e, portanto, incentiva a reprodutibilidade.
A pastilha de perfusão fabricada é alojada em um tubo centrífugo de 50 mL, criando um ambiente isolado. Usando duas pastilhas de perfusão, pode-se estabelecer uma alça de perfusão contendo um reservatório e uma câmara de reação, onde a amostra biológica é incubada. O sistema de perfusão é então conectado a uma bomba peristáltica e a sistemas opcionais de aquisição, como sensores de pressão e aparelhos de ultrassom, para monitorar as condições de cultura (Figura 2).
Amostras da artéria carótida porcina foram coletadas e processadas antes de serem cultivadas em perfusão por 7 dias. Para garantir a qualidade do tecido antes da cultura, foram realizados experimentos preliminares onde as amostras foram fixadas no momento da excisão, após o preparo do tecido e após a perfusão. A coloração fluorescente para marcadores endoteliais (CD31) e de músculo liso (αSMA) foi utilizada para avaliar a manutenção da integridade tecidual. Exemplos de tecidos bem preservados e lesados são apresentados na Figura 3 para comparação. As imagens mostram a importância do manuseio suave do tecido no momento da excisão, pois o processamento incorreto (estiramento excessivo, esmagamento, etc.) pode resultar em perda do endotélio antes da cultura. Os resultados também mostram a importância do estabelecimento gradual da perfusão para evitar danos luminais.
A coloração H&E foi realizada juntamente com a coloração por imunofluorescência (IF) para mostrar a manutenção da morfologia e distribuição global das células na parede do vaso após 7 dias de cultura (Figura 4). A aplicação de condições fisiológicas de cultura no dispositivo garante a manutenção da cobertura endotelial do lúmen, o alinhamento das células musculares lisas na média e a preservação dos vasa vasorum na adventícia.
O design compacto e modular do sistema de biorreator também permite uma ampla gama de configurações do sistema. O arranjo menor compreende um único biorreator e é ideal para estudos farmacológicos e de baixo volume (perfusão recirculante20, volume total de 50-70 mL). Para aumentar o tempo de cultura e reduzir o número de trocas de meios, um sistema de circulação de reservatório único, como o descrito neste protocolo, ou um sistema de alimentação constante é mais ideal, pois possuem um volume maior de meio em circulação. Uma configuração de dupla circulação21 pode ser estabelecida para explorar cenários experimentais onde a localização dos estímulos é crítica. O dispositivo atual também pode ser combinado com sistemas de controle mais sofisticados para permitir o controle preciso por realimentação de parâmetros como pH e oxigênio dissolvido (Figura 5).
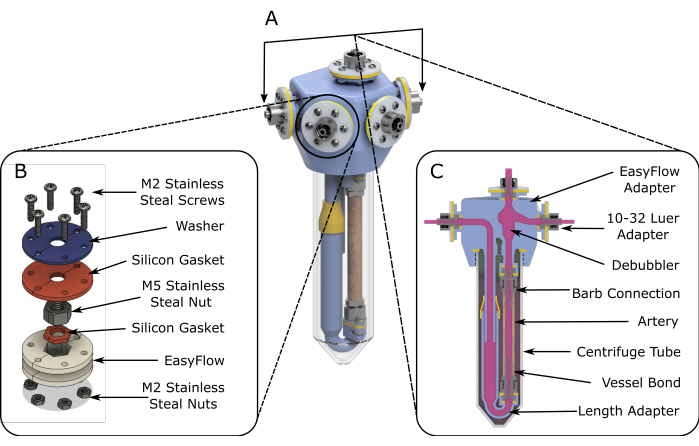
Figura 1: Esquemas de montagem do EasyFlow. (A) Esquemas renderizados em 3D auxiliando a montagem do inserto de perfusão. (B) Esquemas detalhados são fornecidos para facilitar a montagem dos locais de conexão. (C) Uma visão transversal do espaço de reação destaca os componentes essenciais da inserção EasyFlow e a conexão do tecido à inserção. Clique aqui para ver uma versão maior desta figura.
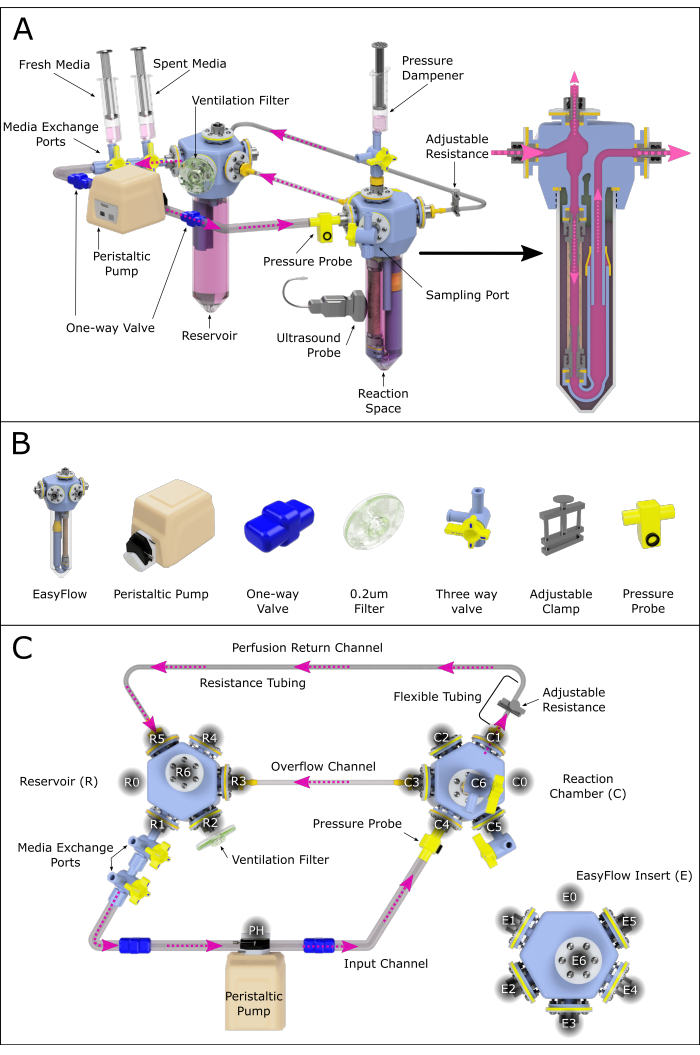
Figura 2: Representação esquemática da montagem do sistema de perfusão. (A) Sistema de perfusão montado contendo todos os componentes importantes, destacando sua posição relativa em um ambiente renderizado em 3D. Nem todos os componentes são para escalar. (B) Visões isométricas individuais dos componentes também são apresentadas. (C) Uma visão superior do sistema de perfusão montado é mostrada para auxiliar a montagem e conexão dos diferentes componentes. As portas foram rotuladas e numeradas no sentido anti-horário para navegar pelos vários locais de conexão através do sistema de perfusão. Este princípio tem sido aplicado ao reservatório (R) e à câmara de reação (C). Os vários canais que ligam as duas câmaras também receberam nomes para referência. Clique aqui para ver uma versão maior desta figura.
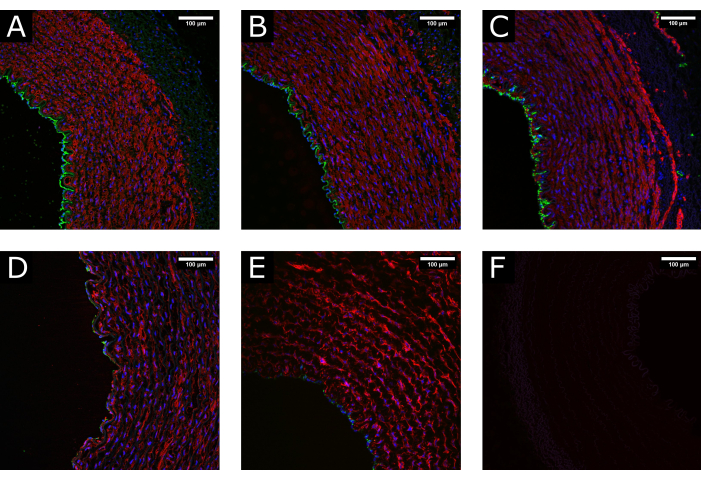
Figura 3: Manutenção tecidual durante o processamento. (A) Imagens confocais mostram a estrutura normal de uma artéria no momento da colheita, (B) após limpeza e processamento e (C) após cultura de perfusão, demonstrando a manutenção de uma morfologia bem preservada. (D) Exemplos de tecido danificado devido ao manuseio excessivo ou incorreto durante o processamento ou (E) devido à aplicação de condições de cultura não fisiológicas (isto é, início abrupto de alto fluxo) mostram esgotamento da cobertura luminal e interrupção do meio. (F) O controle negativo indica a especificidade da coloração. CD31: verde; αSMA: vermelho; DAPI: azul. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
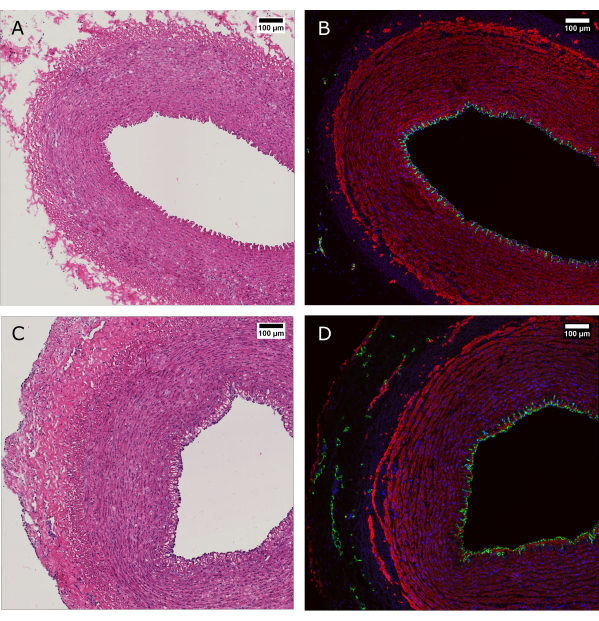
Figura 4: Avaliação histológica do tecido antes e após a cultura de perfusão. (A e B) O tecido arterial foi avaliado por histologia no momento da colheita e (C e D) após 7 dias de cultivo com o sistema de biorreator. (A e C) A coloração H&E revela preservação da estrutura e organização da parede arterial. (B e D) A coloração por imunofluorescência do mesmo tecido evidencia cobertura endotelial, alinhamento de células musculares lisas e vasa vasorum na adventícia. CD31: verde; AME: vermelho; DAPI: azul. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
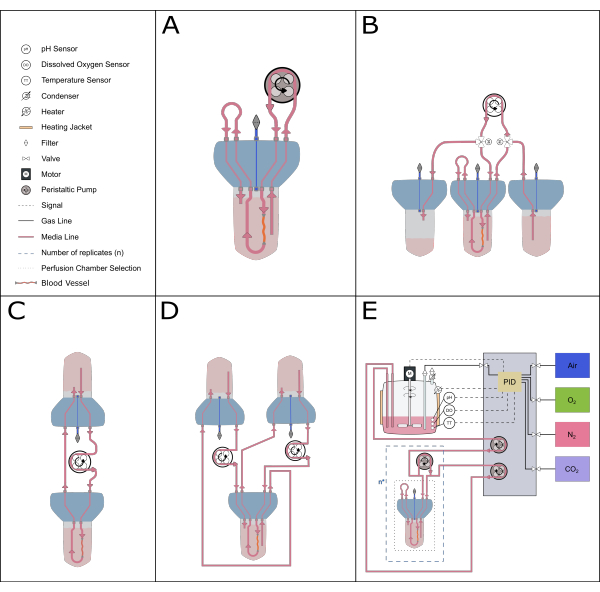
Figura 5: Representação esquemática dos possíveis ajustes de perfusão. Vários dispositivos alternativos podem ser acomodados com a pastilha de perfusão para permitir diferentes estudos experimentais. (A) O arranjo de perfusão recirculante minimiza o volume de meio necessário. (B) A instalação de alimentação constante fornece um suprimento constante de meio para o tecido. (C) A circulação de um único reservatório (como descrito neste trabalho) fornece um volume maior de meios para incubações de longa duração e inclui uma zona tampão para troca de ar e equilíbrio de pressão. (D) A configuração da dupla circulação fornece duas alças distintas alimentando as circulações interna (dentro da artéria) e externa (espaço de reação) de forma independente. (E) O arranjo dinâmico de perfusão inclui gases contínuos e controle de pH por um controlador de derivada integral proporcional (PID). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Componentes para fabricação dos insertos. Clique aqui para baixar esta tabela.
Arquivo Suplementar 1: Modelo 3D da pastilha EasyFlow para fabricação de impressão 3D. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Esquemas de projeto do dispositivo construído, visualização de seção, impressão e componentes de vedação. Clique aqui para baixar este arquivo.
Discussion
Os sistemas de perfusão vascular ex vivo constituem uma plataforma única para estudar a função e o comportamento das células vasculares dentro de seus tecidos nativos sob condições controladas, o que possibilita a dissecção de processos complexos como o remodelamento vascular pós-lesão22. No entanto, a maioria dos biorreatores relatados são sistemas fabricados internamente baseados em componentes feitos sob medida e muitas vezes são difíceis de replicar por outros23. Soluções comerciais alternativas existem, mas carecem de flexibilidade no projeto e podem ser relativamente dispendiosas24.
Desenvolvemos um sistema alternativo que fornece uma plataforma fácil, barata e reprodutível que pode ser fabricada usando técnicas de impressão 3D de código aberto13. O presente artigo descreve a configuração do sistema para habilitar aplicativos reproduzíveis por usuários finais. Essa configuração permite a aplicação de condições fisiológicas e patológicas de pressão (40-180 mmHg), vazão (6-30 mL/min) e em combinação com meios que mimetizam a viscosidade sanguínea, com graus variados de tensão de cisalhamento.
A reprodutibilidade é um aspecto essencial do processo científico, pois permite que os pesquisadores validem os achados de outros e construam sobre eles para avançar nossa compreensão das doenças vasculares. Além disso, ferramentas que possibilitem e promovam colaborações entre grupos são essenciais para o avanço do conhecimento científico. O EasyFlow representa um exemplo dessas soluções acessíveis e de código aberto que podem ser facilmente produzidas e adotadas por laboratórios que trabalham em uma ampla gama de projetos dentro do campo das ciências vasculares e além.
Relatamos que essa cultura do dispositivo mantém a viabilidade do tecido arterial por pelo menos 7 dias, podendo ser usada para modelar etapas específicas da doença vascular. Com isso, pode-se modelar as condições fisiológicas de fluxo e pressão13. É importante ressaltar que essa cultura de perfusão é custo-efetiva devido ao baixo custo de produção e ao baixo volume de meio necessário para operar o sistema.
O design 3D também pode ser adaptado a novas aplicações, e novos materiais para impressão podem ser testados. Mesmo em seu formato atual, o espaço de alojamento de amostras pode ser facilmente adaptado a amostras de diferentes tamanhos, alterando o comprimento dos encaixes ou o furo dos conectores luer. É importante notar que, dada a natureza modular do dispositivo e suas pequenas dimensões, este biorreator pode ser usado em vários setups (Figura 5) e pode ser aplicado em culturas multiplex, onde várias amostras podem ser expostas a diferentes condições ao mesmo tempo em biorreatores separados.
Prevê-se que o uso do sistema seja expandido no futuro para apoiar a cultura de vasos sanguíneos de diferentes origens (por exemplo, diferentes espécies) e de diferentes naturezas (por exemplo, veias, linfáticos), e talvez aplicado à cultura de outros tecidos ocos (por exemplo, traqueia, intestino). Em particular, pesquisas mostram que a cultura de arcabouços teciduais em perfusão constante auxilia na distribuição homogênea das células dentro da construção e maturação do tecido resultante25,26. Além disso, a semeadura dos enxertos vasculares em perfusão contribui para a obtenção de uma luz vascular mais uniformemente celularizada, em comparação com os métodosestáticos27. Por essa razão, vislumbramos que o sistema seja aplicado à engenharia de tecidos para ajudar a enfrentar os desafios atuais, permitindo o desenvolvimento futuro de substitutos sintéticos reprodutíveis dos vasos sanguíneos28.
O protocolo aqui descrito apresenta alguns passos importantes críticos para o sucesso da cultura de fluxo. Estabelecer e monitorar condições adequadas de escoamento não é trivial e precisa ser realizado em cada sistema quando ele é montado pela primeira vez, para garantir que as condições de cultura sejam fisiológicas. O fluxo e a pressão foram monitorados por meio de sensores de pressão e imagens de ultrassom. Outro ponto crítico é garantir que o tecido esteja viável e intacto no início da cultura. Isso requer uma fonte fresca, manuseio cuidadoso e pode ser verificado por análise histológica. Além disso, a solução de problemas deve ser executada no início de cada experimento para identificar qualquer potencial contaminação bacteriana ou fonte de vazamento de mídia.
É importante ressaltar que o sistema de perfusão descrito, embora forneça condições fisiológicas de pressão e fluxo, é incapaz de mimetizar inteiramente os complexos padrões de onda de pressão registrados in vivo. Essa limitação é atribuível ao uso de bomba peristáltica e pode ser resolvida com o uso de equipamentos mais especializados para reproduzir condições hemodinâmicas avançadas. A cultura de vasos sanguíneos em um biorreator também é incapaz de abordar estudos em que o sistema imunológico ou a interação com outros órgãos é crítica.
Em conclusão, é apresentado um sistema de perfusão impresso em 3D simples que pode mimetizar o ambiente hemodinâmico fisiológico, o que deve contribuir para a padronização de culturas de vasos sanguíneos ex vivo . Seu potencial de customização e aplicação em cultura de longo prazo o torna uma ferramenta essencial para o avanço da compreensão desses complexos sistemas biológicos em fisiologia e condições patológicas.
Disclosures
Os autores não têm conflitos de interesse a declarar.
Acknowledgements
Os autores agradecem ao Centro de Patologia Veterinária da Faculdade de Medicina Veterinária da Universidade de Surrey pelos serviços de histologia. Também agradecemos aos Drs. L. Dixon, A. Reis e M. Henstock do The Pirbright Institute (Pirbright, Reino Unido) por seu apoio na aquisição dos tecidos animais, e ao Departamento de Ciências Bioquímicas da Universidade de Surrey, especialmente à equipe técnica, por seu apoio contínuo. O RSM foi apoiado pelo prêmio de estudante do Doctoral College (University of Surrey), DM e PC foram apoiados pelo National Centre for the Replacement, Refinement and Reduction of Animals in Research (números de bolsa: NC/R001006/1 e NC/T001216/1).
Materials
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
References
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved