Um ensaio adaptado baseado em densidade óptica em microplacas para caracterizar a infecção por actinobacteriófagos
In This Article
Summary
Um método de microplacas baseado em densidade óptica é descrito para quantificar o crescimento bacteriano a longo prazo na presença de bacteriófagos, adequado para actinomicetos e outras bactérias de crescimento lento. Este método inclui modificações para reduzir a evaporação e condensação da pálpebra e código R para calcular métricas de infecção viral, incluindo a área sob a curva, o máximo de crescimento e a virulência relativa.
Abstract
Os bacteriófagos são uma parte fundamental dos ambientes naturais e têm uma poderosa capacidade de moldar populações bacterianas. Para entender como fagos individuais interagem com hospedeiros bacterianos de crescimento lento, como actinomicetos, um método fácil e confiável para quantificar o crescimento bacteriano a longo prazo na presença de fagos é necessário. Os leitores de microplacas espectrofotométricas permitem medições repetidas de alto rendimento, mas incubar um pequeno volume por um tempo prolongado pode apresentar desafios técnicos. Este procedimento adapta uma microplaca padrão de 96 poços para permitir a co-cultura de fagos e bactérias sem subamostragem por 96 h, com o crescimento bacteriano registrado a cada 8 h usando valores espectrofotométricos de absorbância. Esses valores de densidade óptica são analisados usando R para produzir métricas de infecção, incluindo a inibição percentual de crescimento, virulência relativa e o índice de Stacy-Ceballos. Os métodos descritos aqui fornecem uma maneira eficaz de conduzir e analisar experimentos de curva de crescimento de microplacas de duração prolongada e incluem modificações para reduzir a evaporação e a condensação da tampa. Esses protocolos facilitam ensaios baseados em microplacas de interações entre hospedeiros bacterianos de crescimento lento e seus bacteriófagos.
Introduction
Bacteriófagos ou fagos são vírus que infectam bactérias. São as entidades biológicas mais numerosas doplaneta1, sendo geralmente aceito que os bacteriófagos influenciam a evolução bacteriana e os processos ecossistêmicos 2,3,4. Existem vários métodos para descrever, medir e analisar a gama de hospedeiros bacteriófagos 8 e a dinâmica da infecção5,6, incluindo métodos baseados em ágar como o método de ágar camada dupla7 e métodos de microplacas baseados em densidade óptica 8,9,10,11,12. Cada método tem suas próprias vantagens e desvantagens. Devido à sua eficiência, os testes de plaqueamento utilizando o método de ágar camada dupla são o "padrão ouro" para ensaios de gama de hospedeiros, mas esse métodoconsome tempo e trabalho9. Métodos rápidos de microplacas, que retornam resultados em 24 h ou menos, fornecem excelentes resultados para hospedeiros bacterianos de crescimento rápido, como Escherichia coli 9,10,11,12, mas são muito breves para mostrar a progressão da infecção por bacteriófagos em hospedeiros bacterianos de crescimento mais lento, como os actinomicetos 7,13,14,15.
Um ensaio de microplaca baseado em densidade óptica projetado para bactérias de crescimento rápido não pode ser executado pelos vários dias necessários para caracterizar a dinâmica da infecção em uma bactéria hospedeira de crescimento lento sem que ocorra evaporação e dê densidades bacterianas artificialmente altas. Assim, a obtenção de dados comparáveis de alto rendimento sobre a dinâmica da infecção por bacteriófagos para espécies bacterianas de crescimento lento requer técnicas especializadas adaptadas para essas bactérias.
O método de microplacas aqui apresentado reduz a evaporação, permitindo que bactérias de crescimento lento sejam co-cultivadas com um fago por um período prolongado de 96 h e permitindo investigações sobre a dinâmica da infecção por fagos e a gama de hospedeiros. Este método também apresenta o índice Stacy-Ceballos16, uma métrica baseada em densidade óptica que permite comparações de virulência entre sistemas de vírus hospedeiros díspares.
Protocol
Embora este protocolo seja escrito para Gordonia terrae, ele também foi usado com sucesso para Gordonia lacunae, Gordonia rubripertincta, e Gordonia westfalica.
1. Preparação de bactérias
- Em um gabinete de biossegurança, utilizar boas práticas microbiológicas17 para inocular uma única colônia de Gordonia terrae CAG3 em um frasco compartimentado estéril de 1 L com 200 mL de caldo de cálcio de levedura peptona18 (PYCa) contendo 0,01 mg/mL de cicloheximida (ver Tabela de Materiais).
- Incubar o balão a 30 °C com agitação a 250 rpm até que a cultura esteja saturada ou durante 3 dias7.
- Diluir serialmente a cultura saturada de G. terrae em caldo PYCa e espalhar 100 μL de cada uma das diluições de 10−4, 10−5 e 10−6 em placas de PYCa 19,20. Refrigerar a cultura saturada não diluída a 4 °C.
- Incubar as placas de espalhamento invertidas durante 3 dias a 30 °C.
- Após a incubação, identifique uma "placa contável", uma placa com 20-200 colônias. Contar o número de colônias nessa placa e calcular as unidades formadoras de colônias por mililitro (ufc/mL)19,20.
- Diluir a cultura saturada com caldo PYCa para 4,0 x 106 ufc/mL de bactérias.
2. Preparação de fagos
NOTA: Os resultados representativos relatados foram obtidos com o fago Gordonia DelRio21, um bacteriófago de clima temperado isolado em G. terrae. Estes métodos também têm sido usados com sucesso com outros fagos de Gordonia .
- Começando com um bacteriófago isolado, diluir em série a amostra de fago em tampão de fago7 para uma diluição de 1 x 10−8 . Realizar um ensaio de titulação de fago em ágar de dupla camada7 infectando 0,3 mL da cultura saturada de G. terrae com 10 μL de cada diluição do fago. Após uma incubação de 5-10 min à temperatura ambiente, combine a mistura de bactérias-fagos com 3 mL de ágar PYCa e despeje em placas de ágar PYCa.
- Incubar as placas invertidas a 30 °C durante 3 dias ou até formar placas7.
- Após a incubação, identifique uma "placa contável", uma placa com 20-200 placas. Contar o número de placas nessa placa e calcular unidades formadoras de placa por mililitro (pfu/mL)7.
3. Preparação de microplacas
NOTA: Microplacas de fundo plano de 96 poços (consulte a Tabela de Materiais) devem ser usadas para este método. Todo o preparo e carregamento da placa deve ser preenchido em um gabinete de biossegurança, devendo ser utilizadas boas práticasmicrobiológicas 17.
- Preparar a solução de revestimento antiembaçante da tampa combinando 100 μL de Triton-X 100, 40 mL de isopropanol a 100% e 160 mL de água deionizada22. Mexa para misturar e guarde à temperatura ambiente.
- Em um gabinete de biossegurança, adicione 6 mL de solução de revestimento da tampa à superfície interna de uma tampa de microplaca estéril de 96 poços, segurando a tampa pelas bordas e girando-a para garantir que ela seja coberta pela solução. Deixe a solução descansar na tampa por 20 s, depois despeje a solução e inverta a tampa em um papel toalha autoclavado em um ângulo até que a tampa esteja completamente seca, o que normalmente leva de 35 a 45 minutos. Tenha cuidado para segurar a tampa pelas bordas.
- Preparar 20 mL de agarose 0,1% em água para cada microplaca de 96 poços, microondulando para derreter a agarose.
- Uma vez que a agarose tenha esfriado a 50-60 °C, pipetar 100 μL da agarose 0,1% em todos os espaços entre os poços da placa e 200 μL de agarose nos poços da linha A e da linha H e coluna 1, coluna 2, coluna 11 e coluna 1223 (Figura 1).
4. Carregando a placa com bactérias e fagos
OBS: Todo o preparo e carregamento da placa deve ser preenchido em gabinete de biossegurança, devendo ser utilizadas as boas práticasmicrobiológicas 17 .
- A placa de 96 poços conterá 75 μL de bactérias 2,0 x 106 ufc/mL em cada poço9. Diluir a cultura bacteriana 4,0 x 106 ufc/mL 1:1 com caldo 2x PYCa para 2,0 x 106 ufc/mL. Preparar 5 mL por placa de 96 poços.
- Diluir o lisado de fago usando tampão de fago 7 para fazer 1 mL cada de concentraçõesde 2,0 x 106 pfu/mL, 2,0 x 105 pfu/mL e 2,0 x 104 pfu/mL. Isso permitirá uma multiplicidade de infecção (MOI) de 1, 0,1 e 0,01 dentro da microplaca9.
- Para carregar a microplaca, pegue uma placa que foi preparada com solução antiembaçante e agarose, e pipete 75 μL da bactéria 2,0 x10 6 ufc/mL nas colunas 3-10, seguindo a Figura 1.
- Na coluna 3 e na coluna 4, adicionar 75 μL de tampão fagológico estéril a cada poço para servir como controle positivo sem fago, seguindo a Figura 1, e pipetar para cima e para baixo para misturar após cada adição. Adicionar 75 μL do fago 2,0 x 10 6 pfu/mL à coluna 5 e à coluna6 , 75 μL do fago 2,0 x10 5 pfu/mL à coluna 7 e à coluna 8, e 75 μL do fago 2,0 x 104 pfu/mL à coluna 9 e à coluna 10, pipetando para cima e para baixo para misturar após cada adição.
- Fita adesiva de ambos os lados curtos da placa com fita de marcação de 0,5 para selar parcialmente a placa, permitindo a troca gasosa.
5. Medição de incubação e absorbância
- Uma vez que as placas estejam carregadas com bactérias e fagos, coloque-as em um agitador de microplacas a 250 rpm e incube a 30 °C.
- Incubar as placas por 96 h, fazendo uma medição de densidade óptica a 600 nm em um leitor de microplacas a cada 8 h a partir da hora 16. Retorne as placas ao agitador entre as medições.
NOTA: Períodos de medição de 4, h 6 h, 8 h e 12 h foram avaliados, começando na hora 0, e determinou-se que um período de amostragem de 8 h começando em 16 h pós-infecção capturou melhor as interações Gordonia-fago. - Monitorar a tampa quanto à condensação durante todo o experimento. Se for observada condensação, substituir a tampa por outra tampa revestida de acordo com o passo 3.2.
- Gere curvas de controle e crescimento infectado seguindo a seção 6 do protocolo.
6. Análise dos dados
- Use um programa de planilha para calcular a média e o desvio padrão para cada diluição de fago, seguindo o layout da planilha no repositório Stacy-Ceballos-Index GitHub (https://github.com/eichristenson/Stacy-Ceballos-Index).
- Crie curvas de crescimento de controle e infectados e calcule métricas de infecção usando R (consulte a Tabela de Materiais) com os pacotes DescTools 24, dplyr 25, ggplot226 e readxl27 e seguindo o script R no repositório Stacy-Ceballos-Index GitHub (https://github.com/eichristenson/Stacy-Ceballos-Index).
- AUCcon é a área sob a curva de controle não infectado, enquanto AUCinf é a área sob a curva infectada16. Calcule a AUC e, em seguida, calcule a inibição percentual do crescimento com base nos valores da área sob a curva, PIAUC16, usando a seguinte equação:
(1 - [AUCinf/AUCcon]) × 100 - As linhas horizontais tracejadas em cada curva mostram o pico de crescimento, com o pico de crescimento não infectado marcado como N assíntota(con) e o pico de crescimento infectado marcado comoN assíntota(inf). Identifique os valores de Nassíntota e, em seguida, calcule a inibição percentual do crescimento com base nesses valores de pico de crescimento, PImax16, usando a seguinte equação:
(1 - [N assíntota(inf)/ Nassíntota(con)]) × 100 - Calcular o índice de Stacy-Ceballos, ISC16, a partir dos valores de PIAUC e PImax , da seguinte forma:
(PIAUC × PImax) 0,5
Calcular a virulência relativa integrando o índice de Stacy-Ceballos ao longo do tempo16.
- AUCcon é a área sob a curva de controle não infectado, enquanto AUCinf é a área sob a curva infectada16. Calcule a AUC e, em seguida, calcule a inibição percentual do crescimento com base nos valores da área sob a curva, PIAUC16, usando a seguinte equação:
Representative Results
Um experimento é bem-sucedido se a curva de crescimento resultante mostrar um aumento na população bacteriana de controle positivo ao longo do tempo, sem flutuação súbita na absorbância. Exemplos de um experimento bem-sucedido em um MOI de 1 com e sem infecção fagogênica produtiva são mostrados na Figura 2 e na Figura 3, respectivamente. Uma infecção produtiva em um MOI de 0,01 está representada na Figura 4. O padrão de crescimento de controle positivo (curva verde) observado nas três figuras indica que as bactérias estão crescendo, não estão se aglomerando durante o crescimento e não há contaminantes. A aglomeração e a contaminação são indicadas por uma absorvância excepcionalmente alta em um único ponto de tempo. Os desvios-padrão normalmente aumentam ao longo do tempo de um experimento; no entanto, um aumento drástico ou desvios-padrão sobrepostos entre as curvas controle e infectada podem indicar contaminação ou aglomeração em um ou mais poços.
A curva de crescimento representando uma infecção fagogênica produtiva, representada pela Figura 2, mostra redução da absorbância bacteriana ao longo do tempo em poços com a adição do fago. Essa redução na densidade bacteriana não será observada se a bactéria estiver fora da faixa de hospedeiro do fago, como mostrado na Figura 3.
As métricas de infecção são mostradas para todos os experimentos representativos, com umI SC relativamente grande para as infecções produtivas na Figura 2 e Figura 4 e um ISC muito pequeno na Figura 3 para o fago que não infectou eficientemente a bactéria hospedeira.
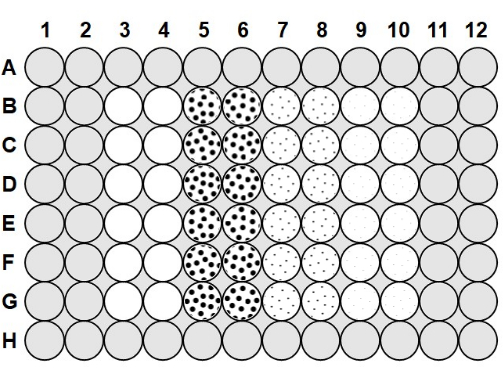
Figura 1: Layout da microplaca. As áreas cinzentas são preenchidas com 0,1% de agarose. Os poços em branco na coluna 3 e na coluna 4 são poços de controle positivo sem fago contendo apenas tampão de fago e 2,0 x 106 ufc/mL de bactérias. Os poços pontilhados contêm fagos e bactérias 2,0 x 106 ufc/mL; os pontos grandes na coluna 5 e na coluna 6 indicam um MOI de 1 com fago de 2,0 x 106 pfu/mL; os pontos médios na coluna 7 e na coluna 8 indicam um MOI de 0,1 com 2,0 x 105 pfu/mL de fago; e os pequenos pontos na coluna 9 e coluna 10 indicam um MOI de 0,01 com 2,0 x 104 pfu/mL de fago. Clique aqui para ver uma versão maior desta figura.
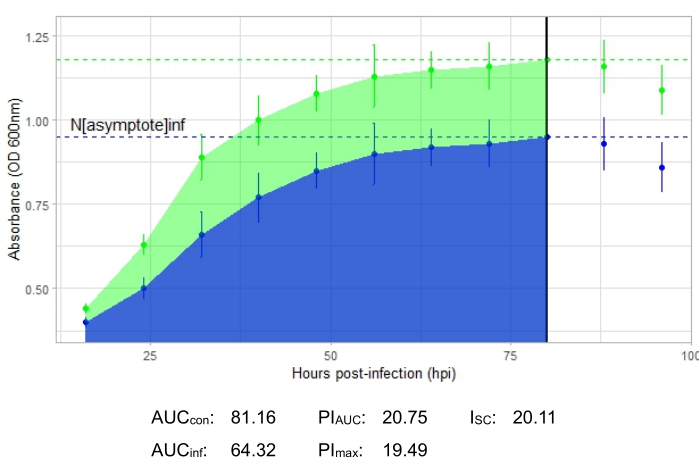
Figura 2: Experimento bem-sucedido de curva de crescimento com um fago em uma MOI de 1 que infecta produtivamente a bactéria hospedeira. Os valores médios de absorbância (± desvio padrão) são mostrados para bactérias não infectadas (verde) e bactérias com o fago adicionado (azul). Abreviações: AUC = área sob a curva; PIAUC = inibição percentual do crescimento calculada a partir da área sob a curva; Nassíntota = valor de pico de crescimento; PImax = inibição percentual do crescimento calculada a partir dos valores de pico de crescimento; ISC = índice de Stacy-Ceballos. Este gráfico representa o fago Gordonia temperado DelRio infectando G. terrae, a bactéria em que foi isolado. Clique aqui para ver uma versão maior desta figura.
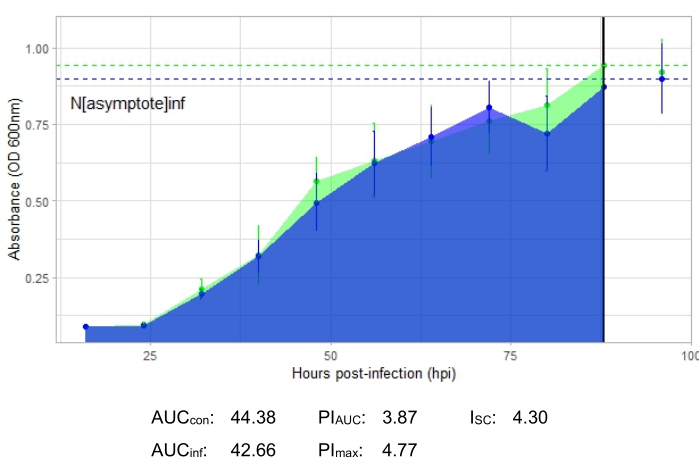
Figura 3: Experimento bem-sucedido de curva de crescimento com um fago em um MOI de 1 que não infecta eficientemente a bactéria hospedeira. Os valores médios de absorbância (± desvio padrão) são mostrados para bactérias não infectadas (verde) e bactérias com o fago adicionado (azul). Abreviações: AUC = área sob a curva; PIAUC = inibição percentual do crescimento calculada a partir da área sob a curva; Nassíntota = valor de pico de crescimento; PImax = inibição percentual do crescimento calculada a partir dos valores de pico de crescimento; ISC = índice de Stacy-Ceballos. Este gráfico representa a infecção por G. rubripertincta por DelRio. Clique aqui para ver uma versão maior desta figura.
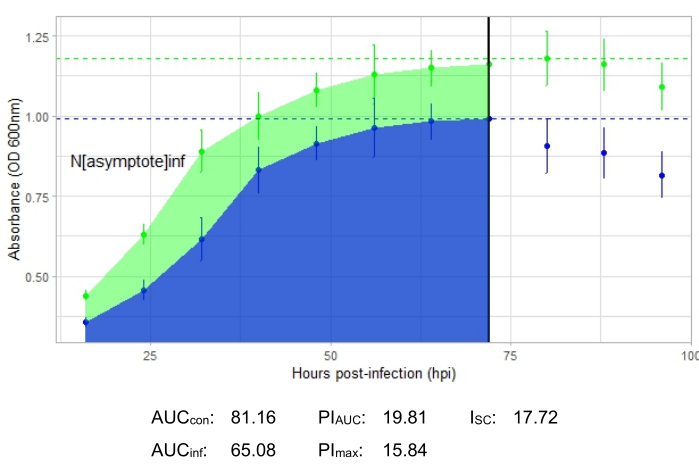
Figura 4: Experimento bem-sucedido de curva de crescimento com um fago em um MOI de 0,01. Os valores médios de absorbância (± desvio padrão) são mostrados para bactérias não infectadas (verde) e bactérias com o fago adicionado (azul). Abreviações: AUC = área sob a curva; PIAUC = inibição percentual do crescimento calculada a partir da área sob a curva; Nassíntota = valor de pico de crescimento; PImax = inibição percentual do crescimento calculada a partir dos valores de pico de crescimento; ISC = índice de Stacy-Ceballos. Este gráfico representa a infecção de G. terrae por DelRio. Clique aqui para ver uma versão maior desta figura.
Discussion
Este método de microplaca baseado em densidade óptica permite investigar a gama de hospedeiros de bacteriófagos e a dinâmica da infecção11 e mostra a utilidade do índice de Stacy-Ceballos16 como medida da virulência de bacteriófagos. Embora esse método possa ser utilizado com qualquer sistema bacteriófago-hospedeiro, ele foi projetado especificamente para adaptar ensaios de crescimento rápido em microplacas 9,10,11 para uso com bactérias de crescimento mais lento, como actinomicetos. Ensaios rápidos de microplacas não podem ser usados para bactérias de crescimento lento sem modificações para tratar a evaporação e a condensação da tampa. Este método descreve essas modificações necessárias e demonstra, pela primeira vez, o uso do índice de Stacy-Ceballos e métricasrelacionadas16 para descrever a infecção por bacteriófagos.
A evaporação pode ser um desafio substancial em ensaios de curva de crescimento de placas de 96 poços de vários dias; Este método resolve esse problema adicionando agarose aos poços de borda e aos espaços entre os poços. A margem de agarose, combinada com o tratamento antiembaçante da tampa22, fornece a umidade necessária dentro da microplaca e permite medições confiáveis de densidade óptica. Sem a umidade adicionada, ocorre evaporação substancial do efeito de borda23 durante o longo período de incubação necessário, levando a leituras de densidade óptica artificialmente altas. O tratamento antiembaçamento da tampa é uma modificação necessária, pois a condensação da tampa também pode elevar artificialmente os valores de densidade óptica. Agitar as placas durante o período de incubação é uma modificação recomendada, pois bactérias actinomicetas podem se aglomerar durante o crescimento, dando valores de densidade óptica artificialmente altos e efetivamente diminuindo a multiplicidade de infecção.
A proporção de bactérias/fagos em experimentos que caracterizam a dinâmica da infecção é crítica, pois deve haver fagos suficientes para mostrar um efeito de infecção, mas não tantos que a população bacteriana hospedeira caia imediatamente9 ou a frequência de lisogenia seja dramaticamente aumentada28. Nesse método, a razão que se mostrou mais efetiva para a obtenção de resultados consistentes foi um MOI de 1, mas resultados utilizáveis também foram obtidos com MOIs de 0,1 e 0,01. Ao implementar este método, recomenda-se escolher uma concentração de bactérias e testar múltiplas concentrações de fagos na faixa de MOI de 0,01-1 9,10,11.
Essa técnica aqui descrita permite que as interações bacteriófagos-hospedeiro sejam avaliadas para bactérias de crescimento lento em ensaios de microplacas de alto rendimento, em vez de com subamostragem de um frasco de cultura maior em cada intervalo de medição29. Além disso, ao demonstrar como os ensaios de crescimento em microplacas 9,10,11 podem ser adaptados, essa técnica aumenta a utilidade de outros ensaios de bacteriófagos baseados em microplacas para bactérias de crescimento mais lento, incluindo a caracterização do fago 5,6,12 e estudos de evolução 30,31. Finalmente, este método demonstra o uso do índice de Stacy-Ceballos16 para descrever a infecção por bacteriófagos. Esta métrica foi inicialmente desenvolvida com dados de um sistema modelo de vírus archaeal e é calculada a partir de valores de densidade óptica, dando-lhe assim ampla utilidade em sistemas de vírus díspares.
Disclosures
Os autores não têm nada a revelar.
Acknowledgements
Este trabalho foi apoiado por uma bolsa do NSF DBI Biology Integration Institute (BII) (prêmio nº 2119968; PI-Ceballos) e pelo programa Arkansas INBRE, com bolsa do National Institute of General Medical Sciences, (NIGMS), P20 GM103429 do National Institutes of Health. Os autores também agradecem o apoio do Programa de Iniciação Científica de Verão de Patterson da Universidade Batista de Ouachita.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
References
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved