Адаптированный микропланшетный анализ на основе оптической плотности для характеристики инфекции актинобактериофагов
In This Article
Summary
Описан метод микропланшетов на основе оптической плотности для количественной оценки долгосрочного роста бактерий в присутствии бактериофагов, подходящих для актиномицетов и других медленно растущих бактерий. Этот метод включает в себя модификации для уменьшения испарения и конденсации крышки, а также код R для расчета показателей вирусной инфекции, включая площадь под кривой, максимум роста и относительную вирулентность.
Abstract
Бактериофаги являются ключевой частью природной среды, и они обладают мощной способностью формировать бактериальные популяции. Чтобы понять, как отдельные фаги взаимодействуют с медленно растущими бактериальными хозяевами, такими как актиномицеты, необходим простой и надежный метод количественной оценки долгосрочного роста бактерий в присутствии фагов. Спектрофотометрические считыватели микропланшетов позволяют проводить высокопроизводительные повторные измерения, но инкубация небольшого объема в течение длительного времени может представлять технические проблемы. Эта процедура адаптирует стандартную 96-луночную микропланшет, чтобы обеспечить совместное культивирование фагов и бактерий без суботбора проб в течение 96 часов, при этом рост бактерий регистрируется каждые 8 часов с использованием спектрофотометрических значений поглощения. Эти значения оптической плотности анализируются с использованием R для получения показателей заражения, включая процентное ингибирование роста, относительную вирулентность и индекс Стейси-Себальоса. Методы, изложенные здесь, обеспечивают эффективный способ проведения и анализа экспериментов по кривой роста микропланшетов с увеличенной продолжительностью и включают модификации для уменьшения испарения и конденсации крышки. Эти протоколы облегчают микропланшетные анализы взаимодействия между медленно растущими бактериальными хозяевами и их бактериофагами.
Introduction
Бактериофаги или фаги — это вирусы, которые заражают бактерии. Они являются самыми многочисленными биологическими объектами на планете1, и принято считать, что бактериофаги влияют на эволюцию бактерий и экосистемные процессы 2,3,4. Существует несколько методов для описания, измерения и анализа бактериофага-хозяина 8 и динамики инфекции 5,6, включая методы на основе агара, такие как методдвухслойного агара 7 и методы микропланшетов на основе оптической плотности8,9,10,11,12. Каждый метод имеет свои преимущества и недостатки. Благодаря своей эффективности испытания на покрытие с использованием метода двухслойного агара являются «золотым стандартом» для анализов диапазона хозяев, но этот метод требует много времени и труда9. Методы быстрых микропланшетов, которые возвращают результаты через 24 часа или меньше, дают отличные результаты для быстрорастущих бактериальных хозяев, таких как Escherichia coli 9,10,11,12, но слишком коротки, чтобы продемонстрировать прогрессирование бактериофагальной инфекции у медленно растущих бактериальных хозяев, таких как актиномицеты7,13,14,15.
Микропланшетный анализ на основе оптической плотности, предназначенный для быстрорастущих бактерий, не может быть запущен в течение нескольких дней, необходимых для характеристики динамики инфекции в медленно растущей бактерии-хозяине, без испарения и создания искусственно высокой бактериальной плотности. Таким образом, получение сопоставимых высокопроизводительных данных о динамике бактериофаговой инфекции для медленно растущих видов бактерий требует специализированных методов, адаптированных для этих бактерий.
Представленный здесь метод микропланшетов уменьшает испарение, что позволяет культивировать медленно растущие бактерии совместно с фагом в течение длительного 96-часового периода и позволяет исследовать динамику фаговой инфекции и диапазон хозяев. Этот метод также демонстрирует индекс Стейси-Себальоса16, метрику на основе оптической плотности, которая позволяет сравнивать вирулентность между разрозненными вирусными системами-хозяевами.
Protocol
Хотя этот протокол написан для Gordonia terrae, он также успешно использовался для Gordonia lacunae, Gordonia rubripertincta и Gordonia westfalica.
1. Подготовка бактерий
- В шкафу биобезопасности используйте надлежащую микробиологическую практику17 для инокуляции одной колонии Gordonia terrae CAG3 в стерильную передвижную колбу объемом 1 л 200 мл пептонного дрожжевого кальциевого бульона18 (PYCa), содержащего 0,01 мг / мл циклогексимида (см. Таблицу материалов).
- Инкубируют колбу при 30 °C с встряхиванием при 250 об/мин до насыщения культуры или в течение 3 суток7.
- Последовательно разбавляют насыщенную культуру G. terrae в бульоне PYCa и распределяют по 100 мкл каждого из 10−4, 10−5 и 10−6 разведений на пластинах PYCa19,20. Охладите неразбавленную насыщенную культуру при температуре 4 °C.
- Инкубируйте разложенные пластины в перевернутом виде в течение 3 дней при 30 °C.
- После инкубации определите «счетную тарелку», тарелку с 20-200 колониями. Подсчитайте количество колоний на этой пластине и рассчитайте колониеобразующие единицы на миллилитр (КОЕ/мл)19,20.
- Разбавьте насыщенную культуру бульоном PYCa до 4,0 x 106 КОЕ/мл бактерий.
2. Подготовка фагов
ПРИМЕЧАНИЕ: Репрезентативные результаты, о которых сообщалось, были получены с помощью фага Gordonia DelRio21, бактериофага умеренного пояса, выделенного на G. terrae. Эти методы также были успешно применены с другими фагами Gordonia .
- Начиная с изолированного бактериофага, последовательно разбавляют образец фага в фаговом буфере7 до разведения 1 х 10−8 . Проведите двухслойный анализ титра фагаагара 7 путем инфицирования 0,3 мл насыщенной культуры G. terrae 10 мкл каждого разведения фага. После 5-10-минутной инкубации при комнатной температуре смешайте смесь бактерий и фагов с 3 мл верхнего агара PYCa и вылейте на агаровые пластины PYCa.
- Инкубируйте пластины, перевернутые при 30 ° C, в течение 3 дней или до образованиябляшек 7.
- После инкубации определите «счетную тарелку», тарелку с 20-200 бляшками. Подсчитайте количество бляшек на этой пластине и рассчитайте количество единиц образования бляшек на миллилитр (БОЕ / мл)7.
3. Подготовка микропланшетов
ПРИМЕЧАНИЕ: Для этого метода следует использовать плоскодонные 96-луночные микропланшеты (см. Таблицу материалов). Вся подготовка и загрузка пластин должны быть завершены в шкафу биобезопасности, и следует использовать надлежащую микробиологическую практику17.
- Приготовьте раствор для покрытия крышки против запотевания, объединив 100 мкл Triton-X 100, 40 мл 100% изопропанола и 160 мл деионизированной воды22. Перемешайте и храните при комнатной температуре.
- В шкафу биобезопасности добавьте 6 мл раствора для покрытия крышки на внутреннюю поверхность стерильной крышки микропланшета с 96 лунками, удерживая крышку за края и поворачивая ее, чтобы убедиться, что она покрыта раствором. Оставьте раствор на крышке на 20 с, затем слейте раствор и переверните крышку на автоклавное бумажное полотенце под углом, пока крышка полностью не высохнет, что обычно занимает 35-45 минут. Будьте осторожны, держите крышку за края.
- Приготовьте 20 мл 0,1% агарозы в воде для каждой 96-луночной микропланшета, разогрев в микроволновой печи, чтобы растопить агарозу.
- После того, как агароза остынет до 50-60 °C, пипетка 100 мкл 0,1% агарозы во все промежутки между лунками пластины и 200 мкл агарозы в лунки в ряду A и ряду H и столбце 1, столбце 2, столбце 11 и столбце 1223 (рис. 1).
4. Загрузка пластины бактериями и фагами
ПРИМЕЧАНИЕ: Вся подготовка и загрузка пластин должны производиться в шкафу биобезопасности, и следует использовать надлежащую микробиологическую практику17 .
- Планшет на 96 лунок будет содержать 75 мкл бактерий размером 2,0 x 106 КОЕ/мл в каждой лунке9. Разбавьте бактериальную культуру 4,0 x 10 6 КОЕ/мл 1:1 2-кратным бульоном PYCa до 2,0 x 10,6КОЕ/мл. Приготовьте 5 мл на 96-луночную тарелку.
- Разбавьте лизат фага с помощью фагового буфера7 , чтобы получить по 1 мл концентраций 2,0 x 106 БОЕ / мл, 2,0 x 105 БОЕ / мл и 2,0 x 104 БОЕ / мл. Это позволит получить кратность инфекции (MOI) 1, 0,1 и 0,01 в пределах микропланшета9.
- Чтобы загрузить микропланшет, возьмите планшет, приготовленный с раствором антитумана и агарозой, и поместите 75 мкл бактерий размером 2,0 x 106 КОЕ/ мл в колонки 3-10, как показано на рисунке 1.
- В колонку 3 и колонку 4 добавьте 75 мкл стерильного фагового буфера в каждую лунку, чтобы он служил в качестве положительного контроля без фага, как показано на рисунке 1, и пипеткой вверх и вниз для смешивания после каждого добавления. Добавьте 75 мкл фага 2,0 x 10 6 БОЕ/мл в столбец 5 и столбец6 , 75 мкл фага 2,0 x 105 КОЕ/мл в столбец 7 и столбец 8 и 75 мкл фага 2,0 x 104 КОЕ/мл в колонку 9 и колонку 10, пипетку вверх и вниз для смешивания после каждого добавления.
- Обклейте обе короткие стороны пластины этикетировочной лентой 0,5 дюйма, чтобы частично запечатать пластину и обеспечить газообмен.
5. Измерение инкубации и абсорбции
- После того, как пластины загружены бактериями и фагами, поместите их в шейкер микропланшетов при 250 об/мин и инкубируйте при 30 °C.
- Инкубируйте планшеты в течение 96 часов, измеряя оптическую плотность на длине волны 600 нм на считывателе микропланшетов каждые 8 часов, начиная с 16 часа. Возвращайте пластины в шейкер между измерениями.
ПРИМЕЧАНИЕ: Были оценены периоды измерения 4, ч 6 ч, 8 ч и 12 ч, начиная с часа 0, и было установлено, что 8-часовой период отбора проб, начинающийся через 16 ч после заражения, лучше всего отражает взаимодействие гордонии и фага. - Следите за конденсацией крышки на протяжении всего эксперимента. Если наблюдается конденсат, замените крышку другой крышкой с покрытием в соответствии с шагом 3.2.
- Сгенерируйте контрольные и зараженные кривые роста в соответствии с разделом 6 протокола.
6. Анализ данных
- Используйте программу для работы с электронными таблицами для расчета среднего значения и стандартного отклонения для каждого разведения фага в соответствии с макетом электронной таблицы в репозитории Stacy-Ceballos-Index GitHub (https://github.com/eichristenson/Stacy-Ceballos-Index).
- Создайте контрольные и зараженные кривые роста и вычислите метрики заражения с помощью R (см. Таблицу материалов) с пакетами DescTools 24, dplyr 25, ggplot226 и readxl27 и следуя сценарию R в репозитории GitHub Stacy-Ceballos-Index (https://github.com/eichristenson/Stacy-Ceballos-Index).
- AUCcon — это площадь под неинфицированной контрольной кривой, а AUCinf — площадь под инфицированной кривой16. Рассчитайте AUC, а затем рассчитайте процент ингибирования роста на основе площади под значениями кривой, PIAUC16, используя следующее уравнение:
(1 - [AUCinf/AUCcon]) × 100 - Пунктирные горизонтальные линии на каждой кривой показывают пик роста, при этом неинфицированный пик роста помечен как N асимптота (con), а зараженный пик роста помечен как Nасимптота (inf). Определите значенияN асимптот, а затем рассчитайте процентное торможение роста на основе этих пиковых значений роста, PImax16, используя следующее уравнение:
(1 - [N асимптот(инф)/ Nасимптот(кон)]) × 100 - Рассчитайте индекс Стейси-Себальоса, ISC16, из значений PIAUC иPI max следующим образом:
(PIAUC ×PI max) 0,5
Рассчитайте относительную вирулентность путем интегрирования индекса Стейси-Себальоса во времени16.
- AUCcon — это площадь под неинфицированной контрольной кривой, а AUCinf — площадь под инфицированной кривой16. Рассчитайте AUC, а затем рассчитайте процент ингибирования роста на основе площади под значениями кривой, PIAUC16, используя следующее уравнение:
Representative Results
Эксперимент является успешным, если результирующая кривая роста показывает увеличение положительной контрольной бактериальной популяции с течением времени без внезапных колебаний поглощения. Примеры успешного эксперимента при MOI 1 с продуктивной фаговой инфекцией и без нее показаны на рисунке 2 и рисунке 3 соответственно. Продуктивная инфекция при MOI 0,01 представлена на рисунке 4. Положительная контрольная картина роста (зеленая кривая), показанная на всех трех рисунках, указывает на то, что бактерии растут, они не слипаются во время роста и не содержат загрязняющих веществ. О комковании и загрязнении свидетельствует необычайно высокая поглощающая способность в один момент времени. Стандартные отклонения обычно увеличиваются в течение эксперимента; Однако резкое увеличение или стандартные отклонения, перекрывающиеся между контрольной и инфицированной кривыми, могут указывать на загрязнение или скопление в одной или нескольких скважинах.
Кривая роста, изображающая продуктивную фаговую инфекцию, представленная на рисунке 2, показывает снижение бактериальной абсорбции с течением времени в лунках с добавлением фага. Это снижение бактериальной плотности не будет замечено, если бактерия находится за пределами диапазона хозяина фага, как показано на рисунке 3.
Показатели инфицирования показаны для всех репрезентативных экспериментов, с относительно большим I SC для продуктивных инфекций на рисунке 2 и рисунке 4 и очень маленьким ISC на рисунке 3 для фага, который неэффективно инфицировал бактерию-хозяина.
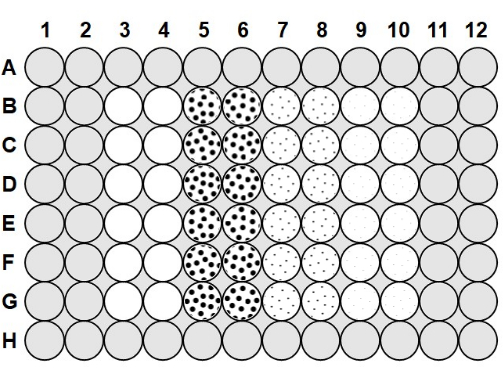
Рисунок 1: Макет микропланшета. Серые области заполнены 0,1% агарозы. Пустые лунки в столбцах 3 и 4 представляют собой контрольные лунки без фагов, содержащие только фаговый буфер и 2,0 x 106 КОЕ/мл бактерий. Точечные лунки содержат фаговые и 2,0 х 106 КОЕ /мл бактерий; большие точки в столбцах 5 и 6 указывают на MOI 1 с фагом 2,0 x 106 БОЕ/мл; средние точки в столбцах 7 и 8 указывают на MOI 0,1 с фагом 2,0 x 105 БОЕ/мл; а маленькие точки в столбцах 9 и 10 указывают на MOI 0,01 с фагом 2,0 x 104 БОЕ/мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
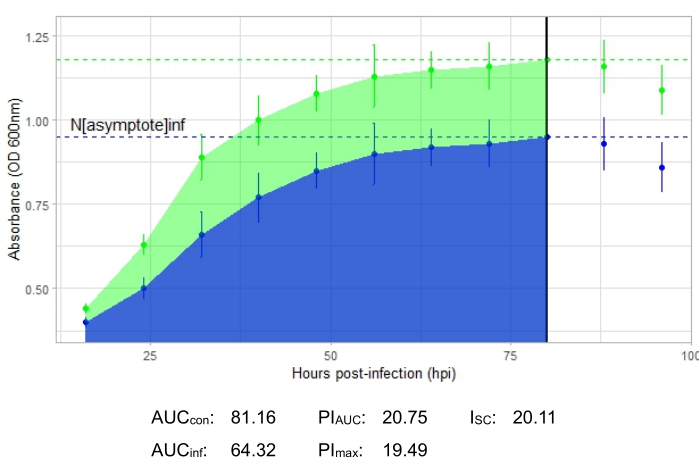
Рисунок 2: Успешный эксперимент с кривой роста с фагом с MOI 1, который продуктивно инфицирует бактерию-хозяина. Средние значения поглощения (± стандартное отклонение) показаны для неинфицированных бактерий (зеленый) и бактерий с добавлением фага (синий). Сокращения: AUC = площадь под кривой; PI AUC = процентное ингибирование роста, рассчитанное по площади под кривой; Nасимптота = значение пикового роста; PImax = процентное торможение роста, рассчитанное по пиковым значениям роста; ISC = индекс Стейси-Себальоса. На этом графике представлен умеренный фаг Gordonia DelRio, заражающий G. terrae, бактерию, на которой он был выделен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
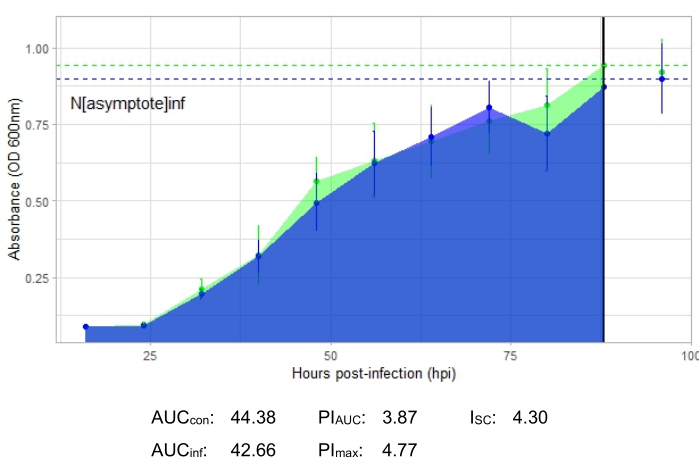
Рисунок 3: Успешный эксперимент с кривой роста с фагом с MOI 1, который неэффективно инфицирует бактерию-хозяина. Средние значения поглощения (± стандартное отклонение) показаны для неинфицированных бактерий (зеленый) и бактерий с добавлением фага (синий). Сокращения: AUC = площадь под кривой; PI AUC = процентное ингибирование роста, рассчитанное по площади под кривой; Nасимптота = значение пикового роста; PImax = процентное торможение роста, рассчитанное по пиковым значениям роста; ISC = индекс Стейси-Себальоса. На этом графике представлена инфекция G. rubripertincta от DelRio. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
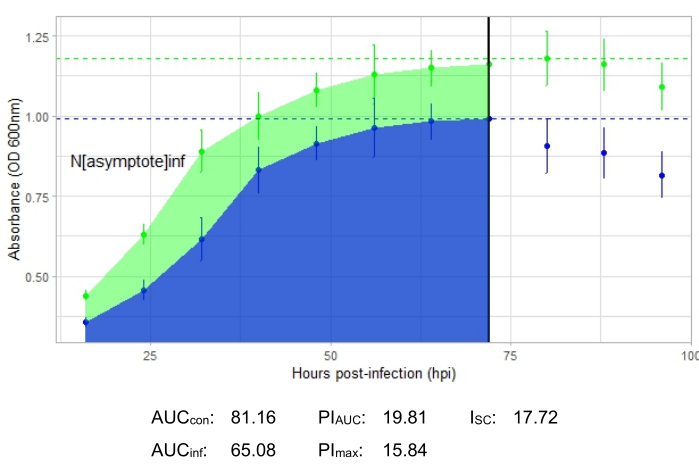
Рисунок 4: Успешный эксперимент с кривой роста с фагом при MOI 0,01. Средние значения поглощения (± стандартное отклонение) показаны для неинфицированных бактерий (зеленый) и бактерий с добавлением фага (синий). Сокращения: AUC = площадь под кривой; PI AUC = процентное ингибирование роста, рассчитанное по площади под кривой; Nасимптота = значение пикового роста; PImax = процентное торможение роста, рассчитанное по пиковым значениям роста; ISC = индекс Стейси-Себальоса. На этом графике представлена инфекция G. terrae от DelRio. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Этот метод микропланшетов, основанный на оптической плотности, позволяет исследовать диапазон хозяев-бактериофагов и динамику инфекции11 и показывает полезность индекса Стейси-Себальоса16 в качестве меры вирулентности бактериофага. Хотя этот метод может быть использован с любой системой бактериофаг-хозяин, он был разработан специально для адаптации анализов быстрого роста микропланшетов 9,10,11 для использования с медленно растущими бактериями, такими как актиномицеты. Экспресс-анализы на микропланшетах не могут быть использованы для медленно растущих бактерий без модификаций, направленных на устранение испарения и конденсации крышки. Этот метод описывает эти необходимые модификации и впервые демонстрирует использование индекса Стейси-Себальоса и связанных с ним показателей16 для описания бактериофаговой инфекции.
Испарение может быть существенной проблемой при многодневных 96-луночных анализах кривой роста пластин; Этот метод решает эту проблему путем добавления агарозы в пограничные колодцы и промежутки между скважинами. Агарозный запас в сочетании с защитой от запотевания крышки22 обеспечивает необходимую влажность внутри микропланшета и позволяет надежно измерять оптическую плотность. Без дополнительной влажности существенное испарение с эффектом края происходит23 в течение длительного инкубационного периода, что приводит к искусственно завышенным показаниям оптической плотности. Обработка крышки против запотевания является необходимой модификацией, поскольку конденсация крышки также может искусственно повышать значения оптической плотности. Встряхивание пластин в течение инкубационного периода является рекомендуемой модификацией, так как бактерии актиномицетов могут слипаться во время роста, давая искусственно высокие значения оптической плотности и эффективно уменьшая множественность инфекции.
Соотношение бактерий и фагов в экспериментах, характеризующих динамику инфекции, имеет решающее значение, так как фагов должно быть достаточно, чтобы показать эффект инфекции, но не настолько, чтобы популяция бактерий-хозяев немедленно упала9 или частота лизогении резко увеличилась28. В этом методе соотношение, признанное наиболее эффективным для получения последовательных результатов, представляло MOI, равное 1, но пригодные для использования результаты также были получены с MOI 0,1 и 0,01. При реализации данного метода рекомендуется выбирать одну концентрацию бактерий и тестировать множественные концентрации фагов в диапазоне MOI 0,01-1 9,10,11.
Этот метод, описанный здесь, позволяет оценивать взаимодействия бактериофага и хозяина для медленно растущих бактерий в высокопроизводительных микропланшетных анализах, а не с помощью суботбора проб из более крупной колбы для культивирования на каждом интервалеизмерения 29. Кроме того, демонстрируя, как могут быть адаптированы анализы ростамикропланшетов 9,10,11, этот метод увеличивает полезность других анализов бактериофагов на основе микропланшетов для медленно растущих бактерий, включая характеристику фагов 5,6,12 и эволюционные исследования30,31. Наконец, этот метод демонстрирует использование индекса Стейси-Себальоса16 для описания бактериофагальной инфекции. Эта метрика была первоначально разработана на основе данных из модельной системы архейных вирусов и рассчитывается на основе значений оптической плотности, что дает ей широкое применение в разрозненных вирусных системах.
Disclosures
Авторам раскрывать нечего.
Acknowledgements
Эта работа была поддержана грантом NSF DBI Biology Integration Institute (BII) (награда No 2119968; PI-Ceballos) и программой INBRE штата Арканзас с грантом Национального института общих медицинских наук (NIGMS), P20 GM103429 Национальных институтов здравоохранения. Авторы также высоко ценят поддержку Летней исследовательской программы бакалавриата Паттерсона в Баптистском университете Уачита.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
References
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved