יצירת תאים דנדריטיים שמקורם במונוציטים עם פנוטיפים סיליליים שונים
In This Article
Summary
מוצג פרוטוקול ייחודי ומקיף ליצירת תאים דנדריטיים אנושיים שמקורם במונוציטים אנושיים (mo-DCs) מתאי דם חד-גרעיניים היקפיים מבודדים (PBMCs) באמצעות טיפול בסיאלידאז. יתר על כן, מתוארות שיטות להערכת האפיון הפנוטיפי והפונקציונלי של mo-DCs ולהעריך כיצד טיפול בסיאלידאז משפר את רמת ההתבגרות של mo-DCs.
Abstract
חומצות סיאליות הן חד-סוכרים בעלי מטען שלילי הנמצאים בדרך כלל בתחנות הקצה של גליקנים על פני התא. בשל ההידרופיליות והמאפיינים הביופיזיקליים שלהם, הם מעורבים בתהליכים ביולוגיים רבים, כגון אפנון התגובה החיסונית, זיהוי אנטיגנים עצמיים ולא עצמיים, אינטראקציות פחמימות-חלבונים ועוד. התוכן הסלולרי של חומצה סיאלית מוסדר על ידי sialidase, אשר מזרז את הסרת שאריות חומצה sialic. מספר מחקרים הראו כי סיאלו-גליקנים חיוניים לניטור מעקב חיסוני על ידי שימוש בקולטני סיגלק מעכבי CIS וטרנס על תאי מערכת החיסון. כמו כן, נקודות ביקורת גליקו-חיסוניות בסרטן הופכות למטרות חיוניות לפיתוח אימונותרפיה. בנוסף, תאים דנדריטיים (DCs) נחשבים למרכיב חשוב באימונותרפיה, במיוחד בחקר הסרטן, בשל תפקידם הייחודי כתאים מציגי אנטיגן מקצועיים (APC) ויכולתם לעורר תגובות חיסוניות נרכשות וליצור זיכרון חיסוני. עם זאת, תפקידם של DCs תלוי בהבשלתם המלאה. ל-DCs לא בשלים יש תפקיד מנוגד ל-DCs בוגרים ותכולת חומצה סיאלית גבוהה, מה שמפחית עוד יותר את רמת ההתבגרות שלהם. זה מפחית את היכולת של DCs לא בשלים להפעיל תאי T, מה שמוביל לתגובה חיסונית נפגעת. כתוצאה מכך, הסרת חומצה סיאלית מפני השטח של התא של DCs אנושיים גורמת להבשלתם, ובכך מגבירה את הביטוי של מולקולות MHC והצגת אנטיגן. בנוסף, הוא יכול לשחזר את הביטוי של מולקולות קו-סטימולטוריות ו-IL-12, וכתוצאה מכך DCs יש יכולת גבוהה יותר לקטב תאי T לכיוון פנוטיפ Th1 ובמיוחד להפעיל תאי T ציטוטוקסיים להרוג תאים סרטניים. לכן, חומצה סיאלית התפתחה כמודולטור מפתח של DCs והיא משמשת כיעד חדש לקידום השימוש הטיפולי שלהם. מחקר זה מספק גישה ייחודית לטיפול ב- DCs שמקורם במונוציטים חוץ גופית עם סיאלידאז, שמטרתה ליצור אוכלוסיות DC עם פנוטיפים שונים של חומצה סיאלית על פני התא ופרופילי התבגרות וגירוי משותף מותאמים.
Introduction
גליקנים נושאי חומצה סיאלית (סיאלוגליקנים) זכו להתעניינות משמעותית בשל תפקידם האימונומודולטורי. החומצה הסיאלית החד-סוכרית, הנפוצה ביותר בבני אדם בצורה של חומצה N-אצטילנוירמית, מציגה ליגנדות בסיסיות ללקטינים עם תפקיד מוכר באימונולוגיה, כגון סלקינים וסיגלקים. לקטינים אלה מזהים סיאלוגליקנים על אותו תא (CIS) או על תאים שונים (טרנס) וממלאים תפקיד משמעותי באינטראקציות מארח-פתוגן ובפעילויות פיזיולוגיות ופתולוגיות שונותשל התא 1,2,3. יתר על כן, מאחר שחומצה סיאלית תופסת את המיקומים הסופיים של גליקוקונדואגטים על פני התא, היא יכולה להסתיר את המבנים הבסיסיים, ובכך לעכב מגע בין תאים באמצעות השפעות דוחות לא ספציפיות או על ידי חסימת זיהוי על ידי לקטינים אחרים4. הפעילות של מגוון של sialyltransferases (המעבירים חומצות סיאליות) ושל sialidases (המנתקים קשרי חומצה סיאלית) בתוך התא קובעת את כמות החומצה הסיאלית הקיימת על פני השטח. בנוסף, sialyltransferases מסיסים ו sialidases מבוטא על ידי המארח או פתוגנים יכולים לשנות חיצונית את כמות חומצה sialic על פני התא 5,6.
סיאלילציה חריגה היא תכונה של מספר מצבים פתולוגיים. במחלות אוטואימוניות, היפוסיאלילציה יכולה לתרום להפעלה חיסונית בלתי מרוסנת ולנזק לאיברים, שכן חומצה סיאלית מסייעת להבחין באנטיגנים עצמיים ולווסת תגובות דלקתיות7. לעומת זאת, היפר-סיאלילציה גורמת לביטוי יתר של סיאלוגליקנים, כגון סיאליל-TN, אנטיגנים סיאליל-לואיס, חומצה פוליזיאלית וגנגליוזידים, המהווה סימן היכר של חלק מסוגי הסרטן 8,9. היפרסיאלילציה תלויה גם בביטוי מוגבר של אנזימים ספציפיים כגון N-אצטילגלוקוזאמינילטרנספראז (GNT-V), אשר מייצר גליקנים מקושרי N משולשים ו / או טטרה אנטנות, אשר נקשרו לצמיחת סרטן וגרורות10. תכולת החומצה הסיאלית מסדירה גם את יציבות החלבונים ותפקודם, שהם המפתח לתפקידם של שחקנים אונקוגניים רלוונטיים11. לכן, סיאלילציה מוגברת יכולה להקל על התפתחות גידולים, גרורות, עמידות לתרופות והתחמקות חיסונית. יתר על כן, הגברת הרגולציה של סיאלוגליקנים מאפשרת לגידולים לקיים אינטראקציה עם קולטני סיגלק מעכבים על תאי מערכת החיסון ולהימנע ממעקב חיסוני. מסיבה זו, סיאלוגליקנים נחשבים כיום לנקודות ביקורת גליקו-חיסוניות ומטרות טיפוליות אטרקטיביות. לדוגמה, מעכבי ציר החיסון Siglec כבר נמצאים בניסויים קליניים מוקדמים, שכן קולטן התא החיסוני Siglec (חומצה סיאלית קושר חומצה חיסונית דמוי LECtin) ממלא תפקיד מעכב חיסון12.
אנזימים שימשו לווסת את הפרופיל הגליקני ככלים למחקר או לאסטרטגיות טיפוליות13,14. Sialidase שימש כדי לשנות ממאירות תאים סרטניים מאז גליקנים sialylated כגון sialyl לואיס X הם קריטיים עבור נדידת תאים גרורות סרטן15. במקביל, מעכבי סיאלידאז, המעכבים את מחשוף החומצה הסיאלית, הגיעו למרפאות לטיפול בזיהומים ויראליים תלויי חומצה סיאלית16. לאחרונה, אפנון חומצה סיאלית זכה להתעניינות נוספת בשל התפקיד הקריטי של חומצות סיאליות כליגנדות בציר החיסון של סיגלק, כלומר הן מציעות אמצעים חדשניים להפחתת בריחת סרטן מתגובות חיסוניות. עניין זה התחזק עוד יותר על ידי חתן פרס נובל לשנת 2022 ברטוצי וצוותה בתרומתם של מספר אסטרטגיות המנתקות באופן סלקטיבי סיאלוגליקנים מגוונים ומשפרות תגובות חיסוניות אנטי-סרטניות17. לפיכך, אסטרטגיות מבוססות סיאלידאז מייצגות שיטה מבטיחה לטיפול בנקודות ביקורת גליקוזיות-אימוניות. הגליקופנוטיפ של תאי מערכת החיסון תלוי בסוג התא ובמצב ההפעלה שלו. לגבי תאי T, לגליקנים יש תפקיד מפתח בשלבים הפתופיזיולוגיים של התפתחות תאי T ובחירת תימוציטים, פעילות תאי T, התמיינות והתפשטות18. לדוגמה, פולילקטוזאמין על גליקופרוטאינים משפיע על רמות בסיסיות של לימפוציטים מסוג B ולימפוציטים מסוג T ועל הפעלת מקרופאגים19. במקרופאגים, לדפוסי ביטוי גליקניים שונים יש תפקיד חשוב בגיוס מקרופאגים למיקרו-סביבה של הגידול (TME)20. לפיכך, הביטוי של גליקנים מקושרי O ו- N מקושרים על ידי תאי מערכת החיסון יכול לשמש כסמנים גליקוביוביולוגיים פוטנציאליים לגישות טיפוליות בטיפול בסרטן ובמחלות אוטואימוניות.
תאים דנדריטיים (DCs) הם תאים ספציפיים מציגי אנטיגן עם יכולת ייחודית לעורר תגובות חיסוניות, כגון חסינות אנטי סרטנית21. DCs חייבים לעבור שדרוג של מולקולות MHC מציגות האנטיגן שלהם כדי להציג אנטיגנים לתאי T (אות 1), מולקולות קו-סטימולטוריות כדי להפעיל תאי T (אות 2) וציטוקינים מעודדי דלקת, כגון IL-12, כדי להפעיל שגשוג תאי T מסייע מסוג 1 (אות 3)22. הפרופיל החיסוני המתקבל מווסת היטב, ונקודות ביקורת חיוניות למניעת תקיפת תאים בריאים. מאחר ש-DCs יכולים לעורר תגובות חיסוניות שונות נגד תאים סרטניים, הם משמשים כחיסונים מבוססי תאים, ומספר לא מבוטל של מחקרים קליניים הוכיחו את היתרונות הפוטנציאליים שלהם23,24. לאחר שה- FDA אישר את החיסון הראשון מבוסס DC בשנת 201025,26, פותחו חיסונים רבים אחרים מבוססי DC. חיסונים מבוססי DC מיוצרים בעיקר ex vivo וניתנים לחולים כדי לעורר תגובות חיסוניות נגד גידולים. עם זאת, הבשלה לא מספקת או קצרה היא כיום אחד הגורמים המגבילים את היעילות הקלינית של DCs ופירושה שיש להשתמש בקוקטיילים ציטוקינים יקרים. ללא הבשלה מספקת, DCs אינם יכולים להפעיל תאי T בנסיבות קליניות. במקום זאת, ה-DCs מבטאים נקודות ביקורת חיסוניות ומפעילים תגובה חיסונית סובלרוגנית המונעת מתאי T ציטוטוקסיים לפעול נגד תאי גידול.
ל-DCs אנושיים יש משטחים סיאליליים כבדים, וסיאלילציה זו פוחתת עם ההבשלה ובמהלך תגובה חיסונית כוללת27. ההתבגרות של DCs יכולה להיגרם על ידי חיסול חומצות סיאליות אלה עם sialidase. הייבוש מעלה מאוד את רמת הוויסות של ציטוקינים שונים, כולל IL-12, עקב טרנסלוקציה של גורם השעתוק NF-kB לגרעין 6,28. בנוסף, התפלה משפרת את הצלבת האנטיגן באמצעות MHC-I ואת התגובה החיסונית נגד הגידול29,30. בהתאם לכך, הנוקאאוט של sialyltransferases ST3Gal.l ו- ST6Gal.l, שיש להם תפקיד מרכזי בסיאלילציה DC, יוצר פנוטיפ בוגר יותר ב- DCs31.
טיפול בסיאלידאז מספק שיטה לגירוי כל ההיבטים של הבשלת DC, כולל הצגת אנטיגן מוגברת, ביטוי מוגבר של מולקולות קו-סטימולטוריות וייצור ציטוקינים מוגבר, כדי לטפל בחסרונות שהוזכרו לעיל ולאפשר ל-DCs לעורר תגובות יעילות. מאמר זה מציג הליך להשגת DCs אנושיים מותפלים קיימא באמצעות שימוש בסיאלידאז חיידקי. DCs דה-סיאלילציה מראים פרופיל התבגרות משופר וניתן להשתמש בהם כמודלים תאיים להגברת תגובות חיסוניות נגד גידולים במבחנה. DCs מתקבלים מונוציטים בדם, אשר לאחר מכן מובחנים במבחנה בנוכחות ציטוקין interleukin-4 (IL-4) ו גרנולוציטים מקרופאגים מושבת גורם מגרה (GM-CSF). עבודה זו מתארת גם שיטות מבוססות לקטין לניתוח חומצה סיאלית על פני התא ושיטות לאימונופנוטיפ של רמת ההתבגרות DC. ההליך המתואר כאן יכול לשמש כדי desialylate סוגי תאים אחרים, ובכך לספק גישה לחקור את התפקיד של sialoglycans, שהם נקודות ביקורת חיוניות glyco-immune רלוונטי immunomodulation.
Protocol
התאים בודדו מהמעילים הבוהקים של תורמי דם אנונימיים בריאים, שהיו מתנדבים שסופקו על ידי בנק הדם הלאומי, Instituto Português do Sangue e da Transplantação (IPST), לאחר שהתקבלה הסכמה כתובה ומודעת של התורם (IMP.74.52.4). השימוש בדם אושר על ידי ועדת האתיקה (IPST 30072015), בהתאם להנחיה 2004/23/EC בדבר סטנדרטים של איכות ובטיחות לתרומה, רכש, בדיקה, עיבוד, שימור, אחסון והפצה של רקמות ותאים אנושיים (החוק הפורטוגלי 22/2007, 29 יוני). הביובנק IPST אוסף ומאחסן דם בשקית פלסטיק ספציפית המכילה דקסטרוז פוספט ציטראט (CPD), תמיסת שימור ונוגדי קרישה, כדי לשמור על שלמות הדם עד לעיבוד. כדי להעריך אם החומר הביולוגי מתאים למניפולציה, מתבצעת בקרה סרולוגית עבור Treponema pallidum, וירוס הפטיטיס B (HBV), וירוס הפטיטיס C (HCV) ונגיף הכשל החיסוני האנושי (HIV), שכולם צריכים להיות שליליים. לצורך המחקר הנוכחי, המעיל הבאפי סופק על ידי IPST לצורכי חקירה, יחד עם מידע לגבי תאריך האיסוף, תוצאות סרולוגיות, סוג דם וגיל התורם32. המעיל האפי יכול להישאר בטמפרטורת החדר למשך יום אחד לכל היותר.
1. השגת תאים דנדריטיים שמקורם במונוציטים
הערה: חשוב להזכיר כי כאשר דם היקפי אנושי עובר מניפולציה, יש לשקול אמצעי זהירות אוניברסליים ספציפיים וסילוק חומרים מתאימים. לפני שמתחילים, לאשר את כל ריאגנטים וחומרים הדרושים מוכנים ומוכנים לשימוש.
- בידוד תאי דם מונוגרעיניים היקפיים
- גש למעיל האפי האנושי.
הערה: מעיל באפי הוא תוצר לוואי המופק מדם שנאסף באמצעות leukapheresis32, המועשר בתאי דם לבנים באמצעות צנטריפוגה. כל השלבים בוצעו בארון בטיחות ביולוגית של תא זרימה אנכי (BSC). - פתח את אריזת מעיל באפי על ידי חיתוך צינור היציאה האטום עם אזמל, והעבר את התוכן לתוך צינור 50 מ"ל. העבירו 7 מ"ל דגימת מעיל באפי לכל צינור חרוטי סטרילי של 15 מ"ל, והוסיפו 6 מ"ל של תמיסת מלח חוצצת פוספט (PBS) לביצוע שטיפה ראשונית. שלב שטיפה ראשוני זה נחוץ על מנת לנקות את הדגימה מהכמות הניכרת של תאי דם אדומים (RBC) ופלזמה, כך שהדגימה מותאמת להפרדה הדרגתית עם מדיום שיפוע צפיפות (ראה טבלת חומרים).
- צנטריפוגה את הצינור בטמפרטורת החדר למשך 10 דקות במהירות של 1,100 x גרם בצנטריפוגה עם רוטור נדנדה ועם הבלם כבוי (ראה טבלת חומרים).
- לאחר הצנטריפוגה, לאסוף את השעיה לויקוציטים (הטבעת הלבנה בין פלזמה RBCs) עם פיפטה פסטר, ולהעביר אותו סטרילי חדש 15 מ"ל צינור חרוטי.
- מלאו את תרחיף הלויקוציטים עד 10 מ"ל עם PBS כדי לסייע לשלב ההפרדה הבא, וערבבו על ידי פיפטינג עדין למעלה ולמטה.
- הכינו את מדיום שיפוע הצפיפות (צפיפות: 1.077 גרם/מ"ל): הכניסו 3 מ"ל של מדיום שיפוע צפיפות לתוך צינור חרוטי סטרילי חדש של 15 מ"ל, ותנו לו להתחמם לטמפרטורת החדר.
- הוסף 5 מ"ל של תרחיף לויקוציטים מדולל (משלב 1.1.5) לתוך הצינור החרוטי המכיל את מדיום שיפוע הצפיפות (5: 3) כדי לבצע הפרדת שיפוע צפיפות. הוסף את הדגימה לאט, טיפה אחר טיפה, באמצעות דפנות הצינור כדי למנוע הפרעה למדיום שיפוע הצפיפות.
- הפרדת שיפוע: צנטריפוגה את המתלה הבינוני שיפוע הצפיפות בטמפרטורת החדר למשך 30 דקות ב- 1,100 x גרם בצנטריפוגה עם רוטור נדנדה ועם הבלם כבוי.
- לאחר הצנטריפוגה, בזהירות להסיר את צינורות חרוט מן הצנטריפוגה. לאחר שלב זה, מגוון של שכבות מוגדרות היטב גלויות, כולל הבאות, החל מלמטה: שכבה אדומה (RBCs וגרנולוציטים), מדיום שיפוע צפיפות, שכבה חיוורת דקה של תאים חד-גרעיניים היקפיים בדם (PBMC) ופלזמה.
- אספו את השכבה הדקה של PBMCs באמצעות פיפטה של פסטר, והימנעו מלקחת את מדיום שיפוע הצפיפות מתחת או יותר מדי פלזמה מעל. הכניסו את דגימת ה-PBMC לצינור חרוטי חדש בנפח 50 מ"ל, מלאו אותו עד 25 מ"ל ב-PBS וערבבו את הדגימה על ידי פיטום עדין למעלה ולמטה.
- צנטריפוגה את הדגימות בטמפרטורת החדר למשך 10 דקות ב 600 x גרם (בלם רגיל) כדי לשטוף תאים שיורית ופסולת, ולהשליך את supernatant על ידי היפוך זהיר של הצינור.
הערה: אם יש יותר מדי זיהום תאי דם אדומים, אשר ניתן להבחין כאשר גלולת התא או הפרווה באפי אינו מופרד לחלוטין או נראה אדמדם, מומלץ lyse RBCs הנותרים. במקרה זה, להוסיף 5 מ"ל של חיץ ליזה RBC (ראה את טבלת החומרים), לערבב היטב, לדגור במשך 5 דקות. מלאו עד 40 מ"ל ב-PBS, צנטריפוגו את הדגימות בטמפרטורת החדר למשך 10 דקות ב-900 x גרם (בלם רגיל), והשליכו את הסופרנאטנט על ידי היפוך זהיר של הצינור. - מלא את הדגימה עד 10 מ"ל עם PBS, ולקחת aliquot לספור את התאים. כדי להסיר טסיות, צנטריפוגה בטמפרטורת החדר למשך 5 דקות ב 400 x גרם (בלם רגיל), ולזרוק את supernatant על ידי היפוך בזהירות של הצינור.
הערה: במקרה שיש מספר משמעותי של טסיות, צנטריפוגה בטמפרטורת החדר למשך 10 דקות ב 200 x גרם (בלם רגיל) פעמיים. הטסיות מזוהות על ידי הדמיה של הדגימה תוך ספירת התאים.
- גש למעיל האפי האנושי.
- בידוד מונוציטים על ידי הפרדה אימונומגנטית
- הכינו את מאגר המיקרו-כדוריות על-ידי הוספת PBS עם אלבומין בסרום בקר (BSA) 0.5% וחומצה אתילאנדיאמין-טראצטית (EDTA) בנפח 2 מילימ"ר. לעקר את התמיסה על ידי סינון (0.2 מיקרומטר), ולשמור את החיץ בקירור (2-8 ° C).
- בצע בידוד + CD14 מונוציטים על ידי מיון תאים מופעל מגנטית (MACS).
- לאחר ספירת תאים באמצעות מונה תאים אוטומטי (שלב 1.4.1), חשב את הנפח המתאים של מאגר מיקרו-חרוזים וחרוזים אימונומגנטיים CD14 (ראה טבלת חומרים) הנדרשים. ודא שפתרונות אלה נשמרים על הקרח. הוסף 80 μL של מאגר microbeads לכל 1 x 10 7 תאים ו 20 μL של חרוזי CD14 לכל 1 x 107 תאים.
- להשהות מחדש את גלולת התא בנפחים שנקבעו קודם לכן, ולדגור במשך 15 דקות ב 4 ° C (2-8 ° C).
הערה: במקרה שיש צורך באימות רמות המונוציטים בדגימות PBMC, בצע ניתוח ציטומטרי זרימה באמצעות נוגדנים מכתימים (למשל, CD14 [Monoclonal TÜK4]). בצע את שלב 3.2 לקבלת פרטים על ניתוח ציטומטרי זרימה. - הוסף 1-2 מ"ל של חיץ microbeads לכל 1 x 107 תאים, צנטריפוגה בטמפרטורת החדר במשך 10 דקות ב 600 x גרם (בלם רגיל) כדי להסיר חרוזים לא קשורים, ולהשליך את supernatant על ידי היפוך בזהירות של הצינור.
- הכן את עמודת LS. עמודות LS מכילות כדורים פרומגנטיים שכאשר הם מונחים על מגנט, מאפשרים שמירה חיובית ועדינה של תאים המסומנים מגנטית33. מיד לפני השימוש, הניחו עמוד LS (ראו טבלת חומרים) על המגנט, שטפו עם 3 מ"ל של חיץ מיקרו-כדוריות מבלי להתייבש לחלוטין, ומיד המשיכו לשלב הבא.
הערה: לעולם אל תיתן לעמודה להתייבש במהלך ההליך כדי למנוע פגיעה בתפוקה. - להשהות מחדש את גלולת התא ב 500 μL של חיץ microbeads לכל 1 x 108 תאים. אם מספר התא גבוה מ- 4 x 108, השתמש במסננת תאים של 40 מיקרומטר כדי למנוע צבירת תאים.
- הוסף את מתלה התא לכניסת העמודה, מקם צינור חרוטי של 15 מ"ל מתחת לשקע העמוד כדי לאסוף את חלק התא השלילי, ושטוף את העמוד שלוש פעמים עם 3 מ"ל של מאגר מיקרו-כדוריות. החלק השלילי כולל את התאים שלא נאספו עם חרוזי CD14 (כלומר, תאי CD14).
- לאחר השטיפה הסופית, הסר את העמוד מהמגנט, הנח אותו על צינור חרוטי סטרילי של 15 מ"ל, פיפטה 5 מ"ל של חיץ מיקרו-חרוזים לתוך פתח העמודה, ומיד הכנס את בוכנה מזרק לתוך פתח העמוד ודחף כדי להוציא את תאי היעד.
- אסוף את התאים המסומנים מגנטית (תאי CD14+ ), וקח aliquot כדי לספור את התאים, כמתואר בשלב 1.4.1.
- צנטריפוגה את שני שברי התא, CD14− ותאי CD14+ , בטמפרטורת החדר למשך 10 דקות ב 600 x גרם (בלם רגיל). השליכו את הסופרנטנט, שמרו את שבר CD14+ לשלבים הבאים, ואחסנו את שבר CD14 לבדיקות עתידיות, כגון מבחני תרבות משותפת, במידת הצורך. במידת הצורך, התאים מחלק CD14− יכולים להישמר בהקפאה ב- RPMI-1640 20% FBS ו- 10% DMSO ב- -80°C.
- התמיינות מונוציטים לתאים דנדריטיים
- הכינו מדיום RPMI-1640 מלא על ידי השלמת מדיום הבסיס RPMI-1640 (המכיל 11.1 מילימטר גלוקוז) עם 10% נסיוב בקר עוברי (FBS), 1% של 2 מילימטר של L-גלוטמין, 1% חומצות אמינו לא חיוניות (NEAA), 1% נתרן פירובט, ו-1% של 100 מיקרוגרם/מ"ל פניצילין/סטרפטומיצין (ראו טבלת חומרים).
- בצע התמיינות מונוציטים לתוך mo-DCs, אשר מתרחשת במשך ~ 5-6 ימים.
- חשב את נפח התווך הדרוש למספר תאי CD14+ שהתקבלו, ולוח את התאים בהתאם למערך הניסוי הבא.
הערה: בפרוטוקול זה, התאים צופו בריכוז של 1.3 x 106 תאים/מ"ל כדי לקחת בחשבון מוות תאי וטעויות מדידה, והתווך הוכן על ידי הוספת 1,000 U/mL של GM-CSF ו-750 U/mL של IL-4 (ראה טבלת חומרים) למדיום שלם וערבובו היסודי. - הוסף את נפח המדיום המתאים לתאי CD14+ , והשהה מחדש על ידי פיפטציה למעלה ולמטה עם פיפטה פסטר. לוחים את תרחיף התא לצלחות של 24 בארות (לכל באר: 1.3 x 106 תאים/מ"ל), ודגרים באינקובטור תרבית בטמפרטורה של 37°C עם 5% CO2.
- שנו את מדיום התרבית, והוסיפו לו ציטוקינים טריים כל 2-3 ימים (בדרך כלל פעם אחת בכל תהליך התמיינות). כדי לבצע זאת, בזהירות להסיר מחצית מדיום התרבית מבלי להפריע לתאים. הוסף את אותה כמות של מדיום טרי עם הריכוז המתאים של ציטוקינים, כפי שתואר קודם לכן בהערה של שלב 1.3.2.1, ודגרה במשך תקופת ההתמיינות הנותרת.
הערה: DCs, כאשר מתמיינים ממונוציטים, הם תאים דבקים באופן רופף. מו-DCs לא בוגרים ממוינים לחלוטין הם תאים בצורת ציר, צפים בחופשיות ונצמדים באופן רופף. התאים עשויים גם ליצור רוזטות, במיוחד כאשר הם בוגרים34. - כדי לאסוף את התאים לאחר ההתמיינות, השתמשו במיקרופיפטה כדי להעביר את כל תרחיף התא לצינור חרוטי סטרילי, ושטפו את בארות הצלחת פעמיים עם PBS, תוך הקשה עדינה על התחתית (איור 1A).
הערה: הימנעו מאיסוף התאים הנצמדים בכבדות, מכיוון שמדובר ככל הנראה במקרופאגים. כדי למנוע הבשלה או הפעלה לא תקינה של התא, ודא שהתאים מטופלים בזהירות רבה. - צנטריפוגו את התאים בטמפרטורת החדר למשך 10 דקות במהירות של 180 x g (בלם רגיל) כדי להסיר שאריות או תאים מתים, והשהו מחדש בתווך/חיץ המתאים למערך הניסוי.
- חשב את נפח התווך הדרוש למספר תאי CD14+ שהתקבלו, ולוח את התאים בהתאם למערך הניסוי הבא.
- בצע את ההתבגרות של mo-DCs.
- במקרה שנדרשת הבשלה של mo-DCs, השתמשו בצלחת באר או בצלוחית, תוך התחשבות בדוגמת ריכוז התאים שהייתה בשימוש בעבר (1.3 x 10 6 תאים/מ"ל), ותנו קוקטייל ציטוקינים על ידי השלמת המדיום עם קוקטייל ציטוקינים הכולל IL-1β (10 ננוגרם/מ"ל),IL-6 (1,000 U/mL), פרוסטגלנדין E2 (PGE2; 1 מיקרוגרם/מ"ל), וגורם נמק גידולי-α (TNF-α; 10 ננוגרם/מ"ל) (ראה טבלת חומרים). לדגור על התאים ב 37 ° C עם 5% CO2 במשך 24 שעות או 48 שעות.
- ספירת תאים וכדאיות
- בצעו ספירת תאים וצביעה כחולה של טריפאן.
- כדי לקבוע את מספר התאים ואת הכדאיות של השעיית התא, לקחת aliquot של 10 μL מן ההשעיה התא, ולערבב אותו עם 10 μL של כחול טריפאן (דילול 1: 1).
- קח 10 μL של התערובת הקודמת, והשתמש במונה התאים האוטומטי כדי לספור את מספר התאים בהתאם להוראות היצרן.
הערה: אם ריכוז התאים גבוה מדי, לדלל את aliquot, ולאחר ספירת התא, לשקול את גורם דילול בחישובים. - התאם את מספר התא ואת המדיום/מאגר עבור מערך הניסוי.
- לקבוע את כדאיות התא אפופטוזיס30.
הערה: בעבודה זו, לאחר הטיפול בסיאלידאז (סעיף 2), בוצעה בדיקת הכדאיות.- לצבוע את mo-DCs עם 5 מיקרוגרם / מ"ל 7-aminoactinomycin D (7-AAD) ו annexin V, ולקבוע את אפופטוזיס על פי הוראות היצרן (ראה טבלת חומרים).
- נתח את התוצאות באמצעות ציטומטריית זרימה29,30.
- בצעו ספירת תאים וצביעה כחולה של טריפאן.
2. טיפול בתאים עם sialidase
הערה: לאחר ההתמיינות למו-DCs, ביום השישי, התאים מוכנים לבדיקת הטיפול בסיאלידאז.
- בהתחשב במערך הניסוי הרצוי, לאסוף ~ 10 x 10 6 mo-DCs מ 10 בארות של לוחות 24 בארות עם 1.3 x 106 תאים / באר, ולהעביר אותם לתוך צינור חרוטי סטרילי חדש 15 מ"ל.
הערה: נניח אובדן תאים כלשהו; בדרך כלל, בשלב זה, הריכוז שנמצא הוא 1.3 x 106 תאים / מ"ל מכיוון ש- mo-DCs ומבשריהם אינם מתרבים וחווים אובדן כדאיות של 20% במהלך התמיינות ל- mo-DCs. - צנטריפוגה בטמפרטורת החדר למשך 5-7 דקות ב 300 x גרם (בלם רגיל), ולהשליך את supernatant כדי להסיר תאים מתים ופסולת.
- מוסיפים 10 מ"ל סל"ד-1640 בינוני (המכיל 11.1 מ"ל גלוקוז), צנטריפוגה בטמפרטורת החדר למשך 4 דקות ב-300 x גרם (בלם רגיל), משליכים את הסופרנטנט, מוסיפים 2 מ"ל סל"ד-1640 ומערבבים היטב.
- מקם 1 מ"ל של תאים RPMI-1640 לתוך microtubes סטרילי חדש, #1 ו #2; כל מיקרו-צינורית תכיל כ-5X106 תאים.
- למיקרו-צינור #1, הוסף 500 mU של sialidase מ Clostridium perfringens (ראה את טבלת החומרים). כדי microtube #2, להוסיף sialidase מטופל דמה, שהוא שליטה שלילית, כדי לאשר אם ההשפעות שנצפו קשורות ישירות להסרת חומצה סיאלית ואינן נובעות מחפצים. sialidase מטופל מדומה הוא sialidase מומת חום, אשר מתקבל על ידי הרתחת האנזים במשך 20 דקות ב 100 ° C.
- יש לדגור במשך 60 דקות בטמפרטורה של 37°C.
- לאחר הדגירה, מקם את התאים לתוך צינורות חרוטי סטריליים חדשים 15 מ"ל עם אותה מספר, #1 ו #2. הוסף כ -4 מ"ל של מדיום RPMI-1640 מלא (המכיל 10% FBS) לשני הצינורות כדי לעצור את התגובה האנזימטית.
- צנטריפוגה בטמפרטורת החדר למשך 4 דקות ב 300 x גרם (בלם רגיל), ולהשליך את supernatant.
- הוסף 5 מ"ל של מדיום RPMI-1640 מלא לכל צינור, וצלחת 1 מ"ל של תאים לכל באר.
3. קביעת פרופיל החומצה הסיאלית
- צביעת לקטין
- לאסוף ולשטוף את התאים בטמפרטורת החדר במשך 5 דקות ב 300 x גרם (בלם רגיל).
- להשעות מחדש את התאים RPMI-1640 + 10% FBS, ולהפיץ את התאים (100,000/100 μL) לתוך microtubes.
- בצע צביעה עבור ציטומטריית זרימה בסל"ד 1640 עם 10% FBS תוך שימוש בריכוז של 0.01 מ"ג/מ"ל עבור כל לקטין: לקטין Sambucus nigra (SNA ), לקטין בוטנים אגלוטינין (PNA) ולקטין Maackia amurensis (MAA) (ראה טבלת חומרים). יש לדגור במשך 30 דקות ב-4°C.
- שטפו את התאים עם 1 מ"ל PBS המכיל 10% FBS או 10% BSA, וצנטריפוגה בטמפרטורת החדר למשך 4 דקות ב 300 x גרם (בלם רגיל).
- לתאים המוכתמים בלקטינים הביוטינילטים, הוסיפו 0.0005 מ"ג/מ"ל סטרפטווידין-PE (ראו טבלת חומרים), ודגרו במשך 15 דקות בטמפרטורת החדר בחושך. לשטוף את התאים עם 1 מ"ל של PBS, וצנטריפוגה בטמפרטורת החדר במשך 4 דקות ב 300 x גרם (בלם רגיל).
- השליכו את הסופרנטנט, ולכל צינור הוסיפו 300 מיקרוליטר של 2% פרפורמלדהיד (PFA 2%). הגן על הצינורות מפני אור, ואם נדרש, אחסן בטמפרטורה של 4°C עד לאיסוף נתונים.
- קבל את הנתונים באמצעות ציטומטר זרימה תוך שבוע מהכנת הדגימה29,30.
- ציטומטריית זרימה
- להשהות מחדש את התאים ב 1 מ"ל של PBS, ולרכוש את הדגימה עם ציטומטר זרימה לרכישת נתונים מיידית.
- עבור איסוף נתונים מושהה, השהה מחדש ב- 300 μL של 2% PFA, וקבל את הנתונים תוך שבוע אחד.
- מיקרוסקופ סריקת לייזר קונפוקלי
- מצופים את התאים על כיסויי זכוכית מצופים פוליליזין בקוטר 12 מ"מ, ודגרים במשך 5 דקות בטמפרטורת החדר.
- צנטריפוגו את החלקות הכיסויים בטמפרטורת החדר למשך דקה אחת במהירות של 100 x גרם (בלם רגיל) כדי לקדם הידבקות תאים.
- יש לתקן בטמפרטורת החדר למשך 30 דקות עם 4% PFA לפני שטיפה עם 1% BSA ב-PBS.
- השתמש בלקטין SNA מצומד FITC (0.01 מ"ג/מ"ל) כדי להכתים חומצות סיאליות α2,6-linked על משטחי התא (ראה טבלת חומרים).
- רכשו תמונות במיקרוסקופ קונפוקלי (ראו טבלת חומרים).
- לאחר עיבוד מחסנית Z, בחרו תמונות בחתך רוחב קונפוקלי מייצג.
- כימות אנליטי של עוצמת הצביעה באמצעות פלואורסצנטיות התא הכוללת המתוקנת (CTCF).
הערה: CTCF = צפיפות משולבת − (שטח התא שנבחר × פלואורסצנטיות ממוצעת של קריאות רקע)29.
4. פרופיל התבגרות של mo-DCs
- צביעת נוגדנים וציטומטריית זרימה
- לאסוף מדגם חדש של התאים המעניינים לבצע צביעת נוגדנים. שטפו את התאים בטמפרטורת החדר במשך 5 דקות במהירות של 300 x גרם (בלם רגיל), ופזרו תאים לתוך המיקרו-צינוריות (100,000 תאים לכל צינור).
- בצע צביעה עבור ציטומטריית זרימה באמצעות הנוגדנים הרצויים (AB), MHI-I, MHC-II, CD80 ו- CD86 (ראה טבלת חומרים).
- יש לדגור על AB מצומדת פלואורסצנטית למשך 15 דקות בטמפרטורת החדר בחושך.
- לשטוף את התאים עם 1 מ"ל PBS, וצנטריפוגה בטמפרטורת החדר במשך 5 דקות ב 300 x גרם (בלם רגיל).
הערה: אם אתם משתמשים ב-ab ללא תווית, הוסיפו ab משני מצומד פלואורסצנטית, ודגרו בחושך במשך 15 דקות בהתאם להוראות היצרן. לשטוף את התאים עם 1 מ"ל של PBS, וצנטריפוגה בטמפרטורת החדר במשך 5 דקות ב 300 x גרם (בלם רגיל). - לכל המיקרו-צינוריות, להוסיף עד 100 μL של PBS, להשעות מחדש את התאים ב 300 μL של 2% paraformaldehyde (PFA 2%), ולשמור את הצינורות בחושך ב 4 ° C עד רכישת הנתונים.
- רכוש את הנתונים באמצעות ציטומטר זרימה.
הערה: לאחר צביעה וקיבוע, ניתן לרכוש את הדגימות על ידי ציטומטריית זרימה באופן מיידי או בתוך תקופה של שבוע. במקרה זה, לאחסן את צינורות ב 4 °C בחושך.
5. בדיקת אימונוסורבנט מקושרת אנזים (ELISA)
הערה: בעבודה זו, ייצור IFN-γ נמדד באמצעות בדיקת ELISA בהתאם להוראות היצרן (ראה טבלת חומרים).
- לציפוי הצלחת בחיץ ציפוי, מדללים את נוגדן הלכידה (1:100, לוכדים נוגדן ב-PBS), מעבירים 100 מיקרוליטר של תמיסה עובדת זו לכל באר, ודגרים לילה בטמפרטורת החדר.
- יש להשליך את נוגדן הלכידה לחלוטין.
- הוסף את מאגר החסימה (לדוגמה, PBS + 2% BSA + 0.05% Tween20), ודגור במשך שעה אחת בטמפרטורת החדר לפני הסרת מאגר החסימה.
- מוסיפים את התקן והדגימה, עם התערובת והדילולים המתאימים, ודגרים במשך שעתיים בטמפרטורת החדר. יש לכבס חמש פעמים עם מאגר כביסה.
- מוסיפים את נוגדן הגלאי הביוטינילציה, ודגרים במשך שעתיים בטמפרטורת החדר, ולאחר מכן חמש שטיפות.
- הוסיפו פולי-HRP-סטרפטווידין-HS ודגרו במשך 30 דקות בטמפרטורת החדר, ולאחר מכן חמש שטיפות עם חיץ כביסה.
- מוסיפים מצע TMB (ראו טבלת חומרים), ודגרים עד 60 דקות בטמפרטורת החדר, תוך התחשבות במערכת הבדיקה בה משתמשים. יש לכבס חמש פעמים עם מאגר כביסה.
- קרא את הדגימות על קורא microplate ב 450 ננומטר.
Representative Results
בידוד מונוציטים והתמיינות מונוציטים למו-DCs
בהתאם לפרוטוקול, מרכזיות אנושיות בודדו מהמעיל האפי באמצעות הפרדת שיפוע צפיפות עם מדיום שיפוע צפיפות ונשטפו היטב. Trypan blue שימש לביצוע ספירת תאים בת קיימא ביום הבידוד, כפי שתואר קודם לכן בשלב 1.4.1. לאחר מכן, בידוד מונוציטים CD14+ בוצע באמצעות ברירה חיובית. כדי להשיג זאת, PBMCs הודגרו עם חרוזים מגנטיים המכילים נוגדן המזהה את האנטיגן CD14. המונוציטים שנבחרו CD14+ גודלו בתרבית בתווך בתוספת GM-CSF ו-IL-4 במשך 5-6 ימים27 כדי להתמיין למו-DCs לא בשלים (איור 1A). ניתן להשיג את ההבשלה של mo-DCs על-ידי יישום קוקטייל של ציטוקינים, כולל IL-6, IL-1β, TNF-α ו-PGE235 (איור 1A).
בתהליך ההתמיינות, כתוצאה מגירוי IL-4 ו-GMCSF, הפנוטיפ של התא צפוי להשתנות. הנתונים מראים כי mo-DCs מאבדים ביטוי של סמן פני השטח CD14, המבוטאים בעיקר על-ידי מונוציטים (איור 1B), ומקבלים ביטוי משמעותי של CD1a, סמן המבוטא על-ידי DCsאנושיים 36,37. Mo-DCs גם מקבלים ביטוי MHC-II (HLA-DR) גבוה יותר, מולקולה מציגה אנטיגן המבוטאת על-ידי DCs אנושיים ותאים מציגי אנטיגן אחרים38 (איור 1B).
תכולת חומצה סיאלית על פני התא
הטיפול של mo-DCs עם sialidase מפחית את התוכן חומצה sialic על פני השטח של mo-DCs, אשר ניתן לאשר על ידי מכתים עם לקטינים, שהם חלבונים המסוגלים להיקשר פחמימות39. מכיוון שהאנזים המשמש מסיר חומצות סיאליות הקשורות ל- α2,3 ו- α2,6 מפני התא, mo-DCs הוכתמו ב- PNA, המזהה אנטיגן T Galβ1-3GalNAcα1-Ser/Thr, כמו גם לקטינים MAA ו- SNA, הנקשרים ל- α2,3- ו- α2,6-sialic, בהתאמה. יעילות הטיפול בסיאלידאז הוערכה על-ידי ציטומטריית זרימה ומיקרוסקופ קונפוקלי (איור 2). כפי שניתן לראות באיור 2A, הטיפול בסיאלידאז הפחית באופן משמעותי את קשירת MAA ו-SNA תוך הגדלת צביעת PNA. הירידה בצביעת SNA לאחר טיפול בסיאלידאז אושרה עוד יותר על-ידי ניתוח מיקרוסקופיה קונפוקלית שהראה ירידה משמעותית בכתמי SNA על פני התא (איור 2B).
אפיון פונקציונאלי של mo-DCs המטופלים בסיאלידאז
כדי להעריך כיצד הטיפול בסיאלידאז משפיע על תפקודי mo-DC, רמת ההתבגרות של mo-DCs הוערכה לאחר טיפול בסיאלידז. כפי שניתן לראות באיור 3A, הטיפול בסיאלידאז מוביל לעלייה משמעותית בביטוי של המולקולות מציגות האנטיגן MHC I ו-MHC II ולביטוי של מולקולות קו-סטימולטוריות CD80 ו-CD86. כדי להעריך את ההשפעה של הסרת חומצה סיאלית על יכולתם של mo-DCs לגרום לתגובות תאי T, נעשה שימוש ב-mo-DCs שטופלו בסיאלידאז ועמוסים בליזטים של תאי גידול כדי ליצור תאי T אוטולוגיים ראשוניים (איור 3). לאחר מכן, הפרופיל של תאי T שהתקבלו אופיין על סמך יכולתם להפריש את הציטוקין Th1 IFN-γ. כפי שניתן לראות באיור 3B, בהשוואה לתאי T שהוקדמו על-ידי mo-DCs שעברו סיאלילציה מלאה, תאי T שהוקדמו על-ידי mo-DCs שטופלו בסיאלידאז הפרישו רמות גבוהות יותר באופן משמעותי של IFN-γ. תוצאות אלה מצביעות על כך ש-mo-DCs שטופלו בסיאלידאז שיפרו את יכולתם להגיע לתאי T אוטולוגיים ראשוניים.
כדאיות התא
לאחר הטיפול בסיאלידז, בוצעה בדיקת כדאיות כדי להבטיח שהטיפול אינו ציטוטוקסי לתאים. לאחר הטיפול, mo-DCs הוכתמו ב-7-AAD וב-Annexin V, כדי לזהות תאים אפופטוטיים שאינם בני קיימא, ונותחו על-ידי ציטומטריית זרימה (איור 4). הנתונים לא מראים הבדל משמעותי בכדאיות התאים בין תאים שלא טופלו (איור 4, פאנל שמאלי) לבין תאים שטופלו בסיאלידאז (איור 4, פאנל ימני).
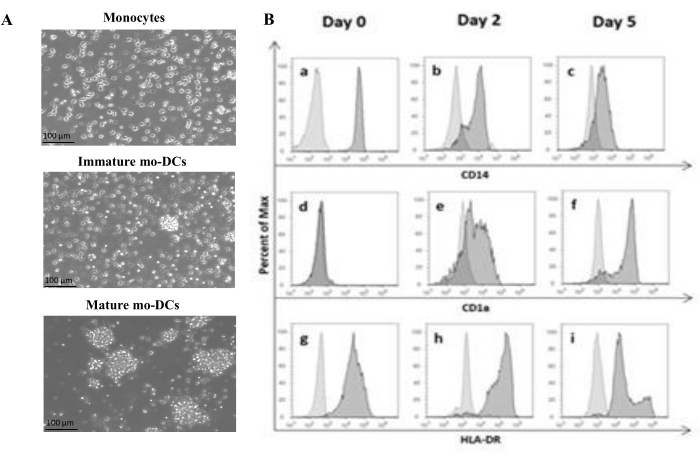
איור 1: התמיינות של מונוציטים מבודדים ל-mo-DCs. (A) מונוציטים CD14+ בודדו ממעילי באפי וגודלו בתרבית בריכוז של 1.3 x 106 תאים/מ"ל ב-37°C. המונוציטים נבדלו בתווך בתוספת 750 U/mL של IL-4 ו-1,000 U/mL של GM-CSF. ניתוח מיקרוסקופי של המורפולוגיה של מונוציטים שבודדו ממעיל באפי אנושי ביום 0 (תמונה עליונה). מו-DCs בוסריים; התאים התמינו במהלך תקופה של 5 ימים באמצעות IL-4 ו- GM-CSF (תמונה אמצעית). mo-DCs בוגרים התקבלו באמצעות ציטוקינים IL-6, IL-1β, TNF-α ו-PGE2 במשך 24 שעות (תמונה תחתונה). פסי קנה מידה: 100 מיקרומטר. (B) התאים נותחו ביום 0, יום 2 ויום 5 לאורך תקופת ההתמיינות באמצעות ציטומטריית זרימה. הנוגדנים הבאים שימשו לאפיון סמני פני התא: (a-c) CD14; (ד-ו) CD1a, ו- (G-I) HLA-DR (MHC Class II). האיור מציג היסטוגרמות מייצגות של לפחות שלוש בדיקות עצמאיות. פאנל (B) שונה מ-Videira et al.40, פטנט WO2017002045A1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
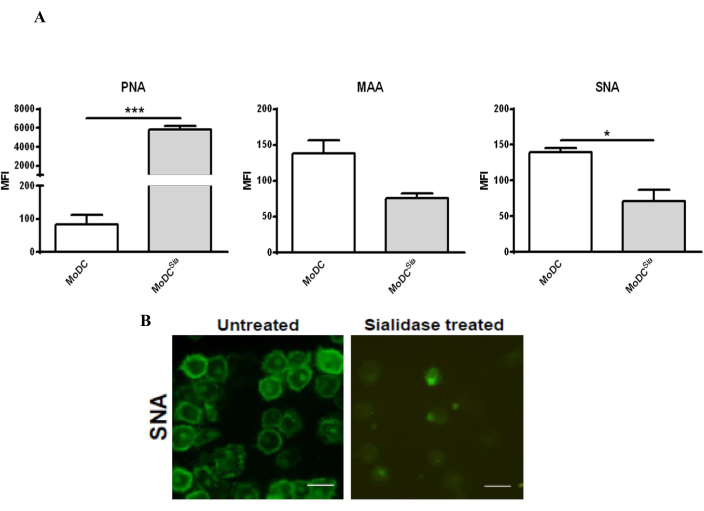
איור 2: טיפול Sialidase ב-mo-DCs אנושיים כדי להסיר חומצות סיאליות הקשורות ל-α2,6 ו-α2,3 מפני השטח של התא. (A) ניתוח של mo-DCs על ידי ציטומטריית זרימה באמצעות צביעת לקטין כדי לבדוק את היעילות של טיפול בסיאלידז. mo-DCs אנושיים טופלו בסיאלידאז (פסים אפורים) או נותרו ללא טיפול (פסים לבנים) ומוכתמים בלקטין SNA (זיהוי [2,6]-חומצות סיאליות), MAA לקטין (זיהוי [2,3]-חומצות סיאליות), ולקטין PNA (זיהוי אנטיגן T-Galβ1-3GalNAcα1-Ser/Thr). הערכים מייצגים את עוצמת הפלואורסצנטיות הממוצעת (MFI) של לפחות שלוש בדיקות עצמאיות. מובהקות סטטיסטית נקבעה באמצעות מבחן t זוגי דו-זנבי (*P < 0.05 או ***P < 0.0001), המתייחס להבדל בין DCs שלא טופלו וטופלו בסיאלידאז. טיפול בסיאלידאז הפחית את קשירת MAA והגביר את צביעת PNA במו-DCs אנושיים, כתוצאה מהסרת חומצות סיאליות מקושרות α(2,3); הסרת חומצות סיאליות הקשורות ל- α(2,6) לאחר טיפול בסיאלידאז זוהתה על ידי ירידה בצביעת SNA. (B) מיקרוסקופ קונפוקלי של mo-DCs שטופלו בסיאלידאז והוכן על כיסויים להשגחה. מגוון של תמונות z-stack נאספו מתאים שונים ועובדו כדי לכלול את עוצמת הצביעה הממוצעת. פסי קנה מידה: 20 מיקרומטר. לוח (A) שונה מ-Silva et al.30; לוח (B) שונה מ-Silva et al.29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
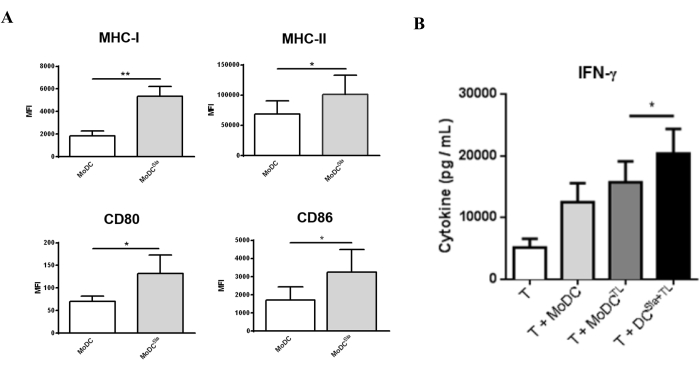
איור 3: טיפול סיאלידאז ב-mo-DCs הגורם לביטוי גבוה יותר של סמני הבשלה. (A) mo-DCs שטופלו בסיאלידאז הראו פנוטיפ הבשלה גבוה יותר מאשר mo-DCs סיאליליים מלאים. ציטומטריית זרימה שימשה להערכת הביטוי של מספר סמני התבגרות. mo-DCs טופלו עם sialidase במשך 1 שעה ב 37 ° C; ערכי הגרף מייצגים את עוצמת הפלואורסצנטיות הממוצעת (MFI) (ממוצע ± SEM) של לפחות שלוש בדיקות עצמאיות. הבדלים מובהקים סטטיסטית חושבו באמצעות מבחן t (*P < 0.05, **P < 0.01), המתייחס להבדל בין התנאים שלא טופלו וטופלו בסיאלידז. (B) mo-DCs אנושיים מיובשים עמוסים באנטיגנים שלמים של הגידול גרמו לתגובות ספציפיות של תאי T. mo-DCs טופלו עם sialidase במשך 1 שעה ב 37 ° C או נשאר ללא טיפול, ואחריו העמסה עם MCF-7 lysates (TL) כמקור של אנטיגנים תאי הגידול השלמים. תרבית משותפת בין mo-DCs ותאי T אוטולוגיים בוצעה במשך 4-8 ימים בנוכחות IL-2 (10 U/mL). תאי T עם mo-DCs מותפלים הראו הפרשה גבוהה משמעותית של ציטוקין Th1, IFN-γ. בעקבות גירוי תאי T עם mo-DCs, הציטוקינים שהופרשו לסופרנאטנטים של תרבית משותפת נמדדו על ידי ELISA (n = 7). ערכי הגרף מייצגים את הריכוז (pg/mL) (ממוצע ± SEM). הבדלים מובהקים סטטיסטית חושבו באמצעות מבחן t (*P < 0.05). הדמות שונתה מ Silva et al.30. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
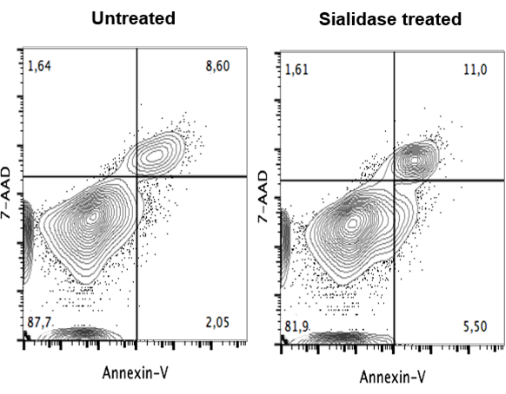
איור 4: היעדר השפעה של טיפול בסיאלידאז על הכדאיות של מו-DCs אנושיים. mo-DCs לא מטופלים (פאנל שמאלי) ו-mo-DCs שטופלו בסיאלידאז (פאנל ימני) היו נתונים לצביעה כפולה עם נספח V ו-7-AAD, והצביעה נותחה על ידי ציטומטריית זרימה. הנתונים לא הראו הבדל משמעותי ביכולת הקיום של התאים בין תאים שלא טופלו לבין תאים שטופלו בסיאלידאז, מה שמרמז על כך שמו-DCs יכולים לסבול טיפול בסיאלידאז ולהישאר בני קיימא כדי להפעיל את הפונקציה החיסונית שלהם. הדמות שונתה מ Silva et al.30. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בידוד מונוציטים
כתב היד הזה מתאר פרוטוקול ליצירת mo-DCs ממונוציטים שבודדו על ידי בני אדם CD14+ (איור 1A), ולאחר מכן ביצוע טיפול בסיאלידאז כדי להפחית את תכולת החומצה הסיאלית על פני השטח של התאים האלה.
ישנן דרכים שונות להשיג DCs אנושיים, כגון ישירות מדם היקפי או רקמות או באמצעות הבחנה מבשרים כגון תאי גזע או מונוציטים. השגת DCs המובחנים ממונוציטים שבודדו מדם היקפי היא הרבה יותר פשוטה בשל הקלות של השגת כמויות גבוהות של מונוציטים בהשוואה למקורות DC אחרים41. ובכל זאת, כדי להשיג אחוז גבוה של מונוציטים מבודדים, יש לעקוב בקפידה אחר כל שלבי הפרוטוקול. לדוגמה, מדיום שיפוע הצפיפות עלול להיות רעיל לתאים, וכדי למנוע מוות תאי, יש להימנע ממגע ממושך של התאים עם מדיום שיפוע הצפיפות ולשטוף את התאים ביסודיות. מניפולציה התא חייב להיעשות מהר ככל האפשר כדי למנוע את אובדן הכדאיות התא. מ-PBMCs ניתן לבודד מונוציטים באמצעות ברירה חיובית בשיטת מיון תאים המופעלים מגנטית (MACS), שהיא טכנולוגיה מתאימה להפקת מספר גבוה של מונוציטים. בנוסף, בהשוואה לשיטות בחירת מונוציטים אחרות, mo-DCs שמקורם במונוציטים מבודדים MACS הם בעלי יכולת גדולה יותר לעורר פעילות תאי T אנטי-סרטניים42. בפרוטוקול הזה, לאחר שבודדו, המונוציטים הודגרו עם IL-4 ו-GM-CSF לתקופה של 5-6 ימים כדי להשיג את ההתמיינות ל-mo-DCs לא בשלים (איור 1). התוצאות הראו שמבחינה מורפולוגית (איור 1A) ופנוטיפית (איור 1B), המונוציטים המבודדים התמינו למו-DCs לא בוגרים. יתר על כן, במהלך ההתמיינות, ה-mo-DCs איבדו את הביטוי של סמני CD14 וקיבלו את הביטוי של CD1a ו-MHC-II (איור 1B), אשר נדרשים להצגת אנטיגן לתאי T.
בידוד זה והתמיינות של מונוציטים למו-DCs הם מגבלות לפרוטוקול זה. תהליך הבידוד הוא צעד רגיש שיש לבצע בזהירות ובמהירות כדי למנוע מוות תאי, ושלב זה חייב להיעשות גם בכל פעם שיש צורך במו-DCs לניסוי חדש. תהליך הבידול אורך 5-6 ימים, מה שמציב קושי מבחינת השימוש בשיטה זו לניתוחים בעלי תפוקה גבוהה. עם זאת, שיטת הבידוד והשימוש בציטוקינים כדי להבדיל בין mo-DCs שימושיים ליצירת מספר גבוה של mo-DCs פונקציונליים במבחנה למטרות ניסוי. mo-DCs שנוצרו בפרוטוקול זה מסוגלים לעבור טיפול sialidase, ציטומטריה זרימה, ELISA, מיקרוסקופ קונפוקלי, וכן הלאה, ובכך להדגיש את החשיבות ואת התועלת של שיטה זו30.
mo-DCs לא בשלים וטיפול sialidase
Sialidases חיוניים בוויסות sialylation והם אחראים על הסרת חומצות sialic מן פני התא glycans. ב mo-DCs, הסרת חומצה סיאלית על ידי sialidase מוביל להבשלה של תאים אלה, אשר מגביר את הצגת אנטיגן צולב ולאחר מכן הפעלת תאי T ופעילות אנטי סרטנית30.
mo-DCs אנושיים לא בוגרים מציגים תכולה גבוהה של חומצות סיאליות הקשורות לפני השטח של התא α(2,6) ו-α(2,3)-מקושרות27 בהשוואה ל-mo-DCs בוגרים31,43. יתר על כן, הסרת חומצות סיאליות על ידי טיפול mo-DCs עם sialidase משפר את ההבשלה של DCs 28,30,31. הסיאלידאז שנבחר לניסוי זה היה מהחיידק Clostridium perfringens. עם זאת, אורגניזמים אחרים מייצרים גם sialidases, כגון חיידקים Streptococcus pneumoniae, Vibrio cholerae, או סלמונלה typhimurium44, עלוקה Macrobdella decora45, ואפילו הומו ספיינס46, ו sialidases מאורגניזמים אלה משמשים גם באופן ניסיוני. עם זאת, לכל sialidase יש ספציפיות המצע שונה. בנוסף, שימוש באנזים sialidase יכול להיות מגבלות; לדוגמה, מניפולציה של mo-DCs במהלך הטיפול יכול עוד לעורר תאים אלה. יתר על כן, כמות sialidase ואת זמני הדגירה חייב להיות אופטימלי מבוסס על סוג התאים בשימוש ואת הרכב חומצה sialic שלהם. הסרת החומצה הסיאלית אינה השפעה קבועה אלא תופעה חולפת, מכיוון שהתא ישחזר את תכולת החומצה הסיאלית על פני התא. מלבד sialidase, ישנן שיטות אחרות כדי להפחית את מולקולות חומצה sialic על פני השטח של תאים, כגון באמצעות מעכבי sialyltransferase, נוקאאוט גנים של גנים sialyltransferase, או חסימה מטבולית של חומצה sialic באמצעות חומצה sialic mimetics47,48,49. עם זאת, שיטות אלה עשויות להיות בעלות השפעות שונות על התאים, ומלבד התפלה, יש לקחת בחשבון את כדאיות התא. הטיפול באנזים סיאלידאז הוא שיטה מעשית להסרה יעילה וחולפת של חומצות סיאליות על פני התא תוך שמירה על יכולת הקיום של התא.
בעבודה זו, סיאלידאז נוסף למו-DCs הלא בשלים בריכוז של 500 mU / 5 x 106 תאים / מ"ל, והתאים הודגרו ב -37 מעלות צלזיוס במשך 60 דקות. הטיפול בוצע באמצעות RPMI-1640 ללא סרום כדי לשמר את יכולת הקיום של התא ולמנוע כל אינטראקציה בין מולקולות הסיאלילציה הקיימות בסרום30. טיפול Sialidase יכול להתבצע עם חוצצים אחרים מלבד RPMI, כגון 50 mM נתרן אצטט, pH 5.1 (במקרה של C. perfingens sialidase), או PBS50,51,52. עם זאת, RPMI-1640 הוא מדיום התרבית הנפוץ ביותר עבור DCs מכיוון שהוא שומר על תנאי ניסוי קבועים במהלך ההליך, נמנע מגרימת התבגרות, ומפחית כל לחץ שעלול להיגרם על ידי מאגרי sialidase או PBS 53,54,55,56. לאחר הדגירה עם סיאלידאז, חיוני לשטוף את התאים ביסודיות עם מדיום בתוספת סרום כדי להבטיח שתגובת האנזים תיפסק. נוכחותן של מולקולות סיאלילציה בסרום תתחרה כמצעים לסיאלידאז, ובכך תבטיח עצירת תגובה מהירה.
אפיון סמן פני השטח לפי ציטומטריית זרימה ומיקרוסקופ קונפוקלי
לצורך קביעת פרופיל החומצה הסיאלית, בפרוטוקול סעיף 3, השתמשנו בצביעת לקטין ואחריה ציטומטריית זרימה ומיקרוסקופ סריקת לייזר קונפוקלי. עבור הליך צביעת התא, בשני המקרים, ריכוזי הלקטין ותנאי הדגירה היו אופטימליים כדי למנוע הצטברות תאים ומוות. זה קריטי לבצע את הדגירה ב 4 ° C במאגרים המכילים לפחות 2% של FBS או BSA כדי למנוע קשירה לא ספציפית של הלקטינים. בפרוטוקול זה, RPMI-1640 המכיל 10% FBS שימש כדי לשמור על תנאי ניסוי קבועים ולהימנע מלחץ תאי. לגבי מיקרוסקופיה קונפוקלית, קיבוע התאים לפני הצביעה חיוני לשימור המורפולוגיה, למניעת אוטוליזה ולשמירה על אנטיגניות.
ניתוח הפנוטיפ של mo-DC על-ידי ציטומטריית זרימה הראה של-mo-DCs שטופלו בסיאלידאז הייתה כמות גבוהה משמעותית של לקטין PNA הקשור לפני השטח של התא בהשוואה ללקטינים MMA ו-SNA, אשר פחתה לאחר הטיפול בסיאלידאז (איור 2A). כצפוי, צביעת PNA גדלה, שכן PNA מזהה אנטיגנים שאינם סיאלילטים, בניגוד ל- MAA ו- SNA, הנקשרים ישירות לחומצות α2,3- ו- α2,6-sialic, בהתאמה30. צביעה זו מאשרת את ההסרה היעילה של חומצות סיאליות משטח התא באמצעות פרוטוקול זה. שיטה נוספת שניתן להשתמש בה כדי לאמת את הטיפול ולנתח את תכולת החומצה הסיאלית על פני התא היא צביעת לקטין ואחריה מיקרוסקופ קונפוקלי, כפי שמודגם באיור 2B.
מלבד הדוגמאות הראשונות, קיימות גישות חלופיות להערכה ולאפיון של תכולת חומצה סיאלית, כגון חיטוט בלקטין על ידי כתם מערבי. קיימים גם לקטינים חלופיים ספציפיים לחומצה סיאלית, כגון Siglecs, קבוצה של לקטינים שיש להם העדפה ברורה לסוגי חומצה סיאלית וקישורים57. מלבד שימוש בלקטינים בשתי הטכניקות (ציטומטריית זרימה, מיקרוסקופיה או כתם מערבי), ניתן גם לאפיין את תכולת החומצה הסיאלית באמצעות נוגדנים; לדוגמה, חומצות α2,8-sialic ניתן להעריך על ידי נוגדנים כגון clone 735, שהוא ספציפי עבור חומצה polysialic58. בנוסף, לאחר טיפול sialidase, תאים יכולים להיבדק פונקציונלית על היעילות הביולוגית או הטיפולית שלהם על ידי הערכת הפנוטיפ שלהם ואת היכולת להפעיל תאי T40. למעשה, כפי שניתן לראות בדוגמאות שסופקו, mo-DCs שטופלו בסיאלידאז הראו פנוטיפ הבשלה גבוה יותר, כמו גם ביטוי מוגבר של מולקולות מציגות אנטיגן וגירוי משותף.
יתר על כן, mo-DCs שטופלו בסיאלידאז יכולים להיות נטענים באנטיגנים ולהיות בתרבית משותפת עם תאי T או תאים אחרים ואז ניתן לחקור לגבי הפנוטיפ, פרופיל הפרשת הציטוקינים או תכונות אחרות. בדוגמה שסופקה, הנתונים מראים כי mo-DCs המטופלים בסיאלידאז יכולים להיות נטענים באנטיגנים סרטניים ולאחר מכן להשתמש בהם להפעלת תאי T. למעשה, תאי T שהתקבלו הראו הפרשת IFN-γ מוגברת, אשר עולה בקנה אחד עם דיווחים קודמים על ההשפעה של מחסור בחומצה סיאלית על הגברת היכולת של mo-DCs להפעיל תאי T 27,28,29,30,31.
לסיכום, פרוטוקול זה מראה שיטה ישימה, ישימה ומעשית ליצירת mo-DCs למניפולציה של תכולת חומצה סיאלית על ידי טיפול בסיאלידאז. פרוטוקול זה מציג מתודולוגיה שיכולה לשרת מטרות ויישומים שונים. לשיטה זו יכול להיות לא רק תפקיד מכריע בהבנת תפקידן של חומצות סיאליות בהבשלה ובתגובה של תאי מערכת החיסון, אלא גם לשמש ככלי אימונומודולטורי.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים או ניגודי עניינים אחרים.
Acknowledgements
המחברים מודים על מימון מהנציבות האירופית GLYCOTwinning GA 101079417 ו-EJPRD/0001/2020 EU 825575; Fundação para a Ciência e Tecnologia (FCT) Portugal, תחת מענקים FCT 2022.04607.PTDC, UIDP/04378/2020, UIDB/04378/2020 (UCIBIO) ו- LA/P/0140/2020 (i4HB). FCT-NOVA. ו-Stemmatters מומנו גם על ידי Fundo Europeu de Desenvolvimento Regional (FEDER), באמצעות Programa Operacional Regional do Norte (Norte 2020) עבור SI I & פרויקט DT DCMatters (NORTE-01-0247-FEDER-047212). אנו מכירים במתקן Biolabs ב- FCT-NOVA וב- GLYCOVID NOVA Saude.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | AstiK’s | CTGP-E15-050 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 24-well plate | Greiner Bio-one | 662 160 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 50 mL conical tube | AstiK’s | CTGP-E50-050 | Obtaining Monocyte-derived Dendritic Cells |
| 7-Aminoactinomycin D (7-AAD) | BioLegend | 420404 | Obtaining Monocyte-derived Dendritic Cells |
| Annexin V | Immunotools | 31490013 | Obtaining Monocyte-derived Dendritic Cells |
| Attune Acoustic Focusing Flow Cytometer | Thermo Fisher Scientific | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs | |
| BSA | Sigma - Aldrich | A3294-100G | Obtaining Monocyte-derived Dendritic Cells; Determination of Sialic Acid Profile |
| CD14 (Monoclonal TÜK4) | Miltenyi Biotec | 130-080-701 | Obtaining Monocyte-derived Dendritic Cells |
| CD80 | Immunotools | 21270803 | Maturation Profiling of mo-DCs |
| CD86 | Immunotools | 21480863 | Maturation Profiling of mo-DCs |
| Cell counting slides and trypan blue | EVE | EVS-050 | Obtaining Monocyte-derived Dendritic Cells |
| Centrifuge | Eppendorf | 5430 R | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Density gradient medium (Histopaque) | Sigma - Aldrich | 10771-100ML | Obtaining Monocyte-derived Dendritic Cells |
| EDTA | Gibco, ThermoFisher | 15400054 | Obtaining Monocyte-derived Dendritic Cells |
| Elisa kit (IFN-γ) | Immunotools | 31673539 | Maturation Profiling of mo-DCs |
| EVE automated cell count | NanoEntek | 10027-452 | Obtaining Monocyte-derived Dendritic Cells |
| Fetal bovine serum (FBS) | Gibco | 10500064 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Granulocyte-macrophage colony-stimulating factor (GM-CSF) | Miltenyi Biotec | 130-093-864 | Obtaining Monocyte-derived Dendritic Cells |
| Human CD14 microbeads (Immunomagnetic beads) | Miltenyi Biotec | 130-050-201 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-1β | Sigma - Aldrich | I9401 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-4 | Miltenyi Biotec | 130-093-919 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-6 | Sigma - Aldrich | SRP3096 | Obtaining Monocyte-derived Dendritic Cells |
| L-glutamine | Gibco | A2916801 | Obtaining Monocyte-derived Dendritic Cells |
| LS column and plunger | Miltenyi Biotec | 130-042-401 | Obtaining Monocyte-derived Dendritic Cells |
| Maackia amurensis (MAA) lectin (MAA lectin - Biotinylated) | Vector labs | B-1265-1 | Determination of Sialic Acid Profile |
| MHC-I (HLA-ABC) | Immunotools | 21159033 | Maturation Profiling of mo-DCs |
| MHC-II (HLA-DR) | Immunostep | HLADRA-100T | Maturation Profiling of mo-DCs |
| Microtubes | AstiK’s | PCRP-E015-500 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Neuraminidase (Sialidase) | Roche | 11585886001 | Treatment of Cells with Sialidase |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | Obtaining Monocyte-derived Dendritic Cells |
| Paraformaldehyde (PFA 2%) | Polysciences Europe | 25085-1 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Paraformaldehyde (PFA 4%) | Biotium | 22023 | Determination of Sialic Acid Profile |
| Pasteur pipettes | Labbox | PIPP-003-500 | Obtaining Monocyte-derived Dendritic Cells |
| Peanut (Arachis hypogaea) Agglutinin (PNA) lectin (PNA lectin - FITC) | Vector labs | FL-1071 | Determination of Sialic Acid Profile |
| Penicillin/streptomycin | Gibco | 15140163 | Obtaining Monocyte-derived Dendritic Cells |
| Phosphate Buffered Saline (PBS) | NZYTech | MB18201 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Prostaglandin E2 (PGE2) | Sigma - Aldrich | P0409 | Obtaining Monocyte-derived Dendritic Cells |
| RBC lysis buffer | BioLegend | 420302 | Obtaining Monocyte-derived Dendritic Cells |
| RPMI-1640 medium (containing 11.1 mM glucose) | Gibco | 31870074 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - Biotinylated) | Vector labs | B-1305-2 | Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - FITC) | Vector labs | FL-1301-2 | Determination of Sialic Acid Profile |
| Sodium pyruvate | Thermofisher | 11360-070 | Obtaining Monocyte-derived Dendritic Cells |
| SpectroMax190 | Molecular Devices | Maturation Profiling of mo-DCs | |
| Streptavidin-PE | BioLegend | 405203 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Tetramethylbenzidine (TMB) | Sigma - Aldrich | T0440 | Maturation Profiling of mo-DCs |
| Tumour necrosis factor-α (TNF-α) | Sigma - Aldrich | H8916 | Obtaining Monocyte-derived Dendritic Cells |
| Zeiss LSM710 confocal microscope | Zeiss | Determination of Sialic Acid Profile |
References
- Varki, A., Gagneux, P. Multifarious roles of sialic acids in immunity. Annals of the New York Academy of Sciences. 1253, 16-36 (2012).
- Bochner, B. S., Zimmermann, N. Role of Siglecs and related glycan-binding proteins in immune responses and immunoregulation. The Journal of Allergy and Clinical Immunology. 135 (3), 598-608 (2015).
- Smith, B. A. H., Bertozzi, C. R. The clinical impact of glycobiology: Targeting selectins, Siglecs and mammalian glycans. Nature Reviews Drug Discovery. 20, 217-243 (2021).
- Schauer, R. Sialic acids as regulators of molecular and cellular interactions. Current Opinion in Structural Biology. 19 (5), 507-514 (2009).
- Manhardt, C. T., Punch, P. R., Dougher, C. W. L., Lau, J. T. Y. Extrinsic sialylation is dynamically regulated by systemic triggers in vivo. Journal of Biological Chemistry. 292 (33), 13514-13520 (2017).
- Cabral, M. G., et al. Human dendritic cells contain cell surface sialyltransferase activity. Immunology Letters. 131 (1), 89-96 (2010).
- Bordron, A., et al. Hyposialylation must be considered to develop future therapies in autoimmune diseases. International Journal of Molecular Sciences. 22 (7), 3402 (2021).
- Julien, S., Videira, P. A., Delannoy, P. Sialyl-Tn in cancer: (How) did we miss the target. Biomolecules. 2 (4), 435-466 (2012).
- Munkley, J. Aberrant sialylation in cancer: Therapeutic opportunities. Cancers. 14 (17), 4248 (2022).
- Dennis, J. W., Laferte, S., Waghorne, C., Breitman, M. L., Kerbel, R. S. S1-6 Branching of Asn-linked oligosaccharides is directly associated with metastasis. Science. 236 (4801), 582-585 (1987).
- Pinho, S. S., Reis, C. A. Glycosylation in cancer: Mechanisms and clinical implications. Nature Reviews Cancer. 15 (9), 540-555 (2015).
- Manni, M., Läubli, H. Targeting glyco-immune checkpoints for cancer therapy. Expert Opinion on Biological Therapy. 21 (8), 1063-1071 (2021).
- Sjögren, J., Lood, R., Nägeli, A. On enzymatic remodeling of IgG glycosylation; Unique tools with broad applications. Glycobiology. 30 (4), 254-267 (2020).
- Trastoy, B., et al. Sculpting therapeutic monoclonal antibody N-glycans using endoglycosidases. Current Opinion in Structural Biology. 72, 248-259 (2022).
- Pascoal, C., et al. Sialyl LewisX/A and cytokeratin crosstalk in triple negative breast cancer. Cancers. 15 (3), 731 (2023).
- von Itzstein, M., et al. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature. 363 (6428), 418-423 (1993).
- Gray, M. A., et al. Targeted glycan degradation potentiates the anticancer immune response in vivo. Nature Chemical Biology. 16 (12), 1376-1384 (2020).
- Fernandes, &. #. 1. 9. 4. ;., et al. Glycans as shapers of tumour microenvironment: A sweet driver of T-cell-mediated anti-tumour immune response. Immunology. 168 (2), 217-232 (2023).
- Togayachi, A., et al. Polylactosamine on glycoproteins influences basal levels of lymphocyte and macrophage activation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15829-15834 (2007).
- Park, D. D. Resident and elicited murine macrophages differ in expression of their glycomes and glycan-binding proteins. Cell Chemical Biology. 28 (4), 567-582 (2021).
- Steinman, R. M. Dendritic cells and immune-based therapies. Experimental Hematology. 24 (8), 859-862 (1996).
- Sabado, R. L., Bhardwaj, N. Directing dendritic cell immunotherapy towards successful cancer treatment. Immunotherapy. 2 (1), 37-56 (2010).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Steinman, R. M., Banchereau, J. Taking dendritic cells into medicine. Nature. 449 (7161), 419-426 (2007).
- So-Rosillo, R., Small, E. J. Sipuleucel-T (APC8015) for prostate cancer. Expert Review of Anticancer Therapy. 6 (9), 1163-1167 (2006).
- Cheever, M. A., Higano, C. S. PROVENGE (Sipuleucel-T) in prostate cancer: The first FDA-approved therapeutic cancer vaccine. Clinical Cancer Research. 17 (11), 3520-3526 (2011).
- Videira, P. A., et al. Surface α2-3- and α2-6-sialylation of human monocytes and derived dendritic cells and its influence on endocytosis. Glycoconjugate Journal. 25 (3), 259-268 (2008).
- Cabral, M. G., et al. The phagocytic capacity and immunological potency of human dendritic cells is improved by α2,6-sialic acid deficiency. Immunology. 138 (3), 235-245 (2013).
- Silva, Z., et al. MHC class I stability is modulated by cell surface sialylation in human dendritic cells. Pharmaceutics. 12 (3), 249 (2020).
- Silva, M., et al. Sialic acid removal from dendritic cells improves antigen cross-presentation and boosts anti-tumor immune responses. Oncotarget. 7 (27), 41053-41066 (2016).
- Crespo, H. J., et al. Effect of sialic acid loss on dendritic cell maturation. Immunology. 128, 621-631 (2009).
- Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components. Council of Europe. , (2017).
- LS Columns. Miltenyi Biotec Available from: https://www.miltenyibiotec.com/US-en/products/Is-columns.html#130-042-401 (2012)
- Nair, S., Archer, G. E., Tedder, T. F. Isolation and generation of human dendritic cells. Current Protocols in Immunology. 07, (2012).
- Wu, X., Xu, F., Liu, J., Wang, G. Comparative study of dendritic cells matured by using IL-1β, IL-6, TNF-α and prostaglandins E2 for different time span. Experimental and Therapeutic Medicine. 14 (2), 1389-1394 (2017).
- Naeim, F., Nagesh Rao, P., Song, S., Phan, R. Chapter 2 - Principles of Immunophenotyping. Atlas of Hematopathology. , 29-56 (2018).
- Cernadas, M., Lu, J., Watts, G., Brenner, M. B. CD1a expression defines an interleukin-12 producing population of human dendritic cells. Clinical and Experimental Immunology. 155, 523-533 (2009).
- Santambrogio, L., Strominger, J. L. The ins and outs of MHC class II proteins in dendritic cells. Immunity. 25 (6), 857-859 (2006).
- Raposo, C. D., Canelas, A. B., Barros, M. T. Human lectins, their carbohydrate affinities and where to find them. Biomolecules. 11 (2), 188 (2021).
- Videira, P. A. Q., et al. Patent WO2017002045. A viable cell population, method for production and uses thereof. Portugal patent. , (2017).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: Advantages for clinical application in comparison to peripheral blood monocyte derived cells. International Journal of Oncology. 20 (2), 247-253 (2002).
- Marques, G. S., Silva, Z., Videira, P. A. Antitumor efficacy of human monocyte-derived dendritic cells: Comparing effects of two monocyte isolation methods. Biological Procedures Online. 20, 4 (2018).
- Bax, M., et al. Dendritic cell maturation results in pronounced changes in glycan expression affecting recognition by Siglecs and galectins. Journal of Immunology. 179 (12), 8216-8224 (2007).
- Chinoy, Z. S., Montembault, E., Moremen, K. W., Royou, A., Friscourt, F. Impacting bacterial sialidase activity by incorporating bioorthogonal chemical reporters onto mammalian cell-surface sialosides. ACS Chemical Biology. 16 (11), 2307-2314 (2021).
- Chou, M. -. Y., Li, S. -. C., Li, Y. -. T. Cloning and expression of sialidase L, a NeuAcα2→3Gal-specific sialidase from the leech, Macrobdella decora. Journal of Biological Chemistry. 271 (32), 19219-19224 (1996).
- Crespo, H. J., Lau, J. T. Y., Videira, P. A. Dendritic cells: A spot on sialic acid. Frontiers in Immunology. 4, 491 (2013).
- Büll, C. Metabolic sialic acid blockade lowers the activation threshold of moDCs for TLR stimulation. Immunology & Cell Biology. 95 (4), 408-415 (2017).
- Ohmi, Y., et al. Majority of alpha2,6-sialylated glycans in the adult mouse brain exist in O -glycans: SALSA-MS analysis for knockout mice of alpha2,6-sialyltransferase genes. Glycobiology. 31 (5), 557-570 (2021).
- Chung, C., et al. Integrated genome and protein editing swaps α-2,6 sialylation for α-2,3 sialic acid on recombinant antibodies from CHO. Biotechnology Journal. 12 (2), 1600502 (2017).
- Hyvärinen, S., Meri, S., Jokiranta, T. S. Disturbed sialic acid recognition on endothelial cells and platelets in complement attack causes atypical hemolytic uremic syndrome. Blood. 127 (22), 2701-2710 (2016).
- Powell, L. D., Whiteheart, S. W., Hart, G. W. Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction. Journal of Immunology. 139, 262-270 (1987).
- Corfield, A. P., Higa, H., Paulson, J. C., Schauer, R. The specificity of viral and bacterial sialidases for α(2-3)- and α(2-6)-linked sialic acids in glycoproteins. Biochimica et Biophysica Acta - Protein Structure and Molecular Enzymology. 744 (2), 121-126 (1983).
- Tkachenko, N., Wojas, K., Tabarkiewicz, J., Rolinski, J. Generation of dendritic cells from human peripheral blood monocytes - Comparison of different culture media. Folia Histochemica et Cytobiologica. 43, 25-30 (2005).
- Kim, S. J., et al. Human CD141+ dendritic cells generated from adult peripheral blood monocytes. Cytotherapy. 21 (10), 1049-1063 (2019).
- Calmeiro, J., et al. In-depth analysis of the impact of different serum-free media on the production of clinical grade dendritic cells for cancer immunotherapy. Frontiers in Immunology. 11, 593363 (2021).
- Stamatos, N. M., et al. LPS-induced cytokine production in human dendritic cells is regulated by sialidase activity. Journal of Leukocyte Biology. 88 (6), 1227-1239 (2010).
- Lehmann, F., Tiralongo, E., Tiralongo, J. Sialic acid-specific lectins: Occurrence, specificity and function. Cellular and Molecular Life Sciences. 63 (12), 1331-1354 (2006).
- Frosch, M., Görgen, I., Boulnois, G. J., Timmis, K. N., Bitter-Suermann, D. NZB mouse system for production of monoclonal antibodies to weak bacterial antigens: Isolation of an IgG antibody to the polysaccharide capsules of Escherichia coli K1 and group B meningococci. Proceedings of the National Academy of Sciences of the United States of America. 82 (4), 1194-1198 (1985).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved