Успешная ортотопическая трансплантация печени мышам с использованием микрокомпьютерной томографии
In This Article
Summary
В этом протоколе мы обсуждаем реализацию модели успешной ортотопической трансплантации печени (ОЛТ) у мышей. Кроме того, обсуждаются адъюванты для дальнейшего анализа проходимости аллотрансплантата после успешного ОЛТ у мышей, в частности, с использованием микрокомпьютерной томографии (микроКТ).
Abstract
Микрокомпьютерная томография (микроКТ) является бесценным ресурсом для исследователей. Новые достижения в этой технологии позволили получить высококачественные изображения микроциркуляторного русла и являются высокоточными инструментами в области трансплантации органов. В этой модели ортотопической трансплантации печени (OLT) у мышей микроКТ дает возможность оценить анастомоз аллотрансплантата в режиме реального времени и имеет дополнительное преимущество, заключающееся в том, что не нужно жертвовать исследуемыми животными. Выбор контраста, а также настройки получения изображения создают изображение высокой четкости, которое дает исследователям бесценную информацию. Это позволяет оценить технические аспекты процедуры, а также потенциально оценить различные терапевтические методы в течение длительного периода времени. В этом протоколе мы поэтапно детализируем модель OLT на мышах и, наконец, описываем протокол микроКТ, который может давать высококачественные изображения, которые помогают исследователям в углубленном анализе трансплантации солидных органов. Мы приводим пошаговое руководство по пересадке печени мыши, а также кратко обсуждаем протокол оценки проходимости трансплантата с помощью микроКТ-ангиографии.
Introduction
Трансплантация является единственным эффективным методом лечения терминальной стадии заболевания печени. Бесспорно, польза от трансплантации печени отличная: медиана выживаемости составляет 11,6 лет по сравнению с 3,1 годамив листе ожидания. Тем не менее, существуют существенные ограничения, которые ограничивают широкое применение трансплантации печени и, самое главное, отсутствие подходящих, высококачественных донорских органов. Таким образом, расширение пула донорских органов потребует инновационных стратегий, позволяющих использовать аллотрансплантаты, которые в настоящее время считаются неподходящими, увеличивая запас безопасности для трансплантации. Поэтому для улучшения доступа к трансплантации печени необходимо обязательно проводить доклинические исследования на мелких животных.
Особенно важное значение для трансплантологических исследований имеют модели трансплантации in vivo. Ортотопическая трансплантация печени у мышей существует уже почти 30лет2 и имеет жизненно важное значение для изучения многих аспектов трансплантации, включая характеристику иммунных реакций, ишемически-реперфузионного повреждения, острого отторжения, терапевтических эффектов новых агентов и долгосрочной выживаемости 3,4,5,6,7. Использование мышей для изучения трансплантации имеет жизненно важное значение, поскольку оно позволяет использовать трансгенные линии мышей для изучения влияния специфических молекулярных путей на результаты трансплантации. Установленные протоколы трансплантации печени мышей были хорошо описаны ранее 8,9.
Существует несколько методов анастомозов для над- и внутрипеченочной нижней полой вены (IVC), воротной вены (PV) и общего желчного протока (CBD). Как правило, они полагаются либо на анастомоз кисти, либо на модифицированную технику сосудистых манжет, аналогичную трансплантации легких мышей 10,11,12. Важным шагом в долгосрочном изучении и выживании мышей-реципиентов, а также в разработке устойчивой программы трансплантации печени мышей является возможность оценить эти критические анастомозы. Методы визуализации для оценки проходимости аллотрансплантата печени часто основываются на ультразвуковом исследовании и компьютерной томографии (КТ) в клинических условиях13,14. КТ имеет явное преимущество перед УЗИ, так как она может обеспечить обзор всей брюшной полости, включая каждый анастомоз, хотя получение этих изображений с помощью УЗИ может быть особенно сложным для мелких животных. Значительные исследования и ресурсы были посвящены разработке точной микроКТ с целью улучшения исследований на животных и информации, которую мы можем получить из этих моделей травм и болезней15,16. Здесь мы опишем протокол ортотопической трансплантации печени мыши (рис. 1) и кратко опишем протокол микроКТ для оценки проходимости аллотрансплантата и стойкости анастомозов.
Protocol
Самцы мышей C57BL/6J (масса тела 30 г) содержались в условиях, свободных от патогенов, в Национальном детском госпитале для животных. Все процедуры были проведены гуманно в соответствии с NIH и Руководством Национального исследовательского совета по гуманному уходу и использованию лабораторных животных и с одобрения Комитета по уходу за животными и использованию в учреждениях Национальной детской больницы (протокол IACUC AR17-00045). См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, инструментам и оборудованию, используемым в этом протоколе.
1. Первоначальная подготовка к операции по трансплантации
- Настройте хирургические устройства.
- Установите устройства для хирургического мониторинга (например, устройство для мониторинга сердечного ритма, пульс-окс, модульную систему мониторинга) и наркозные аппараты.
- Если возможно, включите операционную нагревательную доску до 42 °C.
- Убедитесь, что вентиляционные и наркозные аппараты включены для нагрева испарителя изофлурана. Наполните резервуар для анестезии 30 мл жидкого изофлурана и убедитесь, что аппарат искусственной вентиляции легких подключен к кислороду.
ПРИМЕЧАНИЕ: В этом протоколе мы не интубируем животное; Используйте только носовой обтекатель для насыщения кислородом.
- Запишите массу тела мышей-реципиентов и мышей-доноров.
- Включите мощный хирургический микроскоп и отрегулируйте высоту и фокус в соответствии с предпочтениями хирурга. Убедитесь, что остальные хирургические устройства включены (например, устройство для электрокоагуляции).
- Подготовьте и разложите хирургические инструменты, а также хирургические стяжки из нейлона 10-0 (рисунок 2).
ПРИМЕЧАНИЕ: Все хирургические инструменты были автоклавированы при 121 °C в течение 30 минут. Кроме того, различные конфигурации хирургических инструментов могут быть одинаково эффективными. - Подготовьте манжеты для стентов воротной вены (PV) и общего желчного протока (CBD) (рисунок 3). Поместите ангиокатетер, а также PE10 на стерильную поверхность под мощным микроскопом. Используя хирургическое лезвие #11, разрежьте ангиокатетер так, чтобы образовалась манжета длиной 1,5 мм с выступом примерно 0,75 мм в верхней части тела манжеты; Отрежьте полиэтиленовую трубку (PE10) до длины 2,5 мм. Храните манжеты и стент в стерильном физиологическом растворе до тех пор, пока они не будут готовы к использованию.
ПРИМЕЧАНИЕ: В этой модели трансплантации используется ангиокатетер 20 G для изготовления манжет для реконструкции ФВ, а также полиэтиленовая трубка 10 (PE10) для реконструкции КБД. Все остальные анастомозы пришиваются вручную. - Приготовьте растворы. Приготовьте инъекцию гепарина, которая будет вводиться при 100 ЕД в 0,5 мл раствора гистидин-триптофан-кетоглутарата (ГТК). Храните физиологический раствор, гепарин-солевой раствор, ПБС и консервирующий раствор HTK на льду.
2. Закупка донорских мышей
- Индуцируйте анестезию у мыши-донора, поместив ее в ингаляционную камеру с изофлураном. Убедитесь, что концентрация изофлурана составляет примерно 2,5% при потоке кислорода 2 мл/мин. Подождите 5 минут, пока не разовьется хирургическая плоскость анестезии. Чтобы обеспечить надлежащий уровень анестезии, зажмите мышь пальцем ноги, чтобы вызвать реакцию; Отсутствие реакции свидетельствует о том, что был соблюден надлежащий уровень анестезии.
- Побрейте живот мыши с помощью электронных машинок для стрижки и поместите мышь в положение лежа на грелке. Очистите брюшную полость повидон-йодом, затем 70% этиловым спиртом. Наносите офтальмологическую мазь под глаза мышей, чтобы предотвратить сухость.
- Поместите мышь под мощный микроскоп и держите мышь под наркозом, используя ингаляцию изофлурана 2% концентрации с потоком кислорода 2 мл/мин.
- Выполните срединную лапаротомию ножницами (предпочтительно хирургу) от мечевидного отростка до лобкового симфиза. Затем выполните дополнительный поперечный разрез для создания «крестообразного» рисунка ниже ребер. Используя гемостатические щипцы для комаров, втяните мечевидный отросток, чтобы добиться адекватного обнажения содержимого брюшной полости.
ПРИМЕЧАНИЕ: Щипцы могут быть закреплены в зависимости от предпочтений хирурга. - Выпотрошите кишечник и поместите его с левой стороны брюшной полости во влажную марлевую губку. Мобилизуйте печень, удалив все связочные прикрепления.
- Обнажите соответствующую печеночную артерию (рГА). Скелетизируйте сосуд с помощью изогнутых щипцов и наложите на него нейлоновый шов 10-0.
- Рассеките КБД по всей длине, используя комбинацию острого и тупого рассечения. Выполните дуктотомию (достаточно большую для стента CBD) как можно ближе к верхней границе поджелудочной железы, чтобы обеспечить достаточную длину для будущего использования (~1 см от нижней границы печени). Вставьте стент желчного протока в CBD тонкими щипцами и закрепите его нейлоновым швом 10-0. Лигируйте дистальную часть КБД с помощью нейлонового шовного материала 10-0 (Рисунок 4).
- Втяните правую долю печени по направлению к мечевидному отростку с помощью влажной марлевой губки и обнажите НПВ. Мобилизуйте подпеченочный НПВ (IHIVC) подальше от забрюшинного пространства и прижгите правую надпочечниковую вену с помощью ручного устройства для прижигания (см. таблицу материалов).
- Рассекают правую почечную артерию и вену и перевязывают нейлоном 7-0 и 10-0 соответственно. Перерезать правую почечную вену и артерию, а также оставшиеся прикрепления связок. Наконец, удалите правую почку.
ПРИМЕЧАНИЕ: Это сделано для того, чтобы иметь лучшую экспозицию при окончательном разрезании IHIVC. - Ввести 0,5 мл холодного HTK с раствором гепарина 100 ЕД через ПВ иглой 30 G. Подождите 1 минуту, пока гепарин не распределится систематически. Перерезают воротную вену чуть выше селезеночной вены и верхнебрыжеечную вену.
- Медленно вводят холодный консервирующий раствор HTK с гепарином в IHIVC иглой 30 G для перфузии донорской печени. Прекратите впрыскивание раствора, как только жидкость, поступающая из PV, станет прозрачной. После того, как инъекция будет завершена, наложите микрозажим на IHIVC чуть выше правой почечной вены и разрежьте чуть ниже зажима. Как только этот шаг будет завершен, выключите аппарат искусственной вентиляции легких и прекратите прием изофлурана, так как животное только что было подвергнуто эвтаназии.
- Разрежьте КБД дистально по отношению к стенту, который ранее был установлен на шаге 2.7. Кроме того, определите пузырный проток и перевяжите его нейлоновым швом 10-0. Затем обхватите купол желчного пузыря щипцами и рассеките его из ямки желчного пузыря, используя комбинацию острого и тупого рассечения. После того, как желчный пузырь будет адекватно мобилизован, с помощью пружинных ножниц завершите холецистэктомию, перерезав пузырный проток над ранее наложенным швом.
- Втяните печень вниз, чтобы обнажить надпеченочный НПВ (SHIVC). Разрежьте SHIVC, уделяя особое внимание тому, чтобы обеспечить достаточную длину для анастомоза у животного-реципиента.
- Рассекают свободные дополнительные связочные прикрепления к печени и доставляют донорскую печень ex-vivo и помещают орган в контейнер с холодным физиологическим раствором.
3. Заготовка аллотрансплантата печени
- Поместите лед в изолированный контейнер и поставьте чашку Петри на подушку со льдом. Наполните чашку Петри холодным физиологическим раствором. Поместите аллотрансплантат печени в чашку так, чтобы обнажилась висцеральная поверхность.
- Поместите ПВ через ранее выбранную манжету и выверните вену так, чтобы обнажилась внутренняя эндотелиальная поверхность. Закрепите манжету нейлоновым швом 10-0. Убедитесь, что шов находится в бороздках манжеты для достижения наилучших результатов (Рисунок 5).
- Отрегулируйте аллотрансплантат печени, чтобы обнажить SHIVC и разместить два 8-0 Нейлоновые швы в положении 3' и 9 часов соответственно для возможного анастомоза у животного-реципиента. Отрегулируйте аллотрансплантат печени еще раз, чтобы обнажить IHIVC, и поместите два 8-0 Нейлоновые швы в положении 3' и 9 часов соответственно для возможного анастомоза у животного-реципиента.
4. Операция получателя
ПРИМЕЧАНИЕ: Поскольку это стерильная операция, используйте перчатки и надлежащие средства индивидуальной защиты и вводите антибиотики. Вводят 0,1 мг/кг бупренорфина подкожно в качестве предоперационной анальгезии во время операции.
- Экспонировать рГК, как при донорской операции; Используйте только срединную лапаротомию вместо ранее описанного разреза брюшной полости.
- Мобилизуйте печень и перережьте все связочные прикрепления. Дополнительно перевязать левый диафрагмальный и параэзофагеальный сосуды нейлоновым швом 10-0.
- Втягивают печень снизу и рассекают свободный SHIVC из забрюшинного пространства. Затем втягивают печень сверху и рассекают свободный IHIVC из забрюшинного пространства. При необходимости прижигайте мелкие мостиковые вены и поясничные вены, используя ту же технику, что и выше.
- Прижгите правую надпочечниковую вену ручным прижиганием и обнажите печеночную рубчик. Лигируйте pHA нейлоновым шовным материалом 10-0. Затем рассеките КБД свободным от ФВ и перевязайте КБД швом 7-0 близко к бифуркации КБД, чтобы обеспечить достаточную длину для анастомоза КБД.
- Используйте микрозажим для пережатия внутрипеченочного НВК и временно перевязайте ВП швом 7-0. Начните печеночную фазу. Прекратите ингаляцию изофлурана.
ПРИМЕЧАНИЕ: После пережатия воротной вены и НПВ печеночный венозный возврат полностью блокируется в стадии печени. Ингаляционный анестетик изофлуран метаболизируется печенью; Таким образом, его вдыхание на мгновение прекращается, так как накопление может привести к сердечно-легочному коллапсу. - Через нативный ПВ печени ввести 0,5 мл гепарин-физраствора иглой 30 г для промывания органа.
- Наложите микрососудистые зажимы на SHIVC и IHIVC как можно ближе и дистальнее, чтобы оставить достаточную длину для анастомоза. Разрежьте нативный SHIVC, IHIVC, PV (близко к ранее наложенному шву) и любые оставшиеся связочные прикрепления к родной печени реципиента и доставьте нативную печень ex vivo.
ПРИМЕЧАНИЕ: Зажим IHIVC должен быть выше правой почечной вены. - Поместите донорский аллотрансплантат печени внутрь брюшной полости и втяните подвздошную кость донорского аллотрансплантата, чтобы обнажить ВП. Промойте донорскую и нативную ПВ 0,5 мл гепаринового физиологического раствора с помощью иглы 30 г, чтобы обесвоздухить сосуды, чтобы избежать воздушной эмболии. Затем вводят ранее изготовленную манжету донорского ВП в просвет печени реципиента ВП и при необходимости накладывают швы, чтобы облегчить анастомоз (шов 8-0). Закрепите анастомоз швом 7-0 (Рисунок 6).
- Поверните доску на 180°. Выполнить ручной анастомоз нейлоновым швом 10-0 с донором и нативным SHIVC. После завершения анастомоза задней стенки промыть 0,5 мл гепаринового раствора для опорожнения воздуха, чтобы избежать воздушной эмболии. Полный анастомоз верхней стенки (рис. 7).
- Сначала снимите лигирующий шов ПВ; затем снимите сосудистые зажимы с SHIVC, чтобы начать реперфузию. Завершите печеночную фазу и возобновите ингаляцию изофлурана. Выполнить ручной анастомоз нейлоновым швом 10-0 таким же образом, как и для анастомоза SHIVC, для реконструкции IHIVC. После завершения реконструкции снимают микрозажим с нативного и донорского IHIVC для реперфузии (рис. 8).
- Выполните анастомоз CBD, создав дуктотомию на реципиенте CBD рядом с ранее наложенным швом. Вставьте стент в просвет КБД донора в просвет КБД реципиента и закрепите анастомоз швом 10-0 (Рисунок 9).
- Орошать брюшную полость 1 мл физиологического раствора; Проверьте гемостаз и прижгите оставшиеся кровоточащие сосуды. Закрыть разрез брюшной полости в два слоя, наложив шов 6-0.
- Поместите животное в теплый инкубатор (42 °C) для восстановления и не оставляйте животное без присмотра до тех пор, пока оно не придет в сознание и не станет достаточно активным. Вводите 0,1 мг/кг бупренорфина подкожно после операции и продолжайте введение каждые 8-12 часов в течение 48 часов после операции. Кроме того, вводите карпрофен (0,2 мл, растворенный в 400 мл воды) через бутылку с водой животного-реципиента в течение 7 дней после операции. Понаблюдайте за животным-реципиентом в течение 4-5 часов, а когда оно полностью выздоровеет, верните его в место содержания, так как теперь находиться с другими животными безопасно.
ПРИМЕЧАНИЕ: Обезболивающие препараты и антибиотики могут назначаться в соответствии с рекомендациями местного комитета по этике животных.
5. МикроКТ-ангиография мыши
- После наблюдения за мышью в течение заданного интервала исследования подготовьте мышь к оценке проходимости аллотрансплантата с помощью микроКТ-ангиографии.
- Убедитесь, что аппараты вентиляции и анестезии включены для нагрева испарителя изофлурана. Наполните резервуар для анестезии 30 мл жидкого изофлурана и убедитесь, что аппарат искусственной вентиляции легких подключен к кислороду. Включите микрокомпьютерный томограф и убедитесь, что все программное обеспечение работает правильно.
- Запустите программное обеспечение для сбора данных на системе микрокомпьютерного томографа.
- На мониторе аппарата микроКТ нажмите «Инициализировать систему » и выберите режим компьютерной томографии.
- Выдвиньте кровать; Прикрепите лежанку для мыши и зафиксируйте ее.
- Включите нагревательную доску до 42 °C для клетки для восстановления.
- Наполните шприц объемом 1 мл 100 мкл контрастного вещества для КТ. Прикрепите иглу 30-го калибра для дальнейшего внутривенного введения контрастного вещества. Следите за тем, чтобы в шприце не было пузырьков воздуха.
- Поместите мышь в систему удержания хвостовой вены. Как только мышь полностью окажется внутри удерживающей системы, закройте затвор системы, позвольте хвосту опуститься вертикально и тщательно протрите его спиртовым раствором (70% этанол).
ПРИМЕЧАНИЕ: Успех канюляции хвостовой вены можно увеличить, согрев хвост животного, подержав его в руке в перчатке в течение нескольких минут. - Возьмитесь за хвост по направлению к дистальному отделу и поместите два пальца (указательный и средний) вокруг хвоста проксимальнее планируемого места инъекции. Поместите дистальную часть хвоста (ниже места инъекции) между большим и безымянным пальцами.
- Обеими парами пальцев слегка надавите и введите иглу в вену на небольшую глубину, следя за тем, чтобы шприц и игла были параллельны хвосту. Ослабляя давление указательного пальца на проксимальном отделе хвоста, внутривенно вводят контрастное вещество для КТ. Избегайте аспирации с помощью шприца, так как это может привести к коллапсу вены.
ПРИМЕЧАНИЕ: Во время инъекции не должно ощущаться никакого сопротивления, если игла правильно расположена в вене. Если есть сопротивление, извлеките иглу и снова вставьте ее над первоначальным местом инъекции. Если канюляция вены не удалась даже после двух попыток, замените иглу. - После успешного введения контрастного вещества и извлечения иглы приложите легкий компресс к месту инъекции с помощью стерильной марли, чтобы остановить кровотечение.
- Перенесите мышь в ингаляционную камеру изофлурана и установите концентрацию 2,5% при потоке кислорода 2 мл/мин и подождите 3-4 мин. После того, как плоскость анестезии установлена, быстро перенесите мышь на станину микрокомпьютерного томографа и положите ее в положении лежа на столе сканера (рис. 10).
- Закройте глаза животного необходимым количеством офтальмологической мази. Наденьте носовой обтекатель на животное надлежащим образом и убедитесь, что воздух и изофлуран правильно проходят через носовой конус. Используйте те же параметры анестезии, которые были описаны ранее (шаг 5.12). Смажьте и вставьте ректальный датчик температуры для непрерывного мониторинга температуры тела животного во время визуализации.
- Поместите респиратор в контакт с мышью.
- С помощью ленты прикрепите прокладку для ЭКГ к левой, правой передней и левой задним конечностям. Используйте гель для ультразвука, чтобы улучшить сигнал между прокладкой ЭКГ и кожей.
- Проверьте ЭКГ и дыхательный сигнал в компьютерном программном обеспечении, чтобы убедиться, что на мониторе отображаются правильные комплексы QRS. Для этого установите флажок «Логический вывод » на вкладке «Настройка источника » и выберите провод с наиболее четкой кривой ЭКГ.
ПРИМЕЧАНИЕ: Логические провода соответствуют трем прокладкам ЭКГ, которые подключены к правой, левой грудной клетке и голени. Каждый отведение представляет собой кривую ЭКГ. - Установите усиление для правильной высоты сигнала, обычно 4 или 8 хорошо. Выберите двойное стробирование. На вкладке «Настройка дисплея» настройте параметры дисплея для четкого отображения сигнала: установите флажки рядом с пунктами «ЭКГ» и «RESP» и установите для каждого значение 500. На вкладке «Настройка триггера» убедитесь, что установлены флажки «Канал A», «Канал B» и «DualTrig».
- Убедитесь, что также установлены следующие параметры: Порог: когда сигнал падает ниже этого значения; установите значение 2,500; Гистерезис: убедитесь, что сигнал пересекает гистерезис, чтобы создать программную триггерную точку, в которой начинается новый цикл запуска; установите значение 300; Delay: подождать перед отправкой триггера; установите значение 100; Inhibit: в течение этого периода не может быть сгенерирован сигнал, установите значение 200.
- Следите за тем, чтобы порог для ЭКГ был ниже значения гистерезиса и выше пика сегмента sT на экране дисплея.
- Переместите животное в сканер и нажмите Обновить изображение. Сделайте рентгеновский снимок животного, чтобы выбрать подходящее поле зрения и анатомическое покрытие для последующего микроКТ-изображения.
- Выполняйте получение изображений микроКТ-ангиографии со следующими параметрами: Увеличение: Ультрафокус, Угол сканирования: Полное (360) сканирование, Энергия: Одиночное, Режим сканирования: Стробированный, Настройка: По умолчанию (полное вращение на 360°, настройки рентгеновской трубки по умолчанию 0,33 мА и 55 кВ, 0,750° градуса на шаг, 1 проекция на шаг, 1 x 1 биннинг и время экспозиции 40 мс; двойное стробирование означает стробирование сердца и дыхания) (Рисунок 11).
- После завершения сканирования переведите животное в предварительно разогретую клетку для восстановления. Как только животное полностью выздоровеет, переведите его обратно в основную клетку.
- Реконструировать микроКТ-снимки с помощью системного программного обеспечения. После загрузки изображения установите синие полосы так, чтобы оно охватывало анатомическую область интереса; Предварительный просмотр фрагмента, чтобы уменьшить объем и максимально ограничить его мышью (этот этап помогает уменьшить размер восстановленного изображения).
- Включите контур интересующего объема, чтобы оптимизировать границу изображения. Выберите размер вокселя 40 мкм, проекционный фильтр Ханна и объемный фильтр Гаусса (80 мкм). Перейти в раздел «Дополнительно» | Стробирование на основе изображения и настройка окон запуска и фазы на 0,5 и 0,6 соответственно, выберите 10 фаз для стробирования сердца, а затем нажмите кнопку восстановления объема .
Representative Results
Для тех исследователей, которые не являются хирургами, не знакомы с анатомией или не чувствуют себя комфортно при интерпретации результатов рентгенологических исследований, надлежащий анализ изображений должен выполняться персоналом, прошедшим соответствующую подготовку. Успех OLT на мыши демонстрируется в приведенном выше протоколе. Кроме того, для улучшения показателей исследования и обеспечения обратной связи в режиме реального времени для успешного проведения трансплантации, а также устранения необходимости вскрытия, можно использовать микроКТ-ангиографию для получения точных и четких изображений. В данную рукопись включены репрезентативные изображения (рис. 11). Репрезентативные изображения неудачного анастомоза in vivo можно увидеть на рисунке 12.
Те, кто знаком с анатомией печени и сосудистой сетью, могут увидеть открытые венозные анастомозы НПВ. В некоторых случаях может быть визуализирована и воротная вена, что легко делается в этой модели благодаря манжете воротной вены. Просмотр открытых анастомозов свидетельствует о техническом успехе операции. Кроме того, 3D-реконструкция этих изображений может предоставить исследователям дополнительную информацию и более детальное изображение анатомии сосудов. Используя эту модель, смертность в когорте мышей OLT составляет ~40-45%.

Рисунок 1: Обзор ортотопической трансплантации печени. (А) Графический рисунок, изображающий четыре различных анастомоза: i) надпеченочной IVC анастомоз, ii) инфрапеченочный IVC анастомоз, iii) анастомоз воротной вены, iv) анастомоз общего желчного протока. Каждая стрелка указывает относительное расположение, где сосуд или проток должен быть разрезан надпеченочным НПВ (шаг протокола 2.13), внутрипеченочный НПВ (шаг протокола 2.11), воротную вену (шаг протокола 2.10) и общий желчный проток (шаг протокола 2.7). (Б) Диаграмма анастомозов in vivo . Масштабная линейка = 2 мм. Аббревиатура: IVC = нижняя полая вена. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
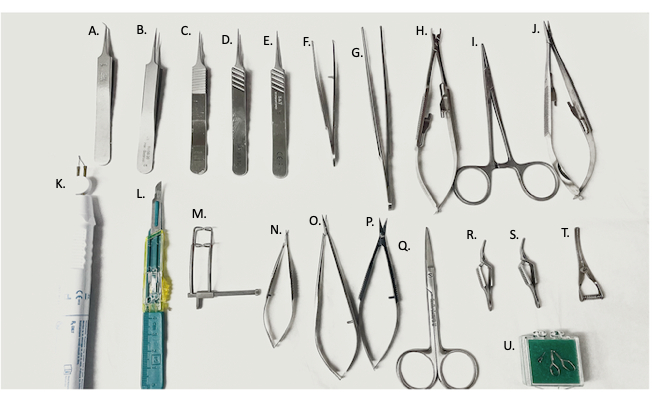
Рисунок 2: Хирургические инструменты, используемые в хирургии. (A) тонкие щипцы под углом 45°, (B-E) тонкие щипцы, (F) изогнутый иглодержатель/щипцы, (G) прямые щипцы, (H) аппликатор сосудистых зажимов, (I) гемостат, (J) иглодержатель, (K) устройство для электроприжигания, (L) лезвие #11, (M) брюшной ретрактор, (N,O) микроножницы, (P) тонкие ножницы, (Q) хирургические ножницы, (R,S) зажимы Яшаргила, (T) зажим для бульдожьих вен, (U) микрососудистый зажим. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Манжета воротной вены и стент желчного протока. Изображение стентов и манжет ex vivo перед использованием. Масштабная линейка = 3,5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
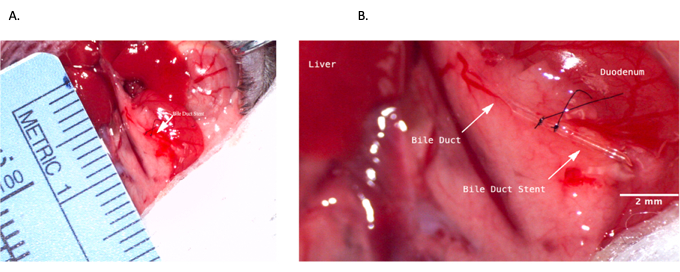
Рисунок 4: Стентирование общего желчного протока во время донорской операции. (A) Стент желчного протока вставляется в общий желчный проток. (B) Стент желчного протока, закрепленный внутри желчного протока. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
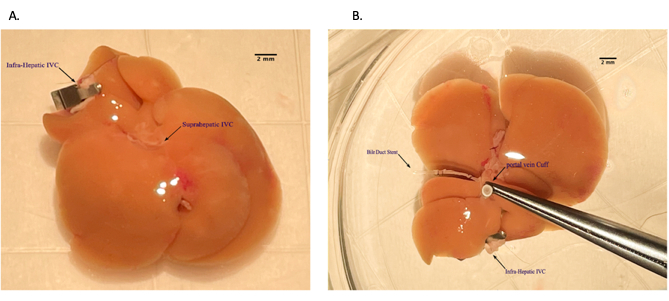
Рисунок 5: Установка манжеты воротной вены во время подготовки аллотрансплантата печени на заднем столе. (А) Продевание воротной вены через венозную манжету. (Б) Вывернутая вена над манжетой. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
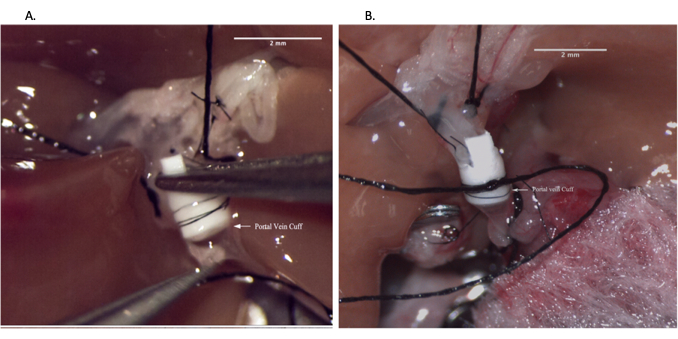
Рисунок 6: Анастомоз воротной вены во время операции реципиента. (А) Введение венозной манжеты в воротную вену реципиента. (B) Анастомоз воротной вены закреплен швом. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
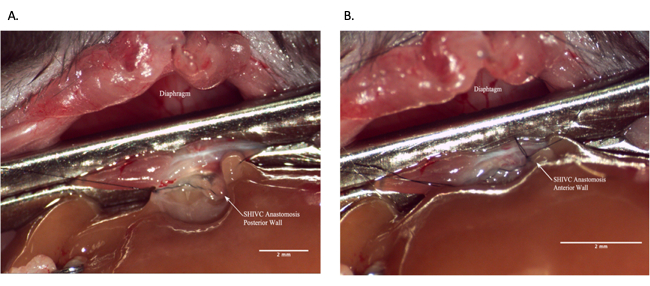
Рисунок 7: Надпеченочной анастомоз IVC во время операции реципиента. (А) Задняя стенка анастомоза завершена. (B) Завершенный анастомоз SHIVC. Масштабная линейка = 2 мм. Сокращения: IVC = нижняя полая вена; SHIVC = надпеченочный IVC. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
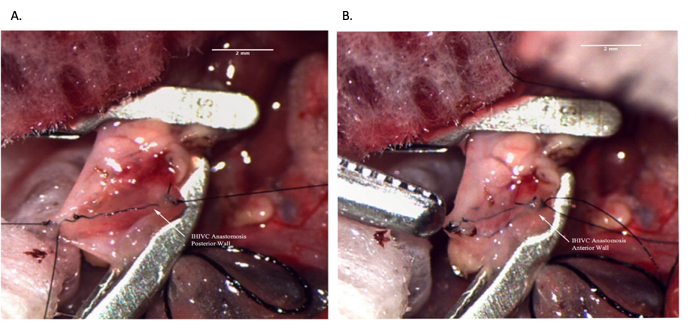
Рисунок 8: Инфрапеченочный НПВ анастомоз во время операции реципиента. (А) Задняя стенка анастомоза завершена. (B) Завершенный анастомоз IHIVC. Масштабная линейка = 2 мм. Сокращения: IVC = нижняя полая вена; IHIVC = подпеченочной IVC. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
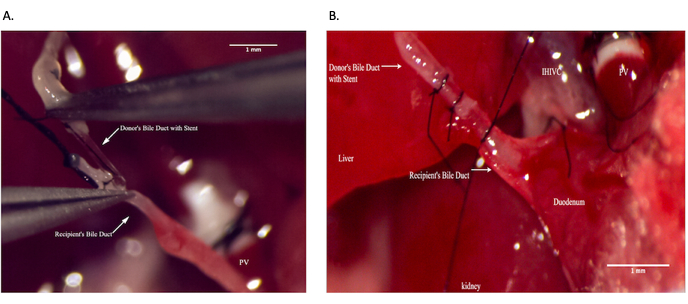
Рисунок 9: Анастомоз общего желчного протока во время операции реципиента. (A) Установка стента желчного протока в общий желчный проток реципиента. (Б) Обеспечение анастомоза желчных протоков. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10: Подготовка животных к микроКТ-ангиографии мышей. (A) Инъекция в хвостовую вену мыши для введения контраста. (B) Мышь пропускается через аппарат микрокомпьютерной томографии. Аббревиатура: микроКТ = микрокомпьютерная томография. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
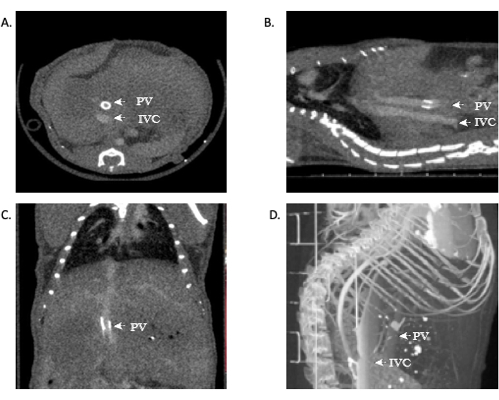
Рисунок 11: Репрезентативные изображения, показывающие микроКТ-ангиографию проходимости аллотрансплантатов. (А,Б) Контраст можно увидеть по всей НПВ, демонстрируя проходимость надпеченочного и подпеченочного анастомозов. (В) Контраст в воротной вене, снова демонстрирующий проходимость. (D) 3D-реконструкция сосудистой системы. Сокращения: микроКТ = микрокомпьютерная томография; IVC = нижняя полая вена; PV = воротная вена. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
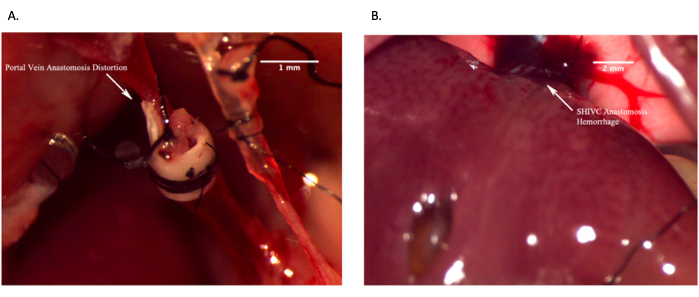
Рисунок 12: Репрезентативные изображения, показывающие неудачные анастомозы in vivo . (A) Неудачный анастомоз воротной вены из-за деформации вены, приводящей к отсутствию кровотока. (B) Неудачный надпеченочный анастомоз IVC из-за чрезмерного кровотечения. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
ОЛТ у грызунов хорошо описан в литературе 2,8. Для выполнения этой технически сложной процедуры часто требуется несколько лет микрохирургии (или операции в целом), поскольку это требует глубокого понимания анатомии и технических способностей. При разработке этой модели мы столкнулись с несколькими техническими проблемами, связанными с анастомозами. В частности, при ВП-анастомозе часто бывает трудно стабилизировать вену для анастомоза. Мы обнаружили, что наложение одного или двух швов (предпочтение хирурга) помогает облегчить установку манжеты. Следует отметить, что наложение большего количества швов увеличивает время операции.
Кроме того, SHIVC находится глубоко в брюшной полости, и на него трудно наложить зажим, чтобы обеспечить адекватное воздействие. Мы обнаружили, что если мышь максимально расслаблена в своей сдержанности, это добавит гибкости вене. В конечном счете, хирург должен определить правильное размещение с практикой. Кроме того, при анастомозе CBD проток снова очень нежный. Может быть трудно наложить швы для стабилизации протока, и, возможно, размещение его на небольшом кусочке марли поможет в его стабилизации. Наконец, поскольку все мелкие млекопитающие обладают уникальной деликатностью в отношении времени анестезии, важно провести операцию как можно быстрее. Идеальное время операции: 1) донорская операция, 45-60 мин; 2) подготовка заднего стола, 15 мин; 3) операция реципиента, 60-80 мин. Практика поможет уменьшить количество ненужных движений.
По мере совершенствования моделей на животных возможности оценки успешности исследовательских вмешательств также расширяются. Впервые микроКТ была использована для проведения исследований сосудистой сети крыс в конце 1990-х годов. Выполнение точных и четких микроКТ-ангиографических исследований у грызунов сопряжено со многими трудностями. Однако большинство проблем возникает из-за коротких сердечных и дыхательных циклов этих млекопитающих. Это решается за счет использования коротких экспозиций для ограничения артефактов движения, а также за счет более высоких скоростей флюенса фотонов18. В целом, мы обнаружили, что использование стробирования сердца, а также корректировка концентрации изофлурана для снижения частоты дыхания дают наиболее четкие изображения. Мы также обнаружили, что использование специфичного для грызунов времени контрастирования для определенных фаз: фазы печеночной артерии, фазы воротной вены и фазы задержки также улучшило визуализацию19. Использование контрастности ExiTron nano 12000 имеет ряд преимуществ и может улучшить общее качество изображения. Он обеспечивает самое сильное контрастное усиление в печени20 и крови21. Еще одним преимуществом является то, что контрастное вещество присутствует в печени в течение 120 часов после первоначальной инъекции, что может снизить связанную с этим токсичность для печени, поскольку требуется меньше контраста,если требуется повторное сканирование.
Кроме того, поскольку сканирование проводится с мышью, получающей седативные препараты изофлураном, контрастное усиление не изменяется при этом изменении физиологии20. Используя эти методы визуализации и контраст ExiTron, можно получить четкую оценку успешных анастомозов при ОЛТ. МикроКТ позволяет проводить неинвазивную оценку аллотрансплантатов in vivo в течение длительного периода времени. Этот протокол уменьшает количество животных, которые должны быть принесены в жертву для оценки сосудистых анастомозов, и дает возможность изучать терапевтические препараты в течение нескольких недель и их влияние на сосудистую сеть.
Ограничения
Следует отметить, что, несмотря на многочисленные пересмотры модели OLT для совершенствования ее методики, визуализация анастомозов с помощью микроКТ все еще продолжается. Кроме того, OLT на мышах дает уникальную возможность взглянуть на трансплантологию. Тем не менее, это не всеобъемлющая модель, так как трудно сохранить жизнь этим мышам дольше 1 недели. Дополнительные модели трансплантации также должны быть использованы для дальнейшего обоснования доклинических экспериментов.
Выводы
За последнее десятилетие прогресс в области микроКТ быстро ускорился, предоставив исследователям бесценные новые инструменты в области моделей животных и трансплантации. В будущем более детальная 3D-визуализация позволит получить более глубокое представление об исследованиях и открытиях.
Disclosures
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Acknowledgements
SMB поддерживается грантом Национального института диабета и заболеваний пищеварительной системы и почек (NIDDK) R01DK1234750. BAW поддерживается грантом Национального института здравоохранения, Национального института сердца, легких и крови R01HL143000.
Materials
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
References
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved