Использование вертикально выровненных массивов углеродных нановолокон на жестких или гибких подложках для доставки биомолекул и красителей растениям
In This Article
Summary
В этой статье мы опишем методы микропроизводства вертикально выровненных углеродных нановолокон (VACNF), переноса VACNF на гибкие подложки и нанесения VACNF как на жесткие, так и на гибкие подложки для растений для доставки биомолекул и красителей.
Abstract
Доставка биомолекул и непроницаемых красителей к неповрежденным растениям является серьезной проблемой. Наноматериалы — это перспективные инструменты для доставки ДНК растениям. Какими бы захватывающими ни были эти новые инструменты, они еще не нашли широкого применения. Наноматериалы, изготовленные на жесткой подложке (подложке), особенно трудно успешно применять к изогнутым структурам растений. В данном исследовании описывается процесс микроизготовления вертикально выровненных массивов углеродных нановолокон и их переноса с жесткой на гибкую подложку. Мы подробно описываем и демонстрируем, как эти волокна (как на жестких, так и на гибких подложках) могут быть использованы для переходного превращения или доставки красителя (например, флуоресцеина) к растениям. Мы показываем, как VACNF могут быть перенесены с жесткой кремниевой подложки на гибкую эпоксидную подложку SU-8 для формирования гибких массивов VACNF. Для преодоления гидрофобной природы СУ-8 волокна в гибкой пленке покрывали тонким слоем оксида кремния (2-3 нм). Чтобы использовать эти волокна для доставки к изогнутым органам растений, мы наносим 1 мкл капли красителя или раствора ДНК на волокнистую сторону пленок VACNF, ждем 10 минут, помещаем пленки на орган растения и используем тампон с вращательным движением, чтобы ввести волокна в растительные клетки. С помощью этого метода мы добились доставки красителя и ДНК в органы растений с изогнутой поверхностью.
Introduction
Трансформация растений (как переходная, так и стабильная) еще не стала широко достижимой для всех растительных тканей и видов. Переходная трансформация растений — это процесс, при котором гены, закодированные в плазмидах, временно внедряются в растения, но не встраиваются стабильно в геном. Традиционные методы, использующие бомбардировку частицами, агробактерии, электропорацию или полиэтиленгликолевую обработку протопластов, медленны или могут быть громоздкими. Кроме того, они применимы не ко всем видам растений 1,2,3,4. Использование наноматериалов для доставки ДНК является бурно развивающейся областью, которая все еще находитсяв зачаточном состоянии. Наноматериалы, в частности углеродные нановолокна, также успешно используются для доставки белков, декстран и красителей к листьям растений, не вызываяреакции на рану. Целью данной работы является предоставление подробного протокола использования одного типа наноматериала – углеродных нановолокон – для доставки биомолекул или красителей к растениям. Здесь мы сосредоточимся на ДНК как на биомолекуле выбора, которая обеспечивает переходную трансформацию клеток в различных органах растений.
Ранее Morgan et al.7 продемонстрировали использование углеродных нановолокон, прикрепленных к жесткой кремниевой подложке, для переходной трансформации листьев салата, N. benthamiana и тополя, а также листьев и корней Arabidopsis. Несмотря на то, что трансформации были успешными на различных органах, волокна было труднее применять к тканям растений с изогнутой поверхностью, таким как корни или плоды. Мы пришли к выводу, что гибкая основа для нановолокон может повысить эффективность их доставки, лучше приспосабливаясь к форме органа.
В этой статье мы подробно опишем методы, используемые для изготовления и проектирования вертикально выровненных углеродных нановолокон, переноса VACNF на гибкие подложки и нанесения VACNF как на жесткие, так и на гибкие подложки растениям для доставки биомолекул и красителей. Углеродные нановолокна были получены с помощью каталитического плазменного осаждения из газовой фазы постоянного тока (dc C-PECVD) с никелевым катализатором. Положение, диаметр и высота точек никелевого катализатора контролировались с помощью комбинации электронно-лучевой литографии, процессов испарения металла и отрыва, описанных Melechko et al.8,9. Используя двухслойный электронно-лучевой резист, на подложку можно нанести более толстый никелевый катализатор, чтобы получить более длинные волокна10. Перенос волокна с жесткой подложки на гибкую основан на модификации методов, описанных в Fletcher et al.11, при этом существующие методы исключают использование слоя аморфного углерода или протекторного слоя фоторезиста. Отрыв SU-8 с переносом волокна достигается за счет использования собственных растягивающих напряжений, возникающих в результате обжига и недоэкспонирования SU-812,13,14. SU-8, сложный полимер, по своей природе гидрофобный, что затрудняет его использование для облегчения доставки ДНК. Чтобы противодействовать гидрофобной природе SU-8, мы наносим тонкий слой оксида кремния путем атомно-слоевого осаждения15 после того, как волокна встроены в SU-8. Нанесение волокон на жесткую подложку для доставки биомолекул/красителей использует силу удара пинцета, описанную в Davern et al.6, и методы на растении и на чипе, описанные в Morgan et al.7. Гибкие пленки VACNF наносятся на изогнутые поверхности растений путем предварительной полусушки капель ДНК или красителя на пленке, как при использовании метода на чипе от Morgan et al.7, а затем прокатывания пленок по изогнутым поверхностям растений с помощью небольшого аппликатора для макияжа16,17. На рисунке 1 изображены различные подходы к нанесению волокон в жестких и гибких субстратах на растения.
Protocol
1. Производство VACNF (Рисунок 2 и Рисунок 3)
- Кремниевую пластину покрыть полиметилметакрилатом (ПММА) 495 А4 резистом при 4000 об/мин и выпекать при 180 °C в течение 5 минут.
ПРИМЕЧАНИЕ: Дайте пластине остыть в течение 10 с, прежде чем переходить к следующему этапу. - Нанесите второй слой резиста (PMMA 950 A2) и выпекайте при температуре 180 °C в течение 5 минут.
- Используйте электронно-лучевую литографию для определения точек катализатора диаметром 300 нм при заданном боковом расстоянии (шаг: 10 мкм или 35 мкм) в матрицах размером 3 мм x 3 мм.
- Резист проявляют в 30-40 мл метилизобутилкетона 1:3: изопропиловый спирт (ИПК) в течение 1,5 мин с последующим промывкой ИФА и сушкойN2.
ПРИМЕЧАНИЕ: Проверьте наличие массива точек с помощью светлопольного микроскопа (20-кратный объектив). - Очистите пластину от остатков резиста с выдержкой 6 с в кислородной плазме (дескпере) в силиконовом травителе.
- С помощью электронно-лучевого испарения сначала наносится адгезионный слой металла (Ti или Cr, 10 нм), а затем второй слой, который является никелевым катализатором (130 нм или 150 нм). Во время осаждения металла из титана или никеля поддерживайте ток ниже 0,2 А при напряжении 10 кВ, давление ниже 5 x 10-6 торр, а скорость осаждения на уровне ~1 А/с для осаждения в пределах прямой видимости.
- Используйте последовательную ультразвуковую обработку в ванне, чтобы удалить металл (Ni), осажденный на нижележащем слое резиста, оставив Ni осажденным непосредственно на кремниевой пластине. Этот процесс называется отрывом.
- Для этого подготовьте 3 емкости с ацетоном и ванните в ацетоне в течение 1 мин; повторить 3 раза при комнатной температуре (RT, 20 °C) на частоте 35 кГц. Промойте изопропиловым спиртом и высушитеN2.
ПРИМЕЧАНИЕ: Никогда не позволяйте ацетону высохнуть на пластине. После последнего ультразвукового воздействия ацетона немедленно промойте изопропиловым спиртом, а затем высушите газомN2 . Если в какой-то момент пластина преждевременно высохнет (до промывки IPA), есть вероятность, что не весь лишний металл и резист будут удалены, и ацетон может оставить осадок.
- Для этого подготовьте 3 емкости с ацетоном и ванните в ацетоне в течение 1 мин; повторить 3 раза при комнатной температуре (RT, 20 °C) на частоте 35 кГц. Промойте изопропиловым спиртом и высушитеN2.
- Проверьте геометрию формы катализатора с помощью сканирующей электронной микроскопии (СЭМ). Для получения СЭМ-изображений микросхем VACNF наклоните столик под углом 30° и используйте напряжение 1-3 кВ, с током луча ~100 пА и рабочим расстоянием ~5 мм.
ПРИМЕЧАНИЕ: Катализатор должен выглядеть как хоккейная шайба (компактный цилиндр) (рисунок 4). Высота компактного цилиндра должна отражать толщину Ni, осажденного на кремниевой пластине. Если профиль Ni-точки высокий и кажется вогнутым в верхней части, напоминая вулкан (рис. 4), то катализатор, скорее всего, будет размачиваться на несколько капель Ni, что приведет к разветвлению углеродных нановолокон9 (рис. 4 и рис. 5). Такие проблемы могут возникнуть из-за плавления резиста во время испарения металла из-за длительного времени осаждения или проблем с процедурой отрыва (Рисунок 4 и Рисунок 5). - Разрежьте кремниевую пластину на четвертинки и поместите ее в камеру химического осаждения из газовой фазы постоянного тока (dc-PECVD) со смесью ацетилена и аммиака. Оптимизация параметров роста для контроля длины и конусности нановолокон (наконечники <200 нм).
- Используйте ток 1-1,5 А и диапазон напряжения 440-560 В. При выращивании волокон используйте фазу предварительной обработки с подачей аммиака, в то время как машина и субстрат нагреваются до 620 °C. Убедитесь, что источник углерода (ацетилен) включен за 10 секунд до запуска плазмы.
ПРИМЕЧАНИЕ: Четвертные пластины используются в случае, если необходимо оптимизировать параметры работы машины PECVD. Для получения волокон длиной более 40 мкм и диаметром наконечников менее 200 нм предлагаются следующие параметры: при толщине никелевого катализатора 130 нм используют ток 1,75 А, время роста 70 мин и соотношение ацетилен:аммиак 45 стандартных кубических сантиметров в минуту (SCCM) : 100 SCCM. При толщине Ni 150 нм используйте ток 1,5 А, время роста 80 мин и соотношение ацетилен: аммиак 48 sccm : 100 sccm. Для выращивания VACNF независимо от толщины катализатора используются следующие параметры: температура роста 620 °C, давление 10 торр во время плазменной резки и высота душевой лейки 20 мм (рис. 6).
- Используйте ток 1-1,5 А и диапазон напряжения 440-560 В. При выращивании волокон используйте фазу предварительной обработки с подачей аммиака, в то время как машина и субстрат нагреваются до 620 °C. Убедитесь, что источник углерода (ацетилен) включен за 10 секунд до запуска плазмы.
- Оцените геометрию полученных волокон с помощью РЭМ при наклоне 30° с потенциалом ускорения 1 кВ.
ПРИМЕЧАНИЕ: Оптимальными волокнами должны быть прямые и неразветвляющиеся. Контролировать ориентацию кристаллов никелевого катализатора с помощью электронно-лучевого испарителя невозможно. В результате некоторые волокна разветвляются из-за обезвоживания катализатором9. Кроме того, ориентация кристаллов приводит к тому, что VACNF растут до разной высоты, поэтому равномерная высота на всех VACNF затруднена. - Нанесите слой фоторезиста (SPR955) на волокна при 1000 об/мин в течение 45 с. Затем нарежьте 1/4 пластины на матрицы размером 3 мм x 3 мм с помощью пилы для нарезки кубиками. Сохраните волокна в этом месте для последующего использования.
ПРИМЕЧАНИЕ: Не выполняйте шаг 1.11, если планируете перенести волокна на гибкую подложку.
2. ПереносVACNF на гибкую подложку (Рисунок 7 и Рисунок 8)
- После синтеза волокон фоторезист СУ-8 2015 наносят на пластины или четвертные пластины при частоте вращения 4000 об/мин в течение 45 с.
- Выпекайте в течение 3 минут при температуре 95 °C.
- Используя контактный выравниватель, экспонируйте пластину с помощью шаблонной маски размером 3 мм 3 мм, которая совпадает с заданным рисунком из электронно-лучевой литографии при 95 мДж/см2.
ПРИМЕЧАНИЕ: Используйте режим бесконтактного контакта с зазором экспозиции, который на 20 мкм больше, чем у самого высокого волокна. Существует вероятность того, что волокна могут быть опрокинуты на этом этапе процесса. - Выпекайте после выдержки в течение 6 минут при температуре 95 °C.
- Проявите пластину в проявителе СУ-8 в течение 15 с, промойте ее ИПА и высушите пластину N2, двигаясь сверху вниз.
ПРИМЕЧАНИЕ: При проявке пластины убедитесь, что она полностью погружена в воду. - Пластины с рисунком Spincoat с защитным слоем тонкого фоторезиста (SPR 955 CM 0,7) при 3000 об/мин в течение 45 с и мягкая выпечка в течение 30 с при 90 °C.
- Нанесите на пластину тонкий слой оксида кремния (2-3 нм), поместив его в атомно-слоевое осаждение на 22 цикла при 100 °C.
- С помощью пилы для нарезки кубиками разрежьте пластину на квадраты размером 3 мм x 3 мм. Совместите пилу для нарезки кубиками с уже существующим рисунком на пластине.
- Оцените геометрию полученных волокон с помощью РЭМ при наклоне 30° с потенциалом ускорения 3 кВ.
- Остановитесь здесь, если храните чипсы для длительного использования (>1 неделя). Храните чипсы в темноте.
- Чтобы отделить гибкие подложки от жестких, поместите отдельные стружки в ацетон на 30 минут или до тех пор, пока SU-8 не начнет скручиваться.
- Промыть пленки SU-8 (прикрепленные к жестким основаниям или отсоединенные от них) изопропиловым спиртом в течение 5 мин, а затем водой в течение 5 мин. При транспортировке поместите чипсы в коммерческую коробку с липкой прокладкой.
- ДОПОЛНИТЕЛЬНО: Поместите безволокнистую сторону пленки SU-8 на водорастворимую ленту или поверх тонкой силиконовой резины с тонкой подложкой из полиэтилентерефталата (ПЭТ) (толщиной 12,5 мкм).
- Используйте пинцет для переноса пленки SU-8. Нажмите на края квадрата SU-8, чтобы помочь ему приклеиться к ленте/силиконовой резине-ПЭТ; Это делается для того, чтобы избежать обрыва волокон. На этом этапе пленки VACNF готовы к немедленному использованию.
- Чтобы подготовить держатель для силиконовой резины/ПЭТ, сделайте следующее: используя набор из 2 частей для силиконовой резины, смешайте две части вместе (эластомер и сшиватель). Далее вырежьте квадрат из ПЭТ и заклейте его скотчем в прозрачную пластиковую посуду. Налейте очень тонкий слой силиконовой резины поверх ПЭТ и отверждайте его при 80 °C в течение 1-2 часов.
3. Внутризаводской метод (при котором капля доставляемого раствора помещается на поверхность растения) с использованием волокон в жестком субстрате (Рисунок 1А)
- Перед использованием удалите фоторезист с помощью ацетона (100%, 5 мин), IPA (100%, 5 мин) и ddH2O (5 мин).
- Положите растительную ткань, которую нужно пронзить, на твердую поверхность для опоры.
- Поместите 1 мкл капли красителя или ДНК (200 нг) на поверхность растительной ткани.
- Поместите чип VACNF с жесткой подложкой на верхнюю часть капли так, чтобы волокна были ориентированы таким образом, чтобы они соприкасались с каплей.
ПРИМЕЧАНИЕ: Ориентация чипов может быть определена по «блеску» пластины. На блестящей стороне чипа есть волокна, а на непрозрачной — нет. - Плоской стороной пинцета постучите по чипу. Отметьте участок растения, с которым соприкасался чип, с помощью маркера с мягким наконечником. Извлеките чипы VACNF после доставки.
ПРИМЕЧАНИЕ: Величина силы, прилагаемой при постукивании, будет варьироваться в зависимости от типа используемой растительной ткани. Перед проведением пронзания волокон рекомендуется потренироваться в простукивании стружки. Не допускать повреждения тканей растений. Повреждение становится очевидным, когда можно увидеть очертания чипа VACNF в ткани растения. - Повторите шаги 3.1-3.5 для контрольных элементов (+Краситель/ДНК, -Волокна; -Краситель/ДНК, +Волокна; и -Краситель/ДНК, -Волокна). -Волокна - это безволоконная сторона чипа.
- При необходимости храните неповрежденные растения или удаленные органы растений во влажных камерах в условиях длительного дня (16 часов света, 8 часов темноты). Для иссечения органов используйте пластиковую чашку Петри с влажными бумажными полотенцами.
4. Метод на кристалле (когда капля раствора для доставки помещается на чип VACNF), жесткая подложка (рис. 1B)
- Перед использованием удалите фоторезист с помощью ацетона (100%, 5 мин), IPA (100%, 5 мин) и ddH2O (5 мин).
- Капля капли 1 мкл красителя или плазмидной ДНК (200 нг) на волоконную сторону чипа VACNF с жесткой подложкой. Убедитесь, что капля находится в центре чипа и покрывает несколько волокон. Дайте капле высохнуть в течение 15 минут.
ПРИМЕЧАНИЕ: Ориентация чипов может быть определена по «блеску» пластины. На блестящей стороне чипа есть волокна, а на непрозрачной — нет. - При работе с листьями или другими иссеченными органами положите их поверх твердой поверхности. При работе с неповрежденными растениями поместите твердую поверхность под орган, на который наносятся VACNF.
- После 15-минутной сушки расположите стружку VACNF так, чтобы сторона волокна соприкасалась с растительной тканью. Постучите по чипу тыльной стороной пинцета.
ПРИМЕЧАНИЕ: Величина силы, прилагаемой при постукивании, будет варьироваться в зависимости от типа используемой растительной ткани. Рекомендуется потренироваться в постукивании стружки. - Повторите шаги 3.6-3.7 внутризаводского метода.
5. Нанесение VACNF в пленках SU-8 на растительную ткань методом на чипе (рис. 1C)
- Поместите 1 мкл капли красителя или ДНК (200 нг) на волокнистую сторону пленки SU-8 и дайте ей высохнуть в течение 10 минут. Обязательно поместите каплю в центр чипа.
ПРИМЕЧАНИЕ: Время высыхания различается в зависимости от используемого основания. - С помощью острого пинцета поместите пленку VACNF на поверхность растения.
ПРИМЕЧАНИЕ: Чем дольше пленки СУ-8 остаются в воздухе, тем более хрупкими они становятся. Чтобы снизить риск потери пленок SU-8, убедитесь, что все заводы/образцы и оборудование находятся рядом с пленками SU-8. - Аккуратно прокатите небольшой аппликатор для макияжа по пленке VACNF. Отметьте области, где размещены гибкие подложки, маркером с мягким наконечником. Удалите гибкие субстраты с поверхности растения с помощью скотча.
ПРИМЕЧАНИЕ: Усилие, прилагаемое при вращении аппликатора для макияжа, будет варьироваться в зависимости от используемых растительных тканей. Потренируйтесь в нанесении пленок VACNF перед введением биомолекул или красителей. Видимые повреждения растительных тканей очевидны, когда можно увидеть очертания пленки VACNF в растительных тканях. - Повторите шаги 5.1-5.3 для контрольных и складских установок, как указано в шаге 3.7 метода «На заводе».
6. Микроскопия и анализ изображений для всех методов доставки
- Визуализация образцов с помощью конфокального микроскопа с использованием длин волн излучения и возбуждения, подходящих для доставленного флуоресцентного зонда/репортера.
ПРИМЕЧАНИЕ: Время, необходимое для переходного превращения, зависит от вида растения и доставленного маркера. Например, экспрессия флуоресцентных маркеров была обнаружена через 48 ч у арабидопсиса против 96 ч у листьевсалата7. - При визуализации старайтесь сфокусироваться на области с отслоившимися волокнами. Волокна будут иметь разную ориентацию. Успех родов не зависит от появления обрывающихся волокон.
ПРИМЕЧАНИЕ: Волокна будут флуоресцентными с наиболее распространенными настройками возбуждения/излучения из-за образования слоя нитрида кремния, образующегося в результате образования волокон в PECVD18. - Сделайте не менее 5 снимков для каждого образца. Результирующий сигнал будет меняться.
- Измерьте значения флуоресценции как общую флуоресценцию (интегральную плотность) в конфокальных областях изображения размером 20 мкм x 20 мкм7 с помощью ImageJ19.
Representative Results
Неоспоримым преимуществом чипов VACNF на жестких или гибких подложках является способность доставлять биомолекулы или красители в определенные места на растении (рис. 1). Здесь мы использовали флуоресцентные показания для оценки доставки. При использовании различных растений, субстратов и способов доставки (на чипе или на растении) могут быть различия во времени появления флуоресцеина красителя. Чтобы определить, подходят ли чипы/пленки VACNF для доставки, быстрый подход заключается в использовании волокон для доставки красителя (Рисунок 9). Изображения, помеченные разными временами на рисунке 9, представляют собой разные поля зрения из одних и тех же образцов. При использовании метода на заводе флуоресцеиновый краситель можно наблюдать сразу после доставки с помощью флуоресцентной микроскопии. Кроме того, если одно и то же поле зрения отображается с течением времени после доставки флуоресцеинового красителя на растение, интенсивность сигнала со временем становится менее яркой (рис. 10). Флуоресцеиновый краситель потенциально может перемещаться из поля зрения в другие области листа через плазмодесматы20,21. По сравнению с методом на заводе, при методе на чипе с волокнами на жесткой подложке краситель движется медленнее по всей площади пронзания (рис. 9). Это может быть результатом того, что краситель отделяется от волокон / регидратируется в клетках и, таким образом, требует больше времени для перемещения.
Волокна в гибкой подложке были пригодны для доставки красителя на изогнутые поверхности, такие как клубника и яблоки (рис. 11 и рис. 12). При использовании гибкого субстрата с клубникой сразу же наблюдался сильный флуоресцеиновый сигнал (рис. 11), в то время как в яблоках требовалось 2 ч, чтобы увидеть сильный флуоресцеиновый сигнал (рис. 12B, D). Успешная доставка плазмид, кодирующих флуоресцентные маркеры, может быть определена с помощью флуоресцентной микроскопии для нахождения результирующего сигнала (рис. 12F, рис. 13 и рис. 14). Контроль необходим для того, чтобы определить, не имеет ли выбранное растение автофлуоресценции, подобной флуоресцентному маркеру, который мы хотим доставить с помощью волокон. Использование только волокон помогает определить, приводит ли сила удара, приложенная пинцетом, к повреждению растительной ткани, или наблюдаемая флуоресценция в образце обусловлена VACNF, которые по своей природе флуоресцентны из-за их слоя нитрида кремния18 (рис. 13C-D). Волокна, пронзенные растительной тканью, не индуцируют раневой реакции, что оценивается по продукцииH2O2 6. Наконец, с помощью контроля +ДНК, -волокон необходимо подтвердить, что ДНК не попадает в растение только путем постукивания, и подтвердить, что волокна необходимы для доставки в растительные клетки (рис. 13E-F). При использовании внутризаводского или внутричипового методов доставки с использованием VACNF на жесткой подложке не должно быть явных различий, на что указывает отсутствие существенной разницы в значениях флуоресценции (рис. 13I). Использование гибких пленок VACNF с внутричиповой доставкой ДНК привело к успешной транзиторной трансформации клеток эпидермиса в купленных в магазине яблоках и луке (рис. 12F и рис. 14).
Неудачные эксперименты могут привести к обрыву волокон в разных полях зрения, но результирующего флуоресцентного сигнала от попытки доставить плазмидную ДНК или краситель не будет. Если на растение будет оказано слишком сильное давление, произойдет явное повреждение тканей (Рисунок 15). Это механическое повреждение может выглядеть как небольшие отверстия или прозрачные участки на растении, как будто был удален слой клеток, если смотреть на растение под микроскопом. Иногда будут видны отпечатки чипа. Эксперимент, в котором экспрессия флуоресцентного белка не обнаруживается после доставки ДНК, также может быть связан с использованием некачественной ДНК, поэтому может быть полезно приготовить свежую ДНК.
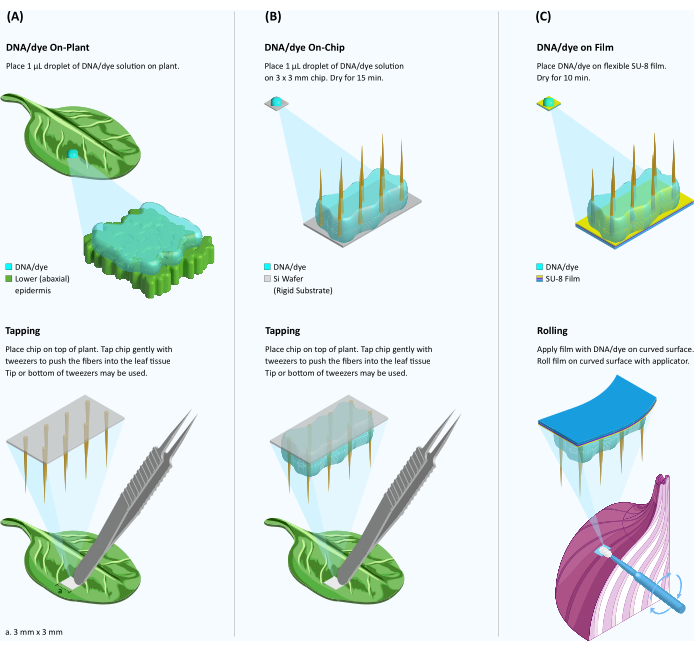
Рисунок 1: Схема доставки красителя/ДНК в растительную ткань с помощью волокон на жестких и гибких подложках. (A) Доставка красителя/ДНК на растительном растении. Капля раствора красителя/ДНК объемом 1 мкл помещается на поверхность листа, а чип VACNF помещается поверх капли. С помощью пинцета чип аккуратно постукивают по ткани. Жесткая подложка удаляется, оставляя нановолокна внутри ткани. (B) Опосредованная волокном доставка ДНК на чипе. Каплю 1 мкл раствора красителя или ДНК отливают на чип VACNF и сушат в течение 15 минут. Чип с полувысушенной ДНК помещают поверх поверхности листа и втыкают в ткань, как показано на панели А. (C) Внутричиповая доставка ДНК из пленки SU-8. Волокна переносятся с жесткой кремниевой подложки на гибкую подложку SU-8. Каплю раствора красителя/ДНК объемом 1 мкл отливают на пленку VACNF и сушат в течение 10 мин. Затем пленка VACNF с полувысушенным красителем/ДНК накатывается на изогнутую поверхность растения с помощью аппликатора для макияжа. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
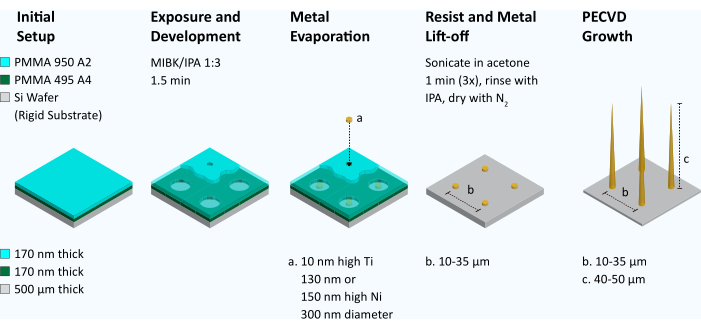
Рисунок 2: Рабочий процесс для создания вертикально выровненных массивов углеродных нановолокон. Для производства VACNF двойной слой полиметилметакрилата (ПММА 495 А4 с последующим ПММА 950 А2) наносится на кремниевую пластину методом центрирования. Электронно-лучевая литография используется для определения массива точек диаметром 300 нм. Затем резист проявляют в метилизобутилкетоне/изопропаноле (MIBK/IPA) в соотношении 1:3 в течение 1,5 мин. С помощью металлического испарителя на пластину наносится адгезивный слой Ti (10 нм), за которым следует слой Ni (130 нм или 150 нм). Оставшийся резист затем удаляется с помощью подъема (ультразвуковая обработка в ванне ацетоном). Геометрия точек катализатора проверяется с помощью СЭМ. Если катализаторы напоминают хоккейные шайбы и плоские, их помещают в машину для химического осаждения из газовой фазы (PECVD) и выращивают волокна. Затем волокна были проверены с помощью SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: СЭМ-изображения идеально вертикально выровненных углеродных нановолокон . (A) Электронная микрофотография VACNF с шагом ~35 мкм и высотой 10-15 мкм, полученная под углом 30°. Это изображение продублировано на рисунке 7C. (B) Электронная микрофотография VANCF с шагом ~20 мкм и высотой 20-30 мкм, полученная под углом 30°. (C) Электронная микрофотография VANCF с шагом ~35 мкм, высотой 50-60 мкм, полученная под углом 30°. (D) Электронная микрофотография зонда VACNF диаметром <200 нм. Диаметр наконечника волокна варьируется (150-300 нм). Поскольку волокна были изображены под углом 30°, высоты, по-видимому, меньше фактической высоты на коэффициент sin(30°)=1/2. Панели А и В были перепечатаны с разрешения Morgan et al.7. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
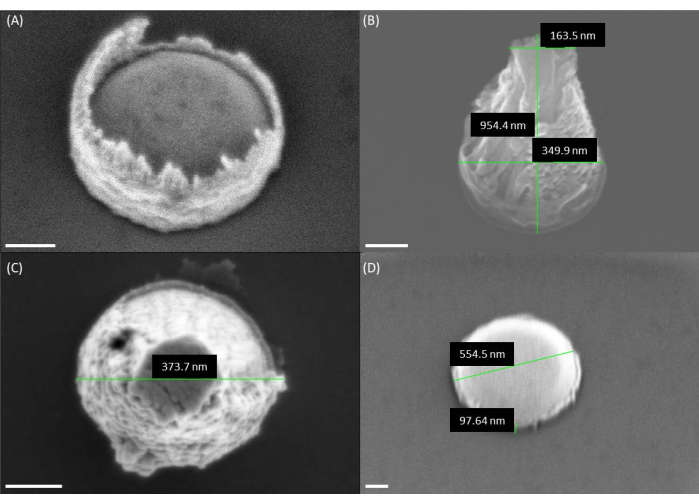
Рисунок 4: Изображения геометрии катализатора до выращивания VACNF. (A) Изображение катализатора после старта. Обратите внимание, что фоторезист присутствует вокруг края катализатора, что приводит к форме вулкана. (В,В) На изображениях, полученных с помощью СЭМ, видна форма вулкана катализатора после использования однослойного резиста из ПММА. (D) Желаемая форма катализатора хоккейной шайбы, изготовленная из двойного слоя ПММА. Поскольку волокна были изображены под углом 30° на панелях A, B и D, высота, по-видимому, меньше фактической высоты на коэффициент sin(30°) = 1/2. Масштабные линейки обозначают длину волны 100 нм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Влияние размера точки катализатора на рост волокна: Для установления оптимального диаметра материала катализатора волокна выращивали из точек размером от 200 до 600 нм. Размеры точек в пределах 400-600 нм приводили к обезвоживанию катализатора и росту нескольких волокон. Наилучшая геометрия волокна была получена при диаметре 300 нм. Более мелкие точки приводили к недостаточной высоте волокон. Из-за того, что волокна были изображены под углом 30°, высоты кажутся меньше фактической высоты на коэффициент sin(30°) = 1/2. Снимки были получены с помощью сканирующей электронной микрофотографии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
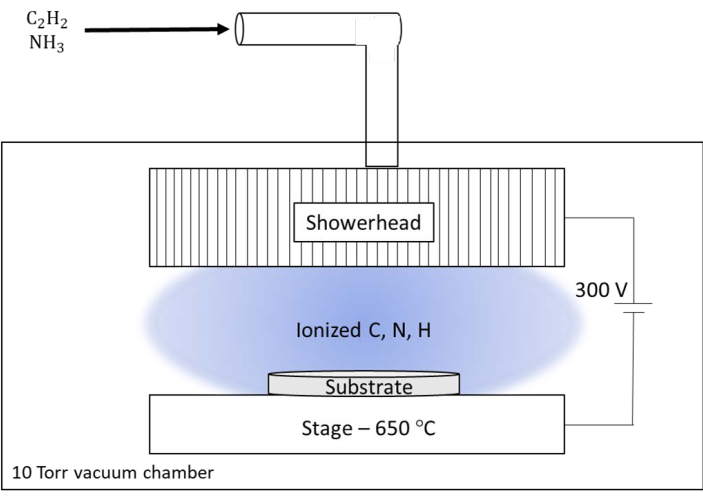
Рисунок 6: Схематическое изображение системы химического осаждения из газовой фазы постоянного тока и плазмы (dc-PECVD), используемой в Национальной лаборатории Оук-Ридж (ORNL). Специальная система в ORNL имеет большую душевую лейку, которая служит реактором для питательных газов и выходом для плазмы. Душевая лейка поддерживалась при потенциале постоянного тока 300 В относительно нагреваемой ступени для подложки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
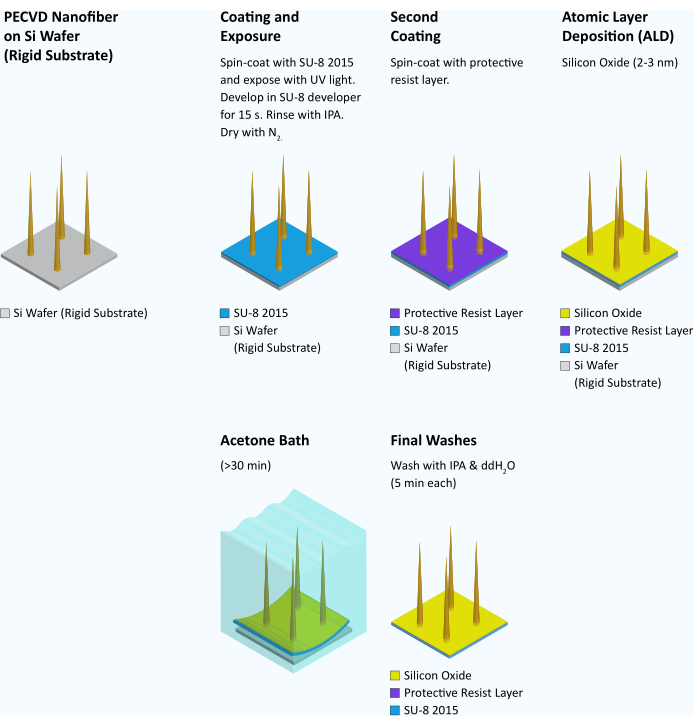
Рисунок 7: Рабочий процесс переноса волокон с жесткой подложки на гибкую. После синтеза и контроля нановолокна каждая пластина подвергается спин-кодированию SU-8 2015 при 4000 об/мин в течение 45 с. Затем пластину выпекают мягко в течение 3 минут при температуре 95 °C. Затем пластина подвергается воздействию ультрафиолета и моделируется в маске-элайнере с концентрацией 95 мДж/см2. После допечки в течение 6 мин при 95 °С пластину проявляют в проявителе СУ-8 в течение 15 с, промывают изопропиловым спиртом и сушат газомN2 . Защитный резистивный слой SPR 955 CM 0,7 наносится на пластину при 3000 об/мин и запекается при 90 °C в течение 30 с. Затем слой оксида кремния (2-3 нм) добавляется к пластине путем атомно-слоевого осаждения (ALD) (22 цикла при 100 °C), чтобы сделать гибкую подложку гидрофильной15. Затем пластина нарезается кубиками на квадраты размером 3 мм x 3 мм с помощью пилы для нарезки кубиками. Во время использования отдельные стружки помещают в ацетон до тех пор, пока SU-8 не начнет скручиваться и не станет вогнутым (>30 мин). В настоящее время слой SU-8 на большинстве чипов может быть захвачен за край острым пинцетом и отслаен от нижележащей кремниевой подложки в виде неповрежденной квадратной пленки толщиной 3 мм. Затем пленку последовательно промывают в изопропиловом спирте и воде по 5 минут и сразу же используют. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 8: СЭМ-изображения переноса волокна с жесткой подложки на гибкую. Показанные изображения являются репрезентативными, но взяты из разных образцов. (A) Длинные волокна после роста PECVD (то же изображение, что и на рисунке 2C). (В,В) Волокна после применения СУ-8. Эпоксидная смола накапливается вокруг основания волокон. Длина открытых волокон варьировалась от 5 мкм до 30 мкм. (D) Волокна, встроенные в Су-8 после отрыва, сохранили свою геометрию. Из-за того, что волокна были изображены под углом 30°, высоты, по-видимому, меньше фактической высоты на коэффициент sin(30°)=1/2. Панель А перепечатана с разрешения Morgan et al.7. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
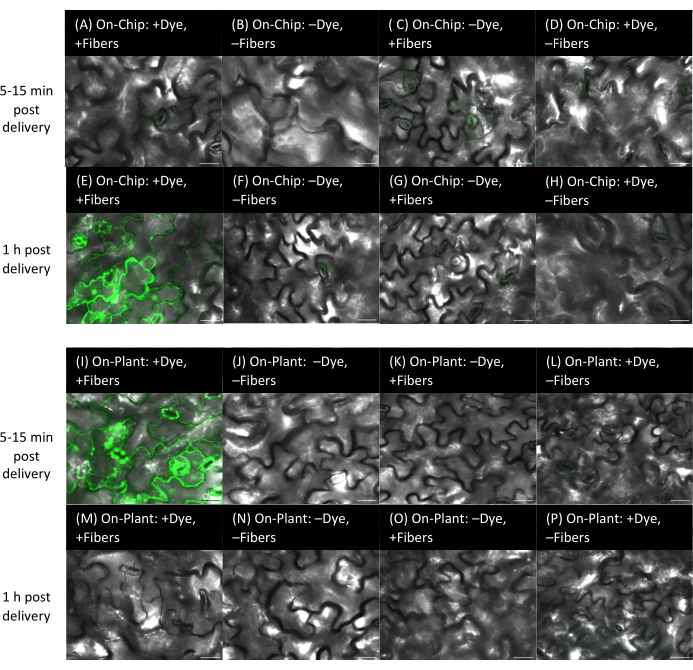
Рисунок 9: Доставка красителя в листья арабидопсиса методами on-chip и on-plant с волокнами на жестких субстратах. (А-) Изображения были получены с помощью конфокальной микроскопии. Метод на чипе (A-H): 1 мкл флуоресцеинового красителя 10 мкМ высушивали в течение 15 мин на чипах VACNF, а затем чипы пинцетом вводили в абаксиальную сторону листьев арабидопсиса. (А-Д) Листья визуализируются в течение 5-15 минут после родов. (Э-Н) Листья на снимке через 1 час после родов. (А,Е) +Краситель, +Волокна. Элементы управления: (B,F) -краситель, -волокна; (C,G) -краситель, +волокна; (D,H) +краситель, -волокна. (И-) Метод на заводе: 1 мкл флуоресцеинового красителя 10 мкМ помещали на поверхность растения, стружку располагали так, чтобы она соприкасалась с каплей, и пинцетом врезали стружку в абаксиальную сторону листьев арабидопсиса. (I-L) в течение 5-15 минут после родов и (M-P) через 1 час после родов. (I,M) +Краситель, +Волокна. Элементы управления: (J,N) -краситель, -волокна; (К,О)-краситель, +волокна; (L,P) + краситель, -волокна. Панели A-P представляют собой одиночные плоские изображения из z-стеков. Масштабные линейки имеют толщину 20 мкм. Волокна имеют шаг 35 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
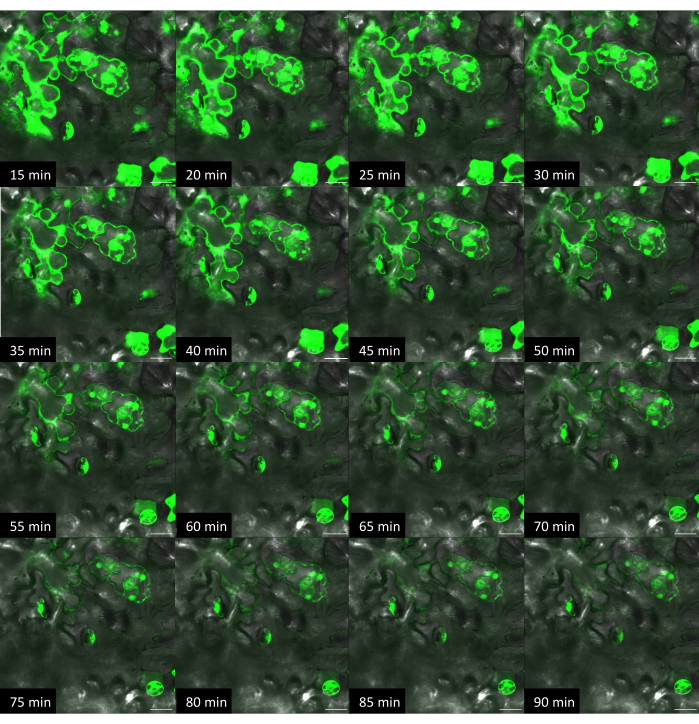
Рисунок 10: Временной ход доставки красителя у Arabidopsis внутризаводским методом с жестким субстратом. Изображения были получены с помощью конфокальной микроскопии. Методом on-plant на поверхность листа помещали 1 мкл раствора флуоресцеинового красителя (10 мкМ), а поверх капли помещали чип VACNF. С помощью пинцета чип аккуратно постукивали по ткани. +Dye, +Fibers изображения одной и той же области были получены каждые 5 минут. Масштабные линейки имеют толщину 20 мкм. Волокна имеют шаг 35 мкм. Панели представляют собой одиночные плоские изображения из z-стеков. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
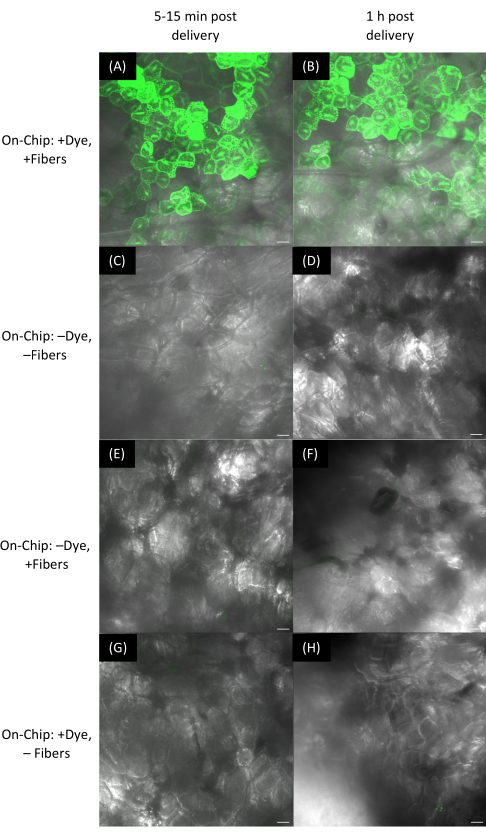
Рисунок 11: Доставка красителя на плоды клубники с помощью пленок VACNF. (A-H) Изображения были получены с помощью конфокальной микроскопии. Методом на чипе капли красителя высушивали на пленках VACNF, которые затем накатывали на фруктовые поверхности с помощью аппликатора для макияжа. Флуоресцеиновый краситель (10 мкМ) доставляли в клетки клубники и визуализировали через (A) 10 мин и (B) 1 ч. (C,D) Контроль без обработки (-краситель, -волокна). (E,F) -Краситель, +Волокна контролируют через 10 мин и 1 ч соответственно. (G,H) + Краситель, -Волокна контролируют через 10 мин и 1 ч соответственно. Масштабные линейки имеют длину волны 40 мкм. Панели A-H имеют максимальную проекцию 188 мкм z-стеков. Волокна имеют шаг 35 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 12: Подача красителя и переходная трансформация яблок с помощью пленок VACNF. (А-Ж) Изображения были получены с помощью конфокальной микроскопии. С помощью метода на чипе 1 мкл капли флуоресцеинового красителя (10 мкМ, В и D) или 1 мкл плазмиды, кодирующей pUBQ10:YFP (ДНК−YFP) (200 нг), высушивали на пленках VACNF, которые затем накатывали на фруктовые поверхности с помощью аппликатора для макияжа. Флуоресцеиновый краситель доставляли в эпидермис яблока и визуализировали через (B) 10 мин и (D) 2 ч. (D) Красителю потребовалось некоторое время, чтобы диффундировать в клетки после доставки. Доставка и экспрессия ДНК-YFP через пленки VACNF после (F) 48 ч. (A, C, E) без контроля обработки (-Dye/DNA-YFP, -Fibers). Масштабные линейки имеют длину волны 40 мкм. Панели A-D представляют собой одиночные плоские изображения из z-стеков. Панели E и F представляют собой максимальную проекцию 53 мкм z-стеков. Шаг волокна составляет 35 мкм. Стрелками обозначены сигналы флуоресцеина или YFP. * обозначает волокна. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
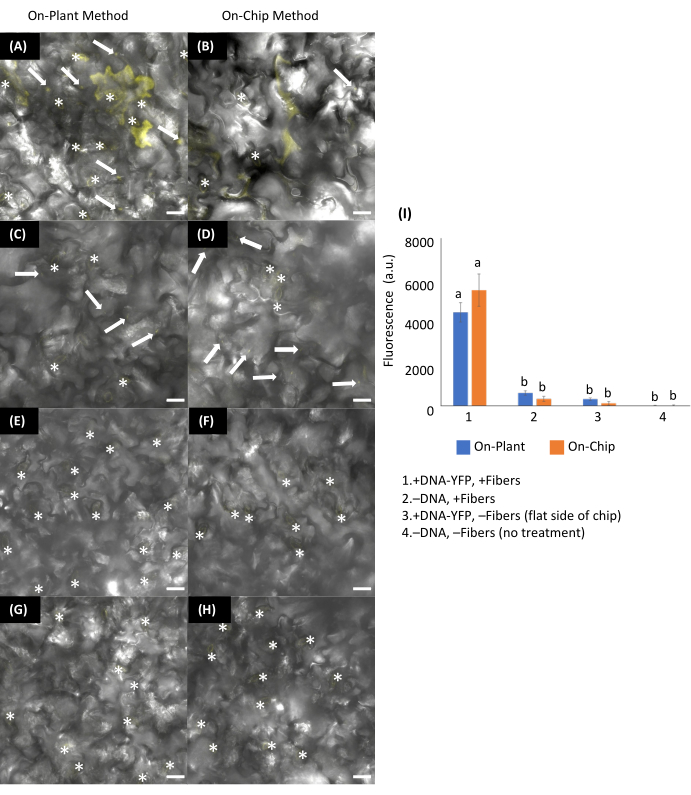
Рисунок 13: Переходная трансформация листьев арабидопсиса с использованием методов VACNF на растении или чипе. (АИзображения были получены с помощью конфокальной микроскопии через 48 ч после доставки ДНК. (А, С, Э, Г) Внутризаводской метод: 1 мкл плазмиды, кодирующей pUBQ10:YFP (DNA−YFP) (200 нг), помещали на абаксиальную сторону листьев арабидопсиса. Чипы располагались таким образом, чтобы они соприкасались с каплей, и пинцетом использовалась для того, чтобы вонзить стружку в ткань листа. (Б, Г, Ж, Н) Метод на чипе: 1 мкл ДНК-YFP (200 нг) высушивали в течение 15 мин на чипах VACNF, а затем пинцетом врезали в абаксиальную сторону листьев арабидопсиса. +DNA-YFP, +Волокна для (A) на предприятии и (B) на чипе. Контроль: (C,D) -ДНК-YFP, + волокна; (E,F) +ДНК-YFP, -волокна; и (G,H)-ДНК, −Волокна. (I) График относительной средней интенсивности флуоресцентного сигнала областей 25, 20 × 20 мкм по изображениям 5 биологических репликаций, объединенных из 2-3 экспериментов с использованием флуоресценции из канала YFP. Области, содержащие устьица (*), были исключены из-за аутофлуоресценции. Из каждого среднего значения вычитали среднюю интенсивность флуоресценции из состояния -DNA-YFP, -Fibers. Для проверки значимости использовался 2-сторонний ANOVA (и критерий Тьюки), а столбцы погрешности представляют собой стандартную ошибку среднего значения. Разные буквы показывают существенные различия между методами лечения (P < 0,0001). Все показанные изображения представляют собой максимальные проекции 40 мкм z−stacks. Масштабные линейки имеют толщину 20 мкм. Белыми стрелками обозначены волокна на изображениях. Шаг волокна составляет 35 мкм. Эта цифра перепечатана с разрешения Morgan et al.7. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 14: Переходная трансформация лука с использованием пленок VACNF. Изображения получали с помощью конфокальной микроскопии через 48 ч после доставки ДНК. С помощью внутричипового метода 1 мкл капель плазмидной ДНК, кодирующей pUBQ 10:YFP (DNA-YFP) (200 нг), высушивали на пленках VACNF в течение10 мин, которые затем накатывали на поверхности органов растений. (А) ДНК-YFP была доставлена, и YFP экспрессировалась в эпидермисе лука. (B) Отсутствие контроля за лечением; (C) контроль (+DNA-YFP, -Fibers) и (D) контроль (-DNA-YFP, +Fibers). Масштабные линейки имеют длину волны 40 мкм. Волокна имеют шаг 35 мкм. Изображения представляют собой максимальные проекции 115 мкм z-стеков. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 15: Повреждение тканей салата при нанесении пленки VACNF . (A-D) Изображения были получены с помощью конфокальной микроскопии. (A) Метод на чипе был использован для доставки ДНК в листья салата через пленки VACNF. Капли ДНК (200 нг) pUBQ 10:YFP сушили в течение10 мин на пленках VACNF, которые затем наматывали на абаксиальную сторону отделенных листьев салата и хранили во влажностной камере в течение 4 дней. (B) контроль (-DNA-YFP, +Fibers). (C) контроль (+DNA-YFP, -Fibers) и (D) отсутствие лечения (-DNA-YFP, -Fibers). Масштабные линейки имеют длину волны 40 мкм. VACNF имеют шаг 35 мкм. Стрелки указывают на повреждение растений в результате перекатывания гибкого субстрата со слишком большой силой. Следует отметить, что успешная VACNF-опосредованная доставка ДНК в салат-латук была достигнута и в других экспериментах7. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
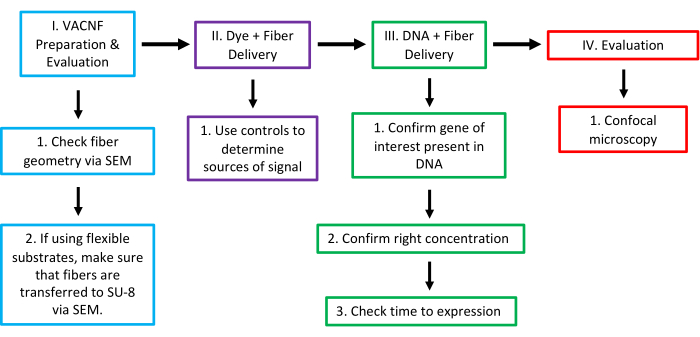
Рисунок 16: Рабочий процесс VACNF-опосредованной доставки на заводах. На этапе I проверьте геометрию волокон с помощью SEM. Для правильной доставки волокнам нужен наконечник диаметром <200 нм. При использовании волокон на гибкой подложке следующим шагом будет подтверждение того, что волокна передаются на SU-8, и проверка высоты обнаженных волокон с помощью SEM. На втором этапе мы проверили полезность волокон, попытавшись доставить краситель в выбранное растение/орган с помощью жесткой или гибкой подложки. Используйте каплю объемом 1 мкл, поместив ее на поверхность растения или ненадолго высушив на стружке/пленке. На этом шаге, как и на всех остальных, необходимо использовать надлежащие элементы управления (-Dye, -Fibers; -Dye, +Fibers; и +Dye,-Fibers), чтобы быть уверенным в том, что сигнал исходит от добросовестной доставки красителя. На этапе III подтвердите, что интересующий ген присутствует в плазмиде, определите концентрацию ДНК для доставки и протестируйте оптимальное количество времени после доставки, чтобы проверить экспрессию. На IV этапе исход оценивали с помощью конфокальной микроскопии для проверки экспрессии введенного маркера. Эта цифра была изменена с разрешения Morgan et al.7. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
В этой работе мы представили методы построения вертикально выровненных массивов углеродных нановолокон, переноса волокон на гибкую подложку и нанесения волокон в жесткой или гибкой подложке растениям для использования в доставке биомолекул или красителей растениям. Мы описали два основных подхода, метод на чипе и на заводе, для осаждения введенных материалов и показали успешные результаты в волокнах на жесткой подложке, а также в методе на чипе с использованием пленок VACNF. Применение этих волокон на практике и в теории проще, чем традиционные методы трансформации растений (бомбардировка частицами, трансформация протопластов с помощью ПЭГ или электропорация) и может быть использовано для растений, невосприимчивых к трансформации, опосредованной агробактериями. Однако трансформируются лишь немногие клетки.
Вертикально выровненные углеродные нановолокна были произведены в Центре нанофазных материалов Национальной лаборатории Оук-Ридж в рамках их пользовательской программы. Пользователи могут подать заявку на использование этого объекта для производства VACNF. В качестве альтернативы чипы VACNF могут производиться в чистых помещениях с помощью машин для химического осаждения из газовой фазы постоянного тока с источником углерода22,23. С описанными методами есть несколько шагов, которые имеют решающее значение для производства волокон, переноса волокна и нанесения чипов/пленок VACNF. Для того, чтобы применение волокна работало, волокна должны быть прямыми и иметь сужающийся диаметр <200 нм на конце, чтобы доставка в растительные клеткибыла успешной6,7 (рис. 3). Для создания углеродных нановолокон определенного размера и шага существует множество параметров, которые могут быть изменены, включая размер точки, боковой шаг и количество осажденного катализатора. Для выбора оптимального размера точки, которая будет использоваться для производства углеродного нановолокна, были выращены волокна различных размеров точек (как показано на рисунке 5). Мы обнаружили, что диаметр 300 нм дает лучшие волокна, поэтому был выбран этот размер точки (рис. 5). После того, как мы нашли правильные параметры, мы решили использовать чипы, которые имеют >50% волокон с идеальной геометрией (прямые и диаметр наконечника <200 нм). Для проверки геометрии волокон мы использовали сканирующую электронную микроскопию для получения изображения случайных полей зрения на образце чипов/пленок VACNF.
Кроме того, волокна должны иметь определенную минимальную длину, чтобы обеспечить доставку в растительные клетки. Важность производства волокон разной длины заключается в том, что более длинные волокна могут быть использованы для проникновения в более глубокие слои тканей. Более длинные волокна (>40 мкм в длину) необходимы для гибких пленок, так как перенос волокна происходит путем отрыва волокон от их основы и требует наслоения SU-8 поверх волокон. Рабочая толщина слоя SU-8, используемого для данного протокола, составляет 20-35 мкм. Минимальная высота, необходимая для осуществления родов в эпидермисе различных растений (изогнутых или плоских), составляет 10-15 мкм 6,7. В результате для пленок VACNF необходимы волокна длиной >40 мкм. При производстве углеродных нановолокон необходимо учитывать несколько различных параметров: материал катализатора, геометрия катализатора, толщина материала катализатора, а также условия в камере PECVD (соотношение газов, давление, температура, ток, высота душевой лейки и время роста)8,9,24,25. Для получения углеродных нановолокон длиной более 25 мкм, используемых Morgan et al.7 и Davern et al.6, мы увеличили количество никелевого катализатора, изменили соотношение ацетилен: аммиак, а также увеличили ток и время роста. Кроме того, мы уделили больше внимания геометрии материала катализатора. Чтобы получить высокие прямые волокна, осажденный катализатор должен был иметь форму хоккейной шайбы, а не форму, напоминающую вулкан (рис. 4). Вулканические структуры возникают из остатков фоторезиста после старта. Для предотвращения образования вулканов при электронно-лучевой литографии использовали двойной слой ПММА для создания поднутрения26. Поднутрение способствует отрыву наплавленного металлического катализатора (рис. 2). Толстый слой катализатора важен для роста высоких VACNF. Морфология VACNF была изучена Merkulova et al.24. Вертикальное выравнивание VACNF обусловлено как ростом типа наконечника никелевого катализатора, так и выравниванием потенциала постоянного тока перпендикулярно подложке (рис. 6). Душевая лейка описывает геометрию реактора PECVD (рис. 6) и служит источником потенциала для электрического поля27.
Для определения массива точек катализатора с помощью электронно-лучевой литографии мы применили электронно-лучевой резист (полиметилметакрилат), а затем использовали электронный луч для создания небольших отверстий в резисте определенной формы и в определенных местах на пластине. Отверстия нужного диаметра размещались на регулярной сетке с заданным шагом (шагом) и файл с указанием желаемого рисунка загружался в инструмент электронно-лучевой литографии перед загрузкой подложки в машину. Помимо высоты волокна, еще одним важным параметром для успешной переноски волокна является количество времени, проведенного в ацетоновой ванне. Пленки VACNF необходимо оставить в ацетоновой ванне достаточно долго, чтобы их края начали скручиваться; Если их оставить в ацетоновой ванне на слишком малое время, их труднее снять со стружки, и они могут сломаться. Чем старше стружка, тем дольше ей придется оставаться в ацетоновой ванне. После ацетоновой ванны пленки/стружку помещали в изопропанол и воду для удаления доступного ацетона, а также для удаления защитного фоторезиста на волокнах.
Для нанесения отжима пластины или вафельные изделия помещаются на вакуумный патрон в машине для нанесения покрытий, и центральное положение пластины проверяется с помощью функции тестирования машины для нанесения покрытий. Маленькая лужица (~2,5 см в диаметре) резиста прикладывается к центру пластины и вращается (3000 об/мин в течение 45 с) Изображения волокон до и после отжима включены в рисунок 8, показывающие сохранение геометрии волокна (высота, ориентация и шаг). Присутствие волокон приводит к тому, что сопротивление вздымается в основании волокон и приводит к более толстым, чем ожидалось, слоям. Центрифугирование после роста VACNF исследовано другими группами11,18.
Еще одним этапом процесса, который имеет жизненно важное значение, является обеспечение того, чтобы к чипам/пленкам VACNF прилагалось нужное усилие. Механизм доставки зависит от того, что волокна делают небольшие проколы в клеточных стенках с помощью импульсной силы пинцета, постукивающего по жестким подложкам 6,7 или прокатывающихся мини-аппликатором для макияжа по гибким подложкам. Волокна могут отламываться, а могут и не отламываться и оставаться в растительных клетках6,7 без влияния на результат, но для получения правильного давления необходима практика в сочетании с исследованием на предмет поглощения красителя и повреждения тканей. Кроме того, важно выбрать подходящие моменты времени визуализации после доставки ДНК с помощью чипов/пленок VACNF, поскольку время до детектируемой экспрессии варьируется в зависимости от вида растений и типов доставляемых векторов7 (рис. 16).
Несмотря на то, что этот метод широко применим к растениям, он имеет несколько ограничений. Например, добавление тонкого слоя оксида кремния к пленкам VACNF не всегда приводит к тому, что пленки становятся полностью гидрофильными из-за защитного слоя фоторезиста, добавленного поверх SU-8. Если эта проблема материализуется, на VACNF могут быть нанесены более толстые слои оксида кремния. Чтобы проверить, являются ли пленки гидрофобными или гидрофильными, их можно поместить в воду. Если пленки тонут, они гидрофильные, а если плавают, то гидрофобные. Кроме того, могут быть различия между партиями производимых волокон. Существует несколько параметров, которые могут быть изменены при выращивании волокон в машине dc-PECVD; то, что описано в этом протоколе, является набором параметров для двух разных количеств никелевого катализатора. Кроме того, ориентация кристаллов никелевого катализатора не может контролироваться28 , и некоторое разветвление неизбежно приведет к образованию волокон.
Несмотря на то, что в этой статье мы продемонстрировали доставку флуоресцеинового красителя и ДНК в клетки растений с использованием как жестких, так и гибких субстратов, этот метод должен быть широко применим для других биомолекул и подходов к генетической модификации, например, для подавления РНК-интерференции для растительных систем, таких как яблоки или другие фрукты, где для получения стабильных трансгенных линий потребовались бы годы. Более того, эти волокна также могут быть использованы для доставки генетических материалов для редактирования или для стабильных трансформаций в растениях.
Disclosures
Авторам нечего раскрывать.
Acknowledgements
Массивы нановолокон были изготовлены в Центре нанофазных материаловедческих наук, который является пользовательским объектом Управления науки Министерства энергетики США (идентификатор предложения: CNMS2019-103 и CNMS2022-A-1182). Поддержка со стороны CNMS присуждается через систему рецензируемых заявок и предоставляется бесплатно успешным кандидатам, которые намерены опубликовать свои результаты (http://www.cnms.ornl.gov/user/becoming_a_user.shtml). Мы благодарим Кевина Лестера и CNMS за помощь в производстве массивов из нановолокон. Мы благодарим д-ра Джона Когмена, д-ра Тимоти Макнайта, д-ра Эмбер Уэбб, Дэрила Бриггса и Трэвиса Би за критические дискуссии по планированию эксперимента. Благодарим д-ра Адама Рондиноне за схему аппарата PECVD. Благодарим Лесли Кэрол за научные иллюстрации. Эта работа финансировалась Научной программой биовизуализации, Министерством энергетики США, Управлением науки, биологических и экологических исследований, DE-SC0019104 и Министерством сельского хозяйства США, 2021-67013-34835. JMM был поддержан Министерством сельского хозяйства США: Национальный институт продовольствия и сельского хозяйства: Инициатива по исследованию сельского хозяйства и продовольствия Predoctoral Fellowship 2021-67034-35167.
Materials
| Name | Company | Catalog Number | Comments |
| 13" x 13" White 1/4-fold heavy duty Brawny industrial shop towel 70Ct | Fastenal | 690535 | |
| 2-Propanol (IPA) | Fischer Scientific | A451-4 | |
| 4" Lid | Entegris | H22-401-0615 | Wafer Carriers |
| 4" tray | Entegris | H22-40-0615 | Wafer Carriers |
| Accretech SS10 dicing saw | Accreteck | SS10 | |
| Acetone | Fischer Scientific | A18-4 | |
| Acetone used in the cleanroom at ORNL | JT Baker | 9005-05 | |
| Apples | Grocery store | No product number | |
| Arabidopsis thaliana | Seeds of accession Columbia from the laboratory of Professor Jean Greenberg at the University of Chicago | No product number | |
| Carbon direct current plasma enhanced chemical vapor deposition machine | Oak Ridge National Laboratory | Custom-built | |
| Cobham Green lettuce | Seeds from the laboratory of Professor Richard Michelmore at the University of California, Davis | No product number | Butterhead lettuce |
| Fluorescein dye | Sigma Aldrich | F2456-2.5G | |
| Gel-box | Gel-Pak | AD-23C-00-X4 | |
| Heidelberg DWL 66 direct-write lithography tool | Heidelberg | DWL 66 | |
| ImageJ | National Institues of Health | No product number | |
| Isoproponal (IPA) used in the cleanroom at ORNL | Doe and Ingalls | CMOS Grade 9079-05 | |
| JEOL 9300FS 100kV electron beam lithography system | JEOL | 8100 | |
| Kimwipes | Kimtech | Kimberly-Clark Professional 34120 | |
| Kord-Valmark disposable polystyrene petri dish | VWR | 11019-554 | |
| Layout Editor | juspertor GmbH | No product number | |
| LSM 710 confocal microscope | Zeiss | No product number | |
| LSM 800 confocal microscope | Zeiss | No product number | |
| Make-up applicator | Amazon | G2PLUS | 500 PCS Disposable Micro Applicators Brush for Makeup and Personal Care (Head Diameter: 1.5 mm)- 5 x 100 PCS |
| Merlin field emission scanning electron microscope | Zeiss | Merlin | |
| MIBK/IPA (methyl isobutyl ketone/isopropanol) (1:3) | Microchem | M089025 | |
| Onions | Grocery store | No product number | |
| Oxford FlexAl atomic layer deposition | Oxford | FlexAl | |
| PMMA 495 A4 | Microchem | M130004 | |
| PMMA 950 A4 | Microchem | M230004 | Can dilute down to A2 |
| Polyethylene terephthalate (PET) | Amazon | KS-6304-21-11 | Type D Clear PET (Polyester) Sheet .0005" Thick x 27" Width x 10 Ft Length 1 pc |
| Precision tweezers | Aven Inc. | 18032TT | |
| pUBQ10:YFP-GW | Arabidopsis Biological Resource Center | CD3-1948 | |
| Silicon etcher (used for descum) | Oxford | Plasmalab | |
| Silicon rubber kit | Smooth-On Inc | Ecoflex 00-20 | |
| Silicon wafers | Pure Wafer | 4N0.001-.005SSP-INV | |
| Spin coater | Brewer Sciences | Model 100CB | |
| SPR 955cm 0.7 | Megaposit | 10018314 | |
| Strawberries | Grocery store | No product number | |
| SU-8 2015 | Microchem | SU-8 2000 Series | Toxic. Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| SU-8 developer | Microchem | SU-8 2000 Series | Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| Suss MicroTec contact aligner | Suss MicroTec | MA6/BA6 | |
| Table top microscope | Phenom XL | used for checking Ni catalysts after metal deposition | |
| Thermionics VE-240 e-beam evaporator | Thermionics | VE-240 |
References
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Gou, Y. J., et al. Optimization of the protoplast transient expression system for gene functional studies in strawberry (Fragaria vesca). Plant Cell, Tissue, and Organ Culture. 141, 41-53 (2020).
- Baltes, N. J., Gil-Humanes, J., Voytas, D. F. Genome engineering and agriculture: Opportunities and challenges. Progress in Molecular Biology and Translational Science. 149, 1-26 (2017).
- Ren, R., et al. Highly efficient protoplast isolation and transient expression system for functional characterization of flowering related genes in Cymbidium orchids. International Journal of Molecular Sciences. 21 (7), 2264 (2020).
- Kumar, S., et al. Nanovehicles for plant modifications towards pest-and disease-resistance traits. Trends in Plant Science. 25 (2), 198-212 (2020).
- Davern, S. M., et al. Carbon nanofiber arrays: a novel tool for microdelivery of biomolecules to plants. PLoS One. 11 (4), e0153621 (2016).
- Morgan, J. M., et al. An efficient and broadly applicable method for transient transformation of plants using vertically aligned carbon nanofiber arrays. Frontiers in Plant Science. 13, 1051340 (2022).
- Melechko, A. V., et al. Vertically aligned carbon nanofibers and related structures: Controlled synthesis and directed assembly. Journal of Physics D: Applied Physics. 97, 041301 (2005).
- Melechko, A. V., Desikan, R., McKnight, T. E., Klein, K. L., Rack, P. D. Synthesis of vertically aligned carbon nanofibres for interfacing with live systems. Journal of Physics D: Applied Physics. 42 (19), 193001 (2009).
- Nelson-Fitzpatrick, N. . Novel Materials for the Design of Cantilever Transducers [dissertation]. , (2011).
- Fletcher, B. L., et al. Transfer of flexible arrays of vertically aligned carbon nanofiber electrodes to temperature-sensitive substrates. Advanced Materials. 18 (13), 1689-1694 (2006).
- Keller, S., Blagoi, G., Lillemose, M., Haefliger, D., Boisen, A. Processing of thin SU-8 films. Journal of Micromechanics and Microengineering. 18 (12), 125020 (2008).
- Wouters, K., Puers, R. Diffusing and swelling in SU-8: insight in material properties and processing. Journal of Micromechanics and Microengineering. 20 (9), 095013 (2010).
- Jamal, M., Zarafshar, A. M., Gracias, D. H. Differentially photo-crosslinked polymers enable self-assembling microfluidics. Nature Communications. 2, 527 (2011).
- Williams, R., Goodman, A. M. Wetting of thin layers of SiO2 by water. Applied Physics Letters. 25 (10), 531-532 (1974).
- Kundu, A., Nogueira Campos, M. G., Santra, S., Rajaraman, S. Precision vascular delivery of agrochemicals with micromilled microneedles (µMMNs). Scientific Reports. 9, 14008 (2019).
- Acanda, Y., Welker, S., Orbović, V., Levy, A. A simple and efficient agroinfiltration method for transient gene expression in Citrus. Plant Cell Reports. 40 (7), 1171-1179 (2021).
- Pearce, R., et al. Synthesis and properties of SiNx coatings as stable fluorescent markers on vertically aligned carbon nanofibers. AIMS Materials Science. 1 (2), 87-102 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crafts, A. S. Translocation in plants. Plant Physiology. 13 (4), 791 (1938).
- Martens, H. J., Hansen, M., Schulz, A. Caged probes: a novel tool in studying symplasmic transport in plant tissues. Protoplasma. 223, 63-66 (2004).
- Liu, J., Essner, J., Li, J. Hybrid supercapacitor based on coaxially coated manganese oxide on vertically aligned carbon nanofiber arrays. Chemistry of Materials. 22 (17), 5022-5030 (2010).
- Saleem, A. M., et al. Low temperature and cost-effective growth of vertically aligned carbon nanofibers using spin-coated polymer-stabilized palladium nanocatalysts. Science and Technology of Advanced Materials. 16, 015007 (2015).
- Merkulov, V. I., Lowndes, D. H., Wei, Y. Y., Eres, G., Voelkl, E. Patterned growth of individual and multiple vertically aligned carbon nanofibers. Applied Physics Letters. 76 (24), 3555-3557 (2000).
- Retterer, S. T., Melechko, A., Hensley, D. K., Simpson, M. L., Doktycz, M. J. Positional control of catalyst nanoparticles for the synthesis of high density carbon nanofiber arrays. Carbon. 46 (11), 1378-1383 (2008).
- Rooks, M. J., Wind, S., McEuen, P., Prober, D. E. Fabrication of 30-nm-scale structures for electron transport studies using a polymethylmethacrylate bilayer resist. Journal of Vacuum Science & Technology B: Microelectronics Processing and Phenomena. 5 (1), 318-321 (1987).
- Lee, G., Sohn, D. K., Seok, S. H., Ko, H. S. The effect of hole density variation in the PECVD reactor showerhead on the deposition of amorphous carbon layer. Vacuum. 163, 37-44 (2019).
- Fowlkes, J. D., et al. Control of catalyst particle crystallographic orientation in vertically aligned carbon nanofiber synthesis. Carbon. 44 (8), 1503-1510 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved