ניתוח אימונוהיסטוכימי מולטיפלקס של נוף תאי החיסון המרחביים של מיקרו-סביבה סרטנית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר בפירוט כיצד מתבצע אפיון תאי החיסון של המיקרו-סביבה של הגידול באמצעות אימונוהיסטוכימיה מרובה.
Abstract
נוף תאי החיסון של המיקרו-סביבה של הגידול עשוי להכיל מידע לגילוי סמנים ביולוגיים פרוגנוסטיים ומנבאים. אימונוהיסטוכימיה מולטיפלקס היא כלי רב ערך לדמיין ולזהות סוגים שונים של תאים חיסוניים ברקמות הגידול תוך שמירה על המידע המרחבי שלה. כאן אנו מספקים פרוטוקולים מפורטים לניתוח אוכלוסיות לימפוציטים, מיאלואידים ותאים דנדריטיים בקטעי רקמות. החל מחיתוך מקטעים משובצי פרפין קבועים בפורמלין, הליכי צביעת מולטיפלקס אוטומטיים על פלטפורמה אוטומטית, סריקת השקופיות במיקרוסקופ הדמיה מולטיספקטרלי, ועד ניתוח תמונות באמצעות אלגוריתם למידת מכונה שפותח בתוך החברה ImmuNet. פרוטוקולים אלה יכולים להיות מיושמים על מגוון רחב של דגימות גידול פשוט על ידי החלפת סמני הגידול כדי לנתח תאים חיסוניים בתאים שונים של הדגימה (גידול לעומת שוליים פולשניים) וליישם ניתוח השכן הקרוב ביותר. ניתוח זה אינו מוגבל לדגימות גידול, אלא יכול להיות מיושם גם על רקמות אחרות (שאינן ) פתוגניות. שיפורים בציוד ובזרימת העבודה בשנים האחרונות קיצרו באופן משמעותי את זמני התפוקה, מה שמקל על היישום העתידי של הליך זה במסגרת האבחון.
Introduction
תאי מערכת החיסון ממלאים תפקיד מכריע בהגנה מפני פתוגנים כגון וירוסים וחיידקים, אך גם מפני תאים סרטניים1. לכן, מערכת החיסון בתוך המיקרו-סביבה של הגידול (TME) טומנת בחובה הבטחה רבה לגילוי סמנים ביולוגיים פרוגנוסטיים ומנבאים2. חדירות תאי מערכת החיסון נמצאו בקורלציה לפרוגנוזה בסוגים שונים של סרטן, אם כי זה עדיין לא יושם בטיפול קליני 3,4. ברוב סוגי הגידולים, מספר גבוה של תאי T ציטוטוקסיים ותאי T עוזר 1 ו/או מספר נמוך של תאי T רגולטוריים קשורים לפרוגנוזות טובות. נמשכים המאמצים לשלב את מה שמכונה "Immunoscore" בבימוי TNM של סרטן המעי הגס, ולהפוך אותו ל-TNM-I בימוי 5,6. ה- Immunoscore נגזר מהמספר הכולל של תאי T (שזוהו עם CD3) ותאי T ציטוטוקסיים (שזוהו עם CD8) בשני אזורי גידול שונים: ליבת הגידול לעומת השוליים הפולשניים (IM) של גידולים. הדירוג החיסוני הוצע גם להיות בעל ערך פרוגנוסטי בסוגי סרטן אחרים, כגון מלנומה, סרטן ריאות וסרטן השד 6,7,8,9. יתר על כן, חדירות תאי מערכת החיסון עשויות גם להיות בקורלציה לתגובה לאימונותרפיה של חסימת נקודות ביקורת10. עם זאת, סמנים ביולוגיים מנבאים אלה חייבים להיות מאומתים במחקרים פרוספקטיביים לפני שניתן יהיה ליישם אותם באופן שגרתי בפרקטיקה קלינית. יתר על כן, הוצע גם כי סמן ביולוגי יחיד לא יספיק לחיזוי משמעותי11. לכן, יצירת מפה מלאה של דגימת חולה על ידי שילוב סמנים ביולוגיים שונים הוצעה כסמן ביולוגי מנבא מקיף יותר במה שמכונה "אימונוגרמה של סרטן"12.
בין השיטות לחקר תאי מערכת החיסון בתוך TME, הטכניקה הוותיקה והידועה ביותר היא אימונוהיסטוכימיה (IHC), המשמשת באופן שגרתי לבדיקות אבחון במספר מחלות, במיוחד סרטן13. טכניקה זו הוגבלה לשימוש בסמן אחד או רק כמה סמנים14 במשך זמן רב, ולכן התחרתה במסגרות מחקר על ידי טכניקות אחרות כגון ציטומטריית זרימה ופרופיל ביטוי גנים (GEP). עם זאת, רקמות הגידול הקבועות בפורמלין ומשובצות פרפין (FFPE) המשמשות בדרך כלל באבחון ומחקר שגרתיים אינן מתאימות (באופן אופטימלי) לציטומטריית זרימה ו- GEP. יתר על כן, למרות GEP וציטומטריית זרימה לספק הרבה תובנה על פנוטיפ התא ותפקוד, חוסר מידע מרחבי הוא חסרון גדול. לכן, הטרוגניות בתוך דגימה, כגון הבדלים באזורים שחדרו לתאי מערכת החיסון לעומת אזורים שאינם נכללים בתאי מערכת החיסון של גידול, עלולה להיעלם15. פלטפורמות חדשניות פותחו לניתוח מולטיפלקס של רקמות FFPE, כגון מולטיפלקס IHC, ציטומטריית מסה של הדמיה וזיהוי CO-Detection על ידי indEXing (CODEX) שניתן להשתמש בהן כדי לזהות סמנים מרובים בו זמנית בתוך קטערקמות 16. תאי מערכת החיסון ב-TME נחקרים באופן נרחב כדי למצוא את הסמנים הביולוגיים הטובים ביותר לאימונותרפיה. עם זאת, טכניקות מולטיפלקס וניתוח תמונה אוטומטי מציבים מכשולים משלהם.
למעבדה שלנו ניסיון רב בצביעת IHC מולטיפלקס בשיטת הגברת אותות אופל/טירמיד (TSA) והפכה זאת לאוטומטי על פלטפורמת IHC (ראה טבלת חומרים)17,18,19,20,21,22,23,24,25,26,27,28, 29,30,31. יש לנו פאנלים אופטימליים של תאי מערכת החיסון לזיהוי תת-קבוצות שונות של לימפוציטים, תאים מיאלואידים ותאים דנדריטיים (DC). רקמות המכילות אזורים צפופים של תאי מערכת החיסון - עבור לימפוציטים או מורפולוגיות מורכבות של תאים (כלומר, תאים מיאלואידים ו-DC) - מאתגרות במיוחד לניתוח, עם סיכון להערכת יתר או חסר של מספר תאי החיסון הנוכחים. כדי להתגבר על בעיה זו, תוכנת הניתוח ImmuNet פותחה על ידי קבוצה32 שלנו, וצינור למידת מכונה זה שיפר מאוד את איכות הזיהוי של סוגים שונים אלה של תאי חיסון. פרוטוקול מפורט החל מקבלת החומר FFPE ועד לניתוח צפיפות תאי החיסון בתאי רקמה שונים ומרחקים בין סוגי תאי מערכת החיסון מתואר כאן.
פרוטוקול זה מתאר כיצד מבוצעים לוחות IHC מרובים במרכז הרפואי האוניברסיטאי Radboud מאז יישום הדמיית הפתולוגיה הדיגיטלית בשנת 2022. לוחות IHC הרב-תכליתיים המתוארים יכולים לשמש עבור קרצינומות שונות (למשל, ריאות, ערמונית, מעי גס, שלפוחית השתן, שד) עם שימוש בנוגדן pan-cytokeratin כסמן גידול או עבור מלנומה עם שימוש בנוגדנים הקשורים למלנוציטים כסמנים סרטניים. פרוטוקולי IHC מרובים אלה עברו אופטימיזציה קפדנית במונחים של ריכוז נוגדנים ראשוני, שילובים פלואורופוריים ורצף הליך הצביעה. אנו ואחרים תיארנו אופטימיזציה של פאנל IHC מרובה מוקדם יותר 17,33,34,35. ניתן להתאים לוחות IHC מרובים, אך יש להעריך את צינורות הניתוח המתוארים ואולי להתאים אותם או להכשיר אותם בהתאם. פרוטוקולי IHC מרובי הצבעים המתוארים עושים שימוש בפלואורופורים של אופל Opal480, Opal520, Opal570, Opal620, Opal690, Opal780 ו- 4',6-diamidino-2-phenylindole (DAPI), כך שפירוק קל של ערבוב וסריקה מהירה במכונת ההדמיה מופעלים באמצעות "Multispectral One Touch ImmunoFluorescence" (MOTiF). צביעה וסריקה של תשעה צבעים אינן מתוארות בפרוטוקול זה מכיוון שהדבר דורש כוונון עדין עוד יותר של מערך הניסוי ומצב סריקה נוסף במכונת ההדמיה המשתמשת במסנן הגביש הנוזלי.
Protocol
חומר המטופל המוצג עבור פרוטוקול זה היה חלק ממחקר שנערך בעבר ונחשב באופן רשמי פטור מאישור אתי רפואי על ידי הוועדה האתית הרפואית המקומית Radboudumc במקביל לחקיקה ההולנדית (תיק מספר 2017-3164)30.
1. איסוף חומר FFPE, בחירת בלוקים והכנת דוגמאות
- אחזר מזהי חסימות FFPE מתיקי מטופלים באמצעות רופאים מטפלים או פתולוגים. בדוק עם התקנות המקומיות אם נדרש אישור אתי.
- בקש בלוקים של FFPE מארכיון הפתולוגיה המקומי או מבתי חולים חיצוניים.
הערה: ייתכן גם שחומר גידולי או ביופסיה נרכשים עבור מחקר מסוים. זה יכול להיות המקרה עבור ניסויים קליניים קטנים או מחקרים בבעלי חיים. במקרים אלה, עיבוד דגימת הרקמה עשוי להיות באחריות החוקר. - כאשר קיימים בלוקים מרובים של FFPE, בחרו את בלוק ה-FFPE המייצג ביותר המכיל רקמת גידול בת-קיימא, באופן מועדף עם רקמת הסטרומה שמסביב על-ידי הערכת השקופיות המוכתמות בהמטוקסילין ובאאוזין (HE) (איור 1).
הערה: מומלץ לקבל חוות דעת מומחה לבחירה זו (למשל, פתולוג). ייתכן כי HEs אינם זמינים להערכת התוכן של בלוק FFPE ויש צורך לבצע חדשים לבחירה. עבור לסעיף 2 לקבלת תיאור. - גזור סרטי FFPE בעובי 4 מיקרומטר על מיקרוטום.
הערה: העובי יכול להיות בין 1 מיקרומטר ל -6 מיקרומטר ללא השפעת כתמים מורגשת; עם זאת, 4 מיקרומטר הוא הסטנדרטי ביותר. - הרכיבו את הדגימות על שקופיות זכוכית במיקום נוח לפלואידיקה של הכתם האוטומטי (איור 2A-C) באמצעות אחת מהשיטות המתוארות להלן:
- מניחים את החלקים על פני המים המזוקקים של 40 מעלות צלזיוס באמבט מים כדי להתמתח ולהרים אותם עם מגלשת זכוכית.
או
הניחו מגלשות זכוכית על פלטת חימום בטמפרטורה של 40 מעלות צלזיוס, והקפידו לכסות את המקום שבו יש להתקין את החלק על המגלשה בטיפת מים מזוקקים. הניחו את החלק על גבי טיפה זו בעזרת מלקחיים ואפשרו לה להימתח. יש לספוג מים מזוקקים באמצעות מגבת נייר ולהסיר עודפי מים על ידי הקשה על המגלשה.
הערה: מיקום מקטעי רקמה קרוב מדי לתווית השקף יגרום לצביעה תת-אופטימלית (איור 2D,E). אנו נוטים להרכיב 6-10 שקופיות זכוכית לכל דגימה כדי לבצע את לוחות IHC המרובבים השונים וכדי לקבל גיבוי.
- מניחים את החלקים על פני המים המזוקקים של 40 מעלות צלזיוס באמבט מים כדי להתמתח ולהרים אותם עם מגלשת זכוכית.
- הניחו למגלשות הזכוכית המותקנת להתייבש ב-56°C למשך שעה אחת או למשך לילה ב-37°C.
- השתמש בשקופיות הזכוכית המותקנות לניסוי או אחסן אותן בקופסאות בטמפרטורה של 4°C.
הערה: מניסיוננו עד כה, ניתן לאחסן שקופיות מותקנות אלה במשך שנים לפני ביצוע צביעת IHC מרובה.
2. יצירת שקופיות המוכתמות בהמטוקסילין ובאאוזין
הערה: כל השלבים הבאים של סעיף 2 יבוצעו במכסה אדים.
- נטרל שקופיות בקסילן (2 x 5 דקות).
- התייבש באתנול (99.6% 1 x 5 דקות; 95% 1 x 5 דקות; 70% 1 x 2 דקות). לחלופין, טבלו את המגלשות פי 3 באתנול 99.6%.
- שטפו את המגלשות במים מזוקקים (2 דקות).
- מכתימים את הגרעינים בהמטוקסילין (10 דקות).
- שטפו את המגלשות עם H2O מזוקק (5 דקות).
- הכתימו את המגלשות עם eosin (5 דקות).
- יש לייבש את המגלשות על ידי טבילה פי 3 באתנול 99.6%.
- טובלים את המגלשות 2x בקסילן.
- מוסיפים כמה טיפות של אמצעי הרכבה ואוטמים עם כיסוי.
- תנו למגלשות להתקשות והוציאו את המגלשות ממכסה האדים כאשר כל הכימיקלים התאדו.
3. ביצוע מונופלקס ומולטיפלקס IHC ב autostainer
- חשב כמה מגיב נדרש בהתאם למספר הדגימות להיות מוכתם.
הערה: לכל ריצה, autostainer יש קיבולת של 30 שקופיות לוקח ~ 18 שעות כדי להשלים את פרוטוקול IHC multiplex עם שישה נוגדנים. כאשר יש צורך להכתים שקופיות נוספות, ניתן להכניס מספר אצוות בכל לילה בשבוע (העבודה); 4 לילות של 30 שקופיות = 120 שקופיות בשבוע.- הכינו את כל הריאגנטים הדרושים בתחילת השבוע. מערכת autostainer מפיק 150 μL של מגיב לכל שקופיות. השתמש במיכלי הטיטרציה של 6 מ"ל עבור ריאגנטים של נוגדנים ואופל ובמכלי 30 מ"ל עבור מגיב החוסם והפרוקסידז המשני של נוגדן-חזרת.
הערה: למיכלים של 6 מ"ל יש תוספות נוחות שניתן להוציא ולהחליף בקלות בעת הצורך. עם חישובי ריאגנטים, יש לקחת בחשבון את הנפח המת של 1.6 מ"ל או 300 מיקרוליטר עבור מיכל 30 מ"ל או מיכל טיטרציה 6 מ"ל, בהתאמה. - לדלל את כל פלואורופורים אופל ו digoxigenin (DIG) 1:100 ב מדלל שסופק; לדלל Opal780 1:25 בדילול נוגדנים. לדלל את כל הנוגדנים הראשוניים בדילול נוגדנים, עם דילולים המפורטים בקובץ משלים 1.
- הכינו את כל הריאגנטים הדרושים בתחילת השבוע. מערכת autostainer מפיק 150 μL של מגיב לכל שקופיות. השתמש במיכלי הטיטרציה של 6 מ"ל עבור ריאגנטים של נוגדנים ואופל ובמכלי 30 מ"ל עבור מגיב החוסם והפרוקסידז המשני של נוגדן-חזרת.
- כדי לעקוב אחר פרוטוקול זה, הפעל מונופלקס IHC (קובץ משלים 2) על שקופיות המכילות הן רקמת בקרת שקדים והן סוגים אחרים של רקמות (גידול) מעניינות לפני שתתחיל בניסוי IHC המרובב בפועל כדי לוודא שכל הריאגנטים מוכנים היטב.
הערה: Monoplex IHC לוקח ~ 3.5 שעות וניתן לבדוק לפני סוף אותו יום עבור דפוסי אות ועוצמה. אם אותות מסוימים חלשים מדי (איור 3), ניתן לבצע התאמות בריאגנטים. - לתיקון אוטופלואורסצנטיות, הכינו שקופית עם רקמה (גידולית) המכילה מבנים אוטופלואורסצנטיים, כגון דם וקולגן. הכן שקופית זו בו זמנית עם שקופיות IHC מונופלקס, אך עם מגיב חוסם המחליף את הנוגדן ואת ריאגנטים אופל (קובץ משלים 3).
הערה: באופן עקרוני, ניתן לעשות שימוש חוזר בשקופית כזו לצורך הדמיה מולטיספקטרלית עד שתיקון אוטופלואורסצנטיות אינו אופטימלי עוד. עם זאת, עם רקמות autofluorescent מאוד, כגון המוח והכבד, מומלץ להשתמש ברקמה זו עבור תיקון autofluorescence. - עם כל ריצת IHC מרובה, טען 29 דגימות למערכת autostainer עם שקופית רקמת בקרה אחת כדי לבדוק את הביצועים של כל ריצת IHC מרובה.
- הורד פרוטוקולי IHC מרובים מאתר האינטרנט של autostainer תחת הכרטיסייה הורדות והתאם אותם כך שיתאימו לכל לוח IHC מרבב מותאם אישית36. עבור IHC מרובה אולמות, ראה קובץ משלים 4 עבור הפרוטוקול ועבור לוחות IHC מרובי מרבבים מותאמים אישית, ראה קובץ משלים 1.
- לאחר השלמת פרוטוקול הצביעה, הוציאו את המגלשות מהמכתים האוטומטי והכניסו אותן למיכל עם חיץ שטיפה.
- כדי למנוע זיהום של מערכת הכתמים האוטומטיים עם DAPI מכיוון שהדגימות כבר מוכתמות בריכוזים נמוכים מאוד, יש למרוח DAPI באופן ידני לפני כיסוי השקופיות בכיסויים. יש להוסיף שתי טיפות DAPI לכל מ"ל של חיץ כביסה ולדגור במשך 5 דקות בטמפרטורת החדר בחושך.
הערה: לבניית ספריות ספקטרליות, חשוב שלא יהיה שום DAPI מוכתם בדוגמאות. טיפה אחת של DAPI לכל מ"ל של חיץ כביסה ו -10 דקות דגירה ב- RT אפשרית גם כן. - שטפו את המגלשות 3x עם מאגר כביסה.
- הניחו את השקופיות על מגבות נייר והקישו על מאגר הכביסה העודף מעל המגלשות.
- פיפט כמה טיפות של מדיום הרכבה על הרקמה.
- הניחו כיסוי זכוכית בעדינות על גבי אמצעי ההרכבה כדי לכסות את המגלשה בזווית כדי למנוע בועות אוויר.
- הסירו עודפי תווך הרכבה ובועות אוויר על ידי דחיפה עדינה של כיסוי הזכוכית בעזרת מלקחיים או קצה צינור נקי.
- השאר את השקופיות ללא הפרעה במשך ~ 24 שעות לפני שאמצעי ההרכבה מתמצק, אופקית על לוח שקופיות מיקרוסקופיה או טען אותם ישירות למיקרוסקופ להדמיה.
- לאחר התמצקות אמצעי ההרכבה או לאחר צילום השקופיות, אחסן את השקופיות בקופסאות מיקרוסקופיה בטמפרטורה של 4°C.
4. הדמיה באמצעות הדמיה פתולוגית דיגיטלית וביאור של קבצי סריקה
- הפעל את מכשיר ההדמיה על-ידי לחיצה על לחצן ההפעלה בצד ימין של המכשיר. לאחר 20 שניות לפחות, הפעל את התוכנה.
הערה: המתן 20 שניות כדי לאפשר הפעלה תקינה של החומרה. - טען את השקופיות לתוך הקלטות לכל ארבע שקופיות.
- אופציונלי: הזן את השקופיות בקובץ .csv שעבורו ניתן להוריד תבנית (קובץ משלים 5). כדי לטעון את קובץ .csv לתוכנית, שמור אותו ב- C:\Users\Public\Akoya\VectraPolaris\States.
הערה: ניתן לטעון עד 20 קלטות או 80 שקופיות בו-זמנית.
- אופציונלי: הזן את השקופיות בקובץ .csv שעבורו ניתן להוריד תבנית (קובץ משלים 5). כדי לטעון את קובץ .csv לתוכנית, שמור אותו ב- C:\Users\Public\Akoya\VectraPolaris\States.
- הגדרות הפניה
- פתחו את Check Dashboard מהתפריט הראשי.
הערה: קלטת עם שקופיות עזר מסופקת על-ידי היצרן וניתן לשמור אותה לצמיתות בחריץ 20. - הגדר את הפניות brightfield בשקופית שסופקה פעם בשבוע בהתאם להוראות היצרן (לוקח כמה דקות).
- הגדר את הפניות הפלואורסצנטיות בשקופית שסופקה פעם בחודש בהתאם להוראות היצרן (לוקח יותר משעה אחת).
- פתחו את Check Dashboard מהתפריט הראשי.
- ביצוע או התאמה של הפרוטוקול
- חזור לתפריט הראשי ולחץ על ערוך פרוטוקול כדי ליצור פרוטוקול.
- לחץ על חדש... ובחר פלואורסצנטיות כמצב הדמיה, סריקת שקופיות מולטיספקטרלית וצבע אופל פולריס 5, 6 ו- 7 תחת האפשרות צביעה.
- תן לפרוטוקול שם תחת שם פרוטוקול ושמור אותו תחת מחקר על-ידי בחירת מחקר מתוך מחקרים זמינים או צור מחקר תחת צור מחקר חדש | שם המחקר.
- סיים על-ידי בחירה באפשרות צור פרוטוקול.
- עבור סוג זה של סריקה, השתמש רק בחלון השמאלי Multispectral Slide Scan Settings; התעלם מהחלון בצד ימין של הגדרות שדה מולטיספקטרלי.
- סרוק את השקופיות בהגדלות שונות. כדי לעקוב אחר פרוטוקול זה, סרוק בהגדלה של 20x על-ידי השארת רזולוציית הפיקסלים על 0.50 מיקרומטר (20x).
- הגדר את זמני החשיפה על-ידי בחירה באפשרות חשיפות סריקה.
- טען את הקלטת שבה נשמרות השקופיות על-ידי בחירת החריץ הנכון תחת האפשרות טען מוביל .
- כדי לסייע בניווט בין השקופיות, בחרו 'קח סקירה כללית ' כדי לקבל תמונת סקירה כללית של המפעיל הסלולרי המכיל את השקופיות לאחר טעינת המפעיל. כדי להפעיל או לכבות זאת באופן אוטומטי, לחץ על סמל גלגל השיניים בפינה השמאלית העליונה, עבור אל העדפות..., וסמן את האפשרות הפעלה או כיבוי תחת תמונת סקירה של ניווט כדי להפעיל את ספק התמונה באופן אוטומטי בעת טעינה למשימות אינטראקטיביות.
- הגדר זמני חשיפה לכל מסנן בשקופיות המוכתמות במונופלקס IHC התואמות על-ידי בחירה באפשרות הגדר חשיפות סריקה ומציאת נקודות שונות עם אות חיובי. מקד באופן ידני או השתמש במיקוד אוטומטי ובחר חשיפה אוטומטית לאחר המעבר למסנן התואם עבור אות זה. בחר את זמן החשיפה הנמוך ביותר כדי למנוע חשיפת יתר וצלם תמונות של כל שקופית לעיון לאחר הגדרת כל זמני החשיפה (איור 3).
הערה: התעלם מהאפשרות הגדר חשיפות שדה עבור סוג סריקה זה. - הגדר את זמני החשיפה בשקופית מוכתמת מרובבת על-ידי בדיקת כל המסננים בכמה מיקומים עם אות חיובי. צמצם את זמן החשיפה האוטומטית הנמוך ביותר ב- 10% כדי למנוע חשיפת יתר וצלם כמה תמונות לאחר הגדרת כל זמני החשיפה.
- צלם תמונות של השקופית הלא מוכתמת לפיצוי אוטופלואורסצנטי באמצעות מסנן המיקוד האוטומטי לדוגמה כדי לנווט (איור 3H).
הערה: מקומות עם אריתרוציטים ומבני קולגן הם מעניינים. ייתכן שיהיה צורך לקצר את זמן החשיפה של מסנן Opal480 עבור אזורים אוטופלואורסצנטיים חזקים. אם האות של Opal480 חזק מספיק, עדיין יש להפריד אותו היטב (ראה סעיף 6) מהמבנים האוטופלואורסצנטיים בגלל היישום של מסנן המיקוד האוטומטי לדוגמה הקנייני. - להעריך את איכות הצביעה וההדמיה באמצעות התוכנה (ראה סעיפים 5 ו-6; איור 4, קובץ משלים 6: איור משלים S1 ואיור משלים S2).
- בחר בלחצן שמור... כדי לוודא שהפרוטוקול וזמני החשיפה המותאמים שלו נשמרים בפרוטוקול.
הערה: כאשר הפרוטוקול כבר נשמר, התוכנה לא מקבלת עד כה הודעה נוספת על התאמות שלא נשמרו.
- סריקה אוטומטית של שקופיות
- חזור לתפריט הראשי ולחץ על סרוק שקופיות כדי לסרוק את השקופיות.
- הזן באופן ידני שמות/מזהי שקופיות ומשימות ופרוטוקולים מתאימים תחת קביעת תצורה של משימות או באופן אוטומטי מקובץ .csv שנוצר בעבר באמצעות 'הגדרת טעינה'.
- לחץ על סרוק כדי להתחיל בסריקה.
- המתן עד שיופיע חלון כדי לשמור את הגדרת הסריקה. לחץ על שמור כדי להשתמש בהגדרות ברירת המחדל ולהתחיל לסרוק.
הערה: סריקה בשיטה זו אורכת ~10-20 דקות לכל שקופית. בהתאם למספר השקפים, הסריקה עשויה להימשך עד יום שלם. - בדוק אם סריקת השקופיות הצליחה עבור כל השקופיות על-ידי חיפוש הודעות שגיאה כלשהן. כדי לדעת אם הסריקה מצליחה, חפש קובץ סריקת שקופיות שלם ( .qptiff) שמור של Akoya של הסריקה ואת הרקמה המלאה בסריקה.
5. ביאור נתונים באמצעות מציג השקופיות
- חזור לתפריט הראשי ולחץ על הפעל את Phenochart כדי לפתוח את מציג השקופיות.
- אם קבצי הסריקה אינם גלויים ישירות, ציין את מיקומם על ידי לחיצה ראשונה על סמל גלגל השיניים בפינה השמאלית העליונה, עבור אל שנה מיקום דפדפן ... ובחר באופן אקראי אחד מקבצי .qptiff של מערך הנתונים המעניין.
הערה: הנתונים מאוחסנים כברירת מחדל ב- D:\Data\VectraPolaris. - טען שקופית על-ידי בחירתה ולחיצה על טען בפינה השמאלית העליונה או על-ידי לחיצה כפולה עליה.
- התחבר על ידי לחיצה על כפתור הכניסה בפינה השמאלית העליונה.
הערה: שם המשתמש יכול להיות רק ראשי התיבות או השם והוא משמש כדי לעקוב אחר מי עשה אילו ביאורים. - כדי לבצע unmixing, לחץ על Unmixing כפתור בחלק העליון ובחר את אופל + AF אופל .
הערה: פעולה זו שימושית כדי להיפטר מחלק מהאות האוטופלואורסצנטי ליד ערוץ אופל 480, אך לא מכולם. - ליצירת אלגוריתם לעיבוד הנתונים באצווה, בחרו תמונות מייצגות באמצעות האפשרות 'עבור inForm Projects 1 x 1 (גודל תמונה: 928 מיקרומטר x 696 מיקרומטר').
הערה: כמה חותמות מייצגות המכילות גידול, סטרומה, רקע וסוגים שונים של תאי חיסון נבחרות לאורך מערך הנתונים כדי להגיע ל~20-30 תמונות. - בהתאם למה שצריך לנתח ברקמה, בחר אזור עניין באמצעות האפשרות החזר השקעה ובחר עבור inForm Batch. מחק ידנית תמונות שאין צורך לנתח, כגון תמונות רחוקות מדי מהגידול או ברקע.
הערה: אנו נוטים לצייר ROI סביב הגידול כולו ולבחור תמונה אחת נוספת הרחק מאזור הגידול כדי להיות מסוגלים לנתח IM של ~ 0.5 מ"מ.
אם החזר ההשקעה המצויר קטן יחסית, החזר ההשקעה יכלול 2-9 תמונות 20x ממוזגות. מכיוון שזה לא מועדף על ידינו, החתימו ידנית את רקמת העניין (שנבחרה עבור inForm Batch) כדי לעקוף זאת. - בסיום הוספת הביאורים, אפשר לביאורים להישמר באופן אוטומטי וטען את השקופית הבאה.
- במהלך תהליך הביאור, בדוק אם השקופיות נסרקו כראוי.
- אם קובץ .qptiff חסר או שקופית לא נסרק בהצלחה, בדוק אם קיימת רקמה כלשהי בשקופית, נקה את השקופית עם 70% אתנול וסרוק שוב.
- אם הרקמה אינה נסרקת במלואה, ובכך חסר אזור שעלול להיות חשוב (גידול), או אם הסריקה של האזור החשוב לא הייתה ממוקדת, נקו את השקף עם 70% אתנול וסרקו שוב.
הערה: בשני המקרים, זה יכול גם לעזור להקיף את הרקמה עם סמן על גבי הכיסוי כדי לעזור למערכת לאתר את הרקמה ולנסות לסרוק שוב (קובץ משלים 6: איור משלים S3). בידינו, טוש אדום דק עבד טוב יותר מטוש שחור עבה.
- לאחר השלמת הסריקה והביאור של כל הדגימות, גבה את הנתונים על-ידי אחסונם במחשב אחר או בדיסק חיצוני.
6. ערבוב ספקטרלי
- פתח את התוכנה inForm Automated Image Analysis Software.
- טען את התמונות לתוכנה לפי קובץ | תמונה פתוחה; בחר קבצי qptiff. תן לחותמות, המסומנות כ - inForm Projects בשלב 5.6, להיטען לתוך הפרויקט.
- טען את קבצי ה- .qptiff המוצגים בתמונה לצורך פיצוי autofluorescence.
- כדי לפצות על אוטופלואורסצנטיות, השתמש בבחירה autofluorescence בכלי התמונה כדי לצייר קו על התמונה מהשקופית הלא מוכתמת דרך סוגים שונים של מבנים שהם אוטופלואורסצנטיים, כגון אריתרוציטים וקולגן.
- במקטע ערוך סמנים וצבעים... , הקצה שמות סמנים המתאימים לאופל פלואורופור והתאם את הצבע לצבע המועדף.
- כדי לבטל את ערבוב הפלואורופורים, בחר הכן הכל בפינה השמאלית התחתונה.
- עברו על התמונות ובדקו אם כל האותות נראים בתמונות ואם הערבוב הלך כשורה. בחר את סמל גלגל העין כדי לכבות ולהפעיל את כל הסמנים בזה אחר זה כדי לבדוק את האיכות.
- לחלופין, אמן את האלגוריתמים עבור פילוח רקמות, פילוח תאים ופנוטיפ.
- עבור אל יצוא הכרטיסייה וצור ספריית ייצוא ריקה חדשה על ידי לחיצה על לדפדף ... כפתור תחת ספריית הייצוא.
- באזור 'תמונות לייצוא:', בחרו 'תמונה ללא הפרדות צבע ותמונות רכיב' (TIFF מרובה תמונות).
- בחר קובץ | שמירה | פרויקט לשמירת האלגוריתם במיקום מסוים.
- עבור אל ניתוח אצווה הכרטיסייה אנכית בצד שמאל עבור עיבוד אצווה של שקופיות.
- בחר צור ספריות נפרדות עבור כל פריט תחת אפשרויות ייצוא.
- כדי להוסיף שקופיות לניתוח, בחר קבצי .qptiff תחת לחצן הוסף שקופיות... וטען אותם בניתוח האצווה.
- בחר הפעל כדי להתחיל את עיבוד האצווה של שקופיות.
7. ציור ROI
- צור תיקיה עם קבצי הרכיבים בלבד ממקטע 6, אך שמור על מבנה התיקיות ההירארכי ללא שינוי (קובצי הרכיבים נמצאים בתיקיות ששמן לפי דוגמה/שקופית).
- פתח את תוכנת מציג השקופיות המלאה של QuPath.
- לחץ על צור פרויקט משמאל ובחר/צור תיקיה ריקה חדשה עם שם מתאים.
- לחץ על אוטומציה ובחר הצג עורך סקריפטים.
- העתק-הדבק את הסקריפט הזמין בקובץ משלים 7. בשורה 34, שנה את המיקום למקום שבו נמצאות תיקיות השקופיות המכילות את כל קבצי הרכיבים (התיקיה שנוצרה בשלב 7.1.
- בחר הפעל וחזור עם סיום תפירת האצווה של שקופיות (למחרת או מאוחר יותר) כדי להמשיך.
- גרור את קובצי .ome.tif שנוצרו לפרוייקט QuPath ושמור אותם כפרויקט.
- כאשר חלון חדש מופיע באופן אוטומטי, בחר הגדר סוג תמונה | פלואורסצנטיות ולחץ על ייבוא.
- בתפריט משמאל, שימו לב לרשימת הדגימות; לחצו פעמיים על אחד מהם כדי לפתוח את הדגימה (איור 5A).
- כדי להתאים את עוצמת הערוצים כך שיהיו גלויים יותר, לחץ על סמל הניגודיות.
- בחרו בכל הערוצים ולחצו על 'איפוס'.
- בטל את Autofluorescence.
- כדי להתחיל לצייר החזר השקעה עבור הגידול, לחץ על סמל הניגודיות ובחר הצג גווני אפור. בחרו את ערוץ סמן הגידול וכווננו את העוצמה שלו כדי להפוך אותו לגלוי בצורה אופטימלית (איור 5B).
- לחצו על כלי המברשת כדי לצייר החזר השקעה על הגידול באופן גס.
- בעת בחירת כלי השרביט, לחץ מחוץ ל-ROI תוך לחיצה על מקש alt כדי להחליק את החזר ההשקעה מבחוץ (איור 5C).
- מיזוג חתיכות גידול מופרדות עם אותו החזר השקעה.
- תן ל- ROI שם מתאים כגון גידול על ידי לחיצה ימנית על הביאור ברשימה משמאל; בחר הגדר מאפיינים והזן את השם.
- כדי לבצע החזר השקעה עבור ההודעה המיידית, הרחב את החזר ההשקעה הקיים מאזור הגידול על-ידי בחירה: אובייקטים | ביאורים... | הרחבת ביאורים.
- בחר את גודל רדיוס ההרחבה ובחר הסר פנים ואילוץ להורה (איור 5D).
- לחץ על סמל הניגודיות, בחר בערוץ הפלואורסצנטי האוטומטי והתאם את העוצמה כדי שיהיה גלוי בצורה מיטבית.
- לחץ על השרביט והתאם את החזר ההשקעה תוך כדי לחיצה על מקש alt כדי להחליק את החזר ההשקעה מבחוץ ולהסיר כל רקע שלא אמור להיות חלק מהחזר השקעה זה.
- תן ל- ROI שם מתאים כגון שוליים פולשניים או הודעות מיידיות על-ידי לחיצה ימנית על הביאור ברשימה משמאל, בחר הגדר מאפיינים, הזן את השם ולחלופין שנה את צבעו לירוק.
- שמור את ההערות: קובץ | ייצוא אובייקטים | יצא את כל האובייקטים ולחץ על אישור עם בחירת ברירת המחדל ב - Export as FeatureCollection ושמור אותה במיקום מועדף.
8. זיהוי תאי מערכת החיסון
- מכיוון ש- ImmuNet משתמשת בנתוני רכיבים (קובצי TIFF רב-ערוציים) הן לאימון והן להסקת מסקנות, פצל ביאורים לערכות הדרכה ואימות. כדי לאמן את המודל, בצע את השלבים המתוארים בקובץ Readme של המאגר, והחליף את ערכת הנתונים והביאורים לדוגמה בנתונים הרצויים. מלבד תאים חיסוניים שונים, ספקו למודל דוגמאות שליליות על ידי ביצוע הערות רקע באתרים שאינם אמורים להיות מזוהים כתא מעניין: תאי גידול, תאים אחרים, או "ללא תאים" (מבנים שיכולים להתבלבל עם תאים מעניינים); ראה פרסום ImmuNet לפרטים32.
- באמצעות ביאורי האימות, ודא שהביצועים משביעי רצון. הסתכלו על שיעור השגיאה לכל סוג ביאור - נתח של ביאורי אימות שהמודל לא זיהה - מדד ההערכה הפשוט ביותר. הערך את הביצועים ביחס לתוצאות חיוביות שגויות על ידי ביצוע מספר החזרי השקעה עם הערות מלאות וחישוב ציוני F.
- בנוסף להערכה כמותית, בדקו ויזואלית את החיזוי כדי לקבל תחושה איכותית של הטעויות שהמודל נוטה לעשות (איור 6, קובץ משלים 6: איור משלים S4, ואיור משלים S5). אם ביצועי המודל אינם מספיקים, הצג באופן חזותי את החיזוי עבור אריחים מסוימים כמתואר במאגר ובדוק אילו אתרים הם המועדים ביותר לשגיאות. הוסף ביאורים נוספים באתרים כאלה והפעל מחדש הדרכה והערכה של מודלים.
- כאשר ביצועי היעד מושגים, הפעל את ההסקה עבור ערכת הנתונים כולה כמתואר בסעיף היסק עבור ערכת הנתונים כולה של קובץ ה- Readme של המאגר. השתמש בקבצי .csv המתקבלים עם חיזוי המודל כקלט לניתוח נתונים (כתוב סקריפט Python או R לשם כך).
9. חיזוי פנוטיפ וניתוח נתונים
הערה: בחלק זה, אנו נותנים דוגמה לניתוח נתונים פשוט עבור דגימת מלנומה יחידה המוכתמת בלוח הלימפוציטים, המשלבת את מיקומם של תאי מערכת החיסון שזוהו על ידי ImmuNet (סעיף 8) והחזר השקעה המסומן באמצעות QuPath (סעיף 7). הניתוח בוצע ב-R 4.1.1 (סקריפט מסופק כקובץ משלים 8). הסקריפט דורש את החבילות: plyr 1.8.8, dplyr 1.0.8, tidyr 1.2.0, sf 1.0-7, ggplot2 3.4.0, RANN 2.6.1 ו- RColorBrewer 1.1-2, שניתן להתקין באמצעות הפקודה install.packages(). כקלט, הוא לוקח קובץ .csv עם החיזוי של ImmuNet של מדגם וקובץ עם החזר השקעה המיוצא מ- QuPath. שלבים 9.1-9.6 מתארים ניתוח של דגימה בודדת המבוצעת בסקריפט שסופק, וסעיפים 9.7-9.9 מתארים אפשרויות לניתוח של דגימות מרובות.
- לאחר טעינת החיזוי של ImmuNet ל-R, קבעו את ערכי הסף לביטוי סמן חזוי על ידי התוויית הסמנים המגדירים פנוטיפים זה מול זה ובחירת הספים המפרידים בין האוכלוסיות בצורה הטובה ביותר.
הערה: אסטרטגיית ה-gating שבה נעשה שימוש עבור המדגם הנתון מוצגת באיור 7B. אסטרטגיות Gating עבור לוחות התאים המיאלואידים והדנדריטיים מוצגות בקובץ משלים 6: איור משלים S6 ואיור משלים S7. - לאחר קביעת הספים, השתמש בהם כדי להקצות לכל חיזוי ImmuNet פנוטיפ המוגדר בחלונית. בחלק מהתחזיות, שימו לב שאף אחד מהסמנים החזויים אינו מעל הסף או שהשילוב של סמנים הנחשבים למבוטא לאחר הסף עשוי להיות לא עקבי (למשל, תחזיות CD3+ CD20+ בלוחות הלימפוציטים). אם ביצועי מודל טובים יושגו בשלב 8.3, החלק החלקי של תחזיות כאלה יהיה קטן; סנן אותם לפני הניתוח.
- כדי לנתח בנפרד את החזר ההשקעה עבור הגידול ואת השוליים הפולשניים שלו עד 100 מיקרומטר המשורטטים ב- QuPath, טען את קבצי GeoJSON המתאימים ב- R, ועבור כל תחזית, קבע את החזר ההשקעה שלתוכו נופלת החיזוי.
- לצורך בדיקת שפיות וכחלק מניתוח נתוני הגישוש, דמיינו את תאי החיסון שנמצאים בדגימה בנפרד ב-ROI המתאים יחד עם גבולות החזר ההשקעה (איור 7A).
- כעת, חשבו בנפרד את הצפיפויות של תאי חיסון שונים עבור כל החזר השקעה. הצפיפויות שנמצאו במדגם הנתון מוצגות בטבלה 1.
- אם קיימות דוגמאות מרובות, הצג באופן חזותי את התפלגות צפיפות התא. המר את ערכי הצפיפות ביומן, כדי להשיג ערכים מבוזרים בדרך כלל.
הערה: כאשר ספירות של פנוטיפים מסוימים הן 0, לא ניתן להמיר אותם ביומן, מה שמוביל לערכים חסרים. כדי להתגבר על בעיה זו, ניתן ליישם החלקה LaPlacian על ידי הוספת 0.5 לכל ספירות התאים תחילה לפני חלוקה בשטח הפנים. - נתחו את ערכי הצפיפות ושרטטו אותם באמצעות התוכנה שבחרתם (איור 8).
- מיקומים שהשתמרו של תאים מאפשרים ניתוח מרחבי. לדוגמה, עבור כל תא חיסוני שזוהה, מצא את השכן הקרוב ביותר, ולאחר מכן עבור כל פנוטיפ, חשב את אחוז המקרים שבהם הפנוטיפים השונים מתרחשים כשכן הקרוב ביותר.
הערה: מאחר שמספר תאי ההרג הטבעי (NK) שנמצאו בדגימה זו היה קטן מאוד, הוצאנו אותם מניתוח זה. התוצאות המתקבלות עבור החזר השקעה על גידולים והודעות מיידיות מוצגות באיור 9.
Representative Results
בלוקים מסוג FFPE המכילים רקמת גידול נבחרו על בסיס דוחות פתולוגיים ושקופיות מוכתמות HE. כאשר נגעים סרטניים מרובים מנותחים מהמטופל ו / או דגימות הגידול גדולות, אלה מחולקים על פני בלוקים FFPE מרובים. אנו מעדיפים לנתח תאי חיסון הן בתא הגידול והן במה שמכונה השוליים הפולשניים (IM) של הגידול. IM היא רקמת סטרומה לא סרטנית הצמודה לגידול. לכן, כאשר ישנם בלוקי FFPE מרובים הזמינים עבור דגימת גידול אחת, בלוקי FFPE המכילים את שני סוגי הרקמה נבחרים. כפי שניתן לראות בשקופיות המוכתמות ב-HE, גוש FFPE אחד הכיל רקמת גידול ורקמת סטרומה הסמוכה לגידול (איור 1A). גוש FFPE נוסף מאותו גידול הכיל הרבה פחות רקמת סטרומה מסביב (איור 1B). עם זאת, עבור דגימות רקמה מסוימות אין ברירה בלוקים FFPE או IM אינו קיים באף אחד בלוקים FFPE. זה קורה לעתים קרובות עבור ביופסיות (מחט), אשר יש לזכור במהלך פענוח נתונים.
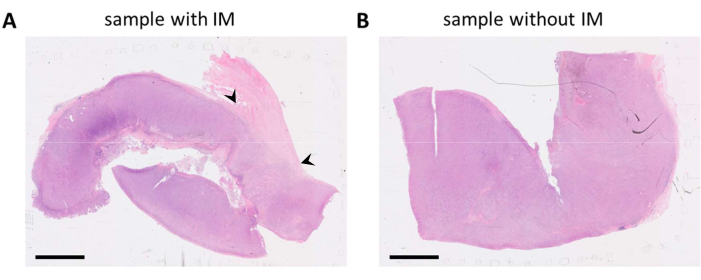
איור 1: שקופיות מוכתמות HE, של דגימת גידול מלנומה. (A) דוגמה לדגימת גידול עם רקמת סטרומה צמודה לגידול (IM) בפינה הימנית העליונה של הדגימה (מסומנת בראשי חץ שחורים). (B) דגימה נוספת מאותו נגע גידולי עם מעט או ללא רקמת סטרומה בדגימה. מוטות קנה מידה = 5 מ"מ. קיצורים: HE = hematoxylin ו eosin; IM = שוליים פולשניים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
צביעת IHC מולטיפלקס עם לוח מוצע בעל שבעה צבעים (קובץ משלים 4) יכולה להתבצע באופן ידני בתהליך צביעה של 3 ימים (בהתחשב בשעות העבודה הרגילות) או לילה במכתים אוטומטי. בעת השימוש במכתים האוטומטיים, יש להרכיב מקטעים במיקום מסוים במגלשת הזכוכית המאפשר זרימה אופטימלית של המערכת (איור 2A). כאשר מקטעים מורכבים כראוי על שקופיות (איור 2B), הם יהיו מוכתמים באופן שווה (איור 2C). אם מקטעים אינם מורכבים בצורה אופטימלית על מגלשת הזכוכית (איור 2D), התוצאה היא לעתים קרובות דפוס צביעה תת-אופטימלי (איור 2E) מאחר שהפלואידיקה של הכתם האוטומטי אינה מגיעה לרקמה (השלמה). מצב זה עשוי להתרחש כאשר הדגימות גדולות מאוד, או כאשר שקופיות מותקנות מסופקות על-ידי מישהו שאינו מודע לבעיה זו. במקרים אלה, יש לבחור רק את החלק המוכתם היטב של השקופית לניתוח. בחירה נוספת עבור סוגים אלה של דגימות יכולה להיות להכתים אותם באופן ידני כדי לפזר את הנוזלים בצורה אופטימלית.
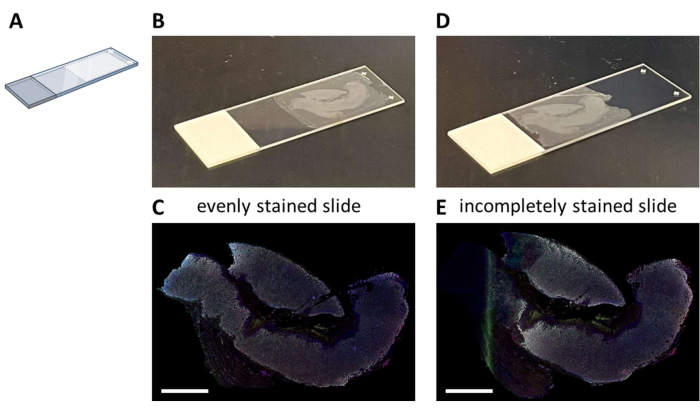
איור 2: הרכבה של מקטע ה-FFPE על מגלשת הזכוכית והפגיעה. (A) סכמה של היכן להרכיב על מגלשת הזכוכית לקבלת צביעה אופטימלית על הכתם האוטומטי. (B) דוגמה לשקופית שהורכבה כהלכה. (C) מגלשות שהורכבו כהלכה גורמות למקטע רקמה מוכתם באופן שווה. (D) דוגמה לשקופית מותקנת לא אופטימלית. (E) שקופיות המותקנות בצורה לא אופטימלית עלולות לגרום למקטע רקמה מוכתם לא שלם כפי שניתן לראות בצד שמאל של תמונה זו. מוטות קנה מידה = 5 מ"מ. קיצור: FFPE = פורמלין-קבוע ופרפין מוטבע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כאשר ניסויי IHC מולטיפלקס גדולים מבוצעים בסבבי צביעה מרובים ויש צורך להכין כמויות גדולות של תמיסות, עדיף לבדוק תחילה ריאגנטים אלה בריצת IHC מונופלקס לפני שממשיכים למולטיפלקס IHC. Monoplex IHC נבדק באמצעות ההדמיה הפתולוגית הדיגיטלית עבור דפוסי צביעה צפויים, וזמני החשיפה נקבעים עם המסננים המתאימים בשקופיות הבקרה (איור 3A-H). רקמת השקדים משמשת כבקרה חיובית עבור רוב הסמנים של תאי החיסון. מאחר שזמן החשיפה ל-DAPI ברקמת הבקרה של השקדים תמיד גבוה יותר מאשר ברקמות אחרות (איור 3G), יש להגדיר את זמן החשיפה ל-DAPI לפי סוג הרקמה שיש לחקור. זמני החשיפה הקבועים בסריקה מסוג זה הם בין אלפית שנייה אחת ל-30 אלפיות השנייה, כתלות בפלואורופור ובמסנן (איור 3I). כאשר מונופלקס IHC עולה על מספרים אלה או דפוס הצביעה אינו ברור כצפוי, יש להתאים או להחליף את תמיסת הנוגדנים. בדוגמה שמוצגת כאן, החלטנו להגדיל את הריכוז של FOXP3 (איור 3C ואיור 3I) כדי שהעוצמה תהיה יותר בטווח עם הסמנים האחרים. Autofluorescence עשוי גם להיות חזק יותר ברקמות אחרות מאשר ברקמת בקרת שקדים. בהגדרה שלנו, זמן החשיפה של מסנן המיקוד האוטומטי לדוגמה הוא בין 25 אלפיות השנייה ל-50 אלפיות השנייה (איור 3H,I).

איור 3: קביעת זמני חשיפה על מונופלקס IHC ודגימות בקרה לא מוכתמות. (A) CD20 - אות אופל 480 ברקמת בקרת שקדים. (B) CD3 - אות אופל 520 ברקמת בקרת שקדים. (C) FOXP3 - אות אופל 570 ברקמת בקרת שקדים. (D) CD56 - אות אופל 620 ברקמת בקרת שקדים (E) CD8 - אות אופל 690 ברקמת בקרת שקדים. (F) סמן גידול - אות אופל 780 ברקמת בקרת שקדים. (G) אות DAPI ברקמת בקרת שקדים הוא לעתים קרובות חלש יותר מסוג הרקמה של עניין. (H) Autofluorescence - אות מיקוד אוטומטי לדוגמה ברקמת בקרת גידול. (I) צילום מסך של זמני החשיפה לפני התאמתו ל-10% ובדיקת שקופיות מוכתמות ב-IHC מרובי אולמות. פסי קנה מידה = 100 מיקרומטר. קיצורים: AF = autofluorescence; IHC = אימונוהיסטוכימיה; DAPI = 4'6-diamidino-2-phenylindol. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לאחר ביצוע המולטיפלקס IHC, זמני החשיפה מותאמים מהגדרות המונופלקס IHC על ידי בדיקת מספר שקופיות IHC מרובות ובחירה בחשיפה אוטומטית. בסריקה מסוג זה אין אפשרות להגנה מפני רוויה ולכן חשוב מאוד להימנע מהגדרת חשיפה גבוהה מדי, ובכך להימנע מחשיפת יתר. חשיפת יתר מעכבת את הערבוב הספקטרלי של הפלואורופורים. לעתים קרובות איננו קובעים זמני חשיפה החורגים מזמני החשיפה שהתבססו על IHC המונופלקס, ואנו רק מפחיתים את זמני החשיפה עבור סמנים חזקים יותר במולטיפלקס IHC (איור 3G ואיור 4A). על ידי חשיפה אוטומטית במיקומים שונים בכמה שקופיות, ניתן לראות שזמני החשיפה של כמה מסננים עדיין גבוהים מדי. יש להתאים אותם למספר הנמוך ביותר שנצפה בעת שימוש בהגדרת החשיפה האוטומטית, ולהחסיר עוד 10% מהערך כדי למנוע חשיפת יתר במקומות בלתי נראים אחרים (איור 4A). בשיטה זו, זמני החשיפה יכולים להיות נמוכים יותר עבור מסננים מסוימים מאשר אלה שנקבעו על מונופלקס IHC. עם זאת, בניסוי IHC מולטיפלקס מוצלח, כל הסמנים צריכים להיות ניתנים לצפייה, לפחות בשקופית הבקרה (איור 4B-H, קובץ משלים 6: איור משלים S1, ואיור משלים S2). קחו בחשבון שייתכן שסמנים מסוימים לא יהיו נוכחים בכל דגימה. על ידי הכללת שקופית בקרה המכילה לפחות קטע שקדים, ניתן לאמת צביעה מוצלחת של כל הסמנים של הלוחות הסטנדרטיים ועוצמת האות.
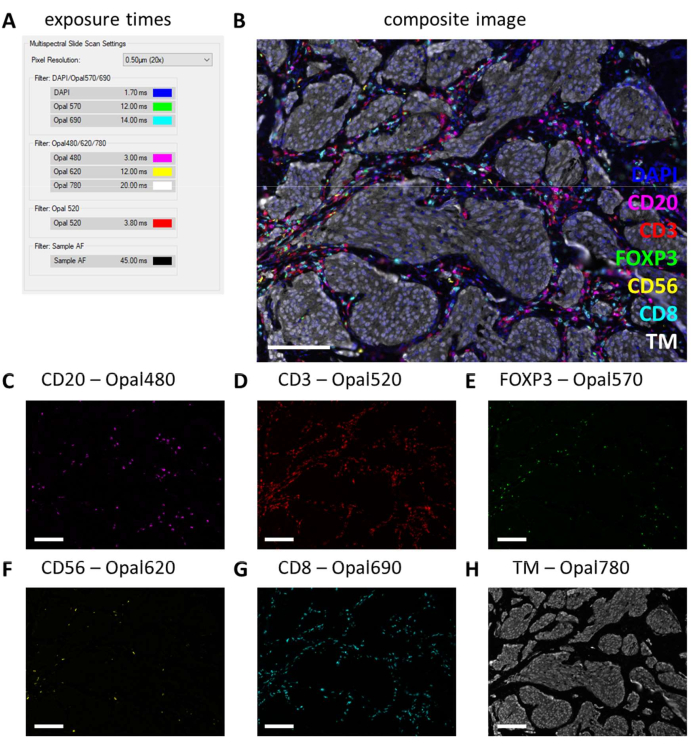
איור 4: דוגמה של קטע מוכתם בהצלחה עם פאנל הלימפוציטים בדגימה של גידול מלנומה. (A) זמני חשיפה המשמשים לרישום דגימת IHC מרובת משתתפים זו. (B) תמונה מורכבת של פאנל לימפוציטים IHC מרובה בתוך רקמת הגידול. (C) CD20 - אות אופל 480 במגנטה. (D) CD3 - אות אופל 520 באדום. (E) FOXP3 - אות אופל 570 בירוק. (F) CD56 - אות אופל 620 בצהוב. (G) CD8 - אות אופל 690 בציאן. (H) TM - אופל 780 בלבן. פסי קנה מידה = 100 מיקרומטר. קיצור: TM = סמן גידול; IHC = אימונוהיסטוכימיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
שקופיות IHC מרובות נסרקות במלואן על ידי מכונת הצילום הדיגיטלית. אריחים לניתוח הבא נבחרים במציג השקופיות. עם זאת, כאשר יש צורך לנתח אזורים ספציפיים יותר, כגון גידול לעומת IM, ניתן לשרטט אזורי עניין אלה (ROIs) באמצעות QuPath. לאחר השלמת עיבוד אצווה של האריחים שנבחרו במציג השקופיות, קובצי רכיבים מתמזגים בחזרה יחד (איור 5A וקובץ משלים 7). באמצעות תעלת סמן הגידול (איור 5B) וכלי שרביט הקסמים ב-QuPath, ניתן לעקוב אחר קווי המתאר של הגידול כדי ליצור את "החזר ההשקעה על הגידול" (איור 5C). לאחר מכן, ניתן להרחיב את החזר ההשקעה על הגידול במרחק מסוים, במקרה זה, 500 מיקרומטר, כדי ליצור "החזר השקעה פולשני על שוליים" (איור 5D). כל רקע לא רצוי (שאינו רקמה) מוסר מהחזר ההשקעה הזה באמצעות כלי שרביט הקסמים על-ידי התבוננות באות האוטופלואורסצנטי (איור 5E). גם Tumor ROI וגם IM ROI נשמרים כקובץ GeoJSON לעיבוד נוסף (איור 5F).
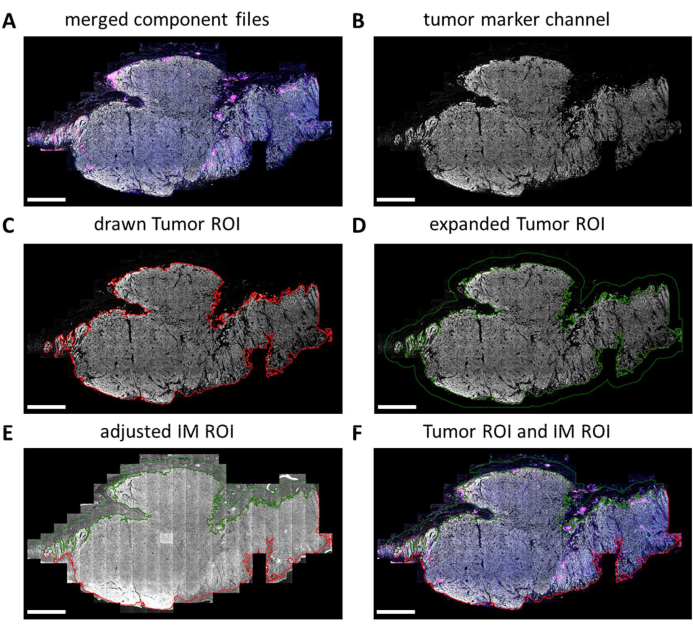
איור 5: החזר השקעה על הגידול ותהליך ציור ROI פולשני בשוליים ב- QuPath. (A) קובצי רכיבים ממוזגים. (B) תמונה בגווני אפור המציגה רק את ערוץ סמן הגידול. (C) החזר ההשקעה של הגידול נמשך סביב אות סמן הגידול. (D) החזר השקעה חדש נעשה על ידי הרחבת החזר ההשקעה על הגידול ב-100-500 מיקרומטר כדי ליצור את החזר ההשקעה של IM. (E) החזר ההשקעה של IM מותאם כך שיכלול רק רקמת סטרומה על ידי אי הכללת רקע (אות שלילי) ומבני רקמות גדולים אחרים כגון שומן, כלי דם וזקיקי שיער. (F) החזר ההשקעה על הגידול שנוצר והחזר ההשקעה על IM נשמרים ומיוצאים לקובצי GeoJSON לעיבוד נוסף של האזורים. החזר ההשקעה על הגידול מוצג עם קו מתאר אדום והחזר ההשקעה של IM מוצג עם קו מתאר ירוק. פסי קנה מידה = 2 מ"מ. קיצורים: החזר השקעה = אזור עניין; IM = שוליים פולשניים; GeoJSON = סימון אובייקט JavaScript גיאוגרפי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ניתן להשתמש ברשתות ImmuNet כדי לזהות תאים חיסוניים. עבור פאנל הלימפוציטים, התמונה הניסיונית המורכבת (איור 6A) יכולה להיות מושווה באופן חזותי עם תאי החיסון שזוהו על-ידי התוכנה (איור 6B). ניתן לערוך השוואות חזותיות דומות עבור הפאנל המיאלואידי (קובץ משלים 6: איור משלים S4) ופאנל התא הדנדריטי (קובץ משלים 6: איור משלים S5).
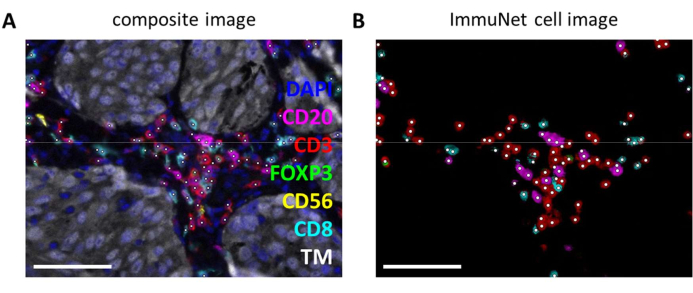
איור 6: לימפוציטים שזוהו על-ידי ImmuNet. (A) תמונה מורכבת של איור 4B שמראה תאים שזוהו על-ידי ImmuNet עם נקודות לבנות. (B) תאים שזוהו על-ידי ImmuNet וביטוי סמן שזוהה לאחר מכן. פסי קנה מידה = 50 מיקרומטר. קיצור: TM = סמן גידול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תאי חיסון שזוהו על ידי ImmuNet ונשמרו בפורמט .csv ניתנים לייבוא לכל שפת תכנות לצורך ניתוח נוסף. ביצענו הדמיה מרחבית וגאטינג ב-R (קובץ משלים 8). לאחר מכן ניתן לבצע הדמיה מרחבית של התאים שזוהו (איור 7A, קובץ משלים 6: איור משלים S6 ואיור משלים S7). ניתן לבצע Gating על ביטוי פסאודו-סמנים כדי לבצע פנוטיפ של תאי החיסון הבודדים (איור 7B).
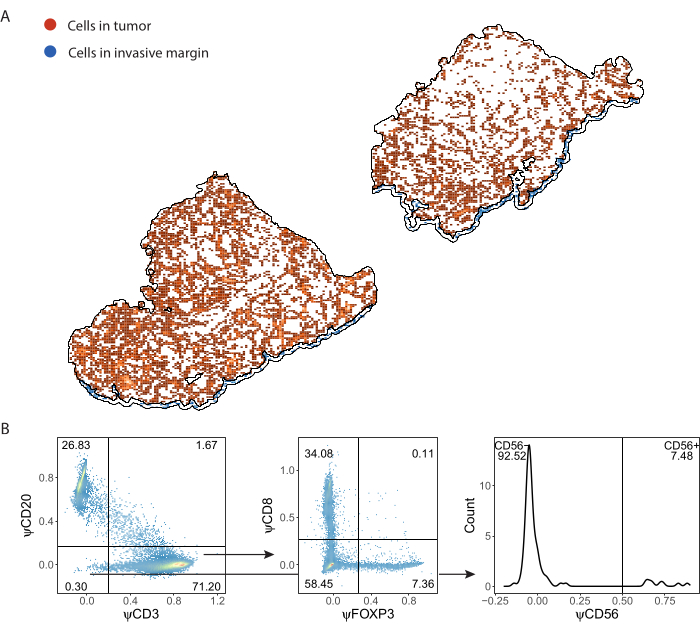
איור 7: אסטרטגיית Gating של פאנל לימפוציטים. (A) תאי מערכת החיסון שזוהו באזורי עניין של גידולים ושוליים פולשניים המסומנים ב-QuPath. (B) Gating של כל התאים שזוהו על ידי ImmuNet מחלק A. לימפוציטים מגודרים תחילה על תאי CD20+ B ותאי T CD3+. תאי T CD3+ מגודרים עוד יותר עבור ביטוי CD8 ו- FOXP3. אוכלוסיית CD20-CD3 מגודרת עבור תאי הרג טבעיים CD56+. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כאשר הפנוטיפים של התאים החזויים נקבעים באמצעות גטינג, ניתן לחשב את צפיפות התאים של פנוטיפים שונים בתוך ROI שונים. זה מחושב על ידי חלוקת המספר הכולל של תאים לכל פנוטיפ בשטח הפנים של החזר ההשקעה (טבלה 1, איור 8 וקובץ משלים 8). כאן, תאי B מוגדרים כ- CD3-CD20+, תאי T מסייעים כ- CD3+CD20-CD8-FoxP3-, תאי T רגולטוריים כ- CD3+CD20-CD8-FoxP3+, תאי T ציטוטוקסיים כ- CD3+CD20-CD8+FoxP3-, ותאי NK כ- CD3-CD20-CD56+.
| פנוטייפ | צפיפות הגידול (תאים/מ"מ2) | צפיפות בהודעות מיידיות (תאים/מ"מ2) |
| תא B | 185.74 | 145.62 |
| תא T עוזר | 301.46 | 157.51 |
| תא T תקינה | 38.53 | 19.53 |
| תא T ציטוטוקסי | 185.35 | 83.21 |
| תא NK | 0.18 | 0 |
טבלה 1: צפיפויות של פנוטיפים בהחזר השקעה. צפיפויות של תאים של פנוטיפים שונים שנמצאו בדגימת מלנומה אחת מוכתמת בלוח הלימפוציטים. הצפיפויות מחושבות בנפרד ב- Tumor ו- IM ROIs. קיצורים: IM = שוליים פולשניים; ROI = אזור עניין.
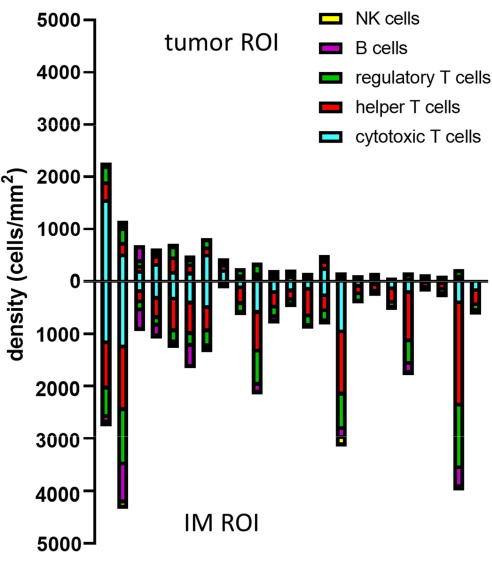
איור 8: דוגמה לניתוח נתונים עבור דגימות מרובות. ניתוח צפיפות של פנוטיפים לימפוציטים שונים בגידול ו- IM של 23 גידולי מלנומה ראשוניים. קיצורים: IM = שוליים פולשניים; ROI = אזור עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לצלול יותר לתוך המידע המרחבי של תאי החיסון האלה, אפשר גם לקבוע מרחקים בין פנוטיפים מזוהים או אחוזים של פנוטיפים של שכנים קרובים בדגימה (איור 9).
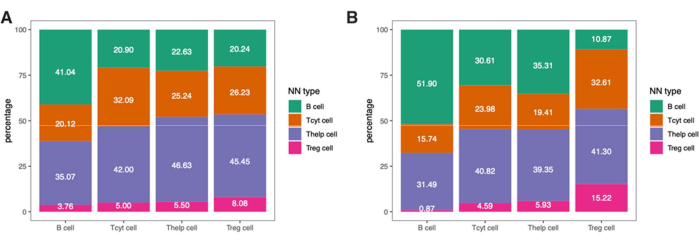
איור 9: דוגמה לניתוח השכן הקרוב ביותר עבור מדגם יחיד. אחוז הפנוטיפים של השכנים הקרובים ביותר עבור סוגי תאים שונים ב-(A) Tumor ו-(B) IM ROIs שנמצאו בדגימת מלנומה יחידה המוכתמת בלוח הלימפוציטים. קיצורים: IM = שוליים פולשניים; ROI = אזור עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
קובץ משלים 1: Multiplex IHC המסכם את מפרט הפרוטוקול. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: פרוטוקול Autostainer עבור monoplex. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: פרוטוקול Autostainer לפיצוי autofluorescence. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 4: פרוטוקול Autostainer לאימונוהיסטוכימיה מרובה. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 5: קובץ .csv תבנית. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 6: לוחות תאים מיאלואידים ודנדריטיים בדגימת רקמת מלנומה; סימון שקופיות במקרה של כשל בסריקה; תאים מיאלואידים ודנדריטיים המוכרים על ידי ImmuNet; אסטרטגיות gating של לוחות תאים מיאלואידים ודנדריטיים. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 7: סקריפט תפר QuPath. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 8: סקריפט ניתוח נתונים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ניתוח מרחבי של TME הוא טכניקה מבוקשת כדי ללמוד יותר על תא תאי החיסון ולגלות סמנים ביולוגיים פרוגנוסטיים ומנבאים חדשים, במיוחד בתחום האימונו-אונקולוגיה16. טכניקות רבות ושונות מפותחות למטרה זו, הכוללות זיהוי חלבונים, תעתיקי mRNA, או שילוב של השניים, עם הערכות של עד 100-1,000 מטרות. עם זאת, ריבוב גבוה יותר מגיע במחיר של ניסויים בעלי תפוקה נמוכה יותר, עלויות ניסוי גבוהות יותר ואתגרים טכניים, ולעתים קרובות ניתן לנתח רק חלק קטן מה-TME. Multiplex IHC בשיטה מבוססת TSA שאנו מתארים כאן, מזהה שישה סמנים שונים + DAPI בו זמנית, הוא יחסית זול יותר לביצוע, ומקטעי רקמות שלמים מצולמים תוך פחות מ -20 דקות, מוכנים לניתוח מלא. טכניקה זו הפכה פחות מורכבת עם אוטומציה של הליך הצביעה. שיפורים במיקרוסקופ המולטיספקטרלי, הכוללים תוספת של שני מסננים נוספים, שיפרו מאוד את זמני הערבוב והסריקה הספקטרליים. ניתן לזהות עד שמונה סמנים שונים + DAPI בו זמנית. עם זאת, על ידי הרחבת המרבב עם יותר סמנים, היתרונות הנ"ל נעלמים ככל שהערבוב הספקטרלי הופך למאתגר יותר וזמני הסריקה של שקופיות שלמות גדלים באופן משמעותי. נעשים מאמצים לתקנן IHC מולטיפלקס בין מוסדות שונים כדי להקל על היישום בהגדרת האבחון ביתר קלות. עבור סטנדרטיזציה זו של IHC מולטיפלקס, אנו ממליצים למשתמשים לדבוק בפרוטוקול נגיש יותר עם שישה סמנים שונים + DAPI. עם זאת, עדיין יש צורך בידע טכני לא מבוטל וניתוח במורד הזרם יכול להיות מאתגר, עבורו פיתחנו מתודולוגיות המתוארות בפרוטוקול זה.
התקינה מתחילה בפיתוח פאנל IHC מרובה אולמות. חשיבות הבחירה של נוגדנים ראשוניים המזהים מטרות חלבון מסוימות הודגשה לפניגיל 17. לוחות IHC המולטיפלקס שלנו מפותחים בעיקר עם שיבוטים ראשוניים של נוגדנים המשמשים ומאומתים גם עבור IHC במחלקת האבחון שלנו. עם זאת, במקרה של פאנל IHC מרובה תאים דנדריטיים, רוב הנוגדנים לא שימשו במסגרת האבחון (Van der Hoorn et al., כתב יד בהגשה). כדי להבטיח ספציפיות ולמזער את הבדלי האצווה, בחרנו להשתמש בנוגדנים חד-שבטיים על פני נוגדנים רב-שבטיים וגם תיקפנו את רוב הנוגדנים באמצעות קווי תאים נגועים ותאים ראשוניים. במהלך השנים נעשה שימוש בגרסאות שונות של לוחות IHC מרובי אולמות במחקרים רבים באמצעות מערכת Vectra 3 18,21,23,24,25,26,27,28,29,30,31,32. כדי ליישם לוחות IHC מרובים אלה בצורה אופטימלית על מערכת PhenoImager HT, היה צורך לבצע התאמות מסוימות בשילובי נוגדנים ראשוניים ופלואורופורים. כדי ליהנות מפירוק ספקטרלי טוב יותר וזמני סריקה מהירים יותר של חלקי רקמות שלמות, יש צורך ביישום הפלואורופורים העדכניים ביותר של Opal480 ו-Opal780 והימנעות משימוש בפלואורופורים של Opal540 ו-Opal650 בלוחות IHC מרובי צבעים בעלי שבעה צבעים. זמני הסריקה מהירים פי 3-10 בהתאם לגודל קטע הרקמה. התאמות פאנל IHC מרובות היו די קלות להשגה, אך יש לזכור כמה שיקולים. הספקטרום הפלואורסצנטי של Opal480 חופף הרבה עם ספקטרום אוטופלואורסצנטי ולכן, מפריע לערבוב ספקטרלי של אריתרוציטים ומבנים אוטופלואורסצנטיים אחרים. שימוש בריכוז מוגבר של הנוגדן הראשוני בשילוב עם Opal480 פתר בעיה זו ברוב המקרים. היישום של מסנן המיקוד האוטומטי לדוגמה הקנייני על PhenoImager HT מקל על ביטול הערבוב של Opal480 ו autofluorescence. עם זאת, עדיף להשתמש בנוגדן ראשוני המניב אות ברור בעת שימוש עם Opal480, כך שהאות שלו גבוה יותר מאשר autofluorescence.
למרות שלוחות IHC מרובים אלה מבוססים, וריאציה מאצווה לאצווה היא משהו שצריך לקחת בחשבון. על ידי ביצוע בקרות מונופלקס IHC לפני תחילת ניסוי IHC המרובב המלא, ראינו לפעמים כי נוגדנים ראשוניים מתפקדים חזקים או חלשים יותר מניסוי לניסוי. הסיבות לכך יכולות להיות טעויות צנרת, תנאי אחסון ריאגנטים לא אופטימליים וחיי מדף. פתרנו זאת על ידי התאמת תמיסת הנוגדנים הראשונית על סמך הניסיון שלנו. גם כאשר לא היה צורך לבצע אף אחת מההתאמות הנ"ל, בכל ניסוי אצווה של IHC מולטיפלקס, חשוב לקבוע זמני חשיפה בהתבסס על שקופיות בקרה מוכתמות במונופלקס IHC.
מכיוון שהמחקר שלנו התמקד בתחילה בסוגים שונים של קרצינומה ומלנומה, לוחות IHC מרובים נדרשו להיות ניתנים להחלפה בין סוגי גידולים עם התאמות מינימליות. לכן, תמיד כללנו סוגים מרובים של רקמות (גידולים) בתהליך האופטימיזציה וראינו כי דילול נוגדנים ראשוניים לסמנים של תאי מערכת החיסון יכול להישמר דומה בין סוגי גידולים שונים. עם זאת, גילוי רקמת הגידול בין קרצינומה למלנומה דורש סמני גידול שונים. בהתאם לכך, סמן הגידול תמיד הותאם לעבודה בסוף כל פאנל IHC מולטיפלקס וכיום משמש תמיד בשילוב עם אופל780, שבמקרה גם צריך להיות בפלואורופור האחרון בהליך צביעת IHC מולטיפלקס. על ידי שימוש בסמן הגידול בסוף המולטיפלקס IHC, לוחות IHC מרובים אלה יכולים להיות מוחלפים בקלות עבור סוגי גידולים אחרים, כגון גליובלסטומה (כלומר, GFAP) ולימפומה הודג'קין (כלומר, CD30). עבור אנגיוסרקומה, השתמשנו בפאנל IHC מרובה לימפוציטים זה עם גן הקשור לטרנספורמציה אריתרובלסטית ספציפית (ERG) כסמן הגידול עם שני ניסויי אופטימיזציה בלבד25. האופטימיזציה כללה טיטרציה של הנוגדן הראשוני ERG ובדיקת פאנל IHC מולטיפלקס עם ERG בקצהו.
התאמות אחרות ללוחות IHC מרובים אלה יכולות להתבצע גם על ידי החלפת סמן תאי חיסון מסוים בסמן חיסוני או פונקציונלי אחר. כל שינוי דורש אופטימיזציה. ניתן לעקוב אחר פרוטוקול האופטימיזציה כמתואר קודם17. שינויים מסוימים בלוחות IHC המרובבים המוצעים יפריעו לאלגוריתמים של ImmuNet שיצרנו. יש להפיק מספיק נתונים ולהקדיש זמן להטמעת שינויים אלה באלגוריתם (לפחות 750 ביאורים לכל סמן חדש ו/או פנוטיפים של תאים, ו-150 ביאורים לאימות סמנים שאומנו בעבר). הפאנלים המוצגים כאן אינם מכילים סמנים פונקציונליים, אם כי הטמעת סמני בקרה חיסונית כגון PD-1 ו- PD-L1 בלוחות IHC מרובים מתבצעת במעבדה שלנו. עם זאת, ניתוח סמנים שהם פחות בינאריים באותות שליליים וחיוביים הוכח כקשה יותר והוא תחום מחקר פעיל בקבוצה שלנו.
מספר הסמנים שניתן להעריך בו זמנית עם IHC מולטיפלקס מוגבל בהשוואה לטכניקות חדשניות אחרות. בעוד שניתן לעקוף זאת על ידי ניתוח לוחות שונים על פרוסות עוקבות של גוש FFPE, יהיה קשה להשוות פרוסות אלה באופן מרחבי. סביר להניח שהכיוון והממצאים המקופלים אינם זהים לאחר הכנת השקופית. עם זאת, מולטיפלקס IHC נגיש למדי, מה שהופך אותו לכלי אטרקטיבי עבור מוסדות וחוקרים נוספים ולכן מתאים יותר ליישום עתידי במסגרת אבחון. עם הסטנדרטיזציה של לוחות תאי חיסון IHC מרובים עבור סוגי גידולים מרובים וצינורות ניתוח במורד הזרם, ניתן היה לצבור ידע נוסף על הבדלים ב- TME בין חולים וסוגי גידולים. זה יכול, למשל, להוביל לתובנות נוספות לגבי התפקיד של TME בתגובה אנטי-סרטנית לטיפולים ספציפיים. זה עשוי אפילו להצמיח סמנים ביולוגיים חדשים כדי לחזות גורמים כגון תגובה לטיפול והישרדות צפויה. בסך הכל, זה יכול לאפשר למולטיפלקס IHC להפוך לכלי קליני המסייע בקבלת החלטות קליניות, בגישת רפואה מותאמת אישית. אמנם, שלבים נוספים של הליך הניתוח צריכים כנראה להיות אוטומטיים וסטנדרטיים כדי שיהיה אפשרי לשימוש בסביבה אבחנתית יומית, כך שנכון לעכשיו, זו בעיקר פרספקטיבה עתידנית.
ניתוח של סמנים מרובים בשקופית מדגם אחת יכול להיות כלי רב עוצמה למרות האתגרים הטכניים שלו. עם פרוטוקולים ניסיוניים סטנדרטיים ושיטת ניתוח חזקה, כפי שתיארנו כאן באמצעות ImmuNet, הכימות של סמנים מרובים הופך אותו לאינפורמטיבי יותר מאשר IHC קלאסי, בעוד IHC מולטיפלקס נשאר בתפוקה גבוהה יחסית בהשוואה לשיטות ניסוי חדשניות עם plex גבוה יותר.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
PhenoImager HT נרכש באמצעות מימון שסופק על ידי המרכז הרפואי האוניברסיטאי Radboud והמרכז הטכנולוגי Radboud למיקרוסקופיה. CF נתמך כספית על ידי מענק האגודה ההולנדית לסרטן (10673) ומענק ERC Adv ARTimmune (834618). JT נתמכת כספית על ידי מענק NWO Vidi (VI.Vidi.192.084). המחברים רוצים להודות לאריק ואן דינתר ואנקור אנקן על עזרתם ביצירת זרימות עבודה לאחסון נתוני IHC מרובים ובנגט פונג מודה על ההוראות כיצד ליישם נתוני IHC מרובים ב- QuPath לציור ROI.
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD14 | Cell Marque | 114R-16 | section 3, clone EPR3653 |
| anti-CD163 | Cell Marque | 163M-15 | section 3, clone MRQ-26 |
| anti-CD19 | Abcam | ab134114 | section 3, clone EPR5906 |
| anti-CD1c (BDCA1) | Thermo Scientific | TA505411 | section 3, clone OTI2F4 |
| anti-CD20 | Thermo Scientific | MS-340-S | section 3, clone L26 |
| anti-CD3 | Thermo Scientific | RM-9107 | section 3, clone sp7 |
| anti-CD303/BDCA2 | Dendritics via Enzo Lifesciences/Axxora | DDX0043 | section 3, clone 124B3.13 |
| anti-CD56 | Cell Marque | 156R-94 | section 3, clone MRQ-42 |
| anti-CD66b | BD Biosciences | 555723 | section 3, clone G10F5 |
| anti-CD68 | Dako Agilent | M087601 | section 3, clone PG-M1 |
| anti-CD8 | Dako Agilent | M7103 | section 3, clone C8/144B |
| anti-Foxp3 | Thermo Scientific | 14-4777 | section 3, clone 236A/E7 |
| anti-Gp100 | Dako Agilent | M063401 | section 3, clone HMB45 |
| anti-HLA-DR, DP, DQ | Santa Cruz | sc-53302 | section 3, clone CR3/43 |
| anti-MART-1 | Thermo Scientific | MS-799 | section 3, clone A103 |
| anti-pan cytokeratin | Abcam | ab86734 | section 3, clone AE1/AE3 + 5D3 |
| anti-SOX10 | Sigma Aldrich | 383R | section 3, clone EP268 |
| anti-Tyrosinase | Sanbio | MONX10591 | section 3, clone T311 |
| anti-XCR1 | Cell Signaling Technologies via Bioké | 44665S | section 3, clone D2F8T |
| antibody diluent | Akoya BioSciences | SKU ARD1001EA | section 3, from Opal 7-Color Automation IHC Kit 50 slide (can optionally also be replaced by TBST with 10% BSA) |
| Bond Aspirating Probe | Leica Biosciences | S21.0605 | section 3 |
| Bond Aspirating Probe Cleaning | Leica Biosciences | CS9100 | section 3 |
| Bond Dewax Solution | Leica Biosciences | AR9222 | section 3 |
| Bond Objectglas label + print lint | Leica Biosciences | S21.4564.A | section 3 |
| Bond Research Detection System 2 | Leica Biosciences | DS9777 | section 3 |
| Bond RX autostainer | Leica Biosciences | - | section 3, automated platform |
| Bond TM Epitope Retrieval 1 - 1 L | Leica Biosciences | AR9961 | section 3 |
| Bond TM Epitope Retrieval 2 - 1 L | Leica Biosciences | AR9640 | section 3 |
| Bond TM Wash Solution 10x - 1 L | Leica Biosciences | AR9590 | section 3 |
| BOND Universal Covertile | Leica Biosciences | S21.4611 | section 3 |
| Bond(TM) Titration Kit | Leica Biosciences | OPT9049 | section 3 |
| Coverslip 24 x 32 mm #1 (0.13-0.16 mm) | Fisher Scientific | 15717592 | section 2 |
| coverslip 24 x 50 mm | VWR | 631-0146 | section 2 |
| DAPI Fluoromount-G | VWR | 0100-20 | section 3, whenever monoplex slides need to be quickly checked, not for official analysis, then DAPI is stained seperately for better results |
| Eosine | section 2, home made | ||
| Ethanol 99.5% | VWR | 4099.9005 | section 2 |
| Fluoromount-G | VWR | 0100-01 | section 3 |
| haematoxyline | - | section 2, home made | |
| ImmuNet | - | immune cell detection and phenotyping pipeline | |
| inForm software 2.4.10 | Akoya BioSciences | - | section 4 & 6 |
| OPAL 480 reagent pack | Akoya BioSciences | FP1500001KT | section 3 |
| OPAL 520 reagent pack | Akoya BioSciences | FP1487001KT | section 3 |
| OPAL 570 reagent pack | Akoya BioSciences | FP1488001KT | section 3 |
| OPAL 620 reagent pack | Akoya BioSciences | FP1495001KT | section 3 |
| OPAL 690 reagent pack | Akoya BioSciences | FP1497001KT | section 3 |
| OPAL 780 reagent pack | Akoya BioSciences | FP1501001KT | section 3 |
| Opal 7-Color Automation IHC Kit 50 slide | Akoya BioSciences | NEL821001KT | section 3 |
| PhenoChart 1.1.0 | Akoya BioSciences | - | section 5 |
| PhenoImagerHT | Akoya BioSciences | CLS143455 | section 4, digital pathology imager with slide viewer and imaging software (formerly known as Vectra Polaris) |
| Quick-D mounting medium | Klinipath | 7280 | section 2 |
| QuPath 0.3.2 | whole slide image analysis software platform | ||
| R 4.1.1 | |||
| Slide boxes | VWR | 631-0737 | section 1 |
| SuperFrost Plus | Thermo Scientific through VWR | 631-9483 | section 1 |
| Vectra Polaris software 1.0.13 | Akoya BioSciences | - | section 4 |
| Xylene | VWR | 4055-9005 | section 2 |
References
- Dunn, G. P., Bruce, A. T., Ikeda, H., Old, L. J., Schreiber, R. D. Cancer immunoediting: from immunosurveillance to tumor escape. Nature Immunology. 3 (11), 991-998 (2002).
- van der Woude, L. L., Gorris, M. A. J., Halilovic, A., Figdor, C. G., de Vries, I. J. M. Migrating into the tumor: a roadmap for T cells. Trends in Cancer. 3 (11), 797-808 (2017).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: impact on clinical outcome. Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Fridman, W. H., et al. The immune microenvironment of human tumors: general significance and clinical impact. Cancer Microenvironment. 6 (2), 117-122 (2013).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Angell, H. K., Bruni, D., Barrett, J. C., Herbst, R., Galon, J. The Immunoscore: colon cancer and beyond. Clinical Cancer Research. 26 (2), 332-339 (2020).
- Angell, H., Galon, J. From the immune contexture to the Immunoscore: the role of prognostic and predictive immune markers in cancer. Current Opinion in Immunology. 25 (2), 261-267 (2013).
- Galon, J., et al. Cancer classification using the Immunoscore: a worldwide task force. Journal of Translational Medicine. 10, 205 (2012).
- Galon, J., et al. World-wide Immunoscore Task Force: meeting report from the 34;Melanoma Bridge", Napoli, November 30th-December 3rd, 2016. Journal of Translational Medicine. 15 (1), 212 (2017).
- Tumeh, P. C., et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 515 (7528), 568-571 (2014).
- Creemers, J. H. A., et al. A tipping point in cancer-immune dynamics leads to divergent immunotherapy responses and hampers biomarker discovery. Journal for Immunotherapy of Cancer. 9 (5), e002032 (2021).
- Blank, C. U., Haanen, J. B., Ribas, A., Schumacher, T. N. CANCER IMMUNOLOGY. The "cancer immunogram". Science. 352 (6286), 658-660 (2016).
- Teruya-Feldstein, J. The immunohistochemistry laboratory looking at molecules and preparing for tomorrow. Archives of Pathology & Laboratory Medicine. 134 (11), 1659-1665 (2010).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Veterinary Pathology. 51 (1), 42-87 (2014).
- Hegde, P. S., Karanikas, V., Evers, S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clinical Cancer Research. 22 (8), 1865-1874 (2016).
- Parra, E. Novel platforms of multiplexed immunofluorescence for study of paraffin tumor tissues. Journal of Cancer Treatment and Diagnosis. 2 (1), 43-53 (2018).
- Gorris, M. A. J., et al. Eight-color multiplex immunohistochemistry for simultaneous detection of multiple immune checkpoint molecules within the tumor microenvironment. Journal of Immunology. 200 (1), 347-354 (2018).
- Roelofsen, T., et al. Spontaneous regression of ovarian carcinoma after septic peritonitis; a unique case report. Frontiers in Oncology. 8, 562 (2018).
- van den Brand, D., et al. Peptide-mediated delivery of therapeutic mRNA in ovarian cancer. European Journal of Pharmaceutics and Biopharmaceutics. 141, 180-190 (2019).
- van den Brand, D., et al. EpCAM-binding DARPins for targeted photodynamic therapy of ovarian cancer. Cancers. 12 (7), 1762 (2020).
- Di Blasio, S., et al. The tumour microenvironment shapes dendritic cell plasticity in a human organotypic melanoma culture. Nature Communications. 11 (1), 2749 (2020).
- van Beek, J. J. P., et al. Human pDCs are superior to cDC2s in attracting cytolytic lymphocytes in melanoma patients receiving DC vaccination. Cell Reports. 30 (4), 1027-1038 (2020).
- Rodriguez-Rosales, Y. A., et al. Immunomodulatory aged neutrophils are augmented in blood and skin of psoriasis patients. Journal of Allergy and Clinical Immunology. 148 (4), 1030-1040 (2021).
- Hoeijmakers, Y. M., et al. Immune cell composition in the endometrium of patients with a complete molar pregnancy: Effects on outcome. Gynecologic Oncology. 160 (2), 450-456 (2021).
- van Ravensteijn, S. G., et al. Immunological and genomic analysis reveals clinically relevant distinctions between angiosarcoma subgroups. Cancers. 14 (23), 5938 (2022).
- van der Woude, L. L., et al. Tumor microenvironment shows an immunological abscopal effect in patients with NSCLC treated with pembrolizumab-radiotherapy combination. Journal for Immunotherapy of Cancer. 10 (10), e005248 (2022).
- Graham Martinez, C., et al. The immune microenvironment landscape shows treatment-specific differences in rectal cancer patients. Frontiers in Immunology. 13, 1011498 (2022).
- Cortenbach, K. R. G., et al. Topography of immune cell infiltration in different stages of coronary atherosclerosis revealed by multiplex immunohistochemistry. International Journal of Cardiology. Heart & Vasculature. 44, 101111 (2023).
- van Wilpe, S., et al. Homologous recombination repair deficient prostate cancer represents an immunologically distinct subtype. Oncoimmunology. 11 (1), 2094133 (2022).
- Gorris, M. A. J., et al. Paired primary and metastatic lesions of patients with ipilimumab-treated melanoma: high variation in lymphocyte infiltration and HLA-ABC expression whereas tumor mutational load is similar and correlates with clinical outcome. Journal for Immunotherapy of Cancer. 10 (5), e004329 (2022).
- van Wilpe, S., et al. Intratumoral T cell depletion following neoadjuvant chemotherapy in patients with muscle-invasive bladder cancer is associated with poor clinical outcome. Cancer Immunology, Immunotherapy. 72 (1), 137-149 (2023).
- Sultan, S., Gorris, M. A. J., Buytenhuijs, F., Lvan de Woude, L. A Segmentation-free machine learning architecture for immune land-scape phenotyping in solid tumors by multichannel imaging. bioRxiv. , (2021).
- Parra, E. R., et al. Immuno-profiling and cellular spatial analysis using five immune oncology multiplex immunofluorescence panels for paraffin tumor tissue. Scientific Reports. 11 (1), 8511 (2021).
- Parra, E. R., et al. Validation of multiplex immunofluorescence panels using multispectral microscopy for immune-profiling of formalin-fixed and paraffin-embedded human tumor tissues. Scientific Reports. 7 (1), 13380 (2017).
- Sun, Z., Nyberg, R., Wu, Y., Bernard, B., Redmond, W. L. Developing an enhanced 7-color multiplex IHC protocol to dissect immune infiltration in human cancers. PLoS One. 16 (2), e0247238 (2021).
- LeicaBiosystems. BOND RX Fully Automated Research Stainer Protocols. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved