Alívio da nefropatia por IgA mediada por dioscina, inibindo a ativação de células B in vivo e diminuindo a produção de IgA1 deficiente em galactose in vitro
In This Article
Summary
Este estudo fornece dados experimentais para o tratamento da nefropatia por imunoglobulina A (IgAN) com Dioscina (DIO), o ingrediente ativo do Dioscoreae Nipponicae Rhizoma (DNR), e um paradigma para estudar os efeitos da fitoterapia e os mecanismos subjacentes in vivo e in vitro.
Abstract
O aumento da IgA1 circulante deficiente em galactose (Gd-IgA1) é causado pela ativação excessiva de células secretoras positivas para IgA no processo de respostas imunes da mucosa, que é um elo crítico na patogênese da nefropatia por IgA (IgAN). A mancha de Peyer, o local proeminente onde os linfócitos B são transformados em células plasmáticas secretoras de IgA, é a principal fonte de IgA. Além disso, a menor expressão do núcleo 1β-1,3-galactosiltransferase (C1GalT1) e sua chaperona molecular, chaperona molecular específica de C1GalT1 (Cosmc), está relacionada à glicosilação anormal de IgA1 em pacientes com NIgA. Nossa experiência clínica mostra que o fitoterápico de Dioscoreae Nipponicae Rhitoma (DNR) pode aliviar a proteinúria e a hematúria e melhorar a função renal em pacientes com NIgA. A dioscina (DIO) é um dos principais ingredientes ativos do DNR, que possui diversas atividades farmacológicas. Este estudo explora o possível mecanismo de DIO no tratamento de IgAN. O camundongo modelo de IgAN foi estabelecido por indução imune da mucosa. Os camundongos foram divididos nos grupos controle, modelo e gavagem DIO. A deposição de IgA glomerular em camundongos, alterações patológicas renais e a expressão dos marcadores de células B CD20 e CXCR5 no adesivo de Peyer foram detectadas por imunofluorescência e imuno-histoquímica. Após a estimulação do lipopolissacarídeo (LPS), os efeitos do DIO na proliferação de células DAKIKI, secreção de IgA e Gd-IgA1, expressão de C1GalT1 e Cosmc foram estudados pelo ensaio do kit de contagem de células-8 (CCK-8), ensaio de imunoabsorção enzimática (ELISA), reação em cadeia da polimerase quantitativa em tempo real (QRT-PCR) e western blotting (WB). Em estudos in vivo , a deposição de IgA acompanhada de hiperplasia mesangial glomerular e aumento da expressão de CD20 e CXCR5 no adesivo de Peyer no camundongo modelo de NIgA foi aliviada por DIO.Estudos in vitro mostraram que 0,25 μg/mL a 1,0 μg/mL DIO inibiu a proliferação de células DAKIKI induzida por LPS, a secreção de IgA e Gd-IgA1 e regulou positivamente o mRNA e a expressão proteica de C1GalT1 e Cosmc. Este estudo demonstra que o DIO pode reduzir a produção de Gd-IgA1 inibindo a ativação excessiva de células secretoras de IgA e regulando positivamente a expressão de C1GALT1/Cosmc.
Introduction
A nefropatia por IgA (NIgA) é o tipo mais comum de glomerulonefrite primária, para a qual não há tratamento específico, e continua sendo uma causa significativa de doença renal terminal1. Embora a patogênese da NIgA ainda não seja totalmente compreendida, a "hipótese multi-hit" é geralmente aceita e apoiada por um grande corpo de evidências de pesquisas clínicas e experimentais2. A patogênese da NIgA envolve a ativação de células B e a produção de IgA1 (Gd-IgA1)3 deficiente em Galactose. O aumento da Gd-IgA1 circulante devido à proliferação e ativação excessiva de células secretoras de IgA durante a resposta imune da mucosa é um elo crítico na patogênese da NIgA 4,5,6. Como local central para a proliferação e ativação da conversão do fenótipo de linfócitos B em células secretoras de IgA, o adesivo de Peyer é a principal fonte de secreção de IgA, intimamente relacionada à ocorrência e desenvolvimento de NIgA 7,8. Além disso, a proliferação de células secretoras de IgA1, bem como a expressão de Core 1β-1,3-galactosiltransferase (C1GalT1) e chaperona molecular específica de C1GalT1 (Cosmc), foram associadas à glicosilação anormal de IgA1, que causa a produção de GD-IgA1 em pacientes com NIgA 6,9.
O estudo clínico sobre o tratamento com NIgA com fitoterapia progrediu nos últimos anos. Yiqi Qingjie Formula é uma fórmula essencial para o tratamento de NIgA pelo Departamento de Nefrologia do Hospital Guang'anmen. O estudo anterior do nosso grupo descobriu que o Gd-IgA1 diminuiu no soro de pacientes com NIgA após o tratamento com Yiqi Qingjie Formula. Como uma das ervas mais utilizadas na Fórmula Yiqi Qingjie, Dioscoreae Nipponicae Rhizoma (DNR) é o rizoma seco de Dioscorea Nipponica Makino, que tem várias funções como regular a imunidade, suprimir a inflamação, aliviar a tosse e a asma10,11. Vários estudiosos trataram NIgA com DNR e obtiveram bons resultados 12,13,14. Como principal ingrediente ativo do DNR15, a dioscina (DIO) reduz o ácido úrico, inibe a fibrose, inibe a resposta inflamatória e o estresse antioxidante 16,17. Portanto, o DIO pode ter um novo mecanismo de ação para inibir a secreção celular de Gd-IgA1 excessivo e exercer efeitos específicos de proteção renal. Ainda assim, nenhum estudo foi relatado sobre o mecanismo de ação da DIO para o tratamento da NIgA.
Para explorar o potencial mecanismo terapêutico do DIO na NIgA e fornecer um novo método para o tratamento da NIgA, realizamos experimentos para os efeitos terapêuticos do DIO na NIgA in vivo e in vitro.
Protocol
O comitê de ética do Hospital de Guanganmen aprovou este experimento (número de aprovação ética do experimento com animais: IACUC-GAMH-2023-003).
1. Preparando camundongos para o procedimento experimental
- Crie 22 camundongos Balb/c machos de grau SPF (6-7 semanas de idade, peso corporal 20-25 g) nas instalações de animais do hospital/centro de pesquisa. Divida os animais em grupos controle (n = 8) e modelo (n = 14) usando o método da tabela de números aleatórios.
- Após 1 semana de criação adaptativa na gaiola de laboratório, alimentar o grupo modelo (grupo) com solução de gamaglobulina bovina (BGG) a 0,1% em água acidificada contendo 6 mmol/L de HCl por 9 semanas de acordo com o protocolo de modelagem de Zou et al.18.
- Injete 0,1 mL de solução de BGG a 0,1% em solução salina na veia da cauda por 3 dias consecutivos, continuando a beber a solução de BGG para preparar um modelo de camundongo experimental de NIgA18.
- Deixe o grupo controle beber livremente 6 mmol/L de água acidificada com HCl sem BGG por 9 semanas. Injete o volume correspondente de solução salina na veia da cauda por 3 dias consecutivos.
NOTA: Os grupos controle e modelo foram alimentados com a mesma qualidade da ração normal. - Após a injeção na veia da cauda, selecione 2 camundongos no grupo controle e 2 camundongos no grupo modelo aleatoriamente e examine-os por proteinúria, microscopia óptica e imunofluorescência para determinar se a modelagem foi bem-sucedida.
NOTA: Nenhum alimento é fornecido aos animais, mas eles não são proibidos de entrar na água; Registre a produção de urina. - Colete urina por 24 h por gaiolas metabólicas e centrifugue-a a 400 x g por 5 min; descarte o sedimento da urina. Após uma diluição de 10 vezes do sobrenadante, medir a concentração de proteinúria utilizando um kit de ensaio de proteínas urinárias e, em seguida, multiplicar pelo fator de diluição e volume de urina para obter 24 h de proteína total na urina.
NOTA: Os métodos de microscopia e imunofluorescência são mostrados nas seções 3 e 4, respectivamente. - Depois de preparar o modelo com sucesso, divida 12 camundongos no grupo modelo em 6 camundongos, cada um no grupo modelo (grupo NIgA) e no grupo gavagem DIO (grupo DIO), de acordo com o método da tabela de números aleatórios.
- Deixar o grupo controle continuar a beber água acidificada com HCl 6 mmol/L sem BGG, e o grupo modelo solução de BGG a 0,1% composta por água acidificada contendo HCl 6 mmol/L. Calcular a dose de administração de gavagem do grupo DIO de acordo com a fórmula de conversão de dose da metodologia experimental farmacológica (convertida de acordo com a massa corporal humana de 70 kg)19. Gavagem DIO comprimidos 0,06 g/kg uma vez por dia durante 8 semanas.
- Após 8 semanas de gavagem, anestesiar os camundongos por via intraperitoneal com pentobarbital sódico a 0,4% (60 mg/kg) e, após confirmar a anestesia adequada por pinça do dedo do pé, isolar os rins e o adesivo de Peyer para posterior microscopia de luz e análises imuno-histoquímicas.
NOTA: O esquema para o modelo in vivo está na Figura Suplementar 1.
2. Análise histológica
- Seções de parafina para rins e adesivo de Peyer
- Fixe tecidos renais de 3 mm de espessura ou 1 adesivo de Peyer com paraformaldeído a 4% por 24 h, desidrate com etanol gradiente e xileno. Mergulhe em cera por 2 h, sele e congele.
- Corte cortes renais de 2 μm de espessura e remendos de Peyer de 4 μm de espessura e espalhe-os em água morna. Retire as fatias desdobradas com uma lâmina de vidro limpa e leve ao forno a temperatura constante a 40 °C durante 1 h. Comece a coloração após o pré-processamento da amostra.
NOTA: Pegue a superfície coronal da parte hilar do rim, com uma espessura de bloco de tecido de 3 mm.
- Desparafine e manche as seções de parafina à temperatura ambiente (RT) por 10 min com solução ácida periódica, evitando a luz. Enxágüe com água destilada e limpe a seco com solução de coloração de Schiff por 20-30 min, evitando a luz. Enxágüe com água destilada até que as seções fiquem vermelhas ao microscópio.
- Coloque as seções em solução de coloração de hematoxilina, core os núcleos por 3 min (os núcleos muito profundamente corados podem ser divididos por cloridrato de etanol) e enxágue com água corrente até que as lâminas fiquem incolores.
- Realize a desidratação de rotina com concentrações gradientes de etanol e xileno, sele as seções com goma neutra e observe ao microscópio. PAS-positivo é vermelho e o núcleo é azul.
3. Análise imuno-histoquímica do adesivo de Peyer
- Prepare seções de parafina do adesivo de Peyer conforme descrito na etapa 2.1.
NOTA: A espessura das seções para imuno-histoquímica e subsequente imunofluorescência é de 4 μm. - Desparafinar as seções de parafina:
- Coloque as seções em xileno I por 5 min, xileno II por 5 min e xileno III por 5 min.
- Além disso, enxágue as lâminas em etanol anidro I por 5 min, etanol anidro II por 5 min, álcool 85% por 5 min, álcool 75% por 5 min. Em seguida, enxágue as lâminas em água destilada.
- Recuperação de antígeno
- Prepare 50x solução estoque de citrato de sódio e dilua com água destilada para 1x para uso. Aqueça em autoclave por 2 min, depois coloque as fatias na autoclave, garantindo que o nível do líquido ultrapasse o nível das fatias.
- Aqueça em alta temperatura por 5 min e deixe as lâminas esfriarem naturalmente. Lave as fatias três vezes com a solução PBS por 5 min cada.
- Bloqueio da peroxidase endógena: Marque as bordas do tecido em um círculo com uma caneta imuno-histoquímica. Incubar as seções em solução de peróxido de hidrogênio a 3% por 15 min em RT, protegida da luz, e lave as seções três vezes com solução de PBS por 5 min de cada vez.
- Bloqueio de soro: Bloqueie as seções colocando 10% de soro de cabra nas seções de tecido marcadas por 30 min em RT. Certifique-se de que as seções estejam uniformemente cobertas com a mancha.
- Incubação de anticorpos primários: Sacuda suavemente a solução de bloqueio e adicione uma proporção do anticorpo primário preparado (CD20 [1:800]; CXCR5 [1:800]) à seção. Colocar a secção numa caixa húmida e incubar durante a noite a 4 °C.
NOTA: Adicione uma pequena quantidade de água à caixa molhada para evitar a evaporação do anticorpo. - Incubação de anticorpos secundários: Lave as seções três vezes com solução de PBS por 5 minutos de cada vez. Remova o PBS sacudindo as seções secas, cubra o tecido com uma gota de anticorpo secundário (marcador HRP) das espécies relacionadas do anticorpo primário e incube em RT por 50 min.
- Homogeneização de 3,3'-diaminobenzidina (DAB): Lave as seções com solução de PBS três vezes por 5 min cada. Depois de sacudir as secas secas, coloque a solução cromogénica DAB recém-preparada sobre as secções. Observe o tempo de desenvolvimento da cor ao microscópio; o positivo é amarelo-acastanhado. Enxágue com água da torneira para interromper o desenvolvimento da cor.
- Núcleos de coloração: Coloração novamente com hematoxilina por cerca de 1 min, lave com água da torneira e depois enxágue por 10 min com água da torneira para voltar ao azul.
- Desidratação e vedação:
- Coloque as seções em álcool 75% por 5 min e álcool 85% por 5 min. Coloque as seções em etanol anidro I por 5 min, etanol anidro II por 5 min e etanol anidro III por 5 min.
- Lave as seções em xileno I por 5 min, retire-as para secar um pouco e sele as seções com goma neutra.
- Aquisição de imagens: Colete imagens por exame microscópico e analise por software halo para análise panorâmica de imagens do tecido.
NOTA: Os núcleos corados com hematoxilina são azuis e a expressão positiva de DAB é observada como amarelo-acastanhada.
4. Imunofluorescência renal de IgA
- Prepare seções de parafina para os rins conforme descrito na etapa 2.1.
- Desparafinar seções de parafina:
- Coloque as seções em xileno I por 5 min, xileno II por 5 min e xileno III por 5 min. Trate as seções em etanol anidro I, etanol anidro II, etanol 95%, etanol 90%, etanol 80%, etanol 70% e etanol 50%, cada um por 5 min, e lave com água destilada.
- Recuperação da proteinase K: Agite as seções secas e desenhe um círculo ao redor da seção de tecido com uma caneta histoquímica. Adicione a solução de trabalho de proteinase K (proporção de 1:9 de solução estoque e PBS) gota a gota para cobrir o tecido e incube a 37 °C por 30 min. Lave as seções três vezes com PBS por 5 min cada.
- Penetrar na membrana celular: Agite ligeiramente as seções secas e cubra-as com 0,1% de Tritão. Incube por 20 min em RT e lave as seções três vezes com PBS por 5 min cada.
- Bloqueio: Adicione 10% de soro de cabra gota a gota para cobrir o tecido uniformemente para bloquear em RT por 30 min.
- Incubação de anticorpos primários: Adicionar uma quantidade adequada de anticorpo IgA conjugado com AF488 de cabra (1:500) gota a gota para cobrir o tecido uniformemente e incubar durante a noite a 4 °C.
- Núcleos de coloração: Lave as fatias três vezes com PBS por 5 min cada. Depois de remover o PBS, adicione a coloração de 4 ', 6-diamidino-2-fenilindol (DAPI) gota a gota nas seções e incube por 15 min em RT, protegido da luz.
- Lave e sele as seções: Lave as seções três vezes com PBS por 5 min e, em seguida, sele-as com um meio de montagem antidesbotamento.
- Microscopia e fotografia: Observe as seções sob um microscópio fluorescente e tire fotos.
NOTA: Para DAPI, a excitação ultravioleta é o comprimento de onda 330-380 nm e o comprimento de onda de emissão é 420 nm, luz azul. O comprimento de onda de excitação do isotiocianato de fluoresceína (FITC) é de 465-495 nm, e o comprimento de onda de emissão é de 515-555 nm, luz verde.
5. Cultura de células
- Obtenha a linha de linfócitos B humanos DAKIKI da ATCC, EUA. Cultura de células DAKIKI em meio RPMI-1640 suplementado com 10% de FBS e 1% de penicilina-estreptomicina.
- Cultive as células em uma incubadora de CO2 a 37 °C, 5% e subcultive-as a cada 2-3 dias. Use células na fase de crescimento logarítmico para todos os experimentos.
- Na confluência de 70% a 80%, colete as células com uma pipeta estéril e centrifugue as células a 140 x g por 5 min. Descarte o sobrenadante, ressuspenda com o meio sem soro e, após 24 h, deixe todas as células em um período quiescente para tratamento subsequente.
6. Ensaios de citotoxicidade de LDH para triagem de concentrações seguras de DIO em células DAKIKI normais
- Semear células DAKIKI em placas de 96 poços a uma densidade de 4x105 células/poço e configurar um grupo de controle baixo, um grupo de controle alto e diferentes concentrações de DIO (0,25, 0,5, 1,0, 2,0, 4,0, 8,0 μg/mL). Incubar em incubadora de CO2 a 5%, 37 °C por 24 h após o tratamento correspondente de acordo com o método de agrupamento.
- De acordo com as instruções do kit de detecção de citotoxicidade, adicione 5 μL de lisado por poço no grupo de controle alto e, em seguida, coloque a placa em uma incubadora de CO2 a 5%, 37 ° C por 15 min.
- Retire a placa, adicione 100 μL da mistura de reação a cada poço, incube no escuro por 10 min em RT e, em seguida, adicione 50 μL da solução de reação de parada. Meça o valor OD a 490 nm no leitor de microplacas o mais rápido possível.
- Calcule a taxa de liberação de LDH de diferentes concentrações de DIO e ≤10% como a dose máxima administrada de acordo com a fórmula: Taxa de liberação de LDH = (LDH de poço experimental - LDH de baixo controle) / (LDH de alto controle - LDH de baixo controle) x 100%.
7. Ensaio CCK-8 para detectar o efeito de DIO na proliferação celular DAKIKI
- Com base nos resultados de nossos experimentos anteriores20, estabelecer um modelo de NIgA usando LPS 40 μg/mL para induzir células DAKIKI.
- Em seguida, semeie 4x105 células/poço em placas de 96 poços e divida nos grupos controle, modelo e DIO de baixa, média e alta concentração (0,25 μg/mL, 0,5 μg/mL e 1,0 μg/mL). Incubar as placas em uma incubadora de CO2 a 5% a 37 °C por 24 h.
- Em seguida, adicione 20 μL de reagente CCK-8 a cada poço e coloque as placas de volta na incubadora (5% CO2, 37 ° C) por 2 h. Após a incubação, detectar o diâmetro externo a um comprimento de onda de 450 nm no leitor de microplacas o mais rapidamente possível.
8. ELISA para detectar o efeito de DIO na secreção de IgA e Gd-IgA1 por células DAKIKI
- Semeie células DAKIKI em placas de 6 poços a uma densidade de 6x106 células/poço e agrupe e trate as células de acordo com a etapa 7.2. Cultivar as células durante 24 h e, em seguida, centrifugar a 850 x g durante 10 min a 4 °C para obter o sobrenadante.
- Detecte as concentrações de IgA e Gd-IgA1 de acordo com as instruções do kit.
9. qRT-PCR para detectar o efeito de DIO nos níveis de mRNA de C1GALT1 e Cosmc em células DAKIKI
- Semeie as células DAKIKI a uma densidade de 6x106 células/poço em uma placa de 6 poços, agrupe e trate as células como CCK8 mencionado na etapa 7.2 e incube por 24 h. Extraia o RNA total das células DAKIKI de acordo com as instruções do kit de extração de RNA total.
- Depois de tomar 1 μL de RNA extraído de cada grupo de amostras e medir sua concentração, transcreva inversamente 1 μg de RNA total de cada amostra em cDNA de acordo com as instruções do kit.
- Em seguida, realize a amplificação por RT-PCR para detectar a expressão de cada gene (95 °C por 15 min, 95 °C por 10 s e 60 °C por 30 s). Calcular o nível de expressão de cada gene utilizando o método 2-ΔΔCT com β-actina como referência interna.
NOTA: As sequências de primers foram as seguintes:
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGCCTTT-3';
Cosmc: 5'-GCTCCTTTTTGAAGGGTGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-actina: 5'-TCACCCACACTGTGCCCATCTACGA-3', 5'-CAGCGGAACCGCTCATTGCCAATGG-3'.
10. Western blotting para examinar o efeito do DIO na expressão das proteínas C1GALT1 e Cosmc em células DAKIKI
- Semeie as células DAKIKI a uma densidade de 6x106 células/poço em uma placa de 6 poços. Agrupe-os e trate-os conforme mencionado na etapa 7.2. Após 24 h de incubação, recolher cada grupo de células.
- Adicione uma quantidade apropriada de solução de lise celular (PMSF: inibidor de fosfatase: solução de lise RIPA = 1:1:100) e incube em gelo por 30 min. Em seguida, centrifugar a 13.500 x g durante 10 minutos a 4 °C e recolher o sobrenadante.
- Determine a concentração de proteína usando o kit de ensaio de concentração de proteína BCA.
- Misture as amostras de proteína com tampão de carregamento 5x SDS-PAGE a 4: 1 por vórtice e aqueça as amostras misturadas a 100 ° C por 5 min para desnaturar a proteína.
- Para detectar proteínas com diferentes pesos moleculares, adicione o marcador de proteína (5 μL/poço) e amostras (20 μg/poço) em diferentes pistas de um gel SDS-PAGE a 12%, execute a eletroforese SDS-PAGE e transfira o gel para as membranas de PVDF.
- Bloqueie as membranas com 5% de leite desnatado por 2 h em RT e incube com os anticorpos primários correspondentes (C1GALT1 [1:1000], Cosmc [1:2000]) por 24 h. Use o anticorpo β-actina (1:100000) como controle interno.
- Lave a membrana de fluoreto de polivinilideno (PVDF) com 1x solução salina tamponada com Tris, detergente Tween 20 a 0,1% (TBST) três vezes (10 min/tempo) e, em seguida, incube com o anticorpo IgG anti-coelho de cabra secundário correspondente (1: 10000) em RT por 2 h.
- Lave a membrana com TBST novamente (três vezes por 10 min cada) e trate-a com uma quantidade adequada de solução de trabalho de quimioluminescência aprimorada (ECL) (de acordo com as instruções do fabricante) para detecção de banda de proteína.
- Capture as imagens usando o sistema de imagem de quimioluminescência e realize uma análise semiquantitativa dos valores de cinza das proteínas usando o sistema de análise de imagem Image J.
11. Agosto Análise estatística
- Use um aplicativo de software apropriado para analisar os dados. Expresse todos os dados como a média ± DP (desvio padrão) e avalie várias amostras por um teste ANOVA unidirecional para comparação entre os grupos.
NOTA: O software estatístico SPSS 26.0 foi utilizado para análise estatística. O método LSD foi usado para comparações bidirecionais entre os grupos quando as variâncias eram iguais, e o método Dunnett T3 foi usado para comparações bidirecionais entre os grupos quando as variâncias não eram iguais. Considerou-se que o P<0,05 indicava diferença estatisticamente significativa.
Representative Results
Efeito da DIO no tecido renal em modelo de camundongos IgNIa
Em comparação com o grupo controle, o modelo de camundongos IgNI induzido pelo sistema imunológico da mucosa (grupo modelo) teve um aumento significativo na proteinúria (Figura 2 suplementar), a deposição de IgA foi visível na região mesangial, a fluorescência foi uniformemente distribuída em aglomerados por toda a região mesangial (Figura 1A), a coloração PAS do tecido renal mostrou proliferação de células mesangiais e hiperplasia estromal (Figura 1B), que foi reduzida no grupo gavagem DIO (grupo DIO).
Efeito da DIO sobre linfócitos B em adesivo de Peyer
O adesivo de Peyer é o principal local de conversão de linfócitos B em células secretoras de IgA. Tomamos o adesivo de Peyer como objeto de pesquisa para observar o efeito da DIO sobre os linfócitos B, detectando a expressão dos marcadores de células B CD20 e CXCR5. Os resultados imuno-histoquímicos mostraram que a expressão de CD20 e CXCR5 foi significativamente maior no grupo modelo em comparação com o grupo controle. DIO pode inibir a expressão dos marcadores moleculares acima (Figura 2A, B).
A faixa de concentração segura de DIO em células DAKIKI
O LDH é um marcador da integridade da membrana plasmática e um indicador de morte celular, com taxas de liberação de LDH mais altas indicando danos celulares mais graves. O ensaio de liberação de LDH foi usado para determinar a faixa de concentração segura de DIO. A concentração máxima segura de DIO foi determinada por uma taxa de liberação de LDH abaixo de 10%. Os resultados (Figura 3) não mostraram citotoxicidade significativa induzida por DIO nas concentrações de 0,25 a 1,0 μg/mL. Portanto, o estudo a seguir usou 0,25, 0,5 e 1,0 μg / mL DIO como nível de dosagem.
Efeitos do DIO na proliferação de células DAKIKI
Os resultados experimentais (Figura 4) mostraram que, em comparação com o grupo modelo (grupo estimulado por LPS), o DIO inibiu a proliferação de células DAKIKI induzida por LPS de maneira dependente da concentração. DIO nas concentrações de 0,5 e 1,0 μg/mL inibiu significativamente a proliferação de células DAKIKI induzida por LPS (P < 0,01).
Efeitos do DIO na função secretora das células DAKIKI
Os níveis de Gd-IgA1 estão intimamente relacionados ao processo patológico da NIgA, e a IgA total é testada em conjunto como um indicador da função secretora celular. Um ensaio ELISA foi usado para detectar o conteúdo de IgA e Gd-IgA1 no sobrenadante da cultura de células DAKIKI. Os resultados mostraram (Figura 5A,B) que as células DAKIKI estimuladas por LPS secretaram mais IgA em comparação com o grupo controle (P < 0,01). Em comparação, o DIO inibiu significativamente as células DAKIKI de secretar IgA (P < 0,01) de maneira dependente da concentração. Em comparação com o grupo controle, as células DAKIKI estimuladas por LPS secretaram mais Gd-IgA1 com tendência estatística (P < 0,10), e DIO inibiu a secreção de Gd-IgA1 de células DAKIKI estimuladas por LPS de maneira dependente da concentração (P < 0,05 e P < 0,01), entre as quais DIO a 1,0 μg/mL inibiu significativamente a secreção de Gd-IgA1 com a taxa inibida de 25%.
O mecanismo de DIO inibe a secreção de Gd-IgA1 pelas células DAKIKI
Para investigar ainda mais o possível mecanismo de DIO inibindo a secreção excessiva de Gd-IgA1 pelas células DAKIKI, os níveis de C1GALT1 glicosilada transferase e mRNA da proteína chaperona Cosmc em células DAKIKI foram detectados por qRT-PCR, e os resultados mostraram (Figura 6A, B) que a expressão relativa de mRNA de C1GALT1 e Cosmc foi regulada negativamente em células DAKIKI no grupo modelo em comparação com o grupo controle (P < 0,01). DIO regulou positivamente a expressão relativa de mRNA de C1GALT1 e Cosmc em diferentes graus em comparação com o grupo modelo, com DIO 1,0 μg / mL regulou significativamente a expressão relativa de mRNA de C1GALT1 e Cosmc (P < 0,05).
Ao mesmo tempo, o método WB foi usado para detectar o efeito de DIO na expressão proteica de C1GALT1 e Cosmc em células DAKIKI. Em comparação com o grupo controle, a expressão proteica de C1GALT1 e Cosmc em células DAKIKI no grupo modelo diminuiu obviamente (P < 0,05). Em comparação com o grupo modelo, a expressão proteica de C1GALT1 e Cosmc após a intervenção DIO foi regulada positivamente. A expressão proteica de C1GALT1 e Cosmc foi significativamente regulada positivamente por DIO na concentração de 1,0 μg / mL (P < 0,05) ( Figura 7A-C ).
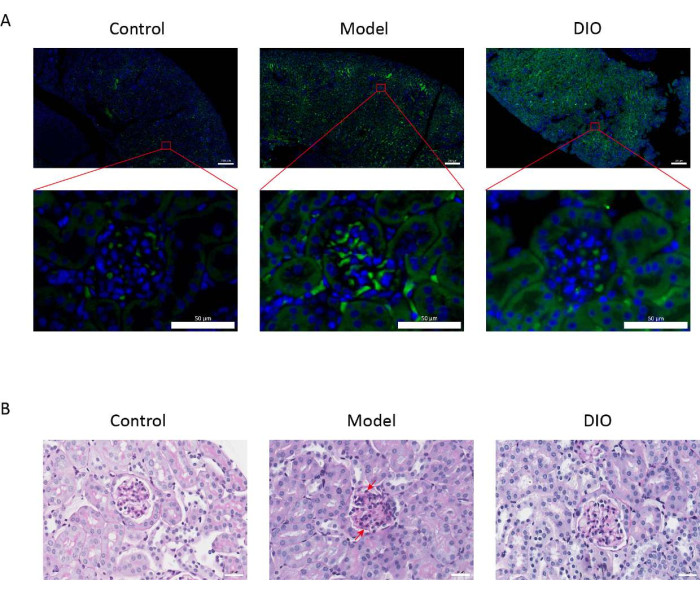
Figura 1: Histopatologia dos rins. (A) Microscópio de imunofluorescência. Cortes renais de camundongos em cada grupo foram corados com anti-IgA (verde) e DAPI (azul). A barra de escala da imagem acima = 200 μm. A barra de escala de imagem abaixo = 50 μm. n = 6 por grupo. (B) Imagens representativas da coloração PAS de tecido renal de camundongos nos grupos Controle, Modelo e DIO. Barra de escala = 30 μm. A seta para baixo mostra as células mesangiais e a seta para cima mostra o estroma. Barra de escala = 30 μm. n = 6 por grupo. Clique aqui para ver uma versão maior desta figura.
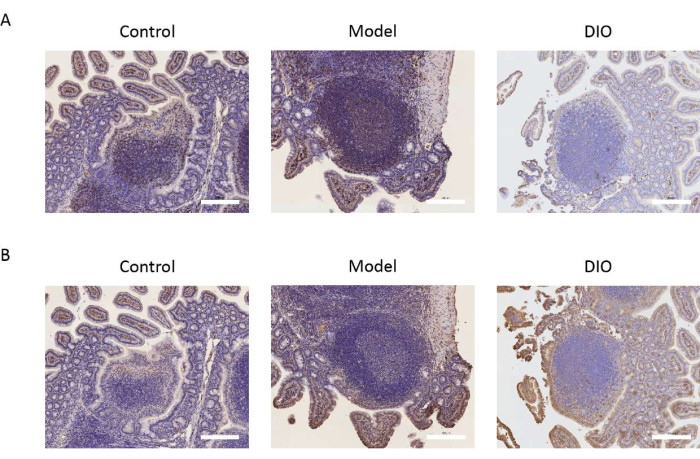
Figura 2: Efeito do DIO nos marcadores de linfócitos B. (A) A expressão de CD20 no adesivo de Peyer. Barra de escala = 200 μm. n = 6 por grupo. (B) A expressão de CXCR5 no adesivo de Peyer. As barras de escala estão no canto inferior direito da imagem. Barra de escala = 200 μm. n = 6 por grupo. Clique aqui para ver uma versão maior desta figura.
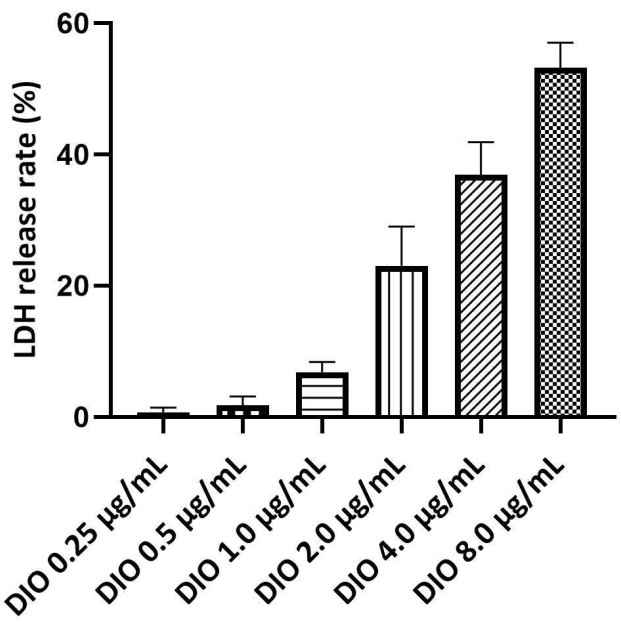
Figura 3. Triagem da concentração segura de DIO em células DAKIKI. Os valores estatísticos são expressos como a média ± DP de três experimentos independentes. Clique aqui para ver uma versão maior desta figura.
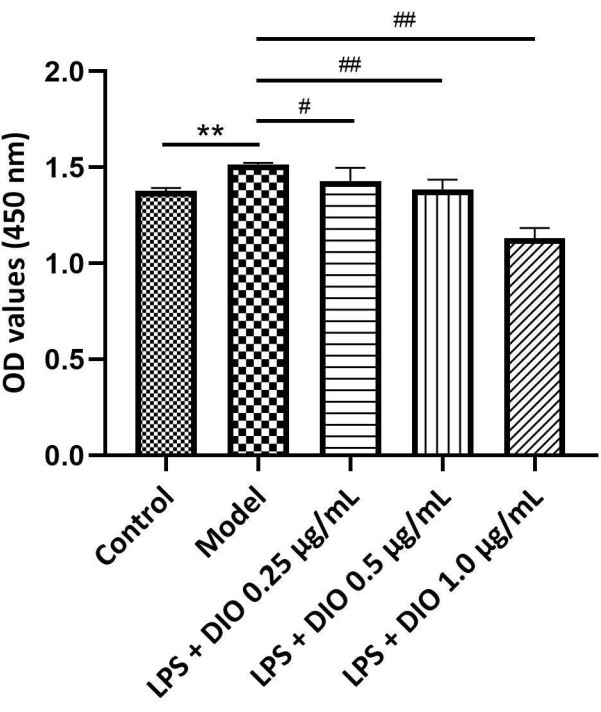
Figura 4. Diferentes concentrações de DIO afetam a proliferação de células DAKIKI. Os dados foram expressos em média ±DP. Em comparação com o grupo controle, **P < 0,01; em comparação com o grupo modelo, #P < 0,05' ##P < 0,01; Os resultados de todos os experimentos foram repetidos três vezes. Clique aqui para ver uma versão maior desta figura.
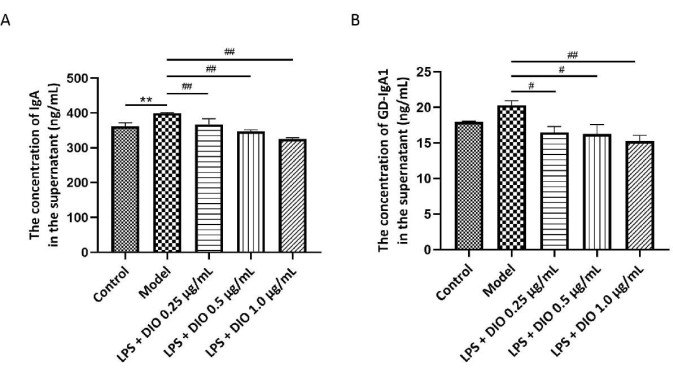
Figura 5. DIO inibe a secreção de IgA e Gd-IgA1 pelas células DAKIKI. (A) O método ELISA detectou a expressão de IgA em cada grupo. (B) O método ELISA detectou a expressão de Gd-IgA1 em cada grupo. Os dados foram expressos como média ± DP. Em comparação com o grupo controle, **P < 0,01; em comparação com o grupo modelo, #P < 0,05, ##P < 0,01; Todos os resultados experimentais foram repetidos três vezes. Clique aqui para ver uma versão maior desta figura.
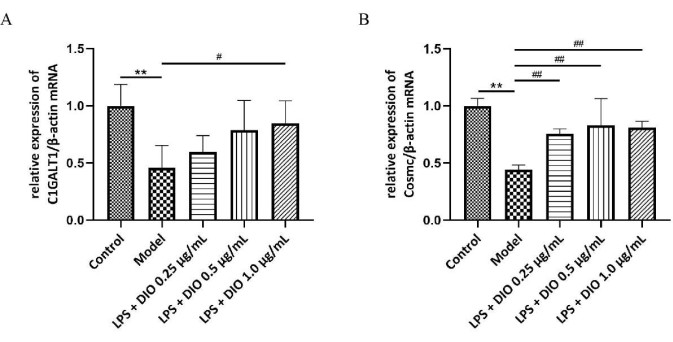
Figura 6. O mecanismo de DIO inibe a secreção excessiva de Gd-IgA1 pelas células DAKIKI. (A) QRT-PCR detectou a expressão de mRNA de C1GALT1. (B) QRT-PCR detectou a expressão de mRNA de Cosmc. Os dados foram expressos como média ± DP. Em comparação com o grupo controle, **P<0,01; em comparação com o grupo modelo, #P < 0,05, ##P < 0,01; Todos os resultados experimentais foram repetidos três vezes. Clique aqui para ver uma versão maior desta figura.
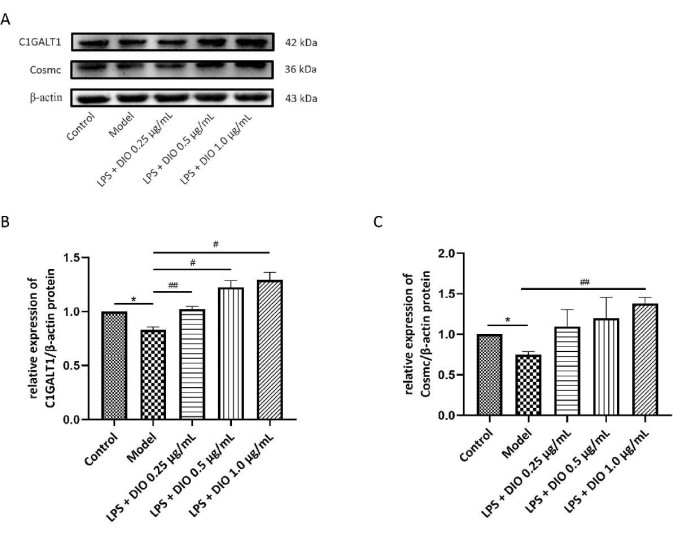
Figura 7. DIO afeta a expressão proteica de C1GALT1 e Cosmc em células DAKIKI. (A) WB verificou a regulação positiva da expressão proteica de C1GALT1 e Cosmc por DIO. (B) A análise semiquantitativa da expressão de C1GALT1 foi realizada usando a imagem J. (C) Análise semiquantitativa da expressão de Cosmc usando a imagem J. Os dados foram expressos como média ±DP. Em comparação com o grupo controle, *P < 0,05; em comparação com o grupo modelo, #P < 0,05, ##P < 0,01, todos os resultados experimentais foram repetidos três vezes. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1. O esquema para o modelo in vivo. Clique aqui para baixar esta figura.
Figura suplementar 2. Alterações na proteinúria. Os dados foram expressos como média ± DP; n = 6 por grupo. Clique aqui para baixar esta figura.
Discussion
A característica patológica da NIgA é a deposição de imunocomplexos contendo IgA1 e GD-IgA1 na região mesangial do glomérulo21,22. Reduzir a formação de complexos imunes pode reduzir a lesão renal e aliviar os sintomas clínicos da NIgA. Em um experimento in vivo, estudamos os efeitos terapêuticos do DIO no NIgA e descobrimos que o DIO pode reduzir a deposição de IgA no rim de camundongos modelo de NIgA Está demonstrado que o acúmulo de células secretoras de IgA no rim está relacionado à patogênese da NIgA23. Como um importante local de proliferação e ativação de linfócitos B, o adesivo de Peyer é uma importante fonte de células secretoras de IgA, então examinamos a expressão de marcadores de linfócitos B (CD20, CXCR5) no adesivo de Peyer e descobrimos que o DIO poderia inibir a expressão de linfócitos B no modelo de camundongos IgAN do adesivo de Peyer. Esses resultados experimentais podem fornecer uma base para a aplicação de DIO no tratamento de NIgA.
Realizamos os seguintes experimentos in vitro para investigar melhor o mecanismo de ação do DIO sobre o NIgA. Em primeiro lugar, foi demonstrado anteriormente que DAKIKI, uma linhagem de células B imortalizada por EBV que secreta IgA1, parte da qual é GD-IgA124, é ideal para pesquisa in vitro do mecanismo de ação da droga sobre IgAN. Escolhemos células DAKIKI para investigar o mecanismo molecular de DIO no tratamento de NIgA. Além disso, a resposta imune inflamatória da mucosa desempenha um papel fundamental na patogênese do NIgA. Como mencionado acima, usamos LPS para estimular as células DAKIKI, que podem liberar fatores pró-inflamatórios e mediar respostas inflamatórias, o que pode imitar melhor o mecanismo das respostas imunes da mucosa no NIgA. O modelo celular in vitro pode ajudar a investigar a possibilidade e o mecanismo de outras drogas para o tratamento da NIgA. Os resultados mostraram que o DIO inibiu a proliferação de células DAKIKI estimuladas pelo LPS de maneira dependente da concentração. O DIO pode inibir a secreção de IgA e Gd-IgA1 em células DAKIKI causada pela estimulação de LPS e regular positivamente a expressão de mRNA e proteína de C1GalT1 e sua chaperona Cosmc em células DAKIKI, sugerindo que DIO poderia reduzir a secreção de Gd-IgA1 regulando positivamente a expressão de C1GALT1 / Cosmc e, assim, inibir a ativação excessiva de células DAKIKI.
As principais etapas devem ser observadas durante os procedimentos experimentais. A concentração de Gd-IgA1 no sobrenadante da célula DAKIKI não está dentro da faixa de detecção do kit ELISA (1,56 ~ 100 ng / mL), e o sobrenadante coletado deve ser centrifugado por um tubo de ultrafiltração para obter o Gd-IgA1 concentrado. Além disso, certifique-se de que o volume de sobrenadante a partir de cada grupo seja o mesmo e o volume final de concentrado obtido após a ultrafiltração seja o mesmo.
Neste estudo, usamos métodos in vitro e in vivo simultaneamente, que podem se apoiar mutuamente nos efeitos farmacológicos e fornecer um exemplo para estudar os efeitos e seus mecanismos da fitoterapia. Algumas coisas poderiam ser melhoradas neste protocolo. Em primeiro lugar, não detectamos concentrações sanguíneas no grupo de gavagem DIO dos camundongos; portanto, a concentração de DIO equivalente às concentrações sanguíneas não é usada em experimentos in vitro . Em segundo lugar, apenas o monômero DIO, o componente ativo do DNR, foi investigado; os efeitos de outros componentes da DNR na NIgA ainda precisam de mais estudos.
Em conclusão, este estudo fornece uma base experimental para o tratamento de NIgA com DIO, o ingrediente ativo da DNR. Este estudo estabeleceu um modelo patológico celular de NIgA mimetizando a resposta imune da mucosa de NIgA tanto in vitro quanto in vivo. Dá uma nova ideia para estudar a medicina tradicional chinesa para prevenir e tratar a NIgA.
Disclosures
Os autores declaram que não têm interesses financeiros concorrentes.
Acknowledgements
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (81973675).
Materials
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
References
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117 (2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18 (2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370 (2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613 (2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602 (2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19 (1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved