ניקוד דלקת במערכת העצבים המרכזית, דמיאלינציה ופגיעה באקסון באנצפלומיאליטיס אוטואימונית ניסיונית
In This Article
Summary
אנצפלומיאליטיס אוטואימונית ניסיונית (EAE) משמשת כמודל של בעלי חיים לטרשת נפוצה. מאמר זה מתאר גישה לניקוד דלקת בחוט השדרה, דמיאלינציה ופגיעה אקסונלית ב- EAE. בנוסף, מוצגת שיטה לכימות רמות האור של נוירופילמנט מסיס בסרום העכברים, המאפשרת הערכה של פגיעה אקסונלית בעכברים חיים.
Abstract
אנצפלומיאליטיס אוטואימונית ניסיונית (EAE) היא מודל נפוץ מבוסס חיסון של טרשת נפוצה (MS). מחלה זו יכולה להיגרם במכרסמים על ידי חיסון פעיל עם רכיבים חלבוניים של מעטפת המיאלין ואדג'ובנט שלם של פרוינד (CFA) או על ידי העברת תאי T T ספציפיים למיאלין ממכרסמים עם חלבון מיאלין/CFA למכרסמים תמימים. חומרת EAE מדורגת בדרך כלל בסולם קליני בן 5 נקודות המודד את מידת השיתוק העולה, אך סולם זה אינו אופטימלי להערכת מידת ההתאוששות מ- EAE. לדוגמה, התוצאות הקליניות נשארות גבוהות בחלק מהמודלים של EAE (למשל, אוליגודנדרוציטים מיאלין גליקופרוטאין [MOG] מודל המושרה בפפטיד של EAE) למרות הרזולוציה של דלקת. לכן, חשוב להשלים ניקוד קליני עם ניקוד היסטולוגי של EAE, אשר גם מספק אמצעי לחקור את המנגנונים הבסיסיים של פגיעה תאית במערכת העצבים המרכזית (CNS).
כאן, מוצג פרוטוקול פשוט כדי להכין ולהכתים קטעי חוט שדרה ומוח מעכברים ולדרג דלקת, דמיאלינציה ופגיעה אקסונלית בחוט השדרה. השיטה לניקוד חדירת לויקוציטים בחוט השדרה יכולה להיות מיושמת גם כדי לדרג דלקת במוח ב- EAE. פרוטוקול למדידת אור נוירופילמנט מסיס (sNF-L) בסרום של עכברים באמצעות בדיקת מולקולה קטנה (SIMOA) מתואר גם כן, המספק משוב על מידת הפגיעה הכוללת במערכת העצבים המרכזית בעכברים חיים.
Introduction
אנצפלומיאליטיס אוטואימונית ניסיונית (EAE) היא המודל הנפוץ ביותר למחלת הדה-מיאלינציה האנושית, טרשת נפוצה (MS)1. פתולוגיה דלקתית קלאסית של טרשת נפוצה, כולל חדירתתאי עוזר מסוג IFN-γ (גמא) ו- IL-17 המייצרים T 2, חדירת מונוציטים דלקתיים3, היווצרות נגעים דלקתיים פריווסקולריים ותת-מנינגיאליים4, והתרחשות של פגיעה באקסון4 במערכת העצבים המרכזית (CNS), נצפתה גם ב- EAE 5,6,7,8,9. הדמיון במנגנוני החיסון בין EAE לטרשת נפוצה הפך את EAE למודל פרה-קליני מתאים לבדיקת היעילות ומנגנוני הפעולה של מספר טיפולים מאושרים מבוססי חיסון לטרשת נפוצה, כולל נטליזומאב, פינגולימוד, דימתיל פומרט וגלטירמר אצטט (נסקרב-1,5). משטרי EAE מסוימים מדגימים היבטים אחרים של פתולוגיה מתקדמת של טרשת נפוצה מעבר לפגיעה אקסונלית, כולל התפתחות של דלקת תת-קרום המוח במוח, דמיאלינציה כרונית, ניוון חוט השדרה, סינפסה ואובדן נוירונים 6,10,11,12. לפיכך, EAE יש תועלת עבור סינון היעילות של טיפולים neuroprotective עבור טרשת נפוצה.
EAE מושרה במכרסמים במספר דרכים. חיסון פעיל הוא שיטת האינדוקציה הנפוצה ביותר וכולל חיסון של מכרסמים עם אנטיגנים של מיאלין (חלבונים מלאים או פפטידים) המתחלבים ב- CFA בתוספת Mycobacterium tuberculosis13 שהומת בחום. בהתאם לזן של עכבר, רעלן שעלת (PTX) מנוהל גם ביום 0 ויום 2 של החיסון כדי להגדיל את החדירה של מחלה13. EAE יכול גם להיגרם על ידי העברה מאמצת של תאי T ספציפיים למיאלין המתקבלים מעכברים בעלי מיאלין/CFA לעכברים בריאים14 או יכול להתפתח באופן ספונטני בעכברים המבטאים יתר על המידה קולטני תאי T ספציפיים לאנטיגנים העיקריים של המיאלין5.
חומרת המחלה והתקדמותה מדורגות בדרך כלל באמצעות סולם קליני דיסקרטי בן 5 נקודות: 1 – צליעה בזנב, 2 – חולשת גפיים אחוריות או כף רגל, 3 – שיתוק מוחלט באחת או בשתי הגפיים האחוריות, 4 – חולשת גפיים קדמיות, 5 – מוות או מוות13. מערכת ניקוד קלינית זו מבוססת על תיעוד ההתקדמות של שיתוק עולה המתרחש עם תחילת המחלה, אך היא פחות רגישה בלכידת מידת ההחלמה מהתקפים דלקתיים במערכת העצבים המרכזית. לדוגמה, גם עכברים שעושים אמבולציה עם קושי וגם עכברים שעושים אמבולציה בקלות אך מפגינים חולשה באחיזת הרגליים מקבלים ציון 2 בסולם EAE. ציונים יכולים להישאר גבוהים בשלב הפוסט-אקוטי של EAE עקב נוכחות של פגיעה או אובדן אקסונים קבועים, למרות הרזולוציה של התגובה הדלקתית9. נעשו מגוון ניסיונות לפתח מערכות ניקוד מעודנות יותר, מבחנים התנהגותיים, מדדים של חוזק הגפיים האחוריות והאחיזה, ומערכות ניטור אינפרא אדום כדי ללכוד טוב יותר הבדלים בליקויים קליניים ב- EAE 9,16,17,18; עם זאת, מדדי ניקוד מורכבים יותר אלה אינם מבחינים בין תרומת דלקת לעומת פגיעה ברקמה לליקויים הנוירולוגיים הבסיסיים. לפיכך, גישת תקן הזהב לציון חומרת EAE היא לבצע ניקוד קליני והיסטולוגי כאחד.
כאן, מתואר פרוטוקול כיצד לנתח ולהטמיע דגימות חוט שדרה ומוח עכבר בפרפין באופן שלוכד את התהליך הסטוכסטי של היווצרות נגעים המתרחש ב- EAE. פרוטוקול מוצג גם כיצד להכתים חלקים עם Luxol fast blue (LFB), שנוצר במקור על ידי Kluver ו- Barrera19, המזהה מיאלין במערכת העצבים המרכזית. החלקים מוכתמים ב-LFB בלבד (לצורך ניתוח דה-מיאלינציה) או מוכתמים נגדית בהמטוקסילין ובאאוזין (H&E) כדי לסייע בהדמיה ובציון של נגעים דלקתיים. פרוטוקולים מסופקים גם כדי לכמת את נוכחותם של לויקוציטים כוללים (CD45), אובדן מיאלין, ואת מספר האקסונים הפגועים (SMI-32) בחוט השדרה באמצעות נוגדנים זמינים מסחרית, טכניקות אימונוהיסטוכימיות (IHC) ותוכנות נגישות לציבור. הפרוטוקול המשמש לכימות לויקוציטים בחוט השדרה יכול להיות מיושם גם כדי לכמת לויקוציטים במוח.
הערכה היסטולוגית של אובדן אקסונלי ופגיעה במוח קשה יותר באופן יחסי מאשר בחוט השדרה, שכן אסופות החומר הלבן במוח אינן פועלות במקביל זו לזו. המדידה של אור נוירופילמנט בסרום (sNF-L) התגלתה כסמן ביולוגי מבטיח לפגיעה עצבית בטרשת נפוצה20,21. מחקרים אחרונים הרחיבו טכנולוגיה זו ל- EAE 22,23,24. כאן, מוצגת שיטה למדידת אור נוירופילמנט בסרום (sNF-L) בעכברים חיים באמצעות בדיקת מולקולות קטנות (SIMOA). שיטה זו דורשת רק כמות קטנה של סרום וניתן לעשות זאת בעכברים חיים תוך חצי יום בלבד, מה שמספק משוב מהיר על האופן שבו טיפול נבדק משפיע על הפגיעה הכוללת במערכת העצבים המרכזית. כל השיטות המתוארות כאן יכולות להיות מיושמות על עכברים מכל מין או זן.
Protocol
כל הניסויים שנערכו בעכברים בוצעו תחת פרוטוקולים לשימוש בבעלי חיים שאושרו על ידי הוועדה לטיפול בבעלי חיים של Unity Health Toronto, בהתאם להנחיות שנקבעו על ידי המועצה הקנדית לטיפול בבעלי חיים. הקפידו ללבוש מעיל מעבדה, כפפות מגן ומשקפי ראייה לאורך כל הליכי המעבדה.
1. קציר ותיקון המוח וחוט השדרה
- הרדימו את העכבר בהתאם למדיניות המוסדית. הניחו את העכבר על שולחן ניתוח וערפו את ראשו באמצעות מספריים כירורגיים (חיתוך כלפי מטה).
- בעזרת מלקחיים של אדסון (ביד לא דומיננטית), אחזו בעור בחלק העליון של ראשו של העכבר. לאחר מכן בצע חתך של 2.5 ס"מ בעור בחלק העליון של הראש באמצעות מספריים כירורגיים.
- השתמש באצבעות כדי לדחוף את העור על הראש לרוחב כדי לדמיין את הגולגולת הבסיסית.
- ייצב את ראש העכבר על ידי אחיזת ארובות העיניים עם מלקחיים אדסון סטנדרטיים.
- בעזרת מספריים עדינים (יד דומיננטית), בצעו חתכים קטנים בגולגולת לאורך קו האמצע מעמוד השדרה הצווארי ועד פקעות הריח.
הערה: הטמע רק כמה מילימטרים של קצות מספריים מתחת לגולגולת בכל פעם כדי למנוע נזק למוח הבסיסי. - השתמש במלקחיים של אדסון עם שיניים כדי לשקף את הגולגולת לרוחב כדי לחשוף את המוח שמתחתיו.
- החזיקו את הראש באמצעות היד הלא דומיננטית. מחזיקים מספריים סגורים (יד דומיננטית), מוציאים את חוט השדרה מעמוד השדרה הצווארי ודוחפים בעדינות את המוח החוצה מהגולגולת, תוך חיתוך עצבי הגולגולת.
- הניחו את המוח בצינור חרוטי המכיל 10 מ"ל של 10% פורמלין חוצץ נייטרלי המסומן בתעודת הזהות של החיה.
- חותכים את הפרווה לאורך קו האמצע של פלג הגוף העליון של העכבר מהצוואר ועד הזנב.
- השתמש באצבעות כדי לדחוף את העור לרוחב כדי לדמיין את עמוד השדרה.
- בעזרת מספריים כירורגיים, חותכים כלפי מטה דרך עמוד השדרה ברמה שבה עצם הירך מתחברת לירך.
- השתמש מספריים כירורגיים כדי לחתוך את דופן הגוף בכל צד של עמוד השדרה מן הירך לצוואר. חתוך את כל האיברים המחוברים.
- מקם את עמוד השדרה המכיל את חוט השדרה באותו צינור של פורמלין המכיל את המוח. אפשרו למוח ולעמוד השדרה להתקבע במשך 5-7 ימים.
הערה: העיתוי של הקיבעון חשוב. נוגדנים מסוימים לא יפעלו אם הרקמה מקובעת יתר על המידה. אם הרקמה אינה מקובעת כראוי, קשה להוציא את חוט השדרה מעמוד השדרה בשלב 2.
2. גרוסינג ועיבוד של חוט השדרה והמוח
הערה: השלבים הבאים מתבצעים במכסה אדים. לפני שמתחילים, הכינו 2X10 ס"מ צלחות פטרי נקיות, בקבוק Erlenmeyer מצויד במשפך מרופד בנייר פילטר, שני אזמלים (אחד לחיתוך עצם ואחד לחיתוך רקמות CNS), נייר עדשה, עיפרון, קלטות הטבעה וצנצנות דגימה ממולאות מראש ב-10% פורמלין.
- בעזרת מספריים, חותכים פיסת נייר עדשה קטנה (באותו רוחב אך פי שניים מאורך הקלטת) ומניחים אותה בצלחת פטרי אחת.
- תייג קלטת פלסטיק עם מזהה הדגימה באמצעות עיפרון.
- יוצקים את הצינור המכיל את המוח ועמוד השדרה הקבועים לתוך המשפך. מעבירים את עמוד השדרה והמוח לצלחת הפטרי הריקה.
הערה: הפורמלין המשומש יסונן לתוך בקבוק Erlenmeyer וניתן לעשות בו שימוש חוזר בשלב 2.13. - חלקו את המוח באופן גס לשש חתיכות קורונליות באמצעות אזמל. בצע חיתוך אחד קאודלי למוח הקטן, אחד באמצע המוח הקטן, אחד רק רוסטרל למוח הקטן, ושני חתכים במוח הרוסטרלי הנותר, יצירת 3 פרוסות קורונליות נוספות בעובי שווה.
- בעזרת מלקחיים, העבירו דגימות מוח על חצי מנייר העדשה בצלחת הפטרי.
- חתכו את חוט השדרה לשלוש חתיכות באמצעות האזמל: החתך הראשון נעשה בתחתית כלוב הצלעות, והחתך השני נעשה ממש מתחת לעקמומיות בעמוד השדרה הצווארי.
- באמצעות אותו אזמל, לחתוך את פיסת עמוד השדרה העצה בקצה הקאודלי עד חוט השדרה ניתן לדמיין.
- להרים את עמוד השדרה החזי (יד לא דומיננטית). החזיקו את המלקחיים של אדסון עם שיניים סגורות היטב (יד דומיננטית) ודחפו בעדינות את קצה המלקחיים לתוך הפתח הקטן יותר של עמוד השדרה בתנועת פיתול עדינה. החוט צריך לצאת מהקצה השני.
הערות: כל מכשיר עגול בגודל חוט השדרה יעבוד למטרה זו. אם חוט השדרה אינו בולט באופן טבעי, אל תכריחו אותו. במקום זאת, השתמש במספריים עדינים כדי לחתוך את העצמות לאורך הצד של עמוד השדרה ולשקף אותו פתוח כדי לחשוף את חוט השדרה. לחלופין, לתקן את חוט השדרה והמוח במשך כמה ימים נוספים פורמלין; עם זאת, יש להחיל את אותו זמן קיבוע על כל הדגימות כדי למנוע הצגת שונות בצביעת נוגדנים. - הרימו את מלקחיים אדסון סטנדרטיים (יד דומיננטית). עדיין מחזיק את פיסת חוט השדרה ביד הפחות דומיננטית, השתמש במלקחיים כדי למשוך בעדינות את החוט שיצא מהעמודה. הניחו את פיסת חוט השדרה בצלחת פטרי המכילה את נייר העדשה.
- חזור על תהליך זה עבור חלקי העמוד המותני/סקרלי וצוואר הרחם.
- חלק את שלושת חלקי חוט השדרה (צוואר הרחם, בית החזה, המותני/העצה) לחתיכות חתך קטנות יותר באמצעות אזמל. חותכים לפחות 15 קטעים, שכל אחד מהם צריך להיות פחות מ 2 מ"מ עובי.
הערה: ודא שהמקטעים קצרים יותר מרוחבם, מה שיגרום למקטעים ליפול בקלות רבה יותר בחתך רוחב במהלך תהליך ההטבעה בשלב 3. - סדרו את חלקי חוט השדרה על אותו חצי של נייר העדשה המכיל חלקי מוח. קפלו את נייר העדשה כדי לדחוס את חתיכות הטישו והניחו אותן בקלטת המסומנת.
הערה: נייר העדשה מונע מחתיכות קטנות של רקמה לברוח מהקלטת במהלך העיבוד. - מעבירים את הקלטת לצנצנת דגימה המכילה פורמלין ממוחזר או טרי.
- חזור על שלבים 2.1–2.13 עבור הדגימות הנותרות.
- לאחר 5-7 ימים של קיבוע, מעבירים קלטות ממיכל הדגימה לאמבט הפורמלין הראשון במעבד הרקמה האוטומטי (ראו טבלת חומרים). הפעל את מעבד הרקמה למשך הלילה בהתאם לתוכנית המתוארת בטבלה משלימה 1. הדגימות מוחזקות בשעוות פרפין חמה עד להטמעה.
3. הטבעה וחיתוך של חלקי המוח וחוט השדרה
- מעבירים קלטות מהמעבד לתא האחיזה החם של תחנת שיבוץ הפרפין (ראו טבלת חומרים).
- הטמע חתכים של חוט השדרה והמוח מכל עכבר בבלוק פרפין יחיד באופן הבא (איור 1):
- ראשית, יוצקים שעוות פרפין רק כדי לכסות את החלק התחתון של התבנית. בעזרת מלקחיים עדינים, מניחים חתיכות חתך של קורונל המוח וחוט השדרה לתוך הפרפין בתחתית התבנית.
- העבירו את העובש למשטח קירור למשך מספר שניות כדי לקבע את חלקי המוח וחוט השדרה במקומם. מחזירים את התבנית למשטח המחומם וממלאים אותה למעלה בפרפין חם.
- הניחו את מכסה הקלטת (המסומן במזהה הדגימה) על גבי התבנית. יוצקים עוד פרפין על מכסה הקלטת. מעבירים את התבנית לתחנת הקירור כדי לאפשר לשעווה להתייצב (מצננים 30-60 דקות).
הערה: הטבעה של חלקי חוט השדרה דורשת תרגול. כדי לשפר את ההצלחה, השתמש באורכים קצרים יותר של חוט השדרה (<2 מ"מ) מכיוון שאלה נוטים יותר ליפול בחתך רוחב. ניתן ללבוש זכוכית מגדלת כירורגית כדי לעזור להבחין אם חתיכות חוט השדרה נמצאות בחתך רוחב. - הר בלוק פרפין על מיקרוטום סיבובי. חיתוך בלוק עד רקמות עניין להופיע בסעיף פרפין.
- גזרו סרטים של 5 מיקרומטר של חלקים מכל בלוק והעבירו אותם לאמבט מים של 42 מעלות צלזיוס.
- אסוף מקטעים בשקופיות ומקם שקופיות במדף שקופיות מזכוכית.
- אופים נתחים ב-180 מעלות בתנור יבש למשך הלילה. יש לקרר את המגלשות לפני שממשיכים להכתים.
4. דה-פרפיניזציה והתייבשות של חלקים כהכנה להכתמה
הערה: השלבים מבוצעים במכסה אדים. לפני שמתחילים, להכין אמבטיות של ממסים. הכינו 5 ליטר של 1x PBS (1 ליטר ddH2O, 8 גרם NaCl, 0.2 גרם KCl, 1.44 גרם Na2HPO4, 0.24 גרם KH2PO4; pH = 7.4) עם 0.05% Tween-20 (PBS-T) לכל שלבי הכביסה.
- נטרלו את הפרפין על ידי הנחת שקופיות בשתי אמבטיות רצופות של קסילן או ממס שאינו מבוסס על קסילן על שייקר למשך 5 דקות כל אחת עם תסיסה עדינה.
- התייבשו רקמות על ידי העברת שקופיות דרך אמבטיות עוקבות של אחוזים יורדים של אתנול: 2 x 100% אתנול (5 דקות כל אחד), 2 x 95% אתנול (3 דקות כל אחד), ו 1 x 70% אתנול (3 דקות). להחזיק 95% אתנול עבור צביעת LFB, ו rehydrate ל 70% אתנול, ולהחזיק PBS-T עבור immunohistochemistry (IHC).
5. LFB למיאלין עם H&E
- הכינו תמיסה של 0.1% LFB (0.2 גרם LFB, ראו טבלת חומרים, 200 מ"ל 95% אתנול, 0.5 מ"ל חומצה אצטית קרחונית). מערבבים ומסננים לצלוחית ארלנמאייר. יש לאחסן בבקבוק כהה עד לשימוש.
- העבירו חלקים מאתנול 95% למתלה שקופיות זכוכית המונחות בכלי צביעה המכיל LFB. מכסים את הכלי ואוטמים בסרט פרפין למניעת אידוי.
- דוגרים על חלקים בתנור ב-56°C למשך הלילה (מקסימום 16 שעות).
- למחרת בבוקר, העבירו את המגלשות לאמבטיה ddH2O והחזיקו.
- בינתיים, הכינו (1) תמיסת ליתיום קרבונט טרייה 0.05% (0.05 גרם ליתיום פחמתי, 100 מ"ל ddH2O); (2) תמיסת Eosin Y (להוסיף 2 גרם מלח eosin ל 40 מ"ל ddH20 ולערבב עד מומס ולאחר מכן לערבב עם 160 מ"ל של 95% אתנול).
- הכינו את האמבטיות הבאות: 1 x ליתיום פחמתי, 3 x 70% אתנול, 3 x 95% אתנול, 2 x 100% אתנול, 3 x ddH20. יש להניח אמבטיות לפי סדר השימוש (ראה טבלה משלימה 2).
- בצע את השלבים כמתואר בטבלה משלימה 2.
- לאחר שהשקופיות יבשות, דמיינו את הנגעים המפרקים מתחת למיקרוסקופ.
6. LFB למיאלין ללא H&E
- בצע הליך מכתים זה לניתוח המיאלין.
הערה: ההליך זהה לשלב 5 (ראה טבלה גמישה 2), אך כולל זרימת עבודה מקוצרת. לאחר שלב 4, המשך בהליך החל משלב 10.
7. שליפת אנטיגן ומרווה פרוקסידז לכתמים אימונוהיסטוכימיים (IHC)
הערה: לפני שמתחילים, הכינו 100 מ"ל של מי חמצן במתנול (1 חלק 30% תמיסת מי חמצן ב-9 חלקים 100% מתנול, במכסה אדים). הכינו 1 ליטר של 10 mM ציטראט חיץ עם Tween-20 (2.94 גרם של טריסודיום ציטראט, מומס ב 1 L של ddH20 בכוס על צלחת ערבוב, להביא pH ל 6.0, ולהוסיף 500 μl של Tween-20). הכן PBS-T (ראה שלב 4). כל השטיפות נעשות באמבטיות של PBS-T עם תסיסה עדינה (על שייקר) אלא אם כן צוין אחרת.
- להרוות פרוקסידז אנדוגני על ידי הנחת שקופיות במי חמצן 3% במתנול למשך 15 דקות (במכסה אדים). שטפו שקופיות פעמיים ב-PBS-T (2 דקות כל אחת).
- העבירו את המגלשות למחזיק מגלשות מתכת והניחו ב-1 ליטר של חיץ ציטראט בסיר לחץ. אטמו את המכסה והוסיפו פקק גומי בחלק העליון של פתח המילוט בקיטור.
- מבשלים גבוה במיקרוגל עד שהלשונית הצהובה על סיר הלחץ קופצת, מה שמעיד על כך שהגיע ללחץ מקסימלי. מבשלים 5 דקות נוספות בלחץ מרבי, ולאחר מכן מוציאים את סיר הלחץ מהמיקרוגל באמצעות כפפות מגן.
- לחץ על ידי הסרת הפקק. הסירו את המכסה ותנו למגלשות להתקרר במאגר הציטראט למשך 20 דקות ולאחר מכן המשיכו לשיטת הצביעה הרצויה.
אזהרה: יש לעמוד לאחור בעת שחרור הקיטור, שכן הוא עלול לגרום לפציעה צורבת.
8. אימונוהיסטוכימיה CD45
הערה: שיטת IHC זו משמשת להדמיה של לויקוציטים מסתננים. שלבי חסימת האבידין/ביוטין משולבים עם שלבי החסימה והדגירה הראשונית של הנוגדנים.
- הכינו חיץ חוסם (2% BSA, 2% סרום ארנבים ב-1x PBS).
- העבר שקופיות למגש שקופיות זכוכית ושטוף פעמיים עם PBS-T (2 דקות כל אחת). הכינו תמיסת אבידין/חסימה (4 טיפות/מ"ל אבידין בסרום ארנבים 2% BSA/2% ב-1 x PBS, ראו טבלת חומרים).
- יש לייבש עודפי PBS-T סביב הרקמה באמצעות נייר טישו מעבדתי. בעזרת עט הידרופובי, ציירו עיגול סביב הרקמה והניחו את המגלשה בתא הלח.
- יש למרוח תמיסת אבידין/חסימה על כל מקטע (400 מיקרוליטר/מגלשה).
- מכסים תא לח ודגרים במשך 30 דקות בטמפרטורת החדר. במהלך שלב זה, הכינו נוגדנים נגד CD45 (טבלה משלימה 3) במאגר חוסם המכיל ביוטין (4 טיפות / מ"ל ביוטין, 2% BSA / 2% סרום ארנבים ב 1x PBS).
- הקש על פתרון החסימה מהחלקה למגבון מעבדה ללא סיבים. יש לטפוח סביב הרקמה באמצעות מגבון מעבדה כדי להסיר עודפי נוזלים.
- החזירו את המגלשה לתא לח. הוסף 400 μL של תמיסת נוגדנים CD45 (ראה טבלת חומרים) לסעיף. יש לדגור למשך הלילה ב-4 מעלות צלזיוס בתא לח מקורה.
- למחרת, יש לנקז את הנוגדנים הראשוניים ולשטוף מגלשות 3 x ב-PBS-T (5 דקות כל אחת).
- יש לייבש את האזור סביב המקטע באמצעות מעבדה נטולת סיבים ולאחר מכן להוסיף 400 μL של נוגדן משני (דילול 1:200 בחיץ חוסם) לכל מקטע. יש לדגור בטמפרטורת החדר למשך שעה אחת.
- בינתיים, להכין מגיב ABC (ראה טבלה של חומרים) על ידי הוספת 2 טיפות של מגיב A עד 5 מ"ל של 1x PBS ולערבב. מוסיפים 2 טיפות מגיב B לאותה תמיסה ומערבבים (מכינים ~30 דקות לפני השימוש).
- שטפו את המגלשות ב-3 החלפות של 1x PBS-T (5 דקות כל אחת) והניחו את המגלשות בתא לח.
- הוסף מגיב ABC 400 μL למקטעים. מכסים תא לח ודגרים במשך 30 דקות בטמפרטורת החדר.
- שטפו את המגלשות ב-3 החלפות של 1x PBS-T (5 דקות כל אחת). בינתיים, הכינו כמות מתאימה של תמיסת DAB בצינור צנטריפוגה 15 מ"ל מכוסה נייר כסף בהתאם להוראות היצרן (ראו טבלת חומרים).
- קח שקופית אחת והתמקד באזור חוט השדרה תחת מיקרוסקופ. הוסף 400 μL DAB לשקופית והפעל את טיימר המעבדה.
- דמיינו את הקטע בזמן שהוא מתפתח ועצרו טיימר כאשר לויקוציטים חומים. העבר את המגלשה לאמבטיה ddH20 כדי לעצור את התגובה. מחזיקים במים למשך 5 דקות. אותו זמן פיתוח משמש לשקופיות הנותרות.
אזהרה: DAB הוא חומר מסרטן. יש להשליך פסולת DAB ולאחר DAB ddH2O כפסולת מסוכנת. - שקופיות נגד כתמים עם Hematoxylin של Mayer במשך ~ 4-10 דקות (ראה טבלה משלימה 2). יש לשטוף מגלשות תחת מי ברז זורמים במשך 10 דקות.
- התייבש באתנול 95% (1 x 3 דקות), ואחריו אתנול מוחלט 100% (2 x 3 דקות כל אחד).
- מעבירים לתוך מכסה אדים, מעבירים את המגלשות לקסילן או לממס תחליפי קסילן למשך 5 דקות. מכסים עם אמצעי הרכבה, ומאפשרים למגלשות להתייבש במשך 1-2 ימים במכסה האדים.
אזהרה: אם אתם משתמשים בקסילן, השתמשו בכפפות כפולות ומלקחיים כדי לטפל במגלשות בעת החלקת כיסוי, מכיוון שהוא רעיל ויכול להמיס כפפות. - נקה את השקופיות באמצעות קסילן וסרוק באמצעות סורק שקופיות בהגדלה של 20x.
9. SMI-32 IHC לנזק אקסונלי
הערה: פרוטוקול זה משתמש בנוגדן SMI-32 של עכבר, אשר מגיב כנגד נוירופילמנט כבד שאינו פוספורילציה, אשר יכול להצטבר באקסונים פגועים25. מכיוון שנוגדן זה הועלה בעכבר ומזהה אנטיגן עכבר, מומלץ להשתמש בערכת עכבר על עכבר (MOM). בהליך זה, שלב חסימת האבידין/ביוטין נעשה כשלב נפרד מהדגירה הראשונית של הנוגדנים. לפני תחילת פרוטוקול זה, de-paraffinize, rehydrate, להרוות פעילות peroxidase אנדוגנית, ולבצע אחזור אנטיגן כמתואר בשלב 4 ושלב 7.
- שטפו חלקים פעמיים עם 2 x PBS-T (2 דקות כל אחד). הסר נוזלים מיותרים סביב מקטעים באמצעות רקמת מעבדה וצייר עיגול סביב רקמות באמצעות עט הידרופובי.
- הוסף 400 μL חוסם חיץ (2% (w/v) סרום עיזים ב 1x PBS-T) עם avidin (4 טיפות / מ"ל) למקטעים. יש לדגור במשך 15 דקות בטמפרטורת החדר.
- טבלו את המגלשות פעמיים ב-1x PBS-T. הוסיפו 400 מיקרוליטר של חיץ חוסם עם ביוטין (4 טיפות/מ"ל) למגלשה ודגרו במשך 15 דקות בטמפרטורת החדר.
- שטפו את המגלשות באמבט PBS-T אחד למשך 2 דקות. בינתיים, הכינו מגיב חוסם MOM על ידי הוספת 2 טיפות של תמיסת מלאי (ראה טבלת חומרים) ל -2.5 מ"ל של PBS 1x.
- הוסף 400 μL של מגיב MOM על הקטע. יש לדגור במשך שעה אחת בטמפרטורת החדר.
- שטפו את המגלשות פעמיים באמבט PBS-T אחד למשך 2 דקות. בינתיים, הכינו את MOM לדילול על ידי הוספת 300 מיקרוליטר של תמיסת מלאי תרכיז חלבון ל-3.75 מ"ל של 1x PBS.
- מוסיפים 400 μL של מדלל MOM ודגרים במשך 5 דקות בטמפרטורת החדר. בינתיים לדלל את נוגדן SMI-32 (ראה טבלה של חומרים) בדילול MOM.
- הקש על המדלל מהשקופיות והוסף 400 μL של תמיסת נוגדנים SMI-32 למקטע. מכסים את החדר הלח ודגרים במשך 30 דקות בטמפרטורת החדר.
- שטפו את המגלשות פעמיים באמבט PBS-T אחד למשך 2 דקות, כל אחת עם תסיסה עדינה. בינתיים, לדלל מגיב עבודה מסוג MOM נגד עכבר IgG במדלל (10 μL של מלאי ב 2.5 מ"ל של דילול).
- הוסף 400 μL של מגיב עבודה IgG נגד עכבר לכל שקופית. דוגרים במשך 10 דקות.
- שטפו את המגלשות פעמיים באמבט PBS-T אחד למשך 2 דקות כל אחת. המשך צביעה בהתאם לשלבים המתוארים בפרוטוקול צביעת CD45 (שלב 8.11 – 8.19).
10. ניקוד LFB ו- H&E לנוכחות נגעים דה-מיאלינציה
הערה: להלן גישת ניתוח שניתן ליישם כדי לקבל תובנות מהירות לגבי חומרת דמיאלינציה דלקתית. ניתוח זה מתבצע במקטעים של החבל שנדגמו ברמות שונות (צוואר הרחם, בית החזה והמותני, לפחות 3 מקטעים לכל רמה). עיין באטלס המוח אלן עבור חוט השדרהשל עכבר 26 כדי לסייע בזיהוי הרמה האנטומית של חוט השדרה. ניתוח זה דורש קבצי TIFF. אם התמונות הסרוקות הן בתבנית .cci, בצע את ההוראות בטבלה משלימה 4 כדי להמיר קובצי czi לקובצי TIFF.
- פתח את תמונת TIFF של המקטע לניתוח על-ידי גרירה ושחרור של הקובץ לתוך ImageJ. התבוננו בקטע חוט השדרה ב-4 רבעים: גבי, שמאלי לטרלי, ימין לטרלי וקדמי (איור 2A,B).
- ציון עבור נוכחות של נגעים דה-מיאלינציה בכל רביע כפי שמתואר באיור 2.
הערה: נוכחות נגע מביאה לציון 1 באותו רביע, ובסך הכל 4 נקודות אפשריות לכל קטע. ציון 1 מוקצה גם אם יש נגעים מרובים בתוך רביע. - חבר את כל הנקודות עבור כל עכבר וחלק במספר הכולל של הרבעים שנדגמו כדי לקבל את שבר הרבעים עם נגעים תת-קרום המוח.
11. חישוב חלק השטח של צביעת LFB בחומר לבן חוט השדרה
הערה: ניתוח זה מודד את אחוז השטח של החומר הלבן חוט השדרה המוכתם ב- LFB.
- פתח מקטע מוכתם ב- LFB שנשמר כקובץ TIFF על-ידי גרירה/שחרור של הקובץ לתוך ImageJ.
- לחץ על תמונה > הקלד > 8 סיביות כדי להפיק תמונה בקנה מידה אפור. לחץ על תמונה > התאם סף >. התאימו את המחוון התחתון כך שהכיסוי האדום ילכוד את כל האזורים הכהים (מיאלין) שנראים בעין (איור 2C–E). לחץ על החל.
- לחץ על ניתוח כלי > > ROI Manager כדי לפתוח את מנהל החזר ההשקעה.
- בחרו בכלי ציור מצולע בסרגל הכלים ImageJ. כלי ציור זה מאפשר לשרטט אזור של חוט השדרה באמצעות עכבר המחשב.
- שרטט את האזור הגבי של חוט השדרה והוסף את המצולע למנהל החזר ההשקעה על ידי לחיצה על t במקלדת.
- שרטט את האזור הקדמי-צדדי של החומר הלבן של חוט השדרה והוסף את המצולע למנהל החזר ההשקעה.
הערה: בעת מעקב, יש להוציא כלי דם גדולים, קרעים ברקמה, ממצאים ואזורים הסמוכים לקרן הגבית (איור 2A,B חץ), שהם בדרך כלל פחות מיאלין. היו מדויקים ככל האפשר בעת העקיבה מכיוון שהכללת יותר מדי רקע לבן תטה את התוצאות. - לחץ על נתח > קבע מדידות ובחר שבר שטח.
- לחץ על מדידה במנהל החזר ההשקעה. זה ייתן את החלק של האזור המתואר כי הוא מוכתם LFB.
- מתיבת התוצאות החדשה שנוצרה, העתק את הערכים ל- Excel וסגור את חלון התמונה. חשב את שטח השבר הממוצע של % המוכתם עבור האזורים הגביים והוונטרו-לטרליים. ממוצע אלה כדי לקבל ערך עבור סעיף זה.
- חזור על שלבים 11.1–11.9 עבור מקטעי צוואר הרחם, בית החזה והמותני (N = 3/level/mouse).
- חשב את אחוז הממוצע של מקטע המיאלין עבור כל המקטעים עבור כל עכבר. אחוז דה-מיאלינציה מוערך על ידי הפחתת אחוז הצביעה מ-100.
12. ניתוח מספר תאי CD45+ וביציות אקסון SMI-32+
- גרור ושחרר תמונת TIFF מוכתמת CD45 או SMI-32 לתוך ImageJ. לחץ על נתח > הגדר קנה מידה > גלובלי > אישור כדי להגדיר את סרגל קנה המידה בכל התמונות. שים לב שזה נעשה רק עבור התמונה הראשונה.
- בחר בכלי ציור המצולע ועקוב אחר החומר האפור באמצעות עכבר המחשב. לחץ על נתח > מדוד ורשום את התוצאות ב- Excel כ"אזור החומר האפור".
- כאשר המצולע המצויר עדיין על התמונה, הסר את החומר האפור מהתמונה על ידי לחיצה על מקש Delete (מקלדת). פעולה זו משאירה רק את החומר הלבן לניתוח.
- שרטט את כל קטע חוט השדרה באמצעות כלי ציור המצולע . אל תכלול אזורים של רקמה חסרים או פגומים.
- לחץ על נתח > למדוד ולהקליט את התוצאות כמו "שטח רקמות כולל" בקובץ Excel.
- לחץ על תמונה > צבע > deconvolution. בחלון הנפתח וקטורים, בחר H DAB. יופיעו שלושה חלונות חדשים – שמור על החלון בצבע חום (ערוץ DAB) ומחק חלונות תמונה אחרים.
- לחץ על תמונה > התאם סף >. התאימו את המחוון התחתון לסף התמונה כך שהכיסוי האדום ילכוד את אותה כמות של כתמים חומים שזוהו בעין. לחץ על החל.
- לחץ על Process > Binary > Watershed. בשלב זה השווה את התמונה המקורית ואת התמונה הבינארית כדי להבטיח שהם מסכימים.
- לחץ על נתח > נתח חלקיקים. בחר הצג כיסוי ושנה את ההגדרות: גודל = 5 - 150 מיקרומטר2, מעגליות = 0.4 - 1. לחץ על אישור.
הערה: הגדרות אלה מאפשרות לכלול תאים בודדים וקבוצות קטנות של תאים שלא פוצלו עם פונקציית פרשת המים, בניגוד לאי-הכללתם בניתוח. - בחלון התוצאות, רשום את המספר האחרון בעמודה השמאלית ביותר ב- Excel, המייצגת את ספירת החלקיקים הכוללת. לאחר מכן, חשב את שטח החומר הלבן (שטח הרקמה הכולל – שטח החומר האפור במ"מ2). בטא ספירת חלקיקים כוללת לכל אזור חומר לבן (ספירה/מ"מ2).
- חזרו על צעדים לכל תמונת RGB שנשמרה. לאחר שכל חלקי חוט השדרה נותחו עבור עכבר אחד, ממוצע ספירת החלקיקים למ"מ2 רקמה עבור אותו עכבר.
הערה: זרימת העבודה המשמשת לניתוח לויקוציטים של חוט השדרה יכולה להיות מיושמת גם על אזורי מוח.
13. מדידת sNF-L באמצעות בדיקת SIMOA
- איסוף דם של 100-200 מיקרוליטר מעכברים חיים על ידי דימום ספנוס באמצעות צינורות מיקרוטיינר נימיים או באמצעות ניקוב לב באמצעות מזרק ומחט 25 גרם (הליך סופני). עבור האחרון, להעביר דם לתוך צינור מיקרוצנטריפוגה 1.5 מ"ל.
- תנו לדם להיקרש בטמפרטורת החדר למשך 30-60 דקות.
- דגימות צנטריפוגה ב 2660 x גרם במשך 5 דקות ב 4 ° C ו pipete את החלק העליון (סרום) לתוך צינור microcentrifuge חדש. יש לאחסן את הסרום בטמפרטורה של -80°C עד שהוא מוכן לשימוש.
- אופן ההכנה: אפשר לכיילים ולפקדים (ערכת בדיקת NF-light, ראה טבלת חומרים) להתחמם לטמפרטורת החדר למשך שעה אחת לפני השימוש. הוציאו את מצע האנזים (RGP) מהמקרר והכניסו לאמבט מים בטמפרטורה של 30°C למשך 30 דקות לפחות, תוך ערבול כל 10 דקות.
- הפשירו את דגימות הסרום על קרח. לאחר ההפשרה, מערבלים בעדינות דגימות וצנטריפוגה ב 10000 x גרם במשך 5 דקות כדי לזרוק כל פסולת.
- טען את הצלחת: סובב את המכיילים ואת הפקדים. טען את המכיילים בכפילות, פקדים בשכפול ודגימות סרום בשכפול על צלחת 96 בארות שסופקה עם הערכה. דגימות הסרום מדוללות ביחס של 1:3 עם דילול המסופק בערכה. אוטמים את הצלחת.
- הפעל את מכונת SIMOA (ראה טבלת חומרים) לפי סדר המחשב, התוכנית ולאחר מכן ההתקן. אפשר למכשיר לאתחל ולהפעיל תחזוקת תחילת היום .
- מערבלים את החרוזים המגנטיים במשך 30 שניות.
- טען את הכרטיסיה ריאגנטים על המסך, לחץ פעמיים על מיקום ארון התקשורת שבו יש להציב את בקבוק המגיב ולאחר מכן סרוק את הברקוד של הבקבוק.
- הניחו חרוזים מגנטיים במצב רעד על המדף (מיקומים 1–3).
- המשך, טעינת הגלאי, מגיב SBG ומגיב RGP למכונה.
- לחץ על הגדרה בתוכנה. ודא שמצב הדגימה נמצא על הצלחת. בכרטיסיה setup run, תן שם לניסוי.
- הקצה בארות על הצלחת עבור המכיילים באופן הבא: לחץ על הבאר ולאחר מכן בחר את הבדיקה. בחר כיול A ולאחר מכן לחץ על עולה. סמן בארות A1-8 ולאחר מכן לחץ על משכפלים (2) כדי להקצות את הקואורדינטות להפעלת המכיילים בכפול. הפעל באמצעות פרוטוקול מסודר.
הערה: עיין בתעודת הניתוח (אתר היצרן) כדי לקבל את הריכוזים של כל כיול עבור כל מספר פריט מסוים. לאחר הקצאת בארות, לא ניתן לנווט הרחק ממסך זה מבלי לאבד את העבודה, עד שהצלחת ננעלת במקומה. - הקצה את הדוגמאות לפי השלבים הבאים:
- בפינה השמאלית התחתונה של המסך, לחץ על לחצן כדי להקצות את הדגימות. הדגש בארות שבהן הדגימות אמורות להיות ממוקמות.
- סמן את הבדיקה שיש להפעיל מהרשימה, בחר את מספר העותקים המשוכפלים וציין את דילול הלוח של 4x.
- כאשר הבארות עדיין מסומנות, הזן קידומת עבור מזהה הדגימה והמספר ההתחלתי ולאחר מכן לחץ על צור כדי להפיק מזהים רציפים עבור הדגימות. חזור על שלבים עבור דגימות בקרה.
- יש להעמיס לוחית לתוך מחזיק הצלחת (A1 עד A12).
- בממשק המסך, לחץ על דוגמאות תכנות שבוצעו והמשך לכרטיסייה משאבי מערכת. בדוק שכל מיכלי הריאגנטים מלאים ומכלי האשפה ריקים.
- לחץ על הפעל.
- לאחר השלמת הריצה, בדוק את עקומת הכיול תחת הכרטיסייה "הפחתת נתונים" על-ידי בחירת שם הבדיקה והלוחית.
- עבור אל "היסטוריית הפעלה" והשתמש במסננים כדי למצוא את ההפעלה האחרונה. בחר הפעל ולאחר מכן את כל התוצאות. לחץ על ייצוא ושמור את קובץ .csv. לחץ על דוח ולאחר מכן בחר דוח כיול אצווה ובחר את ההפעלה האחרונה. הצג את הדוח בתצוגה מקדימה וייצא אותו.
- הפעל את תחזוקת סוף היום המומלצת על-ידי היצרן. כבה את התוכנית, את ההתקן ולאחר מכן את המחשב.
Representative Results
איור 3 מראה צביעה ייצוגית של IHC והיסטוכימיה, עם דוגמאות של נגעי EAE חריפים (משמאל) ומבוגרים יותר (מימין). צביעה מייצגת של CD45 עם צביעה נגדית של המטוקסילין מוצגת באיור 3A,B. איור 3C-F מראה דוגמאות של צביעת LFB עם (איור 3C,D) או בלי (איור 3E,F) הכתם הנגדי H&E. למרות שהמטוקסילין אינו ספציפי לתאי מערכת החיסון, גרעיני תאי החיסון מוכתמים בצורה כהה יותר וניתן להבדיל בינם לבין תאים שוכנים במערכת העצבים המרכזית. איור 3G,H מראה צביעה מייצגת של אקסונים SMI-32+, מוכתמים בהמטוקסילין. שימו לב להופעה המוגברת של כתם זה בנגעי EAE ישנים יותר.
נזק של מסילות myelinated הוא הנפוץ ביותר בחוט השדרה ב EAE מורין פעיל וזה הגורם העיקרי לשיתוק במחלה זו 7,9. לפיכך, ניקוד לנוכחות דלקת ונזק לרקמות בחוט השדרה מקבל עדיפות בניתוחים היסטולוגיים. נגעי EAE מופיעים באופן ספורדי באזורים שונים (קדמיים, רוחביים או גביים) (איור 2A,B) וברמות שונות (עצה, מותני, בית חזה, צוואר הרחם) של חוט השדרה. שיטת ההטבעה המתוארת מבטיחה דגימה טובה של נגעים לאורך כל החבל. יותר מקטעים מוטבעים מאשר מנותחים, מכיוון שמקטעים מסוימים עלולים להינזק בתהליך העיבוד או החיתוך. כדי להבטיח דגימה מייצגת, לפחות 3 חלקים מייצגים מנותחים ברמות צוואר הרחם, בית החזה והמותני של חוט השדרה עבור כל עכבר. זהותה של כל דגימה מסונוורת על מנת שהאדם המבצע את הניתוח אינו מוטה בעת בחירת חלקים מייצגים לניתוח.
כדי לקבל תובנות מהירות על הבדלים בחומרה ההיסטולוגית של EAE, ניתן לקבל ניקוד לנוכחות של נגעים דה-מיאלינטיים תת-מנינגיאליים ברביע חוט השדרה במקטעים נבחרים (איור 2A,B). זוהי שיטה מהירה שניתן לבצע על תמונות סרוקות או באמצעות מיקרוסקופ אור. ניתוח זה רגיש מספיק כדי לזהות הבדלים בחומרת EAE היסטולוגית בין קבוצות כאשר EAE חמור בקבוצה אחת ומתון בקבוצה אחרת. לדוגמה, בניסוי באיור 4, EAE הושרה בנקבות מסוג בר (WT) ובעכברים עם מחיקה ב-OGR1 (OGR1 KO) באמצעות MOG p35-55/CFA בתוספת PTX. עכברים בקבוצת WT פיתחו EAE חמור עם שיתוק מוחלט, ואילו קבוצת הנוקאאוט OGR1 פיתחה מחלה קלה. הבדל זה בציון הקליני תואם להבדל בשבריר הרבעים שהיו להם נגעים תת-קרום המוח (איור 4C).
חשוב להשלים את הניקוד של נגעים דה-מיאלינציה עם אחוז חלק שטח של צביעת מיאלין כדי ללכוד את מידת האובדן של אקסונים מיאלין ו / או מיאלין במהלך ההתקפה האוטואימונית. בדוגמה באיור 4, אחוז מקטע המיאלין גם היה שונה במידה ניכרת בין עכברי OGR1 ועכברי WT (איור 4D). מקטע המיאלין באחוזים גם נמצא בקורלציה משמעותית עם ציון EAE המצטבר בעכברים עם EAE (איור 4E), ולכן משמש כמדד טוב לנזק הכולל לרקמות במחלה זו. שים לב שפרוטוקול זה אינו מבחין בעוצמת כתם המיאלין. אם זו התוצאה הרצויה, יש לבצע צביעה אימונופלואורסצנטית לחלבוני מיאלין כגון חלבון פרוטאוליפיד או חלבון בסיסי במיאלין ולמדוד את עוצמת הצביעה הזו.
במקרה שבו EAE חמור בשתי קבוצות ההשוואה, חלק גבוה יותר של רבעי חוט השדרה יכיל נגעים דלקתיים/דה-מיאלינטינג. במקרה זה, גישה רגישה יותר לציון דלקת היא לספור את מספר הלויקוציטים CD45+ לכל מ"מ2 חומר לבן (ראו צביעה מייצגת באיור 3A). שיבוט נוגדני CD45 המתואר כאן מזהה את כל הלויקוציטים החודרים, ומכתים רק תאי מיקרוגליה מזדמנים המווסתים את ביטוי CD45 ב-EAE (ראו חץ פתוח באיור 3B), ולכן הוא שימושי בלכידת חדירת תאי מערכת החיסון ההיקפיים.
במחקרי EAE ארוכי טווח (>20 יום), מומלץ לבצע גם ניתוח של פגיעה באקסון. צביעת SMI-32 בחלקי חוט השדרה היא שיטה רגישה לאיתור אקסונים פגומים. אף על פי שהדלקת בחוט השדרה שוככת עם הזמן, ואקסונים שנחסכו יכולים לעבור למיאליזציה מחדש, אקסונים ששרדו מפגינים מידה דיפרנציאלית של פגיעה שיורית9 (איור 3G,H). לדוגמה, במודל MOG p35-55-induced של EAE בעכברי C57BL6/J, מידת הפגיעה והאובדן האקסונליים היא גורם לציונים קליניים לאחר שהתהליך הדלקתי שכך9. איור 5 מראה דוגמה לכך בניסוי EAE בעכברים זכרים ונקבות WT, עכברים ועכברים שחסרים בגן שנקרא peroxisome proliferator-activated receptor-delta (PPAR-delta) בתא המיאלואידי (LysMCre: Ppardfl/fl). אצל הזכרים, עכברי WT חזרו לתפקד בגפיים האחוריות, אך התוצאות הקליניות נותרו גבוהות בקבוצת LysMCre: Ppardfl/fl. לעומת זאת, בניסוי בנקבות, שתי קבוצות הניסוי השיגו ציונים גבוהים לאורך כל הדרך. במבט ראשון, תוצאה זו הצביעה על כך של-PPAR-delta הייתה השפעה ספציפית למין ב-EAE; אולם ניקוד פתולוגי של חוט השדרה גילה שלעכברים משני המינים בקבוצת LysMCre: Ppardfl/fl הייתה פגיעה אקסונלית מוגברת בהשוואה לעמיתיהם ב-WT (איור 5B). השפעה גנוטיפית על התוצאות הקליניות ככל הנראה לא נצפתה בנקבות מכיוון שנקבות עכברי WT נטו להציג פגיעה אקסונלית מוגברת, שהתבטאה בליקויים נוירולוגיים כרוניים.
באותו ניסוי, נקבות LysMCre: Ppardfl/fl עכברות נמצאו עם חדירה נרחבת יותר של תאי T במוח הקטן, מה שמספק דוגמה לאופן שבו ניקוד דלקת במוח עשוי להיות שימושי ב- EAE. ב-EAE, דלקת במוח נמצאת בעיקר במוח הקטן ובגזע המוח (איור 6A,D,G), אולם ניתן למצוא אותה גם בקרומי המוח (שניתן לראות מתחת להיפוקמפוס באיור 6C), ליד החדרים (איור 6F), ובמערכות חומר לבן אחרות כולל עצב הראייה וקורפוס קולוסום (איור 6B,E). ניקוד דלקת המוח נעשה באזור מסוים במוח (למשל, חומר לבן המוח הקטן) על ידי ספירת מספר תאי CD45 לכל אזור רקמה2 מ"מ באמצעות אותה מתודולוגיה המתוארת עבור פרוטוקול חוט השדרה. בשיטת גרוסינג המתוארת כאן, חתך נמצא באמצע המוח הקטן, אשר מספק את נקודת המבט של המוח הקטן וגזע המוח כפי שמוצג באיור 6A.
מדידת sNF-L באמצעות בדיקת SIMOA הפכה לסמן ביולוגי שימושי להערכת פגיעה אקסונלית מתמשכת ותגובות לטיפול בטרשת נפוצה התקפית-הפוגתית20,21,27,28. אותה ערכת בדיקת SIMOA המשמשת למדידת sNF-L בני אדם ניתנת ליישום למדידת sNFL 22,23,24 של עכבר. כדי לחקור את הביצועים של בדיקה זו בזיהוי פגיעה אקסונלית ב-EAE, sNF-L נמדד בנקבות עכברי C57BL6/J בנקודת הסיום של ניסוי EAE, והרמות הושוו לאלה בעכברי ביקורת בריאים תואמי מין שלא היה להם EAE. נמצא שלעכברים עם EAE היו רמות גבוהות בהרבה של sNF-L מאשר בעכברים בריאים (איור 7A), והרמות האלה מתואמות עם צפיפות האקסונים של SMI-32+ בחוט השדרה (איור 7B). בהשוואה לניקוד היסטולוגי של פגיעה אקסונלית, בדיקת SIMOA מהירה יותר (מעכברים מדממים לתוצאות ניתן להשיג תוך קצת יותר מחצי יום) ולכן מספקת משוב מהיר על אופן הפעולה של הטיפול בעכברים חיים. לבדיקה זו יש גם יתרון בכך שהיא משקפת פגיעה אקסונלית הן בעמוד השדרה והן במוח.

איור 1: גוש פרפין מייצג של אזורי המוח וחוט השדרה. 5 חתכי המוח העטרתיים וחתך חוט השדרה (בעובי 1.5-2 מ"מ) מוטמעים באותו בלוק על מנת שניתן לחתוך אותם בחתך אחד. יש להטמיע לפחות 15 חלקים של חוט השדרה, המאפשרים בחירה נאותה של חלקים לניתוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
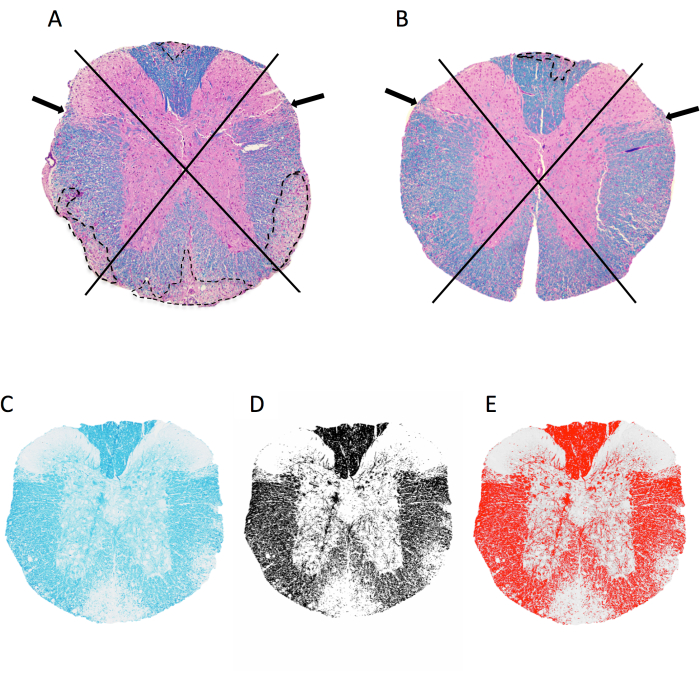
איור 2: ניקוד דלקת קרום המוח ואחוז אזור המיאלין ברמת חוט השדרה החזי. (A,B) הצג תמונות של חוט השדרה החזי מנקבת עכבר C57BL6/J עם MOG p35-55-induced EAE מוכתם ב-LFB/H&E. מוצגת הגישה המשמשת להמחשת רבעים ודוגמאות של נגעים דה-מיאלינציה (מסומנים בקו מקווקו). לעכבר ב- A יש 4 מתוך 4 רבעים עם נגעים דה-מיאלינאטים מתמזגים, בעוד שלעכבר ב- B יש 1 מתוך 4 רבעים מושפעים. לעכבר ב-B יש אמנם דלקת מסוימת ברבעים אחרים, אך זו לא התבטאה בנגע קונפלואנטי ולכן אינה מנוקדת. (ג-ה) דוגמה של תמונת LFB, והתמונה בגווני אפור וסף בתמונהJ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
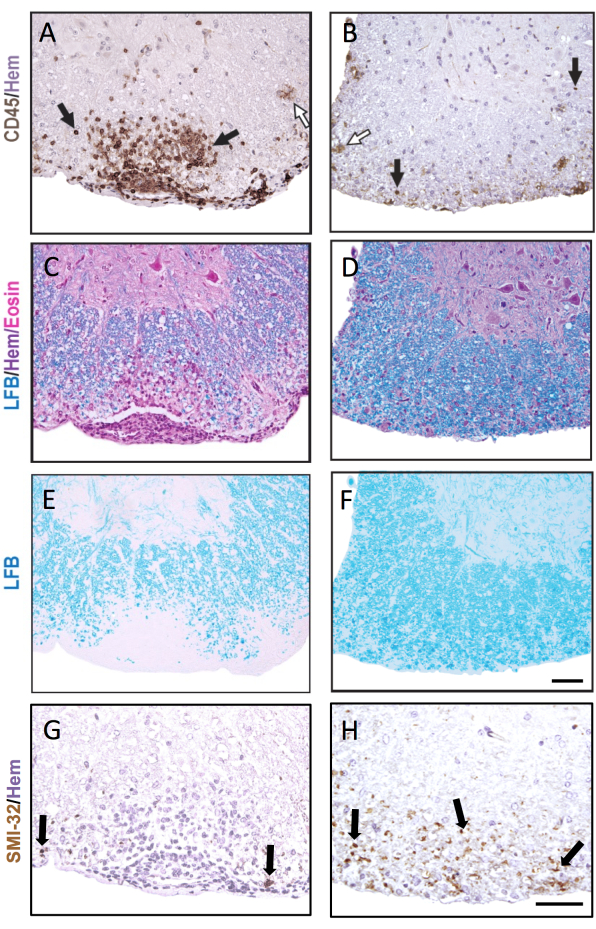
איור 3: חלקי חוט השדרה מוכתמים ב-CD45, LFB H&E, LFB ו-SMI-32. דוגמאות לנגע תת-קרום המוח מוקדם (A,C,E,G) ומאוחר (B,D,F,H) בחוט השדרה המוכתם בנוגדן CD45 (A,B), LFB/H&E (C,D), LFB בלבד (E,F) ונוגדן SMI-32 (G,H). חיצים שחורים מראים דוגמאות של תאים מוכתמים בכל נוגדן בהתאמה. חיצים לבנים מראים מיקרוגליה משוערת שהוכתמה כ- CD45+. סרגל קנה מידה = 50 מיקרומטר. איור זה מראה צביעה מייצגת של נגעים בחוט השדרה של נקבת עכבר C57BL6/J במהלך EAE ומדגיש כיצד פתולוגיה יכולה להיות שונה בין חלקי חוט שדרה שונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
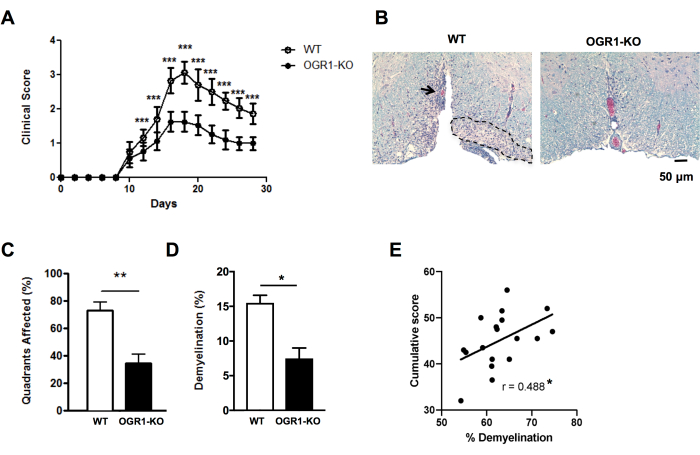
איור 4: יישום הניקוד עבור נגעים ואחוז דה-מיאלינציה ב-EAE. דוגמה לניסוי EAE שבו נקבות עכברים עם מחסור בגן קולטן מצומד לחלבון G (OGR1) של סרטן השחלות על רקע C57BL6/J פיתחו EAE קליני פחות חמור מאשר נקבות C57BL6/J של נקבות Wildtype (WT). EAE הושרה על ידי חיסון עם MOG p35-55/CFA בתוספת PTX ועכברים דורגו על פי הסולם הקליני הבא: 1 = שיתוק זנב. 2 = חולשת גפיים אחוריות וכף רגל, 3 = שיתוק גפיים אחוריות, 4 = חולשת גפיים קדמיות, 5 = חולשה. (A) ציונים קליניים ממוצעים + SEM של עכברים לאורך זמן. (B) מוצגת דוגמה לצביעת LFB/H&E בחוט השדרה הגחוני. סרגל קנה מידה = 50 מיקרומטר. (C) ממוצע + SEM אחוז רבעים שהכילו נגעים דה-מיאלינטינג. (D) ממוצע + SEM אחוז דה-מיאלינציה בכל קבוצה. (E) מראה תוצאות מניסוי אחר ב-MOG p35-55-induced EAE בעכברי C57BL6/J, שבו ציוני EAE של עכברים בודדים סוכמו במהלך 30 ימי התצפית והיו בקורלציה עם אחוז דה-מיאלינציה בחוט השדרה. המתאמים בוצעו באמצעות מבחן ספירמן. לוחות ב (A-D) מותאמים מ Souza C et al.29. הנתונים ב-(E) הם נתונים מקוריים. *P<0.05, **P<0.01, ***P<0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
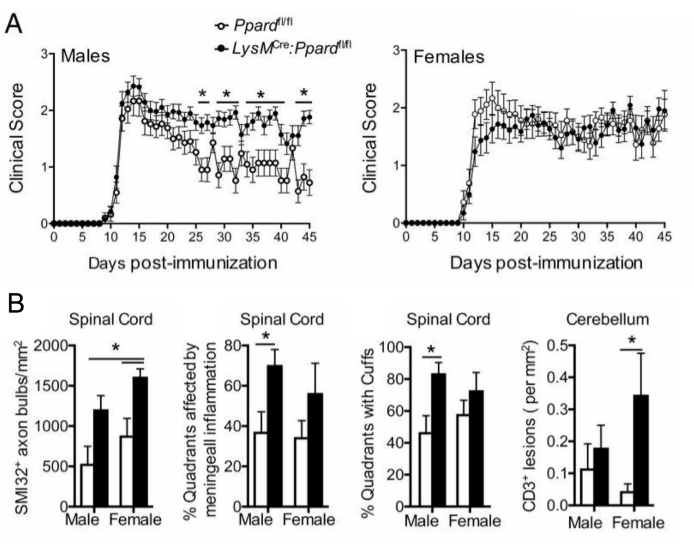
איור 5: יישום צביעת SMI-32 כדי להבין את ההשפעה של גנוטיפ על פנוטיפ EAE קליני. איור זה מראה דוגמה לניסוי EAE שבו זכרים ונקבות פראיים (נושאים אלל פלוקסי של Ppard) ועכברים מוטנטיים ספציפיים למיאלואיד Ppard (LysMCre: Ppardfl/fl) על רקע C57BL6/J חוסנו ב-MOG p35-55/CFA וב-PTX והיו במעקב במשך 45 יום. (A) מציג את הציונים הקליניים הממוצעים + SEM של עכברים. (B) מראה ממוצע + תוצאות SEM של ניקוד היסטולוגי של מספר אקסונים SMI-32+ בחוט השדרה, %רבעים עם נגעים תת-קרום המוח, אחוז רבעים עם אזיקים פריווסקולריים, ו-#CD3 נגעים במוח הקטן למ"מ2 רקמה. ניסוי זה הראה השפעה גנוטיפית על צביעת SMI-32. נתון זה נלקח מ Drohomyrecky. ואח'15. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
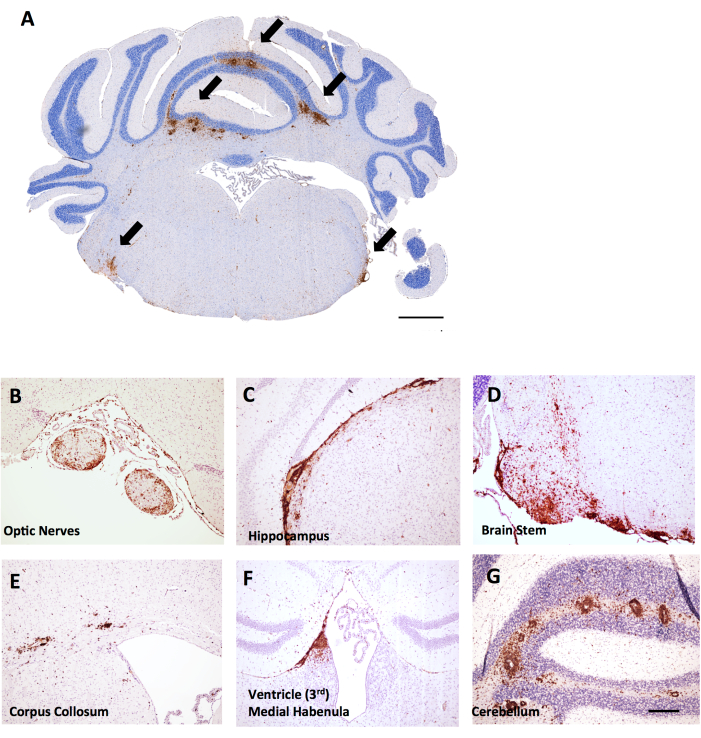
איור 6: דוגמאות לצביעת CD45+/hematoxylin במקטעי העטרה במוח ב-MOG p35-55-induced EAE בעכברי C57BL6/J נקבות. נגעי CD45+ מוצגים בצבע חום. (A) נגעי CD45+ בגזע המוח של חתכי העטרה. סרגל קנה מידה = 150 מיקרומטר. (ב-ג) דוגמאות לנגעי CD45+ בעצבי הראייה (B), שלוחות קרום המוח מתחת להיפוקמפוס (C), גזע המוח (D), קורפוס קולוסום (E), הבנולה המדיאלית ליד החדר (F) והמוח הקטן (G). סרגל קנה מידה: (B-G) = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
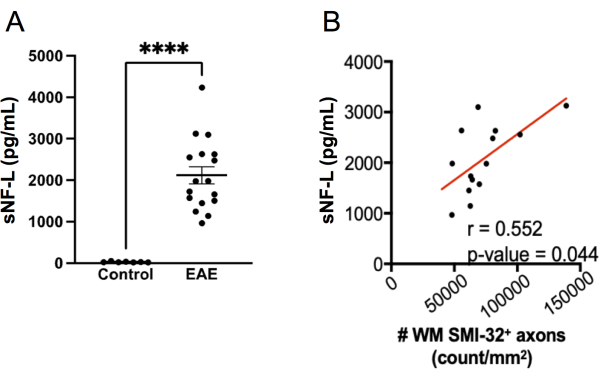
איור 7: רמות sNF-L בסרום ב-MOG p35-induced EAE. (A) רמות NFL בסרום שנאספו מעכברי ביקורת נקבות ועכברי EAE בנקודת הסיום של ניסוי אחד. הנתונים נותחו באמצעות מבחן מאן ויטני דו-זנבי. (ערך ****p < 0.0001). (B) מקטעי חוט השדרה נקצרו בנקודת הקצה ומוכתמו ב-SMI-32. מספר התאים החיוביים לכל אזור רקמת החומר הלבן נקבע ותואם עם NF-L בסרום בנקודת הקצה באמצעות בדיקת ספירמן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: תיאור אמבטיות המשמשות לעיבוד רקמות. קלטות מועברות באופן אוטומטי דרך סדרות אלה של אמבטיות באמצעות מעבד אוטומטי. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: שלבים בכחול לוקסול מהיר והמטוקסילין וצביעת אאוסין. טבלה זו מתארת את סדר השלבים בפרוטוקול הצביעה Luxol Fast Blue ו- Hematoxylin and Eosin. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 3: נוגדנים המשמשים לצביעה אימונוהיסטוכימית. מתוארים הנוגדנים המשמשים בפרוטוקול זה, כמו גם אלה שניתן להשתמש בהם כדי לחקור עוד יותר דלקת, מיקרוגליוזיס ואסטרוגליוזיס. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 4: כיצד להמיר קבצי .czi לקבצי TIFF. שים לב שאופטימלי להשתמש בתמונה ברזולוציה גבוהה, אך ניתן לשמור תמונות ברזולוציה בינונית במקום זאת אם זיכרון העבודה של המחשב מוגבל. זה הכרחי להשתמש בתמונות של אותה רזולוציה על פני ניתוחים. כמו כן, שים לב שהתמונה האחרונה של הסידרה היא תווית השקופית. הימנע מקריאת התווית כדי להבטיח שהניתוח עיוור. 30,31 אנא לחץ כאן להורדת קובץ זה.
Discussion
צביעה היסטולוגית של חוט השדרה היא כלי חשוב בהערכת חומרת המחלה, במיוחד במקרים בהם קיימים הבדלים בין קבוצות הטיפול במידת ההחלמה מהמחלה בשלב הפוסט-אקוטי של המחלה. צביעה בגין חדירת תאי מערכת החיסון (CD45), מיאלין (LFB) ופגיעה אקסונלית (SMI-32) מסייעת לאפיין את הגורם הבסיסי לשינוי הציונים הקליניים בעכברים. פרוטוקול הצביעה ההיסטולוגית המתואר כאן מספק פרספקטיבה של דלקת, כמו גם את מידת הפגיעה במיאלין ובאקסונל. יתר על כן, התוצאות המוצגות מאמתות מדידת sNF-L כשיטה להעריך את היקף הנזק העצבי הכולל ב- EAE.
הפרמטרים הקריטיים לניתוח זה הם להבטיח שהחוקרים יהיו עיוורים לזהות המקטעים ושיש דגימה שוות ערך בכל רמה של חוט השדרה על פני העכברים השונים. הסיבה לכך היא שחומרת הדלקת יכולה להיות גדולה יותר ברמות נמוכות יותר של הטבל. פרמטר קריטי נוסף הוא גודל קבוצות הניסוי. חוטי השדרה והמוח נקצרים בדרך כלל מ-6-8 עכברים לכל קבוצה בנקודת הסיום כדי לראות הבדלים משמעותיים בין קבוצות עם טיפולים או גנוטיפים בעלי גודל השפעה צנוע. חשוב גם לוודא שלעכברים נבחרים, כאשר הם ממוצעים, יש ציונים ממוצעים מייצגים של הקבוצה כולה. לגבי פתרון בעיות, בעיה נפוצה בה נתקלים אלה שאינם מנוסים בפרוטוקול היא שחוט השדרה קבוע למשך זמן לא מספיק והוא אינו נשלף בקלות מעמוד השדרה. אם זה המקרה, ניתן לנתח את חוט השדרה באופן ידני מהעמוד על ידי חיתוך לאורך תהליכי עמוד השדרה באמצעות מספריים עדינים ופתיחת העמוד כדי לחשוף את חוט השדרה. לחילופין, ניתן לקבע רקמות למספר ימים נוספים מבלי להפריע להצלחת צביעת הנוגדנים. שיבוט הנוגדנים המתואר כאן עובד ברקמה קבועה עד שבועיים בפורמלין.
הטבעה של חלקי חוט השדרה דורשת מיומנות ותרגול. מומלץ להרכיב זכוכית מגדלת ולכוון מנורה מעל עמדת ההטבעה כדי לראות טוב יותר אם החתכים נופלים בחתך רוחב או בחתך אורך. שמירה על אורכם של חלקי חוט השדרה בפחות מ -2 מ"מ במהלך הברוטו תעזור להם ליפול בחתך רוחב. בעיה נפוצה נוספת בה נתקלים משתמשים פחות מנוסים היא שה-LFB מתאדה במהלך הדגירה הלילית, ומשאיר חצי מהמגלשה מוכתמת וחצי לא מוכתמת. כדי למנוע אידוי, יש לאטום את צלחת צביעת הזכוכית בסרט תרמופלסטי ולאחר מכן בניילון נצמד. אם מתרחשת אידוי וחלקים מוכתמים באופן לא אחיד, מומלץ להסיר לחלוטין את הכחול של המגלשות עם ליתיום פחמתי ולהכתים אותן שוב ב- LFB למשך הלילה. בעיה נפוצה נוספת היא שמשתמשים אינם מבטלים לחלוטין את הכחול של החומר האפור לאחר LFB. זה קריטי לבחון חלקים בודדים תחת המיקרוסקופ כדי לוודא כי כמות מספקת של de-bluing הושגה לפני שתמשיך עם צעדים אחרים בפרוטוקול. בנוסף, למרות שכתמי CD45 ו- SMI-32 IHC מתפקדים בצורה חזקה, עדיין חשוב לפתור את ריכוזי הנוגדנים בניסויים ראשוניים עבור כל מנת נוגדנים חדשה שמתקבלת. זה יכול להיעשות על ידי בדיקת מגוון ריכוזים של הנוגדן על קטע בקרה חיובית (EAE חוט השדרה). צביעה ראשונה צריכה לכלול גם בקרה שלילית המורכבת מנוגדן משני בלבד ללא הוספת נוגדן ראשוני. לבסוף, קריטי בניתוח התמונות לסף תמונות בודדות מכיוון שהצביעה יכולה להיות לא אחידה בין שקופיות או מקטעים.
פרוטוקול זה משתמש בתוכנה זמינה באופן חופשי. אם אין לאדם גישה למעבד, להטמעה או למיקרוטום, ניתן להפנות שלבים אלה לליבת פתולוגיה מבוססת בית חולים המציעה שירותים אלה. כמו כן, אם אין לאדם גישה לסורק שקופיות, ניתן להשתמש במיקרוסקופ אור המצויד במצלמת וידאו כדי לשמור תמונות TIFF של חוט השדרה או אזורי המוח. לזרימת עבודה מבוססת מיקרוסקופ, לכוד קטעי LFB או LFB/H&E בהספק נמוך (הגדלה של 40x) ועבור צביעת CD45 ו-SMI-32, צלם לפחות ארבעה חלונות המרוכזים בחלקים הגחונים, הגביים והצדיים של חוט השדרה (הגדלה של פי 200 עבור CD45 והגדלה של 400x עבור SMI-32). ניתן לבצע ניתוח תמונות על תמונות אלה כדי לכמת את הצביעה באופן דומה למתואר.
ההחלטה באיזו גישה היסטולוגית לנקוט כדי לדרג EAE תלויה עד כמה הציונים הקליניים שונים בין הקבוצות. לדוגמה, אם יש הבדלים דרסטיים בניקוד הקליני של EAE (קבוצה אחת קיבלה EAE ואחת לא), זה בדרך כלל מתייחס להבדלים בדלקת בתיווך היקפי. במקרה זה, ניקוד עבור נוכחות של נגעים demyelinating על חלקים מוכתמים LFB / H&E הוא מספיק ויגלה הבדלים בין קבוצות. אם הקבוצות דומות יותר בניקוד הקליני בתחילת המחקר, ובמקום זאת יש הבדלים במידת ההחלמה הקלינית (לדוגמה, ניסוי באיור 5A), עדיף ליישם את זרימת העבודה ההיסטולוגית המלאה המתוארת כאן, כולל ניקוד של דלקת במוח בגזע המוח ובמוח הקטן, כדי להבחין אם ההבדלים בכרוניקה של המחלה קשורים להבדלים בדלקת או לנזק לרקמות. אם נמצאו הבדלים בדלקת כפי שהוערכו על ידי ספירת CD45, ניתן לבצע מחקרי IHC נוספים כדי להכתים תאי T (אנטי CD3), מונוציטים / מקרופאגים מסתננים (Mac3) ומיקרוגליה (Iba-1/TMEM119) (שיבוטים מומלצים של נוגדנים נמצאים בטבלה משלימה 3). הפעלת מיקרוגליה משתקפת על ידי עלייה בעוצמת צביעת Iba-1 על מיקרוגליה בעלת תווית כפולה Iba-1+TMEM-19+ ונסיגה מוגברת של תהליכי מיקרוגליה שניתן להעריך על ידי ניתוח שול בסעיפים32. יתר על כן, טכניקות כמו ציטומטריית זרימה או ריצוף RNA של תא בודד יכולות להיות מיושמות כדי לבצע אפיון עמוק יותר של התדירות והפנוטיפ של אוכלוסיות החיסון במוח ובחוט השדרה.
ספירת אקסונים SMI-32+ היא שיטה רגישה לאיתור פגיעה באקסון ב-EAE32,33 וב-MS34. SMI-32, אשר מזהה את הצורה הלא זרחנית של neurofilament כבד או בינוני מצטבר נורות קצה של נוירונים transected. חלופה לאיתור אקסונים פגועים היא להכתים בחלבון מבשר עמילואיד (APP) שיכול להצטבר באקסונים כתוצאה משיבוש בהעברת האקסון33. דפוס הכתמים עבור SMI-32 ו- APP למרות ששניהם משקפים פגיעה באקסון, אינם חופפים בדרך כלל, מה שמעיד על כך שהם מזהים פתולוגיות שונות33. ניתן גם להשלים מדדים היסטולוגיים של פגיעה אקסונית על ידי מדידת sNF-L, שהוא מדד מהיר ורגיש לפגיעה אקסונלית מתמשכת הן בעמוד השדרה והן במוח. זה מציע את היתרון כי זה יכול להיעשות בחצי יום בעכברים חיים. החיסרון של שיטה זו הוא שהערכות יקרות והמכונה מתמחה מאוד. החברה שמוכרת את ערכת sNF-L מציעה תשלום עבור שירות למי שאין לו גישה למכונת SIMOA. חלופה להערכת פגיעה באקסון היא ניקוד עבור אובדן אקסונים על ידי ספירת אקסונים במקטעים מוכתמים בכחול טולוידין של חוט השדרה12 או ספירת צרורות נוירופילמנט שזוהו על ידי SMI-31 באזורים של החומר הלבן של חוט השדרה32. שתי גישות אלה מייגעות יותר מאשר מדידת SMI-32 או sNF-L.
אם הציונים הקליניים של EAE שונים בין הקבוצות, אך ניקוד עבור דלקת, דמיאלינציה ופגיעה אקסונלית אינו מגלה הבדלים בין הקבוצות, ייתכן שיהיה שימושי להכתים עבור הפעלת אסטרוציטים באמצעות GFAP (ראה טבלה משלימה 3 לשיבוט נוגדנים מומלץ). הפעלת אסטרוציטים קשורה לעלייה בצביעת GFAP וזה הוכח בקורלציה עם התקדמות EAE בכמה מודלים של EAE, כולל EAE כרוני בחולדת DA35.
לסיכום, פרוטוקול זה מתאר שיטות ומספק זרימת עבודה של ניתוח לביצוע ניקוד היסטולוגי של EAE.
Disclosures
שאנון דאן מייעצת עבור FSD Lucid Psycheceuticals.
Acknowledgements
אנו מודים לד"ר ריימונד סובל (אוניברסיטת סטנפורד) על שהראה לנו את השיטה שלו לגרוס ולתקן קטעי מוח וחוט שדרה. אנו מודים לקייל רוברטון ולמילאן גנגולי ממרכז טורונטו לפנוגנומיקה על לימוד שיטת ההטבעה ועל חיתוך כל כך הרבה מחלקי המוח וחוט השדרה שלנו. אנו מודים לד"ר מתיו קוסיק ולד"ר רוברט פוג'ינאמי (אוניברסיטת יוטה) על שיתוף הפרוטוקולים שלהם לניקוד דלקת תת-קרום המוח והפריווסקולרית בחוט השדרה. אנו מודים לשלינה עוסמאן על שיתוף השיבוט של נוגדן CD45. אנו מודים ל-Xiofang Lu על ההכשרה במעבד הרקמות ובתחנת הטמעת הרקמות, ועל תחזוקת ציוד זה במרכז המחקר קינן למחקר ביו-רפואי בבית החולים סנט מייקל. עבודה זו נתמכה על ידי מענק ביו-רפואי מטרשת נפוצה קנדה (ל-SED). כרמן אוצ'יפארי נתמכת על ידי סטודנטית מממשלת קנדה. נוריה אלוורז-סנצ'ז נתמכת על ידי מלגת קינן לפוסט-דוקטורט.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
References
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved