Pontuação de Inflamação, Desmielinização e Lesão do Axônio do Sistema Nervoso Central na Encefalomielite Autoimune Experimental
In This Article
Summary
A encefalomielite autoimune experimental (EAE) serve como modelo animal de esclerose múltipla. Este artigo descreve uma abordagem para pontuar inflamação medular, desmielinização e lesão axonal em EAE. Adicionalmente, um método para quantificar os níveis de luz solúvel dos neurofilamentos no soro de camundongos é apresentado, facilitando a avaliação da lesão axonal em camundongos vivos.
Abstract
A encefalomielite autoimune experimental (EAE) é um modelo comum de esclerose múltipla (EM) de base imunológica. Esta doença pode ser induzida em roedores pela imunização ativa com componentes proteicos da bainha de mielina e adjuvante completo de Freund (CFA) ou pela transferência de células T efetoras específicas da mielina de roedores preparados com proteína mielina/CFA para roedores virgens. A gravidade do EAE é tipicamente pontuada em uma escala clínica de 5 pontos que mede o grau de paralisia ascendente, mas essa escala não é ideal para avaliar a extensão da recuperação do EAE. Por exemplo, os escores clínicos permanecem altos em alguns modelos de EAE (por exemplo, modelo de EAE induzido por peptídeo de glicoproteína de oligodendrócitos de mielina [MOG]), apesar da resolução da inflamação. Assim, é importante complementar o escore clínico com o escore histológico do EAE, que também fornece um meio para estudar os mecanismos subjacentes da lesão celular no sistema nervoso central (SNC).
Aqui, um protocolo simples é apresentado para preparar e manchar seções da medula espinhal e do cérebro de camundongos e para pontuar inflamação, desmielinização e lesão axonal na medula espinhal. O método para pontuar a infiltração leucocitária na medula espinhal também pode ser aplicado para pontuar a inflamação cerebral no EAE. Um protocolo para medir a luz solúvel de neurofilamentos (sNF-L) no soro de camundongos usando um ensaio Small Molecule Assay (SIMOA) também é descrito, o que fornece feedback sobre a extensão da lesão global do SNC em camundongos vivos.
Introduction
A encefalomielite autoimune experimental (EAE) é o modelo murino mais comum para a doença desmielinizante humana, a Esclerose Múltipla (EM)1. A patologia inflamatória clássica da EM, incluindo a infiltração de células T helper produtoras de IFN-γ (gama) e IL-172, a infiltração de monócitos inflamatórios3, a formação de lesões desmielinizantes inflamatórias perivasculares e submeníngeas4 e a ocorrência de lesão axonal4 no sistema nervoso central (SNC), também é observada nas EAE 5,6,7,8,9. A semelhança nos mecanismos imunológicos entre EAE e MS tornou o EAE um modelo pré-clínico adequado para testar a eficácia e os mecanismos de ação de várias terapias imunológicas aprovadas para a EM, incluindo natalizumabe, fingolimode, fumarato de dimetilo e acetato de glatiramer (revisado em 1,5). Alguns regimes EAE modelam outros aspectos da patologia progressiva da EM além da lesão axonal, incluindo o desenvolvimento de inflamação submeníngea no cérebro, desmielinização crônica, atrofia medular, sinapse e perda de neurônios 6,10,11,12. Assim, a EAE tem utilidade para rastrear a eficácia de terapias neuroprotetoras para a SM.
EAE é induzido em roedores de várias maneiras. A imunização ativa é o método de indução mais comum e envolve a imunização de roedores com antígenos da mielina (proteínas integrais ou peptídeos) emulsionados em CFA suplementado com Mycobacterium tuberculosis morto pelo calor 13. Dependendo da cepa do camundongo, a toxina pertussis (PTX) também é administrada no dia 0 e no dia 2 da imunização para aumentar a penetrância da doença13. O EAE também pode ser induzido pela transferência adotiva de células T mielina-específicas obtidas de camundongos preparados com mielina/CFA para camundongos saudáveis14 ou pode se desenvolver espontaneamente em camundongos que superexpressam receptores de células T específicos para os principais antígenos da mielina5.
A gravidade e a progressão da doença EAE são comumente pontuadas usando uma escala clínica discreta de 5 pontos: 1 – claudicação da cauda, 2 – fraqueza dos membros posteriores ou pés, 3 – paralisia completa em um ou ambos os membros posteriores, 4 – fraqueza dos membros torácicos, 5 – moribundos ou mortos13. Esse sistema de escore clínico é sólido em documentar a progressão da paralisia ascendente que ocorre no início da doença, mas é menos sensível em capturar a extensão da recuperação de ataques inflamatórios do SNC. Por exemplo, tanto os ratos que deambulam com dificuldade como os ratos que deambulam facilmente, mas apresentam fraqueza de preensão dos pés, recebem uma pontuação de 2 na escala EAE. Os escores podem permanecer elevados na fase pós-aguda do EAE devido à presença de lesão ou perda permanente do axônio, mesmo apesar da resolução da respostainflamatória9. Houve uma variedade de tentativas de desenvolver sistemas de pontuação mais refinados, testes comportamentais, medidas de força de membros pélvicos e de preensão manual e sistemas de monitoramento infravermelho para melhor captar diferenças nos déficits clínicos em EAE9,16,17,18; no entanto, essas medidas de pontuação mais intrincadas não distinguem a contribuição da inflamação versus lesão tecidual para os déficits neurológicos subjacentes. Assim, a abordagem padrão-ouro para pontuar a gravidade do EAE é realizar pontuação clínica e histológica.
Aqui, é descrito um protocolo de como dissecar e incorporar espécimes da medula espinhal e do cérebro de camundongos em parafina de forma a capturar o processo estocástico de formação de lesões que ocorre no EAE. Também é apresentado um protocolo de como corar cortes com Luxol fast blue (LFB), originalmente criado por Kluver e Barrera19, que detecta mielina no SNC. Os cortes são corados apenas com LFB (para análise de desmielinização) ou são contracorados com hematoxilina e eosina (H&E) para ajudar a visualizar e pontuar lesões inflamatórias. Protocolos também são fornecidos para quantificar a presença de leucócitos totais (CD45), a perda de mielina e o número de axônios lesados (SMI-32) na medula espinhal usando anticorpos disponíveis comercialmente, técnicas de imuno-histoquímica (IHQ) e software de acesso público. O protocolo usado para quantificar leucócitos na medula espinhal também pode ser aplicado para quantificar leucócitos no cérebro.
A avaliação histológica da perda e lesão axonal no cérebro é comparativamente mais difícil do que na medula espinhal, uma vez que os tratos da substância branca cerebral não correm em paralelo uns aos outros. A medida da luz sérica de neurofilamentos (sNF-L) tem emergido como um promissor biomarcador de lesão neuronal naEM20,21. Estudos recentes têm estendido essa tecnologia para EAE 22,23,24. Aqui, um método é apresentado para medir a luz de neurofilamento sérico (sNF-L) em camundongos vivos usando um ensaio Small Molecule Assay (SIMOA). Este método requer apenas uma pequena quantidade de soro e pode ser feito em camundongos vivos em apenas meio dia, fornecendo feedback rápido sobre como uma terapia testada está afetando a lesão geral do SNC. Todos os métodos descritos aqui podem ser aplicados a camundongos de qualquer sexo ou linhagem.
Protocol
Todos os experimentos realizados com camundongos foram realizados sob protocolos de uso animal aprovados pelo Unity Health Toronto Animal Care Committee, seguindo as diretrizes estabelecidas pelo Canadian Council on Animal Care. Certifique-se de usar jaleco, luvas de proteção e óculos durante os procedimentos laboratoriais.
1. Colheita e fixação do cérebro e da medula espinhal
- Eutanásia do rato de acordo com as políticas institucionais. Deite o rato de bruços sobre uma mesa dissecante e decapite com uma tesoura cirúrgica (cortando para baixo).
- Usando pinças Adson (na mão não dominante), segure a pele no topo da cabeça do mouse. Em seguida, faça uma incisão de 2,5 cm na pele no topo da cabeça usando tesoura cirúrgica.
- Use os dedos para empurrar a pele da cabeça lateralmente para visualizar o crânio subjacente.
- Estabilize a cabeça do mouse segurando as órbitas oculares com pinças Adson padrão.
- Usando tesoura fina (mão dominante), faça pequenos cortes no crânio ao longo da linha média, desde a coluna cervical até os bulbos olfatórios.
NOTA: Incorpore apenas alguns milímetros de pontas de tesoura abaixo do crânio de cada vez para evitar danificar o cérebro subjacente. - Use pinças de Adson com dentes para refletir o crânio lateralmente para revelar o cérebro subjacente.
- Segure a cabeça usando a mão não dominante. Segurando a tesoura fechada (mão dominante), retire a medula espinhal da coluna cervical e empurre suavemente o cérebro para fora do crânio, cortando os nervos cranianos.
- Coloque o cérebro em um tubo cônico contendo 10 mL de formalina tamponada neutra a 10% que é rotulada com o ID do animal.
- Incise o pelo ao longo da linha média do tronco do rato, do pescoço à cauda.
- Use os dedos para empurrar a pele lateralmente para visualizar a coluna.
- Usando tesoura cirúrgica, corte para baixo através da coluna no nível onde os fêmures se prendem ao quadril.
- Use uma tesoura cirúrgica para cortar a parede do corpo em cada lado da coluna vertebral, do quadril ao pescoço. Aparar todos os órgãos anexos.
- Coloque a coluna vertebral que contém a medula espinhal no mesmo tubo de formalina que contém o cérebro. Deixe o cérebro e a coluna vertebral fixarem por 5 a 7 dias.
NOTA: O momento da fixação é importante. Alguns anticorpos não funcionarão se o tecido estiver sobrefixado. Se o tecido estiver subfixado, é difícil extruir a medula espinhal da coluna vertebral na etapa 2.
2. Captação e processamento da medula espinhal e cérebro
Observação : as etapas a seguir ocorrem em um exaustor de fumaça. Antes de começar, prepare placas de Petri limpas de 2 x 10 cm, um frasco Erlenmeyer equipado com um funil forrado com papel de filtro, dois bisturis (um para cortar osso e outro para cortar tecidos do SNC), papel para lente, um lápis, de incorporação e frascos de espécimes pré-preenchidos com 10% de formalina.
- Usando uma tesoura, corte um pequeno pedaço de papel lente (a mesma largura, mas o dobro do comprimento do) e coloque-o em uma placa de Petri.
- Rotule uma de plástico com o ID do espécime usando um lápis.
- Despeje o tubo que contém o cérebro fixo e a coluna vertebral no funil. Transfira a coluna vertebral e o cérebro para a placa de Petri vazia.
NOTA: A formalina utilizada filtra-se para o balão de Erlenmeyer e pode ser reutilizada no passo 2.13. - Divida grosseiramente o cérebro em seis partes coronais usando um bisturi. Faça um corte caudal ao cerebelo, um no meio do cerebelo, um apenas rostral ao cerebelo e dois cortes no cérebro rostral restante, criando 3 cortes coronais adicionais de igual espessura.
- Usando pinças, transfira amostras cerebrais para metade do papel da lente na placa de Petri.
- Corte a medula espinhal em três pedaços usando o bisturi: o primeiro corte é feito no fundo da caixa torácica e o segundo corte é feito logo abaixo da curvatura na coluna cervical.
- Com o mesmo bisturi, aparar o retalho da coluna sacral na extremidade caudal até que a medula espinhal possa ser visualizada.
- Pegue a coluna torácica (mão não dominante). Segure a pinça Adson com os dentes bem fechados (mão dominante) e empurre suavemente a extremidade da pinça para a abertura menor da coluna vertebral usando um movimento suave de torção. O cordão deve emergir da outra extremidade.
NOTAS: Qualquer instrumento arredondado que seja do tamanho da medula espinhal funcionará para este fim. Se a medula espinhal não sair naturalmente, não a force. Em vez disso, use uma tesoura fina para cortar os ossos ao longo do lado da coluna vertebral e refleti-la aberta para revelar a medula espinhal. Alternativamente, fixe a medula espinhal e o cérebro por alguns dias adicionais em formalina; no entanto, o mesmo tempo de fixação deve ser aplicado a todos os espécimes para evitar a introdução de variabilidade na coloração de anticorpos. - Pegue o padrão Adson Forceps (mão dominante). Ainda segurando a peça medular com a mão menos dominante, use pinças para puxar suavemente a medula emergida para fora da coluna. Coloque o pedaço da medula espinhal na placa de Petri que contém o papel da lente.
- Repita esse processo para os fragmentos da coluna lombar/sacral e cervical.
- Divida as três peças medulares (cervical, torácica, lombar/sacral) em pedaços transversais menores com bisturi. Cortar pelo menos 15 segmentos, cada um dos quais deve ter menos de 2 mm de espessura.
NOTA: Certifique-se de que os segmentos sejam mais curtos do que largos, o que fará com que as seções caiam mais facilmente na seção transversal durante o processo de incorporação na etapa 3. - Disponha os pedaços da medula espinhal na mesma metade do papel da lente contendo pedaços de cérebro. Dobre o papel da lente para sanduíche os pedaços de tecido e coloque-o no etiquetado.
NOTA: O papel da lente evita que pequenos pedaços de tecido escapem do durante o processamento. - Transfira a para um frasco de amostra contendo formalina reciclada ou fresca.
- Repita as etapas 2.1–2.13 para os espécimes restantes.
- Após 5-7 dias da fixação, transfira do recipiente da amostra para o primeiro banho de formalina no processador automático de tecidos (ver Tabela de Materiais). Execute o processador de tecido durante a noite de acordo com o programa descrito na Tabela Suplementar 1. Os espécimes são mantidos em cera de parafina quente até a incorporação.
3. Incorporação e corte de seções do cérebro e da medula espinhal
- Transfira do processador para a câmara de retenção quente da estação de incorporação de parafina (consulte Tabela de Materiais).
- Incorpore cortes transversais da medula espinhal e do cérebro de cada camundongo em um único bloco de parafina da seguinte forma (Figura 1):
- Primeiro, despeje cera de parafina apenas para cobrir o fundo do molde. Usando pinças finas, coloque peças transversais do cérebro, coronal e medula espinhal na parafina no fundo do molde.
- Transfira o molde para a superfície de resfriamento por vários segundos para fixar as peças do cérebro e da medula espinhal no lugar. Mova o molde de volta para a superfície aquecida e preencha-o até o topo com parafina quente.
- Coloque a tampa do (que é rotulada com o ID do espécime) em cima do molde. Despeje mais parafina por cima da tampa do. Transfira o molde para a estação de resfriamento para permitir que a cera se fixe (esfrie por 30 a 60 min).
NOTA: A incorporação de seções da medula espinhal requer prática. Para melhorar o sucesso, use comprimentos mais curtos da medula espinhal (<2 mm), pois estes são mais propensos a cair na secção transversal. As lupas cirúrgicas dos olhos podem ser usadas para ajudar a distinguir se as peças da medula espinhal estão em secção transversal. - Monte bloco de parafina em micrótomo rotativo. Aparar o bloqueio até que os tecidos de interesse apareçam na secção em parafina.
- Cortar fitas de 5 μM de secções de cada bloco e transferi-las para banho-maria a 42 °C.
- Colete seções em slides e coloque slides em um rack de slides de vidro.
- Asse seções a 37 °C em forno seco durante a noite. Resfriar as lâminas antes de proceder à coloração.
4. Desparafinização e reidratação de cortes em preparação para coloração
NOTA: As etapas são executadas em um exaustor de fumaça. Antes de começar, prepare banhos de solventes. Preparar 5 L de 1x PBS (1 L ddH2O, 8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4; pH = 7,4) com 0,05% Tween-20 (PBS-T) para todas as etapas de lavagem.
- Desparafinizar colocando lâminas em dois banhos consecutivos de xileno ou um solvente à base de não xileno em um agitador por 5 min cada com agitação suave.
- Hidratar os tecidos transferindo lâminas através de banhos sucessivos de porcentagens decrescentes de etanol: 2 x 100% etanol (5 min cada), 2 x 95% etanol (3 min cada) e 1 x 70% etanol (3 min). Manter em etanol 95% para coloração LFB, e reidratar para etanol 70%, e manter em PBS-T para imunohistoquímica (IHQ).
5. LFB para mielina com H&E
- Preparar uma solução de 0,1% LFB (0,2 g LFB, ver Tabela de Materiais, 200 mL de etanol a 95%, 0,5 mL de ácido acético glacial). Misturar e filtrar num balão de Erlenmeyer. Conservar num frasco escuro até à utilização.
- Transfira seções de etanol 95% para uma prateleira de vidro que é colocada em um prato de coloração contendo LFB. Tampe o prato e sele com filme de parafina para evitar a evaporação.
- Incubar secções a 56 °C em forno durante a noite (máximo 16 h).
- Na manhã seguinte, transfira os slides para um banho ddH2O e segure.
- Enquanto isso, preparar (1) solução fresca de carbonato de lítio a 0,05% (0,05 g de carbonato de lítio, 100 mL ddH2O); (2) Solução de Eosina Y (adicionar 2 g de sal de eosina a 40 mL ddH20 e misturar até dissolver e depois misturar com 160 mL de etanol 95%).
- Prepare os seguintes banhos: 1 x carbonato de lítio, 3 x 70% etanol, 3 x 95% etanol, 2 x 100% etanol, 3 x ddH20. Coloque os banhos por ordem de utilização (ver Quadro Suplementar 2).
- Siga as etapas descritas na Tabela Suplementar 2.
- Após a secagem das lâminas, visualizar as lesões desmielinizantes ao microscópio.
6. LFB para mielina sem H&E
- Realizar este procedimento de coloração para a análise da mielina.
NOTA: O procedimento é idêntico ao passo 5 (consulte a Tabela 2 do Supplemetary), mas tem um fluxo de trabalho abreviado. Após a etapa 4, continue o procedimento a partir da etapa 10.
7. Recuperação antigênica e extinção da peroxidase para coloração imunoistoquímica (IHQ)
NOTA: Antes de começar, preparar 100 mL de peróxido de hidrogênio em metanol (1 parte de solução de peróxido de hidrogênio a 30% em 9 partes de metanol 100%, em uma capela de fumaça). Preparar 1 L de tampão citrato 10 mM com Tween-20 (2,94 g de citrato trissódico, dissolvido em 1 L de ddH20 num copo em placa de agitação, levar o pH a 6,0 e adicionar 500 μl de Tween-20). Prepare o PBS-T (consulte a etapa 4). Todas as lavagens são feitas em banhos de PBS-T com agitação suave (em um agitador), salvo indicação em contrário.
- Eliminar a peroxidase endógena colocando lâminas em peróxido de hidrogénio a 3% em metanol durante 15 minutos (num exaustor). Lave as lâminas duas vezes em PBS-T (2 min cada).
- Transfira as corrediças para um suporte de corrediça de metal e coloque em 1 L de tampão citrato em uma panela de pressão. Sele a tampa e adicione uma rolha de borracha na parte superior da saída de vapor.
- Cozinhe no alto do micro-ondas até que a aba amarela da panela de pressão apareça, indicando que a pressão máxima foi atingida. Cozinhe por mais 5 minutos na pressão máxima e, em seguida, retire a panela de pressão do micro-ondas usando luvas de proteção.
- Despressurize removendo a rolha. Retire a tampa e deixe as lâminas esfriar no tampão citrato por 20 min e depois prossiga para o método de coloração desejado.
CUIDADO: Recue ao liberar o vapor, pois pode causar uma lesão escaldante.
8. Imuno-histoquímica para CD45
NOTA: Este método IHQ é usado para visualizar leucócitos infiltrantes. As etapas de bloqueio de avidina/biotina são combinadas com as etapas de bloqueio e incubação de anticorpos primários.
- Preparar tampão de bloqueio (2% de BSA, 2% de soro de coelho em 1x PBS).
- Transfira as lâminas para a bandeja de vidro e lave duas vezes com PBS-T (2 min cada). Preparar avidina/solução de bloqueio (4 gotas/ml de avidina em BSA a 2%/soro de coelho a 2% em 1 x PBS, ver Tabela de Materiais).
- Seque o excesso de PBS-T ao redor do tecido usando um papel higiênico de laboratório. Usando uma caneta hidrofóbica, desenhe um círculo ao redor do tecido e coloque a lâmina na câmara úmida.
- Aplicar avidina/solução de bloqueio em cada secção (400 μL/slide).
- Cobrir a câmara úmida e incubar por 30 min à temperatura ambiente. Durante esta etapa, preparar o anticorpo anti-CD45 (Tabela Suplementar 3) em tampão de bloqueio contendo biotina (4 gotas/mL de biotina, 2% de BSA/2% de soro de coelho em 1x PBS).
- Toque na solução de bloqueio de deslize para um lenço de laboratório sem fiapos. Passe ao redor do tecido usando um lenço de laboratório para remover o excesso de líquido.
- Coloque o escorregador de volta em uma câmara úmida. Adicionar 400 μL de solução de anticorpos CD45 (ver Tabela de Materiais) à secção. Incubar durante a noite a 4 °C numa câmara húmida coberta.
- No dia seguinte, drene o anticorpo primário e lave as lâminas 3 vezes em PBS-T (5 min cada).
- Secar a área ao redor da seção usando um laboratório sem fiapos e, em seguida, adicionar 400 μL de anticorpo secundário (diluição de 1:200 em tampão de bloqueio) em cada seção. Incubar à temperatura ambiente durante 1 h.
- Enquanto isso, prepare o reagente ABC (ver Tabela de Materiais) adicionando 2 gotas de reagente A a 5 mL de 1x PBS e misture. Adicione 2 gotas de reagente B à mesma solução e misture (prepare ~30 min antes de usar).
- Lave as lâminas em 3 trocas de 1x PBS-T (5 min cada) e coloque as lâminas em uma câmara úmida.
- Adicionar 400 μL de reagente ABC às secções. Cobrir a câmara úmida e incubar por 30 min à temperatura ambiente.
- Lave as lâminas em 3 trocas de 1x PBS-T (5 min cada). Enquanto isso, prepare uma quantidade apropriada de solução DAB em um tubo centrífugo de 15 mL coberto com folha de acordo com as instruções do fabricante (consulte a Tabela de Materiais).
- Pegue uma lâmina e concentre-se em uma seção da medula espinhal sob um microscópio. Adicione 400 μL DAB ao slide e inicie o temporizador de laboratório.
- Visualize a seção enquanto ela está se desenvolvendo e pare o temporizador quando os leucócitos estiverem marrons. Transfira a lâmina para um banho ddH20 para parar a reação. Segure na água por 5 min. O mesmo tempo de desenvolvimento é usado para os slides restantes.
CUIDADO: DAB é um carcinógeno. Descarte resíduos DAB e ddH2O pós-DAB como resíduos perigosos. - Lâminas de contracoloração com Hematoxilina de Mayer por ~4-10 min (ver Tabela Suplementar 2). Enxágue as lâminas em água corrente da torneira por 10 min.
- Desidratar em etanol 95% (1 x 3 min), seguido de etanol absoluto a 100% (2 x 3 min cada).
- Movendo-se para um exaustor, transfira as lâminas para xileno ou um solvente substituto de xileno por 5 min. Cubra com meio de montagem e deixe as corrediças secarem por 1-2 dias no exaustor.
CUIDADO: Se estiver usando xileno, use luvas duplas e pinças para manusear as lâminas ao deslizar a tampa, pois é tóxico e pode dissolver as luvas. - Limpe os slides usando xileno e digitalize usando um scanner de slides com ampliação de 20 vezes.
9. SMI-32 IHC para dano axonal
NOTA: Este protocolo utiliza um anticorpo SMI-32 de camundongo, que reage contra neurofilamentos pesados não fosforilados, que podem se acumular nos axônioslesados25. Uma vez que este anticorpo foi criado em camundongos e detecta um antígeno de camundongo, recomenda-se que um kit Mouse on Mouse (MOM) seja utilizado. Neste procedimento, a etapa de bloqueio de avidina/biotina é feita como uma etapa separada da incubação primária do anticorpo. Antes de iniciar este protocolo, desparafinize, reidrate, extinga a atividade da peroxidase endógena e conduza a recuperação do antígeno conforme descrito nas etapas 4 e 7.
- Lave as seções duas vezes com 2 x PBS-T (2 min cada). Remova o líquido extra ao redor das seções usando um tecido de laboratório e desenhe um círculo ao redor dos tecidos usando uma caneta hidrofóbica.
- Adicionar 400 μL de tampão de bloqueio (2% (p/v) de soro de cabra em 1x PBS-T) com avidina (4 gotas/mL) às seções. Incubar durante 15 minutos à temperatura ambiente.
- Mergulhe as lâminas duas vezes em 1x PBS-T. Adicionar 400 μL de tampão bloqueador com biotina (4 gotas/mL) à lâmina e incubar por 15 min à temperatura ambiente.
- Lave as lâminas em um banho de 1 x PBS-T por 2 min. Enquanto isso, prepare o reagente de bloqueio do MOM adicionando 2 gotas de solução-estoque (ver Tabela de Materiais) a 2,5 mL de 1x PBS.
- Adicionar 400 μL de reagente MOM à secção. Incubar durante 1 h à temperatura ambiente.
- Lave as lâminas duas vezes em um banho PBS-T de 1x por 2 min. Enquanto isso, prepare o diluente MOM adicionando 300 μL de solução estoque de concentrado proteico a 3,75 mL de 1x PBS.
- Adicionar 400 μL de diluente MOM e incubar durante 5 min à temperatura ambiente. Enquanto isso, diluir o anticorpo SMI-32 (ver Tabela de Materiais) no diluente MOM.
- Retire o diluente das lâminas e adicione 400 μL de solução de anticorpos SMI-32 à secção. Cobrir a câmara úmida e incubar por 30 min à temperatura ambiente.
- Lave as lâminas duas vezes em um banho PBS-T de 1x por 2 min, cada uma com agitação suave. Enquanto isso, diluir MOM anti-mouse IgG reagente de trabalho no diluente (10 μL de estoque em 2,5 mL de diluente).
- Adicionar 400 μL de reagente de trabalho IgG anti-rato por lâmina. Incubar por 10 min.
- Lave as lâminas duas vezes em um banho PBS-T de 1x por 2 min cada. Continue a coloração seguindo os passos descritos no protocolo de coloração CD45 (passo 8.11 – 8.19).
10. Pontuação de BFL e H&E para presença de lesões desmielinizantes
NOTA: A seguir está uma abordagem de análise que pode ser aplicada para obter insights rápidos sobre a gravidade da desmielinização inflamatória. Esta análise é realizada em seções do cordão amostradas em diferentes níveis (cervical, torácica e lombar, pelo menos 3 cortes por nível). Consulte o Allen Brain Atlas for Mousespinal cord 26 para ajudar a identificar o nível anatômico da medula espinhal. Essa análise requer arquivos TIFF. Se as imagens digitalizadas estiverem no formato .czi, siga as instruções na Tabela Suplementar 4 para converter arquivos czi em arquivos TIFF.
- Abra a imagem TIFF da seção a ser analisada arrastando e soltando o arquivo no ImageJ. Observe o corte medular em 4 quadrantes: dorsal, lateral esquerdo, lateral direito e anterior (Figura 2A,B).
- Escore para a presença de lesões desmielinizantes em cada quadrante conforme ilustrado na Figura 2.
OBS: A presença de lesão resulta em escore 1 nesse quadrante, totalizando 4 pontos possíveis por corte. Um escore de 1 é atribuído mesmo se houver múltiplas lesões dentro de um quadrante. - Somar todos os pontos de cada camundongo e dividir pelo número total de quadrantes amostrados para obter a fração de quadrantes com lesões submeníngeas.
11. Cálculo da fração de área da coloração LFB na substância branca da medula espinhal
NOTA: Esta análise mede a fração de área percentual da substância branca da medula espinhal que é corada com LFB.
- Abra uma seção manchada de LFB salva como um arquivo TIFF arrastando/soltando o arquivo no ImageJ.
- Clique em Imagem > Digite > 8 bits para produzir uma imagem em escala de cinza. Clique em Imagem > Ajustar > Limite. Ajuste o controle deslizante inferior para que a sobreposição vermelha capture todas as regiões escuras (mielina) vistas a olho nu (Figura 2C–E). Clique em Aplicar.
- Clique em Analisar > Ferramentas > ROI Manager para abrir o ROI Manager.
- Selecione a ferramenta de desenho de polígono na barra de ferramentas do ImageJ. Esta ferramenta de desenho permite delinear uma região da medula espinhal com o mouse do computador.
- Contorne a região dorsal da medula espinhal e adicione o polígono ao Gerenciador de ROI clicando em t no teclado.
- Contorne a região ântero-lateral da substância branca da medula espinhal e adicione o polígono ao gerenciador de ROI.
NOTA: Ao traçar, excluir grandes vasos sanguíneos, rupturas no tecido, artefatos e áreas adjacentes ao corno dorsal (Figura 2A, seta B), que normalmente são menos mielinizadas. Seja o mais preciso possível ao rastrear, pois incluir muito fundo branco distorcerá os resultados. - Clique em Analisar > Definir Medidas e selecione Fração de Área.
- Clique em Medir no ROI Manager. Isso dará a fração da área delineada que é corada com LFB.
- Na caixa de resultados recém-produzidos, copie os valores para o Excel e feche a janela de imagem. Calcular a fração % média de área corada para as regiões dorsal e ventro-lateral. Faça a média desses para obter um valor para essa seção.
- Repita as etapas 11.1–11.9 para seções cervicais, torácicas e lombares (N = 3/nível/mouse).
- Calcule a porcentagem média de fração de mielina para todas as seções de cada mouse. A porcentagem de desmielinização é estimada subtraindo-se a porcentagem de área de coloração de 100.
12. Análise do número de células CD45+ e ovoides axônios SMI-32+
- Arraste e solte uma imagem TIFF manchada com CD45 ou SMI-32 no ImageJ. Clique em Analisar > Definir escala > Global > Ok para definir a barra de escala em todas as imagens. Observe que isso é feito apenas para a primeira imagem.
- Selecione a ferramenta de desenho de polígono e trace a massa cinzenta usando o mouse do computador. Clique em Analisar > Medir e registre os resultados no Excel como "Área de Massa Cinzenta".
- Com o polígono desenhado ainda na imagem, remova a massa cinzenta da imagem clicando na tecla Delete (teclado). Essa ação deixa apenas a substância branca para ser analisada.
- Descreva toda a seção da medula espinhal usando a ferramenta de desenho de polígono . Exclua todas as regiões do tecido que estão ausentes ou danificadas.
- Clique em Analisar > Medir e registre os resultados como "Área Total de Tecido" no arquivo Excel.
- Clique em Imagem > Deconvolução de Cores > Cores. Na janela suspensa de vetores, selecione H DAB. Três novas janelas aparecerão – mantenha a janela em tons de marrom (canal DAB) e exclua outras janelas de imagem.
- Clique em Imagem > Ajustar > Limite. Ajuste o controle deslizante inferior para limitar a imagem para que a sobreposição vermelha capture a mesma quantidade de coloração marrom detectada pelo olho. Clique em Aplicar.
- Clique em Processo > Bacia Hidrográfica > Binário. Nesta etapa, compare a imagem original e a imagem binária para garantir que estejam de acordo.
- Clique em Analisar > Analisar Partículas. Selecione Mostrar sobreposição e modifique as configurações: Tamanho = 5 - 150 μm2, Circularidade = 0,4 – 1. Clique em OK.
Observação : essas configurações permitem que células individuais e pequenos grupos de células que não foram divididas com a função Watershed sejam incluídas em vez de serem excluídas na análise. - Na janela de resultados, registre o último número na coluna mais à esquerda no Excel, que representa a contagem total de partículas. Em seguida, calcule a área da substância branca (área total do tecido – área da substância cinzenta em mm2). Contagem total de partículas expressa por área de substância branca (contagem/mm2).
- Repita as etapas para cada imagem RGB salva. Uma vez que todas as seções da medula espinhal tenham sido analisadas para um camundongo, a média da contagem de partículas por mm2 de tecido para esse camundongo.
NOTA: O fluxo de trabalho usado para analisar leucócitos da medula espinhal também pode ser aplicado a regiões cerebrais.
13. Mensuração do sNF-L pelo ensaio SIMOA
- Coletar 100–200 μL de sangue de camundongos vivos por sangria safena usando tubos de microtainer capilar ou via punção cardíaca usando uma seringa e agulha 25 G (procedimento terminal). Para este último, transferir o sangue para um tubo de microcentrífuga de 1,5 mL.
- Deixe o sangue coagular à temperatura ambiente por 30 a 60 min.
- Centrifugar amostras a 2660 x g durante 5 min a 4 °C e pipetar a fracção superior (soro) para um novo tubo de microcentrífuga. Conservar o soro a -80 °C até estar pronto a utilizar.
- Preparação: Permitir que calibradores e controles (kit de ensaio NF-light, consulte Tabela de Materiais) aqueçam à temperatura ambiente por 1 h antes do uso. Retire o substrato enzimático (RGP) da geladeira e coloque em banho-maria a 30 °C por pelo menos 30 min, agitando a cada 10 min.
- Descongelar as amostras de soro no gelo. Uma vez descongelados, despeje suavemente as amostras de vórtice e centrifuja a 10000 x g por 5 min para pellet quaisquer detritos.
- Carregue a placa: Vórtice os calibradores e os controles. Coloque os calibradores em duplicata, os controles em duplicata e as amostras de soro em duplicata na placa de 96 poços fornecida com o kit. As amostras de soro são diluídas na proporção de 1:3 com diluente fornecido no kit. Sele a placa.
- Ligue a máquina SIMOA (consulte Tabela de Materiais) na ordem do computador, do programa e, em seguida, da máquina. Permita que a máquina inicialize e execute a manutenção do início do dia .
- Vórtice as contas magnéticas por 30 s.
- Carregar Reagentes guia na tela, clicando duas vezes na posição do rack onde o frasco de reagente deve ser colocado e, em seguida, digitalizando o código de barras do frasco.
- Coloque as esferas magnéticas na posição de agitação no rack (posições 1–3).
- Continue carregando o detector, o reagente SBG e o reagente RGP na máquina.
- Clique em configuração no software. Verifique se o modo de amostra está na placa. Na guia de execução da instalação, nomeie o experimento.
- Atribua poços na placa para os calibradores da seguinte maneira: Clique no poço e selecione o ensaio. Selecione calibrar A e clique em ascender. Realce os poços A1-8 e clique em replicates (2) para atribuir as coordenadas para que os calibradores sejam executados em duplicado. Execute usando o protocolo puro.
NOTA: Consulte o certificado de análise (site do fabricante) para obter as concentrações de cada calibrador para cada número de lote específico. Uma vez que os poços são atribuídos, não é possível navegar para longe desta tela sem perder o trabalho, até que a placa esteja travada no lugar. - Atribua os exemplos seguindo as etapas abaixo:
- No canto inferior direito da tela, clique no botão para atribuir as amostras. Destaque os poços onde as amostras devem ser localizadas.
- Marque o ensaio a ser executado na lista, escolha o número de réplicas e especifique a diluição integrada de 4x.
- Com os poços ainda realçados, insira um prefixo para o ID da amostra e o número inicial e, em seguida, clique em gerar para produzir IDs sequenciais para as amostras. Repita as etapas para amostras de controle.
- Placa de carga no suporte da placa (A1 a A12).
- Na interface da tela, clique em amostras de programação concluídas e vá para a guia de recursos do sistema. Verifique se todos os recipientes de reagente estão cheios e se os recipientes de resíduos estão vazios.
- Clique em Executar.
- Quando a execução estiver concluída, verifique a curva de calibração na guia "Redução de dados" selecionando o ensaio e o nome da placa.
- Vá para "Histórico de Execução" e use os filtros para encontrar a execução mais recente. Selecione executar e, em seguida, todos os resultados. Clique em exportar e salve o arquivo .csv. Clique no relatório e, em seguida, selecione o relatório de calibração de lote e selecione a execução recente. Visualize o relatório e exporte-o.
- Execute a manutenção de final de dia recomendada pelo fabricante. Desligue o programa, a máquina e, em seguida, o computador.
Representative Results
A Figura 3 mostra coloração histoquímica e histoquímica representativa, com exemplos de lesões agudas (esquerda) e mais antigas (direita). A coloração representativa de CD45 com contracoloração de hematoxilina é mostrada na Figura 3A,B. A Figura 3C–F mostra exemplos de coloração LFB com (Figura 3C,D) ou sem (Figura 3E,F) a contracoloração H&E. Embora a hematoxilina não seja específica das células imunes, os núcleos das células imunes mancham mais escuramente e podem ser distinguidos das células residentes no SNC. A Figura 3G,H mostra coloração representativa dos axônios SMI-32+, contracorados com hematoxilina. Observe o aumento do aparecimento desta mancha em lesões mais antigas do EAE.
A lesão dos trajetos mielinizados é mais prevalente na medula espinhal em EAE murinas ativas e este é o principal fator de paralisia nessa doença 7,9. Assim, a pontuação para a presença de inflamação e dano tecidual na medula espinhal é priorizada nas análises histológicas. As lesões do EAE ocorrem esporadicamente em diferentes regiões (anterior, lateral ou dorsal) (Figura 2A,B) e em diferentes níveis (sacral, lombar, torácico, cervical) da medula espinhal. O método de incorporação descrito garante uma boa amostragem das lesões em todo o cordão. Mais seções são incorporadas do que analisadas, uma vez que algumas seções podem ficar danificadas no processo de processamento ou seccionamento. Para garantir uma amostragem representativa, um mínimo de 3 cortes representativos são analisados nos níveis cervical, torácico e lombar da medula espinhal para cada camundongo. A identidade de cada espécime é cega para que a pessoa que conduz a análise não seja tendenciosa ao selecionar seções representativas para análise.
Para obter insights rápidos sobre as diferenças na gravidade histológica das EAE, pode-se pontuar a presença de lesões desmielinizantes submeníngeas nos quadrantes da medula espinhal em cortes selecionados (Figura 2A,B). Este é um método rápido que pode ser realizado em imagens digitalizadas ou usando um microscópio de luz. Essa análise é sensível o suficiente para detectar diferenças na gravidade histológica do EAE entre os grupos quando o EAE é grave em um grupo e leve em outro. Por exemplo, no experimento da Figura 4, EAE foi induzido em fêmeas selvagens (WT) e camundongos com deleção em OGR1 (OGR1 KO) usando MOG p35-55/CFA mais PTX. Camundongos do grupo WT desenvolveram EAE grave com paralisia completa, enquanto o grupo knockout OGR1 desenvolveu doença leve. Essa diferença no escore clínico correspondeu a uma diferença na fração de quadrantes que apresentavam lesões submeníngeas (Figura 4C).
É importante complementar a pontuação de lesões desmielinizantes com fração de área percentual da coloração de mielina para capturar a extensão da perda de mielina e/ou axônios mielinizados durante o ataque autoimune. No exemplo da Figura 4, a porcentagem de fração de mielina também diferiu significativamente entre os camundongos OGR1 e WT (Figura 4D). A porcentagem de fração de mielina também se correlaciona significativamente com o escore cumulativo de EAE em camundongos com EAE (Figura 4E) e, portanto, serve como uma boa medida do dano tecidual geral nesta doença. Note que este protocolo não distingue a intensidade da coloração de mielina. Se este for o resultado desejado, deve-se realizar a coloração por imunofluorescência para proteínas da mielina, como a proteína proteolipídica ou a proteína básica da mielina, e medir a intensidade dessa coloração.
No caso de EAE grave em ambos os grupos comparadores, uma fração maior dos quadrantes medulares conterá lesões inflamatórias/desmielinizantes. Nesse caso, uma abordagem mais sensível para pontuar a inflamação é contar o número de leucócitos CD45+ por mm2 de substância branca (ver coloração representativa na Figura 3A). O clone de anticorpos CD45 descrito aqui detecta todos os leucócitos infiltrantes e apenas cora microglias ocasionais que regulam a expressão de CD45 no EAE (ver seta aberta na Figura 3B) e, portanto, é útil na captura da infiltração de células imunes periféricas.
Em estudos de EAE de longo prazo (>20 dias), recomenda-se que se realize também uma análise da lesão axonal. A coloração SMI-32 em cortes da medula espinhal é um método sensível para detectar axônios danificados. Embora a inflamação na medula espinhal diminua com o tempo e os axônios poupados possam se remielinizar, os axônios sobreviventes exibem uma extensão diferencialde lesão residual9 (Figura 3G,H). Por exemplo, no modelo de EAE induzido por MOG p35-55 em camundongos C57BL6/J, a extensão da lesão axonal e a perda são um direcionador dos escores clínicos após a diminuição do processo inflamatório9. A Figura 5 mostra um exemplo disso em um experimento EAE em camundongos WT machos e fêmeas que são deficientes em um gene chamado receptor delta ativado por proliferador de peroxissoma (PPAR-delta) no compartimento mieloide (LysMCre: Ppardfl/fl). Nos machos, os camundongos WT recuperaram a função dos membros posteriores, mas os escores clínicos permaneceram altos no grupo machos LysMCre: Ppardfl/fl. Por outro lado, no experimento no sexo feminino, ambos os grupos experimentais tiveram escores altos durante todo o experimento. À primeira vista, esse resultado sugeriu que o PPAR-delta tinha um efeito sexo-específico em EAE; no entanto, a pontuação patológica da medula espinhal revelou que camundongos de ambos os sexos no grupo LysMCre: Ppardfl/fl tiveram lesão axonal aumentada em comparação com os colegas WT (Figura 5B). Um efeito genotípico nos escores clínicos provavelmente não foi observado em fêmeas porque camundongos fêmeas WT tenderam a exibir lesão axonal aumentada, que se manifestou em déficits neurológicos crônicos.
Neste mesmo experimento, fêmeas de camundongos fêmeas LysMCre: Ppardfl/fl apresentaram infiltração de células T mais extensa no cerebelo, fornecendo um exemplo de como a inflamação cerebral pode ser útil no EAE. Nas EAE, a inflamação no cérebro é predominantemente encontrada no cerebelo e tronco cerebral (Figura 6A,D,G), mas também pode ser encontrada nas meninges (vistas sob o hipocampo na Figura 6C), próximas aos ventrículos (Figura 6F) e em outros tratos da substância branca, incluindo o nervo óptico e o corpo coloso (Figura 6B,E). A pontuação da inflamação cerebral é feita em uma região específica do cérebro (por exemplo, substância branca cerebelar) contando o número de células CD45 por região de tecido mm2 usando a mesma metodologia descrita para o protocolo da medula espinhal. No método de grosseamento aqui descrito, um corte é no meio do cerebelo, o que fornece a perspectiva do cerebelo e do tronco cerebral, como mostrado na Figura 6A.
A mensuração do NFL-L por meio do ensaio SIMOA tornou-se um biomarcador útil para avaliar a lesão axonal em curso e as respostas à terapia na EM remitente-recorrente 20,21,27,28. O mesmo kit de ensaio SIMOA usado para medir sNF-L em humanos pode ser aplicado para medir sNFL em camundongos 22,23,24. Para explorar o desempenho deste ensaio na detecção de lesão axonal em EAE, o sNF-L foi medido em camundongos fêmeas C57BL6/J no ponto final de um experimento de EAE e os níveis foram comparados com aqueles em camundongos controles saudáveis pareados por sexo que não tinham EAE. Verificou-se que camundongos com EAE apresentaram níveis muito mais elevados de sNF-L do que em camundongos saudáveis (Figura 7A) e esses níveis se correlacionaram com a densidade de axônios SMI-32+ na medula espinhal (Figura 7B). Em comparação com a pontuação histológica da lesão axonal, o ensaio SIMOA é mais rápido (de camundongos sangrando a resultados podem ser alcançados em pouco mais de meio dia) e, portanto, fornece feedback rápido de como um tratamento está funcionando em camundongos vivos. Este ensaio também tem a vantagem de refletir a lesão axonal na medula espinhal e no cérebro.

Figura 1: Bloqueio representativo em parafina de cortes cerebrais e medulares. As 5 seções cerebrais coronais e as seções transversais da medula espinhal (1,5–2 mm de espessura) estão embutidas no mesmo bloco para que possam ser cortadas em uma seção. Pelo menos 15 seções da medula espinhal devem ser incorporadas, permitindo a seleção adequada de cortes para análise. Clique aqui para ver uma versão maior desta figura.
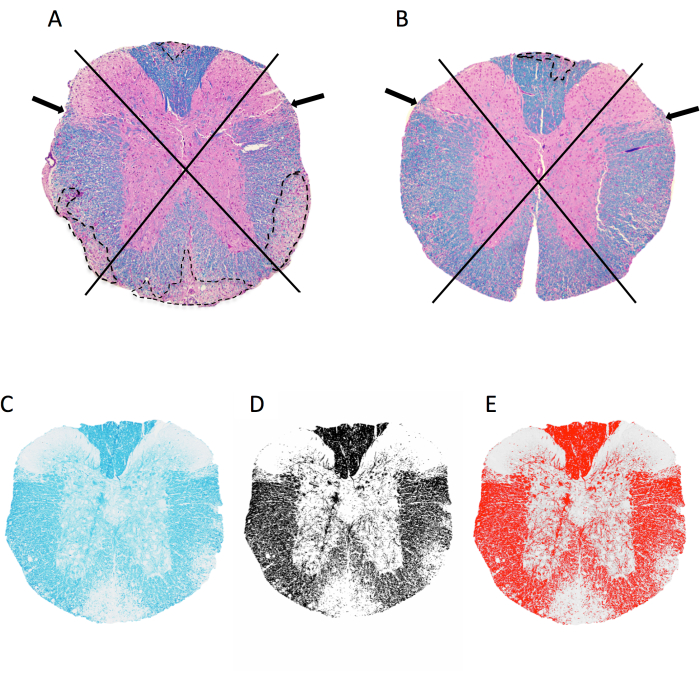
Figura 2: Pontuação da inflamação meníngea e porcentagem de área de mielina ao nível da medula espinhal torácica. (A,B) mostram imagens da medula espinhal torácica de um camundongo fêmea C57BL6/J com EAE induzido por MOG p35-55 corado com LFB/H&E. Mostra-se a abordagem utilizada para visualização de quadrantes e exemplos de lesões desmielinizantes (traçadas em linha pontilhada). O camundongo em A tem 4 de 4 quadrantes com lesões desmielinizantes confluentes, enquanto o camundongo em B tem 1 de 4 quadrantes afetados. O camundongo em B tem alguma inflamação em outros quadrantes, mas isso não se manifestou em uma lesão confluente e, portanto, não é pontuado. (C-E) Exemplo de imagem LFB e a imagem em escala de cinza e limite no imageJ. Clique aqui para ver uma versão maior desta figura.
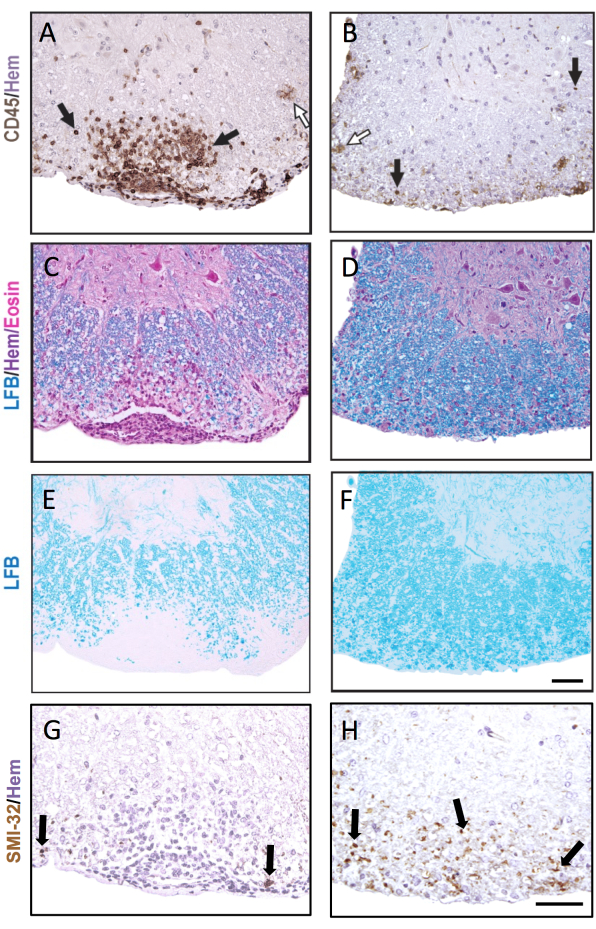
Figura 3: Cortes medulares corados com CD45, LFB H&E, LFB e SMI-32. Exemplos de lesão submeníngea precoce (A,C,E,G) e tardia (B,D,F,H) NA MEDULA ESPINHAL CORADOS PARA ANTICORPOS CD45 (A,B), LFB/H&E (C,D), LFB isolados (E,F) e SMI-32 (G,H). As setas pretas mostram exemplos de células coradas com cada respectivo anticorpo. As setas brancas mostram uma possível micróglia corada como CD45+. Barra de escala = 50 μm. Esta figura mostra a coloração representativa de lesões na medula espinhal de uma fêmea de camundongo C57BL6/J durante EAE e destaca como a patologia pode ser diferente em diferentes cortes da medula espinhal. Clique aqui para ver uma versão maior desta figura.
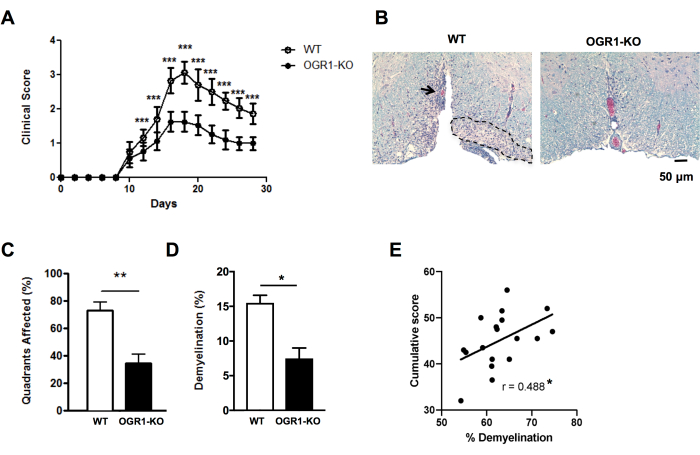
Figura 4: Aplicação do escore para lesões e porcentagem de desmielinização em EAE. Mostrado é um exemplo de um experimento EAE onde camundongos fêmeas deficientes no gene do receptor acoplado à proteína G do câncer de ovário 1 (OGR1) no fundo C57BL6/J desenvolveram EAE clínico menos grave do que camundongos fêmeas C57BL6/J wildtype (WT). EAE foi induzida pela imunização com MOG p35-55/CFA mais PTX e os camundongos foram pontuados de acordo com a seguinte escala clínica: 1 = paralisia da cauda. 2 = fraqueza dos membros posteriores e pés, 3 = paralisia dos membros posteriores, 4 = fraqueza dos membros torácicos, 5 = moribundos. (A) Média + EPM dos escores clínicos de camundongos ao longo do tempo. (B) Mostra-se um exemplo de coloração LFB/H&E na medula ventral. Barra de escala = 50 μm. (C) Quadrantes médios + EPM que continham lesões desmielinizantes. (D) Média + percentual de EPM desmielinização em cada grupo. (E) mostra o resultado de outro experimento em EAE induzido por MOG p35-55 em camundongos C57BL6/J, onde os escores de EAE de camundongos individuais foram somados ao longo dos 30 dias de observação e foram correlacionados com a porcentagem de desmielinização na medula espinhal. As correlações foram realizadas por meio do teste de Spearman. Os painéis em (A–D) são adaptados de Souza C et al.29. Os dados em (E) são dados originais. *P<0,05, **P<0,01, **P<0,001. Clique aqui para ver uma versão maior desta figura.
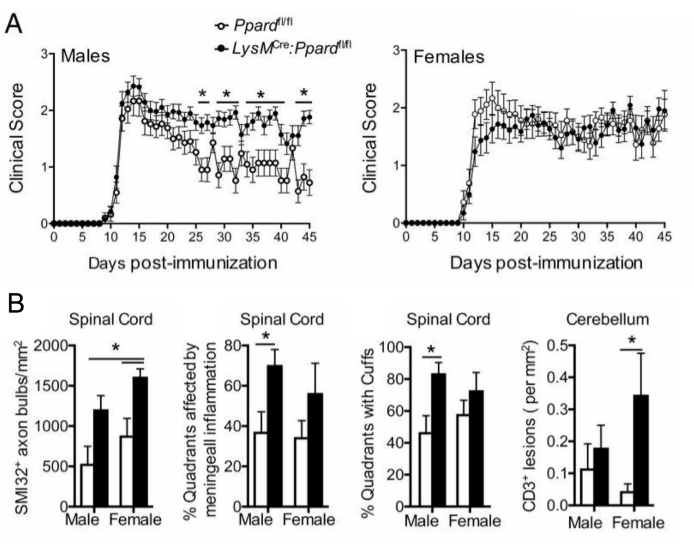
Figura 5: Aplicação da coloração SMI-32 para entender o efeito de um genótipo no fenótipo clínico do EAE. Esta figura mostra um exemplo de um experimento EAE onde machos e fêmeas selvagens (carregam o alelo floxado de Ppard) e camundongos mutantes mieloides específicos de Ppard (LysMCre: Ppardfl/fl) no fundo C57BL6/J foram imunizados com MOG p35-55/CFA e PTX e foram acompanhados por 45 dias. (A) mostra a média + EPM dos escores clínicos dos camundongos. (B) mostra resultados médios + EPM da pontuação histológica do número de axônios SMI-32+ na medula espinhal, %quadrantes com lesões submeníngeas, quadrantes percentuais com manguitos perivasculares e #CD3 lesões no cerebelo pormm2 de tecido. Este experimento mostrou efeito genotípico na coloração SMI-32. Esta figura é adaptada de Drohomyrecky. et al.15. Clique aqui para ver uma versão maior desta figura.
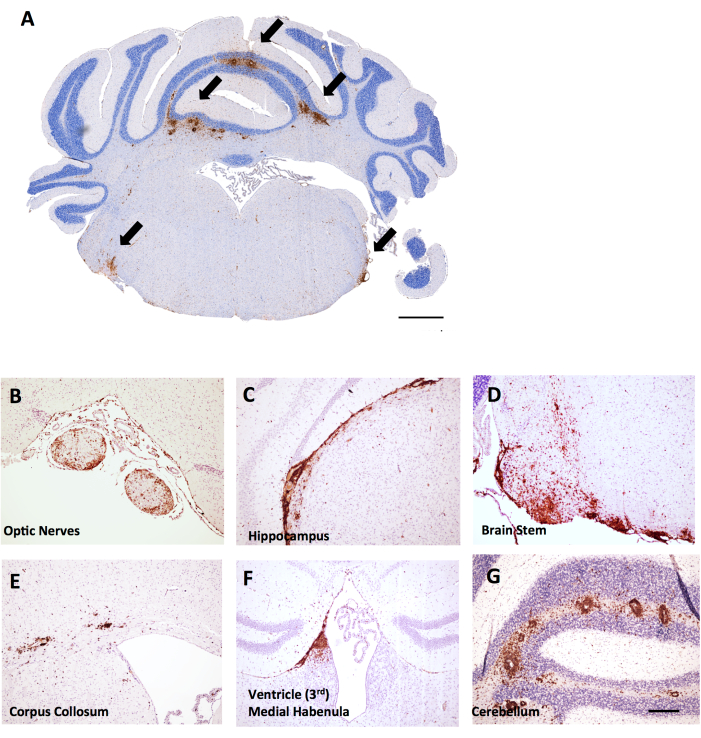
Figura 6: Exemplos de coloração CD45+/hematoxilina em cortes coronais cerebrais em EAE induzido por MOG p35-55 em camundongos fêmeas C57BL6/J. As lesões CD45+ são mostradas em marrom. (A) Lesões CD45+ no tronco encefálico de cortes coronais. Barra de escala = 150 μm. (B-G) Exemplos de lesões CD45+ nos nervos ópticos (B), extensões meníngeas sob o hipocampo (C), tronco cerebral (D), corpo coloso (E), habênula medial próxima ao ventrículo (F) e cerebelo (G). Barra de escala: (B–G) = 50 μm. Clique aqui para ver uma versão maior desta figura.
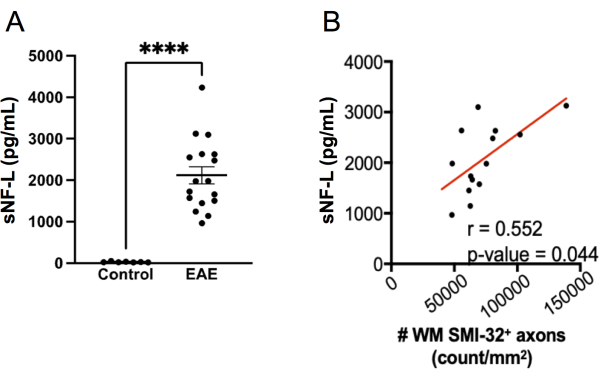
Figura 7: Níveis séricos de NFL-L no GEA induzido por MOG p35-55. (A) Níveis séricos de NFL coletados de fêmeas de camundongos controle e EAE no ponto final de um experimento. Os dados foram analisados pelo teste bicaudal de Mann Whitney. (****p valor < 0,0001). (B) Os cortes medulares foram retirados no ponto final e corados com SMI-32. O número de células positivas por área de tecido da substância branca foi determinado e correlacionado com NF-L sérico ao final usando o teste de Spearman. Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar 1: Descrição dos banhos utilizados no processamento de tecidos. Os são movidos automaticamente através desta série de banhos usando um processador automatizado. Clique aqui para baixar este arquivo.
Tabela Suplementar 2: Passos na coloração Luxol Fast Blue e Hematoxilina e Eosina. Esta tabela descreve a ordem dos passos no protocolo de coloração Luxol Fast Blue e Hematoxilina e Eosina. Clique aqui para baixar este arquivo.
Tabela Suplementar 3: Anticorpos utilizados para coloração imunoistoquímica. São descritos os anticorpos que são usados neste protocolo, bem como aqueles que podem ser usados para explorar mais a inflamação, microgliose e astrogliose. Clique aqui para baixar este arquivo.
Tabela suplementar 4: Como converter arquivos .czi em TIFF. Observe que é ideal usar uma imagem de alta resolução, mas imagens de resolução média podem ser salvas em vez disso se a memória de trabalho do computador for limitada. É imprescindível o uso de imagens da mesma resolução em todas as análises. Além disso, observe que a última imagem da série é o rótulo do slide. Evite ler o rótulo para garantir que a análise seja cega. 30,31 Clique aqui para baixar este arquivo.
Discussion
A coloração histológica da medula espinhal é uma ferramenta importante na avaliação da gravidade da doença EAE, particularmente nos casos em que há diferenças entre os grupos de tratamento na extensão da recuperação da doença na fase pós-aguda da doença. A coloração para infiltração de células imunes (CD45), mielina (LFB) e lesão axonal (SMI-32) ajuda a caracterizar a causa subjacente dos escores clínicos alterados em camundongos. O protocolo de coloração histológica aqui descrito fornece uma perspectiva da inflamação, bem como da extensão da mielina e da lesão axonal. Além disso, os resultados mostraram validar a medida do NFL-L como um método para avaliar a extensão do dano neuronal global em EAE.
Os parâmetros críticos para esta análise são garantir que os investigadores sejam cegados para a identidade das seções e que haja amostragem equivalente em cada nível da medula espinhal nos diferentes camundongos. Isso ocorre porque a gravidade da inflamação pode ser maior em níveis mais baixos do cordão. Outro parâmetro crítico é o tamanho dos grupos experimentais. A medula espinhal e os cérebros são tipicamente colhidos de 6 a 8 camundongos por grupo no final para ver diferenças significativas entre grupos com tratamentos ou genótipos com tamanhos de efeito modestos. Também é importante garantir que os camundongos selecionados, quando calculados em média, tenham escores médios representativos de todo o grupo. Em relação à solução de problemas, um problema comum encontrado por aqueles que não têm experiência com o protocolo é que a medula espinhal é fixada por um período insuficiente de tempo e não é facilmente extrudada da coluna vertebral. Se este for o caso, a medula espinhal pode ser dissecada manualmente da coluna por clipe ao longo dos processos espinhosos usando tesouras finas e abrindo a coluna para revelar a medula espinhal. Alternativamente, os tecidos podem ser fixados por alguns dias adicionais sem interferir no sucesso da coloração de anticorpos. Os clones de anticorpos aqui descritos funcionam em tecidos fixados até 2 semanas em formalina.
Incorporar as peças da medula espinhal requer habilidade e prática. Recomenda-se o uso de lupas oculares e a direção de uma lâmpada sobre a estação de incorporação para melhor visualizar se as seções estão caindo em seção transversal ou longitudinal. Manter os comprimentos dos pedaços da medula espinhal em menos de 2 mm durante a captação irá ajudá-los a cair na secção transversal. Outro problema comum encontrado para usuários menos experientes é que o LFB evapora durante a incubação durante a noite, deixando metade da lâmina manchada e metade sem manchas. Para evitar a evaporação, a placa de coloração de vidro deve ser selada com filme termoplástico e, em seguida, filme plástico. Se ocorrer evaporação e as seções forem coradas de forma desigual, recomenda-se desazular completamente as lâminas com carbonato de lítio e recolori-las novamente em LFB durante a noite. Outro problema comum é que os usuários não desazuisam totalmente a massa cinzenta após o LFB. É fundamental examinar seções individuais sob o microscópio para garantir que uma quantidade suficiente de desrubor tenha sido alcançada antes de prosseguir com outras etapas do protocolo. Além disso, embora as colorações de IHQ CD45 e SMI-32 tenham um desempenho robusto, ainda é importante identificar as concentrações de anticorpos em experimentos preliminares para cada novo lote de anticorpos recebido. Isso pode ser feito testando uma variedade de concentrações do anticorpo em uma seção de controle positivo (EAE medula espinhal). A primeira coloração também deve incluir um controle negativo que consiste em anticorpo secundário isolado sem adição de anticorpo primário. Finalmente, é fundamental na análise de imagens limitar imagens individuais, pois a coloração pode ser desigual entre slides ou seções.
Este protocolo utiliza software disponível gratuitamente. Se a pessoa não tiver acesso a um processador, um incorporador ou micrótomo, essas etapas podem ser fornecidas a um núcleo de patologia hospitalar que ofereça esses serviços. Além disso, se não tiver acesso a um scanner de lâminas, pode-se usar um microscópio de luz equipado com uma câmera de vídeo para salvar imagens TIFF da medula espinhal ou regiões cerebrais. Para um fluxo de trabalho baseado em microscópio, capture cortes LFB ou LFB/H&E em baixa potência (aumento de 40x) e para coloração de CD45 e SMI-32, imagine pelo menos quatro janelas centradas nas partes ventral, dorsal e lateral da medula espinhal (aumento de 200x para CD45 e aumento de 400x para SMI-32). A análise das imagens pode ser realizada para quantificar a coloração de maneira semelhante à descrita.
A decisão de qual abordagem histológica tomar para pontuar EAE depende do quanto os escores clínicos diferem entre os grupos. Por exemplo, se houver diferenças drásticas no escore clínico do EAE (um grupo recebeu EAE e outro não), isso geralmente está relacionado a diferenças na inflamação mediada por periféricos. Neste caso, pontuar a presença de lesões desmielinizantes nos cortes corados com BFL/H&E é suficiente e revelará diferenças entre os grupos. Se os grupos forem mais semelhantes no escore clínico no início e, em vez disso, houver diferenças na extensão da recuperação clínica (por exemplo, experimento na Figura 5A), é melhor aplicar o fluxo de trabalho histológico completo descrito aqui, incluindo a pontuação da inflamação cerebral no tronco cerebral e no cerebelo, para distinguir se as diferenças na cronicidade da doença estão relacionadas a diferenças na inflamação ou dano tecidual. Se forem encontradas diferenças na inflamação, conforme avaliado pela contagem de CD45, estudos adicionais de IHQ podem ser feitos para corar células T (anti-CD3), monócitos/macrófagos infiltrantes (Mac3) e micróglia (Iba-1/TMEM119) (clones de anticorpos recomendados estão na Tabela Suplementar 3). A ativação da micróglia é refletida por um aumento na intensidade da coloração de Iba-1 na micróglia de dupla marcação Iba-1+TMEM-19+ e um aumento da retração dos processos da micróglia que pode ser avaliado pela análise Sholl nas seções32. Além disso, técnicas como citometria de fluxo ou sequenciamento de RNA de célula única podem ser aplicadas para conduzir uma caracterização mais profunda da frequência e fenótipo de populações imunes no cérebro e na medula espinhal.
A contagem de axônios SMI-32+ é um método sensível para detectar lesão axonal em EAE32,33 e em MS34. SMI-32, que detecta a forma não fosforilada de neurofilamento pesado ou médio acumula-se em bulbos terminais de neurônios transeccionados. Uma alternativa para detectar axônios lesados é a coloração com proteína precursora de amiloide (APP) que pode se acumular nos axônios como resultado da interrupção do transporte de axônios33. O padrão de coloração para SMI-32 e PFA, embora ambos reflitam lesão axonal, normalmente não se sobrepõem, indicando que estão detectando patologias diferentes33. Pode-se também complementar as medidas histológicas da lesão axonal medindo o NF-L, que é uma medida rápida e sensível da lesão axonal em curso tanto na medula espinhal quanto no cérebro. Ele oferece a vantagem de que pode ser feito em meio dia em ratos vivos. Uma desvantagem deste método é que os kits são caros e a máquina é altamente especializada. A empresa que vende o kit sNF-L oferece uma taxa de serviço para quem não tem acesso a uma máquina SIMOA. Uma alternativa para avaliar a lesão axonal é pontuar a perda axonal contando axônios em cortes corados com azul de toluidina da medula espinhal12 ou contando feixes de neurofilamentos detectados por SMI-31 em áreas da substância branca da medula espinhal32. Ambas as abordagens são mais trabalhosas do que a medida de SMI-32 ou sNF-L.
Se os escores clínicos do EAE diferirem entre os grupos, mas a pontuação para inflamação, desmielinização e lesão axonal não revelar diferenças entre os grupos, pode ser útil corar para ativação de astrócitos usando GFAP (ver Tabela Suplementar 3 para clone de anticorpos recomendado). A ativação astrocitária está associada a um aumento na coloração de GFAP e isso se correlacionou com a progressão do EAE em alguns modelos de EAE, incluindo EAE crônico no rato DA35.
Em conclusão, este protocolo descreve métodos e fornece um fluxo de trabalho de análise para conduzir a pontuação histológica do EAE.
Disclosures
Shannon Dunn presta consultoria para FSD Lucid Psycheceuticals.
Acknowledgements
Agradecemos ao Dr. Raymond Sobel (Universidade de Stanford) por nos mostrar seu método de grossar e corrigir seções do cérebro e da medula espinhal. Agradecemos a Kyle Roberton e Milan Ganguly, do Toronto Centre for Phenogenomics, por aprenderem o método de incorporação e por cortarem tantas de nossas seções do cérebro e da medula espinhal. Agradecemos ao Dr. Matthew Cussick e ao Dr. Robert Fujinami (Universidade de Utah) por compartilharem seus protocolos para pontuar inflamação submeníngea e perivascular na medula espinhal. Agradecemos a Shalina Ousman por compartilhar o clone do anticorpo CD45. Agradecemos a Xiofang Lu pelo treinamento no processador de tecidos e na estação de incorporação de tecidos e pela manutenção deste equipamento no Keenan Research Centre of Biomedical Research no St. Michael's Hospital. Este trabalho foi apoiado por uma bolsa Biomédica da MS Canada (para SED). Carmen Ucciferri é apoiada por um estudante do Governo do Canadá. Nuria Alvarez-Sanchez é apoiada por uma bolsa de pós-doutorado Keenan.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
References
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved