הנדסת מכלולי גידים לבדיקת הצלבה תאית במחלה ותיקון
In This Article
Summary
כאן, אנו מציגים מערכת מודל אסמבלואיד המחקה את ההצלבה התאית של הגידים בין רקמת הליבה של הגיד נושא העומס לבין תא חיצוני המכיל אוכלוסיות תאים המופעלות על ידי מחלה ופציעה. כמקרה שימוש חשוב, אנו מדגימים כיצד ניתן לפרוס את המערכת כדי לחקור הפעלה רלוונטית למחלה של תאי אנדותל חיצוניים.
Abstract
גידים מאפשרים תנועה על ידי העברת כוחות שריר לעצמות. הם מסתמכים על ליבת גידים קשיחה הכוללת סיבי קולגן ואוכלוסיות תאי סטרומה. ליבה נושאת עומס זו מוקפת, מוזנת ומתוקנת על ידי שכבת רקמה סינוביאלית המרכיבה את תא הגיד החיצוני. למרות תכנון מתוחכם זה, פציעות גידים הן נפוצות, והטיפול הקליני עדיין מסתמך על פיזיותרפיה וניתוח. המגבלות של מערכות מודל ניסיוניות זמינות האטו את הפיתוח של טיפולים חדשניים לשינוי מחלות ומשטרים קליניים מונעי הישנות.
מחקרי In vivo בבני אדם מוגבלים להשוואת גידים בריאים לרקמות חולות או קרועות סופניות שנדגמו במהלך ניתוח תיקון ואינם מאפשרים מחקר אורך של מחלת הגידים הבסיסית. מודלים של בעלי חיים in vivo מציבים גם מגבלות חשובות בנוגע למורכבות פיזיולוגית מעורפלת, הנטל האתי על בעלי החיים והעלויות הכלכליות הגדולות הכרוכות בשימוש בהם. יתר על כן, מודלים של בעלי חיים in vivo אינם מתאימים לבדיקה שיטתית של תרופות ומסלולי אינטראקציה רב-תאיים ורב-רקמתיים. גם מערכות מודל חוץ גופיות פשוטות יותר נכשלו. אחת הסיבות העיקריות לכך היא כישלון לשכפל כראוי את העומס המכני התלת-ממדי הדרוש למחקר משמעותי של תאי הגידים ותפקודם.
מערכת המודל התלת-ממדית החדשה המוצגת כאן מקלה על חלק מהבעיות הללו על ידי ניצול צמחי ליבה של גיד זנב מורין. חשוב לציין, צמחים אלה נגישים בקלות במספרים גדולים מעכבר יחיד, שומרים על דפוסי טעינה תלת-ממדיים באתרם ברמה התאית, וכוללים מטריצה חוץ-תאית דמוית in vivo. בפרוטוקול זה, ניתנות הוראות שלב אחר שלב כיצד להגדיל צמחי ליבה של גידים עם הידרוג'ל קולגן עמוס בתאי אנדותל שמקורם בשריר, פיברובלסטים שמקורם בגידים ומקרופאגים שמקורם במח עצם כדי להחליף אוכלוסיות תאים המופעלות על ידי מחלות ופציעות בתוך תא הגידים החיצוני. הוא מדגים כיצד ניתן לאתגר את מכלולי הגידים המתקבלים באופן מכני או באמצעות גירויים מיקרו-סביבתיים מוגדרים כדי לחקור את הדיבור הרב-תאי המתפתח במהלך מחלה ופציעה.
Introduction
בתפקידם להעביר כוחות שריר לעצמות כדי לאפשר תנועה, הגידים מתמודדים עם כמה מהלחצים המכניים הקיצוניים ביותר המתרחשים בגוף האדם 1,2,3. בשל הזדקנות חברות, שכיחות גוברת של השמנת יתר, והפופולריות הגוברת של פעילויות ספורט תובעניות מכנית, השכיחות של מחלות גידים ופציעות צפויה לטפס במדינות המפותחות 4,5,6. הפיתוח של משטרי טיפול חדשניים מבוססי ראיות ומשנים מחלות כדי להילחם בעלייה זו עוכב על ידי מגבלות של מערכות מודל 1,7,8 הזמינות כיום.
באופן אידיאלי, מודלים לתיקון מחלות ופציעות יאפשרו לחקור כיצד איבר המטרה מעבד קבוצה מוגדרת של פרמטרי קלט (חיקוי גורמי מחלה, טבלה 1) לפרמטרי פלט מדידים (המייצגים סימני היכר של מחלות, טבלה 2) תוך בקרה על גורמים מבלבלים. מחקרים המשתמשים במערכות מודל כאלה יוכלו לזהות את התהליכים הפיזיולוגיים (הפתו-פתו) העומדים בבסיס מחלות ותיקון פציעות ולצבור ידע שניתן לנצל כדי למנוע או להפחית סימני היכר של מחלות ופציעות במרפאות. יישום עיקרון זה על גידים, מערכת מודל שימושית צריכה לשחזר חלקים מרכזיים של תגובת גיד in vivo למחלה ופציעה, אשר כוללים את סימני ההיכר הבאים: microdamage, דלקת, neovascularization, hypercellularity, תחלופת מטריצה מואצת, ו decommedmentalization 9,10,11,12,13,14,15 . באמצעות שימוש בסימני היכר אלה כבסיס, ניתן להסיק את הדרישות הבאות למערכת מודל מוצלחת לתיקון מחלת גידים ופציעות.
עומס יתר מכני משוער כגורם מרכזי בפגיעה בגידים ובפתוגנזה של מחלות, ולכן הוא גישה ניסיונית נפוצה ליצירת מיקרו-נזק16. יכולת העמסה מכנית ניתנת לשליטה היא, אם כן, תנאי מוקדם ראשון במעלה למודלים של מחלות גידים ותיקון פציעות. באופן אידיאלי, מערכת הדגם מאפשרת שלושה מצבים עיקריים: העמסת מתיחה אחת לנזק, העמסת עייפות ופריקה 8,17,18. עם דפורמציה מכנית, תאים שוכנים ברקמה חווים שילוב מורכב של כוחות מתח, כוחות גזירה (עקב הזזה של סיבי קולגן המקיפים את התאים), וכוחות דחיסה המתרחשים במהלך פריקה או בסמוך לאנתזה19,20. מערכות מודל צריכות לשחזר דפוסי טעינה מורכבים אלה קרוב ככל האפשר.
דרך חלופית להחדיר מיקרו-נזק מטריציוני היא למנף גורמי עקה ביוכימיים המחקים נטייה מערכתית למחלות ופציעות גידים, כגון ציטוקינים דלקתיים (פרו-)דלקתיים, עקה חמצונית או ריכוזי גלוקוז גבוהים 21,22,23. כתוצאה מכך, מיקרו-סביבה נישה הניתנת לשליטה מהווה יתרון למערכת מודל לתיקון מחלות גידים ופציעות.
תנאי מוקדם נפוץ כדי שמערכות מודל יהיו מסוגלות לשחזר דלקת, ניאו-וסקולריזציה והיפר-תאיות הוא נוכחות סלקטיבית של אוכלוסיות תאים המניעות תהליכים אלה24. עבור תהליכים דלקתיים, אוכלוסיות אלה כוללות נויטרופילים, תאי T ומקרופאגים, בעוד שתאי אנדותל ופריציטים יידרשו כדי לחקור ניאו-וסקולריזציה 25,26,27,28,29. פיברובלסטים של גידים חיוניים לא רק לתיקון גידים, אלא, כתאים מתרבים ונודדים, גם אחראים חלקית להיפר-תאיות המקומית שנצפתה במחלת גידים 30,31,32,33,34,35,36.
מלבד שינויים באוכלוסיית התאים התושבים, הרכב מטריצת הגידים משתנה גם במחלות גידים ופציעות 7,37,38,39,40. כדי להציג את הרמזים המיקרו-סביבתיים הרלוונטיים למחלה הנכונה, מערכות מודל צריכות להיות מסוגלות לשלב מטריצה חוץ-תאית המותאמת לשלב המחלה או הפציעה הממוקדת, לדוגמה, על ידי הפעלת שילובים פרופורציונליים רלוונטיים של קולגן-1, קולגן-3 ופיברונקטיןתאי 41.
המידור של גידים בריאים לליבת הגידים ולתאים החיצוניים (כלומר, אנדוטנון, אפיטנון ופרטנון) הוא מרכזי בתפקודם ולעיתים קרובות מופרע בגידים חולים או פצועים 1,42,43,44,45,46,47 . שילוב מידור גידים תלת-ממדי במערכות מודל הגידים נדרש אפוא לא רק כדי לדמות את התהליכים העומדים בבסיס המידור מחדש והמידור מחדש באופן הדוק יותר, אלא גם מסייע לבסס את השיפועים המרחביים-זמניים הנכונים של ציטוקינים וחומרי מזון48,49.
לבסוף, מודולריות היא נכס מרכזי נוסף של מערכות מודל, ומאפשרת לחוקרים לשלב את התרומה היחסית הנכונה ואת יחסי הגומלין בין גורמי הלחץ שתוארו לעיל במהלך התהליכים הנחקרים 8,17.
מלבד בחירת אופני הקלט האופטימליים, צעד חשוב הוא היכולת למדוד, להתבונן ולעקוב אחר שינויים בפלט המתקבל. התכונות המכניות של מערכת המודל (כלומר, אורך אזור הבוהן, מודולוס אלסטי ליניארי, מתח מתיחה מרבי, לחץ מתיחה מרבי, חוזק עייפות והרפיית מתח) הן מרכזיות כאן, שכן הן מאפיינות את הפונקציה העיקרית של הגיד 50,51,52. כדי לקשר שינויים תפקודיים אלה לשינויים ברמת הרקמה, חשוב לאפשר שיטות לאיתור נזק מטרי מבני (קולגן) ומעקב אחר התרבות וגיוס אוכלוסיות תאים רלוונטיות למחלות ולתיקון 30,53,54,55,56,57,58,59,60.
כדי לחקור שיחות צולבות מתפתחות בין תאים לתאים ולמטריצות תאים, אדם צריך להיות מסוגל לבודד או לסמן חלבונים בכמויות מתאימות לצורך כימות (כלומר, ELISA, פרוטאומיקה, אימונוהיסטוכימיה, ציטומטריית זרימה)14,21,61,62. ניתוח ביטוי גנים ספציפי לאוכלוסייה או לפחות לתא צריך להיות אפשרי גם כן (כלומר, מיון תאים המופעלים על ידי פלואורסצנטיות [FACS], ריצוף RNA חד-תאי/בתפזורת ותגובת שרשרת כמותית של פולימראז בזמן אמת (RT-qPCR))21,24,27,63. מערכת המודל צריכה לאפשר למדוד כמה שיותר מפרמטרי הפלט הנ"ל על אותה דגימה ועל דגימות מרובות באופן מהיר מספיק כדי לפתוח מחקרים בעלי תפוקה גבוהה.
מבין מערכות המודל הזמינות כיום לחקר מחלות גידים אנושיים ותיקון פציעות, גוף האדם עצמו הוא, כמובן, המייצג ביותר. זה גם הכי פחות תואם להתערבות ניסיונית. בעוד חולים עם פציעות גידים חריפות זמינים בשפע למחקרים קליניים, חולים עם טנדינופתיה מוקדמת (מחלת הגידים הנפוצה ביותר) הם לרוב ללא תסמינים ולעתים קרובות אינם מזוהים קלינית עד ששינויים חמורים יותר באים לידי ביטוי 14,64,65. עובדה זו מקשה להצביע על הרגע הקריטי שבו הומאוסטזיס הגידים יורד מהפסים ועל המנגנונים שמאחורי המעקה הזה 16,66,67,68,69. בנוסף, שאיבת ביופסיות מגידים בריאים היא מאתגרת מבחינה אתית, שכן היא עלולה לגרום לנזק מתמשך. שרידי גיד המסטרינג מניתוח שחזור רצועה צולבת קדמית משמשים לעתים קרובות כבקרות בריאות, אך ניתן לטעון כי הם שונים בתפקוד, תכונות מכניות, אוכלוסיות תאים והרכב מטריצה בהשוואה לשרוול המסובב, אכילס וגידי פטלר המושפעים בדרך כלל ממחלת גידים ופציעה 70,71,72,73.
מודלים של בעלי חיים in vivo נגישים ונוחים יותר, אך השימוש בהם מטיל נטל אתי משמעותי על בעלי החיים ועלות כלכלית על החוקרים. בנוסף, רוב חיות המודל הפופולריות אינן מפתחות נגעים טנדינופתיים באופן ספונטני (כלומר, חולדות, עכברים, ארנבות) או חסרות את הפריימרים ואת הזנים המהונדסים גנטית הדרושים כדי לעקוב אחר מסלולי התקשורת הרב-תאיים המעורבים בה (כלומר, סוסים, ארנבות).
מערכות מודל דו-ממדיות פשוטות במבחנה נמצאות בצד השני של ספקטרום הסיבוכיות/טרקטיביליות ומאפשרות טוב יותר מחקר מבוקר וחסכוני בזמן של מסלולי תקשורת בין-תאיים ספציפיים בתגובה לקבוצה נשלטת יותר של טריגרים 8,74. עם זאת, מערכות פשוטות אלה בדרך כלל אינן מצליחות לשחזר את העומס המכני הרב-ממדי (כלומר, מתח, דחיסה וגזירה) שהוא מרכזי בפונקציונליות הגידים. בנוסף, הקשיחות הגבוהה (מדי) של פלסטיק תרבית רקמות נוטה לעקוף כל רמז מטריצה המסופק על ידי ציפויים שנועדו לחקות את מצב המחלה של עניין75,76.
כדי להתגבר על חיסרון זה, פותחו מערכות מודל תלת-ממדיות מתוחכמות יותר ויותר של רקמות כדי לספק מטריצה הניתנת לטעינה שהרכבה יכול להיות מותאם לפחות חלקית למצב המחלה הרצוי 77,78,79. עם זאת, מערכות אלה לא רק מתקשות לשכפל במדויק את הרכבי המטריצות החוץ-תאיות המורכבות in vivo ואת דפוסי ההעמסה התאית, אלא בדרך כלל חסרות יכולת העמסה לטווח ארוך ואת הממשקים המידוריים הדרושים לחקר מסלולי התקשורת חוצי המדורות המתאמים מחלות גידים ותיקון פציעות 48,49,80.
למערכות מודל Ex vivo tendon explant יש את היתרון המובהק של הרכב מטריצה מובנה דמוי vivo הכולל נישות pericellian, מחסומים חוצי תאים, כמו גם שיפועים ציטוקינים/חומרים מזינים מרחביים-זמניים ומשחזרים דפוסי עומס מורכבים כאשר מותחים אותם8. כתוצאה ממגבלות דיפוזיה של חומרי מזון תלויי גודל, קשה לשמור בחיים צמחים ממודלים גדולים יותר של בעלי חיים (כלומר, סוסים) לצורך מחקר ארוך טווח של מחלות גידים ותיקון פציעות 81,82,83. בינתיים, צמחים קטנים יותר ממיני מורין (כלומר, גיד אכילס, גיד פטלרי) מאתגרים לשחזור ולהעמסה מכנית. גודלם גם מגביל את כמות החומר שניתן לאסוף לקריאות ברמת התא, החלבונים והגנים מבלי לאגד דגימות ולהקטין את התפוקה. במובן זה, פשקווילים של גידי זנב מורין מציעים את הפוטנציאל לפתוח מחקר בתפוקה גבוהה של מחלות גידים ותיקון פציעות מכיוון שהם זמינים בכמויות גדולות מעכבר יחיד, לשמר את הרכב המטריקס הפריתאי in vivo ולשחזר דפוסי העמסה תאית. עם זאת, במהלך תהליך החילוץ הם מאבדים את רוב התא החיצוני שלהם והכיל בו אוכלוסיות כלי דם, חיסוניות ופיברובלסטים הנחשבים כיום כגורמים למחלות גידים ולתיקון 8,18.
כדי לגשר על פער זה, פותחה מערכת מודל המשלבת את היתרונות של צמחי ליבה שמקורם בגיד זנב מורין עם היתרונות של מערכות מודל מבוססות הידרוג'ל תלת ממדי. מערכת מודל זו מורכבת מהידרוג'ל עמוס תאים (קולגן-1) הנוצק סביב גיד הזנב84,85. במאמר זה, שלבי הייצור הדרושים מסופקים בפירוט לצד קריאות שימושיות שניתן להשיג על ידי תרבית משותפת של צמחי ליבה (תא פנימי) בתוך הידרוג'ל קולגן מסוג 1 (תא חיצוני) עמוס תאי אנדותל.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הרשויות האחראיות (מספרי הרישוי של קנטון ציריך ZH104-18 ו- ZH058-21). סקירה כללית מוצגת באיור 1.
1. בידוד מרכיבי מכלול גידים מעכברים בני 12-15 שבועות (כלומר, B6/J-Rj)
- הרדימו את העכברים באמצעות חנק המושרה על ידי גזCO2 . כדי למקסם את התשואה, אין לעבד יותר מ -3 עכברים בכל פעם ולהמשיך בבידוד התאים מיד לאחר המתת חסד.
- להבטיח מוות על ידי אינדוקציה דו צדדית של pneumothorax.
- לעקר את עור העכבר עם 80% אתנול ולהעביר את העכבר למכסה מנוע סטרילי של בטיחות ביולוגית.
- בידוד צמחי ליבה של גיד הזנב.
- השתמש באזמל (מס '21) כדי להפריד את הזנב מהעכבר על ידי חיתוך אותו בבסיסו.
- מתחילים בקצה הזנב, אוחזים בו בפינצטה ומנענעים אותו כדי לשבור את העור. לאחר מכן, משכו בעדינות את הפינצטה מהזנב כדי לחשוף את צמחי הליבה של הגיד.
- מניחים את ליבת הגיד למדיום התרבית הסטנדרטי (DMEM/F12 + 10% FBS + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 1% חומצות אמינו לא חיוניות) ומפרידים אותם מחלק הזנב המשוך באמצעות להב אזמל טרי (מס' 21).
- חזור על שלבים 1.4.2. ו-1.4.3. עד שכל הזנב מעובד והגיד מתקצר מ-25 מ"מ.
- חתכו את עציצי הליבה המבודדים לחתיכות באורך 25 מ"מ באמצעות להב אזמל טרי (מס' 21).
- מדוד את הקוטר הממוצע של עציצי הליבה באמצעות מיקרוסקופ אור המחובר לתוכנת ניתוח תמונה באמצעות מצלמה דיגיטלית הניתנת לחיבור C-mount.
- השתמשו בנקודה ולחצו לבחירת הכלי למדידת קווים בצד ימין.
- מדדו את קוטר האקספלנט בשלושה מקומות שונים וחשבו את הקוטר הממוצע שלהם.
- כדי להקל על הידוק ובדיקות מכניות מאוחר יותר, המשך רק עם צמחי ליבה בעלי קוטר ממוצע גדול מ -100 מיקרומטר.
- הפריקה בשילוב עם האקספוזיציה לתנאי תרבית סטנדרטיים (37 מעלות צלזיוס, 20% O2, תוספת בסרום) משנה את ביטוי הגן תוך 6 שעות לאחר הבידוד וגורמת להתכלות תוך 7 ימים21. כדי להתחיל במצב מעין הומיאוסטטי, לייצר את מכלולי הגידים ולהתחיל את הניסויים מיד לאחר בידוד ליבת הגיד.
- בהתאם למערך הניסוי, נדרשים צמחי ליבה של גידים סוטים כקבוצת ביקורת. כדי לסטות מצמחי ליבה של גידים, הקפיאו אותם במיכל קטן מלא בחנקן נוזלי למשך 5 שניות באמצעות פינצטה ולאחר מכן הפשירו אותם במשך 5 שניות בטמפרטורת החדר (RT). חזור על מחזור הקפאה-הפשרה זה 3 פעמים והמשך לשלב 4 ("הידוק צמחי הליבה").
אזהרה: חנקן נוזלי עלול לגרום לכוויות קור, לחנק ולחומרים רגילים רבים. יש להשתמש רק במיכלים המיועדים לנוזלים בטמפרטורה נמוכה וללבוש ביגוד מגן (כלומר, מגן פנים, כפפות מתאימות, נעליים סגורות).
- בידוד פיברובלסטים של גידים.
- השתמש באזמל (מס '21) כדי לבצע חתך רוחבי באמצע כף רגלו של העכבר. בצע שני חתכים בניצב לכף הרגל, לאורך צידי הרגליים האחוריות ועד הירכיים מכל קצה של חתך זה.
- השתמשו בפינצטה כדי לקבע את דש העור החתוך בכף הרגל ולקלף את העור המכסה את שרירי השוק. בעת בידוד תאי אנדותל מאותו עכבר, הסר את כל העור במקום.
- מפרידים את גיד אכילס מעצם הקלקניוס בעזרת להב אזמל טרי (מס' 21). מקבעים את הקצה הרופף של גיד אכילס בעזרת הפינצטה ומפרידים את הקצה השני משריר הגסטרוקנמיוס.
- שטפו את גיד אכילס פעם אחת ב-PBS והשתמשו באזמל (מס' 21) כדי להסיר את כל רקמת השריר שנותרה עד שתישאר רק רקמת הגיד הלבן. אם תאי אנדותל מבודדים מאותו עכבר, השאירו את גיד אכילס ב-PBS והמשיכו בשלב 1.6. ראשון.
- יש לערבב את גידי אכילס מחיה אחת לתוך צינור פלסטיק בנפח 15 מ"ל המכיל 10 מ"ל מדיום עיכול גידים (DMEM/F12 + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 2 מ"ג/מ"ל קולגנאז 1) ולעכל במשך 6-8 שעות ב-37°C תחת תסיסה איטית ומתמדת באמצעות שייקר אורביטלי במהירות נמוכה ב-15 סל"ד.
- צנטריפוגה את תמיסת הגידים המעוכלת ב 500 x גרם במשך 5 דקות ב RT, לשאוף את supernatant, ו resuspend ב 8 מ"ל של מדיום תרבית סטנדרטי (DMEM / F12 + 10% FBS + 1% פניצילין / סטרפטומיצין + 1% אמפוטריצין + 1% חומצות אמינו לא חיוניות), ותרבית בבקבוק תרבית T25 בתנאי תרבית סטנדרטיים (37 ° C, 20 % O2) במשך 7 ימים ללא שינוי מדיה. לאחר מכן, לשנות את התקשורת פעם בשבוע.
- פיצול התאים במפגש של 80% לבקבוק תרבית T150 (1:6). יש להקפיא את התאים במעבר 2 ב-2 מ"ל של מדיום הקפאה סטרילי מסונן (70% DMEM/F12 + 20% FBS + 10% DMSO) המופץ לשני צינורות קריו-צינוריות בנפח 1.5 מ"ל ולשמור אותם בטמפרטורה של -80°C עד לשימוש נוסף. השתמש טריפסין כדי להסיר את התאים מפלסטיק תרבית הרקמה.
- בודד תאי אנדותל שמקורם בשריר.
- אם פיברובלסטים בגידים אינם מבודדים מאותו עכבר, התחל בשלבים 1.5.1 ו- 1.5.2.
- השתמש מספריים כדי להפריד את הרגליים האחוריות מהגוף על ידי חיתוך במפרק הירך.
- שטפו את הרגליים האחוריות פעם אחת ב-PBS קר (~ 4 מעלות צלזיוס), הסירו את השרירים (ארבע ראשי עצם הירך, extensor digitorum longus, סולאוס וגסטרוקנמיוס) בעזרת אזמל (מס' 21), והניחו את השרירים בתוך צלחת פטרי על קרח.
- השתמשו בלהב אזמל טרי (מס' 21) כדי לטחון את רקמת השריר לחתיכות קטנות מ-1 מ"מ3 תוך שמירה על צלחת הפטרי על קרח.
- אגרו את רקמת השריר הטחון משתי הרגליים האחוריות לתוך צינור פלסטיק של 50 מ"ל המכיל 12.5 מ"ל של מדיום עיכול שרירים (PBS + 2 מ"ג / מ"ל collagenase IV + 2 מ"ג / מ"ל dispase II + 2 mM CaCl2).
- הכניסו את צינור הפלסטיק לאמבט מים בטמפרטורה של 37°C למשך 10 דקות. נערו במרץ את התמיסה והחזירו אותה ל-10 דקות נוספות. חזור על הפעולה עד שהתמיסה נראית הומוגנית ונשארות רק חתיכות (לבנות) של גיד ופאשיה (כ-4X10 דקות). בינתיים, המשך עם בידוד פיברובלסטים בגיד או בידוד מקרופאגים.
- הוסף 12.5 מ"ל של PBS קר + 10% FBS לצינור הפלסטיק כדי לעצור את העיכול.
- השתמש במחזיק פיפטה מונע סוללה מצויד פיפטה 50 מ"ל כדי לשאוף את המתלה מצינור הפלסטיק. ציידו את צינור הפלסטיק במסננת תאים בגודל 400 מיקרומטר וסננו את המתלה כדי להסיר לכלוך. חזור על התהליך עם מסננת תאים של 100 מיקרומטר.
- צנטריפוגה את המתלה המסונן ב 400 x גרם במשך 5 דקות ב RT. Resuspend ב 10 מ"ל של PBS קר + 10% FBS וצנטריפוגה שוב.
- השהיה מחדש ב-8 מ"ל של מדיום תרבית אנדותל (תערובת 1:1 של DMEM/F12 וערכת אנדופן 3 + 10 U/mL הפרין + 20% FBS + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 30 מ"ג/מ"ל תוסף גדילה אנדותל) בתוספת פורומיצין (4 מ"ג/מ"ל) לבחירת האוכלוסייה.
- זרעו את התאים מעכבר אחד לתוך בקבוק תרבית T25 אחד שהיה מצופה בעבר ב-2 מ"ל של תמיסת ג'לטין סטרילית 0.2% למשך שעתיים ב-37°C ולאחר מכן יובשו למשך הלילה ב-RT לאחר הסרת התמיסה העודפת. הכינו את הצלוחיות יום לפני הבידוד.
- לאחר 24 שעות בתנאי תרבית סטנדרטיים (37°C, 20% O2), הסירו את מדיום תוסף הפורומיצין, שטפו את התאים המחוברים פעם אחת עם PBS, ותרביתו אותם ב-8 מ"ל של מדיום תרבית אנדותל.
- מעבירים את התאים ביחס של 1:5 במפגש של 80% לצלוחיות מצופות ג'לטין ומשתמשים בהם בניסויים עד P2. השתמש בתמיסת ניתוק תאים שאינה טריפסין (רשימת חומרים) כדי להסיר את התאים מפלסטיק תרבית הרקמה ולא להקפיא אותם.
- בודדו מקרופאגים שמקורם במח עצם.
- אם פיברובלסטים של גידים או תאי אנדותל אינם מבודדים מאותו עכבר, בצע תחילה את שלבים 1.5.1, 1.5.2, 1.6.2 ו- 1.6.3.
- לאחר הסרת העור, הגיד ורקמות השריר, יש לשטוף את שאריות העצמות (עצם הירך והשוקה) פעם אחת ב-PBS קר (~4°C).
- מניחים את העצמות ב- PBS קר טרי (~ 4 ° C) ומשתמשים באזמל (מס '21) כדי לחתוך בהדרגה את האפיפיזה עד לחשיפה של מח העצם. הוא מופיע כנקודה אדומה משני צידי העצם.
- ציידו מזרק במחט הזרקה בגודל 0.4 מ"מ x 25 מ"מ (G27) ומלאו אותו ב-10 מ"ל מדיום תרבית מקרופאגים (DMEM/F12 + 10% FBS + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 1% חומצות אמינו לא חיוניות).
- החזיקו עצם אחר עצם מעל צינור פלסטיק של 50 מ"ל, הכניסו את מחט ההזרקה בעומק של כ-1 מ"מ לתוך מח העצם החשוף בחלקו העליון, ושטפו את מח העצם על ידי ריקון המזרק. מח העצם הסמוק מופיע כמבנה דמוי צינור אדמדם כאשר הוא תלוי בתווך.
- ממיסים את מח העצם על ידי הדבקתו בעדינות מעלה ומטה שוב ושוב באמצעות קצה פיפטה בנפח 1 מ"ל. השתמש במחזיק פיפטה מונחה סוללה המצויד בפיפט 50 מ"ל כדי לסנן את תרחיף התא דרך מסננת תאים של 100 מיקרומטר בחזרה לצינור הפלסטיק של 50 מ"ל ולצנטריפוגה אותו במהירות של 350 x גרם למשך 5 דקות ב- RT.
- הסר את הסופרנטנט, השהה מחדש את הגלולה במאגר ליזה של 10 מ"ל תאי דם אדומים (RBC), וצנטריפוגה שוב ב 350 x גרם למשך 10 דקות בטמפרטורת החדר.
- השהה מחדש את הגלולה ב 5 מ"ל של מדיום תרבית מקרופאגים (DMEM / F12 + 10% FBS + 1% פניצילין / סטרפטומיצין + 1% אמפוטריצין + 1% חומצות אמינו לא חיוניות) וזרע אותו לתוך צלחות פטרי לא מטופלות בקוטר 100 מ"מ (5-8 x 106 תאים לכל מנה).
- לאחר 4 שעות, הוסף 5 מ"ל של מדיום תרבית מקרופאגים בתוספת 40 ng/mL גורם מגרה מושבת מקרופאגים (m-CSF) למדיום תרבית התא ללא m-CSF (תערובת 1:1) כדי להגיע לריכוז סופי של 20 ng/mL m-CSF.
- לאחר 6 ימים, השתמש בתאים בניסויים או הקפיא אותם עד לשימוש נוסף. השתמש בתמיסת ניתוק תאים שאינה טריפסין (רשימת חומרים) כדי להסיר את התאים מפלסטיק תרבית הרקמה.
הערה: לאחר הבידוד, התאים אינם מתרחבים עוד. שיטות בידוד התאים המתוארות כאן פועלות גם עם עכברים וחולדות מחוץ לטווח הגילאים שצוין.
- כדי לאמת את הפנוטיפ של אוכלוסיות התאים המבודדים באמצעות ציטומטריית זרימה, המשך לשלב 6.3.4.
2. בידוד קולגן מחולדות Wistar או Sprague-Dawley
- פעל לפי פרוטוקול הבידוד המתואר בפירוט במקום אחר86. זה עובד גם עם עכברים, אם כי עם תשואה נמוכה בהרבה.
- קבע את ריכוז התמיסה המתקבלת עם בדיקת הידרוקסיפרולין, הערך את הטוהר עם דף SDS, ואחסן את התמיסה ב -4 מעלות צלזיוס עד לשימוש בניסויים.
3. ייצור מרכיבי מערכת התרבות
- הדפס תלת מימד את מחזיקי המהדק, את תחנת ההרכבה ואת תבניות התא.
- טען את קובץ ה- .stl המצורף (קובץ משלים 1) עבור מחזיקי המהדק, תחנת ההרכבה ותבניות התא לתוכנת החיתוך. כדי להתאים את מספרי האובייקטים כנדרש, השתמש באפשרות הצבע ולחץ לבחירת אובייקטים והעתק והדבק כדי להכפיל אותם.
- הקש Export G-code (Ctrl-R) כדי ליצור את קוד G ולאחר מכן יצא אותו (Ctrl-G).
- טען את ה-G-code למדפסת תלת-ממד.
- השתמש בחוטים לא צבעוניים ותואמים ביולוגית לתהליך ההדפסה (כלומר, חומצה פולילקטית).
- חותכים חוטי 3 מ"מ לתוך החורים של מחזיק המהדק שיישא את הברגים באמצעות חותך חוטים (קובץ משלים 2 וקובץ משלים 3, חורים 1 ו-3).
- הכניסו סיכות נירוסטה לחור בחלק האחורי של מחזיק המהדק (קובץ משלים 2 ותיק משלים 3, חור 4).
- יש לעקר את מחזיקי המהדק ואת תחנת ההרכבה באור UV למשך שעה לפחות אחת לפני השימוש. אין לעשות שימוש חוזר במחזיקי מהדק מודפסים בתלת-ממד.
- לחילופין, יש לייצר את מחזיקי המלחציים ואת עמדת ההרכבה מפוליאתרמיד באמצעות התוכניות המצורפות (קובץ משלים 2, קובץ משלים 3 וקובץ משלים 4), שהוא יקר יותר אך מאפשר שיטות עיקור טובות יותר (כלומר, אוטוקלאבינג) ושימוש חוזר.
- יצקו את התאים באמצעות תבניות המודפסות בתלת-ממד.
- ממלאים את תבניות התא בסיליקון.
- משחררים את הסיליקון בתא ואקום (90 mbar) למשך 30 דקות.
- תן לתמיסה להתפלמר ב RT לילה או על פלטה חמה ב 70 ° C במשך 1 שעה, בהתאם להתנגדות החום של החוטים המשמשים לתבניות.
- בזהירות להסיר את התאים פולימרי מן התבניות לחתוך סיליקון מיותר עם אזמל (מס '21).
- אופציונלי: אם יש לטעון מכנית את המכלולים, ובכך את התאים שמסביב, חזקו את החורים בתאי הסיליקון בצינורות חלולים העשויים מפלדת אל-חלד.
- מכונת מהדקי המתכת מנירוסטה באמצעות התוכנית המצורפת (קובץ משלים 5).
- לפני כל שימוש, שטפו את מהדקי הנירוסטה, את מחזיקי מהדק הפוליאתרמיד, את הברגים ואת תא הסיליקון.
- סוניק למשך 10 דקות ב-80% אתנול (EtOH) ו-20% מי אוסמוזה הפוכה (ROW).
- סוניק למשך 10 דקות ב-50% EtOH ו-50% איזופרופנול.
- יש לשטוף 3 פעמים עם ROW.
- סוניק למשך 10 דקות בתרכיז ניקוי אלקליין 0.5% (כלומר, 3 מ"ל ב-600 מ"ל ROW).
- סוניק למשך 10 דקות בתרכיז ניקוי אלקליין 0.5%.
- יש להשאיר בתרכיז ניקוי אלקליין 0.5% תוך כדי ניעור במשך שעה ו-50 דקות.
- יש לשטוף 3 פעמים עם ROW.
- סוניק במשך 10 דקות ב- ROW.
- אוורור את הרכיבים autoclave אותם.
4. הידוק צמחי הליבה
- הניחו מחזיקי מהדק תואמים יחד עם מהדק מתכת אחד כל אחד לתוך תחנת ההרכבה.
- מניחים חתיכות נייר אוטוקלאביות רטובות (4 מ"מ x 25 מ"מ) על גבי מהדקי המתכת ולאחר מכן חותכים את הנייר לאורך הגבולות הפנימיים של המלחציים בעזרת אזמל (מס' 21). גזור 2 פיסות נייר נוספות, קטנות יותר (4 מ"מ x 1.5 מ"מ) מפיסת נייר אחרת ושמור אותן רטובות.
- בעזרת פינצטה מחודדת, הניחו 8 עציצי ליבה על הנייר בין מהדקי המתכת עם נקודות הקצה שלהם על מהדקי המתכת.
- כסו את נקודות הקצה של עציצי הליבה בחתיכות הנייר הקטנות יותר (4 מ"מ x 1.5 מ"מ) ולאחר מכן הניחו עליהן מהדקי מתכת. השתמש במברג ובברגים הקטנים (M3 x 6 מ"מ) כדי לקבע את עציצי הליבה בין מהדקי המתכת למחזיק המהדק.
- העבירו בזהירות את צמחי הליבה המהודקים לתאי תרבית הסיליקון ומלאו תאים אלה ב-2 מ"ל של מדיום תרבית תאים סטנדרטי (DMEM/F12 + 10% FBS + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 1% חומצות אמינו לא חיוניות).
- אופציונלי: אם יש להעמיס מכנית את המכלולים/התאים שמסביב, יש לקבע אותם באמצעות ברגים נוספים (M3 x 16 מ"מ) בחור 3 (קובץ משלים 2 וקובץ משלים 3, חור 3).
5. הכנה ויציקה של קולגן הידרוג'ל
- הסר את תאי המטרה מפלסטיק תרבית הרקמה עם תמיסת ניתוק תאים, צנטריפוגר אותם ב 400 x גרם במשך 5 דקות ב RT, והשהה אותם מחדש ב 1 מ"ל של מדיום תרבית סטנדרטי.
- עבור מכלול אחד, נדרשים 10 μL PBS (20x), 1.28 μL של 1 M NaOH (125x), 8.72 μL של מים מזוקקים פעמיים (ddH2O, 23x), 80 μL של קולגן-1 (2.5x או 1.6 מ"ג/מ"ל סופי), ו-100 μL (2x) של מדיית תרבית סטנדרטית (עבור מכלולים ללא תאים // ליבה) או תרחיף תאים. מכינים רכיבים אלה בשתי תמיסות נפרדות ומערבבים אותם רק מיד לפני היציקה.
- פתרון Crosslinking: אחסן את PBS, NaOH, ddH20 ואת תרחיף התא של עד 12 מכלולים (+10% מרווח בטיחות) לתמיסת crosslinking ושמור אותו בצינור פלסטיק 15 מ"ל על קרח. התאם את ריכוז תרחיף התא כדי להשיג את הריכוזים הסופיים הבאים לאחר ערבוב שתי התמיסות: 250,000 תאים/מ"ל פיברובלסטים של גידים, 500,000 תאים/מ"ל תאי אנדותל שמקורם בשריר, או 370,000 תאים/מ"ל מקרופאגים שמקורם במח עצם.
- תמיסת קולגן-1: אגרו את תמיסת הקולגן-1 הדרושה לעד 12 מכלולים (+10% מרווח בטיחות) בצינור פלסטיק נוסף של 15 מ"ל ושמרו אותו על קרח.
- לאחר שתמיסת הקרוסלינקינג ותמיסת הקולגן-1 מוכנות על קרח, שאפו את מדיום תרבית התאים מתאי התרבית המכילים את צמחי הליבה המהודקים.
- הוסיפו את תמיסת הקולגן-1 לתמיסת הקרוסלינקינג עם פיפטה של 1000 מיקרוליטר וערבבו את שתי התמיסות על ידי זינוק מעלה ומטה במהירות מבלי ליצור בועות. כסו את העציצים הבודדים של ליבת הגידים ב-200 מיקרוליטר של התמיסה המעורבת על ידי הזרמתו למטעים המסופקים על ידי תאי הסיליקון.
- תן הידרוג'לים פילמור במשך 50 דקות ב 37 ° C.
- מלאו בזהירות את תאי תרבית הסיליקון ב-1.5 מ"ל של מדיום התרבות המשותפת בהתאמה על ידי פיפטציה בפינות החדרים.
- עבור תרבית משותפת של ליבה // פיברובלסט, מלא DMEM/F12, 10% FBS, 1% חומצות אמינו לא חיוניות, 1% פניצילין/סטרפטומיצין, 1% אמפוטריצין, 200 מיקרומטר L-חומצה אסקורבית, 20 ננוגרם/מ"ל גורם מגרה מושבת מקרופאגים.
- עבור תרבית משותפת של ליבה // מקרופאגים, מלא DMEM/F12, 10% FBS, 1% חומצות אמינו לא חיוניות, 1% פניצילין/סטרפטומיצין, 1% אמפוטריצין, 200 מיקרומטר L-חומצה אסקורבית, 20 ננוגרם/מ"ל גורם מגרה מושבת מקרופאגים.
- לתרבית תאי ליבה // אנדותל, מלא תערובת 1:1 של DMEM/F12 ואת ערכת אנדופן 3 + 10 U/mL הפרין + 20% FBS + 1% פניצילין/סטרפטומיצין + 1% אמפוטריצין + 30 מ"ג/מ"ל תוסף גדילה אנדותל.
- תרבות המכלולים בתנאי התרבות המתאימים להשערה. כדי לחקות סביבת נישה דמוית נגע, למשל, תרבית אותם בטמפרטורה של 37 מעלות צלזיוס ו-20% O2. שנה את מדיום התרבות פעמיים בשבוע אחד. כדי למנוע זיהומים, הניחו את התאים בתוך צלחת פטרי גדולה או קופסה סטרילית לפני הכנסתם לאינקובטור.
הערה: זמן התרבות תלוי בהשערה ובמערך התרבות המשותפת. לדוגמה, מכלולי ליבה // פיברובלסטים בסביבת נישה דמוית נגע הופכים לבלתי יציבים מכנית לאחר כשלושה שבועות.
6. שיטות קריאה זמינות
- ביצוע מיקרוסקופ פלואורסצנטי, כולל בדיקות כדאיות ומורפולוגיה.
- באופן כללי, ניתן לדמיין את המכלולים כתושבות מלאות. לשם כך, הסר את המכלולים מהמלחציים על ידי חיתוך אותם במספריים קרוב למלחציים והעברתם לצלחת בת 12 בארות.
- שטפו את המכלולים פעם אחת עם PBS.
- אם מבוצעת בדיקת כדאיות, יש להכתים כל מכלול ב-100 μL של הומודימר אתידיום 4 x 10-6 M ב-PBS (EthD-1) למשך 20 דקות ב-37°C בחושך.
- שטפו את המכלולים 3x עם PBS, ולאחר מכן קבעו אותם עם 500 μL של 4% פורמלדהיד כל אחד למשך 20 דקות ב-RT.
אזהרה: לפורמלדהיד 4% יש השפעות אלרגניות, מסרטנות ומוטגניות, רעיל לרבייה ועלול לגרום לרעילות התפתחותית (רפרוטוקסית) או לנזק לאיברים. יש ללבוש ביגוד מגן וכפפות, הגנה על העיניים ומסכה או הגנה אחרת על הנשימה. - שטפו את המכלולים 3x עם PBS והמשיכו עם פרוטוקול הצביעה הנבחר. מבחר כתמים תואר בעבר84,85.
הערה: הימנעו מכתמים המשתמשים בפלואורופורים עם אורך גל פליטה קרוב לזה של קולגן אוטופלואורסצנטי (בסביבות 480 ננומטר).
- בהתאם להוראות היצרן, בצע בידוד RNA ספציפי לתא עבור RT-qPCR או ריצוף RNA כלל גנומי.
- הסר את המכלולים מן מלחציים עם מספריים.
- אופציונלי: השתמש בפינצטה כדי להפריד את צמחי הליבה מתא ההידרוג'ל החיצוני.
- בריכה 20-24 צמחי ליבה בקוטר 20 מ"מ או 2 הידרוג'לים עמוסי תאים של קולגן לבידוד כמויות מספיקות של RNA.
- השתמשו ב-1 מ"ל של טריזול קר ושיבוש מכני (כלומר, חרוזי מתכת או טחינה קריוגנית) כדי להרוס את המטריצה החוץ-תאית של צמחי הליבה המאוגדים או של הידרוג'ל הקולגן המאוחד.
אזהרה: רעילות דרך הפה, הרעלת העור ורעילות בשאיפה. גורם לגירוי בעור ובעיניים. יש לטפל רק עם כפפות ובארון בטיחות כימי. - המשך בבידוד RNA מהתא ליזט באמצעות ערכות מיצוי RNA סטנדרטיות כמתואר קודם או כמתואר בהוראות היצרן84,85.
- ציטומטריית זרימה ספציפית לתא.
- הסר את המכלולים מן מלחציים עם מספריים.
- אופציונלי: השתמש בפינצטה כדי להפריד את צמחי הליבה מתא ההידרוג'ל החיצוני.
- יש לעכל תאים ב-1 מ"ל של PBS עם collagenase I (3 מ"ג/מ"ל) ו-dispase II (4 מ"ג/מ"ל) למשך 4 שעות ב-37°C תחת תסיסה מתמדת.
- צנטריפוגה את התמיסה המעוכלת ב 500 x גרם במשך 5 דקות ב RT ולשאוף את supernatant.
- יש להשהות מחדש את הגלולה ב-100 מיקרוליטר של חיץ FACS (1% FBS ב-PBS) המכיל נוגדנים מצומדים פלואורופורים לפי בחירה. מבחר נוגדנים מצומדים פלואורופורים עובדים תוארו בעבר84,85.
- דגרו על תמיסת הצביעה למשך 30 דקות ב-RT.
- דללו את תמיסת הצביעה עם 1.4 מ"ל של חיץ FACS וצנטריפוגו אותה למשך 5 דקות ב-500 x גרם ב-RT.
- השהה מחדש את הגלולה במאגר FACS של 350 מיקרוליטר וסנן את התמיסה דרך מכסה מסננת רשת ניילון של 100 מיקרומטר לפני שתנתח אותה עם ציטומטר הזרימה הנבחר בהתאם להוראות היצרן.
- לנתח את supernatant.
- החליפו את מדיום התרבות המשותפת במדיום תרבית משותפת ללא סרום 3 ימים לפני קולקציית הסופרנאטנט.
- בצע ניתוח מיידי ומושהה של הסופרנאטנט המועשר והלא מדולל עם ערכות בדיקה אימונוסורבנטיות מקושרות אנזימים (ELISA) וערכות גילוי בקנה מידה של מזו (MSD). לניתוח מושהה, אחסנו את הסופרנאטנט בצינורות פלסטיק של 1.5 מ"ל בטמפרטורה של -80°C.
- להעריך את התכונות המכניות assembloid.
- השתמש במכשיר מתיחה מותאם אישית כדי להפעיל כוחות מכניים ולמדוד תכונות מכניות22. פיני הדיבל מפלדת אל-חלד וברגי הנירוסטה הופכים את המהדקים למחוברים גם להתקני מתיחה אחרים.
- מכיוון שהתכונות המכניות של המכלול נקבעות במידה רבה על ידי זו של הליבה המשובצת explant 18, למדוד את התכונות המכניות של explant הליבה לפני הטמעתו בהידרוג'ל כדי להפחית את הסיכון של הרס הידרוג'ל יצוק טרי בתהליך המדידה.
Representative Results
בידוד רכיבים (איור 1 ואיור 2)
לפני השימוש בצמחי הליבה ובאוכלוסיות התאים בתרבית משותפת של אסמבלואידים, יש לבדוק את המרכיבים האלה תחת המיקרוסקופ (איור 1). צמחי ליבה צריכים להיות בקוטר אחיד (100-200 מיקרומטר) וללא סטיות או קמטים גלויים. תאי אנדותל צריכים להציג צורה מוארכת במגע עם תאים אחרים, מה שהם לא עושים כאשר הם נזרעים בצפיפות נמוכה מדי בגלל תפוקה ראשונית נמוכה מהבידוד. במקרה זה, תאי האנדותל מקבלים צורה עגולה יותר עם שלוחות שלד ציטו-שלד ומתרבים לאט יותר במידה ניכרת. חלקו אותם 1:5 לאחר 7-10 ימים. פיברובלסטים של גידים שבודדו מגידי אכילס מניחים מורפולוגיה עגולה יותר בהשוואה למקביליהם האנושיים תוך 1-2 מעברים (10-14 ימים כל אחד) כאשר הם פוצלו ביחס של 1:6. המקרופאגים קטנים בהרבה מפיברובלסטים או תאי אנדותל ואינם מתרבים לאחר הבידוד. בהתאם אצווה, הצורה שלהם יכולה להשתנות בין פירמידלי עגול.
הפנוטיפים של המרכיבים התאיים אומתו באמצעות ציטומטריית זרימה. נוגדן CD31 מצומד שימש כסמן לתאי אנדותל (איור 2A). קביעת סף הפלואורסצנטיות בהתבסס על דגימת ביקורת לא מוכתמת (אפור), 90.1% ממעבר 1 (P1) ו-48.7% מתאי אנדותל מעבר 2 (P2) זוהו כחיוביים ל-CD31. קו עכבר מהונדס גנטית המבטא יחד את סמן הפיברובלסטים של הגיד Scleraxis לצד חלבון פלואורסצנטי ירוק (ScxGFP) ונוגדן CD146 מצומד שימש לאפיון הפיברובלסטים של הגידים (איור 2B)35,60. לאחר מעבר אחד (P1), 37.3% מהפיברובלסטים היו ScxGFP+CD146-, 0.2% היו ScxGFP+CD146+, 4.3% היו ScxGFP-CD146+, ו-58% היו ScxGFP-CD146-. לאחר שני מעברים (P2), אחוז תאי ScxGFP+CD146 ירד ל-27.6%, אחוז תאי ScxGFP+CD146+ עלה ל-6.9%, אחוז תאי ScxGFP-CD146+ עלה ל-10.6% ואחוז תאי ScxGFP-CD146 ירד ל-54.9%. כדי לזהות ולאפיין את המקרופאגים, נעשה שימוש בנוגדן F4/80 בשילוב עם CD86 ונוגדן CD206 (איור 2C). לאחר בידוד ותרבית, 96.4% מהתאים שמקורם במח עצם היו חיוביים ל-F4/80. מבין התאים החיוביים ל-F4/80, 8.6% היו CD206+CD86-, 23.6% היו CD206+CD86+, 28.3% היו CD206-CD86+, ו-39.4% היו CD206-CD86-. מהירות הקישור הצולבות של קולגן עשויה להשתנות מאצווה לאצווה, ויש לבדוק אותה לפני תחילת הניסויים.
מראה אסמבלואיד (איור 3)
בתנאי תרבית דמויי נגעים (36°C, 20% O2), צמח הליבה נותר ניתן למתיחות מכנית, לא השתנה במראהו, והמשיך להיות ניתן להבחנה חזותית ולהפרדה פיזית מההידרוג'ל שמסביב במשך 21 יום לפחות (איור 3A,B). ההידרוג'ל שמסביב נדחס עם הזמן, כאשר מהירות הדחיסה הייתה תלויה באוכלוסיית התאים שנזרעה לתוכו. פיברובלסטים שמקורם בגיד אכילס כיווצו את ההידרוג'ל הסובב אותם במהירות הגבוהה ביותר, ועשו זאת באופן רדיאלי כאשר הם יצקו הידרוג'ל סביב צמח ליבה ולכל הכיוונים כאשר לא (איור 3B,C). בתחילה, הידרוג'לים נטולי תאים שהונחו סביב צמח ליבה נדחסו גם כן. התכווצות זו נגרמה ככל הנראה על ידי תאים נודדים מצמח הליבה, דבר המצביע על ממשק דינמי חוצה תאים. מאחר שהידרוג'לים נטולי תאים ללא עציץ ליבה מוטבע לא נדחסו באופן ניכר, נראה שהתרומה של התכווצות כתוצאה מאיבוד מים היא זניחה (איור 3B וקובץ משלים 6).
לכן, חוסר בדחיסת הידרוג'ל יכול לשמש לאיתור טעויות בהרכבה האסמבלואידית (כלומר, ריכוזי תאים נמוכים) ויש לבדוק אותו לפני שממשיכים בשיטות קריאה יקרות יותר. בעת ביסוס שיטה זו, טעויות נפוצות בהפחתת ריכוז התאים כללו תאים גוססים בהידרוג'ל החיצוני מכיוון שהם הושארו זמן רב מדי בתמיסת הקרוסלינקינג הקשה יחסית (pH גבוה, טמפרטורה נמוכה) וייבוש צמחי ליבה מכיוון שהזמן בין שאיפה בינונית להזרקת הידרוג'ל היה ארוך מדי, או מכיוון שצמח הליבה היה מהודק גבוה מכדי להיות מוטבע בקולגן.
מיקרוסקופ פלואורסצנטי קונפוקלי: ניתוח כדאיות ומורפולוגיה (איור 3)
לאחר שהוצאו מהמלחציים בעזרת מספריים (איור 3B), ניתן לתקן, לצבוע ולצלם מכלולים באמצעות מיקרוסקופ קונפוקלי בכללותו ללא חתך. כאן, מכלולי ליבה // אנדותל, ליבה // מקרופאגים וליבה // מכלולים פיברובלסטים הוכתמו ב-DAPI (NucBlue) ובאתידיום הומודימר (EthD-1) כדי לנתח את הכדאיות, וב-DAPI וב-F-actin כדי לנתח מורפולוגיה והתפשטות תאים בהידרוג'ל קולגן תלת-ממדי (איור 3D). הכדאיות של מכלולי תאי ליבה // אנדותל (איור 3E) כומתה ונמצאה בדרך כלל נמוכה יותר לאחר הרכבת אסמבלואיד מאשר דווח בעבר עבור מכלולי ליבה // מקרופאגים וליבה // פיברובלסטים84. עם זאת, הכדאיות נשארה יציבה במהלך תרבית האסמבלואיד לפחות עד היום השביעי.
מיקרו-נזק הנגרם באופן מכני ומדידת תכונות מכניות (איור 4)
הברגים והפינים המחוברים למחזיקי המהדק מאפשרים קיבוע של מכלולים מהודקים להתקני מתיחה חד ציריים. מכשיר המתיחה המותאם אישית המשמש כאן מצויד בתא עומס של 10 N ותואר בפרסומים קודמים (איור 4A)22. כל הדגימות היו מותנות מראש עם חמישה מחזורי מתיחה למאמץ של 1% לפני המדידות.
רישום עקומת המאמץ המלאה של צמחי ליבה או מכלולים (איור 4B) יאפשר לכמת את המודולוס האלסטי הליניארי (α), את הלחץ המרבי (β) ואת המאמץ המרבי (у). עם זאת, הוא גם פוגע באופן בלתי הפיך בעציץ הליבה או במכלול, מה שלא מאפשר להעריך את התפתחות האורך של הלחץ המרבי (β) והזן המרבי (у) עבור אותן דגימות (איור 4B). כאן, המודולוס האלסטי הליניארי שימש כמדד ליכולת הדגימה לעמוד בכוחות, שכן מדידה זו דורשת מתיחת הדגימה למאמץ של 2% בלבד, שהוכח בעבר כי אינו גורם להפחתה קבועה במודולוס האלסטי הליניארי18. בפרט, מכלולי תאי אנדותל // נחשפו להליך ההידוק לזן של 2% (בערך קצה האזור האלסטי הליניארי) או 6% זן (בערך הזן המרבי). המיקרו-נזק שנוצר הוערך על-ידי מדידת המודולוס האלסטי הליניארי לפני ואחרי ההליך (איור 4C).
בהתאם לניסויים שנערכו בעבר תוך ניצול צמחי ליבה חד-תרבותיים, מכלולי תאי ליבה // אנדותל שמרו על המודולוס האלסטי הליניארי שלהם למשך 14 יום לפחות כאשר גודלו בתרבית בתנאי נישה כמו-הומיאוסטטיים (29°C, 3% O2) ונחשפו לזנים שאינם עולים על 2%18,21. באשר לגירוי בסיסי מכני, נראה כי המתיחה הסטטית המופעלת דרך המלחציים מחקה במידה מספקת את רמות המאמץ המקוריות שחוו יחידות הליבה של הגידים in vivo כדי למנוע תהליכים קטבוליים הקשורים בדרך כלל לפריקת מטריצה87. ואכן, את הירידה ההדרגתית והמובהקת סטטיסטית של המודולוס האלסטי הליניארי שנצפתה במכלולי תאי אנדותל // שנחשפו לזן של 6% ניתן לייחס לפריקת המטריצה הנובעת ממיקרו-נזק מטריצה המושרה מכנית.
בעת ביצוע ניסויים אלה, חשוב למנוע את התייבשות של assembloid. כאן, הם היו עטופים בנייר autoclaved ו רטוב, אבל שיטות אחרות יכול גם להיות קיימא בהתאם התאימות שלהם עם מכשיר מתיחה בשימוש. מכיוון שהחיכוך בין מהדקי המתכת לעציץ הליבה מוגבל, הוסף פיסות נייר קטנות בין המתכת לעציץ הליבה במהלך ההידוק כדי למנוע החלקה ועקוב מקרוב אחר תהליך המתיחה כדי לזהות ולהרחיק צמחי ליבה ומכלולים שהחליקו על הליבה.
ניתוח שעתוק ספציפי לתא והפרשה ספציפית לאסמבלואיד (איור 5 ואיור 6)
בקבוצה הראשונה של ניסויי ליבה חד-תרבותיים שהוצגו כאן, הוערכה יציבות ביטוי גני הליבה לאחר בידוד explant כדי לנתק את הבידוד מהשפעות הניסוי (איור 5A). אף על פי שמספרי העתקה גבוהים יותר נחוצים למסקנות מדויקות, הביטוי של Vegfa ו- Mmps גדל מאוד בצמחי ליבה מבודדים טריים תוך שעות לאחר בידוד הצמח כאשר גודלו בתרבית בתנאי נישה דמויי נגע (37 ° C, 20% O2).
ניאו-וסקולריזציה היא סימן היכר מרכזי של מחלת גידים ותיקון שיכול, בחלקו, להיות מונע על ידי תאי אנדותל המופעלים על ידי גורמים פרו-אנגיוגניים (כלומר, גורם גדילה אנדותל וסקולרי, Vegfa) המופרשים על ידי ליבת הגיד תחת היפוקסיה88. כאשר בוחנים את השלב הראשון של הדיבור הפוטנציאלי הזה (איור 5B), נמצא כי הביטוי הן של Vegfa והן של סמן ההיפוקסיה Carbonic Anhydrase 9 (Ca9) היה מובהק סטטיסטית מוגבר בצמחים חד-תרבותיים תחת מתח חמצן נמוך (3% O2) בהשוואה לצמחים חד-תרבותיים תחת מתח חמצן גבוה (20% O2). בינתיים, נראה כי מתח החמצן הנמוך לא גרם לשינויים בביטוי של סמני פיברובלסטים בגידים כגון Scleraxis (Scx) וקולגן-1 (Col1a1). יחד, תוצאות אלה מזהות תאים שושבי ליבה כתורמים סבירים לאיתות פרו-אנגיוגני בנישה היפוקסית.
לאחר מכן, ההפעלה של תאי אנדותל על ידי איתות ליבה פרו-אנגיוגני הוערכה בתרבית משותפת של אסמבלואיד תאי ליבה // אנדותל תחת מתח חמצן גבוה (20% O2) ונמוך (3% O2). למרבה המזל, ההרכב המודולרי של מכלולים מאפשר ניתוח שעתוק ספציפי לתא לאחר תרבית על-ידי הפרדה פיזית של צמח הליבה מהידרוג'ל הקולגן החיצוני (איור 6A). בצמח הליבה (איור 6D), ביטוי Vegfa אושר שוב כעולה תחת מתח חמצן נמוך, אם כי ההשפעה על סמנים היפוקסיים אחרים כגון Fgf2 הייתה פחות ברורה ודורשת מספרי שכפול גבוהים יותר למסקנות מדויקות. בנוסף, הביטוי של סמנים פרו-דלקתיים כגון Tnf-α וסמנים לפירוק מטריצה חוץ-תאית כגון Mmp3 ירד בליבה תחת מתח חמצן נמוך. בהידרוג'ל החיצוני שנזרע בתחילה עם תאי אנדותל (איור 6E), נוכחות של צמח ליבה חי (aC) הפחיתה את ביטוי Vegfa תחת מתח חמצן נמוך, אך לא תחת מתח חמצן גבוה. בנוסף, נוכחות של explant ליבה devitalized (dC) תחת מתח חמצן נמוך גם לא להפחית ביטוי vegfa . תחת מתח חמצן נמוך, ביטוי Tnf-α בהידרוג'ל החיצוני היה דומה סביב aC/dC אך גדל תחת מתח חמצן גבוה סביב צמחי ליבה חיים. ביטוי Fgf2 ירד בכל התנאים בהשוואה להידרוג'ל החיצוני עמוס תאי אנדותל שהורכב סביב צמח ליבה שעבר סטייה תחת מתח חמצן גבוה אך לרוב תחת מתח חמצן נמוך. ביטוי Mmp3 היה הגבוה ביותר סביב צמחי ליבה חיים תחת מתח חמצן גבוה והנמוך ביותר סביב צמחי ליבה סוטים תחת מתח חמצן נמוך. בסך הכל, נראה כי תאי האנדותל שעברו תרבית משותפת מגיבים הן לצמח הליבה הפעיל, המסוגל ליזום דיבור צולב והן לשינויים ברמות החמצן. ניתוח תמלול מקיף יותר יקל על הבהרת התרומות שלהם.
המודולריות של מערכת האסמבלואיד מאפשרת אינטגרציה של תאים מהונדסים גנטית המכילים גנים פלואורסצנטיים. כאן, תאי אנדותל שבודדו מעכברי Pdgfb-iCreER mG89 נזרעו לתוך תא ההידרוג'ל. תאים אלה מבטאים במשותף את תת-היחידה b (Pdgfb) של גורם גדילה הנגזר מטסיות דם של סמן תאי אנדותל לצד חלבון פלואורסצנטי ירוק משופר (EGFP), אשר גורם לתאי אנדותל המבטאים Pdgfb להיראות ירוקים תחת המיקרוסקופ (איור 6C). באמצעות שיטה זו, נוכחותם של תאי אנדותל המבטאים Pdgfb אושרה כנשמרת במשך 7 ימים בתרבית (37 מעלות צלזיוס) ונראתה בלתי תלויה במתח חמצן (20% O2 לעומת 3% O2).
כדי לנתח את ההפרשה של אסמבלואידים, מדיום התרבית המשמש בהתאמה לליבה // ללא תאים ולליבה // פיברובלסט, ליבה // מקרופאגים, או ליבה // תרבית משותפת של תאי אנדותל הוחלף במקבילו נטול הסרום שלושה ימים לפני ששאף והקפיא את הסופרנאטנט המועשר כעת בסוד (איור 6A). זמן העשרה זה הספיק כדי לזהות ציטוקינים כגון גורם גדילה אנדותל כלי דם (VEGF) עם בדיקת MSD, כפי שמוצג כאן עבור צמחי ליבה ומכלולי ליבה // פיברובלסטים שגודלו בתרבית בתנאי נישה דמויי נגעים (איור 6B).
שיקולים חשובים בעת ניתוח ההפרשות והתעתיקים של צמחי ליבה ומכלולים נוגעים לשימוש בבקרות נאותות. לצמחי ליבה טריים שבודדו יש ערך מוגבל, שכן במיוחד הביטוי שלהם של Vegfa ו-Mmps עולה מאוד תוך שעות לאחר הבידוד (איור 5A). צמחים מותאמי זמן המוקפים בהידרוג'ל נטול תאים מתאימים יותר כבקרות לביטוי הגנים של תא הליבה. עבור הידרוג'ל חיצוני, הידרוג'לים עמוסי תאים שגודלו בתרבית ללא צמח ליבה הם בקרות נחותות בהשוואה להידרוג'לים עמוסי תאים שגודלו סביב צמחי ליבה סוטים (קובץ משלים 7), בעיקר משום שהם נדחסים לצורות עגולות במקום הידרוג'לים מוארכים אשר משנים מאוד את המורפולוגיה של התא (איור 3A).
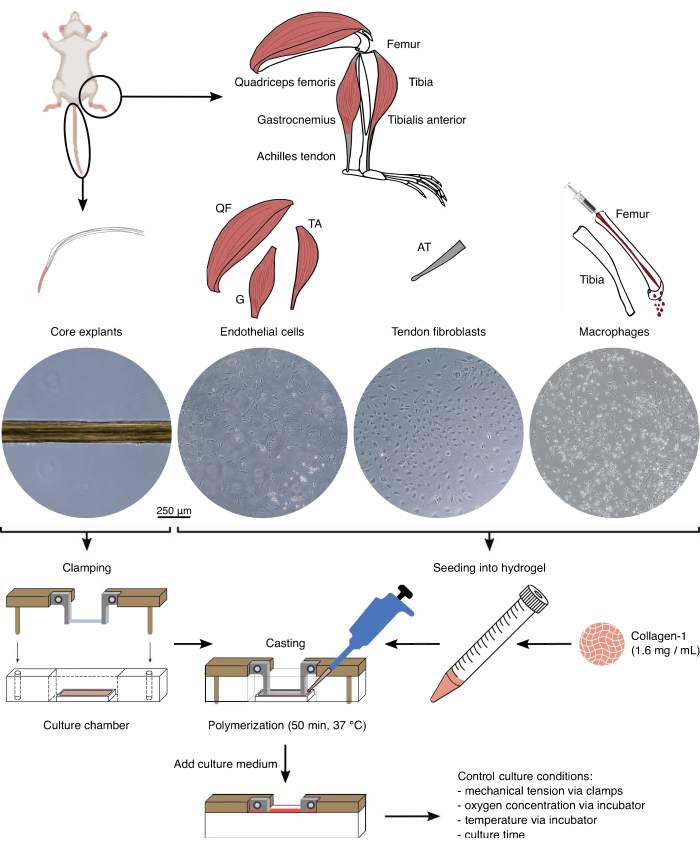
איור 1: בידוד והרכבה של רכיבי הרכבה כדי ליצור מודל in vivo crosstalk. צמחי ליבת הגידים הוצאו מזנבות עכברים, נחתכו והודקו. שרירי הרגליים של עכבר (כלומר, שרירי ארבע ראשי (QF), גסטרוקנמיוס (G) וטיביאליס קדמי (TA)) עוכלו כדי לבודד תאי אנדותל שגודלו לאחר מכן בתרבית פלסטיק של תרבית רקמה. גידי אכילס (AT) עוכלו גם הם כדי לבודד פיברובלסטים של גידים, שלאחר מכן תורבתו על פלסטיק של תרבית רקמות. מח העצם מהטיביה ועצם הירך נשטף מהעצמות. לאחר מכן, המונוציטים המבודדים גודלו בתרבית פלסטיק בתרבית רקמה והתמיינו למקרופאגים נאיביים. תמונות מיקרוסקופ האור (10x) מתארות את הופעתם של צמחי ליבה, תאי אנדותל, פיברובלסטים של גידים ומקרופאגים מיד לפני שילובם במכלולים. במהלך ההרכבה, התאים שגודלו בתרבית על פלסטיק הוכנסו לתרחיף ולאחר מכן נזרעו לתמיסת קולגן-1 (1.6 מ"ג/מ"ל). לאחר מכן, תערובת התא-הידרוג'ל נוצקה סביב צמח הליבה המהודק ופולימרית במשך 50 דקות ב -37 מעלות צלזיוס לפני הוספת מדיום תרבית. תנאי התרבית נשלטו באמצעות מלחציים (מתח מכני) והגדרות האינקובטור (ריכוז חמצן, טמפרטורה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
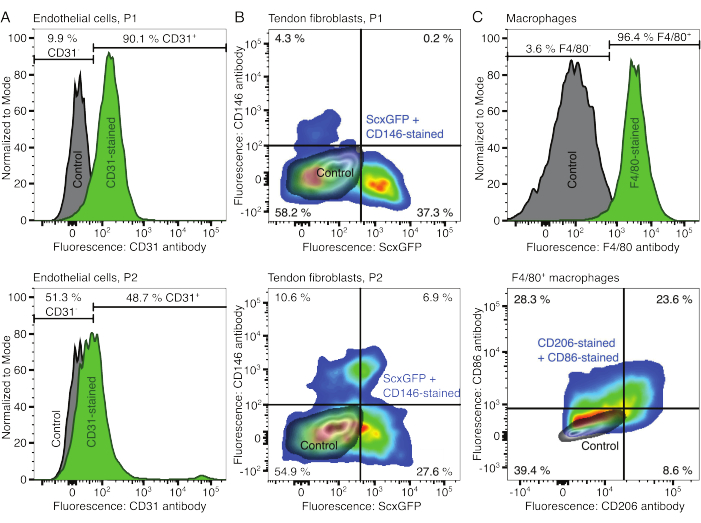
איור 2: אפיון של רכיבי אסמבלואיד תאי. (A) אנליזה ציטומטרית של זרימה מייצגת של תאי אנדותל שמקורם בשריר לאחר מעבר אחד (P1, שורה עליונה) ושני מעברים (P2, שורה תחתונה). הספירות עבור תאים לא מוכתמים (אפורים) ומוכתמים CD31 (ירוק) נורמלו למודאליים. האחוזים ניתנים עבור הקבוצה המוכתמת ב- CD31. (B) אנליזה ציטומטרית של זרימה מייצגת של פיברובלסטים שמקורם בגיד אכילס לאחר מעבר אחד (P1, שורה עליונה) ושני מעברים (P2, שורה תחתונה). הצירים מדווחים על עוצמות פלואורסצנטיות של תאים לא מוכתמים (אפורים) ותאים המבטאים ScxGFP ומוכתמים בנוגדנים CD146 (צבעי הקשת). (C) ניתוח ציטומטרי של זרימה מייצגת של מקרופאגים שמקורם במח עצם לאחר תרבית. בשורה העליונה, הספירות של תאים לא מוכתמים (אפורים) ומוכתמים F4/80 (ירוק) נורמלו למודאליים. האחוזים ניתנים עבור הקבוצה המוכתמת F4/80. הגרף בשורה התחתונה מדווח על עוצמות פלואורסצנטיות של תאים לא מוכתמים (אפור) ותת-קבוצה F4/80+ של תאים המוכתמים בנוגדני CD206 ונוגדנים CD86 (צבעי הקשת). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
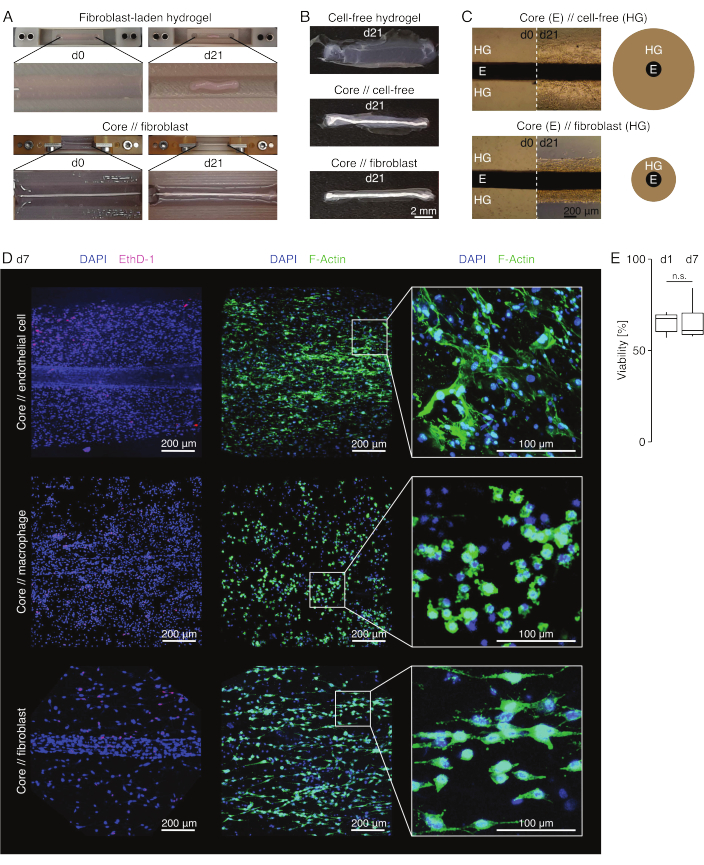
איור 3: הדמיה ומראה של אסמבלואיד. (A) תצלומים מייצגים שצולמו ביום 0 (d0) וביום 21 (d21) של תרבית (37°C, 20% O2) מראים התכווצות רב-ממדית של הידרוג'ל המכיל פיברובלסטים חיצוניים ללא אקספלנט ליבה מוטבע ודחיסה רדיאלית חזקה של הידרוג'ל המכיל פיברובלסטים חיצוניים סביב צמח ליבה. (B) תצלומים מייצגים שצולמו ביום ה-21 (d21) של תרבית (37°C, 20% O2) מראים הבדלים במהירות הדחיסה בין הידרוג'לים נטולי תאים, הידרוג'לים נטולי תאים היצוקים סביב צמח ליבה, והידרוג'לים עמוסי פיברובלסטים בגידים היצוקים סביב צמח ליבה. (C) תמונות מיקרוסקופ האור המייצגות (10x) שצולמו ביום 0 (d0) וביום 21 (d21) של תרבית (37°C, 20% O2) מצביעות על שינויים אורכיים בנוכחות אוכלוסיות תאים ועל מהירות הדחיסה של קולגן הידרוג'ל (HG) סביב צמח הליבה (E) בליבה // נטולת תאים ובליבה // תרבית משותפת של אסמבלואיד פיברובלסט. הייצוג הסכמטי מתאר את ההבדלים בדחיסת הידרוג'ל בין ליבה // אסמבלואיד נטול תאים לבין ליבה // פיברובלסט אסמבלואיד קו-תרבית. (D) תמונות מייצגות של מיקרוסקופ קונפוקלי שצולמו ביום 7 (d7) של ליבה // תא אנדותל, ליבה // מקרופאגים, וליבה // תרבית משותפת של אסמבלואיד פיברובלסט (37°C, 20% O2). תמונות בשורה השמאלית מתארות מכלולים עם גרעיני תאים מוכתמים בכחול (DAPI) ותאים מתים מוכתמים בוורוד (Ethidium homodimer-1). שתי השורות האחרות מתארות מכלולים עם גרעיני תאים מוכתמים בכחול (DAPI) וחוטי אקטין בירוק (F-actin). (E) קופסאות המתארות את הכדאיות המכומתת של מכלולי תאי ליבה // אנדותל ביום 1 (d1) וביום 7 (d7) של תרבית משותפת. N = 5. הצירים העליונים והתחתונים מתאימים לרביעון הראשון והשלישי (אחוזונים 25 ו-75) והאמצעי לחציון. השפם משתרע מהציר העליון/התחתון עד לערך הגדול ביותר/הקטן ביותר שאינו עולה על פי 1.5 מהטווח הבין-רבעוני. ערכי P: n.s.p > 0.05. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
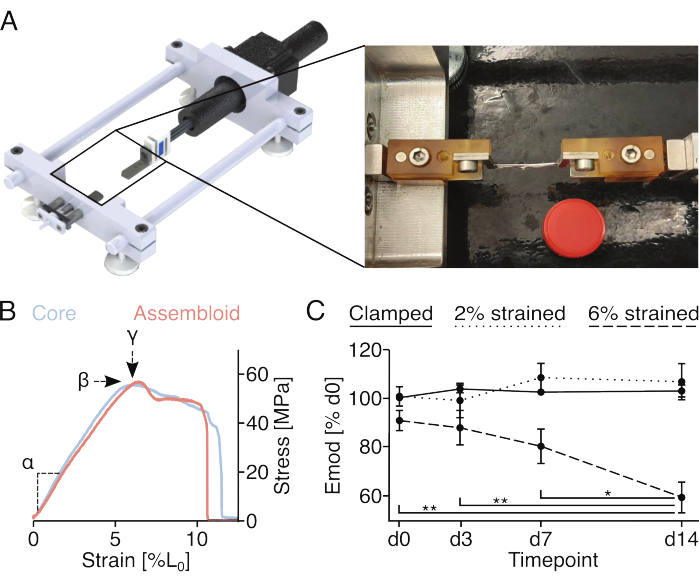
איור 4: גירוי מכני של מכלולים ומדידת תכונות מכניות של אסמבלואיד. (A) תיאור גרפי של התקן המתיחה בהתאמה אישית הכולל את פלטפורמות מחזיק המהדק, חיישן כוח ומנוע צעד. התמונה המצולמת מציגה מכלול המורכב על מכשיר המתיחה עם מלחציים. מכסה של צינור פלסטיק 15 מ"ל (Ø: 17 מ"מ) המשמש לקנה מידה. (B) גרף המתאר עקומות מתח/מאמץ מייצגות עבור צמחי ליבה (כחול בהיר) ומכלולים (אדום בהיר). ניתן לחלץ מהנתונים את המודולוס האלסטי הליניארי (α), הלחץ המרבי (β) והמאמץ המרבי (у) כדי לאפיין באופן מכני את צמח הליבה או האסמבלואיד. (C) גרף המציג את המודולוס האלסטי הליניארי (Emod) של מכלולי תאי ליבה // אנדותל שגודלו בתרבית משותפת (29°C, 3% O2) במשך מסלול זמן של 14 יום לאחר שהודקו (קו מוצק), הודקו ונמתחו לזן 2% L0 (קו מקווקו), או הודקו ונמתחו לזן 6% L0 (קו מקווקו) בתחילת הניסוי. N = 5. נקודות הנתונים נורמלו למודולוס האלסטי הליניארי הראשוני לפני המתיחה וכולן מוצגות כממוצע (±sem). ערכי P: *p < 0.05, **p < 0.01. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
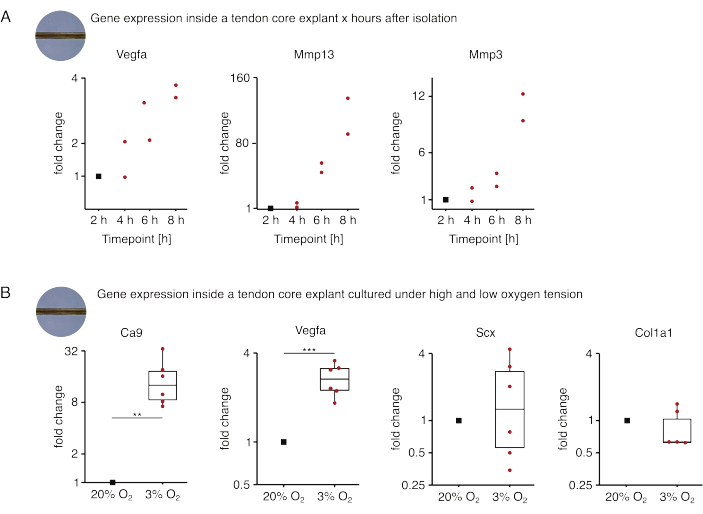
איור 5: שינויים בתעתיק הליבה לאחר בידוד ותרבות בתנאי נישה שונים. (A) תרשים פיזור המתאר את שינויי הקיפול בביטוי גנים Vegfa, Mmp13 ו-Mmp3 בצמחים חד-תרבותיים (37°C, 20% O2) של ליבת מורין פולטים 2 שעות, 4 שעות, 6 שעות ו-8 שעות לאחר בידודם מהזנב. שינויי הקיפול בנקודות הזמן המתאימות נורמלו לביטוי הגן שעתיים לאחר הבידוד. N = 2. (B) קופסאות המתארות את שינויי הקיפול בביטוי הגנים Ca9, Vegfa, Scx ו-Col1a1 בצמחי ליבה שעברו תרבית חד-תרבותית תחת מתח חמצן נמוך (3% O2) נורמלו והושוו לאלה שעברו תרבית חד-תרבותית תחת מתח חמצן גבוה (20% O2). N = 5-6. הצירים העליונים והתחתונים של הקופסאות מתאימים לרביעון הראשון והשלישי (אחוזונים 25ו-75) והאמצעי לחציון. השפם משתרע מהציר העליון/התחתון עד לערך הגדול ביותר/הקטן ביותר שאינו עולה על פי 1.5 מהטווח הבין-רבעוני. נקודות נתונים המשמשות לנורמליזציה מתוארות כנקודות שחורות ונקודות נתונים בודדות כנקודות אדומות. ערכי P: **p < 0.01, ***p < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
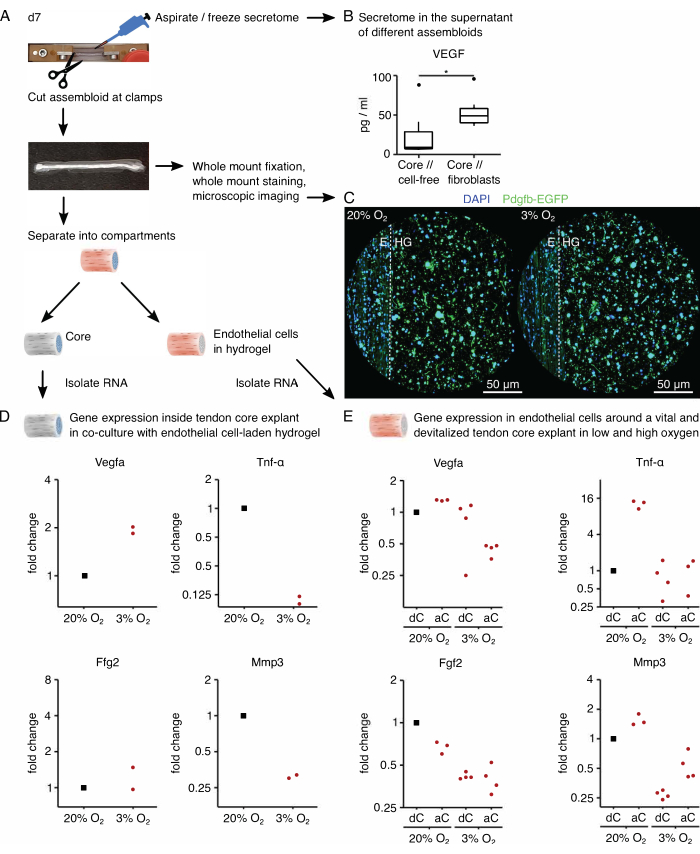
איור 6: ניתוח הפרשה ספציפית להרכבה ושעתוק ספציפי למדור. (A) תצלום מייצג המראה את האסמבלואיד ביום 7 (d7), כאשר נלקחו דגימות הפרשה ושעתוק ותיאור זרימת העבודה הבסיסית. (B) ריכוז VEGF (pg/mL) בסופרנאטנט של מכלולי ליבה // נטולי תאים וליבה // פיברובלסטים לאחר 7 ימים של תרבית משותפת (37°C, 20% O2) המתוארים כתרשימי קופסה. N = 6. (C) תמונות מייצגות במיקרוסקופ קונפוקלי של מכלולי תאי ליבה // אנדותל לאחר 7 ימים של תרבית משותפת (37°C) תחת מתח חמצן גבוה (20% O2) ומתח חמצן נמוך (3% O2). גרעיני התא מוכתמים בכחול (DAPI), ותאי האנדותל המשובצים מבטאים במשותף חלבון פלואורסצנטי ירוק משופר (EGFP) לצד תת-יחידה b (Pdgfb) של סמן תאי אנדותל. הקו המקווקו מציין את הממשק התאי בין צמח הליבה (E) לבין הידרוג'ל עמוס תאי אנדותל (HG). (D) תרשים פיזור המתאר את שינויי הקיפול בביטוי הגנים Vegfa, Tnf-α, Fgf2 ו-Mmp3 בתא הליבה ממכלולי תאי ליבה // אנדותל שגודלו בתרבית משותפת תחת מתח חמצן נמוך (3% O2) נורמלו והושוו לאלה שגודלו בתרבית תחת מתח חמצן גבוה (20% O2). N = 2. (E) תרשים פיזור המתאר את שינויי הקיפול בביטוי הגנים Vegfa, Tnf-α, Fgf2 ו-Mmp3 בתא החיצוני של מכלולי תאי ליבה // אנדותל עם ליבה חיה (aC) או ליבה מעוותת (dC) בתרבית משותפת תחת מתח חמצן גבוה (20% O2) ומתח חמצן נמוך (3% O2). שינויי הקיפול בתנאים המתאימים נורמלו לתא החיצוני של מכלול תאי ליבה // אנדותל עם ליבה סווטה (dC) בתרבית משותפת תחת מתח חמצן גבוה (20% O2). N = 3-4. ב-B, הצירים העליונים והתחתונים של הקופסאות מתאימים לרביעון הראשון והשלישי (אחוזונים 25 ו-75) והאמצעי לחציון. שפם משתרע מהציר העליון / התחתון לערך הגדול / הקטן ביותר לא יותר מ -1.5 פעמים הטווח הבין-רבעוני. חריגים מתוארים כנקודות שחורות. ערכי P: *p < 0.05. ב- D וב- E, נקודות הנתונים המשמשות לנורמליזציה מתוארות כנקודות שחורות, ונקודות נתונים בודדות מתוארות כנקודות אדומות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: דרישות קלט עבור מערכות מודל של מחלות גידים ופציעות. רשימה של גורמי מחלת גידים ראשוניים ומניעים משניים הותאמה למבחר פרמטרי קלט שהטרקטיביות שלהם היא מרכזית למידול מחלת גידים ופציעה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: דרישות פלט עבור מערכות מודל מחלות גידים ופציעות. מבחר סימני היכר של מחלת גידים הותאמו למבחר פרמטרים של פלט שהכימות שלהם הוא מרכזי לפרשנות התנהגות של מחלת גידים ומודל פגיעה. אנא לחץ כאן כדי להוריד טבלה זו.
קובץ משלים 1: קובץ .stl עבור מחזיקי המהדק, תחנת ההרכבה ותבניות התא. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: תוכנית מחזיק מהדק ימני. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: תוכנית מחזיק מהדק שמאלי. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 4: תוכנית פלטפורמת ההרכבה לחץ כאן להורדת קובץ זה.
קובץ משלים 5: תוכנית מלחציים ממתכת. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 6: תמונה המציגה התכווצות הידרוג'ל ללא תאים. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 7: תמונה המציגה גרעין חריג. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בסך הכל, למערכת מודל assembloid המוצגת כאן יש כמה צעדים קריטיים להדגיש. ראשית, מערכת המודל טובה רק כמו איכות מרכיביה. חיוני לבדוק במיקרוסקופ את צמח הליבה ואת אוכלוסיות התאים המיועדים לזרעים לפני תחילת תהליך ההרכבה. כמו כן, חשוב לאמת את הפנוטיפ של אוכלוסיות התאים המבודדות לפחות פעם אחת באמצעות ציטומטריית זרימה. במיוחד כאשר משתמשים לראשונה באצווה חדשה של קולגן-1, כדאי לבדוק את מהירות ההצלבה בריצת ניסוי לפני הטמעת תאים בתוכה. הרכבה assembloid דורש הרבה טיפול ידני, אשר מגדיל את הסיכון של זיהומים. כדי למזער את הסיכון לזיהומים, עבדו במכסה מנוע סטרילי לבטיחות ביולוגית עם זרימת אוויר למינרית, החליפו כפפות לעתים קרובות וטיהרו את הכפפות כמו גם את חלל העבודה עם 80% אתנול. מסיבות דומות, אין להשתמש במחזיקי המהדק המודפסים בתלת-ממד יותר מפעם אחת. לפני תהליך ההטבעה עצמו, חשוב לשמור את כל רכיבי ההידרוג'ל (תמיסת קרוסלינקינג, תמיסת קולגן-1) על קרח כדי למנוע קרוסלינקינג מוקדם. כתוצאה מכך, יש לעבוד במהירות ברגע שהתאים מתווספים לתמיסת הקרוסלינקינג כדי להגביל את מוות התאים בגלל ה- pH הגבוה והטמפרטורה הנמוכה של תמיסת הקרוסלינקינג. כדי למנוע מוות תאי הקשור לייבוש בצמח הליבה, יש לשאוף את התווך המכסה את צמחי הליבה המהודקים מיד לפני ערבוב תמיסת הקישור עם תמיסת הקולגן-1. כדי להבטיח את המיקום המרכזי של explant הליבה בתוך הידרוג'ל, זה אידיאלי להטיל את הידרוג'ל סביב explant ליבה מהודקת כי הוא מתוח מעט. לשם כך, השתמש בסיכת הדיבל ובבורג בורג M3 x 16 מ"מ כדי לקבע את מחזיקי המהדק ללוח (מודפס בתלת-ממד) עם חורים באורכים המתאימים. לאחר זמן פילמור של 50 דקות, ניתן להוריד שוב את המתח של צמח הליבה המשובץ בהתאם לתנאי התרבית הרצויים. למידת המתח שהאסמבלואיד חווה במהלך התרבית יש השפעה עמוקה על תוצאות הניסוי ויש לשמור עליה אחידה בין דגימות ותנאים21.
אף על פי כן, ההשפעה הגדולה של העמסה מכנית (לא) על תוצאות הניסוי היא יתרון עיקרי של מודל האסמבלואיד על פני רוב החלופות המהונדסות רקמות, במיוחד מכיוון שהרכב המטריצה המתוחזק של אקספלנט הליבה אמור גם לשחזר את דפוסי ההעמסה המורכבים in vivo ברמה התאית90. בעוד שבפועל, הודגמו עד כה רק המדידה של המודולוס האלסטי הלינארי, מתח המתיחה המרבי ולחץ המתיחה המרבי של מכלולים, פרוטוקולים למדידות חוזק עייפות והרפיית מאמץ תוארו עבור צמחי ליבה של גידים במקומות אחרים וצריכים להיות ישימים למכלולים91,92. בנוסף לדפוסי ההעמסה דמויי in vivo, המודולריות הרב-שכבתית של המכלול היא ככל הנראה היתרון הגדול ביותר שלו. הודות לתאי התרבית הנפרדים, ניתן להגדיר קבוצה נשלטת של תנאי נישה עבור כל דגימה בנפרד (כלומר, טמפרטורה, מתח חמצן, ריכוז גלוקוז, תוספים, ממריצים, מעכבים ומתיחה סטטית עם צלחת). לאחר מכן, קשיחות המטריצה והרכב המטריצות של התא החיצוני ניתנים להתאמה אישית באמצעות הרכב ההידרוג'ל ויאפשרו לדוגמה לחקור את ההשפעה של מיקרו-סביבה רקמתית חולה יותר ויותר על ידי שילוב יותר קולגן-3 ופיברונקטין תאי93,94,95. אוכלוסיות התאים המוערכות בתא החיצוני ניתנות להתאמה בקלות על ידי בחירת התאים לזרוע, אך ניתן גם לשנות אותן בליבת הגידים על ידי מינוף קווי תאים וקווי עכבר מהונדסים גנטית מבוססים (כלומר, דלדול תאי ScxLin)96. המטריצה השונה והרכב התאים של שני התאים מספקים מבנה תלת ממדי ממודר ייחודי שהוא סימן היכר נוסף של הגיד המרכזי 1,30,46.
בעת שימוש במערכת זו, חשוב לשקול את ההשלכות של המודולריות של המערכת על הפירוט של פרמטרי התוצאה. בעוד שניתן להעריך את התרבות התאים וגיוסם עבור כל תא בנפרד, התכונות המכניות, רכיבי ההפרשה ותוצרי הפירוק ניתנים כיום למדידה רק עבור המכלול השלם. לגבי התפוקה, אדם אחד שהוכשר כראוי יכול להכין עד 50 מכלולים ביום עבודה רגיל, כאשר צוואר הבקבוק העיקרי הוא הליך ההידוק (clamping). בעוד שחלק משיטות הקריאה אינן סותרות זו את זו, ניתן להעריך תכונות מכניות ולהפריש רכיבים באופן חוזר ונשנה על אותה דגימה, כמו גם על הרכב אוכלוסיית התא (ציטומטריית זרימה), שעתוק תאים (RT-qPCR, ריצוף RNA), או מטריצה והתפלגות תאים (אימונוציטוכימיה/מיקרוסקופ פלואורסצנטי) בנקודות קצה. בפרסומים קודמים נפרסו שיטות אלה כדי לאפיין באופן נרחב אינטראקציות בין-תאיות, חוצות מדור, בליבה // פיברובלסטים ובליבה // מכלולי מקרופאגים שנחשפו לנישה דמוית נגע84,85. בעבודה זו נחקרה יכולתה של מערכת מודל האסמבלואיד לחקור את יחסי הגומלין חוצי המדורות בין תאי הליבה לתאי אנדותל חיצוניים תחת גירויים מיקרו-סביבתיים שונים.
המודולריות של מערכת המודל מאפשרת חידוד עתידי של השיטה, אשר יש צורך להתגבר על המגבלות הבאות של איטרציה העיצוב הנוכחי. הניתוח הציטומטרי של הזרימה שהוצג בעבודה זו ונתוני ריצוף RNA של תא בודד שפורסמו לאחרונה גילו כי האוכלוסיות השוכנות בגידים ואוכלוסיות שמקורן בגיד אכילס הטרוגניות יותר ממה שהניחו בעבר 24,34,59,84,97. בנוסף, התנהגות הנדידה של אוכלוסיות תאים שוכני ליבה או הידרוג'ל מטשטשת את מידור האסמבלואיד במהלך התרבית. שני הגורמים יחד מאתגרים את ייחוס ההבדלים השעתוק לסוגי תאים ספציפיים ולהפריד בין תהליכי התרבות לתהליכים מבוססי הגירה. ניתן להתגבר על מגבלה זו על ידי זיקוק אוכלוסיית הקלט באמצעות מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) בהתבסס על ההרכב התאי של גידים בריאים או חולים שאופיינו במחקרי in vivo אחרונים, שיפור הקריאה על ידי יישום ריצוף RNA חד-תאי, ושילוב סמני התפשטות כגון צביעת EdU (5-ethynyl-2'-deoxyuridine) במהלך מיקרוסקופיה.
המכלולים המוצגים כאן חולקים גם חולשה עם רוב מערכות המבחנה הקיימות כיום המדמות איברים חולים המנותקים משאר הגוף98,99. עם זאת, הפלטפורמה מבוססת תא התרבות המשמשת כאן ממקמת את מערכת המודל היטב לשילוב בפלטפורמה מרובת איברים שבה מחוברים מכלולים המחקים איברים שונים וניתן לחקור אינטראקציות בין איברים.
בבסיסה, מערכת המודל מבוססת על גידי מכרסמים מיקום, מה שמביא למערכת חסרונות ייחודית משלה. ראשית, יכולת התרגום של התוצאות נפגעת על ידי עכברי בר שאינם מפתחים או סובלים ממחלות גידים 8,100,101. שילוב רקמות ותאים מבני אדם או מזני עכברים חדשים שפותחו ומציגים היבטים של מחלת גידים יכול להקל על בעיה זו102. המעבר למכלול מבוסס אדם מעניין במיוחד, שכן הוא יאפשר מחקרים עם רקמות שמקורן בחולים מגידים חולים שונים (כלומר, דלקת גידים, גידים או דלקת צפק) ואפילו תורמים עמידים לטיפול שיוכלו לפתוח תוכניות טיפול מותאמות אישית יותר. שנית, צמחי גיד זנב מורין אינם מטפלים טוב במיוחד במיקרו-נזק הנגרם כתוצאה מעומס יתר, מה שמגביל את תחולת מערכת המודל לחקר נזק חריף לגידים.
מכל הסיבות הללו, מכלולי אקספלנט // הידרוג'ל נמצאים בעמדה מעולה לחקור ביולוגיה של ליבת גידים, אינטראקציות מבנה-פונקציה של מטריצה ואינטראקציות צולבות בין אוכלוסיות תאים ספציפיות בתגובה למיקרו-נזק הנגרם על ידי נישה. תובנות שנאספו ממחקרים אלה בעלי תפוקה גבוהה למדי יכולות לתת כיוון למחקר in vivo ופיתוח טיפול.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי מענק ETH 1-005733
Materials
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
References
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved