מערכת כל-אנושית של תרביות כבד ליישומים לפיתוח תרופות
In This Article
Summary
ההתקדמות הטכנית האחרונה אפשרה ייצור בקנה מידה גדול של פלטפורמת מבחנה עבור מטבוליזם של תרופות ויישומי רעילות. מערכת כבד דו-ממדית + אנושית (TV2D+) מספקת תוצאות רלוונטיות מבחינה פיזיולוגית באמצעות שיטות תרבית דו-ממדיות מסורתיות. פרוטוקול זה יתמוך במשתמשי קצה בהגדרה, תחזוקה ויישום של המערכת.
Abstract
מציאת מודל תרבית ארוך טווח ורלוונטי לבני אדם עבור הפטוציטים אנושיים ראשוניים (PHHs) למחקרים פרמקולוגיים וטוקסיקולוגיים נותרה אתגר. פלטפורמות מודל מבחנה נוכחיות הן לעתים קרובות לא נוחות ומורכבות, חסרות יציבות פנוטיפית לאורך זמן, ואינן תומכות במספר מגרשי PHH, חסרות יכולת שחזור ניסיונית וגמישות. כאן, אנו מספקים פרוטוקול מפורט להפשרה, ציפוי ותחזוקה של מערכת כבד דו-ממדית + אנושית (TV2D+), המנצלת טכניקות וציוד סטנדרטיים של תרבית דו-ממדית (2D) תוך שמירה על תוחלת חיים ארוכה ויציבות פנוטיפית לאורך זמן המלווים בדרך כלל מערכות תלת-ממדיות (תלת-ממדיות) מורכבות יותר. התוצאות מראות התקשרות ואחוזי לוחית ב- TV2D+ כפונקציה של צפיפות הזריעה של PHH, כמו גם פונקציונליות יציבה למשך שבועיים לפחות בתרבית. מגוון של צפיפויות זריעה PHH מוערכים כדי להשיג תרבות מוצלחת לטווח ארוך. כאשר הם מבוססים כראוי, ה-PHHs ב-TV2D+ מתארגנים במושבות הפטוציטים, מבטאים סמן ספציפי לכבד ושומרים על כדאיות, שלמות אדריכלית ורמות רלוונטיות מבחינה פיזיולוגית של אלבומין ואוריאה. שילוב תכונות ייחודי זה הופך את מערכת TV2D+ למודל כבד מתאים למגוון יישומים פרמקולוגיים וטוקסיקולוגיים.
Introduction
חיזוי הבטיחות והיעילות הטיפולית הוא חלק חשוב בפיתוח תרופות פרה-קליניות. עם זאת, מודלים פרה-קליניים קונבנציונליים במבחנה של הכבד מוגבלים ביכולתם לחקות במדויק את המיקרו-סביבה התאית in vivo של הכבד ולשמור על פונקציונליות ומורפולוגיה של הפטוציטים לאורך זמן. יש צורך במודלים המספקים יכולת מטבולית יציבה במשך יותר משבוע כדי להעריך תרכובות בעלות מחזור איטי או לחקור תוצאות הקשורות לחשיפה תת-חריפה או כרונית. ניסויים בבעלי חיים In vivo נכשלים לעתים קרובות בחיזוי יעילות התרופה והסיכון בשל הבדלים בין מינים תרגומיים במנגנוני פינוי הכבד האנושיים1. מודלים דו-ממדיים (2D) של הכבד הנוכחיים במבחנה, כגון מונוקולטורה מסורתית של הפטוציטים אנושיים ראשוניים (PHH) או תרביות סנדוויץ', חסרים יציבות פנוטיפית ואריכות ימים בתרבית, מה שמוביל לאובדן תפקוד הפטו-תאי מרכזי ושלמות אדריכלית לאורך זמן2. שיטה חלופית כוללת היווצרות של ספרואידים הפטוציטים תלת-ממדיים (3D), המציעים מיקרו-סביבה רלוונטית יותר לעומת תרבית דו-ממדית. עם זאת, שיטה זו מוגבלת על ידי זמינות של חומרי גלם, בחירת PHH תורם לוט, שחזור, ואובדן כדאיות עם הגדלת גודל הספרואיד 3,4,5,6. הוצגו פלטפורמות רב-תאיות שבהן PHHs נזרעים עם תאי הזנה על לוחות בגודל קבוע ומיקרו-דפוסים. למרות שמודלים אלה עשויים לאפשר זמני תרבית ארוכים יותר, תאי הזנה לא אנושיים המשמשים בפלטפורמות אלה יכולים לשנות את תוצאות הניסויים ולהגביל את יישומם בשל תרומת רקע מולדת לסילוק תרופות ופרופילים מטבוליים 1,7. מערכת הכבד הדו-ממדית הכל-אנושית TruVivo (TV2D+) שתוארה לאחרונה ב-Weaver, et al8, פותחה כדי להתמודד עם חלק מהמגבלות של שיטות מסורתיות, תרבות משותפת ותרבות תלת-ממדית של PHHs. התאים שאינם מזינים את הכבד מפחיתים את ההבדלים בין המינים בחילוף החומרים ובייצור הפרקרינים ומספקים את התמיכה הדרושה להפטוציטים ראשוניים בצורה חזקה הניתנת לשחזור, שאינה יכולה להיות מסופקת על ידי תאי כבד מקבילים שאינם פרנכימליים מתורם יחיד עקב מגבלות בהרחבה, בפנוטיפ ובביצועים. תאי ההזנה שנבחרו היו מסוגלים להתרחב באופן עקבי לפני השימוש וחסרו את הצורך בטרנספורמציה או התמיינות. כפי שתואר על ידי Glicklis et al.4 ו- Khetani et al.5, מודלים של תרבית תלת ממדית כמו ספרואידים hepatocyte יש אתגרים עם רבייה עקב השתנות התורם ושמירה על עקביות בגודל הספרואידים, אשר משפיע על דיפוזיה תזונתיים ב spheroids גדול מ 200 מיקרומטר, המוביל לירידה בכדאיות ופונקציונליות. בדומה להיווצרות ספרואידים תלת-ממדיים, מערכת TV2D+ מסתמכת על הרכבה עצמית של PHHs; עם זאת, מושבות PHH שנוצרו מפוזרות על פני שטח הפנים של הבאר בעומק תא בודד ולא דחוסות לצבר יחיד. שיטת תרבית זו עשויה להיות שימושית כדי לטפל בשונות התורמים, ולאפשר ל-PHHs להיות מצופים, מתורבתים ולשמור על פונקציונליות בסיסית בצפיפויות זריעה שונות. מערכת TV2D+ עשויה גם להגביר את החוסן של הטיפול במשתמשים עקב אובדן במהלך מניפולציה או ציוד מיוחד הנדרש לביצוע תרבית מורחבת בכדוריות תלת-ממדיות.
מערכת TV2D+ משלבת תרבות דו-ממדית סטנדרטית עם אריכות ימים ויציבות פנוטיפית המלוות בדרך כלל מערכות תלת-ממדיות. הפרוטוקול המתואר כאן מספק הוראות שלב אחר שלב למשתמשים עם מיומנויות בסיסיות של תרביות רקמה במעבדות המצוידות בציוד סטנדרטי כגון ארונות בטיחות ביולוגית, צנטריפוגות ואינקובטורים של CO2 . כל שלב בתהליך מתואר בפירוט, כולל הכנת מדיה, הפשרה, ציפוי ותחזוקה של מערכת התרבות המתקבלת. הפרוטוקול מכיל גם שיטה לקביעת תפוקות פונקציונליות בסיסיות של הפטוציטים, אלבומין ואוריאה, כמו גם ניתוח תמונה אימונופלואורסצנטית לקביעת התקשרות PHH לנורמליזציה. כאשר הם מבוססים כראוי, ה- PHHs ב- TV2D+ מתארגנים במושבות הפטוציטים, מחקים את המורפולוגיה הטבעית של הכבד, ושומרים על כדאיות מורחבת, שלמות אדריכלית ורמות רלוונטיות פיזיולוגית של אלבומין ואוריאה למשך שבועיים לפחות8. מכיוון שהמערכת יכולה לאפשר מגוון של צפיפויות זריעה של PHH, היא עשויה להיות שימושית בהגדלת הזמינות של מגרשי PHH פחות ניתנים לציפוי בעלי מאפיינים רצויים של תורמים. שילוב זה של נגישות ופונקציונליות הופך את TV2D+ למודל כבד מתאים למגוון יישומים פרמקולוגיים וטוקסיקולוגיים.
Protocol
פרוטוקול זה תואם את הנחיות ועדת האתיקה של Lifenet Health. כתב היד אינו מכיל מחקרים עם משתתפים אנושיים או מחקרים בבעלי חיים שבוצעו על ידי מי מהמחברים. כל התאים בודדו מרקמת תורם בהסכמה מלאה למטרות מחקר על ידי Lifenet Health.
1. הכנה בינונית
- יש להפשיר בקבוק אחד בכל תא הזנה המפשיר מדיום, להשלים A, להשלים B ולהשלים C (ראה טבלת חומרים) באמבט מים בטמפרטורה של 37°C או 16-24 שעות בטמפרטורה של 4°C.
- Aliquot את כל הבקבוק (10 מ"ל) של תא מזין מפשיר בינוני לתוך 15 מ"ל או 50 מ"ל צינור חרוט.
הערה: גודל גלולת התא יהיה קל יותר לצפייה באמצעות צינור חרוטי של 15 מ"ל. - הוסף 4.5 מ"ל של תוספת B ו 11 מ"ל של תוספת A לבקבוק אחד של בינוני ציפוי (75 מ"ל) (ראה טבלת חומרים) כדי ליצור מדיום ציפוי שלם.
הערה: מדיום ציפוי מלא יש ריכוז של FBS <5% v/v. - לתוך בקבוק נפרד, להוסיף 100 מ"ל של מדיום תרבית (ראה טבלה של חומרים), 1 מ"ל תוספת C, ו 14 מ"ל תוספת A כדי ליצור מדיום תרבית שלם.
הערה: למדיום התרבית המלאה יש ריכוז של FBS <1% v/v - יש לאחסן את יתרת תוספת C ותוספת A בטמפרטורה של -20°C עד שבוע 2 להכנה בינונית.
הערה: מחזורי הקפאה-הפשרה חוזרים ונשנים יפחיתו את חיי המדף של התוספים. מומלץ להקפיא-להפשיר רק פעם אחת. - לפני השימוש, חם 10 מ"ל של מדיום הפשרת תאי הזנה, מדיום הפשרת הפטוציטים, מדיום ציפוי מלא, ומדיום תרבית שלם למשך 20-30 דקות באמבט מים של 37 מעלות צלזיוס.
2. הפשרה, ספירה וציפוי של תאי הזנה אנושיים (איור 1A)
- תרבית את תאי ההזנה כשעה לפני זריעת PHHs. הפשרת תאי הזנה (ראה טבלת חומרים) באמבט מים של 37 מעלות צלזיוס למשך 1-2 דקות.
הערה: הימנע מחשיפה ממושכת (למשל, >2 דקות) על ידי ניטור הפשרה והסרת הבקבוקון כאשר נוזל הופך רופף בהקפאה כאשר הוא הפוך. - מיד לאחר ההפשרה, מניחים את תאי ההזנה על קרח.
- באמצעות טכניקות אספטיות, בארון בטיחות ביולוגית (BSC), להוסיף תאים מופשרים טריים 10 מ"ל של מדיום הפשרת תאי הזנה.
- השתמש פיפטה 1000 μL כדי לשטוף את הבקבוקון פעם אחת עם 1 מ"ל של התא / להפשיר בינוני השעיה ולאסוף.
- סבבו במהירות של 400 x גרם במשך 4 דקות בטמפרטורת החדר (RT).
- בזהירות להשליך את supernatant כדי לא להפריע את כדור התא על ידי pipetting או שאיפת ואקום. גלולת תא השעיה מחדש ב 1 מ"ל של מדיום ציפוי מלא ולספור את תאי ההזנה.
הערה: ניתן לספור תאי הזנה באמצעות תפוז אקרידין ופרופידיום יודיד (AOPI) על מונה תאים אוטומטי או כחול טריפאן באמצעות המאציטומטר. ספירת התאים עשויה להשתנות בהתאם לטכנולוגיה ולמשתמש. לקבלת התוצאות הטובות ביותר, ספור דגימות כפולות והישאר עקבי במתודולוגיה שנבחרה. - דללו את תרחיף התא ל-100,000 תאים/מ"ל באמצעות אמצעי הציפוי המלא.
- צלחת 500 μL (50,000 תאים) לכל באר של תרחיף התא המדולל על צלחת מצופה קולגן 24 בארות (ראה טבלת חומרים).
- נערו את הלוח בתנועה צפון (N)-דרום (S)-מזרח (E)-מערב (W) על ידי שימוש בתנועה קדימה ואחורה בכיוון N-S פעמיים ואחריה אותה תנועה E-W. חזור על פרוטוקול ניעור זה 2 פעמים נוספות במשך 3 סיבובים בסך הכל.
הערה: יש לבצע טלטול בכוח מתון כדי למנוע התזה על מכסה הצלחת ועדיין לסייע בפיזור התאים (עיין בסרטון). - יש לדגור ב-37°C/5% CO2 למשך 60 דקות.
- הצג את הקובץ המצורף לתא מזין לפני שתמשיך להפשיר הפטוציטים.
הערה: קובץ מצורף מקובל לתא מזין הוא חזותית בערך 50% חופפים.
3. הפשרה, ספירה וציפוי של הפטוציטים אנושיים ראשוניים (איור 1B)
- לאחר 30 דקות של תרבית תאי הזנה, סנן מדיום הפשרת הפטוציטים שחומם מראש דרך יחידת מסנן פוליאתרסולפון (PES) 0.2 מיקרומטר.
- הפשירו PHH באמבט מים בטמפרטורה של 37°C למשך 1-2 דקות.
הערה: הימנע מחשיפה ממושכת (למשל, >2 דקות) על ידי ניטור הפשרה והסרת הבקבוקון כאשר נוזל הופך רופף בהקפאה כאשר הוא הפוך. - מיד לאחר ההפשרה, מניחים PHHs על קרח.
- ב BSC, יוצקים תרחיף PHH לתוך מדיום הפשרת הפטוציטים.
הערה: הימנע מתרחיפים של תאי PHH במידת האפשר. זה קריטי ביותר לא לבצע pipetting במהלך העברת PHHs מופשר מן cryovial אל המדיום הפשרה. - השתמש פיפטה 1000 μL כדי לשטוף את הבקבוקון 3-4 פעמים על ידי pipeting בעדינות 1 מ"ל של hepatocyte/להפשיר בינוני תרחיף בחזרה לתוך הבקבוקון ואיסוף הכביסה על ידי מזיגת אותו בחזרה לתוך המדיום להפשרה.
- מכסים והופכים בעדינות את מתלה ה-PHH המופשר 5 פעמים.
- סובב ב- 100 x גרם במשך 8 דקות ב- RT.
- בזהירות להשליך את supernatant כדי לא להפריע את כדור התא על ידי pipetting או שאיפת ואקום. לקיר הצינור החרוטי, הוסף 3 מ"ל של מדיום ציפוי מלא.
- נענע את הצינור החרוטי מצד לצד כדי להשהות מחדש את גלולת התא.
- הוסף 5 מ"ל נוספים של מדיום ציפוי מלא להפטוציטים המושעה.
- לספור PHHs.
הערה: ניתן לספור PHHs באמצעות AOPI על מונה תאים אוטומטי או כחול טריפאן באמצעות hemacytometer. ספירת התאים עשויה להשתנות בהתאם לטכנולוגיה ולמשתמש. לקבלת התוצאות הטובות ביותר, ספור דגימות כפולות והישאר עקבי במתודולוגיה שנבחרה. - לדלל את תרחיף התא לצפיפות הזריעה הרצויה (300,000-600,000 PHHs/mL) באמצעות אמצעי הציפוי המלא.
הערה: צפיפות זריעת הפטוציטים אופטימלית עשויה להשתנות ממגרש למגרש. צפיפות הזריעה המומלצת למגרש נתון תינתן בתעודת הניתוח (COA). השתמש במשוואה הבאה כדי לקבוע hepatocytes/mL עבור צלחת 24 באר.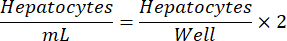
- מתאי ההזנה המצופים, הסר את המדיום על ידי פיפטינג או שאיפת ואקום.
הערה: כדי להבטיח את הכדאיות של תאי ההזנה, מומלץ לשנות לא יותר מ -3 בארות בכל פעם. - יש למרוח מיד 500 μL (150,000-300,000 תאים) לכל באר של תרחיף הפטוציטים המדולל על צלחת קולגן 24 בארות מצופה מראש המכילה תאי הזנה.
- נערו את הצלחת בתנועת N-S-E-W על ידי שימוש בתנועה קדימה ואחורה בכיוון N-S פעמיים ואחריה אותה תנועה E-W. חזור על פרוטוקול ניעור זה 2 פעמים נוספות במשך 3 סיבובים בסך הכל.
הערה: יש לבצע ניעור בכוח מתון כדי למנוע התזה על מכסה הצלחת ועדיין לסייע בפיזור התא. - יש לדגור ב-37°C/5% CO2 למשך 2-4 שעות. במשך 60 הדקות הראשונות של התרבית, נערו את הצלחת כל 15 דקות בתנועת N-S-E-W כמו בשלב 3.15 לעיל.
- לאחר הדגירה מוציאים את הצלחת מהאינקובטור ומניחים אותה ב-BSC.
- נערו את הצלחת והסירו את מצע הציפוי המלא על ידי פיפטינג או שאיפת ואקום.
הערה: כדי להבטיח את הכדאיות של התרבית, מומלץ לשנות לא יותר מ 3 בארות בכל פעם. - הוסיפו מיד 500 מיקרוליטר של מדיום תרבית שלם שחומם מראש לכל באר.
4. תחזוקה
- Aliquot ו מראש חם מדיום תרבית מלאה באמבט מים 37 ° C במשך 20-30 דקות. כ 13.5 מ"ל של בינוני נדרש עבור צלחת אחת 24 באר.
- להאכיל תרביות מדי יום עם 500 μL לכל באר של מדיום תרבית מלאה טרייה שחוממה מראש.
הערה: כדי להבטיח את הכדאיות של התרבית, מומלץ לשנות לא יותר מ 3 בארות בכל פעם. - הכינו מדיום תרבית מלא טרי כל 7 ימים.
5. איסוף דגימות תרבית למדידת אלבומין ואוריאה
- בימים 7, 10 ו-14, אספו 500 מיקרוליטר של תווך מבאר(ות) הדגימה הרצויה לתוך שפופרת מיקרוצנטריפוגה, כפי שמוצג באיור 1C.
- סובבו את הדגימות/ות במהירות של 320 x גרם במשך 10 דקות ב-4°C לפסולת כדורית.
- השתמש פיפטה כדי להעביר supernatant(s) דגימה לתוך צינור(ים) microcentrifuge חדש (ים), למנוע הפרעה של הכדור.
- הפעל את הדגימות בבדיקת אלבומין ו / או אוריאה (ראה סעיפים 10 ו -11, בהתאמה).
הערה: ניתן לאחסן דגימות בטמפרטורה של -20°C עד -80°C למשך שבועיים.
6. יום מכתים I
זהירות: מאגר הקיבוע מכיל Paraformaldehyde. פרפורמלדהיד עלול לגרום לנזק לעיניים, לגירוי בעור ולהרעלת איברים. עבוד באזור עם אוורור טוב ולבש ציוד הגנה אישי מתאים (PPE).
- לאחר איסוף דגימות בינוניות ביום ה-14, הוסיפו 300 מיקרוליטר של חיץ קיבוע (ראו טבלת חומרים) לכל באר כדי להיות מוכתמים, כפי שמוצג באיור 1C. מכתימים מינימום 2 בארות.
- יש לדגור בטמפרטורה של 4°C למשך 20-60 דקות.
- הכן מאגר חדירה 1x (ראה טבלת חומרים) על-ידי הוספת 5 מ"ל של תמיסת מלאי 10x ל- 45 מ"ל של PBS 1x (ראה טבלת חומרים).
הערה: ניתן לאחסן את מאגר החדירות 1x בטמפרטורה של 4° צלזיוס למשך חודש אחד. - יש לשטוף פעמיים עם 300 μL של חיץ חדירה 1x על קרח.
- הוסף 300 μL של נוגדן ראשוני cytokeratin 18 (ראה טבלה של חומרים) באמצעות דילול 1:1000 ב 1x permeabilization buffer על קרח.
הערה: באופן מינימלי, יש לדגור על באר אחת עם חיץ חדירה אחד בלבד לבקרה משנית של נוגדנים בלבד. - לדגור 16-24 שעות ב 4 ° C.
7. יום מכתים II
- למחרת, להסיר את הנוגדן הראשוני על ידי pipetting או שאיפת ואקום.
- יש לשטוף פעמיים עם 300 מיקרוליטר לכל באר של חיץ חדירה אחד על קרח.
- הוסף 300 μL של נוגדן משני פלואורסצנטי (ראה טבלת חומרים) באמצעות דילול 1:500 במאגר חדירות 1x (כולל בקרה שניונית בלבד).
הערה: יש להימנע מאור בעת שימוש בנוגדנים פלואורסצנטיים. - יש לדגור במשך 30-45 דקות ב-4°C צלזיוס בחושך.
- הסר את הנוגדן המשני על ידי pipetting או שאיפת ואקום.
- יש לשטוף פעמיים עם 300 מיקרוליטר לכל באר של חיץ חדירה אחד על קרח.
- יש לשטוף פעם אחת עם 300 מיקרוליטר לבאר של 1x PBS.
- הוסף 150 μL של מדיום הרכבה 4′,6-diamidino-2-phenylindole (DAPI) (ראה טבלת חומרים) לכל באר ודגור במשך 15 דקות ב- RT בחושך.
הערה: ניתן לעטוף את הצלחת בפרפילם ולאחסן בטמפרטורה של 4°C בחושך למשך שבוע. - מבט תחת מיקרוסקופ פלואורסצנטי. צלם 5 תמונות של כל ערוץ פלואורסצנטי ספציפי עבור כל באר באמצעות עדשה אובייקטיבית 10x (ודא שלתמונה אחת יש סרגל קנה מידה).
הערה: DAPI יש עירור/פליטה של 358 ננומטר/461 ננומטר. השתמש במיקרוסקופ פלואורסצנטי המצויד במסנני הזיהוי המתאימים הן עבור DAPI והן עבור פלואורופור הנוגדנים המשני.
8. ניתוח ImageJ (איור 2)
הערה: מומלץ להשתמש ב-ImageJ גרסה 1.52a ואילך.
- פתחו תמונה הכוללת סרגל קנה מידה ב-ImageJ. לחץ על סמל הקו הישר וצייר קו לאורך המדויק של סרגל קנה המידה [איור 2 (1)]
הערה: במידת הצורך, לחץ על סמל זכוכית מגדלת כדי להגדיל או להקטין את התצוגה. - לחץ על הכרטיסייה נתח . סמנו ולחצו על 'קבע קנה מידה'.
- שנה את המרחק הידוע למרחק של סרגל קנה המידה. שנה יחידות אורך ליחידות סרגל קנה המידה. החל את ההגדרות באופן גלובלי על-ידי סימון כללי. לחץ על אישור כדי להגדיר את קנה המידה.
הערה: לאחר החלת הגדרה זו, כל תמונה שתיפתח תציג את האזור המחושב של שדה הראייה ביחידות שהזין המשתמש. - פתח תמונה של DAPI בלבד ב- ImageJ. לחץ על הכרטיסייה תהליך וסמן את החסר רקע. הסר את 50 הפיקסלים הרקע בכל פעם עד שהאזורים שאינם מוכתמים יהיו שחורים.
הערה: אם התמונה אינה מכילה רקע, שלב זה אינו נדרש. - לחץ על הכרטיסיה תמונה וסמן סוג. לחץ על 8 סיביות כדי ליצור את התמונה בגווני אפור [איור 2 (2)].
- סף את התמונה באופן ידני או אוטומטי כדי לכלול את כל חלקיקי DAPI (היזהר שלא לעבור את הסף) באופן ידני [איור 2 (3)]. לחץ על הכרטיסיה תמונה וסמן את התאמה. לחץ על סף. לחץ על החל בסיום.
- לחץ על הכרטיסיה תהליך וסמן בינארי. לחץ על פרשת המים.
- לחץ על הכרטיסיה נתח וסמן /לחץ על נתח חלקיקים [איור 2 (4)]. הגדר את הגודל ל - 5-אינסוף ואת המעגליות ל - 0.00-1.00. בכרטיסיה הנפתחת הצג , בחר חלוקה לרמות. ודא שתוצאות התצוגה, סיכום וכלול חורים מסומנים. לחץ על אישור.
הערה: ניתן לכוונן את טווח החלקיקים הרצוי אם הסף מניב פיקסלים ברקע. - רשום את תוצאת הספירה כ- TOTAL DAPI.
- פתח תמונת Cytokeratin 18/DAPI ממוזגת ב- ImageJ.
- השתמש בסמל Multi-Point [איור 2 (5)] כדי לספור ידנית את כל חלקיקי DAPI שאינם מוכתמים עבור Cytokeratin 18.
- רשום את התוצאה כתאי הזנה. השתמש במשוואה הבאה כדי לקבוע DAPI של הפטוציטים.
הפטוציטים DAPI = סה"כ DAPI - תא מזין DAPI
9. כימות סך כל הפטוציטים המחוברים ואחוז ההתקשרות (לוחית)
- צור גורם קנה מידה עבור אזור התרבות של 24 בארות באמצעות המשוואה שלהלן. ניתן למצוא מדידות שדה ראייה בחלק העליון של כל תמונה שנפתחה [איור 2 (2), תיבה ירוקה].
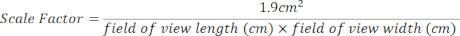
- חשב את סך כל הפטוציטים המצורפים באמצעות המשוואה להלן.
הפטוציטים מצורפים = גורם קנה מידה × הפטוציטים DAPI - חשב את אחוז ההתקשרות של הפטוציטים באמצעות המשוואה שלהלן.
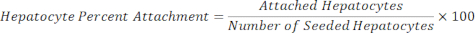
10. בדיקת אלבומין
- מדוד את ייצור האלבומין באמצעות בדיקת אימונוסורבנט מקושרת אנזים סנדוויץ' (ELISA) (ראה טבלת חומרים) על דגימות מדוללות בשעה 1:200.
הערה: לקבלת דיוק, המשתמש מאשר שהדגימות נמצאות בטווח הליניארי של העקומה הסטנדרטית. הערכה שצוינה מספקת את כל החומרים וההוראות לביצוע הבדיקה. - נרמל ריכוזי דגימה להפטוציטים מחוברים באמצעות המשוואה להלן.
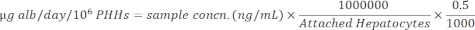
11. בדיקת אוריאה
אזהרה: מגיב חומצה חנקן אוריאה בדם (BUN) מכיל חומצה גופרתית. ריכוז החומצה הגופרתית בריאגנט חומצה BUN נחשב קורוזיבי. אין לבלוע. עבודה באזור עם אוורור טוב ללבוש PPE מתאים.
- סינתזת אוריאה נמדדת בשיטת דיאצטיל מונוקסימה שונה (ראה טבלת חומרים).
- לדלל 53.3 μL של 75 מ"ג / ד"ל אוריאה לתוך 346.7 μL של מדיום תרבית שלמה כדי להפוך תקן #1 (100 מיקרוגרם / מ"ל)
- תייג שפופרות 2-8 והשתמש בדילול טורי ביחס של 1:2 כדי לבצע את תקני בדיקת האוראה (טבלה 1).
- הוסף 10 μL של דגימה או תקן לבארות של לוח תחתון שחור ושקוף 96 בארות (ראה טבלת חומרים).
- הוסף 150 μL של מגיב BUN לכל באר המכילה דגימה. הכינו מגיב BUN על ידי ערבוב 1/3 מגיב צבע BUN עם 2/3 מגיב חומצה BUN. השתמש במשוואה הבאה כדי לסייע בחישובים.
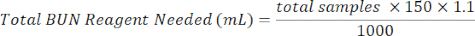
מגיב צבע BUN (מ"ל) = סך מגיב BUN הדרוש × 0.333
מגיב חומצה BUN (מ"ל) = סך מגיב BUN הדרוש × 0.667 - דוגרים צלחת במשך 90 דקות בתנור או אינקובטור ב 60 מעלות צלזיוס.
- יש לקרוא את ספיגת הצלחת באופן מיידי ב-540 ננומטר וב-650 ננומטר.
- צור עקומה סטנדרטית על-ידי הפחתת ספיגה ריקה ורקע (650 ננומטר) מכל הדגימות והתקנים. צור קו המתאים ביותר על ידי ניתוח רגרסיה ליניארית.
- קביעת ריכוז דגימה לא ידוע מהעקומה הסטנדרטית.
- נרמל את ריכוזי הדגימה להפטוציטים מחוברים באמצעות המשוואה להלן.
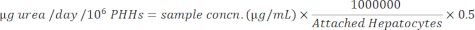
Representative Results
השיטה הכוללת של ציפוי, תרבית ובדיקת פונקציונליות בסיסית של מערכת תרביות הכבד כוללת טכניקות וניתוח נפוצים של תרביות תאים ראשוניות, כפי שמודגם באיור 1. חיבור הפטוציטים ואחוזי הצלחת חושבו ביום ה-14 באמצעות ניתוח ImageJ של לפחות חמש תמונות של צביעת ציטוקרטין 18 ו-DAPI לכל באר (איור 2). תמונות מייצגות של PHHs בתרבית עם תאי הזנה מוצגות באיור 3. צפיפויות הזריעה השונות בכבד הראו הבדלים חזותיים של מפגש בהתבסס על צפיפות הזריעה ושמרו על מורפולוגיה כבדית קובואידית טיפוסית במשך 14 ימי תרבית. תמונות של מגרשים A ו-B של תורמי כבד צולמו עבור כל צפיפות זריעה שנבדקה (איור 4A). אחוז הצלחתיות הממוצע של תורם B (89.04% ± 3.99%, 198,552 ± 49,885 PHHs) היה גבוה יותר מתורם A (66.08% ± 6.67%, 146,128 ±-33,063 PHHs) בכל צפיפויות הזריעה שנעשה בהן שימוש (איור 4B). לתורם א' הייתה אחוזי צלחות גבוהים משמעותית באמצעות 150,000 PHHs/באר (76.07% ±-12.87%) בהשוואה ל-250,000-300,000 PHHs לבאר (62.75% ±-9.64%). תורם B לא הראה הבדלים משמעותיים באחוזי הצלחת של הפטוציטים. תורם B היה בעל צלחות הפטוציטים הנמוכה ביותר (85.78% ± 13.25%) בצפיפות הזריעה הגבוהה ביותר, 300,000 PHHs / באר. בדומה לתורם א', זריעת תורם B ב-150,000 PHHs/באר הייתה בעלת אחוזי הצלחת הגבוהים ביותר של הפטוציטים (94.75% ±-15.07%).
ייצור אלבומין וסינתזה של אוריאה נמדדו בשלוש נקודות זמן במהלך תקופת התרבית בת 14 הימים ונורמלו להפטוציטים מחוברים מחושבים. בסך הכל, תורם A הגדיל את ייצור האלבומין בהשוואה לתורם B (41.32 ± 4.58 מיקרוגרם alb/day/106 PHHs לעומת 34.66 ± 10.03 מיקרוגרם alb/day/106 PHHs) (איור 5). לתורמים A ו-B הייתה תפוקת האלבומין הגבוהה ביותר בזריעת הפטוציטים ב-150,000 PHHs/well, 45.91 ± 5.96 מיקרוגרם alb/day/106 PHHs ו-48.67 ± 20.44 מיקרוגרם alb/day/106 PHHs, בהתאמה. לא נצפו הבדלים משמעותיים בייצור אלבומין בצפיפות הזריעה בה נעשה שימוש. כפי שצוין על ידי Baudy et al.3, רצוי כי מערכות מיקרופיזיולוגיות בכבד לשמור על ייצור אלבומין עקבי סינתזת אוריאה עם פחות מ 50% שינוי במשך 14 ימים של תרבית. מקדם השונות (CV) חושב על ידי חלוקת הממוצע בסטיית התקן לימים 7, 10 ו-14. כל הדגימות הופעלו בכפילויות. קורות החיים של תפוקת אלבומין במהלך 14 ימי תרבית של 150,000 PHHs לבאר היו 12.24% עבור תורם A ו- 37.97% עבור תורם B, פחות מהקריטריון הרצוי של 50%. שונות גבוהה בייצור אלבומין נצפתה הן בתורם א' והן בתורם ב' כאשר זרעו 250,000 ו-300,000 PHH/באר. בצפיפות זריעה זו, שני התורמים חווים ירידה תלולה בייצור אלבומין בין הימים 7, 10 ו-14 של תרבית (תורם CV א', 22.49%, ותורם ב', 45.07%).
סינתזת אוריאה של תורם B (95.09 ± 18.91 מיקרוגרם אוריאה ליום/106) הוגדלה בהשוואה לתורם A (64.92 ± 4.66 מיקרוגרם אוריאה ליום/106 PHHs) בממוצע ימים 7, 10 ו-14 PHH נתונים ספציפיים (איור 6). תורם B (113.49 ± 37.34 מיקרוגרם אוריאה ליום/106 PHHs) ותורם A (69.12 ± 17.06 מיקרוגרם אוריאה ליום/106 PHHs) היו בעלי סינתזת האוריאה הגדולה ביותר במהלך תקופת תרבית של 14 יום בצפיפות של 150,000 PHHs / באר ו -200,000 PHHs / באר, בהתאמה. שני המגרשים התורמים היו בעלי תפוקת האוראה הנמוכה ביותר וקורות החיים הגבוהים ביותר של 300,000 PHHs / באר. לא נצפו הבדלים משמעותיים בסינתזת אוריאה בצפיפות הזריעה בה נעשה שימוש. קורות החיים הנמוכים ביותר עבור סינתזת אוריאה עבור תורם A נצפו בתרבית של 250,000 PPHs / באר (23.11%) ו -200,000 PHHs / באר עבור תורם B (28.26%). כפי שמודגש על ידי תוצאות אלה, צפיפות זריעה אופטימלית עבור הרבה נתון של PHH תלויה ברמת המפגש הרצויה בזמן הבדיקה ואת אופי התוצאות הנמדדות; צפיפות זריעה גבוהה יותר לא תמיד מתואמת עם אות גבוה יותר או טווח דינמי גבוה יותר.
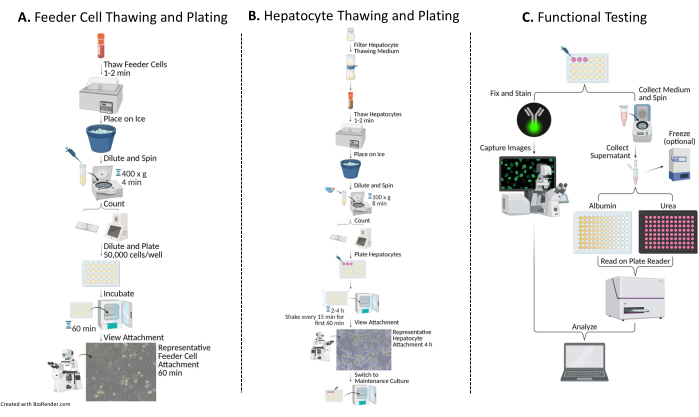
איור 1: תרשים זרימה של ציפוי, תרבית ובדיקה תפקודית של הפטוציטים עם תאי הזנה. (A) תאי הזנה מופשרים בתווך הפשרה מסוים (ראו טבלת חומרים), מרחפים מחדש באמצעי ציפוי שלם (ראו טבלת חומרים), והתאים נספרים. התאים מדוללים, מצופים ומודגרים במשך 60 דקות בטמפרטורה של 37°C/5% CO2. (B) הפטוציטים מופשרים בתווך הפשרה מסוים (ראו טבלת חומרים), מרחפים מחדש בתווך ציפוי שלם, והתאים נספרים. הפטוציטים מדוללים ומצופים בתאי הזנה. התאים מודגרים במשך 2-4 שעות בטמפרטורה של 37°C/5% CO2, ורועדים בתנועת N-S-E-W כל 15 דקות במשך 60 הדקות הראשונות של התרבית. מדיום הציפוי מוחלף במדיום תרבית שלם שחומם מראש לתחזוקת התרבות (ראה טבלת חומרים). התרבויות מוזנות מדי יום. (C) בימים 7, 10 ו-14 נאספות דגימות בינוניות לבדיקת אלבומין ואוריאה. לאחר איסוף הדגימות ביום ה-14, התאים קבועים ומוכתמים בנוגדן ציטוקרטין 18 (ראה טבלת חומרים) 16-24 שעות ב-4 מעלות צלזיוס. יתר על כן, הם מודגרים בנוגדן משני מתאים, נשטפים ומותקנים עם DAPI (ראה טבלת חומרים) ללכידה וניתוח תמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: ניתוח תמונות באמצעות תוכנת ImageJ. עיבוד ImageJ של תמונות שצולמו. שלב 1: קנה מידה מוחל על כל התמונות בהתבסס על סרגל קנה המידה הספציפי למיקרוסקופ. שלב 2: סוג התמונה משתנה. שלב 3: מגבלת סף מוחלת על חלקיקי DAPI נבחרים. שלב 4: ניתוח חלקיקים מבוצע, והספירה נרשמת. שלב 5: כדי לקבוע את מספר תאי ההזנה המחוברים, תמונה ממוזגת נספרת באמצעות הכלי הרב-נקודתי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
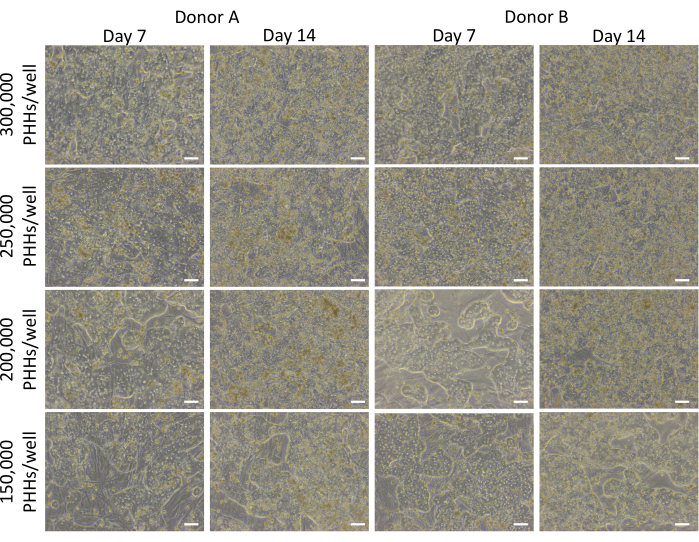
איור 3: מורפולוגיה של צפיפויות שונות של זריעת כבד בתרבית עם תאי הזנה. תמונות מייצגות בימים 7 ו-14 של PHHs בתרבית עם תאי הזנה (50,000 תאים / באר) בצפיפות זריעה בכבד של 150,000, 200,000, 250,000 ו- 300,000 PHHs/בארות. התמונות צולמו באמצעות עדשה אובייקטיבית 10x במיקרוסקופ ניגודיות פאזה הפוכה. סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
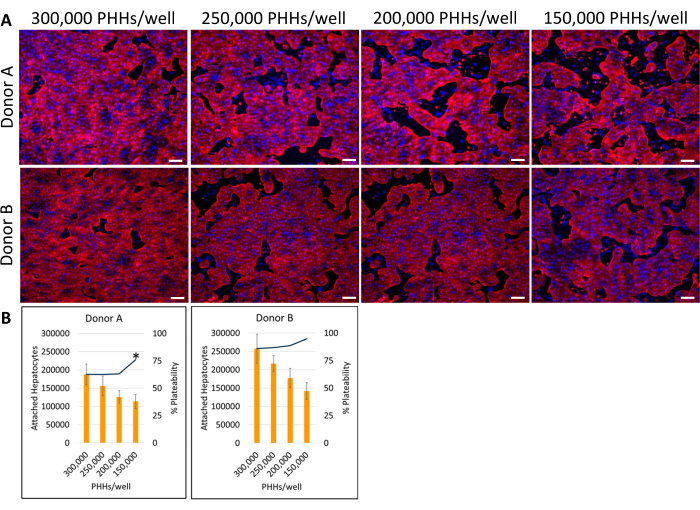
איור 4: אימונוציטוכימיה פלואורסצנטית של צפיפויות זריעה שונות בכבד בתרבית עם תאי הזנה. (A) תמונות מייצגות של צביעת ציטוקרטין 18 (אדום) ביום ה-14 בצפיפות זריעה בכבד של 150,000, 200,000, 250,000 ו-300,000 PHHs/בארות. שתי בארות לכל צפיפות זריעה נקבעו למשך 30 דקות ב -4 מעלות צלזיוס. בארות הודגרו 16-24 שעות ב 4 מעלות צלזיוס עם נוגדן ראשוני ב 1:1000. נוגדן משני שימש בשעה 1:500 למשך 30 דקות ב 4 מעלות צלזיוס בחושך. DAPI (כחול) כתם גרעיני נוסף לבארות במשך 15 דקות בטמפרטורת החדר. התמונות צולמו באמצעות עדשה אובייקטיבית 10X במיקרוסקופ פלואורסצנטי הפוך. סרגל קנה מידה = 100 מיקרומטר. (B) הפטוציטים מחוברים מחושבים ואחוזי הצלחתיות של צפיפויות זריעה שונות בכבד שחושבו באמצעות ImageJ. *p ≤ 0.05, לאחוזי צלחת עבור 200,000, 250,000 ו-300,000 PHH/באר. קווי שגיאה מייצגים סטיית תקן (n ≥ 5 תמונות לכל תנאי). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
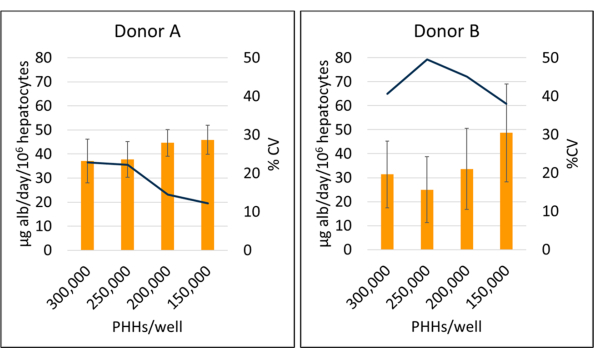
איור 5: ייצור אלבומין של הפטוציטים בתרבית עם תאי הזנה. הפקת אלבומין מצפיפויות זריעה בכבד ב 150,000, 200,000, 250,000, ו 300,000 PHHs / באר. עמודות מייצגות את הממוצע של 14 יום של מיקרוגרם אלבומין ליום מנורמל לסך כל הפטוציטים המחוברים. שורה מייצגת קורות חיים בין הימים 7, 10 ו-14. קווי שגיאה מייצגים סטיית תקן (n ≥ 2 בארות לכל תנאי עם עותקים משוכפלים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
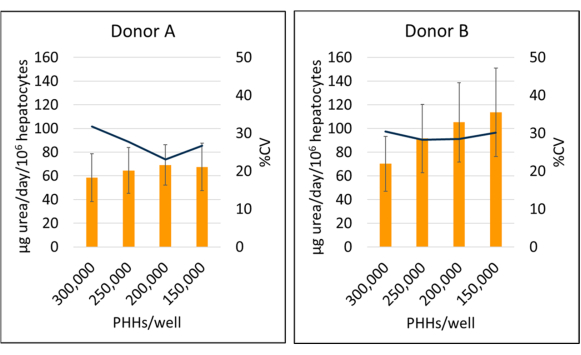
איור 6: סינתזת אוריאה של הפטוציטים בתרבית עם תאי הזנה. סינתזת אוריאה מצפיפויות זריעה בכבד ב 150,000, 200,000, 250,000, ו 300,000 PHHs / באר. עמודות מייצגות ממוצע של 14 יום של אוריאה מיקרוגרם ליום מנורמל לסך כל הפטוציטים המחוברים. שורה מייצגת % CV בין הימים 7, 10 ו-14. קווי שגיאה מייצגים סטיית תקן (n ≥ 2 בארות לכל תנאי עם עותקים משוכפלים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| סטנדרט (S) # | ריכוז (מק"ג/מ"ל) | תמיסת אוריאה (μL) | תרבות שלמה (μL) |
| 1 | 100 | 53.3 75 מ"ג/ד"ל מלאי | 346.7 |
| 2 | 50 | 100 (פתרון S1) | 100 |
| 3 | 25 | 100 (פתרון S2) | 100 |
| 4 | 12.5 | 100 (פתרון S3) | 100 |
| 5 | 6.26 | 100 (פתרון S4) | 100 |
| 6 | 3.125 | 100 (פתרון S5) | 100 |
| 7 | 1.5625 | 100 (פתרון S6) | 100 |
| ריק | 0 | 0 | 100 |
טבלה 1: הכנת מדגם סטנדרטי של אוריאה. באמצעות 75 מ"ג / ד"ל ציר אוריאה, להכין תמיסת אוריאה 100 מיקרוגרם / מ"ל. Aliquot את הנפחים המוצעים כדי להגיע לריכוז הסופי עבור העקומה הסטנדרטית.
Discussion
מערכת תרבית הכבד המתוארת ניתן להקים במעבדות המצוידות במכשור תרבית רקמות סטנדרטי. המערכת, המורכבת מתאי PHH המתורבתים עם תאי הזנה, מאפשרת למשתמש לגדל PHHs במשך שבועיים לפחות עם ייצור אלבומין יציב וסינתזה של אוריאה. בגלל השונות בכמות התורמים PHH, רק PHHs מסוננים מראש ומוסמכים מומלצים לשימוש במערכת. למרות שמספר ה-PHHs המחוברים משתנה בהתאם לכמות התורם ולצפיפות הזריעה, יכולת הציפוי היחסית נשארת דומה בכל חלקת תורם. בעוד צפיפות הזריעה המומלצת מומלצת, הנתונים לעיל מצביעים על כך שניתן להתאים את צפיפות זריעת הפטוציטים לצרכים ניסיוניים שונים; עם זאת, יש לציין כי זריעת מספר גדול יותר של PHHs עשויה שלא לספק תפוקות פונקציונליות גבוהות או עקביות יותר. ניתוח של מגרשי PHH שהוערכו הראה את קורות החיים הנמוכים ביותר לייצור אלבומין וסינתזה של אוריאה באמצעות צפיפות זריעה נמוכה יותר של 150,000 PHHs / באר ו 200,000 PHHs / באר; עם זאת, לא נמצאו הבדלים משמעותיים בין אלבומין ואוריאה בכל צפיפות זריעה. צפיפות זריעה גבוהה יותר של 250,000 PHHs/באר ו-300,000 PHHs/well מראה ירידה גדולה יותר באלבומין ובאוריאה במהלך תקופת התרבית בת 14 הימים. שונות אינהרנטית של התורם בצלחות עשויה להשפיע על עקביות ייצור האלבומין וסינתזה של אוריאה ב-250,000 PHHs/well ו-300,000 PHHs/well עבור מנות התורם שנבדקו. בדומה לכדורואידים גדולים של הפטוציטים, לפיקוח על PHHs במערכת TV2D+ עלולות להיות השפעות שליליות על התרבות והפונקציונליות ארוכות הטווח של PHHs.
כל השלבים בהפשרה, בציפוי ובתחזוקה הם קריטיים לתרבות מוצלחת וליצירת נתונים; עם זאת, ישנן מספר טעויות נפוצות שמשתמשים חסרי ניסיון יכולים להימנע מהן. PHHs רגישים מאוד לנזק משני לתנודות טמפרטורה, לחץ גזירה וחשיפה לאוויר 9,10. יש לנקוט אמצעי זהירות בעת הפשרת PHHs כדי למנוע מסגרות זמן הפשרה ממושכות ופיפטינג מוגזם. השימוש בשיטת מזיגה ידנית, טיימר והעברה מיידית מאמבט מים לקרח יפחיתו את הטעויות הנפוצות הללו שיכולות להשפיע על הכדאיות והציפוי של PHHs. בנוסף, כאשר בעיות בשרשרת האספקה הופכות נפוצות יותר, ייתכן שיהיה קשה להשיג צלחות מצופות קולגן. ניתן להשתמש בציפוי ידני של לוחות שטופלו בתרבית רקמה באמצעות פתרונות מסחריים של קולגן מסוג I (5-10 מיקרוגרם לסמ"ק2) כדי להתגבר על בעיה זו; עם זאת, לביצועים ועקביות מיטביים, מומלץ להשתמש בלוחות קולגן מצופים מראש. בתהליך המעבר מתרבית תאי הזנה בלבד להכנסת PHHs, חיוני למנוע התייבשות שכבת תאי ההזנה. לעולם אל תאפשר חשיפה לאוויר לתאי ההזנה. כל זמן חשיפה לאוויר עלול להוביל לאיכות ירודה של שכבת תאי ההזנה, מה שישפיע לרעה על התרבית ארוכת הטווח של PHHs. מומלץ לאפשר כמות קטנה של תווך שיורי להישאר בין שינויים בינוניים. לעיתים, PHHs עשויים להכיל פסולת עודפת מבידוד, מה שעלול להקשות על הצפייה במורפולוגיה. כדי לעזור עם בעיה זו, לנער את הצלחת לפני שינוי בינוני ולהשתמש שאיפת ואקום. לבסוף, בעת ביצוע שינוי בינוני, בזהירות לשאוף את המדיום בילה נזהר לא להפריע תאים בתרבית. פיפטה טרייה בנפח בינוני במורד דופן הבאר כדי למנוע פיפטציה ישירות על שכבת התא. כמו כן, על המשתמש להימנע מחשיפה לאוויר בכל שינוי בינוני, באמצעות שינוי 3 בארות מומלץ (סעיפים 3 ו-4). כמו כן יש לציין כי שינוי יומי בינוני הוא אידיאלי אך לא נדרש.
למרות שמיקרוסקופ פלואורסצנטי הפך נפוץ ברוב המעבדות, תוכנה הדרושה לביצוע ניתוח תמונה ספציפי עלולה להיות כרוכה בהוצאות נוספות. ניתן להוריד את ImageJ בחינם, מה שהופך אותו לכלי ניתוח תמונה נגיש בקלות. השלבים בפרוטוקול מספקים בסיס שאליו המשתמש עשוי להזדקק לאופטימיזציה, במיוחד ניתוח חלקיקים של צביעת DAPI; עם זאת, בהיעדר יכולת הדמיה פלואורסצנטית, ערכי חיבור PHH ביום 14 מסופקים על תעודות ניתוח ספציפיות ללוט. סף נמוך יגרום לספירה לא מדויקת של חלקיקי DAPI. מומלץ גם לבדוק את שטח הפנים של חלקיקי DAPI בודדים לפני קביעת אי הכללת גודל. ניתן להשיג זאת על-ידי שימוש בסמל הסגלגל [איור 2 (1), סמל העיגול מתחת לכרטיסייה עריכה ] וציור עיגול שמקיף את חלקיק DAPI. לאחר מכן ניתן להשתמש בכרטיסיה ניתוח כדי למדוד את השטח של חלקיק DAPI שנבחר. ניתן לבחור מדידות ספציפיות באמצעות הגדרת מדידות תחת הכרטיסיה ניתוח [שלב 8.9 ואיור 2 (4)].
השיטות הנוכחיות לגידול PHHs כוללות שימוש בציפויים כגון קולגן-I להגברת חיבור התאים במונוקולטורה דו-ממדית מסורתית11 או כיסוי עם מטריצה חוץ-תאית, כמו מטריג'ל מבוסס מורין, טכניקה המכונה בדרך כלל "תרבית סנדוויץ'"12,13,14,15. בעוד שטכניקת תרבית הסנדוויץ' משפרת את המורפולוגיה והקוטביות של PHH לאורך זמן בהשוואה למונוקולטורה מסורתית, שתי הגישות עדיין חסרות יציבות פנוטיפית ארוכת טווח בתרבות עבור רוב סוגי ה-PHH. שיטה נוספת המשמשת לתרבית PHH היא הכנת ספרואידים תלת-ממדיים; עם זאת, כפי שצוין קודם לכן על ידי Glicklis et al.4, יכולים להיות אתגרים טכניים עם שחזור של גודל spheroid עקב השתנות התורם. במאמץ ליצור מודל כבד רלוונטי יותר מבחינה פיזיולוגית, פותחו מודלים רב-תאיים. כפי שתואר על ידי Ware et al.7, שימוש במיקרו-דפוסים, פיברובלסטים מורינים ותאי אנדותל סינוסואידים ראשוניים של הכבד האנושי המוקפים ב-PHHs אפשרו זמני תרבית מבחנה ארוכים יותר. עם זאת, מיקרו-תבניות יכולות להיות תהליך מורכב וגוזל זמן, ותאי ההזנה שאינם אנושיים עשויים לתרום לרקע באותות מטבוליים, מה שמגביל את התועלת של פלטפורמה זו ביישומים מסוימים. השימוש בתאים שונים שאינם תאי כבד, כולל פיברובלסטים עוריים של בני אדם וחולדות ותאי אנדותל של אבי העורקים של בקר כתאי הזנה לתרבית משותפת של הפטוציטים, הראה הפרשת אלבומין ויצירת צומת הדוקה בדומה לתרביות משותפות של תאי הזנה ממוצא כבד16. עם זאת, מנגנון האינטראקציות בין תאים שאינם מזינים את הכבד TV2D+ לבין PHHs בתרבית צריך להיחקר עוד יותר כדי להבין טוב יותר את ההשפעה על היציבות והפונקציונליות של PHHs במערכת זו. מערכת התרביות שתוארה בעבר על ידי Weaver et al.8 יכולה לגדל בהצלחה PHHs במושבות כבד למשך עד 42 יום, וליצור רשתות תעלות מרה נרחבות. ה-PHHs שגודלו בתרבית במערכת זו שמרו על פונקציונליות מרכזית של הכבד, כולל פעילות Cytochrome 1A2, 2B6 ו-3A4 ופעילות אנזימים מבוססי Uridine 5′-diphospho-glucuronosyltransferase (UGT), יצירת מטבוליטים שלב I ו-II, ייצור אלבומין וסינתזה של אוריאה במשך 22 ימים לפחות במבחנה ללא מטריג'ל. מערכת תרבית זו מייצרת תפוקות יציבות ורלוונטיות מבחינה פיזיולוגית הניתנות להתאמה בקלות לכל מעבדה ליישומים פרמקולוגיים וטוקסיקולוגיים. למרות שפונקציות PHH מרכזיות נשמרות במערכת TV2D+, לא בוצעו השוואות ישירות למודל הספרואיד התלת-ממדי; עם זאת, עבודה עתידית המשווה את אותם תורמי PHH בין מערכות התרבית תוכיח את עצמה כבעלת ערך בקביעת הגבולות והיתרונות של שתי השיטות.
יישומים פוטנציאליים של TV2D+ כוללים הערכה של פינוי מטבולי ואינטראקציות בין תרופות לתרופות של תרכובות בעלות מחזור נמוך, פגיעה בכבד הנגרמת על ידי תרופות והערכת סיכונים של אגרוכימיקלים. חיזוי מדויק של פינוי הכבד של תרופות חדשות ומתפתחות מסתמך על תרבית PHH יציבה וממושכת עם שימור של פונקציונליות הפטוצלולרית מרכזית, דבר מאתגר במיוחד בעת הערכת תרכובות בעלות מחזור נמוך. בנוסף, הערכת סיכונים ורעילות כבד הנגרמת על ידי כימיקלים הם חששות בריאותיים עיקריים, והמודלים הנוכחיים אינם מספקים את היציבות והפונקציונליות לטווח ארוך בתרבית כדי להעריך במדויק רעילות כימית כרונית פוטנציאלית שעשויה להיות משנית לחשיפה חריפה. PHHs בריאים וחולים שגודלו בתרבית TV2D+ הראו הבדלים אופייניים בתפקוד ובנטיית השומנים שנשמרו לאורך זמן17. מחקרים אלה תומכים ב- TV2D+ ככלי מבטיח למגוון יישומים פרמקולוגיים וטוקסיקולוגיים.
Disclosures
JO, LW, EG, EL, SP ו-JW הם עובדים של LifeNet Health, הארגון ללא מטרות רווח שמייצר TV2D+.
Acknowledgements
ברצוננו להודות למליסה קלר וונדי הטמן על עזרתן בסקירת כתבי יד ודיור.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
References
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved