Un sistema di coltura epatica interamente umano per applicazioni di sviluppo di farmaci
In This Article
Summary
I recenti progressi tecnici hanno consentito la produzione su larga scala di una piattaforma in vitro per il metabolismo dei farmaci e le applicazioni di tossicità. Un sistema epatico 2D+ completamente umano (TV2D+) fornisce risultati fisiologicamente rilevanti utilizzando i tradizionali metodi di coltura bidimensionale. Questo protocollo supporterà gli utenti finali nella configurazione, nella manutenzione e nell'applicazione del sistema.
Abstract
Trovare un modello di coltura a lungo termine e rilevante per l'uomo per gli epatociti umani primari (PHH) per gli studi farmacologici e tossicologici rimane una sfida. Le attuali piattaforme di modelli in vitro sono spesso scomode e complesse, mancano di stabilità fenotipica nel tempo e non supportano lotti multipli di PHH, mancando di riproducibilità sperimentale e flessibilità. Qui, forniamo un protocollo dettagliato per lo scongelamento, la placcatura e il mantenimento di un sistema epatico 2D+ completamente umano (TV2D+), che sfrutta le tecniche e le attrezzature standard di coltura bidimensionale (2D) mantenendo la longevità e la stabilità fenotipica nel tempo che tipicamente accompagnano i sistemi tridimensionali (3D) più complessi. I risultati mostrano l'attaccamento e la percentuale di placcabilità in TV2D+ in funzione della densità di semina di PHH, nonché una funzionalità stabile per almeno 2 settimane in coltura. Per ottenere una coltura di successo a lungo termine, viene valutata una gamma di densità di semina PHH. Se stabiliti correttamente, i PHH in TV2D+ si organizzano in colonie di epatociti, esprimono un marcatore specifico per l'epatica e mantengono la vitalità, l'integrità architettonica e i livelli fisiologicamente rilevanti di albumina e urea. Questa combinazione unica di attributi rende il sistema TV2D+ un modello epatico adatto per una varietà di applicazioni farmacologiche e tossicologiche.
Introduction
Prevedere la sicurezza e l'efficacia terapeutica è una parte importante dello sviluppo preclinico dei farmaci. Tuttavia, i modelli epatici preclinici in vitro convenzionali sono limitati nella loro capacità di imitare accuratamente il microambiente cellulare epatico in vivo e di mantenere la funzionalità e la morfologia degli epatociti nel tempo. C'è bisogno di modelli che forniscano una competenza metabolica stabile per più di 1 settimana per valutare i composti a lento turnover o studiare gli esiti associati all'esposizione subacuta o cronica. I test in vivo sugli animali spesso non riescono a prevedere l'efficacia e il rischio dei farmaci a causa delle differenze di specie traduzionali nei meccanismi di clearance epatica umana1. Gli attuali modelli epatici bidimensionali (2D) in vitro, come la monocoltura primaria di epatociti umani (PHH) tradizionali o le colture sandwich, mancano di stabilità fenotipica e longevità in coltura, portando alla perdita della funzione epatocellulare chiave e dell'integrità architettonica nel tempo2. Un metodo alternativo prevede la formazione di sferoidi epatocitari tridimensionali (3D), offrendo un microambiente più rilevante rispetto alla coltura 2D. Tuttavia, questo metodo è limitato dalla disponibilità di materie prime, dalla selezione del lotto di donatori PHH, dalla riproducibilità e dalla perdita di vitalità con l'aumento delle dimensioni degli sferoidi 3,4,5,6. Sono state introdotte piattaforme multicellulari in cui i PHH vengono seminati con cellule feeder su piastre microstrutturate di dimensioni fisse. Sebbene questi modelli possano consentire tempi di coltura più lunghi, le cellule feeder non umane utilizzate in queste piattaforme possono alterare i risultati sperimentali e limitarne l'applicazione a causa del contributo innato di fondo alla clearance del farmaco e ai profili metabolici 1,7. Il sistema epatico 2D+ TruVivo all-human (TV2D+) recentemente descritto in Weaver, et al8, è stato sviluppato per affrontare alcuni dei limiti dei metodi di coltura tradizionali, di co-coltura e 3D dei PHH. Le cellule non epatiche riducono le differenze interspecie nel metabolismo e nella produzione paracrina e forniscono il supporto necessario per gli epatociti primari in modo riproducibile e robusto che non può essere fornito dalle corrispondenti cellule epatiche non parenchimali di un singolo lotto di donatori a causa delle limitazioni nell'espansione, nel fenotipo e nelle prestazioni. Le cellule feeder scelte erano in grado di essere costantemente espanse prima dell'uso e non avevano la necessità di trasformazione o differenziazione. Come descritto da Glicklis et al.4 e Khetani et al.5, i modelli di coltura 3D come gli sferoidi epatocitari presentano sfide con la riproducibilità a causa della variabilità del donatore e del mantenimento della coerenza nelle dimensioni degli sferoidi, che influisce sulla diffusione dei nutrienti in sferoidi superiori a 200 μm, portando a una diminuzione della vitalità e della funzionalità. Come la formazione di sferoidi 3D, il sistema TV2D+ si basa sull'autoassemblaggio dei PHH; tuttavia, le colonie di PHH formate sono disperse sulla superficie del pozzo a una profondità di una singola cellula piuttosto che compattate in un singolo aggregato. Questo metodo di coltura può essere utile per affrontare la variabilità del donatore, consentendo di placcare, coltivare e mantenere la funzionalità di base a varie densità di semina. Il sistema TV2D+ può anche aumentare la robustezza della manipolazione da parte dell'utente a causa della perdita durante la manipolazione o delle attrezzature specializzate necessarie per eseguire una coltura estesa negli sferoidi 3D.
Il sistema TV2D+ combina la coltura 2D standard con la longevità e la stabilità fenotipica che tipicamente accompagnano i sistemi 3D. Il protocollo qui descritto fornisce indicazioni dettagliate per gli utenti con competenze di base in materia di coltura tissutale in laboratori dotati di attrezzature standard come cabine di biosicurezza, centrifughe e incubatori a CO2 . Ogni fase del processo è descritta in dettaglio, compresa la preparazione dei terreni, lo scongelamento, la placcatura e la manutenzione del sistema di coltura risultante. Il protocollo contiene anche un metodo per determinare le uscite di funzionalità di base degli epatociti, l'albumina e l'urea, nonché l'analisi delle immagini in immunofluorescenza per determinare l'attacco PHH per la normalizzazione. Se stabiliti correttamente, i PHH in TV2D+ si organizzano in colonie di epatociti, imitando la morfologia epatica nativa, e mantengono la vitalità estesa, l'integrità architettonica e i livelli fisiologicamente rilevanti di albumina e urea per almeno 2 settimane8. Poiché il sistema può consentire una gamma di densità di semina di PHH, può essere utile per aumentare la disponibilità di lotti di PHH meno piastribili che hanno caratteristiche di donatori desiderabili. Questa combinazione di accessibilità e funzionalità rende TV2D+ un modello epatico adatto per una varietà di applicazioni farmacologiche e tossicologiche.
Protocol
Questo protocollo segue le linee guida del comitato etico di Lifenet Health. Il manoscritto non contiene studi con partecipanti umani o studi su animali condotti da nessuno degli autori. Tutte le cellule sono state isolate dal tessuto del donatore con il pieno consenso a scopo di ricerca da parte di Lifenet Health.
1. Preparazione media
- Scongelare un flacone per ciascun mezzo di scongelamento della cellula di alimentazione, il supplemento A, il supplemento B e il supplemento C (vedi tabella dei materiali) a bagnomaria a 37 °C o 16-24 ore a 4 °C.
- Aliquotare l'intero flacone (10 mL) di mezzo di scongelamento della cella di alimentazione in una provetta conica da 15 mL o 50 mL.
NOTA: La dimensione del pellet cellulare sarà più facile da visualizzare utilizzando una provetta conica da 15 mL. - Aggiungere 4,5 mL di integratore B e 11 mL di integratore A a un flacone di mezzo di placcatura (75 mL) (vedere Tabella dei materiali) per ottenere un mezzo di placcatura completo.
NOTA: Il mezzo di placcatura completo ha una concentrazione di FBS <5% v/v. - In un flacone separato, aggiungere 100 mL di terreno di coltura (vedere Tabella dei materiali), 1 mL di supplemento C e 14 mL di supplemento A per ottenere un terreno di coltura completo.
NOTA: Il terreno di coltura completo ha una concentrazione di FBS <1% v/v - Conservare il supplemento C rimanente e l'integratore A a -20 °C fino alla preparazione media della settimana 2.
NOTA: Ripetuti cicli di gelo-disgelo ridurranno la durata di conservazione degli integratori. Si consiglia di congelare-scongelare solo una volta. - Prima dell'uso, riscaldare 10 mL di terreno di scongelamento delle cellule di alimentazione, terreno di scongelamento degli epatociti, terreno di placcatura completo e terreno di coltura completo per 20-30 minuti a bagnomaria a 37 °C.
2. Scongelamento, conteggio e placcatura di cellule umane (Figura 1A)
- Coltivare le cellule di alimentazione circa 1 ora prima di seminare i PHH. Scongelare le celle di alimentazione (vedere la tabella dei materiali) a bagnomaria a 37 °C per 1-2 minuti.
NOTA: Evitare l'esposizione prolungata (ad es. >2 min) monitorando lo scongelamento e rimuovendo il flaconcino quando il liquido si stacca nel crioviale quando viene capovolto. - Subito dopo lo scongelamento, posizionare le celle di alimentazione sul ghiaccio.
- Utilizzando tecniche asettiche, in una cabina di biosicurezza (BSC), aggiungere cellule appena scongelate a 10 mL di terreno di scongelamento delle cellule di alimentazione.
- Utilizzare una pipetta da 1000 μL per lavare il flaconcino una volta con 1 mL di sospensione di cellula/terreno di scongelamento e raccogliere.
- Centrifugare a 400 x g per 4 minuti a temperatura ambiente (RT).
- Scartare con cura il surnatante per non disturbare il pellet cellulare mediante pipettaggio o aspirazione sottovuoto. Risospendere il pellet cellulare in 1 mL di mezzo di placcatura completo e contare le celle di alimentazione.
NOTA: Le cellule feeder possono essere contate utilizzando l'arancio acridina e lo ioduro di propidio (AOPI) su un contatore di cellule automatizzato o il blu tripano utilizzando un ematometro. Il numero di cellule può variare a seconda della tecnologia e dell'utente. Per ottenere i migliori risultati, contare i campioni duplicati e rimanere coerenti con la metodologia scelta. - Diluire la sospensione cellulare a 100.000 cellule/mL utilizzando il mezzo di placcatura completo.
- Piastra da 500 μL (50.000 cellule) per pozzetto della sospensione cellulare diluita su una piastra a 24 pozzetti rivestita di collagene (vedere Tabella dei materiali).
- Agitare la piastra con un movimento Nord (N)-Sud (S)-Est (E)-Ovest (W) utilizzando un movimento avanti e indietro in direzione N-S 2 volte seguito dallo stesso movimento E-W. Ripeti questo protocollo di agitazione altre 2 volte per un totale di 3 giri.
NOTA: Eseguire l'agitazione con forza moderata per evitare schizzi sul coperchio della piastra mentre si assiste ancora nella distribuzione delle cellule (fare riferimento al video). - Incubare a 37 °C/5% CO2 per 60 min.
- Visualizzare l'attacco della cellula di alimentazione prima di procedere allo scongelamento degli epatociti.
NOTA: L'attacco accettabile della cella di alimentazione è visivamente confluente per circa il 50%.
3. Scongelamento, conteggio e placcatura di epatociti umani primari (Figura 1B)
- Dopo 30 minuti di coltura cellulare feeder, filtrare il terreno di scongelamento degli epatociti preriscaldato attraverso un'unità filtrante in polietersulfone (PES) da 0,2 μm.
- Scongelare i PHH a bagnomaria a 37 °C per 1-2 min.
NOTA: Evitare l'esposizione prolungata (ad es. >2 min) monitorando lo scongelamento e rimuovendo il flaconcino quando il liquido si stacca nel crioviale quando viene capovolto. - Subito dopo lo scongelamento, mettere i PHH sul ghiaccio.
- In una BSC, versare la sospensione di PHH nel mezzo di scongelamento degli epatociti.
NOTA: Evitare di pipettare le sospensioni di cellule PHH quando possibile. È molto importante non eseguire pipettaggio durante il trasferimento di PHH scongelati dal mezzo crioviale a quello di scongelamento. - Utilizzare una pipetta da 1000 μL per lavare il flaconcino 3-4 volte pipettando delicatamente 1 mL di sospensione di epatocita/terreno di scongelamento nel flaconcino e raccogliendo il lavaggio versandolo nuovamente nel mezzo di scongelamento.
- Chiudere e capovolgere delicatamente la sospensione PHH scongelata 5 volte.
- Girare a 100 x g per 8 min a RT.
- Scartare con cura il surnatante per non disturbare il pellet cellulare mediante pipettaggio o aspirazione sottovuoto. Alla parete del tubo conico, aggiungere 3 mL di mezzo di placcatura completo.
- Far oscillare il tubo conico da un lato all'altro per risospendere il pellet cellulare.
- Aggiungere altri 5 ml di terreno di placcatura completo agli epatociti risospesi.
- Contare i PHH.
NOTA: I PHH possono essere contati utilizzando AOPI su un contatore di cellule automatizzato o il blu trypan utilizzando un ematotometro. Il numero di cellule può variare a seconda della tecnologia e dell'utente. Per ottenere i migliori risultati, contare i campioni duplicati e rimanere coerenti con la metodologia scelta. - Diluire la sospensione cellulare alla densità di semina desiderata (300.000-600.000 PHH/mL) utilizzando il mezzo di placcatura completo.
NOTA: La densità ottimale di semina degli epatociti può variare da lotto a lotto. La densità di semina consigliata per un determinato lotto sarà indicata nel certificato di analisi (COA). Utilizzare l'equazione seguente per determinare gli epatociti/mL per una piastra a 24 pozzetti.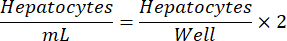
- Dalle celle di alimentazione piastre, rimuovere il terreno mediante pipettaggio o aspirazione sottovuoto.
NOTA: Per garantire la vitalità delle celle di alimentazione, si consiglia di cambiare non più di 3 pozzetti alla volta. - Applicare immediatamente 500 μL (150.000-300.000 cellule) per pozzetto della sospensione epatocitaria diluita sulla piastra a 24 pozzetti di collagene pre-rivestita contenente le cellule di alimentazione.
- Scuotere la piastra con un movimento N-S-E-W utilizzando un movimento avanti e indietro in direzione N-S 2 volte seguito dallo stesso movimento E-W. Ripeti questo protocollo di agitazione altre 2 volte per un totale di 3 giri.
NOTA: Eseguire l'agitazione con forza moderata per evitare schizzi sul coperchio della piastra mentre si assiste comunque nella distribuzione delle cellule. - Incubare a 37 °C/5% CO2 per 2-4 ore. Per i primi 60 minuti di coltura, agitare la piastra ogni 15 minuti con movimento N-S-E-W come al punto 3.15 sopra.
- Dopo l'incubazione, rimuovere la piastra dall'incubatrice e posizionarla in BSC.
- Agitare la piastra e rimuovere l'intero mezzo di placcatura mediante pipettaggio o aspirazione sottovuoto.
NOTA: Per garantire la vitalità della coltura, si consiglia di cambiare non più di 3 pozzetti alla volta. - Aggiungere immediatamente 500 μL di terreno di coltura completo preriscaldato a ciascun pozzetto.
4. Manutenzione
- Aliquote e preriscaldamento del terreno di coltura completo in un bagno d'acqua a 37 °C per 20-30 min. Per una piastra da 24 pozzetti sono necessari circa 13,5 mL di terreno.
- Somministrare quotidianamente colture con 500 μL per pozzetto di terreno di coltura completo fresco e preriscaldato.
NOTA: Per garantire la vitalità della coltura, si consiglia di cambiare non più di 3 pozzetti alla volta. - Preparare il terreno di coltura fresco completo ogni 7 giorni.
5. Raccolta di campioni di surnatante di coltura per la misurazione dell'albumina e dell'urea
- Ai giorni 7, 10 e 14, raccogliere 500 μL di terreno dal pozzetto o dai pozzetti del campione desiderati in una o più provette per microcentrifuga, come mostrato nella Figura 1C.
- Centrifugare il/i campione/i a 320 x g per 10 minuti a 4 °C fino a ottenere detriti di pellet.
- Utilizzare una pipetta per trasferire il surnatante del campione in una o più nuove provette per microcentrifuga, evitando la rottura del pellet.
- Eseguire i campioni sul test dell'albumina e/o dell'urea (vedere rispettivamente paragrafi 10 e 11).
NOTA: I campioni possono essere conservati a una temperatura compresa tra -20 °C e -80 °C per 2 settimane.
6. Colorazione giorno I
ATTENZIONE: Il tampone di fissazione contiene paraformaldeide. La paraformaldeide può causare danni agli occhi, irritazione della pelle e tossicità d'organo. Lavorare in un'area con una buona ventilazione e indossare adeguati dispositivi di protezione individuale (DPI).
- Dopo la raccolta dei campioni di terreno il giorno 14, aggiungere 300 μL di tampone di fissazione (vedere la tabella dei materiali) a ciascun pozzetto da colorare, come mostrato nella Figura 1C. Colorare un minimo di 2 pozzetti.
- Incubare a 4 °C per 20-60 min.
- Preparare 1x tampone di permeabilizzazione (vedere la tabella dei materiali) aggiungendo 5 mL di soluzione madre 10x a 45 mL di PBS 1x (vedere la tabella dei materiali).
NOTA: Il tampone di permeabilizzazione 1x può essere conservato a 4° C per 1 mese. - Lavare 2 volte con 300 μL di tampone di permeabilizzazione 1x su ghiaccio.
- Aggiungere 300 μL di anticorpo primario citocheratina 18 (vedere Tabella dei materiali) utilizzando una diluizione 1:1000 in tampone di permeabilizzazione 1x su ghiaccio.
NOTA: Incubare minimamente un pozzetto con 1x tampone di permeabilizzazione solo per un controllo secondario di soli anticorpi. - Incubare 16-24 h a 4 °C.
7. Colorazione II giorno
- Il giorno seguente, rimuovere l'anticorpo primario mediante pipettaggio o aspirazione sottovuoto.
- Lavare 2 volte con 300 μL per pozzetto di 1x tampone di permeabilizzazione su ghiaccio.
- Aggiungere 300 μL di anticorpo secondario fluorescente (vedere Tabella dei materiali) utilizzando una diluizione 1:500 in tampone di permeabilizzazione 1x (includere solo il controllo secondario).
NOTA: Evitare la luce quando si utilizzano anticorpi fluorescenti. - Incubare per 30-45 minuti a 4 °C al buio.
- Rimuovere l'anticorpo secondario mediante pipettaggio o aspirazione a vuoto.
- Lavare 2 volte con 300 μL per pozzetto di 1x tampone di permeabilizzazione su ghiaccio.
- Lavare 1 volta con 300 μL per pozzetto di 1x PBS.
- Aggiungere 150 μL di terreno di montaggio 4′,6-diamidino-2-fenilindolo (DAPI) (vedere la tabella dei materiali) in ciascun pozzetto e incubare per 15 minuti a RT al buio.
NOTA: La piastra può essere avvolta in parafilm e conservata a 4 °C al buio per 1 settimana. - Vista al microscopio a fluorescenza. Cattura 5 immagini di ogni canale fluorescente specifico per ogni pozzetto utilizzando l'obiettivo 10x (assicurati che un'immagine abbia una barra di scala).
NOTA: DAPI ha un'eccitazione/emissione di 358 nm/461 nm. Utilizzare un microscopio a fluorescenza dotato dei filtri di rilevamento appropriati sia per il DAPI che per il fluoroforo dell'anticorpo secondario.
8. Analisi ImageJ (Figura 2)
NOTA: Si consiglia di utilizzare ImageJ versione 1.52a o successiva.
- Aprire un'immagine contenente una barra di scala in ImageJ. Fare clic sull'icona Linea retta e tracciare una linea alla lunghezza esatta della barra della scala [Figura 2 (1)]
NOTA: Se necessario, fare clic sull'icona Lente di ingrandimento per ingrandire o rimpicciolire. - Fare clic sulla scheda Analizza . Evidenziare e fare clic su Imposta scala.
- Modificare Distanza nota con la distanza della barra della scala. Modificare Unità di lunghezza con le unità della barra della scala. Applicare globalmente le impostazioni selezionando Globale. Fare clic su OK per impostare la scala.
NOTA: Una volta applicata questa impostazione, ogni immagine aperta mostrerà l'area calcolata del campo visivo in unità immesse dall'utente. - Aprire un'immagine solo DAPI in ImageJ. Fare clic sulla scheda Processo ed evidenziare Sottrai sfondo. Rimuovi lo sfondo 50 pixel alla volta fino a quando le aree non macchiate diventano nere.
NOTA: se l'immagine non contiene sfondo, questo passaggio non è obbligatorio. - Fare clic sulla scheda Immagine ed evidenziare Tipo. Fare clic su 8 bit per rendere l'immagine in scala di grigi [Figura 2 (2)].
- Fissare la soglia dell'immagine manualmente o automaticamente per includere tutte le particelle DAPI (fare attenzione a non superare manualmente la soglia) [Figura 2 (3)]. Fare clic sulla scheda Immagine ed evidenziare Regola. Fare clic su Soglia. Al termine, fare clic su Applica .
- Fare clic sulla scheda Processo ed evidenziare Binario. Fare clic su Spartiacque.
- Fare clic sulla scheda Analizza ed evidenziare/fare clic su Analizza particelle [Figura 2 (4)]. Impostare la dimensione su 5-infinito e la circolarità su 0,00-1,00. Nella scheda a discesa Mostra, seleziona Contorni. Assicurarsi che le opzioni Visualizza risultati, Riepiloga e Includi fori siano selezionate. Fare clic su OK.
NOTA: L'intervallo di particelle desiderato può essere regolato se la soglia produce pixel di sfondo. - Registrare il risultato del conteggio come TOTAL DAPI.
- Aprire un'immagine di citocheratina 18/DAPI unita in ImageJ.
- Utilizzare l'icona Multi-Point [Figura 2 (5)] per contare manualmente tutte le particelle DAPI non colorate per la citocheratina 18.
- Registrare il risultato come FEEDER CELLS. Usa l'equazione seguente per determinare il dapi degli epatociti.
Epatocita DAPI = DAPI totale - Cella di alimentazione DAPI
9. Quantificazione degli epatociti attaccati totali e della percentuale di attacco (Plateability)
- Creare un fattore di scala per l'area di coltura a 24 pozzetti utilizzando l'equazione riportata di seguito. Le misurazioni del campo visivo si trovano nella parte superiore di ogni immagine aperta [Figura 2 (2), riquadro verde].
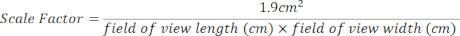
- Calcola il totale degli epatociti attaccati usando l'equazione seguente.
Epatociti attaccati = Fattore di scala × Epatocita DAPI - Calcola la percentuale di attacco degli epatociti usando l'equazione seguente.
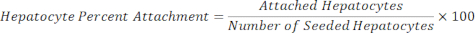
10. Dosaggio dell'albumina
- Misurare la produzione di albumina utilizzando un test di immunoassorbimento enzimatico a sandwich (ELISA) (vedere Tabella dei materiali) su campioni diluiti a 1:200.
NOTA: Per precisione, l'utente conferma che i campioni rientrano nell'intervallo lineare della curva standard. Il kit specificato fornisce tutti i materiali e le istruzioni per eseguire il test. - Normalizzare le concentrazioni del campione agli epatociti attaccati utilizzando l'equazione seguente.
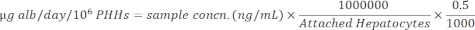
11. Saggio dell'urea
ATTENZIONE: Il reagente acido di azoto ureico nel sangue (BUN) contiene acido solforico. La concentrazione di acido solforico nel reagente dell'acido BUN è considerata corrosiva. Non ingerire. Lavorare in un'area con una buona ventilazione e indossare DPI adeguati.
- La sintesi dell'urea viene misurata utilizzando un metodo modificato del diacetile monoxima (vedi Tabella dei materiali).
- Diluire 53,3 μL di urea 75 mg/dL in 346,7 μL di terreno di coltura completo per ottenere lo Standard #1 (100 μg/mL)
- Etichettare le provette 2-8 e utilizzare una diluizione seriale 1:2 per rendere standard i test dell'urea (Tabella 1).
- Aggiungere 10 μL di campione o standard ai pozzetti di una piastra a 96 pozzetti con fondo trasparente a pareti nere (vedere la tabella dei materiali).
- Aggiungere 150 μL di reagente BUN a ciascun pozzetto contenente il campione. Preparare il reagente BUN mescolando 1/3 del reagente colorante BUN con 2/3 di reagente acido BUN. Usa l'equazione qui sotto per facilitare i calcoli.
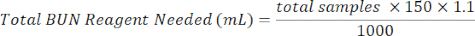
Reagente colorante BUN (mL) = Reagente BUN totale necessario × 0,333
Reagente acido BUN (mL) = Reagente BUN totale necessario × 0,667 - Incubare la piastra per 90 minuti in forno o incubatrice a 60 °C.
- Leggere immediatamente l'assorbanza della piastra a 540 nm e 650 nm.
- Creare una curva standard sottraendo l'assorbanza del bianco e dello sfondo (650 nm) da tutti i campioni e gli standard. Generare una linea di adattamento mediante l'analisi di regressione lineare.
- Determinare la concentrazione del campione sconosciuto dalla curva standard.
- Normalizzare le concentrazioni del campione agli epatociti attaccati utilizzando l'equazione seguente.
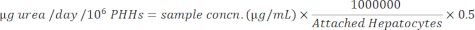
Representative Results
Il metodo generale di placcatura, coltura e test di funzionalità di base del sistema di coltura epatica coinvolge le comuni tecniche e analisi di coltura cellulare primaria, come illustrato nella Figura 1. L'attacco epatocitario e la percentuale di piacabilità sono stati calcolati il giorno 14 utilizzando l'analisi ImageJ di almeno cinque immagini di citocheratina 18 e colorazione DAPI per pozzetto (Figura 2). Immagini rappresentative di PHH coltivati con cellule feeder sono mostrate nella Figura 3. Le varie densità di semina epatica hanno mostrato differenze visive di confluenza in base alla densità di semina e hanno mantenuto la tipica morfologia epatica e cuboidale per 14 giorni di coltura. Le immagini dei lotti A e B dei donatori di epatociti sono state acquisite per ciascuna densità di semina testata (Figura 4A). La percentuale media di platabilità per il donatore B (89,04% ± 3,99%, 198.552 ± 49.885 PHH) è risultata superiore a quella del donatore A (66,08% ± 6,67%, 146.128 ± 33.063 PHH) in tutte le densità di semina utilizzate (Figura 4B). Il donatore A ha avuto una percentuale di platabilità significativamente più elevata utilizzando 150.000 PHH/pozzetto (76,07% ± 12,87%) rispetto a 250.000-300.000 PHH/pozzetto (62,75% ± 9,64%). Il donatore B non ha mostrato differenze significative nella percentuale di piacabilità degli epatociti. Il donatore B aveva la più bassa piagliabilità epatocitaria (85,78% ± 13,25%) alla più alta densità di semina, 300.000 PHH/pozzetto. Analogamente al donatore A, il donatore B di semina a 150.000 PHH/pozzetto ha avuto la più alta percentuale di piacabilità degli epatociti (94,75% ± 15,07%).
La produzione di albumina e la sintesi dell'urea sono state misurate in tre punti temporali durante il periodo di coltura di 14 giorni e normalizzate agli epatociti attaccati calcolati. Nel complesso, il donatore A ha aumentato la produzione di albumina rispetto al donatore B (41,32 ± 4,58 μg alb/die/106 PHH vs. 34,66 ± 10,03 μg alb/die/106 PHHs) (Figura 5). I donatori A e B hanno avuto la più alta produzione di albumina seminando epatociti rispettivamente a 150.000 PHH/pozzetto, 45,91 ± 5,96 μg alb/die/106 PHH e 48,67 ± 20,44 μg alb/die/106 PHHs. Non sono state osservate differenze significative nella produzione di albumina nelle densità di semina utilizzate. Come affermato da Baudy et al.3, è auspicabile che i sistemi microfisiologici epatici mantengano una produzione costante di albumina e sintesi di urea con meno del 50% di variazione in 14 giorni di coltura. Il coefficiente di variazione (CV) è stato calcolato dividendo la media per la deviazione standard per i giorni 7, 10 e 14. Tutti i campioni sono stati eseguiti in duplicati. Il CV per la produzione di albumina nel periodo di coltura di 14 giorni a 150.000 PHH/pozzetto è stato del 12,24% per il donatore A e del 37,97% per il donatore B, inferiore al criterio del 50% desiderato. Un'elevata varianza nella produzione di albumina è stata osservata sia nel donatore A che nel donatore B quando seminato a 250.000 e 300.000 PHH/pozzetto. A queste densità di semina, entrambi i donatori sperimentano una forte diminuzione della produzione di albumina tra i giorni 7, 10 e 14 della coltura (donatore CV A, 22,49% e donatore B, 45,07%).
La sintesi di urea del donatore B (95,09 ± 18,91 μg di urea/die/106) è risultata aumentata rispetto al donatore A (64,92 ± 4,66 μg di urea/die/106 PHHs) quando si calcola la media dei dati specifici del lotto di PHH per i giorni 7, 10 e 14 (Figura 6). Il donatore B (113,49 ± 37,34 μg di urea/giorno/106 PHH) e il donatore A (69,12 ± 17,06 μg di urea/giorno/106 PHH) hanno avuto la maggiore sintesi di urea in un periodo di coltura di 14 giorni, seminando rispettivamente a una densità di 150.000 PHH/pozzetto e 200.000 PHH/pozzetto. Entrambi i lotti donatori hanno avuto la più bassa produzione di urea e il CV più alto a 300.000 PHH/pozzetto. Non sono state osservate differenze significative nella sintesi dell'urea nelle densità di semina utilizzate. Il CV più basso per la sintesi di urea per il donatore A è stato osservato quando coltivato a 250.000 PPH/pozzetto (23,11%) e 200.000 PHH/pozzetto per il donatore B (28,26%). Come evidenziato da questi risultati, la densità di semina ottimale per un dato lotto di PHH dipende dal livello di confluenza desiderato al momento del saggio e dalla natura dei risultati che vengono misurati; Una maggiore densità di semina potrebbe non essere sempre correlata a un segnale o a una gamma dinamica più elevati.
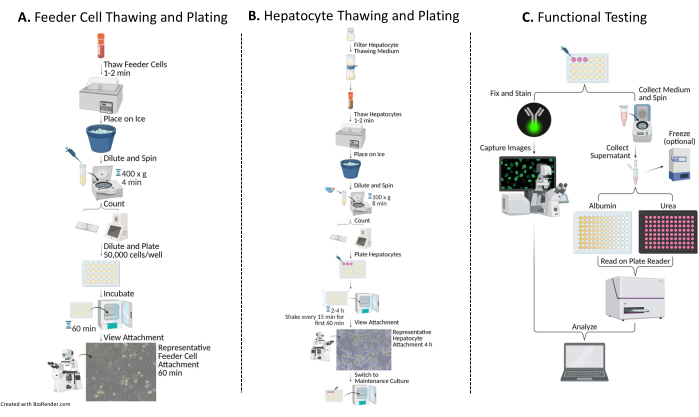
Figura 1: Diagramma di flusso della placcatura, della coltura e del test funzionale di epatociti con cellule feeder. (A) Le cellule di alimentazione vengono scongelate in uno specifico mezzo di scongelamento (vedi Tabella dei materiali), risospese in un mezzo di placcatura completo (vedi Tabella dei materiali) e le cellule vengono contate. Le cellule vengono diluite, piastrate e incubate per 60 minuti a 37 °C/5% di CO2 . (B) Gli epatociti vengono scongelati in uno specifico mezzo di scongelamento (vedi Tabella dei materiali), risospesi in un mezzo di placcatura completo e le cellule vengono contate. Gli epatociti vengono diluiti e placcati con cellule feeder. Le cellule vengono incubate per 2-4 ore a 37 °C/5% di CO2 , agitando con un movimento N-S-E-W ogni 15 minuti per i primi 60 minuti di coltura. Il terreno di coltura viene sostituito con un terreno di coltura completo preriscaldato per il mantenimento della coltura (vedere la tabella dei materiali). Le colture vengono nutrite quotidianamente. (C) Nei giorni 7, 10 e 14, vengono raccolti campioni di terreno per il test dell'albumina e dell'urea. Dopo la raccolta dei campioni il giorno 14, le cellule vengono fissate e colorate con l'anticorpo Citocheratina 18 (vedi Tabella dei materiali) 16-24 h a 4 °C. Inoltre, vengono incubati in un anticorpo secondario appropriato, lavati e montati con DAPI (vedi Tabella dei materiali) per l'acquisizione e l'analisi delle immagini. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Analisi delle immagini con il software ImageJ. Elaborazione ImageJ delle immagini acquisite. Fase 1: viene applicata una scala a tutte le immagini in base alla barra della scala specifica del microscopio. Passaggio 2: il tipo di immagine viene modificato. Passaggio 3: viene applicato un limite di soglia per selezionare le particelle DAPI. Fase 4: viene eseguita un'analisi delle particelle e viene registrato il conteggio. Passo 5: per determinare il numero di celle di alimentazione collegate, un'immagine unita viene contata utilizzando lo strumento multipunto. Fare clic qui per visualizzare una versione più grande di questa figura.
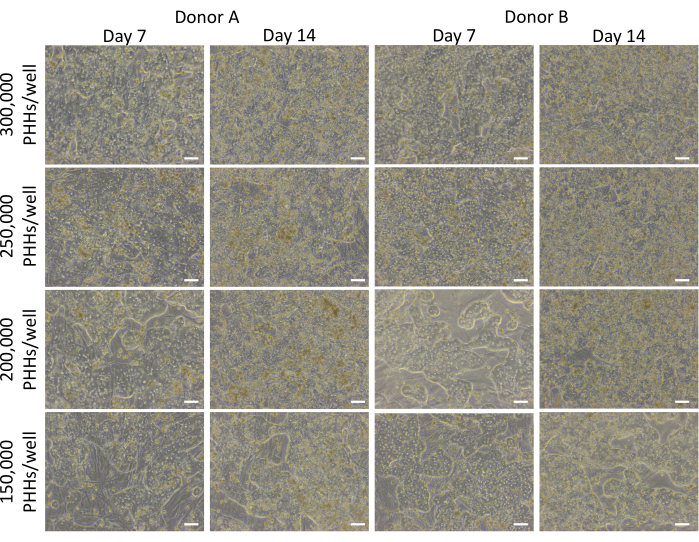
Figura 3: Morfologia di varie densità di semina epatica coltivate con cellule feeder. Immagini rappresentative nei giorni 7 e 14 di PHH coltivati con cellule feeder (50.000 cellule/pozzetto) a densità di semina epatica di 150.000, 200.000, 250.000 e 300.000 PHH/pozzetti. Le immagini sono state scattate utilizzando un obiettivo 10x su un microscopio a contrasto di fase invertito. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
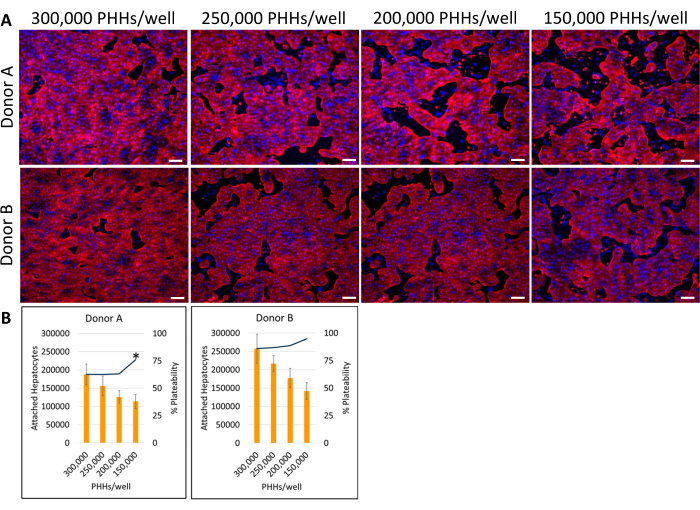
Figura 4: Immunocitochimica fluorescente di varie densità di semina epatica coltivate con cellule feeder. (A) Immagini rappresentative della colorazione della citocheratina 18 (rosso) il giorno 14 a densità di semina epatica di 150.000, 200.000, 250.000 e 300.000 PHH/pozzetti. Due pozzetti per ogni densità di semina sono stati fissati per 30 minuti a 4 °C. I pozzetti sono stati incubati 16-24 ore a 4°C con anticorpo primario a 1:1000. Un anticorpo secondario è stato utilizzato a 1:500 per 30 minuti a 4 °C al buio. Il colorante nucleare DAPI (blu) è stato aggiunto ai pozzetti per 15 minuti a temperatura ambiente. Le immagini sono state scattate utilizzando un obiettivo 10X su un microscopio a fluorescenza invertita. Barra della scala = 100 μm. (B) Epatociti attaccati calcolati e percentuale di piattilità di varie densità di semina epatica calcolate utilizzando ImageJ. *p ≤ 0,05, alla percentuale di platinabilità per 200.000, 250.000 e 300.000 PHH/pozzetto. Le barre di errore rappresentano la deviazione standard (n ≥ 5 immagini per condizione). Fare clic qui per visualizzare una versione più grande di questa figura.
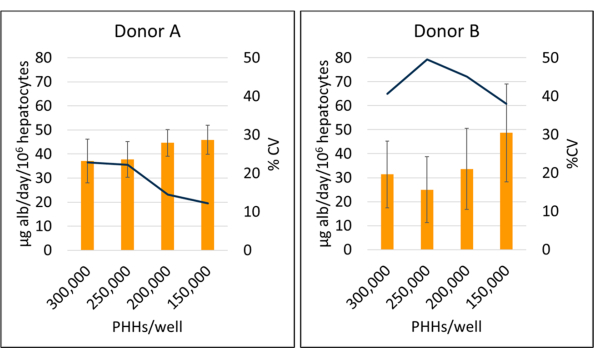
Figura 5: Produzione di albumina di epatociti coltivati con cellule nutritrici. Produzione di albumina da densità di semina epatica a 150.000, 200.000, 250.000 e 300.000 PHH/pozzetto. Le colonne rappresentano la media a 14 giorni di microgrammi di albumina/giorno normalizzati sul totale degli epatociti attaccati. Una linea rappresenta il CV tra i giorni 7, 10 e 14. Le barre di errore rappresentano la deviazione standard (n ≥ 2 pozzetti per condizione con repliche). Fare clic qui per visualizzare una versione più grande di questa figura.
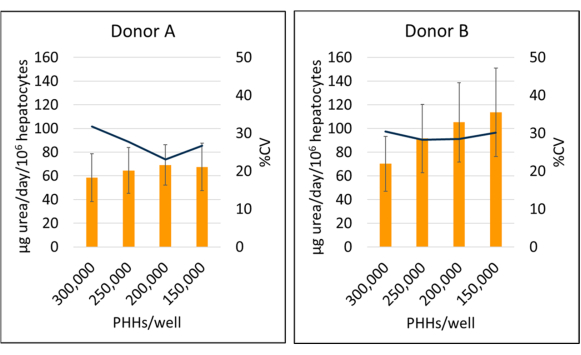
Figura 6: Sintesi dell'urea di epatociti coltivati con cellule feeder. Sintesi dell'urea da densità di semina epatica a 150.000, 200.000, 250.000 e 300.000 PHH/pozzetto. Le colonne rappresentano la media di 14 giorni di μg di urea/giorno normalizzata rispetto al totale degli epatociti attaccati. Una linea rappresenta %CV tra i giorni 7, 10 e 14. Le barre di errore rappresentano la deviazione standard (n ≥ 2 pozzetti per condizione con repliche). Fare clic qui per visualizzare una versione più grande di questa figura.
| Standard (S) # | Concentrazione (μg/mL) | Soluzione di urea (μL) | Coltura completa (μL) |
| 1 | 100 | 53.3 75 mg/dL di magazzino | 346.7 |
| 2 | 50 | 100 (soluzione S1) | 100 |
| 3 | 25 | 100 (soluzione S2) | 100 |
| 4 | 12.5 | 100 (soluzione S3) | 100 |
| 5 | 6.26 | 100 (soluzione S4) | 100 |
| 6 | 3.125 | 100 (Soluzione S5) | 100 |
| 7 | 1.5625 | 100 (Soluzione S6) | 100 |
| Vuoto | 0 | 0 | 100 |
Tabella 1: Preparazione del campione standard di urea. Utilizzando 75 mg/dL di urea madre, preparare una soluzione di urea da 100 μg/mL. Aliquotare i volumi suggeriti per raggiungere la concentrazione finale per la curva standard.
Discussion
Il sistema di coltura epatica descritto può essere stabilito in laboratori dotati di strumentazione standard per la coltura dei tessuti. Composto da PHH coltivati con cellule feeder, il sistema consente all'utente di coltivare PHH per almeno due settimane con produzione stabile di albumina e sintesi di urea. A causa della variabilità del lotto donatore di PHH, si raccomanda l'uso nel sistema solo di PHH pre-selezionati e qualificati. Sebbene il numero di PHH attaccati vari in base al lotto del donatore e alla densità di semina, la piattiabilità relativa rimane simile all'interno di ciascun lotto del donatore. Sebbene le densità di semina raccomandate siano consigliate, i dati di cui sopra suggeriscono che la densità di semina degli epatociti può essere regolata per diverse esigenze sperimentali; tuttavia, va notato che il seeding di un numero maggiore di PHH potrebbe non fornire output funzionali più elevati o più coerenti. L'analisi dei lotti di PHH valutati ha mostrato il CV più basso per la produzione di albumina e la sintesi dell'urea utilizzando densità di semina inferiori di 150.000 PHH/pozzetto e 200.000 PHH/pozzetto; Tuttavia, non sono state riscontrate differenze significative tra albumina e urea a qualsiasi densità di semina. Densità di semina più elevate di 250.000 PHH/pozzetto e 300.000 PHH/pozzetto mostrano una maggiore diminuzione dell'albumina e dell'urea nel periodo di coltura di 14 giorni. La variabilità intrinseca del donatore nella piacabilità può influenzare la consistenza della produzione di albumina e della sintesi dell'urea a 250.000 PHH/pozzetto e 300.000 PHH/pozzetto per i lotti di donatori testati. Analogamente ai grandi sferoidi epatocitari, la sovrasemina di PHH nel sistema TV2D+ può avere effetti negativi sulla coltura e sulla funzionalità a lungo termine dei PHH.
Tutte le fasi di scongelamento, placcatura e manutenzione sono fondamentali per il successo della cultura e della generazione di dati; Tuttavia, ci sono diversi errori comuni che gli utenti inesperti possono evitare. I PHH sono altamente suscettibili ai danni secondari alle fluttuazioni di temperatura, alle sollecitazioni di taglio e all'esposizione all'aria 9,10. È necessario prendere precauzioni durante lo scongelamento dei PHH per evitare tempi di scongelamento prolungati e un pipettaggio eccessivo. L'uso di un metodo di versamento manuale, di un timer e del trasferimento immediato dal bagno d'acqua al ghiaccio ridurrà questi errori comuni che possono influire sulla vitalità e sulla platibilità dei PHH. Inoltre, con i problemi della catena di approvvigionamento che diventano sempre più comuni, potrebbe essere difficile ottenere piastre rivestite di collagene. Per ovviare a questo problema è possibile utilizzare il rivestimento manuale di piastre trattate con colture tissutali utilizzando soluzioni commerciali di collagene di tipo I (5-10 μg/cm2); Tuttavia, per prestazioni e consistenza ottimali, si consiglia di utilizzare piastre di collagene pre-rivestite. Nel processo di transizione dalla coltura di sole cellule feeder all'introduzione di PHH, è fondamentale evitare che lo strato di cellule feeder si asciughi. Non permettere mai l'esposizione all'aria delle celle di alimentazione. Qualsiasi tempo di esposizione all'aria può portare a una scarsa qualità dello strato cellulare di alimentazione, che avrà un impatto negativo sulla coltura a lungo termine dei PHH. È buona norma lasciare che una piccola quantità di terreno residuo rimanga tra un cambio di terreno e l'altro. A volte, i PHH possono contenere detriti in eccesso dall'isolamento, che possono rendere difficile la morfologia di visualizzazione. Per risolvere questo problema, agitare la piastra prima di un cambio di fluido e utilizzare l'aspirazione sottovuoto. Infine, quando si esegue un cambio di terreno, aspirare con cura il terreno esausto, facendo attenzione a non disturbare le cellule in coltura. Pipettare il volume medio fresco lungo il lato del pozzetto per evitare il pipettaggio direttamente sullo strato cellulare. L'utente deve inoltre evitare l'esposizione all'aria ad ogni cambio del fluido, utilizzando il cambio a 3 pozzetti raccomandato (Sezioni 3 e 4). Va anche notato che un cambio medio giornaliero è l'ideale ma non necessario.
Sebbene i microscopi fluorescenti siano diventati comuni nella maggior parte dei laboratori, il software necessario per eseguire un'analisi specifica delle immagini può comportare spese aggiuntive. ImageJ può essere scaricato gratuitamente, il che lo rende uno strumento di analisi delle immagini facilmente accessibile. Le fasi del protocollo forniscono una base su cui l'utente potrebbe aver bisogno di ottimizzare, in particolare l'analisi delle particelle della colorazione DAPI; tuttavia, in assenza di capacità di imaging fluorescente, i valori di attacco PHH al giorno 14 sono forniti su certificati di analisi specifici per lotto. Una soglia scadente comporterà un conteggio impreciso delle particelle DAPI. Si consiglia inoltre di controllare l'area superficiale delle singole particelle DAPI prima di impostare un'esclusione dimensionale. Ciò può essere ottenuto utilizzando l'icona ovale [Figura 2 (1), icona a forma di cerchio sotto la scheda Modifica ] e disegnando un cerchio che racchiuda la particella DAPI. La scheda Analizza può quindi essere utilizzata per misurare l'area della particella DAPI selezionata. Le misurazioni specifiche possono essere selezionate utilizzando Imposta misurazioni nella scheda Analizza [passaggio 8.9 e Figura 2 (4)].
I metodi attuali per la coltura dei PHH prevedono l'uso di rivestimenti come il collagene-I per aumentare l'attaccamento cellulare nella tradizionale monocoltura bidimensionale11 o la sovrapposizione con una matrice extracellulare, come il Matrigel a base murina, una tecnica comunemente indicata come "coltura a sandwich"12,13,14,15. Sebbene la tecnica di coltura a sandwich migliori la morfologia e la polarità del PHH nel tempo rispetto alla monocoltura tradizionale, entrambi gli approcci mancano ancora di stabilità fenotipica a lungo termine in coltura per la maggior parte dei lotti piastribili di PHH. Un altro metodo utilizzato per coltivare i PHH è la produzione di sferoidi 3D; tuttavia, come affermato in precedenza da Glicklis et al.4, ci possono essere problemi tecnici con la riproducibilità delle dimensioni degli sferoidi a causa della variabilità del donatore. Nel tentativo di creare un modello di fegato più rilevante dal punto di vista fisiologico, sono stati sviluppati modelli multicellulari. Come descritto da Ware et al.7, l'utilizzo di micropatterning, fibroblasti murini e cellule endoteliali sinusoidali primarie del fegato umano circondate da PHH ha consentito tempi di coltura in vitro più lunghi. Tuttavia, il micropatterning può essere un processo complesso e dispendioso in termini di tempo e le cellule di alimentazione non umane possono contribuire al background nei segnali metabolici, limitando l'utilità di questa piattaforma in alcune applicazioni. L'uso di varie cellule non epatiche, tra cui fibroblasti dermici umani e di ratto e cellule endoteliali dell'aorta bovina come cellule feeder per la co-coltura di epatociti, ha mostrato una secrezione di albumina e la formazione di giunzioni strette simili alle co-colture di cellule feeder di origine epatica16. Tuttavia, il meccanismo delle interazioni tra le cellule nutritrici non epatiche TV2D+ e i PHH in coltura deve essere ulteriormente studiato per comprendere meglio l'influenza sulla stabilità e sulla funzionalità dei PHH in questo sistema. Il sistema di coltura precedentemente descritto da Weaver et al.8 è in grado di coltivare con successo PHH in colonie epatiche per un massimo di 42 giorni, formando estese reti canalicolari biliari. I PHH coltivati in questo sistema hanno mantenuto la funzionalità epatica chiave, tra cui l'attività del citocromo 1A2, 2B6 e 3A4 e l'attività enzimatica a base di uridina 5′-difosfo-glucuronosiltransferasi (UGT), la formazione di metaboliti di fase I e II, la produzione di albumina e la sintesi dell'urea per almeno 22 giorni in vitro senza Matrigel. Questo sistema di coltura produce risultati stabili e fisiologicamente rilevanti che sono facilmente adattabili a qualsiasi laboratorio per applicazioni farmacologiche e tossicologiche. Sebbene le funzioni chiave di PHH siano mantenute nel sistema TV2D+, non sono stati effettuati confronti diretti con il modello sferoidale 3D; tuttavia, il lavoro futuro che confronta gli stessi donatori di PHH tra i sistemi di coltura si rivelerà prezioso per determinare i limiti e i vantaggi di entrambi i metodi.
Le potenziali applicazioni di TV2D+ includono la valutazione della clearance metabolica e delle interazioni farmaco-farmaco di composti a basso turnover, il danno epatico indotto da farmaci e la valutazione del rischio di prodotti agrochimici. La previsione accurata della clearance epatica di farmaci nuovi ed emergenti si basa su una coltura di PHH stabile e prolungata con mantenimento della funzionalità epatocellulare chiave, che è particolarmente impegnativa quando si valutano composti a basso turnover. Inoltre, la valutazione del rischio e la tossicità epatica indotta da sostanze chimiche sono le principali preoccupazioni per la salute e i modelli attuali non forniscono la stabilità e la funzionalità a lungo termine in coltura per valutare con precisione la potenziale tossicità chimica cronica che può essere secondaria all'esposizione acuta. I PHH sani e malati coltivati in TV2D+ hanno mostrato differenze caratteristiche nella funzione e nella disposizione dei lipidi che sono state mantenute nel tempo17. Questi studi supportano TV2D+ come uno strumento promettente per una varietà di applicazioni farmacologiche e tossicologiche.
Disclosures
JO, LW, EG, EL, SP e JW sono dipendenti di LifeNet Health, l'organizzazione senza scopo di lucro che produce TV2D+.
Acknowledgements
Vorremmo ringraziare Mellissa Keller e Wendy Hetman per la loro assistenza nella revisione del manoscritto e della figura.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
References
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved