Двухслойное микрофлюидное устройство для производства комбинаторных пробок
In This Article
Summary
Представлено изготовление двухслойного устройства на основе полидиметилсилоксана (PDMS) для получения комбинаторных библиотек в водомасляных эмульсиях (пробках). Необходимое аппаратное и программное обеспечение, необходимое для автоматизации производства свечей, подробно описано в протоколе, а также демонстрируется производство количественной библиотеки флуоресцентных свечей.
Abstract
Капельная микрофлюидика — это универсальный инструмент, который позволяет выполнять большое количество реакций в химически различных нанолитровых отсеках. Такие системы используются для инкапсуляции самых разных биохимических реакций – от инкубации одиночных клеток до проведения ПЦР-реакций, от геномики до химического синтеза. Соединение микрофлюидных каналов с регулирующими клапанами позволяет контролировать их открытие и закрытие, тем самым обеспечивая быстрое производство крупномасштабных комбинаторных библиотек, состоящих из популяции капель с уникальным составом. В этой статье представлены протоколы изготовления и эксплуатации двухслойного микрофлюидного устройства на основе PDMS под давлением, которое может быть использовано для создания комбинаторных библиотек эмульсий типа «вода в масле», называемых пробками. Благодаря включению программного обеспечения и микрофлюидного оборудования, поток желаемых жидкостей в устройстве можно контролировать и манипулировать им для создания комбинаторных библиотек свечей и для контроля состава и количества составляющих популяций пробок. Эти протоколы ускорят процесс создания комбинаторных скринингов, особенно для изучения реакции на лекарственные препараты в клетках биопсии онкологических больных.
Introduction
Микрофлюидика позволяет манипулировать небольшими количествами жидкостей в микроканалах1. Масштаб работы типичных микрофлюидных устройств составляет от десятков до сотен микрометров, что позволяет миниатюризировать химические и биологические реакции, тем самым позволяя проводить такие реакции с относительно небольшими количествами реагентов. Первоначально микрофлюидные устройства изготавливались из таких материалов, как кремний2 и стекло3. Несмотря на то, что они все еще используются4, они создают определенные проблемы, такие как совместимость с растворителями, высокая стоимость производства и трудности с интеграцией средств управления потоком жидкости 5,6. Методики изготовления на основе PDMS, называемые мягкой литографией, предлагают недорогую альтернативу быстрому прототипированию устройств7 и возможность изготовления сложных многослойных устройств8. Добавление клапанов и насосов к устройствам PDMS позволяет управлять маршрутизацией и скоростью текучих сред в устройствах 9,10. Было разработано несколько способов проектирования и приведения в действие микроклапанов обратимым или необратимым образом, например, биметаллические клапаны, изготовленные из кремния и алюминия, которые имеют термический привод11 или используют газ, образующийся в результате электрохимической реакции, для отклонения мембраны из нитрида кремния12. Gu et al. демонстрируют использование механических выводов дисплея Брайля для давления на микроканалы для регулирования потока13. Одним из наборов микроклапанов, который приобрел популярность, являются пневматические клапаны на основе PDMS, впервые предложенные группой Stephen Quake14. Обычно такие клапаны состоят из двух ортогональных микроканалов – проточного и управляющего. При нагнетании давления в канале управления тонкая мембрана PDMS отклоняется от проточного канала, перекрывая его и тем самым прерывая поток жидкости. После сброса давления мембрана расслабляется, тем самым открывая канал потока и позволяя возобновить поток жидкости. Таким образом, клапаны PDMS позволяют регулировать расход надежным и реверсивным образом, поскольку канал управления может подвергаться давлению и сбросу давления несколько раз15. Кроме того, поскольку такие клапаны могут приводиться в действие приложением давления, они открывают возможности для цифрового управления и автоматизации16. Кроме того, поскольку они изготовлены из одного и того же материала, они могут быть легко интегрированы в производство устройств на основе PDMS с использованием методов мягкой литографии 8,17,18. Эти особенности делают клапаны PDMS привлекательным выбором для регулирования потока в микрофлюидных устройствах. Торсен и др. использовали принцип таких клапанов для разработки жидкостного мультиплексора — комбинаторного массива пневматических клапанов — для работы с почти тысячей входных каналов потока с двадцатью каналами управления19. Этот принцип был расширен для селективного направления текучих сред в микрофлюидные хемостаты таким образом, что уникальные реакции могут быть проведены одновременно в каждом реакторе 20,21,22,23. Однако такие микрореакторы, хотя и полезны для оптимизации использования ограниченного количества реагентов, не могут распараллеливать несколько реакций и недостаточны для высокопроизводительных исследований.
Капельная микрофлюидика — это подкатегория микрофлюидики, которая включает в себя производство капель путем манипулирования несмешивающимся, многофазным потоком жидкости в микрофлюидных устройствах24. Образование капель включает в себя разрушение непрерывной текучей среды путем введения несмешивающейся жидкости, что приводит к защемлению из-за нестабильности межфазной энергии и образованию эмульсии25. Поверхностно-активные вещества способствуют образованию округлых капель, когда эмульсии покидают микроканал, стабилизируя межфазные энергии26. Более крупные капли, называемые пробками, менее стабильны и могут собираться в удерживающем отсеке (например, по длине трубки) в виде массива водных отсеков, расположенных с обеих сторон одной или несколькими несмешивающимися жидкостями27. В дополнение к миниатюризации и компартментализации, капельная микрофлюидика также обеспечивает повышенную пропускную способность биологических реакций, поскольку может быть получено большое количество монодисперсных капель, каждая из которых служит нанореактором28. Капли, однажды сгенерированные, также могут быть подвергнуты дальнейшим манипуляциям, таким как расщепление 29,30, слияние31,32, сортировка33,34 и сборка в структуры более высокого порядка35,36. Капельная микрофлюидика произвела революцию в нескольких научных областях и технологиях - от ПЦР37 до транскриптомики одиночных клеток38, от открытия лекарств39,40 до вирусологии41, от секвенирования следующего поколения42 до химического синтеза43.
Интеграция мягкой литографии и микроклапанов на основе PDMS с капельной технологией представляет собой мощную комбинацию, которая позволяет регулировать поток жидкости в микроканалах и последующий контроль содержимого капель. В зависимости от открытия и закрытия каналов можно получить отдельные популяции капель, каждая из которых имеет определенный состав. Такая платформа могла бы миниатюризировать, разделять и распараллеливать биохимические реакции и, следовательно, быть полезной техникой для комбинаторногоскрининга. Комбинаторный скрининг — это высокопроизводительный метод генерации десятков тысяч комбинаций выбранных реагентов для получения библиотек, состоящих из отдельных популяций известного состава. Комбинаторный скрининг был использован для обнаружения синергетических эффектов между лекарственными препаратами и антибиотиками для ингибирования роста бактерий45. В области терапии рака комбинаторный скрининг использовался для тестирования комбинаций противораковых препаратов для данного пациента, тем самым продвигая персонализированную терапию46,47. Mathur et al. развили эту технологию, интегрировав комбинаторный подход к штрихкодированию ДНК для оценки изменений транскриптома при высокопроизводительном скрининге лекарств48. Таким образом, комбинаторный скрининг является мощной, но зарождающейся технологией, и существует необходимость в разработке различных микрофлюидных технологий для выполнения и облегчения таких процедур скрининга.
Целью данной рукописи является представление полного набора протоколов для изготовления двухслойного микрофлюидного устройства, способного генерировать комбинаторную библиотеку водомасляных пробок, и описание аппаратного и программного обеспечения, необходимого для работы такого устройства. Поток жидкости регулируется с помощью пневматических клапанов на основе PDMS с регулируемым давлением, которые, в свою очередь, управляются специальной программой LabVIEW. Расход реагентов в аппарате достигается с помощью имеющихся в продаже нагнетательных насосов. Представлен прототип с восемью входами, в котором пробка образована содержимым трех входных отверстий, каждое из которых содержит водный реагент. Водная фаза встречается с непрерывной масляной фазой, а пробки производятся на Т-образном переходе с частотой 0,33 Гц. Функционирование системы демонстрируется путем создания количественной библиотеки, содержащей три различные популяции флуоресцентных свечей. Эта технология и набор протоколов помогут ускорить создание комбинаторных библиотек для целей высокопроизводительного скрининга.
Protocol
1. Мягкая литография
ПРИМЕЧАНИЕ: Микрофлюидное устройство состоит из двух слоев, проточного слоя и контрольного слоя (рисунок 1A), и каждый слой отлит из пластин с индивидуальным рисунком с использованием положительного и отрицательного фоторезиста соответственно (см. Таблицу материалов для получения подробной информации о фоторезисте и проявителях).
- Выполните изготовление пластин для слоя потока, как описано ниже.
- Обезвоживайте кремниевую пластину (диаметром 100 мм, ориентированная <1-0-0> 525) в течение ночи (12-16 часов) при 250 °C.
- Дайте пластине остыть, прежде чем приступать к отжиму. Нанесите 3-4 мл позитивного фоторезиста на центр пластины.
- Отжим в течение 40 с при 1400 об/мин (344 об/мин), чтобы получить высоту элемента 45 мкм.
- Мягкий выпекайте на конфорке с помощью температурного нарастания, повышая со скоростью 450 °С/ч, от 35 °С до 105 °С. Этот этап также может быть выполнен на тканях из микрофибры, чтобы предотвратить прямой контакт и свести к минимуму пузырьки фоторезиста. Снимите пластину с конфорки и дайте ей остыть на салфетках из микрофибры.
- Поместите фотошаблон (промышленного производства), соответствующий проточному слою (эмульсионной стороной вниз), на кремниевую пластину с резистивным покрытием и экспонируйте ее под УФ-лампой со скоростью 10 мВт/см2 до достижения общей экспозиции 200 мДж/см2 .
- Используйте две конфорки - одну при 65 °C, а другую при 95 °C - для выполнения выпечки после выдержки - в течение 1 мин и 7 мин соответственно - на тарелках.
- Проявите пластину, перенеся ее в чашку Петри, заполненную проявителем для положительного фоторезиста. Взбалтывайте чашку Петри, встряхивая ее на настольном шейкере с полностью погруженной пластиной, и периодически обновляйте раствор проявителя до тех пор, пока пластина полностью не проявится, и ее свойства не будут четко видны.
- Используйте деминерализованную воду, чтобы смыть остатки резиста с пластины, и проверьте под стереомикроскопом наличие остатков внутри каналов. Удалите остатки, вернув пластину в раствор проявителя или осторожно добавив проявитель в пластину с помощью микропипетки. После завершения высушите пластину с помощью пистолета-распылителя азота.
- Осушите пластину, поместив ее на конфорку, установленную на 110 °C, на 25 минут. Этот процесс приводит к округлению объектов.
- Приступайте к силанизации пластины, как описано в шаге 1.3.
ПРИМЕЧАНИЕ: Осаждение из паровой фазы гексаметилдисилазана (HMDS) также может быть выполнено на кремниевых пластинах перед нанесением резиста для улучшения адгезии между резистом и пластиной.
- Выполните изготовление пластин для управляющего слоя, как описано ниже.
- Возьмите еще одну кремниевую пластину и обезвоживайте, поместив ее на конфорку, установленную при температуре 110 °C, на 15 минут.
- Извлеките пластину и дайте ей остыть до комнатной температуры, прежде чем приступать к отжиму.
- Нанесите 5 мл негативного фоторезиста на центр пластины.
- Используйте следующий протокол вращения для получения высоты элемента 40 мкм: 5 с при 500 об/мин (ускорение 100 об/мин), 33 с при 1400 об/мин (300 об/мин) и, наконец, замедлитесь до 0 об/мин в течение 5 с при 300 об/мин.
- Выпекайте мягкую выпечку с помощью двух отдельных конфорок, установленных на 65 °C и 95 °C в течение 1 и 15 минут соответственно. Снимите пластину с конфорки и дайте ей остыть на салфетках из микрофибры.
- Поместите фотошаблон (промышленного производства), соответствующий контрольному слою (эмульсионной стороной вниз), на пластину с резистивным покрытием и экспонируйте пластину под УФ-лампой, установленной на 15 мВт/см2, до достижения общей экспозиции 250 мДж/см2 .
- Используйте две конфорки - одну при 65 °C, а другую при 95 °C - и выполняйте выпекание пластины после выдержки в течение 2 минут, а затем 5 минут соответственно. Снимите пластину с конфорки и дайте ей остыть на салфетках из микрофибры.
- Проявите пластину, перенеся ее в чашку Петри, заполненную проявителем для негативного фоторезиста на 4 минуты. Обновите проявитель и продолжайте процесс еще 4 минуты.
- Промойте пластину изопропанолом, чтобы удалить остатки фоторезиста, и с помощью стереомикроскопа проверьте пластину на наличие остатков внутри каналов.
- Удалите остатки, вернув пластину в раствор проявителя или осторожно добавив проявитель в пластину с помощью микропипетки. После завершения высушите пластину с помощью пистолета-распылителя азота.
- После полного проявления запекайте фоторезист, поместив пластину на конфорку, установленную при температуре 95 °C, на 10 минут.
- Приступайте к силанизации, как описано в шаге 1.3.
- Проведите силанизацию, как описано ниже.
- Поместите клеевую пластину в эксикатор. Поместите стеклянный флакон в эксикатор и добавьте 4-5 капель 1,1,3,3 тетраметилдисилоксана.
ВНИМАНИЕ: 1,1,3,3 тетраметилдисилоксан не токсичен, но легко воспламеняется. Можно использовать и другие силаны, но они могут быть токсичными. Рекомендуется проводить силанизацию в вытяжном шкафу при наличии необходимых средств индивидуальной защиты (СИЗ), таких как лабораторный халат, очки и нитриловые перчатки. - Вытяните вакуум на 15 минут и закройте эксикатор на 12-16 часов, чтобы силан осел на пластине.
- Откройте эксикатор и утилизируйте стеклянную бутылку. Поместите в чистую чашку Петри.
- Поместите клеевую пластину в эксикатор. Поместите стеклянный флакон в эксикатор и добавьте 4-5 капель 1,1,3,3 тетраметилдисилоксана.
- Выполните изготовление микрофлюидных устройств, как описано ниже.
ПРИМЕЧАНИЕ: Следующий протокол был адаптирован из предыдущих работ23.- Подготовьте два отдельных решения PDMS - одно для проточного слоя и одно для контрольного уровня. Для каждого раствора смешайте в стакане базовый агент и отвердитель из набора PDMS и перемешайте с помощью смесительного стержня. Для контрольного слоя требуется 10 г базового агента и 0,5 г отвердителя (в соотношении 20:1), а для проточного слоя требуется 40 г базового агента и 8 г отвердителя (соотношение 5:1).
- Дегазируйте растворы PDMS в эксикаторе до тех пор, пока растворы не станут свободными от газа.
- Поместите силанизированную проточного слоя в чашку Петри, покрытую фольгой, и полейте пластину соответствующим раствором PDMS. Поместите чашку Петри обратно в эксикатор и потяните вакуум для дальнейшей дегазации (примерно на 20 минут).
- Покройте силанизированную пластину управляющего слоя соответствующим раствором PDMS. Налейте 3-4 мл раствора на центр пластины и отжимайте в течение 20 с при 1500 об/мин при 408 об/мин. Поместите на ровную поверхность в закрытую чашку Петри на 20 минут.
- Поместите проточный и контрольный слои в духовку при температуре 80 °C на 18-20 минут. Периодически следите за двумя слоями, чтобы проверить, затвердевают ли они. Слои готовы, когда они достаточно прочные, чтобы быть податливыми, но слегка липкими, так как это улучшает сцепление между двумя слоями.
- Вырежьте скальпелем PDMS вокруг каждого из устройств на пластине проточного слоя. Убедитесь, что вы не обрезаете слишком близко к элементам и оставляете примерно 2 см пространства между элементом и краями PDMS. После отсоединения от кремниевой пластины заклейте блок PDMS лентой со стороны элемента, чтобы избежать загрязнения пылью.
- После того, как все блоки PDMS вырезаны, поместите их один за другим на соответствующую пластину управляющего слоя, выполнив грубое выравнивание на глаз.
- После того, как все блоки размещены на соответствующих участках управляющего слоя, отрегулируйте положение каждого из блоков таким образом, чтобы регулирующие клапаны перекрывались над соответствующими проточными каналами для завершения выравнивания. Это также можно сделать с помощью стереомикроскопа.
- Удалите воздушные карманы между двумя слоями, надавливая. Если воздушный карман находится на объекте или рядом с ним, следите за тем, чтобы каналы не схлопывались при давлении.
- Поместите устройства в духовку при температуре 80 °C и оставьте их сцепляться на 12-16 часов. Поместите грузы весом 100 г на каждое из устройств, чтобы улучшить сцепление между двумя слоями.
- Выньте пластину и вырежьте каждое отдельное устройство. Снимите устройства с пластины управляющего слоя и заклейте функциональную сторону скотчем.
- Поместите каждое отдельное устройство на коврик для резки стороной вверх и проделайте отверстие для каждого из восьми входных отверстий проточного слоя, восьми входных отверстий канала контрольного слоя, входных отверстий для масла и выпускного отверстия с помощью биопсийного пуансона 0,75 мм стороной элемента вверх.
- Загрузите плазменный азер предметным стеклом микроскопа и одним устройством со снятой лентой и стороной элемента вверх. Провести кислородное плазменное озоление мощностью 30 Вт в течение 20 с.
- Как только озоление будет завершено, возьмите устройство и выдвиньте стекло и поместите устройство функциональной стороной вниз на предметное стекло. Адгезия между PDMS и стеклом должна быть сразу видна невооруженным глазом. Надавите на любые участки с воздушными карманами, чтобы выдавить воздух.
- Поместите устройства на конфорку, установленную на 110 °C, на 60 мин с грузом сверху, чтобы улучшить сцепление PDMS со стеклом.
2. Настройка оборудования
Примечание: Схема соединений с микрофлюидным устройством показана на рисунке 1B , а реализация такой схемы с использованием необходимого оборудования показана на рисунке 2.
- Настройте пневматические клапаны, как описано ниже.
ПРИМЕЧАНИЕ: Каждый канал управления, который регулирует клапан PDMS на чипе, в свою очередь, управляется одним электромагнитным клапаном. Представленный здесь прототип состоит из восьми каналов управления (рис. 1A), и, следовательно, требуется восемь электромагнитных клапанов.- Электромагнитные клапаны управляются с помощью специальной программы LabVIEW (Main Interface Program; Рисунок 3 и дополнительный файл 1, дополнительный файл 2, дополнительный файл 3, дополнительный файл 4). Эта программа отправляет команды MODBUS через TCP-соединение (дополнительный файл 5, дополнительный файл 6) контроллеру WAGO. Подключите устройство WAGO к компьютеру с помощью программы LabVIEW с помощью кабеля Ethernet. Последовательно подключите электромагнитные клапаны к портам контроллера WAGO. Более подробное описание см. в ранее описанном протоколе23.
- Подключите блок электромагнитных клапанов к источнику сжатого воздуха с помощью трубки 1/4 дюйма и установите давление блока клапанов на 3,5 бар. В этой системе использовались восемь клапанов с маркировкой 9-16.
- Настройте регуляторы давления, как описано ниже.
ПРИМЕЧАНИЕ: Для управления потоком жидкости используется коммерчески доступный нагнетательный насос (Рисунок 2). Восьмилинейный и четырехлинейный насосные агрегаты использовались для размещения восьми водных и двух масляных входов в устройстве. Давление в каждом порту регулируется с помощью программного обеспечения, предоставляемого производителями.- Подключите нагнетательный насос к источнику сжатого воздуха, убедившись, что подаваемое давление не превышает максимально допустимое давление насоса (2,2 бар для восьми- и четырехлинейного контроллеров).
- Подключите нагнетательные насосы к компьютеру с помощью USB-разъема.
- После включения насосы должны быть видны в соответствующем программном обеспечении. Установите давление на ноль во время настройки насосов.
- Подключите штекерный люэр к разъему 3/32 дюйма с зазубринами к каждому из 12 выходных портов люэровского замка на контроллерах.
- Подсоедините кусок мягкой трубки (внешний диаметр: 3 мм, внутренний диаметр: 1 мм, L: 15 см) к заусенице. Подсоедините еще один люэр с наружной резьбой к разъему 3/32 дюйма с заусеницей с другим концом мягкой трубки.
- Подсоедините заглушку люэра (23 G, 0,5 дюйма) к разъему с заусеницей. На этом этапе регулятор давления настроен и готов к использованию.
3. Настройка микрофлюидного устройства
- Подсоедините трубку канала управления, как описано ниже (рисунок 2).
- Для каждого канала управления отрежьте отрезок трубки из политетрафторэтилена (ПТФЭ) (внешний диаметр: 0,042 дюйма, внутренний диаметр: 0,022 дюйма). Вставьте штифт заглушки 23 G, 0,5 дюйма люэра на одном конце.
- Подсоедините заглушку люэра к штекерному люэру с нейлоновым разъемом 3/32. Вставьте штуцер соединителя в отрезок полиуретановой трубки (внешний диаметр: 4 мм, внутренний диаметр: 2,5 мм). Подсоедините другой конец полиуретановой трубки непосредственно к электромагнитному клапану.
- Наполните шприц водой и подсоедините на конце заглушку 23 г, 0,5 дюйма люэра.
- Подсоедините свободный конец трубки из ПТФЭ к шприцу и впрыскивайте воду примерно до середины трубки.
- Отсоедините трубку от шприца и вставьте свободный конец трубки в пробитое отверстие соответствующего канала управления (рисунок 1A-C 1-8). Повторяйте до тех пор, пока каждый канал управления не будет подключен к соответствующему электромагнитному клапану.
ПРИМЕЧАНИЕ: В данной статье электромагнитные клапаны 9-16 были подключены к каналам управления, соответствующим соответственноС1-С8. Хотя они могут быть соединены любым способом, важно помнить о порядке и последовательности соединений, особенно при работе с программой Main Interface. - Используйте программу Main Interface (Рисунок 3), чтобы открыть все электромагнитные клапаны (Pressure urize all control channels). Это вытолкнет жидкость из трубки в каналы управления микрофлюидного устройства и тем самым заполнит его. Пример клапанов под давлением и без давления показан на рисунке 4.
- Подключите реагенты и загрунтуйте устройство, как описано ниже.
- Убедитесь, что все каналы управления находятся под давлением, нажав кнопку Pressureurize all Control Channels в программе Main Interface (рисунок 3).
- Для каждого из водных реагентов отрежьте сегмент трубки из ПТФЭ (внешний диаметр: 0,042 дюйма, внутренний диаметр: 0,022 дюйма) достаточно длинный, чтобы подсоединить насосы к входным отверстиям микрофлюидного устройства. Подсоедините одну из трубок к заглушке Люэра, начиная с шага 2.2.6.
- Наполните шприц необходимым реагентом и подсоедините на конце заглушку 23 г, 0,5 люэра.
- Вводите реагент в соответствующую трубку из ПТФЭ до тех пор, пока трубка не заполнится. Следите за тем, чтобы реагент не попал в выходное отверстие на насосном агрегате.
- Вставьте свободный конец трубки в соответствующее впускное отверстие в микрофлюидной стружке.
- Приложите давление 400 мбар к каждому входному водному реагенту с помощью прилагаемого программного обеспечения.
- Последовательно сбросьте давление в каналах управления по отдельности с помощью программы Main Interface (рис. 3), чтобы убедиться, что все реагенты достигли Т-образного соединения устройства. При необходимости приводите в действие отдельные клапаны, нажимая соответствующие кнопки в программе в блоке Каналы управления Ручное давление давления.
- Повторите шаги с 3.2.3 по 3.2.5 для нефтяных реагентов. Приложите давление 400 мбар к каждому из входных масляных реагентов.
- Одновременно сбросьте давление во всех каналах управления, нажав кнопку Сброс давления во всех каналах управления (рис. 3), пока весь воздух не будет удален из устройства. Это можно наблюдать невооруженным глазом или под микроскопом.
- Создайте давление во всех каналах управления, нажав кнопку Нагнетание всех каналов управления (рисунок 3). На этом этапе все реагенты подключены, устройство загрунтовано и готово к использованию.
- Запрограммируйте и выполните эксперимент, как описано ниже.
- Закодируйте состав, последовательность и реплики каждой популяции свечей, которые будут созданы, в файл .csv, как показано в дополнительном файле 7 , который служит входными данными для автоматического эксперимента в программе Main Interface (рисунок 3). Отметьте необходимые каналы управления 0, если они соответствуют входу, который должен быть открыт, и 1, если его нужно закрыть. Каждая строка в файле .csv соответствует одной отдельной популяции плагинов.
- Загрузите .csv в программу Main Interface, нажав кнопку Folder на вкладке Experiment File .
- Введите соответствующие поля в программе, такие как «Итерации эксперимента» (чтобы определить, сколько раз была произведена заданная последовательность свечей), «Время разгерметизации» (чтобы определить, как долго необходимо открыть входные каналы и разгерметизировать соответствующий управляющий канал в миллисекундах), «Время наддува» (чтобы определить, как долго необходимо закрывать входные отверстия между последовательностями заполнения пробок в миллисекундах).
- Выберите входные каналы, соответствующие производству штрихкодов, в разделе Входы штрихкодов (до 3 каналов), а также продолжительность, в течение которой они должны быть открыты (Время штрихкодирования (мс)). Кроме того, эти штрихкоды также могут быть жестко закодированы во входном файле .csv, как показано в дополнительном файле 7.
- Уменьшите давление входных масляных реагентов до 200 мбар.
- Подсоедините трубку из ПТФЭ (внешний диаметр: 0,042 дюйма, внутренний диаметр: 0,022 дюйма) нужной длины к выходу, чтобы собрать заглушки. Чтобы обеспечить равномерное производство пробки, используйте для сбора трубки длиной около 100 см, предварительно заполненные пробками. Это необходимо для нейтрализации разницы давления на выходе, которая возникает из-за скопления пробок в трубке.
- Нажмите кнопку Run Experiment, чтобы запустить программу и подключить рабочую среду.
- Выполните запись и анализ данных, как описано ниже (см. рис. 5).
ПРИМЕЧАНИЕ: В этом разделе конкретно описывается метод анализа флуоресцентных свечей. В зависимости от характера образующихся заглушек этот раздел может быть изменен по мере необходимости.- Наполните шприц маслом (минеральным или фторированным) и подсоедините на конце заглушку 23 G 0,5 in люэра. Закрепите шприц на насосе.
- Подсоедините один из концов заполненной трубки для сбора к заглушке Люэра на шприце. Прикрепите другой конец заполненной коллекторной трубки над линзой объектива микроскопа.
- Поместите резервуар для отходов под концом трубки рядом с целью.
- Сфокусируйте микроскоп на заданной области трубки и настройте его на запись флуоресценции в нужном канале (каналах).
- Установите расход насоса на 50 μл/мин.
- Запишите видео флуоресцентного канала в виде файла .avi.
- Проанализируйте файл .avi с помощью прилагаемого скрипта Python (дополнительный файл 8) для извлечения средней флуоресценции в предопределенной области интереса (ROI) на кадр файла .avi (пример приведен в дополнительном файле 9).
- Используйте предоставленный настраиваемый скрипт R (дополнительный файл 10) для извлечения условий и построения графика исходных данных и высот пиков.
ПРИМЕЧАНИЕ: Сценарий R из дополнительного файла 10 был использован для анализа в этой статье. Пользовательские функции R, используемые в этом скрипте для резки данных, определения условий с помощью штрихкодов и анализа высот пиков для отдельных свечей и построения графиков, представлены в дополнительном файле 11.
Representative Results
Одной из важнейших особенностей микрофлюидного чипа являются клапаны PDMS, и их способность регулировать поток жидкости была охарактеризована, поскольку она влияет на парадигму работы устройства. С этой целью расход дистиллированной воды (измеренный с помощью коммерческого датчика расхода) через входные каналы регистрировался в зависимости от различных входных давлений при периодическом повышении давления (3,5 бар в течение 2000 мс) и сбросе давления (1000 мс) клапанов PDMS (рис. 6A). Было замечено, что клапаны способны регулировать расход жидкости примерно до 800 мбар входного давления, о чем свидетельствует падение расхода до нуля при срабатывании клапанов (рисунок 6 B-D). Это подтверждает обоснованность использования таких клапанов на основе PDMS для регулирования потока реагентов внутри каналов. Кроме того, при давлении 1200 мбар входное давление слишком велико для того, чтобы клапаны могли регулировать расход, о чем свидетельствует то, что расход не снижается до нуля (рис. 6E). В то время как продолжительность наддува и сброса давления клапанов PDMS может быть изменена, рассчитана скорость изменения расхода жидкости при текущих условиях наддува (2000 мс) и разгерметизации (1000 мс). При входном давлении 400 мбар поток можно включать и выключать с частотой 1,26 Гц и 1,44 Гц соответственно (рис. 6C).
Предыдущие итерации аналогичного комбинаторного высокопроизводительного микрофлюидного устройства также включали отработанный канал, соединенный с каждым проточным каналом46,47. Эти устройства работали в режиме постоянного расхода (когда реагенты впрыскивались в устройство при постоянном расходе, а не при постоянном давлении), а сточные каналы были запрограммированы на открытие, когда их соответствующие входные каналы были закрыты, чтобы уменьшить любое повышение давления. Такие каналы, хотя и полезны, приводят к потере реагентов, поскольку содержимое отработанного канала не способствует образованию пробки. Кроме того, дополнительные каналы управления и, следовательно, дополнительные насосы также необходимы для регулирования открытия и закрытия сливных каналов. В представленном здесь прототипе были удалены каналы отходов, и была установлена операционная парадигма, которая позволяет сократить потери реагентов и уменьшить сложность конструкции и эксплуатации. Это включает в себя впрыскивание водных реагентов в режиме постоянного давления, а не в режиме постоянного расхода. Для лучшего понимания этих двух режимов в каждом случае оценивалась зависимость между давлением и расходом в каналах во время приведения в действие клапана (с использованием той же установки, что показана на рисунке 6A), результаты которой показаны на рисунке 7. На рисунке 7A был измерен расход дистиллированной воды при впрыске при постоянном давлении (300 мбар), и было замечено, что во время приведения в действие клапана расход падает до нуля, а при сбросе давления в клапане расход восстанавливается до уровней, предшествовавших срабатыванию. Однако в режиме постоянного расхода, при котором давление в каналах регистрировалось при закачке дистиллированной воды с постоянным расходом (2,5 мкл/мин; Рисунок 7B), срабатывание клапана не привело к полному закрытию впускного отверстия, о чем свидетельствует то, что расход не упал до нуля, и наблюдалось повышение давления в канале. Это давление, которое снимается при открытии каналов для отходов. Поскольку режим постоянного входного давления позволяет устройству работать без противодавления при срабатывании клапана, тем самым устраняя необходимость в отводящих каналах, этот режим был принят для работы микрофлюидного чипа.
Для демонстрации функциональности микрофлюидного устройства была сформирована количественная комбинаторная библиотека флуоресцентных свечей. К восьми входам аппарата три водных реагента – флуоресцеин (50 мкМ) в четырех входах (I1Я3, Я5, Я7), дистиллированная вода в трех входных отверстиях (I4Я6, Я8), одно входное отверстие с синим красителем (I2; действовать как штрих-код) - и два масляных реагента - фторированное масло (FC-40) и минеральное масло (MO) на входе O1 и O2, соответственно - были подключены (Рисунок 1А, Рисунок 8А). Фторированное масло служит несущей фазой, в которой рассеиваются водные пробки, а минеральное масло способствует стабильности пробок и сводит к минимуму адгезию содержимого пробки к стенкам, тем самым сводя к минимуму перекрестное загрязнение между пробками46. С тремя входными отверстиями, вносящими свой вклад в состав одной популяции пробки, эта конфигурация может генерировать три различные флуоресцентные популяции: FFF, состоящую из флуоресцеина из трех каналов, FFW, состоящую из флуоресцеина из двух каналов и воды из одного канала, и FWW, состоящую из флуоресцеина из одного канала и воды из двух каналов. При такой установке существует 12 различных условий (популяции пробок, произведенных с помощью определенной комбинации из трех входов), которые могут производить пробки FWW, 18 различных условий, которые могут производить вилки FFFW, и четыре различных условия, которые могут производить пробки FFF. Таким образом, чип был запрограммирован на создание этих 34 различных условий с пятью различными репликами разъемов в каждом, а также пятью репликами разъемов со штрих-кодом, разделяющих их. Рекомендуется чередовать популяции флуоресцентных пробок с популяцией штрих-кода, т.е. набором цветных (в идеале нефлуоресцентных) пробок (в данном случае образованных открытием входных каналов, соответствующих синему красителю, и двух каналов дистиллированной воды), которые видны невооруженным глазом. Это позволяет пользователю контролировать производство пробок на наличие таких проблем, как разрушение или сплавление пробок, и помогает в последующем анализе пробок. Таким образом, в общей сложности 340 пробок - 170 экспериментальных пробок и 170 пробок штрих-кодирования, разделяющих различные условия, - были сгенерированы и собраны в трубках из ПТФЭ, образец которых показан в Рисунок 8В. Время разгерметизации и время наддува были установлены на уровне 1000 мс и 2000 мс соответственно. Была проанализирована флуоресценция пробок и их изменчивость в различных экспериментальных условиях и между ними, результаты которого представлены в Рисунок 8С,D. Рисунок 8С показывает флуоресценцию на кадр файла .avi, сгенерированного на шаге 3.4.6, который выделяет 34 рассматриваемых экспериментальных условия (разграничены синей линией). Среднее значение флуоресценции пиков в условиях показано красным цветом, а пунктирные линии указывают на стандартную ошибку в этом условии. Высоты пиков всех пробок в каждой популяции, полученные путем вычитания исходной флуоресценции из максимальной флуоресценции, обнаруженной в каждом пике, были нанесены на график Рисунок 8D. Последний пик в каждом условии не учитывался при расчетах, так как это была загрязненная пробка из-за смешивания реагентов на Т-образном переходе (поскольку флуоресценция пробок регистрировалась в порядке, обратном образованию пробки, первая пробка в популяции во время производства является последней пробкой в популяции во время анализа). Было очевидно, что высота свечей FWW составляет около одной трети (среднее значение = 40,9, стандартное отклонение = 3,1), а высота свечей FFFW составляет около двух третей (среднее значение = 78,4, стандартное отклонение = 5) от высоты свечей FFF (среднее значение = 117, стандартное отклонение = 10). Эти результаты соответствуют ожидаемым пропорциям флуоресценции в различных популяциях разъемов FF/FFW/FWW, что подчеркивает надежность устройства и его функционирование.
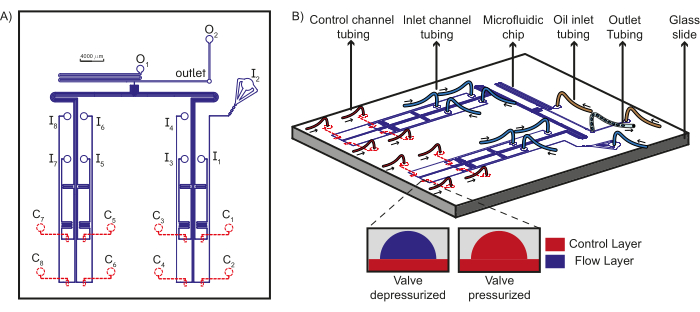
Рисунок 1: Схема конструкции устройства и микрофлюидной установки. (A) Проточный слой чипа показан синим цветом, а уровень управления - красным. В общей сложности восемь уникальных водных реагентов могут протекать через входные отверстия (I1-8) к Т-образному соединению, где они встречаются с масляными фазами из масляных входов (O1-2), образуя пробки, которые собираются на выходе. Каждый входной канал потока находится под управлением уникального канала управления (C1-8). (B) Схема микрофлюидного чипа вместе с соединениями трубок с входными отверстиями, каналами управления и масляными реагентами показана вместе с выходными трубками. Стрелки указывают направление потока жидкости в трубке. На врезке показан принцип работы клапанов PDMS. Пунктирные линии указывают, что слой управления находится под слоем потока. Эта цифра была изменена по сравнению с Dubuc et al49. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
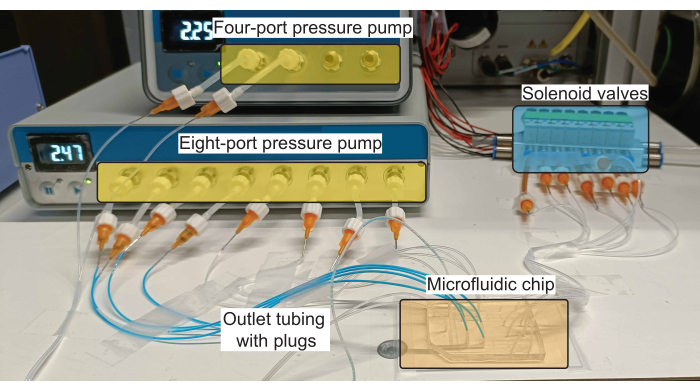
Рисунок 2: Схема аппаратной настройки для производства плагинов. Нагнетательные насосы управляют потоком реагентов (как водных, так и масляных) во впускных каналах, а электромагнитные клапаны управляют приведением в действие клапанов PDMS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Основная интерфейсная программа для управления микрофлюидным устройством. Эта индивидуальная программа позволяет вручную управлять давлением отдельных пневматических клапанов (белая панель). Он также позволяет выполнять полный эксперимент (синяя панель), где он принимает файл .csv с желаемым количеством пробок и необходимыми параметрами, такими как время нагнетания и сброса давления клапана, и отображает статус выполнения эксперимента, в том числе то, какие каналы управления находятся под давлением, а какие нет, в режиме реального времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Иллюстрация 4: Привод клапана под давлением. Светлопольные микроскопические изображения (A) сброса давления в клапане PDMS (горизонтальном) и открытии входного канала (вертикального) и (B) клапана PDMS под давлением и перекрытия входного канала. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
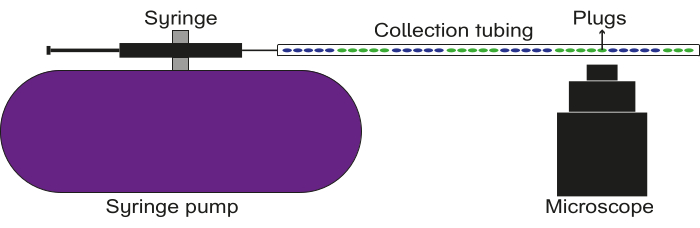
Рисунок 5: Схема настройки записи данных. Трубка для сбора соединяется со шприцем с маслом, который прикреплен к насосу. Пробки пропускаются через трубку для сбора, а изображения/видео снимаются с помощью флуоресцентного микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
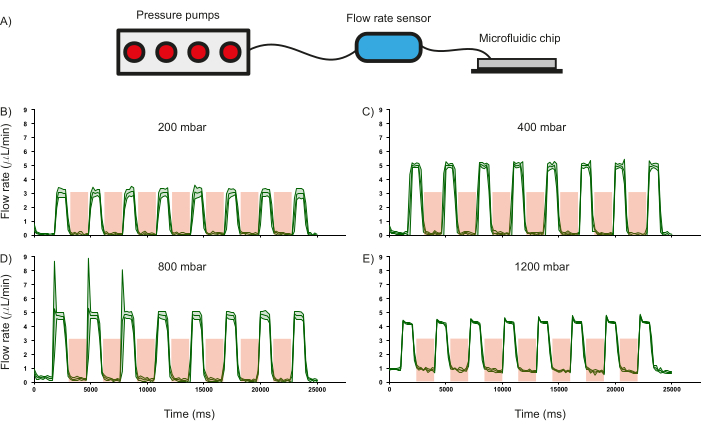
Рисунок 6: Влияние срабатывания клапана на расход при заданном входном давлении. (A) Схема аппаратной установки, используемой для контроля расхода в микрофлюидных каналах. Чувствительность расхода в каналах при работе при различных входных давлениях (B) 200 мбар, (C) 400 мбар, (D) 800 мбар и (E) 1200 мбар. Продолжительность срабатывания клапана показана в красной затененной области. Для всех экспериментов использовалась дистиллированная вода. Стандартное отклонение трех независимых измерений показано зеленой заштрихованной областью. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
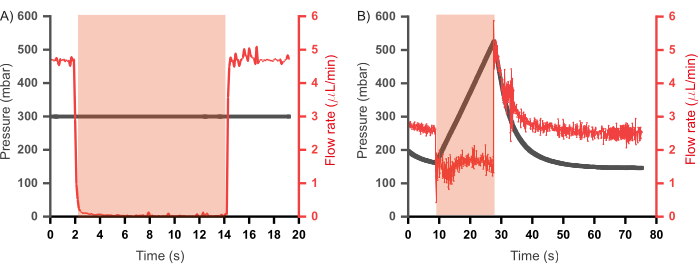
Иллюстрация 7: Соотношение между давлением и расходом реагентов во входных каналах при срабатывании клапана. (A) В режиме постоянного входного давления (300 мбар) клапана расход снижается до нуля при срабатывании клапана. (B) В режиме постоянного расхода (2,5 мкл/мин) срабатывание клапана приводит к быстрому повышению давления в канале до тех пор, пока давление в клапане не будет сброшено. Продолжительность срабатывания клапана показана в красной затененной области. Для всех экспериментов использовалась дистиллированная вода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
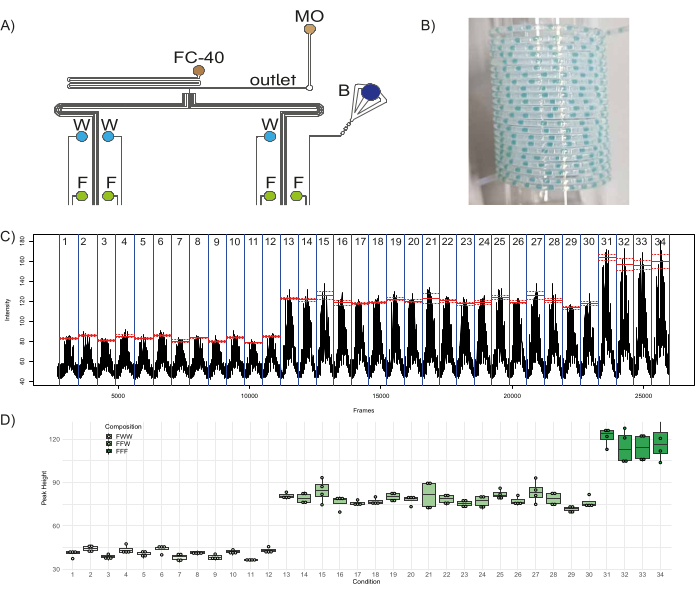
Рисунок 8: Производство популяций флуоресцентных свечей. (A) Схема экспериментальной установки, изображающая соединение различных реагентов с устройством. Сокращения: F = флуоресцеин, W = дистиллированная вода, B = синий пищевой краситель, FC-40 = фторированное масло и MO = минеральное масло. (B) Образец изображения коллекторной трубки, содержащей пробки. (C) Необработанные данные, полученные в результате анализа, показывают среднюю интенсивность флуоресценции, измеренную в указанной области интереса (ROI), в зависимости от номера кадра видеофайла. Красные линии показывают среднее значение пиковой флуоресценции для каждого условия (совокупность свечей, произведенных с определенной комбинацией из трех входов), а пунктирные линии показывают соответствующую стандартную ошибку. (D) Диаграммы высоты вершин в различных условиях. Точкам соответствуют отдельные пики, прямоугольники для каждого условия варьируются от первого до третьего квартиля распределения соответствующих пиков, а толстая линия используется для медианного значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Основная интерфейсная программа для работы с устройством. Интерфейс управления для ручного нагнетания давления в каналах управления и запуска автоматического эксперимента в восьмивходном устройстве. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Альтернативная программа главного интерфейса для работы с устройством. Интерфейс управления для работы устройства с восемью входами без функции штрихкодирования. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Подпрограмма LabVIEW с глобальными переменными. SubVI основной интерфейсной программы, перечисляющий и отображающий состояние глобальных переменных в основной интерфейсной программе, а именно каналов управления. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Программа LabVIEW для сохранения значений глобальных переменных. SubVI основной интерфейсной программы, сохраняющей текущее состояние клапанов в виде массива, который будет использоваться для поддержания одного и того же состояния клапанов в случае неактивности пользователя более 30 секунд. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: Программа LabVIEW по протоколу управления передачей (TCP). SubVI для поддержания TCP-соединения между основной интерфейсной программой и контроллером WAGO. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 6: Глобальная переменная TCP Подпрограмма LabVIEW. Программа для хранения выходной переменной TCP. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 7: Входные данные для проведения автоматического эксперимента. Файл .csv, кодирующий состав, последовательность и реплики популяций пробок для проведения экспериментов по получению количественных флуоресцентных свечей, как подробно описано в этой статье. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 8: Скрипт Python для анализа популяции флуоресцентных свечей. Пользовательский скрипт на Python для считывания значений флуоресценции из записи штекеров (файл .avi). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 9: Результаты флуоресцентного анализа свечей. Выходные данные скрипта Python, содержащего значения флуоресценции для ROI 5x5 из записи свечей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 10: Программа R для чтения выходного файла. Пользовательская программа, используемая в этой работе для считывания выходных значений флуоресценции и построения необработанных данных, высот пиков и стандартных отклонений. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 11: Функции R для анализа и построения графиков флуоресцентных данных. Пользовательские функции R, которые используются для 1. сократить исходные данные флуоресцентных значений, 2. определить различные условия эксперимента, 3. определить пики из заданных условий, 4. построить график наложения необработанных данных и обнаруженных условий и 5. Нанесение на график идентифицированных пиков и наложение необработанных данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
В данной работе представлен набор протоколов для изготовления и эксплуатации микрофлюидного устройства на основе PDMS для автоматизированной генерации комбинаторных библиотек в отсеках типа «вода в масле», называемых заглушками. Сочетание микрофлюидики с капельной технологией обеспечивает мощный метод инкапсуляции небольшого количества реагентов в большое количество отсеков, тем самым открывая возможности для крупномасштабного комбинаторного скрининга.
Ранее было описано несколько технологий для создания химически различных компартментов с помощью микрофлюидики, каждая из которых имеет свои преимущества и ограничения. Kulesa et al.50 описали стратегию инкапсуляции клеток штрих-кодами в капли с использованием микротитровальных планшетов и слияния этих капель с помощью электрического поля для создания комбинаторной библиотеки. Хотя такой подход может генерировать множество комбинаций капель, он ограничен необходимостью ручных операций в рабочем процессе. Tomasi et al.51 разработали микрофлюидную платформу для слияния капли, содержащей сфероид (свободно плавающие клеточные агрегаты), со стимулирующей каплей, тем самым позволяя манипулировать микроокружением сфероида. Этот метод позволяет изучать такие важные явления, как межклеточные взаимодействия и действие лекарств, но он имеет относительно низкую пропускную способность. Eduati et al.46 и Utharala et al.47 разработали микрофлюидную платформу на основе клапанов, которая может автоматически генерировать высокопроизводительные комбинаторные библиотеки. Однако в этих исследованиях клапаны управляются с помощью устройства Брайля, что требует громоздких этапов выравнивания между микроклапаном и микрофлюидным чипом. Ключевой особенностью системы, описанной в данной работе, является реализация пневматических клапанов PDMS для регулирования потока жидкости во входных каналах. Поскольку эти клапаны основаны на PDMS, они могут быть довольно плавно включены в этапы изготовления микрофлюидного чипа. Кроме того, они являются относительно простым вариантом для управления потоком жидкостей во впускных каналах, поскольку они могут приводиться в действие путем подачи давления через внешний источник газа. Наконец, продолжительность и последовательность нагнетания и сброса давления в этих клапанах могут быть запрограммированы, тем самым автоматизируя производство отдельных групп плунжерей с высокой пропускной способностью. Еще одной важной особенностью является использование режимов постоянного давления для впрыска реагентов через входное отверстие, что позволяет отказаться от включения сливных каналов для сброса накопления давления, возникающего в режиме постоянного расхода. Это упрощает конструкцию устройства, снижает потребность в дополнительных клапанах и оборудовании для управления клапанами сливного канала, а также минимизирует потери реагентов.
В то время как изготовление устройств с PDMS относительно несложно, реализация таких устройств требует использования обширной аппаратной атрибутики, такой как пневматические электромагнитные клапаны (для управления приведением в действие клапанов PDMS), нагнетательные насосы (для управления потоком впускных и масляных реагентов) и программное обеспечение (для регулирования электромагнитных клапанов). Несмотря на то, что они представляют собой значительные инвестиции, такая установка обеспечивает стабильность и надежность для успешной работы устройства. Кроме того, аппаратные компоненты и архитектура, описанные в этом протоколе, настраиваются модульным образом. Поэтому для некоторых модулей можно использовать альтернативы, чтобы снизить затраты или адаптировать их к конкретным потребностям. Например, существует множество насосов, которые можно использовать в зависимости от полезности, бюджета, доступности и удобства 52,53,54. Дополнительные компоненты, такие как резервуары для жидкости и регуляторы температуры, могут быть включены для чувствительных входных реагентов23. Кроме того, эта конструкция может быть увеличена или уменьшена для удовлетворения конкретных научных потребностей. Например, в этой статье описан прототип с восемью входами, который позволяет комбинировать восемь уникальных реагентов для производства пробок. Это может быть увеличено до устройства с 16 входами, что позволяет использовать большее количество входов и их более крупные комбинации. Следовательно, потребуются дополнительные каналы управления и электромагнитные клапаны для работы с входными отверстиями, но такой прототип позволяет генерировать более крупные и разнообразные комбинаторные библиотеки. Наконец, в этой статье каждая популяция пробки образуется путем открытия трех из восьми водных входных отверстий микрофлюидного устройства. Было отмечено, что для такой конфигурации давление приблизительно 200 мбар для нефтяных реагентов и 400 мбар для водных реагентов соответствует режиму производства пробки, который приводится в действие исключительно приводом клапана. Когда к маслу (маслам) прикладывалось более высокое давление, наблюдалось разрушение свечей, а применение более низкого давления приводило к расплавлению свечей. Оптимальный режим давления для производства пробок зависит от широкого спектра факторов, таких как количество входов, способствующих образованию пробки, характер и вязкость жидкостей, а также размеры каналов, и должен быть оптимизирован по мере необходимости.
Одним из недостатков работы в режиме постоянного давления является то, что жидкости с разной вязкостью имеют разную скорость потока при постоянном давлении. Поэтому необходимо убедиться, что водные реагенты, протекающие через входные отверстия, имеют сопоставимую вязкость. Использование жидкостей различной вязкости повлияет не только на поток жидкости во входных каналах, но и на образование пробки на Т-образном переходе, тем самым ставя под угрозу состав популяций пробки. Еще одним недостатком является загрязнение популяции пробок остаточными реагентами на Т-образном переходе. Когда устройство переключается между производством различных популяций свечей, первая/последняя вилка в последовательности каждой популяции имеет тенденцию к загрязнению предыдущей или следующей популяцией. Это можно преодолеть, создав дополнительные реплики каждой популяции и не считая загрязненной пробки во время анализа. Наконец, существует также возможность различий между отдельными устройствами, возникающих из-за несоответствий в изготовлении и/или внешних источников (колебания давления). Эту проблему можно смягчить, повторно используя один микрофлюидный чип несколько раз и гарантируя, что полный запуск комбинаторной библиотеки выполняется на одном чипе, чтобы свести к минимуму влияние этих несоответствий.
Микрофлюидное устройство и сопутствующий набор операционных протоколов, представленных в этой статье, были использованы для демонстрации создания количественной комбинаторной библиотеки свечей. Таким образом, эта платформа может быстро генерировать комбинаторные библиотеки различных популяций плагинов с высокой пропускной способностью. В результате, такие технологии могут быть использованы для различных целей скрининга, включая, но не ограничиваясь этим, комбинаторный скрининг лекарственного препарата на образцах биопсии пациента, посредством чего небольшое количество клеток, извлеченных из биопсии, может быть распределено в большом количестве капель и обработано большой комбинацией противоракового препарата для оптимизации индивидуальной терапии для данного образца пациента и, таким образом, ускорить персонализированнуютерапию рака. 48,55.
Disclosures
Ф. Э. — фрилансер TheraMe! АГ. Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Acknowledgements
Мы хотели бы поблагодарить Стейси Мартина из NanoLab TuE за помощь в осаждении паров HMDS. Это исследование финансировалось Институтом сложных молекулярных систем (ICMS) при TU/e и Нидерландской организацией научных исследований (NWO) Программа гравитации IMAGINE! (номер проекта 24.005.009).
Materials
| Name | Company | Catalog Number | Comments |
| 1,1,3,3 tetramethyldisiloxane | Merck Life Science NV | MFCD00008256 | |
| 4 channel digital input/output module | WAGO Kontakttechnik GmbH | 750-504 | |
| Acetone | Boom Labs | BOOMSKEUZW3 | |
| Analysis Software | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE | |
| AZ 40XT 11D | Merck Life Science NV | 212299 | Positive photoresist |
| AZ 726 MIF developer | Merck Life Science NV | 10055824960 | Developer for positive photoresist |
| Biopsy Punch, Rapid Core | World Precision Instruments Germany, GMBH | 504529 | 0.75 mm ID, W/Plunge |
| Blue food dye | PME | FC1036 | |
| Controller end module | WAGO Kontakttechnik GmbH | 750-600 | |
| Ethernet Controller | WAGO Kontakttechnik GmbH | 750-881 | |
| FC-40 | Merck Millipore | F9755-100ML | |
| Fluigent flow unit | Fluigent | FLU-S-D | |
| Fluigent pressure system | Fluigent | MFCS-EZ | 0 - 2 bar |
| Fluorescein | Merck Life Science NV | MFCD00005050 | |
| Hot plate | Torrey Pines Scientific | HP61 | |
| Inverted microscope | Nikon Instruments | Eclipse Ti-E | |
| Isopropanol | Boom Labs | BOOMSKEUZE3 | |
| LabVIEW (Software Version 20) | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/tree/main/LabVIEW_8_inlet_device_ VERSION_1 | All files have been saved for LabVIEW version 20. It is advised to use this version or higher to open the files. |
| Luer stubs | Instech Laboratories, Inc. | LS23 | 23 ga, 0.5" |
| Male Luer to barb connectors | Cole Parmer | 45505-32 | 3/32" ID |
| MasterFlex PTFE tubing | Avator/VWR | 48634 | |
| Microscope Slides | VWR | 470150-480 | |
| Microscope slides, Plain | Corning | 2947-75X50 | |
| Mineral Oil | Merck Millipore | 330760-1L | |
| mr DEV 600 | Micro resist Technology | R815100 | Developer for negative photoresist |
| Oven | Thermo Scientific | Heraeus T6P 50045757 | |
| Oxygen plasma asher | Quorum Technologies | K1050X | |
| Photomask | CAD/Art Services, Inc. | ||
| Photomask Design | Eindhoven University of Technology (Adapted from Merten Lab, EPFL) | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/blob/main/8_inlet_JoVE_device_design.dwg | |
| Pneumatic valve array | FESTO | 1x 8 valve array, Normally closed valves | |
| Silicon Wafers | Silicon Materials | <1-0-0>, 100 mm diameter, 525 μm thickness | |
| Single edge blades | GEM Scientific | ||
| Soft tubing | Fluigent | 1 mm ID, 3 mm OD | |
| Spin coater | Laurell Technologies Corporation | WS-650MZ-23NPPB | |
| Stereo microscope | Olympus Corporation | SZ61 | |
| SU-8 3050 | Kayakli Advanced Materials | Y311075 1000L1GL | Negative photoresist |
| Sylgard 184 Silicone Elastomer Kit (PDMS) | Dow | 1317318 | |
| Syringe | B Braun Injekt - F Fine Dosage Syringe | 10303002 | |
| UV-LED exposure system | Idonus | UV-EXP150S-SYS | |
| Vacuum pump | Vacuumbrand GmbH | MD1C | |
| Weighing scales | Sartorius | M-prove |
References
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Terry, S. C., Herman, J. H., Angell, J. B. A gas chromatographic air analyzer fabricated on a Silicon wafer. IEEE Transactions on Electron Devices. 26 (12), 1880-1886 (1979).
- Mellors, J. S., Gorbounov, V., Ramsey, R. S., Ramsey, J. M. Fully integrated glass microfluidic device for performing high-efficiency capillary electrophoresis and electrospray ionization mass spectrometry. Anal Chem. 80 (18), 6881-6887 (2008).
- Wlodarczyk, K. L., Hand, D. P., Maroto-Valer, M. M. Maskless, rapid manufacturing of glass microfluidic devices using a picosecond pulsed laser. Sci Rep. 9 (1), 20215 (2019).
- Nielsen, J. B., et al. Microfluidics: innovations in materials and their fabrication and functionalization. Anal Chem. 92 (1), 150-168 (2020).
- Nge, P. N., Rogers, C. I., Woolley, A. T. Advances in microfluidic materials, functions, integration, and applications. Chem Rev. 113 (4), 2550-2583 (2013).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288 (5463), 113-116 (2000).
- Oh, K. W., Ahn, C. H. A review of microvalves. Journal of Micromechanics and Microengineering. 16 (5), R13 (2006).
- Au, A. K., Lai, H., Utela, B. R., Folch, A. Microvalves and micropumps for BioMEMS. Micromachines. 2 (2), 179-220 (2011).
- Jerman, H. Electrically-activated, normally-closed diaphragm valves. J. Micromech. Microeng. 4 (4), 210 (1994).
- Neagu, C. R., Gardeniers, J. G. E., Elwenspoek, M., Kelly, J. J. An electrochemical microactuator: principle and first results. J microelectromechanical sys. 5 (1), 2-9 (1996).
- Gu, W., Zhu, X., Futai, N., Cho, B. S., Takayama, S. Computerized microfluidic cell culture using elastomeric channels and Braille displays. Proc Natl Acad Sci U S A. 101 (45), 15861-15866 (2004).
- Studer, V., et al. Scaling properties of a low-actuation pressure microfluidic valve. J Appl Phys. 95 (1), 393-398 (2004).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proc Natl Acad Sci U S A. 101 (40), 14431-14436 (2004).
- Ridgeway, W. K., Seitaridou, E., Phillips, R., Williamson, J. R. RNA-protein binding kinetics in an automated microfluidic reactor. Nucleic Acids Res. 37 (21), e142 (2009).
- Fu, A. Y., Chou, H. P., Spence, C., Arnold, F. H., Quake, S. R. An integrated microfabricated cell sorter. Anal Chem. 74 (11), 2451-2457 (2002).
- Liu, J., Enzelberger, M., Quake, S. A nanoliter rotary device for polymerase chain reaction. Electrophoresis. 23 (10), 1531-1536 (2002).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic large-scale integration. Science. 298 (5593), 580-584 (2002).
- Galas, J. C., Haghiri-Gosnet, A. M., Estévez-Torres, A. A nanoliter-scale open chemical reactor. Lab Chip. 13 (3), 415-423 (2013).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proc Natl Acad Sci U S A. 110 (40), 15985-15990 (2013).
- Yelleswarapu, M., et al. Sigma factor-mediated tuning of bacterial cell-free synthetic genetic oscillators. ACS Synth Biol. 7 (12), 2879-2887 (2018).
- van der Linden, A. J., et al. A multilayer microfluidic platform for the conduction of prolonged cell-free gene expression. J Vis Exp. (152), 59655 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chem Rev. 117 (12), 7964-8040 (2017).
- Seemann, R., Brinkmann, M., Pfohl, T., Herminghaus, S. Droplet based microfluidics. Rep Prog Phys. 75, 016601 (2012).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab Chip. 12 (3), 422-433 (2012).
- Clausell-Tormos, J., et al. Droplet-based microfluidic platforms for the encapsulation and screening of mammalian cells and multicellular organisms. Chem Biol. 15 (5), 427-437 (2008).
- Umbanhowar, P. B., Prasad, V., Weitz, D. A. Monodisperse emulsion generation via drop break off in a coflowing stream. Langmuir. 16 (2), 347-351 (2000).
- Abate, A. R., Thiele, J., Weitz, D. A. One-step formation of multiple emulsions in microfluidics. Lab Chip. 11 (2), 253-258 (2011).
- Chen, Y., Gao, W., Zhang, C., Zhao, Y. Three-dimensional splitting microfluidics. Lab Chip. 16 (8), 1332-1339 (2016).
- Ahn, K., Agresti, J., Chong, H., Marquez, M., Weitz, D. A. Electrocoalescence of drops synchronized by size-dependent flow in microfluidic channels. Appl Phys Lett. 88 (26), 264105 (2006).
- Fidalgo, L. M., Abell, C., Huck, W. T. S. Surface-induced droplet fusion in microfluidic devices. Lab Chip. 7 (8), 984-986 (2007).
- Bernath, K., et al. In vitro compartmentalization by double emulsions: Sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem. 325 (1), 151-157 (2004).
- Aharoni, A., Amitai, G., Bernath, K., Magdassi, S., Tawfik, D. S. High-throughput screening of enzyme libraries: thiolactonases evolved by fluorescence-activated sorting of single cells in emulsion compartments. Chem Biol. 12 (12), 1281-1289 (2005).
- Deng, N. N., Yelleswarapu, M., Huck, W. T. S. Monodisperse uni- and multicompartment liposomes. J Am Chem Soc. 138 (24), 7584-7591 (2016).
- Deng, N. N., Yelleswarapu, M., Zheng, L., Huck, W. T. S. Microfluidic assembly of monodisperse vesosomes as artificial cell models. J Am Chem Soc. 139 (2), 587-590 (2016).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Shembekar, N., Chaipan, C., Utharala, R., Merten, C. A. Droplet-based microfluidics in drug discovery, transcriptomics and high-throughput molecular genetics. Lab Chip. 16 (8), 1314-1331 (2016).
- Wong, A. H., et al. Drug screening of cancer cell lines and human primary tumors using droplet microfluidics. Sci Rep. 7 (1), 9109 (2017).
- Jing, W., Han, H. Droplet microfluidics for high-resolution virology. Anal Chem. 94 (23), 8085-8100 (2022).
- Ding, Y., Choo, J., deMello, A. J. From single-molecule detection to next-generation sequencing: microfluidic droplets for high-throughput nucleic acid analysis. Microfluid Nanofluidics. 21 (3), 58 (2017).
- Nightingale, A. M., et al. A stable droplet reactor for high temperature nanocrystal synthesis. Lab Chip. 11 (7), 1221-1227 (2011).
- De Stefano, P., Bianchi, E., Dubini, G. The impact of microfluidics in high- throughput drug-screening applications. Biomicrofluidics. 16 (3), 031501 (2022).
- Tekin, E., et al. Prevalence and patterns of higher-order drug interactions in Escherichia coli. NPJ Syst Biol Appl. 4, 31 (2018).
- Eduati, F., et al. A microfluidics platform for combinatorial drug screening on cancer biopsies. Nat Commun. 9 (1), 2434 (2018).
- Utharala, R., et al. A microfluidic Braille valve platform for on-demand production, combinatorial screening and sorting of chemically distinct droplets. Nat Protoc. 17 (12), 2920-2965 (2022).
- Mathur, L., et al. Combi-seq for multiplexed transcriptome-based profiling of drug combinations using deterministic barcoding in single-cell droplets. Nat Commun. 13 (1), 4450 (2022).
- Dubuc, E., et al. Cell-free microcompartmentalised transcription–translation for the prototyping of synthetic communication networks. Curr Opin Biotechnol. 58, 72-80 (2019).
- Kulesa, A., Kehe, J., Hurtado, J. E., Tawde, P., Blainey, P. C. Combinatorial drug discovery in nanoliter droplets. Proc Natl Acad Sci U S A. 115 (26), 6685-6690 (2018).
- Tomasi, R. F. X., Sart, S., Champetier, T., Baroud, C. N. Individual control and quantification of 3D spheroids in a high-density microfluidic droplet array. Cell Rep. 31 (8), 107670 (2020).
- White, J. A., Streets, A. M. Controller for microfluidic large-scale integration. HardwareX. 3, 135-145 (2018).
- Brower, K., et al. An open-source, programmable pneumatic setup for operation and automated control of single- and multi-layer microfluidic devices. HardwareX. 3, 117-134 (2018).
- Gonzalez-Suarez, A. M., Long, A., Huang, X. H., Revzin, A. A Compact control system to enable automated operation of microfluidic bioanalytical assays. Biosensors. 12 (12), 1160 (2022).
- Mathur, L., Ballinger, M., Utharala, R., Merten, C. A. Microfluidics as an enabling technology for personalized cancer therapy. Small. 16 (9), e1904321 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved