Bactérias da Impressão 3D para Estudo da Motilidade e Crescimento em Meios Porosos 3D Complexos
In This Article
Summary
Este protocolo descreve um procedimento para impressão tridimensional (3D) de colônias bacterianas para estudar sua motilidade e crescimento em matrizes complexas de hidrogel poroso 3D que são mais semelhantes aos seus habitats naturais do que culturas líquidas convencionais ou placas de Petri.
Abstract
As bactérias são ubíquas em ambientes porosos tridimensionais complexos (3D), como tecidos biológicos e géis, solos subsuperficiais e sedimentos. No entanto, a maioria dos trabalhos anteriores tem se concentrado em estudos de células em líquidos a granel ou em superfícies planas, que não recapitulam totalmente a complexidade de muitos habitats bacterianos naturais. Aqui, essa lacuna no conhecimento é abordada descrevendo o desenvolvimento de um método para imprimir colônias densas de bactérias em 3D em matrizes de hidrogel granulares emperradas. Essas matrizes possuem tamanhos de poros ajustáveis e propriedades mecânicas; eles confinam fisicamente as células, suportando-as em 3D. Eles são opticamente transparentes, permitindo a visualização direta da disseminação bacteriana através de seus arredores usando imagens de imagem. Como prova desse princípio, aqui, a capacidade deste protocolo é demonstrada pela impressão 3D e imageamento de Vibro cholerae não móveis e móveis, bem como Escherichia coli não móvel, em matrizes granulares de hidrogel emperradas com tamanhos variados de poros intersticiais.
Introduction
As bactérias frequentemente habitam diversos e complexos ambientes porosos 3D, desde géis mucosos no intestino e pulmões até solo no solo 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,21,
22,23,24,25. Nesses cenários, o movimento bacteriano através da motilidade ou crescimento pode ser impedido por obstáculos circundantes, como redes poliméricas ou embalagens de grãos minerais sólidos, influenciando a capacidade das células de se espalhar por seus ambientes26, acessar fontes de nutrientes, colonizar novos terrenos e formar comunidades protetoras de biofilme27. No entanto, estudos de laboratório tradicionais normalmente empregam geometrias altamente simplificadas, com foco em células em culturas líquidas ou em superfícies planas. Embora essas abordagens produzam insights importantes sobre a microbiologia, elas não recapitulam totalmente a complexidade dos habitats naturais, levando a diferenças dramáticas nas taxas de crescimento e no comportamento da motilidade em comparação com medições realizadas em ambientes do mundo real. Portanto, um método para definir colônias bacterianas e estudar sua motilidade e crescimento em ambientes porosos 3D mais semelhantes a muitos de seus habitats naturais é extremamente necessário.
Inocular células em gel de ágar e, em seguida, visualizar sua disseminação macroscópica por olho ou usando uma câmera fornece uma maneira simples de conseguir isso, como proposto pela primeira vez por Tittsler e Sandholzer em 193628. No entanto, essa abordagem sofre de uma série de desafios técnicos importantes: (1) Embora os tamanhos dos poros possam, em princípio, ser variados variando a concentração de agarose, a estrutura dos poros de tais géis é mal definida; (2) O espalhamento de luz faz com que esses géis sejam turvos, dificultando a visualização de células em escala individual com alta resolução e fidelidade, particularmente em grandes amostras; (3) Quando a concentração de ágar é muito grande, a migração celular é restrita à superfície plana superior do gel; (4) A complexa reologia desses géis torna desafiadora a introdução de inóculos com geometrias bem definidas.
Para resolver essas limitações, em trabalhos anteriores, o laboratório de Datta desenvolveu uma abordagem alternativa usando matrizes granulares de hidrogel - compostas por partículas de hidrogel biocompatíveis inchadas em cultura bacteriana líquida - como "placas de Petri porosas" para confinar células em 3D. Essas matrizes são sólidas macias, auto-reparáveis, de tensão de escoamento; assim, ao contrário dos géis reticulados usados em outros processos de bioimpressão, um microbocal de injeção pode mover-se livremente dentro da matriz ao longo de qualquer caminho 3D prescrito, reorganizando localmente as partículas de hidrogel29. Essas partículas então se redensificam rapidamente e se auto-curam ao redor das bactérias injetadas, apoiando as células no lugar sem qualquer processamento prejudicial adicional. Este processo é, portanto, uma forma de impressão 3D que permite que as células bacterianas sejam dispostas - em uma estrutura 3D desejada, com uma composição de comunidade definida - dentro de uma matriz porosa com propriedades físico-químicas ajustáveis. Além disso, as matrizes de hidrogel são completamente transparentes, permitindo que as células sejam visualizadas diretamente por imagem.
A utilidade dessa abordagem foi demonstrada anteriormente de duas maneiras. Em um conjunto de estudos, células diluídas foram dispersas por toda a matriz hidrogel, o que possibilitou estudos da motilidade de bactérias individuais30,31. Em outro conjunto de estudos, comunidades multicelulares foram impressas em 3D em géis em escala centimétrica usando um bico injetor montado em um palco de microscópio programável, o que possibilitou estudos da disseminação de coletivos bacterianos em seu entorno32,33. Em ambos os casos, esses estudos revelaram diferenças até então desconhecidas nas características de disseminação de bactérias que habitam ambientes porosos em comparação com aquelas em cultura líquida/em superfícies planas. No entanto, por terem sido montados em um estágio de microscópio, esses estudos anteriores foram limitados a pequenos volumes de amostra (~1 mL) e, portanto, a escalas de tempo experimentais curtas. Eles também foram limitados em sua capacidade de definir geometrias de inóculos com alta resolução espacial.
Aqui, a próxima geração desta plataforma experimental que aborda ambas as limitações é descrita. Especificamente, são fornecidos protocolos pelos quais se pode usar uma impressora 3D modificada com uma extrusora de seringa acoplada à impressão 3D e imagem de colônias bacterianas em grandes escalas. Além disso, dados representativos indicam como esta abordagem pode ser útil para estudar a motilidade e o crescimento de bactérias, usando o biofilme Vibrio cholerae e a Escherichia coli planctônica como exemplos. Essa abordagem permite que as colônias bacterianas sejam sustentadas por longos tempos e visualizadas usando várias técnicas de imagem. Assim, a capacidade dessa abordagem de estudar comunidades bacterianas em habitats porosos 3D tem um enorme potencial de pesquisa e aplicação, impactando o tratamento e o estudo de micróbios no intestino, na pele, no pulmão e no solo. Além disso, essa abordagem pode ser usada no futuro para impressão 3D de materiais vivos projetados à base de bactérias em formas independentes mais complexas.
Protocol
Esta abordagem consiste em converter uma impressora comercial de modelagem de deposição fundida 3D em uma bioimpressora 3D usando um protocolo previamente estabelecido por Tashman et al.34. Em resumo, Tashman e colaboradores substituíram uma cabeça de extrusora comercial por uma extrusora de bomba de seringa personalizada. Esta extrusora permite a impressão de suspensões líquidas altamente concentradas de células bacterianas em 3D, com seu volume extrudado e posição 3D controlados pela linguagem de programação G-code. O volume extrudado é especificado no software pela etapa da extrusora (E-step) e é adicionalmente calibrado conforme descrito abaixo. Essas suspensões bacterianas são, portanto, impressas diretamente em uma matriz granular de hidrogel, que atua como um suporte 3D para as células. Abaixo, o protocolo também descreve como preparar matrizes com diferentes concentrações de polímeros, caracterizar as mudanças resultantes no tamanho dos poros e propriedades reológicas, e caracterizar a motilidade e o crescimento bacterianos subsequentes usando imagens diretas.
1. Conversão de uma impressora 3D comercial em uma bioimpressora 3D
- Remova a extrusora e o aquecedor de uma impressora 3D comercial (consulte Tabela de materiais).
- Siga os protocolos anteriores para fabricar a extrusora da bomba de seringa34, com uma modificação adicional para acomodar uma seringa Luer lock descartável. Monte a extrusora da bomba de seringa na impressora.
NOTA: Os arquivos CAD necessários para modificar a extrusora da bomba de seringa para seringas de plástico são fornecidos em Arquivos suplementares 1-3. - Instale e abra o software da impressora 3D (consulte Tabela de Materiais) em um computador. Conecte a impressora 3D ao computador.
- Coloque uma seringa descartável de 1 mL com uma agulha de tamanho adequado nas pinças impressas em 3D alinhando as metades superior e inferior do mecanismo (Figura 1). Fixe as abraçadeiras ao redor da seringa usando três parafusos de soquete M8 e porcas hexadecimais finas de aço (consulte a Tabela de Materiais). O êmbolo da seringa conecta-se com o parafuso de chumbo na extrusora da bomba de seringa. Levante manualmente o êmbolo girando o parafuso de chumbo para criar uma folga de 0,5 mL de ar na seringa.
- Se a contaminação for uma preocupação para o experimento, transporte o complexo seringa-pinça para um biohood e esterilize com spray de etanol 70% na entrada antes de completar as etapas seguintes.
2. Preparação da suspensão bacteriana
- Para V. cholerae e E. coli, crescer durante a noite em uma placa de ágar Lennox LB (Caldo de Luria, ver Tabela de Materiais) a 37 °C.
- Para V. cholerae, inocular as células em 3 mL de LB líquido com dez esferas de vidro estéreis. Cultivar as células em uma incubadora de agitação a 37 °C por 5-6 h até a fase exponencial média para uma densidade óptica (OD) 600 de ~0,9.
- Para E. coli, inocular as células em 3 mL de LB líquido. Inocular 200 μL da cultura noturna em LB fresco por 3 h até que o DO atinja 0,6.
- Transferir a cultura para um tubo de centrífuga de 10 mL. Centrifugar a cultura por 5 min a 5.000 x g à temperatura ambiente para formar um pellet. Remova o sobrenadante. Ressuspender com ~10 μL de LB líquido para atingir uma densidade celular de ~9 x 1010 células por mL.
3. Carregar a suspensão bacteriana na seringa
NOTA: São fornecidos dois métodos para carregar as bactérias na seringa (passo 3.1 e passo 3.2). O passo 3.1 trabalha para carregar pequenos volumes de suspensões bacterianas, <200 μL, e o passo 3.2 trabalha para carregar volumes maiores de suspensões bacterianas, >200 μL. A etapa 3.1 foi utilizada para os resultados representativos aqui apresentados.
- Coloque uma seringa Luer lock de plástico vazia de 1 mL na bioimpressora 3D. Conecte o êmbolo da seringa com o parafuso de chumbo. Retrair manualmente a seringa para adicionar 0,2 mL da folga de ar para fornecer espaço para o êmbolo se mover na seringa, pois um pequeno volume de células ~20-50 μL são usados para cada lote de experimentos.
- Fixe uma agulha romba à ponta da seringa com o tamanho da agulha necessário para o tamanho das características de impressão necessárias. Aqui, uma agulha de 2 polegadas 20 G é usada.
- Coloque a suspensão bacteriana na seringa colocando um tubo de centrífuga de 10 mL com o inóculo bacteriano abaixo da agulha. Gire manualmente o parafuso para retrair o êmbolo da seringa e carregar as células na seringa. Os volumes de células bacterianas são tão pequenos que, muitas vezes, as células são apenas carregadas na agulha.
- Retire o êmbolo do complexo seringa-pinça e use outra seringa e agulha para carregar cuidadosamente o complexo seringa-pinça com as suspensões bacterianas desejadas, tomando cuidado para evitar o aprisionamento de bolhas de ar. O complexo seringa-pinça deve ser preenchido ligeiramente sobre a borda com a suspensão bacteriana desejada e, em seguida, transferido para a bioimpressora.
- Introduza cuidadosamente o complexo seringa-pinça sem o êmbolo no soquete correspondente no núcleo principal da extrusora da bioimpressora.
- Certifique-se de que o carro da impressora esteja aproximadamente na metade do parafuso de chumbo e que uma placa de coleta esteja presente sob a seringa carregada. Em seguida, insira cuidadosamente o êmbolo através do carrinho e do complexo seringa-pinça até que ele pegue no carrinho. Deprima o êmbolo lentamente na suspensão bacteriana para evitar o aprisionamento de bolhas de ar na seringa.
- Deslize a fixação do adaptador sobre o carro sobre a parte de trás do êmbolo para prendê-lo no lugar para manobras de extrusão e retração.
4. Calibração da etapa da extrusora para o volume depositado
- Para calibrar a etapa da extrusora (E-step) para o volume depositado, primeiro configure a bioimpressora com a seringa, a agulha da seringa e a suspensão bacteriana de depósito que serão utilizadas no experimento. Aqui, uma seringa Luer lock de 1 mL é usada.
- Determine um intervalo estimado de passo E para calibrar extrudindo um número arbitrário de passo E (~200) e observe a mudança de volume do êmbolo com marcadores de volume de seringa.
- Use esta relação E-passo grosso/volume para determinar as configurações do E-step para executar a varredura de calibração. Por exemplo, se um passo E de 200 extrusa aproximadamente 20 μL por inspeção visual e se deseja depositar 10-200 μL, teste os passos E entre 100-2000.
- Para realizar a varredura de calibração linear, primeiro rotule e meça a massa seca de vinte tubos de coleta de 1,5 mL em uma balança analítica com sensibilidade de 0,1 mg.
- Extruda a suspensão bacteriana nos tubos de 1,5 mL pré-medidos. Para cada etapa E, execute pelo menos 2 repetições. Repita para todos os passos E ao longo da faixa linear, substituindo a suspensão bacteriana conforme necessário. Se a contaminação for uma preocupação para o experimento, limpe o exterior da agulha da seringa com um lenço sem fiapos saturado com etanol 70% após cada amostra.
- Medir a massa de todos os tubos de 1,5 mL com a mesma balança analítica. Subtrair o primeiro valor de massa do segundo para obter uma massa líquida de suspensão bacteriana depositada.
- Converta a massa da suspensão bacteriana em um volume com a densidade do material. Para muitas suspensões bacterianas compostas principalmente de água, 1 g/mL é uma aproximação de densidade apropriada.
- Execute um ajuste linear entre o passo E e o volume extrudado para concluir o processo de calibração.
5. Preparação da matriz de hidrogel granular
- Em um gabinete de biossegurança, adicionar grânulos secos de copolímeros de ácido acrílico/acrilato de alquila reticulados (ver Tabela de Materiais) a 400 mL de Lennox Luria-Bertani (LB) a 2% para manter a matriz estéril; no entanto, outros meios líquidos de cultura de células também podem ser usados para inchar a matriz de hidrogel.
NOTA: A porcentagem em peso de grânulos adicionados ao LB depende do tamanho dos poros que se almeja. No presente estudo, para uma matriz de hidrogel granular a 0,9%, 3,6 g de grânulos secos são adicionados ao LB e para uma matriz de hidrogel granular a 1,2%, 4,8 g de grânulos secos são adicionados ao LB. Os grânulos de hidrogel são homogeneamente dispersos misturando-os em um misturador de bancada por 2 min. - Uma vez misturado, ajuste o pH para 7,4 adicionando incrementos de 20 a 500 μL de hidróxido de sódio (NaOH) 10 M para garantir a viabilidade celular. Após cada adição de NaOH, meça o pH mergulhando uma ponta de pipeta na mistura e, em seguida, limpando a matriz de hidrogel em um papel de teste de pH.
NOTA: À medida que o NaOH é adicionado, a viscosidade da mistura aumentará à medida que os grânulos de hidrogel começarem a inchar. Os grânulos de hidrogel inchados têm ~5 μm a 10 μm de diâmetro e estão amontoados em uma matriz de hidrogel. A malha interna dos grânulos é de ~40 nm a 100 nm, conforme previamente estabelecido32. O tamanho da malha é grande o suficiente para que moléculas pequenas (por exemplo, oxigênio e nutrientes) se difundam livremente, mas pequenas o suficiente para que as bactérias fiquem confinadas entre os poros intersticiais. - Em seguida, transfira a matriz de hidrogel granular para um tubo centrífugo de 50 mL usando uma seringa plástica estéril de 50 mL. Centrifugar a matriz de hidrogel a 161 x g por 1 min à temperatura ambiente para remover as bolhas formadas durante o processo de mistura.
- Deixe a matriz de hidrogel descansar por pelo menos 2 dias à temperatura ambiente para garantir que não tenha ocorrido contaminação. A contaminação aparece como microcolônias suspensas na matriz de hidrogel. Após dois dias, centrifugar a matriz de hidrogel a 161 x g por 1 min para remover quaisquer bolhas adicionais que se formem.
NOTA: O protocolo pode ser pausado aqui armazenando a matriz de hidrogel à temperatura ambiente por até uma semana. - Na cabine de biossegurança, utilizando uma seringa plástica estéril de 30 mL, transfira a quantidade desejada de matriz hidrogel para o recipiente onde ocorrerá a impressão (aqui foram utilizados ~20 mL para um frasco de cultura de tecidos de 20 mL ou 1 mL para micro cubetas plásticas de 1 mL).
6. Caracterização das propriedades reológicas da matriz de hidrogel granular
- Coloque ~3 mL da matriz de hidrogel em um reômetro de cisalhamento (ver Tabela de Materiais) com um intervalo de 1 mm entre placas paralelas rugosas de 50 mm de diâmetro para medir as propriedades reológicas.
- Quantifique o comportamento do escoamento usando medidas de cisalhamento unidirecionais no reômetro de cisalhamento medindo a tensão de cisalhamento em função de uma varredura logarítmica da taxa de cisalhamento de 10-4 s-1 a 102 s-1 (por exemplo, Figura 2A).
NOTA: Em baixas taxas de cisalhamento, a matriz de hidrogel terá uma tensão de cisalhamento constante (a tensão de escoamento) que é independente da taxa de cisalhamento. Em altas taxas de cisalhamento, a tensão de cisalhamento aumentará com uma dependência da lei de potência da taxa de cisalhamento, indicando a fluidização da matriz de hidrogel. Esse comportamento de estresse de rendimento permite que as bactérias sejam impressas em 3D dentro da matriz granular de hidrogel29. - Medir os módulos de armazenamento e perda, G' e G'', respectivamente, em função da frequência, utilizando reologia oscilatória de pequena amplitude com amplitude de deformação de 1% e frequências entre 0,1 a 1 Hz (por exemplo, Figura 2B).
NOTA: A matriz de hidrogel granular ideal para impressão 3D deve ter um módulo de armazenamento maior que o módulo de perda, o que indica que o meio atua como um sólido elástico emperrado29.
7. Caracterização do tamanho dos poros intersticiais da matriz de hidrogel granular
- Sonicate 100 nm nanopartículas fluorescentes de poliestireno carboxilado (~3,6 x10 13 partículas/mL, ver Tabela de Materiais) em sua embalagem por 15 min para ressuspender para quebrar quaisquer agregações/aglomerados de partículas. Transfira 50 μL de nanopartículas para um tubo de microcentrífuga de 1,5 mL.
- Centrifugar por 10 min a 9.500 x g à temperatura ambiente até que o pellet se forme e o sobrenadante esteja límpido. Retirar o sobrenadante e ressuspender o pellet em 1 mL do meio de cultura líquido (aqui LB) utilizado para preparar a matriz de hidrogel granular.
NOTA: O protocolo pode ser pausado aqui armazenando as nanopartículas ressuspensas a 4 °C por até 3 meses.
- Centrifugar por 10 min a 9.500 x g à temperatura ambiente até que o pellet se forme e o sobrenadante esteja límpido. Retirar o sobrenadante e ressuspender o pellet em 1 mL do meio de cultura líquido (aqui LB) utilizado para preparar a matriz de hidrogel granular.
- Sonicar as nanopartículas ressuspensas por 30 min. Transferir 1 mL de matriz granular de hidrogel para um tubo de microcentrífuga de 1,5 mL. Adicionar 1 μL das nanopartículas ressuspensas à matriz granular de hidrogel e misturá-las com uma ponta de pipeta. Após a mistura, centrifugar por 30 s a 161 x g à temperatura ambiente.
- Transfira a matriz de hidrogel e a mistura de nanopartículas para uma placa de Petri de 35 mm de diâmetro com um poço de fundo de vidro de 0,1 mm de espessura. O poço tem 20 mm de diâmetro e 1 mm de profundidade. Coloque uma tampa de vidro por cima e pressione para baixo para desativar o fluxo e a evaporação durante a imagem. Uma alternativa à tampa de vidro é adicionar 1 mL de óleo de parafina na parte superior.
- Obtenha imagens das nanopartículas usando um microscópio confocal com uma objetiva de óleo de 40x com zoom adicional de 8x no software de imagem (consulte a Tabela de Materiais).
NOTA: Um objetivo de ampliação mais alto poderia ser usado em vez de usar zoom digital adicional no software.- Imagem de um loop temporal sem atraso (idealmente ~19 quadros/s) em um único plano z por 2 minutos com pelo menos quatro nanopartículas dentro do campo de visão. Repita de 15 a 20 vezes em locais diferentes para coletar dados suficientes para estatísticas (100 a 200 nanopartículas).
- Use um software de rastreamento de partículas para analisar o deslocamento das partículas. Aqui, um script personalizado é usado com base no algoritmo clássico de Crocker-Grier para rastrear o centro de massa da nanopartícula35 (veja Arquivo Suplementar 7).
- A partir do rastreamento de partículas, calcule o deslocamento quadrático médio (MSD). O MSD exibirá difusão livre no espaço de poros em curtos comprimentos e escalas de tempo e transição para escalonamento subdifusivo em grandes comprimentos e escalas de tempo devido ao confinamento35.
- Identifique a escala de comprimento onde ocorre a transição para a escala subdifusiva para estimar o tamanho dos poros locais. Calcule o tamanho dos poros adicionando esta escala de comprimento ao diâmetro das nanopartículas. Repita a análise do tamanho dos poros para cada nanopartícula medida. Isso produzirá uma distribuição de tamanho de poro a partir da qual um tamanho médio de poro pode ser calculado (por exemplo, Figura 3).
8. 3D processo de impressão
- Suportes personalizados para impressão 3D para os recipientes de amostra (consulte Arquivos Suplementares 4-6 para os arquivos CAD). Aqui, são utilizados suportes para frascos de cultura de tecidos e microcubetas. Os suportes permitem programar a impressora para imprimir várias amostras em uma única sessão de impressão. Coloque os recipientes de amostra com meio hidrogel nos suportes na plataforma de construção.
- Abra o software de impressão 3D. Carregue um código g pré-programado no software. Para obter os resultados representativos, a etapa 3.1 é usada para carregar a suspensão bacteriana na impressora 3D.
NOTA: Um exemplo de um código g para imprimir geometrias verticais lineares é dado na Tabela 1. - Através do software de impressão 3D, mova os planos x-y-z para centralizar a cabeça de impressão no plano x-y para ser o primeiro recipiente e, em seguida, para abrigar o eixo z. O eixo z do homing levantará a cabeça de impressão. Gire manualmente o parafuso lentamente para deprimir o êmbolo da seringa até que uma pequena quantidade da suspensão bacteriana possa ser vista na ponta da agulha.
- Limpe levemente o excesso de suspensão bacteriana com um lenço descartável estéril. Com base na altura do porta-amostras, da agulha e da seringa, usando o software de impressão 3D, abaixe a cabeça de impressão a uma distância fixa no meio de hidrogel no recipiente de amostra de escolha. Inicie o processo de impressão clicando em Imprimir.
- Quando a impressão estiver concluída, feche os recipientes de amostra. Limpe a impressora com etanol 70%. Descarte corretamente a seringa e a agulha.
9. Crescimento e obtenção de imagens da V. cholerae
- Para imagens de campo de visão grande, use uma câmera com um acessório de lente de zoom para o crescimento da célula de imagem com uma caixa de luz. Fotografe as amostras logo após a impressão à temperatura ambiente e, em seguida, transfira-as para uma incubadora. Manter as amostras a 37 °C em uma incubadora estacionária entre as sessões de imagem durante o experimento.
- Capturar imagens durante um período de tempo desejado para observar o comportamento de crescimento em longos períodos na matriz granular de hidrogel.
Representative Results
O uso de uma bioimpressora 3D com a matriz granular de hidrogel expande as capacidades das bioimpressoras para imprimir colônias bacterianas em formas que, quando impressas em um substrato plano, cairiam devido à baixa viscosidade da suspensão bacteriana. A resolução da abordagem aqui apresentada depende da velocidade de extrusão, tamanho da agulha, velocidade da cabeça de impressão, ar na agulha e viscosidade da suspensão bacteriana. Devido ao baixo volume de suspensão bacteriana, bolhas de ar podem ser introduzidas inadvertidamente durante o carregamento da suspensão bacteriana na seringa e agulha. Isso pode levar ao depósito de uma bolha de ar na estrutura impressa final (Figura 4). Outra maneira de introduzir bolhas de ar na impressão é se não pressionar o êmbolo para formar uma pequena gota de suspensão bacteriana na ponta da agulha antes de imprimir e existir uma folga de ar na ponta da agulha. Não deprimir o êmbolo da seringa antes da impressão também pode levar a diferentes volumes de células sendo impressos no mesmo lote. No entanto, com o passar do tempo, a bolha de ar se dissolve no meio circundante, como mostrado na Figura 4.
Para calibrar a etapa de extrusão, o volume depositado depende de como o atuador linear da cabeça de impressão traduz o êmbolo da seringa, o diâmetro interno da seringa impactará diretamente o volume. Além disso, as propriedades reológicas da suspensão bacteriana afetarão a facilidade com que eles cortam a contração da agulha para imprimir suavemente. Assim, esse procedimento de calibração deve ser refeito para cada instalação de seringa/agulha/suspensão bacteriana. Em princípio, a calibração da seringa poderia ser automatizada. No entanto, na prática, escrever um código que se aplique amplamente a muitos casos de uso seria um desafio. Por exemplo, um usuário com o objetivo de calibrar a extrusão de aproximadamente 300 μL a partir de uma seringa de 1 mL precisaria recarregar a seringa com muito mais frequência do que um usuário calibrando em torno de um volume alvo de 30 μL. Como a constante de calibração E-step to volume é desconhecida quando o processo de calibração começa, o usuário pode não ser capaz de prever exatamente com que frequência o recarregamento é realmente necessário. Além disso, para automatizar o processo de calibração, as posições exatas de cada tubo de 1,5 mL pré-pesado precisariam ser especificadas. Para garantir que toda a biotinta seja depositada da agulha no tubo para uma calibração precisa, deve ser feito um contacto preciso entre a agulha e o fundo/parede do tubo. Sem um bom contato, pequenas gotículas podem permanecer molhadas e presas à agulha. Assim, qualquer variação posicional entre os tubos pode contribuir sobremaneira para erros no processo de calibração. Por essas razões, os autores recomendam que cada usuário construa um programa de calibração que atenda às suas necessidades únicas.
Uma característica chave da abordagem apresentada aqui é a capacidade de visualizar bactérias se espalhando por seus ambientes diretamente via motilidade e crescimento usando imagens de imagem. Em uma versão anterior do protocolo de aquisição de imagens, placas de 6 poços foram preenchidas com 19 mL de uma matriz granular de hidrogel. No entanto, mesmo com uma impressão 3D bem-sucedida de uma linha horizontal de células que pôde ser observada em um microscópio invertido, uma colônia densa também cresceria na superfície superior do meio, limitando a visualização com microscopia de campo claro (Figura 5). A colônia na superfície superior provavelmente resultou de contaminação quando a agulha da seringa foi colocada ou removida do meio durante a impressão. Para contornar esse problema, linhas verticais de células são impressas em frascos de cintilação (Figura 6A). No entanto, a curvatura dos frascos cilíndricos causou distorção durante a aquisição de imagens. Isso levou à seleção de cubetas de paredes planas e frascos de cultura de tecidos como recipientes de amostra para impressão, permitindo imagens não distorcidas (Figura 6B-D). Uma limitação dos frascos de cultura de tecidos é o pequeno pescoço inclinado que limita as geometrias que podem ser impressas.
Em conjunto, este protocolo permite a observação da motilidade e crescimento bacteriano em ambientes porosos complexos em longas escalas de tempo. Alguns exemplos são mostrados na Figura 6B-G para V. cholerae formadores de biofilme usando microscopia de campo claro, bem como células planctônicas de E. coli usando microscopia confocal de fluorescência de varredura a laser, demonstrando a versatilidade desta abordagem. De fato, um problema potencial das matrizes de hidrogel é sua possível autofluorescência quando imageadas usando microscopia de fluorescência; entretanto, as imagens mostradas na Figura 6F,G demonstram que esta autofluorescência é mínima na plataforma experimental aqui apresentada. Outra limitação de tais abordagens de microscopia óptica é sua resolução espacial, que é definida pelo limite de difração em ~100 s nanômetros; no entanto, essa escala de comprimento é muito menor do que o tamanho de uma célula bacteriana individual e, portanto, as técnicas ópticas fornecem a capacidade de obter imagens de células bacterianas desde a escala de células individuais (Figura 6G) até a escala de colônias multicelulares maiores 30,31,32,33. Exemplos adicionais são descritos abaixo.
Como observado acima, a abordagem aqui apresentada pode ser usada para imprimir em 3D e obter imagens de colônias bacterianas em pequenos volumes de matriz (1 mL) e grandes (20 mL). Assim, as diferenças nos resultados obtidos com diferentes volumes são descritas a seguir, utilizando colônias impressas em 3D de V. cholerae móvel e não móvel como exemplos representativos. A resolução espacial (largura da linha) da impressão é definida pelo diâmetro interno do bocal. Nos exemplos descritos abaixo, uma agulha com diâmetro interno de 0,6 mm resulta em uma colônia cilíndrica inicial de 0,6 mm. Trabalhos anteriores demonstraram que a resolução de impressão pode ser reduzida ainda mais usando um capilar de vidro puxado com um diâmetro interno de ~100-200 μm33.
Para os pequenos volumes, são utilizadas duas matrizes granulares diferentes de hidrogel com duas diferentes distribuições de tamanho de poros: uma com tamanho médio de poro maior que o diâmetro médio de uma célula de V. cholerae, 0,2-0,4 μm36, e outra com tamanho médio de poro menor que esse diâmetro. As amostras ao longo de doze dias são imageadas e medidas através da análise de imagens da expansão areal das colônias ao longo do tempo (Figura 7 e Figura 8). Para as células não móveis, que só podem se espalhar pelo seu entorno através do crescimento celular, a taxa de expansão areal foi semelhante entre as diferentes matrizes investigadas (Figura 7), indicando que as diferenças no tamanho dos poros da matriz não influenciam a disseminação celular através do crescimento - como esperado. Em contraste, para as células móveis que se espalham por seu entorno através da motilidade ativa, a taxa de expansão areal de V. cholerae foi maior para a matriz de hidrogel com os poros maiores - para os quais o confinamento pelos grãos de hidrogel impede menos a motilidade celular. Essas diferenças na disseminação bacteriana também foram aparentes nas morfologias das colônias (Figura 8). A colônia de V. cholerae em matrizes hidrogéis com poros maiores espalhou-se através de plumas lisas e difusas (Figura 8A), refletindo a disseminação através da motilidade ativa, como observado anteriormente32. De fato, consistente com essa interpretação, essas plumas difusas não são observadas no caso de células não móveis (Figura 8C). Além disso, os poros são suficientemente grandes para que as células não empurrem as contas enquanto nadam pelos poros. Além disso, a tensão viscosa aplicada pela natação é inferior a 1 Pa, o que é insuficiente para deformar sensivelmente a matriz de hidrogel circundante. Em contraste, a colônia em matrizes de hidrogel com poros menores se espalha apenas através de plumas ásperas semelhantes a fractais para células móveis e não móveis (Figura 8B,D), refletindo a disseminação apenas através do crescimento celular, enquanto as células crescem transitoriamente deformam e produzem a matriz circundante. De fato, dado que a tensão de escoamento das matrizes de hidrogel é muito menor do que a pressão de turgescência das células, neste limite de tamanho de poros pequenos, a matriz apenas fornece fraca resistência ao crescimento celular e não parece afetar fortemente a estrutura impressa em 3D, também como verificado em nosso trabalho anterior37.
Resultados semelhantes são observados para experimentos realizados em amostras de grande volume; no entanto, dada a maior abundância de nutrientes nessas amostras, os experimentos poderiam sustentar o crescimento celular em escalas de tempo mais longas. Como exemplo, são mostrados resultados usando matrizes de hidrogel granulares onde o tamanho médio dos poros era menor do que o tamanho da célula - e, portanto, a disseminação celular foi principalmente devido ao crescimento. As amostras são fotografadas por ~30 dias nas matrizes granulares de hidrogel e observada expansão areal semelhante para células não móveis e móveis durante as primeiras 150 h; no entanto, em tempos ainda mais longos, observa-se forte variabilidade entre as amostras, com algumas amostras exibindo taxas de espalhamento mais rápidas (Figura 9 e Figura 10). Curiosamente, ao reamostrar a matriz de hidrogel após o experimento - um benefício do grande volume da matriz de hidrogel - uma diminuição na tensão de escoamento, módulos de armazenamento e módulos de perda são medidos (Figura 11), indicando que as matrizes tornaram-se mais macias. Essa alteração pode ser devida ao fato de V . cholerae produzir uma molécula que está alterando as propriedades da matriz hidrogel e promovendo a disseminação celular em longos tempos, o que será interessante testar em pesquisas futuras. Exemplos das morfologias ásperas de colônias semelhantes a fractais que resultam nesses experimentos são mostrados na Figura 10.

Figura 1: Imagens da bioimpressora 3D personalizada. (A) Bioimpressora com cabeça de extrusora de bomba de seringa modificada com seringa e agulha descartáveis Luer lock. A bioimpressora tem ~46 cm de largura. (B) Imagem da impressão 3D de células em frascos preenchidos com matriz de hidrogel emperrada. A largura da imagem é de 87 mm. Clique aqui para ver uma versão maior desta figura.
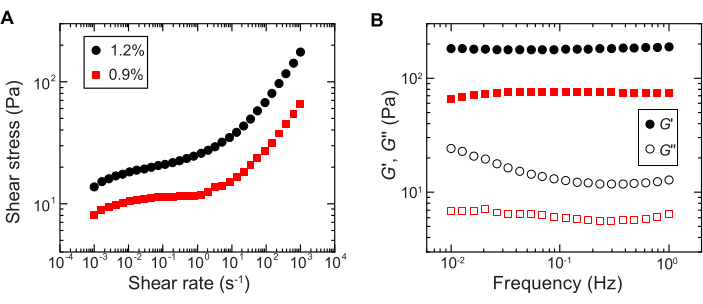
Figura 2: Caracterização das propriedades reológicas das matrizes granulares de hidrogel. (A) Tensão de cisalhamento em função da taxa de cisalhamento aplicada. (B) Módulos de armazenamento e perda, G' e G'', respectivamente, em função da frequência de oscilação. A legenda indica a fração mássica de hidrogel utilizada para preparar cada matriz de hidrogel. Clique aqui para ver uma versão maior desta figura.
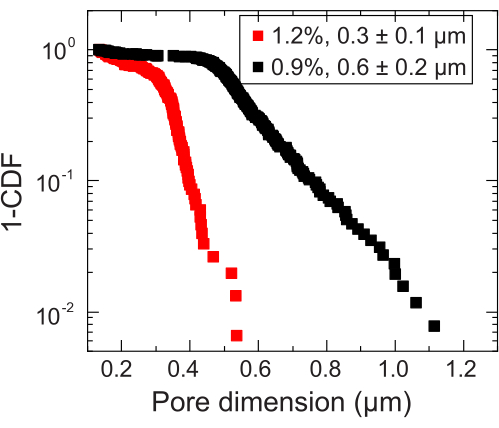
Figura 3: Medidas do tamanho dos poros de duas matrizes granulares representativas de hidrogel. Através do rastreamento de traçadores, a distribuição das dimensões de poros características é determinada para cada matriz de hidrogel. Os dados são representados por 1-CDF, onde CDF é a função de distribuição cumulativa. A legenda indica a fração mássica de hidrogel utilizada para preparar cada matriz. Clique aqui para ver uma versão maior desta figura.
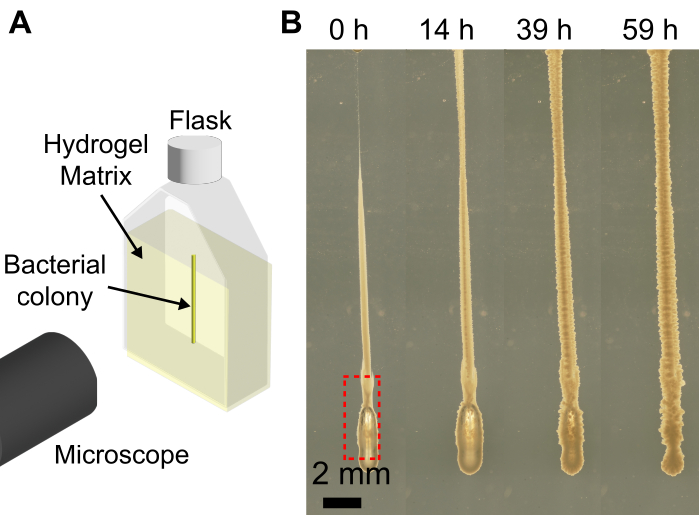
Figura 4: Exemplos de bolhas formadas durante a impressão 3D de bactérias. (A) Esquema da configuração da imagem. (B) Instantâneos do crescimento de V. cholerae com uma bolha na parte inferior da impressão (caixa vermelha) em matriz de hidrogel a 1,2% inchada em LB. Após 59 h de crescimento a 37 °C, a bolha de ar é totalmente dissolvida e a colônia colapsa de volta devido à elasticidade da matriz de hidrogel. Barra de escala = 2 mm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Imagens da linha horizontal de V. cholerae móvel impressas em uma placa de seis poços preenchida com matriz de hidrogel a 1,2% inchada em LB e o biofilme que se formou na superfície superior após 48 h de incubação a 37 °C. (A) Esquema da configuração da imagem. (B) A formação de biofilme na superfície superior devido à contaminação durante a impressão 3D diminui a opacidade e não permite imagens nítidas da linha horizontal. A superfície superior forma rugas, presumivelmente devido ao crescimento diferencial. Barra de escala = 5 mm. Clique aqui para ver uma versão maior desta figura.
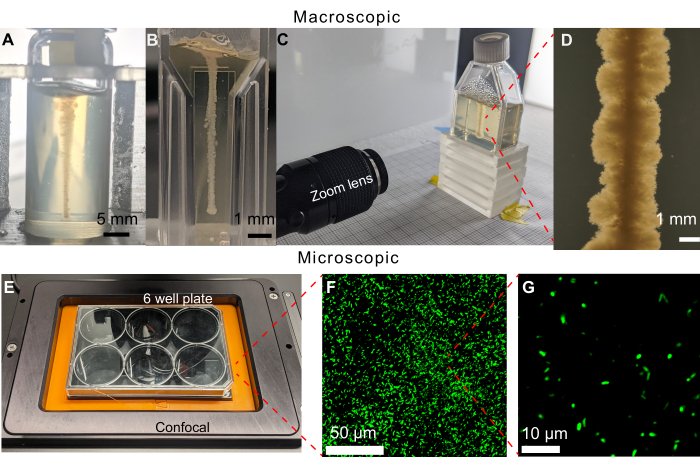
Figura 6: Exemplos de diferentes recipientes de amostra que podem ser usados neste método. (A) V. cólera impressa num frasco para injetáveis de vidro preenchido com matriz de hidrogel granular a 1,2% após 470 horas. A curvatura do frasco dificulta a obtenção de imagens do crescimento. Barras de escala = 5 mm. (B) V. cholerae impresso em micro-cubeta preenchida com matriz granulada de hidrogel a 1,2%. Os lados planos permitem imagens claras, no entanto, os pequenos volumes limitam a duração dos experimentos antes que as células fiquem sem substratos de crescimento. (C) Configuração de imagem com lente zoom para obtenção de imagens de V. cholerae impressa em frasco de cultura de tecidos preenchido com matriz granular de hidrogel a 1,2%. Semelhante ao caso da micro-cubeta, as laterais planas permitem imagens claras. Os frascos de cultura de tecidos podem ser preenchidos com maiores volumes de matriz granular de hidrogel, prolongando o tempo experimental. (D) Imagem da lente zoom de V. cholerae impressa dentro de uma matriz de hidrogel granular a 1,2% após 100 h de incubação a 37 °C. Barra de escala = 1 mm. (E) Configuração de imagem com microscópio confocal para obtenção de imagens de células fluorescentes. (F) Projeção 3D de micrografias confocais de E. coli fluorescente dentro da matriz de hidrogel granular a 1,2% após 10 dias de incubação a 37 °C. Barra de escala = 50 μm. (G) Micrografia confocal de resolução de célula única de E. coli fluorescente dentro da matriz de hidrogel. Barra de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
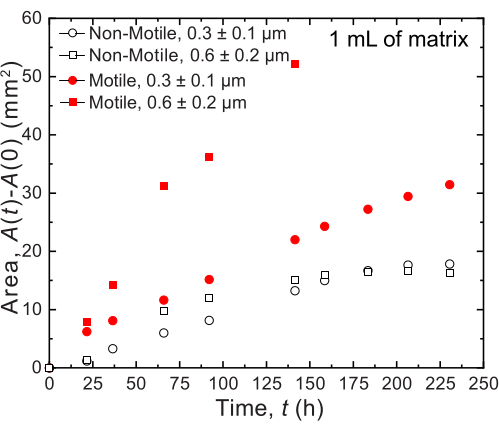
Figura 7: Expansão da área em função do tempo das colônias de V. cholerae impressas em 1 mL de matrizes de suporte de hidrogel granular. Os dados do gráfico são provenientes da análise das imagens da Figura 8. Observou-se que as células móveis (círculo vermelho fechado e quadrado) se espalharam mais rapidamente do que as células não móveis, refletindo a disseminação tanto pelo crescimento quanto pela motilidade. Além disso, as células móveis na matriz de hidrogel com um grande tamanho de poro (quadrados vermelhos) espalharam-se a uma taxa mais rápida do que as células na matriz de hidrogel com poros de 0,3 μm (círculos vermelhos). As células não móveis não mostram diferença na taxa de expansão areal entre os dois tamanhos de poros, pois estão apenas crescendo. Clique aqui para ver uma versão maior desta figura.

Figura 8: Colônias de V. cholerae impressas em 1 mL de matrizes de suporte de hidrogel granular. (A) Instantâneos do crescimento e motilidade de V. cholerae móvel em matriz hidrogel granular a 0,9% onde o tamanho dos poros é maior que o diâmetro celular médio. As setas indicam uma pluma difusa que se forma devido ao movimento das células através da matriz de hidrogel. (B) Instantâneos do crescimento e motilidade de V. cholerae móvel em uma matriz de hidrogel granular de 1,2% onde o tamanho dos poros é menor do que o diâmetro celular médio. As setas indicam uma pluma áspera, semelhante a fractal, que se forma devido ao crescimento celular. (C) Instantâneos da evolução temporal de V. cholerae não móvel em matriz de hidrogel granular a 0,9% onde o tamanho dos poros é maior que o diâmetro celular médio. Neste caso, plumas difusas que refletem a motilidade não são observáveis. (D) Instantâneos do crescimento de V. cholerae não móvel em uma matriz de suporte de hidrogel granular de 1,2% onde o tamanho dos poros é menor do que o diâmetro celular médio. Neste caso, plumas ásperas, semelhantes a fractais, refletindo o crescimento, são novamente observáveis. Barras de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
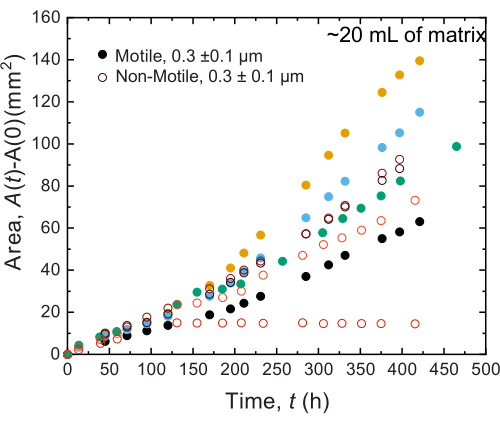
Figura 9: Expansão da área em função do tempo das colônias de V. cholerae impressas em 20 mL de matrizes de suporte de hidrogel granular a 1,2%. Observa-se que células não móveis (círculos abertos) e móveis (círculos fechados) se espalham em taxas semelhantes nas primeiras 100 h. Após 100 h, diferenças nas taxas de expansão areal são observadas, potencialmente devido à evolução da variabilidade em tempos longos. Clique aqui para ver uma versão maior desta figura.

Figura 10: Colônias de V. cholerae impressas em 22 mL de matrizes de hidrogel granular a 1,2% cultivadas a 37 °C. (Topo) Instantâneos do crescimento de V. cholerae móvel. (Parte inferior) Instantâneos do crescimento de V. cholerae não móvel. Em ambos os casos, plumas ásperas e semelhantes a fractais que refletem o crescimento são observáveis. Barras de escala = 2 mm. Clique aqui para ver uma versão maior desta figura.
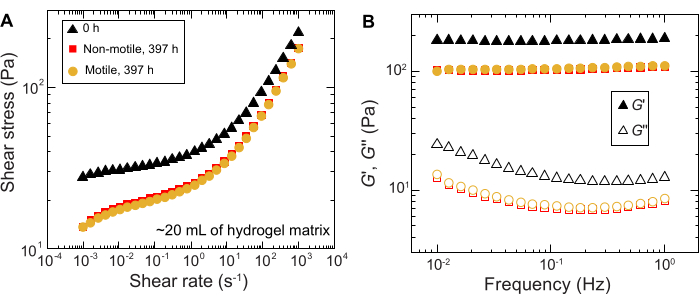
Figura 11: Caracterização das propriedades reológicas da matriz de hidrogel granular a 1,2% antes (0 h) e após o experimento (397 h). (A) Tensão de cisalhamento em função da taxa de cisalhamento aplicada. (B) Módulos de armazenamento e perda, G' e G'', respectivamente, em função da frequência de oscilação aplicada. Clique aqui para ver uma versão maior desta figura.
| Comandos Gcode | Tarefas | |||
| M82 | Modo de extrusão absoluta | |||
| M302 S0 | Permitir extrusão a frio | |||
| M92 E14575 | Ajuste as etapas de extrusão por mm | |||
| G92 X35.61 Y81 Z0 E0.0 | Defina o eixo z e a posição de extrusão para zero, e a posição x-,y- para 35,71 mm e y 88 mm onde a cabeça de impressão está quando o código g é iniciado | |||
| M221 S100 T0 | Define a taxa de fluxo para 100% | |||
| M107 | Desligue o ventilador | |||
| G1 F1 X35,61 Y81 E0,1 | Extrudir os 20 μL de biotinta para a matriz à taxa de alimentação de 50 μL/min, onde a posição atual foi definida | |||
| G0 F200 Z60 | Puxe a agulha para fora da matriz e do contianer da amostra a uma velocidade de 200 mm/min | |||
| G0 F500 X65.81 Y81.0 | Mover a agulha para o próximo contiainer de amostra a uma velocidade de 500 mm/min | |||
| G0 F100 Z0 | Abaixe a agulha no próximo contiainer da amostra até a mesma posição z em que a impressão começou a uma velocidade de 100 mm/min | |||
| G1 F1 X65.81 Y81.0 E0.2 | Extrudir os 20 μL de biotinta para a matriz à taxa de alimentação de 50 μL/min, onde a posição atual foi definida | |||
| G0 F200 Z60 | Puxe a agulha para fora da matriz e do contianer da amostra a uma velocidade de 200 mm/min | |||
| G0 F500 X96.01 Y81.0 | Mover a agulha para o próximo contiainer de amostra a uma velocidade de 500 mm/min | |||
| G0 F100 Z0 | Abaixe a agulha no contiainer da amostra até a mesma posição z em que a impressão começou a uma velocidade de 100 mm/min | |||
| G1 F1 X96.01 Y81.0 E0.3 | Extrudir os 20 μL de biotinta para a matriz à taxa de alimentação de 50 μL/min, onde a posição atual foi definida | |||
| G0 F200 Z60 | Puxe a agulha para fora da matriz e do contianer da amostra a uma velocidade de 200 mm/min | |||
| G0 F500 X126.21 Y81.0 | Mover a agulha para o próximo contiainer de amostra a uma velocidade de 500 mm/min | |||
| G0 F100 Z0 | Abaixe a agulha no próximo contiainer da amostra até a mesma posição z em que a impressão começou a uma velocidade de 100 mm/min | |||
| G1 F1 X126.21 Y81.0 E0.4 | Extrudir os 20 μL de biotinta para a matriz à taxa de alimentação de 50 μL/min, onde a posição atual foi definida | |||
| G0 F200 Z80 | Puxe a agulha para fora da matriz e do contianer da amostra a uma velocidade de 200 mm/min | |||
Tabela 1: Programação em código G para impressão de linhas verticais da suspensão bacteriana.
Arquivo suplementar 1: Arquivo STL para a braçadeira inferior Seringas Luer lock descartáveis de 1 mL para a extrusora de seringa. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: Arquivo STL para a braçadeira superior para seringas Luer lock descartáveis de 1 mL para a extrusora de seringa. Clique aqui para baixar este arquivo.
Arquivo suplementar 3: Arquivo STL para o adaptador de seringa para seringas Luer lock descartáveis de 1 mL para a extrusora de seringa. Clique aqui para baixar este arquivo.
Arquivo suplementar 4: arquivo STL para o porta-amostras de cubeta. Clique aqui para baixar este arquivo.
Arquivo suplementar 5: arquivo STL para o porta-amostra do frasco de tecido. Clique aqui para baixar este arquivo.
Arquivo Suplementar 6: Arquivo STL para a placa de 6 poços e a cama de impressão de placa de Petri de 35 mm. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Script personalizado para rastreamento de partículas. Clique aqui para baixar este arquivo.
Discussion
Etapas críticas do protocolo
É importante garantir que, ao preparar cada matriz de hidrogel, a matriz seja feita em um ambiente estéril. Caso contrário, pode ocorrer contaminação, que se manifesta como, por exemplo, microcolônias (pequenos esferoides) na matriz após vários dias. Durante o processo de mistura, é importante que todas as partículas de hidrogel granular seco sejam dissolvidas. Além disso, ao ajustar o pH de cada matriz de hidrogel com o NaOH, os grânulos começarão a inchar, o que aumenta a viscosidade da matriz de hidrogel, tornando a mistura mais difícil. O uso do misturador de suporte ajudará a garantir que o NaOH seja bem misturado à matriz de hidrogel. Durante o carregamento de cada suspensão bacteriana, bolsas de ar podem se formar na agulha. Para evitar esse problema, certifique-se de que a ponta da agulha esteja sempre sentada na suspensão bacteriana no tubo da centrífuga e não na parte inferior do tubo ou perto da superfície superior. Outra forma de superar essa questão é cultivar grandes volumes de células e, assim, ter volumes maiores da suspensão bacteriana para impressão.
Limitações
Atualmente, durante a impressão, a baixa viscosidade da suspensão bacteriana limita as geometrias que podem ser impressas e muitas vezes leva à formação de biofilme e crescimento no topo da superfície da matriz de hidrogel devido a células-traço. Existem alguns métodos potenciais para superar essa limitação, incluindo aumentar a viscosidade da suspensão bacteriana ou otimizar ainda mais as configurações da impressora 3D. Para aumentar a viscosidade da suspensão bacteriana, pode-se misturar a suspensão bacteriana com outro polímero - por exemplo, o alginato, que já foi usado anteriormente para a impressão 3D de bactérias em superfícies planas38. As configurações da impressora podem ser otimizadas para permitir a retração do êmbolo da seringa durante a retirada da agulha da matriz granular de hidrogel, o que teria o potencial de impedir que as células fossem depositadas durante a remoção da agulha da matriz de hidrogel.
A importância do método em relação aos métodos existentes/alternativos
O método aqui descrito permite a impressão de colônias bacterianas em matrizes granulares de hidrogel. As matrizes granulares de hidrogel permitem o estudo do impacto de fatores ambientais externos (por exemplo, tamanho dos poros, deformabilidade da matriz) sobre a motilidade e o crescimento de bactérias. Além disso, enquanto neste trabalho, LB é usado como meio de crescimento líquido para inchar a matriz de hidrogel, a matriz de hidrogel pode ser inchada com outros meios de crescimento líquidos, incluindo meios com antibióticos. Métodos prévios para o estudo de bactérias em ambientes confinados eram limitados pelo tempo de experimentação, pelo tamanho da malha polimérica e pela rigidez da matriz de hidrogel circundante37,38. Já existem protocolos para a confecção de matrizes granulares de hidrogel a partir de diferentes polímeros, de modo que o potencial para estudar os impactos de diferentes condições ambientais sobre a motilidade e o crescimento de bactérias é vasto. Este método permite o estudo de bactérias em ambientes de controle que mais facilmente recapitulam os ambientes que as bactérias habitam no mundo real, como o muco do hospedeiro ou o solo. Outra limitação de muitos outros métodos é a opacidade da matriz circundante; no entanto, essa abordagem usando materiais opticamente transparentes fornece a capacidade de explorar, por exemplo, o controle optogenético e o padrão de bactérias em 3D.
Além de estudar a motilidade e o crescimento, o método de impressão 3D descrito aqui supera a limitação de muitos outros métodos de bioimpressão que exigem a deposição de uma biotinta em um substrato e, portanto, são limitados na altura do material vivo projetado que podem produzir. No futuro, este protocolo de bioimpressão pode ser expandido para fabricar materiais biohíbridos misturando polímeros com células formadoras de biofilme. As matrizes de hidrogel granulares fornecem suporte para impressão 3D de materiais vivos mais espessos e em maior escala e geometrias mais complexas do que muitos outros métodos atuais de bioimpressão de bactérias. Enquanto este trabalho utilizou apenas V. cholerae e E. coli, outras espécies, como Pseudomonas aeruginosa, também foram impressas com sucessoem 3D 37. Além da impressão, a impressora pode ser adaptada para fazer uma amostragem controlada de bactérias após o crescimento para ver se houve alguma alteração genética, por exemplo.
Disclosures
A plataforma experimental usada para imprimir e fotografar comunidades bacterianas em 3D nesta publicação é objeto de um pedido de patente depositado pela Universidade de Princeton em nome de Tapomoy Bhattacharjee e S.S.D. (PCT Application number PCT/US/2020/030213).
Acknowledgements
R.K.B. agradece o apoio do Programa de Bolsistas Presidenciais de Pós-Doutorado. Este material também é baseado em trabalho apoiado pela NSF Graduate Research Fellowship Program Grant DGE-2039656 (para A.M.H.). A.S.D.-M. e H.N.L. agradecem o apoio do Lidow Independent Work/Senior Thesis Fund da Universidade de Princeton. Agradecemos também ao laboratório de Bonnie Bassler pelo fornecimento de cepas de V. cholerae. A S.S.D. reconhece o apoio da NSF Grants CBET-1941716, DMR-2011750 e EF-2124863, bem como do Eric and Wendy Schmidt Transformative Technology Fund, da New Jersey Health Foundation, do Pew Biomedical Scholars Program e do Camille Dreyfus Teacher-Scholar Program.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL cuvettes | VWR | 97000-586 | |
| 1 mL Luer lock syringe | BH Supplies | BH1LL | |
| 10 M NaOH | Sigma-Aldrich | 72068 | |
| 100 nm carboxylated fluorescent polystyrene nanoparticles (FluoSpheres) | Invitrogen, (ThermoFischer Scientific) | F8803 | |
| 15 mL centrifuge tubes | ThermoFischer Scientific | 14-955-237 | |
| 20 G blunt needle | McMaster Carr | 75165A252 | |
| 25 mL tissue culture flasks | VWR | 10861-566 | |
| 3D printer | Lulzbot | LulzBot Mini 2 | |
| 3D printing software | Cura | Cura-Lulzbot | |
| 50 mL centrifuge tubes | ThermoFischer Scientific | 14-955-239 | |
| Agar | Sigma-Aldrich | A1296 | |
| Carbomer Granular Hydrogel Particles | Lubrizol | Carbopol 980NF | dry granules of crosslinked acrylic acid/alkyl acrylate copolymers |
| Centrifuge (2 mL tube capacity) | VWR | 2405-37 | |
| Centrifuge (50 mL tube capacity) | ThermoFischer Scientific | 75007200 | Sorvall (brand) ST 8 (model) |
| Confocal Microscope | Nikon | A1R+ inverted laserscanning confocal microscope | |
| Glass bottom petri dish | Cellvis | D35-10-1-N | |
| Lennox LB (Lubria Broth) | Sigma-Aldrich | L3022 | |
| M8 × 1.25 mm, 150 mm long, Fully Threaded Socket Cap | McMaster Carr | 91290A478 | |
| M8 × 1.25 mm, Brass Thin Hex Nut | McMaster Carr | 93187A300 | |
| Open-source syringe pump | Custom-made | Replistruder 4 | https://www.sciencedirect.com/science/article/pii/S2468067220300791 |
| Petri dish (60 mm round) | ThermoFischer Scientific | FB0875713A | |
| Shear Rheometer | Anton Paar | MCR 501 | |
| Ultrasonic cleaner | VWR | 97043-992 |
References
- Persat, A., et al. The mechanical world of bacteria. Cell. 161 (5), 988-997 (2015).
- Stoodley, P., Dodds, I., Beer, D. D., Scott, H. L., Boyle, J. D. Flowing biofilms as a transport mechanism for biomass through porous media under laminar and turbulent conditions in a laboratory reactor system. Biofouling. 21 (3-4), 161-168 (2005).
- Ludemann, H., Arth, I., Liesack, W. Spatial changes in the bacterial community structure along a vertical oxygen gradient in flooded paddy soil cores. Applied and Environmental Microbiology. 66 (2), 754-762 (2000).
- Sicard, J. F., Bihan, G. L., Vogeleer, P., Jacques, M., Harel, J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology. 7, 387 (2017).
- Grice, E. A., Segre, J. A. The skin microbiome. Nature Reviews Microbiology. 9 (4), 244-253 (2011).
- Balzan, S., Quadros, C. D. A., Cleva, R. D., Zilberstein, B., Cecconello, I. Bacterial translocation: Overview of mechanisms and clinical impact. Journal of Gastroenterology and Hepatology. 22 (4), 464-471 (2007).
- Chaban, B., Hughes, H. V., Beeby, M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology. 46, 91-103 (2015).
- Datta, S. S., Steinberg, A. P., Ismagilov, R. F. Polymers in the gut compress the colonic mucus hydrogel. Proceedings of the National Academy of Sciences. 113 (26), 7041-7046 (2016).
- Harman, M. W., et al. The heterogeneous motility of the Lyme disease spirochete in gelatin mimics dissemination through tissue. Proceedings of the National Academy of Sciences. 109 (8), 3059-3064 (2012).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Siitonen, A., Nurminen, M. Bacterial motility is a colonization factor in experimental urinary tract infection. Infection and Immunity. 60 (9), 3918-3920 (1992).
- Lux, R., Miller, J. N., Park, N. H., Shi, W. Motility and chemotaxis in tissue penetration of oral epithelial cell layers by Treponema denticola. Infection and Immunity. 69 (10), 6276-6283 (2001).
- O’Neil, H. S., Marquis, H. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infection and Immunity. 74 (12), 6675-6681 (2006).
- Gill, C. O., Penney, N. Penetration of bacteria into meat. Applied and Environmental Microbiology. 33 (6), 1284-1286 (1977).
- Shirai, H., Datta, A. K., Oshita, S. Penetration of aerobic bacteria into meat: A mechanistic understanding. Journal of Food Engineering. 196, 193-207 (2017).
- Thornlow, D. N., Brackett, E. L., Gigas, J. M., Dessel, N. V., Forbes, N. S. Persistent enhancement of bacterial motility increases tumor penetration: Motility enhances bacterial tumor penetration. Biotechnology and Bioengineering. 112 (11), 2397-2405 (2015).
- Toley, B. J., Forbes, N. S. Motility is critical for effective distribution and accumulation of bacteria in tumor tissue. Integrative Biology. 4 (2), 165-176 (2011).
- Dechesne, A., Wang, G., Gülez, G., Or, D., Smets, B. F. Hydration-controlled bacterial motility and dispersal on surfaces. Proceedings of the National Academy of Sciences. 107 (32), 14369-14372 (2010).
- de Souza, R., Ambrosini, A., Passaglia, L. M. P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology. 38 (4), 401-419 (2015).
- Turnbull, G. A., Morgan, J. A. W., Whipps, J. M., Saunders, J. R. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiology Ecology. 36 (1), 21-31 (2001).
- Watt, M., Kirkegaard, J. A., Passioura, J. B. Rhizosphere biology and crop productivity—a review. Soil Research. 44 (4), 299-317 (2006).
- Adadevoh, J. S. T., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Retention of Bacteria in Porous Media with Residual NAPL Entrapment. Environmental Science & Technology. 52 (13), 7289-7295 (2018).
- Adadevoh, J. S. T., Triolo, S., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Residence Time of Bacteria in Granular Media Containing Distributed Contaminant Sources. Environmental Science & Technology. 50 (1), 181-187 (2016).
- Ford, R. M., Harvey, R. W. Role of chemotaxis in the transport of bacteria through saturated porous media. Advances in Water Resources. 30 (6-7), 1608-1617 (2007).
- Wang, M., Ford, R. M., Harvey, R. W. Coupled effect of chemotaxis and growth on microbial distributions in organic-amended aquifer sediments: Observations from laboratory and field studies. Environmental Science & Technology. 42 (10), 3556-3562 (2008).
- Amchin, D. B., Ott, J. A., Bhattacharjee, T., Datta, S. S. Influence of confinement on the spreading of bacterial populations. PLoS Computational Biology. 18 (5), e1010063 (2022).
- Moore-Ott, J. A., Chiu, S., Amchin, D. B., Bhattacharjee, T., Datta, S. S. A biophysical threshold for biofilm formation. eLife. 11, e76380 (2022).
- Tittsler, R. P., Sandholzer, L. A. The use of semi-solid agar for the detection of bacterial motility. Journal of Bacteriology. 31 (6), 575-580 (1936).
- Bhattacharjee, T., et al. Polyelectrolyte scaling laws for microgel yielding near jamming. Soft Matter. 14 (9), 1559-1570 (2018).
- Bhattacharjee, T., Datta, S. S. Confinement and activity regulate bacterial motion in porous media. Soft Matter. 15 (48), 9920-9930 (2019).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075 (2019).
- Bhattacharjee, T., Amchin, D. B., Ott, J. A., Kratz, F., Datta, S. S. Chemotactic migration of bacteria in porous media. Biophysical Journal. 120 (16), 3483-3497 (2021).
- Bhattacharjee, T., Amchin, D. B., Alert, R., Ott, J. A., Datta, S. S. Chemotactic smoothing of collective migration. eLife. 11, e71226 (2022).
- Tashman, J. W., Shiwarski, D. J., Feinberg, A. W. A high performance open-source syringe extruder optimized for extrusion and retraction during FRESH 3D bioprinting. HardwareX. 9, e00170 (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Chatterjee, T., Chatterjee, B. K., Chakrabarti, P. Modelling of growth kinetics of Vibrio cholerae in presence of gold nanoparticles: Effect of size and morphology. Scientific Reports. 7 (1), 9671 (2017).
- Martínez-Calvo, A., et al. Morphological instability and roughening of growing 3D bacterial colonies. Proceedings of the National Academy of Sciences. 119 (43), e2208019119 (2022).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward approach for 3D bacterial printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Zhang, Q., et al. Morphogenesis and cell ordering in confined bacterial biofilms. Proceedings of the National Academy of Sciences. 118 (31), e2107107118 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved