In Vivo הדמיה של כדורי כבד המושתלים בחדר הקדמי של עין העכבר
* These authors contributed equally
In This Article
Summary
כאן אנו מתארים פלטפורמה המאפשרת הדמיה לא פולשנית in vivo של ספרואידים בכבד המושתלים בחדר הקדמי של עין העכבר. תהליך העבודה משתרע מיצירת ספרואידים מתאי כבד ראשוניים להשתלה בעין העכבר והדמיית in vivo ברזולוציה תאית במיקרוסקופ קונפוקלי.
Abstract
מחקרים ביו-רפואיים של הכבד ביונקים מעוכבים על ידי היעדר שיטות להדמיית אורך לא פולשנית in vivo ברזולוציה תאית. עד כה, הדמיה אופטית של הכבד באתרו אפשרית על ידי הדמיה תוך חיונית, המציעה הדמיה ברזולוציה גבוהה ברמה התאית אך לא ניתן לבצעה מספר פעמים ולכן אורכית באותה חיה. שיטות הדמיה לא פולשניות, כגון ביולומינסנציה, מאפשרות מפגשי הדמיה חוזרים על אותו בעל חיים אך אינן משיגות רזולוציה של תאים. כדי להתמודד עם פער מתודולוגי זה, פיתחנו פלטפורמה להדמיית in vivo לא פולשנית של ספרואידים בכבד המושתלים בחדר הקדמי של עין העכבר. בתהליך העבודה המתואר במחקר זה, כדורי כבד ראשוניים של עכברים נוצרים במבחנה ומושתלים בחדר הקדמי של העין של עכברים מושתלים, שם הם מושתלים בקשתית. הקרנית פועלת כחלון גוף טבעי דרכו אנו יכולים לדמיין את הספרואידים המושתלים במיקרוסקופ קונפוקלי קונבנציונלי. הספרואידים שורדים במשך חודשים בעין, שבמהלכם ניתן לחקור את התאים בהקשרים של בריאות וחולי, כמו גם להיות מנוטרים בתגובה לגירויים שונים על פני מפגשי הדמיה חוזרים ונשנים באמצעות בדיקות פלואורסצנטיות מתאימות. בפרוטוקול זה, אנו מספקים פירוט של השלבים הדרושים ליישום מערכת הדמיה זו ומסבירים כיצד לרתום את הפוטנציאל שלה בצורה הטובה ביותר.
Introduction
הניטור של תפקוד הכבד ביונקים במהלך בריאות ומחלות מוגבל על ידי היעדר טכניקות הדמיה ברזולוציה גבוהה ולא פולשניות in vivo . ההדמיה של איבר זה מעוכבת על ידי מיקומו הבלתי נגיש, וכדי להרכיב תהליכים תאיים, מחקרי in vivo מסתמכים על הקרבת בעלי חיים בנקודות זמן שונות. כדי לעקוף מגבלת הדמיה זו, עבודה רבה מסתמכת על מודלים במבחנה , שבהם מיקרו-רקמות דמויות כבד מוצגות ונחקרות בסביבה מבוקרת.
בשנים האחרונות, פיתוח מערכות תרבית תלת ממדיות, כגון ספרואידים בכבד, סייע וקידם את חקר הכבד. ספרואידים בכבד הם אגרגטים רב-תאיים המחקים את המיקרו-סביבה ואת האינטראקציות המורכבות בין תאים של רקמת הכבד במידה מסוימת1 ומציעים יתרונות ברורים על פני תרביות חד-שכבתיות מסורתיות 2,3. ספרואידים בכבד משמשים גם כמודלים למחלות כבד שונות 4,5,6 וסייעו להבנת מנגנוני המחלה. עם זאת, מגבלות עיקריות של המודלים הנוכחיים של כבד במבחנה הן היעדר סביבה פיזיולוגית in vivo וזמן ניצול מוגבל בתרבית (סביב 20 יום)3. ספרואידים בכבד הושתלו בעבר באתרים שונים in vivo, כגון מתחת לכמוסת הכליה7 או intraperitoneally8, שאינם נגישים להדמיה אופטית. דימות כבד תוך חיוני היא טכניקה חדישה המציעה הדמיה ברזולוציית התא בזמן אמת. נכון לעכשיו, הדמיית כבד באתרו אפשרית רק על האיבר החיצוני, שהוא פולשני מאוד ולעתים קרובות טרמינל9. למרות שהתאמת חלון בטן תאפשר טיפולי הדמיה חוזרים ונשנים של הכבד, היא כרוכה בניתוח מורכב וטיפול לאחר מכן.
כדי לבצע ניטור אורכי ברזולוציה תאית, בחנו השתלה של ספרואידים בכבד לתוך החדר הקדמי של העין (ACE) של עכברים, שבו הרקמה דמוית הכבד מושתלת בסביבה פיזיולוגית, מחוברת לגירויי הגוף ונגישה לדימות אופטי. הקרנית היא רקמה שקופה ומשמשת כחלון דרכו ניתן לצלם מיקרו-רקמות המושתלות בקשתית באופן לא פולשני ואורכי באמצעות מיקרוסקופ קונפוקלי. כאן, אנו מציגים זרימת עבודה של פלטפורמה חדשה זו שפותחה עבור הדמיה in vivo של ספרואידים בכבד10. פרוטוקול זה הוא מדריך שלב אחר שלב ליישומו, המחולק ל-(1) מיצוי תאי כבד ראשוניים של עכברים והיווצרות במבחנה של ספרואידים בכבד, (2) השתלת ספרואידים בכבד לתוך ACE של עכברים מושתלים, ו-(3) הדמיה in vivo של ספרואידים מושתלים בכבד בעכברים מורדמים. יתר על כן, נציג כמה מהאפשרויות והיישומים של פלטפורמת הדמיה זו.
Protocol
כל ההליכים שבוצעו בבעלי חיים אושרו על ידי ועדת האתיקה לניסויים בבעלי חיים במכון קרולינסקה.
1. מיצוי תאי כבד ראשוניים של עכבר ויצירת ספרואידים במבחנה
- הכנה
- עבור קנולציה, כריתת כבד ובידוד של תאי כבד ראשוניים, הכינו את החומרים הסטריליים או החד-פעמיים הבאים בנוסף לפיפטות סרולוגיות ולצינורות צנטריפוגות (איור 1A): משאבה פריסטלטית, צנטריפוגת דלי נדנדה, פד סופג, מזרן דיסקציה, שני מלקחיים בעלי קצה מעוקל, מספריים כירורגיים, מחט פרפר אחת 27 גרם, מסננת תאים אחת בגודל 70 מיקרומטר, מרים תאים אחד, צלחת פטרי אחת בקוטר 100 מ"מ, תא ספירת תאים, ומיקרו-צלחות תחתונות בצורת U 96-Well.
- הכינו את התמיסות המשמשות לזילוח הכבד, בידוד תאי כבד ראשוניים ויצירת ספרואידים בכבד כמפורט בטבלה 1.
הערה: יש להכין את מאגר העיכול ואת תמיסת שיפוע השיפוע טריים. - הגדירו את מערכת הזילוח המורכבת ממשאבה פריסטלטית, אשר מוליכה תמיסות מאמבט המים בטמפרטורה של 42 מעלות צלזיוס אל הכבד (איור 1A). הטמפרטורה הגבוהה יותר של אמבט המים מבטיחה כי חוצצים להגיע לכבד בטמפרטורה אופטימלית של 37 °C (77 °F). התאם אישית זאת בהתאם לאורך הצינור ולטמפרטורת החדר (RT).
- עבור הקנולציה, להתאים מחט פרפר 27 G לקצה הצינור. שמור על מדיית הציפוי המשמשת בשלבי הבידוד הסופיים ב- 4 ° C.
- פרוצדורה
- חממו מראש את התמיסות הבאות באמבט המים של 42 מעלות צלזיוס בצינורות צנטריפוגות של 50 מ"ל: 40 מ"ל של PBS, 20 מ"ל של חיץ זילוח ו -12 מ"ל של חיץ עיכול.
- כדי לנקות ולחמם את צינורות המשאבה, הזרים כ -20 מ"ל של PBS שחומם מראש.
- החליפו את הצינור למאגר הזילוח, הגדילו את הצינור ומחט הפרפר והגדירו את קצב הזרימה ל-4 מ"ל/דקה. ודא שאין בועות בצנרת במהלך שינויי חיץ לאורך כל הפרוטוקול.
- הרדימו את העכבר על ידי נקע צוואר הרחם והשתמשו במחטים כדי לקבע את הגפיים ללוח הניתוח.
- הרטיבו את פרוות הבטן עם 70% אתנול ונתחו אותה כדי לגשת לאברי העיכול.
- הזיזו את המעיים ימינה כדי לחשוף את הווריד הפורטלי ואת הווריד הנבוב התחתון (איור 1B).
- מקננים את הווריד קאווה בערך באמצע אורכו עם המחט במצב אופקי, מוודאים שהיא יציבה ומתחילים את המשאבה.
- כאשר הכבד מתחיל להתנפח, או נקודות לבנות מופיעות באונות הקרובות יותר, חתכו את וריד השער כדי לאפשר למאגר הדם והזילוח להתנקז החוצה.
- הכבד צריך להתחיל להלבין מיד. עודדו ניקוי באמצעות מלקחיים מעוקלים כדי להדק את וריד הפורטל במרווחים של 5 שניות.
- חזור על שלב 1.2.9 עד שהכבד צהוב ונקי מדם (כ 15-20 מ"ל של חיץ זילוח).
- עצור את המשאבה הפריסטלטית כדי להחליף את הצינורית למאגר העיכול והפעל מחדש את המשאבה. כאשר מאגר העיכול מגיע לכבד, הפחיתו את קצב הזרימה ל-2.5 מ"ל/דקה.
הערה: הפנול האדום בחיץ העיכול מאפשר להבחין בהגעתו לכבד ומאפשר התאמה של פרמטרים של המשאבה במהלך הטיפול. - כדי לעודד את החיץ להגיע לכל אונות הכבד ולהבטיח עיכול תקין, חזור על שלב 1.2.9 מספר פעמים.
- עצור את זרימת המשאבה הפריסטלטית כאשר מאגר העיכול מתרוקן או שהכבד נראה מתעכל מספיק.
הערה: ניתן לנטר חזותית את מידת העיכול על ידי צביטה עדינה של אונות הכבד במלקחיים ובדיקה אם מופיעים סימנים קטנים על הרקמה. גם הכבד יהיה דקיק. - כדי לחלץ את הכבד, חתכו את רצועות הכבד ואת החיבורים בתוך חלל הבטן, במטרה להסיר אותו לחלוטין, והניחו אותו בצלחת פטרי המכילה 10 מ"ל של מדיום ציפוי קר (טבלה 1).
- לאחר הסרת כיס המרה, לעשות צביטות קטנות על האונות באמצעות מלקחיים, קורע קלות את הקפסולה בכבד. על ידי ניעור הכבד בצלחת, התבוננו בתאים הנשפכים החוצה למדיום.
- החזיקו את הכבד יציב עם מלקחיים, גררו בעדינות את מרים התאים לאורך האונות כדי לשחרר את התאים.
הערה: עיכול בין-לובולרי נכון יוביל להשעיית תאים במדיה, ולא לשברי רקמות. - באמצעות פיפטה סרולוגית, לאסוף את תרחיף התא מצלחת פטרי ולסנן דרך מסננת תאים 70 מיקרומטר הממוקם על צינור צנטריפוגה 50 מ"ל. השתמש מדיה ציפוי טרי לשטוף את צלחת של תאי כבד מעוכל ולהעביר אותם לפילטר.
- צנטריפוגה ב 50 x גרם במשך 5 דקות ב 4 ° C כדי pellet את התאים.
- הסר את supernatant, משאיר כ 1 מ"ל כדי לכסות את גלולת התא, מערבלים את הצינור כדי להשעות מחדש את התאים, ולאחר מכן בהדרגה להוסיף 10 מ"ל של ציפוי קר בינוני.
- הוסף את 10 מ"ל של תמיסת שיפוע לתרחיף התא והפוך בעדינות את הצינור 10 פעמים.
- צנטריפוגה ב 200 x גרם במשך 10 דקות ב 4 ° C.
- הגלולה מכילה תאי כבד ברי קיימא המועשרים בהפטוציטים, ואילו הסופרנאטנט מכיל תאים מתים ופסולת. יש להשליך את הסופרנאטנט באמצעות פיפטה סרולוגית, תוך השארת כ-1 מ"ל, ולהשהות מחדש את הגלולה על ידי ערבול עדין.
- הוסף 20 מ"ל של מדיום ציפוי קר למתלה התא ולצנטריפוגה ב- 50 x גרם למשך 5 דקות ב- 4 ° C כדי לשטוף את תמיסת השיפוע.
- הסר את supernatant, משאיר כ 1 מ"ל מעל הכדור, ו resuspend את התאים ב 20 מ"ל של מדיום ציפוי קר.
הערה: כאן, ניתן לדחוס את גלולת התא, כך שאם יש צורך, השתמש פיפטה סרולוגית 10 מ"ל כדי לנתק בעדינות את התאים. - קבע ידנית את מספר התא ואת הכדאיות באמצעות תא ספירת תאים ו- Trypan Blue.
הערה: תאי הפטוציטים ישקעו במהירות בצינור; כדי להשעות אותם מחדש, הפוך בעדינות את הצינור כמה פעמים. - זרעו את תאי הכבד ב-200 מיקרוליטר/באר של ציפוי בינוני ב-1200 תאים/באר לתוך לוחות היצמדות אולטרה-נמוכים של 96 באר.
הערה: נפח המדיה האופטימלי לכל באר הוא 200 μL; עם זאת, ניתן לזרוע תאים ב 100 μL / טוב. - סובבו את הצלחות ב 200 x גרם במשך 3 דקות כדי לאסוף את התאים במרכז הבארות.
- דגרו (37°C, 5% CO2) על התאים והניחו להם ליצור ספרואידים במשך 5 ימים (איור 1C) באופן טבעי.
- ביום 5, הוציאו בזהירות מחצית מהמדיה שבבאר והחליפו אותה באמצעי תחזוקה ללא נסיוב (טבלה 1). חזור על שלב זה כל 48 שעות עד יום 10, כאשר כדורי הכבד מוכנים להשתלה.
הערה: היווצרות מבנה דמוי קפסולה בכדורי כבד בתרבית מראה צבירה טובה וכדאיות.
2. השתלת ספרואידים בכבד לחדר הקדמי של העין (ACE)
- הכנה
- להשתלת ספרואידים של כבד לתוך ACE, הקפד לארגן את המשאבים הבאים (איור 2A): סטריאומיקרוסקופ, יחידת הרדמה איזופלורן, תא אינדוקציה, איזופלורן, כרית חימום, פלטת בסיס מתכת בהתאמה אישית, מחזיק ראש עכבר ומסיכת גז, מלקחיים המחוברים למפרק האוניברסלי המוצק, מזרק בוכנה מושחל המילטון 500 מיקרוליטר, סיליקון, פוליאתילן וצינורות משאבה, צינורית זכוכית קהה בהתאמה אישית או קטטר 24 גרם, אתנול 70%, מי מלח סטריליים, מחטים סטריליות 23 גרם, משחת עיניים (פרפין נוזלי וזלין ביחס של 1:1), מזרק חד פעמי של 1 מ"ל ותרחיף תאים 35 מ"מ.
- נקו את מזרק המילטון, הצינורית והצינורית על ידי העברת 70% אתנול ומלוחים.
- מלאו את מזרק המילטון, הצינור וצינורית הזכוכית במי מלח וקיבעו את מזרק המילטון לספסל במצב אופקי בעזרת סרט הדבקה (איור 2A).
- השתמשו בצינורית זכוכית קהה בהתאמה אישית.
- האריכו נימי זכוכית בורוסיליקט באמצעות מושך מיקרופיפטה דו-שלבי לקוטר פנימי של >300 מיקרומטר כדי לאפשר את שאיפת הספרואידים.
- משופעים ומקהים את הקצה באמצעות משופע מיקרואלקטרודות וחושפים את קצה הצינורית ללהבה למשך מספר שניות כדי לרכך את הקצוות.
הערה: שיפוע המיקרואלקטרודות מורכב מאבן שיוף מסתובבת המופעלת ידנית; לכן, הגדרות ספציפיות אינן ישימות.
- לחלופין, בנו צינורית באמצעות החלק הפלסטי של צנתר 24G (איור 2B).
- הכינו את יחידת איזופלורן ההרדמה וחממו את כרית החימום ל-37°C.
- מכסים את קצות המלקחיים המחוברים למפרק האוניברסלי המוצק עם חתיכת צינורות פוליאתילן כדי ליצור לולאה, המסייעת לייצב את העין.
- מעבירים את כדורי הכבד מהצלחת בעלת 96 הקידוחים לצלחת תרחיף תאים בקוטר 35 מ"מ עם אמצעי תחזוקה באמצעות פיפטה וקצה של 200 מיקרוליטר.
- פרוצדורה
- מרדימים את העכבר בתא האינדוקציה באמצעות מינון של 2.5% איזופלורן ואוויר של 280 מ"ל/דקה.
- כאשר העכבר מחוסר הכרה, הורידו את חומר ההרדמה ל-1.8% איזופלורן ו-280 מ"ל/דקה, חברו את צינור ההרדמה למחזיק הראש, והעבירו במהירות את בעל החיים לכרית החימום, תוך מיקום האף בתוך מחזיק הראש.
- לשתק את הראש עם הברגים, להוציא בעדינות את העין מהשקע ולאבטח אותה עם המלקחיים ולהניח טיפת מלח על שתי העיניים כדי למנוע התייבשות.
- תחת הסטריאוסקופ, השתמש מזרק המילטון כדי לשאוף ולאסוף את כדורי הכבד לתוך קצה הצינורית ולהשאיר אותם לנוח אופקית על משטח נקי.
הערה: מדיה שואפת יחד עם כדורי הכבד מסייעת למנוע מהם להידבק לדפנות הצינורית. - בזהירות לנקב את הקרנית באמצעות מחט 23 גרם ולייבש את הומור מימי מחלחל עם רקמה. במידת הצורך, כדי להרחיב את החתך, החליקו בזהירות את המחט הצידה כדי לחתוך את הקרנית.
הערה: מחט סטרילית חד פעמית משמשת לביצוע ניקוב הקרנית, כך שהקרנית אינה מחוטאת לפני החתך. - הוסיפו טיפות מלח לעין כדי למנוע ייבוש.
- קח את הצינורית המכילה את כדורי הכבד והחזק אותה במאונך כדי לאפשר לכדוריות להימשך לכיוון קצה הצינורית.
- הכניסו בעדינות את הצינורית לתוך החור, וכשהשיפוע מופנה לכיוון האישון, השתמשו במזרק המילטון כדי לגרש באיטיות את כדורי הכבד לתוך ACE (איור 2C).
הערה: לפני הסרת הצינורית, מומלץ להמתין מספר שניות עד שהלחצים הנוזליים בתוך העין ומחוצה לה יתאמו מחדש וימנעו את בריחת הספרואידים חזרה אל מחוץ לעין. - מחוץ לקרנית, מקמו את כדורי הכבד סביב האישון והרחיקו אותו מהחתך על-ידי דחיפת הקרנית בעדינות עם קצה הצינורית (איור 2C).
- המתן ~ 5-10 דקות עד שכדורי הכבד יתיישבו על הקשתית לפני שחרור העין מהמלקחיים.
- החל משחת עיניים וזלין על העין המנותחת, אשר מסייע לשמן ולרפא את הקרנית.
- אם תרצה, המשך לנתח את העין השנייה באותה שיטה.
- לפני התעוררות העכבר, לנהל משכך כאבים כדי למנוע אי נוחות לאחר הניתוח, למשל, 0.1 מ"ג / ק"ג buprenorphine במי מלח סטריליים, מנוהל תת עורית.
הערה: רק מנה אחת של משככי כאבים ניתנה לעכברים מכיוון שהם התאוששו במהירות מהליך קטן זה ולא הראו סימני כאב או שינוי בהתנהגות. מכיוון שהליך זה מהיר מאוד (לוקח פחות מ -10 דקות) וגורם לאי נוחות קלה בלבד, העכברים אינם זקוקים לטיפול לאחר הניתוח, מלבד שיכוך כאבים לאחר הניתוח המנוהל לפני התעוררות החיה.
3. הדמיית In vivo של ספרואידים מושתלים בכבד ב- ACE
- הכנה
- הכינו את החומרים והמכשירים הבאים להדמיית in vivo לא פולשנית של ספרואידים בכבד שהושתלו ב-ACE (איור 3A): מיקרוסקופ קונפוקלי זקוף, יעד טבילת מים למרחקי עבודה ארוכים, יחידת הרדמה איזופלורנית, תא אינדוקציה, איזופלורן, כרית חימום, פלטת בסיס מתכתית בהתאמה אישית, מחזיק ראש עכבר ומסיכת גז, מלקחיים המחוברים למפרק האוניברסלי המוצק, ג'ל דמעות מלאכותי, משחת עיניים (פרפין נוזלי וזלין ביחס של 1:1).
- חומרים אופציונליים כוללים בדיקות פלואורסצנטיות בהזרקה, מזרקים חד פעמיים ומחטי 27 G להזרקה תוך ורידית של הזנב.
- פרוצדורה
- מרדימים את העכבר בתא האינדוקציה באמצעות מינון של 2.5% איזופלורן ואוויר של 280 מ"ל/דקה.
- כאשר העכבר מחוסר הכרה, הורידו את חומר ההרדמה ל-1.8% איזופלורן ו-280 מ"ל/דקה, חברו את צינור ההרדמה למחזיק הראש, והעבירו במהירות את בעל החיים לכרית החימום, תוך מיקום האף בתוך מחזיק הראש.
- לשתק את הראש במחזיק הראש באמצעות הברגים.
- יש למרוח טיפה של ג'ל דמעות מלאכותי על שתי העיניים כדי למנוע התייבשות.
- בשלב זה, להזריק תוך ורידי בדיקות פלואורסצנטיות דרך וריד הזנב תמונה מיד לאחר מכן.
- הטו את הראש, הוציאו בעדינות את העין מהשקע, ואבטחו אותה במלקחיים למקומה מתחת למטרה.
- מרחו כמות נדיבה של ג'ל דמעות מלאכותי כדי למלא את החלל שבין הקרנית למטרה והתמקדו בכדורי הכבד דרך העינית.
הערה: במידת האפשר, הסר את העינית של אחד האוקולרים כדי להשיג ראייה שאינה מוגדלת ולאתר בקלות רבה יותר את הספרואידים על הקשתית. - על מנת לקבל הדמיה ברזולוציה גבוהה למרות תנועות הנשימה של החיה, השתמש במטרות 25x ובהגדרות ההדמיה הבאות: פורמט 512 x 512 פיקסלים, מהירות סריקה של 600 הרץ ועובי ערימת Z של 3 מיקרומטר. ראו הגדרות הדמיה מפורטות בטבלה 2.
הערה: במהלך ההדמיה, ריכוז ההרדמה מותאם מ 1.6-2.2 מ"ל / שעה isoflurane כדי להשיג קצב נשימה רדוד ומבוקר ובכך למזער את התנועה של החיה. - בסיום ההדמיה, יש לטפל בעיניים המצולמות באמצעות משחת עיניים וזלין לפני הסרת איזופלורן והתעוררות החיה.
Representative Results
תאי כבד ראשוניים, מועשרים עבור הפטוציטים, בודדו מכבד העכבר על-ידי זילוח דו-שלבי של collagenase, תוך שימוש במשאבה פריסטלטית כדי להפיץ חוצצים חמים דרך הכבד, תוך ניצול כלי הדם של האיבר כדי להעביר אנזימי דיסוציאציה לכל התאים (איור 1A). לשם כך, הווריד הנבוב התחתון עבר קנולציה, והווריד הפורטלי נחתך כדי לאפשר זרימה של חוצצים (איור 1B). ראשית, חיץ מבוסס HBSS נשטף דרך הכבד כדי לנקות את הדם. אם הקנולציה מצליחה ואין קרישי דם, הכבד הופך לצהוב תוך מספר שניות. שנית, חיץ עיכול המכיל את תערובת האנזימים Liberase הופץ דרך הכבד כדי לנתק את הרקמה לתרחיף חד-תאי. התאים נספרו ידנית ונזרעו ללוחות ULA (96-well ultra-low-adherence), המאפשרים הרכבה עצמית לספרואידים תוך מספר ימים. ביום 5 נוצרים הספרואידים, והקפסולה הדקה הגובלת בכדוריות מעידה על צבירה מוצלחת (איור 1C). אנו מחכים ליום ה-10 להשתלה, ואז הספרואידים קומפקטיים ופיתחו קשרים חזקים בין תאים לתאים. מספר תאי הזרעים לבאר קבע את גודל הספרואיד של הכבד, כאשר 1000, 1200 ו-1500 תאים/באר הניבו ספרואידים של 238 מיקרומטר ± 10 מיקרומטר, 248 מיקרומטר ± 17 מיקרומטר ו-298 מיקרומטר ±-19 מיקרומטר (ממוצע ± SD), בהתאמה (איור 1C,D). להשתלה, אנו בוחרים ספרואידים בקוטר של כ -250 מיקרומטר מהסיבות הבאות: (1) גודל הספרואידים לא צריך להיות גדול מדי כדי למנוע היפוקסיה וליבה נמקית, אבל צריך להכיל מספיק תאים כדי לתמוך בתקשורת התא תאים ולאפשר עיצוב מחדש של השתל בעין, (2) המשקל של ספרואידים בגודל זה מאפשר להם להימשך לכיוון הקשתית ולשפר את קליטתם, (3) גודל זה מתאים ביחס להשתלת 5-10 ספרואידים לעין עכבר.
ניתוח ההשתלה דורש מזרק מושחל ידני המחובר לצינורית זכוכית (איור 2A). צינורית הזכוכית מורכבת מנימי זכוכית בורוסיליקט ששונו בתוך הבית כדי לקבל קצה קהה עדין באמצעות מושך מיקרופיפטה ומשופע. ניתן ליצור צינורית חלופית פשוטה יותר באמצעות צנתר פלסטיק מסחרי המחובר לצינור המזרק ומיוצב בקצה פיפטה (איור 2B). הניתוח כולל חיסון של ספרואידים בכבד לתוך ACE דרך חתך בקרנית (איור 2C). הספרואידים מוקמו על גבולות האישון כדי להפוך אותם לנגישים יותר להדמיה ולמנוע מהם לנוע לזווית העין. עכברי אלבינו שימשו להשתלה, מכיוון שהקשתית הלא פיגמנטית שלהם מאפשרת הדמיה in vivo של כדורי הכבד המושתלים. עכברים מושתלים הושתלו בשתי העיניים עם 7-10 ספרואידים לעין, ותמונות סטריאוסקופיות צולמו 3 ימים לאחר ההשתלה (פוסט-טקס) כמו גם שבוע וחודש לאחר Tx כדי לתעד את ריפוי הקרנית ואת הצלחת השתלת הספרואידים (איור 2D). יש לציין כי השינוי במראה של כדורי הכבד ב-ACE בין מועד ההשתלה הטרי לבין השתלתם המלא נובע מהתיישבות השתל על הקשתית, כמו גם מצמיחת חד-שכבה של תאי קשתית מעל הספרואידים. שיעור הצלחת ההשתלה של ספרואידים בכבד ב-ACE הוא 70% (n = 9 עיניים בעכברים זכרים ונקבות כאחד) (איור 2E). הימים הראשונים שלאחר Tx הם הקריטיים ביותר להישרדות ולקליטה, ככל הנראה בגלל שהחיה המושתלת משפשפת את עיניה ומשחררת את הספרואידים לפני שהקרנית החלימה. גודלם של כדורי הכבד אינו שונה באופן משמעותי לאחר Tx, ושינויים בצורה מיוחסים לעיצוב מחדש של השתל ולקליטתו (איור 2F). חודש לאחר Tx, כל הספרואידים המושתלים שהיו נוכחים בקשתית היו וסקולריים ועצבניים, כפי שניתן לראות על-ידי צביעה אימונופלואורסצנטית (איור 2G).
הדמיה לא פולשנית in vivo מבוצעת בעכברים מושתלים מורדמים באמצעות מיקרוסקופ קונפוקלי זקוף ומטרת טבילה למרחקים ארוכים (איור 3A, טבלה 2). הדמיה פלואורסצנטית ב-ACE יכולה להיות מושגת באמצעות גישות שונות, כפי שמתואר באיור 3B. הזרקת בדיקות פלואורסצנטיות למחזור הדם של העכבר המקבל מאפשרת הדמיה של סוגי תאים ומבנים שונים בתוך הספרואידים. השתמשנו בלקטין כדי לסמן כלי דם (איור 3C), ב-CMFDA כדי לצפות ברשת קנאליקולי המרה (איור 3D) וב-pHrodo-LDL, שאישר ספיגה פעילה של LDL בתאים ספרואידים (איור 3E). ניתן להשתמש גם בכדורי כבד שנוצרו ממודלים של עכברי כתב. אלבומין-Cre:tdTomato ספרואידים אפשרו תיוג ומעקב אחר הפטוציטים (איור 3F), וספרואידים המבטאים את הביו-חיישן פלואורסצנטי של מחוון מחזור תאי יוביקוויטין (FUCCI) שימשו כדי להמחיש דינמיקה של מחזור התא ברזולוציה של תא בודד (איור 3G). לבסוף, ספרואידים בכבד יכולים לעבור הנדסה גנטית במבחנה לפני ההשתלה, ובמקרה של התמרה של נגיף הקשור לאדנו (AAV)-GFP, הביטוי נצפה in vivo במשך יותר מ-6 חודשים (איור 3H).
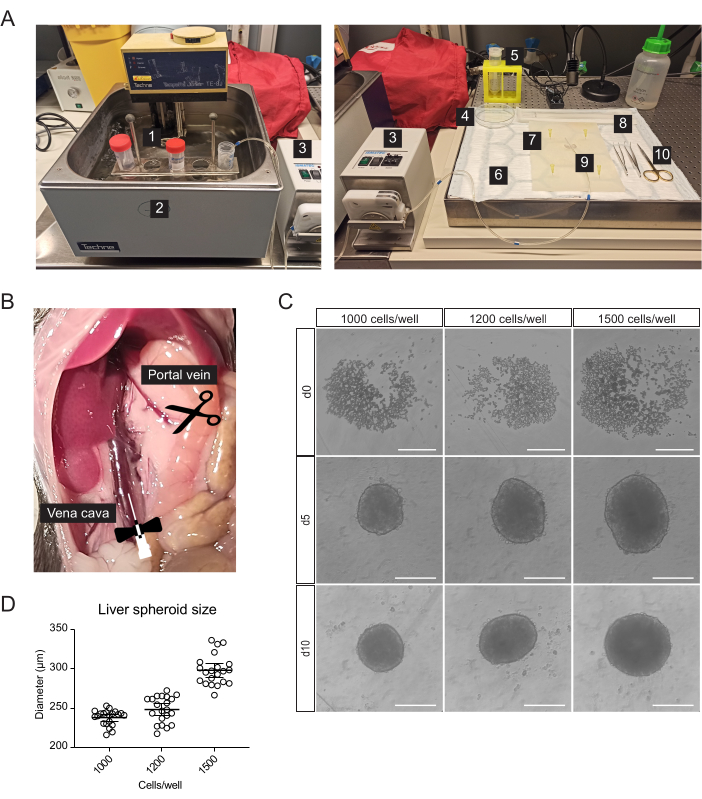
איור 1: בידוד של הפטוציטים ראשוניים של עכברים ויצירת ספרואידים בכבד. (A) חומר וציוד המשמשים לבידוד של הפטוציטים ראשוניים של עכברים: 1. מאגרי בידוד; 2. אמבט מים; 3. משאבה פריסטלטית; 4. צלחת פטרי; 5. מסננת תאים; 6. כרית סופגת; 7. מחצלת נתיחה; 8. מרים תאים; 9. מחט פרפר 27 גרם; 10. כלי נתיחה. (B) חלל הבטן במהלך הניתוח: הווריד קאווה מחורר ומחורר, והווריד הפורטלי נחתך כדי לאפשר זרימה של החוצצים. (C) תמונות ברייטפילד של היווצרות ספרואידים בכבד במבחנה ב-0 (d0), 5 (d5) ו-10 (d10) ימים לאחר הזריעה, פסי קנה מידה = 200 מיקרומטר. (D) גודל ספרואיד כבד בריכוזי זריעת תאים שונים, n = 21 ספרואידים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
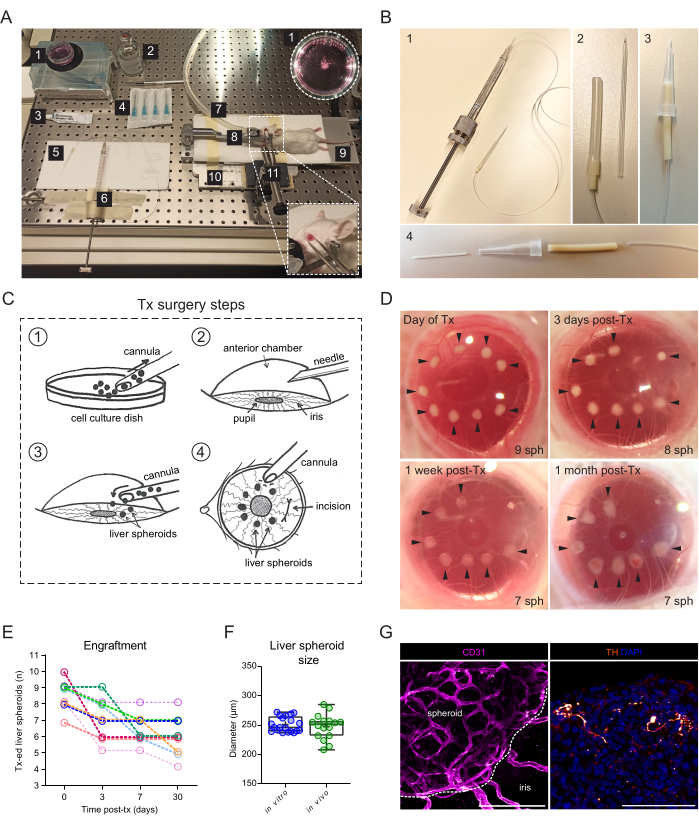
איור 2: השתלה והשתלה של ספרואידים בכבד לתוך ACE של עכברים. (A) חומרים וציוד המשמשים להשתלה (Tx) של ספרואידים בכבד לתוך ACE: 1. ספרואידים של כבד בצלחת תרבית; 2. מלוחים סטריליים; 3. משחת עיניים; 4. מחטים 23 גרם; 5. קנולה; 6. מזרק המילטון; 7. צינור גז הרדמה; 8. מחזיק ראש ומסכת גז; 9. כרית חימום; 10. לוח בסיס מתכת בהתאמה אישית; 11. מלקחיים ומפרק אוניברסלי מוצק. (ב) התקנת מזרק קנולה והמילטון: 1. צינורית זכוכית המחוברת למזרק המילטון באמצעות צינורות פורטקס ומחט 27G; 2. צינורית זכוכית מחוברת לצינורות הפורטקס באמצעות מקטעים נוספים של צינורות סיליקון וצינורות PharMed; 3. צינורית פלסטיק חלופית שהורכבה; 4. חלקים המרכיבים את צינורית הפלסטיק: צנתר פלסטיק 24G BD Insyte המחובר באמצעות צינורות PharMed ועטוף בקצה פיפטה חתך של 10 μl ליציבות ואחיזה. (C) איור של שלבי ניתוח Tx: 1. הספרואידים נאספים לתוך הצינורית; 2. הקרנית מנוקבת במחט; 3. הצינורית מוחדרת לחתך, והספרואידים משתחררים לתוך ACE; 4. מבחוץ של העין, הספרואידים ממוקמים קרוב לאישון והרחק מהחתך. (D) תמונות סטריאוסקופיות של כדורי כבד (sph) בעין העכבר ביום הניתוח וב-3, 7 ו-30 יום לאחר הניתוח. חצים מצביעים על ספרואידים בני קיימא. (E) ספרואיד כבד (גודל של 1200 תאים/באר) קצב קליטה לאחר Tx, n = 9 עיניים ב-6 עכברים מושתלים. (F) גודל ספרואידים בכבד בתרבית, לפני ההשתלה (במבחנה, n = 20 ספרואידים מהכנה יחידה) וחודש לאחר Tx ב-ACE (in vivo, n = 16 ספרואידים ב-3 עכברים מושתלים), המחושב על ידי ממוצע קטרים אנכיים ואופקיים. (G) צביעה אימונופלואורסצנטית של ספרואידים מושתלים בכבד חודשיים לאחר Tx, המראה וסקולריזציה (CD31, ורוד, קו מקווקו תוחם את המסה הספרואידית) ועצבוב סימפתטי (טירוזין הידרוקסילאז (TH), כתום), סרגל קנה מידה = 100 מיקרומטר. הנתונים עבור לוח F הותאמו באישור Lazzeri-Barcelo et al.10. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
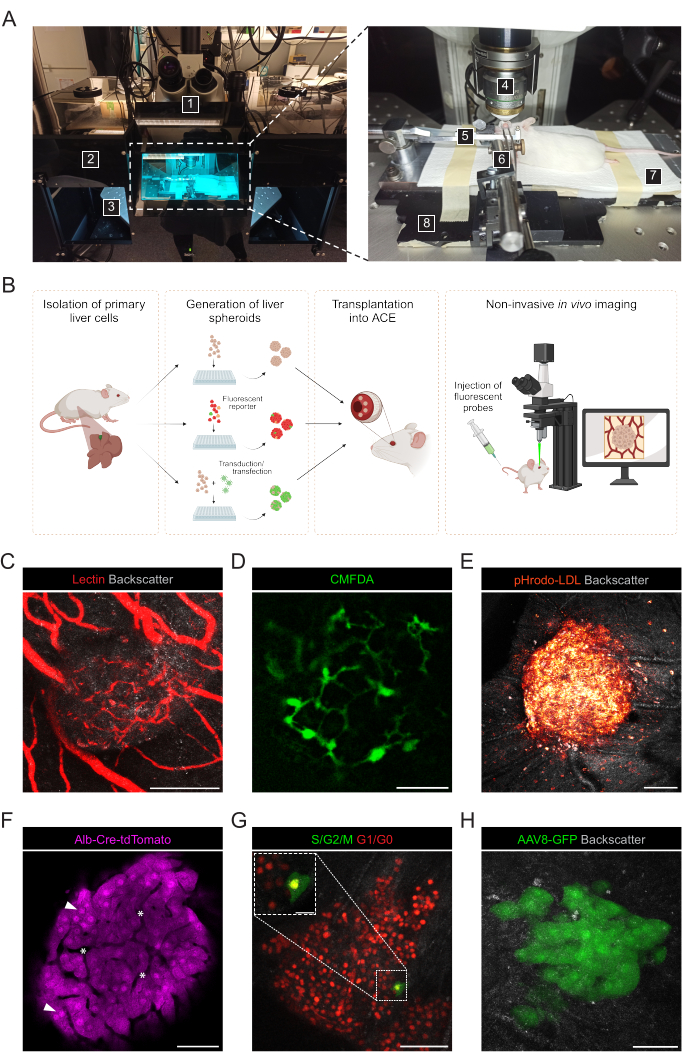
איור 3: הדמיה תוך-עינית לא פולשנית in vivo של ספרואידים מושתלים בכבד. (A) חומר וציוד המשמשים להדמיית ACE in vivo : 1. מיקרוסקופ קונפוקלי לסריקת לייזר זקוף; 2. קופסה כהה; 3. שלב XYZ ממונע; 4. טבילה-מטרה; 5. מחזיק ראש ומסכת גז; 6. מלקחיים ומפרק אוניברסלי מוצק; 7. כרית חימום; 8. פלטת בסיס מתכת בהתאמה אישית. (B) דיאגרמה המתארת גישות שונות המשמשות להדמיית in vivo של קריאות פלואורסצנטיות בכדורי כבד המושתלים בעין. (ג-ח) תמונות מייצגות של ספרואידים בכבד ACE במהלך הדמיה in vivo במיקרוסקופ קונפוקלי. אות הפיזור האחורי משמש לצפייה בנפח ובמבנה הספרואידים; (C) כלי דם המסומנים על ידי הזרקת לקטין פלואורסצנטי, סרגל קנה מידה = 100 מיקרומטר; (D) רשת Bile canaliculi המסומנת על ידי הזרקה של CMFDA פלואורסצנטי, סרגל קנה מידה = 50 מיקרומטר; (E) ספיגת LDL על ידי הזרקה של בדיקת pHrodo-LDL פלואורסצנטית, סרגל קנה מידה = 100 מיקרומטר; (F) הפטוציטים המבטאים Td-Tomato, ראשי חץ מציינים גרעינים וכוכביות מציינות כלי דם תוך-ספרואידיים, סרגל קנה מידה = 50 מיקרומטר; (G) ניטור הדינמיקה של מחזור התא בכדורי כבד המבטאים FUCCI, מוטות קנה מידה = 50 מיקרומטר (תמונה ראשית) ו-20 מיקרומטר (ניפוח). (H) ספרואידים בכבד שהותמרו במבחנה עם AAV8-GFP לפני Tx וצולמו בעין 6 חודשים לאחר Tx, סרגל קנה מידה = 50 מיקרומטר. התמונה בלוח G הותאמה באישור Lazzeri-Barcelo et al.10. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פתרונות המשמשים לבידוד של הפטוציטים ראשוניים של עכבר. הרכב פתרונות ומאגרים הדרושים לבידוד הפטוציטים של עכבר. יש לערבב את רכיבי חיץ העיכול ותמיסת שיפוע טריים ביום הבידוד. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2. הגדרות מיקרוסקופ קונפוקלי Leica SP5 המשמש להדמיית תוך עינית in vivo של ספרואידים בכבד. הטבלה הותאמה באישור Lazzeri et al.10. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
פרוטוקול זה מתאר פלטפורמה חדשנית להדמיית in vivo תוך עינית של ספרואידים בכבד המושתלים ב- ACE. ה-ACE שימש בעבר כאתר השתלה של מיקרו-רקמות אחרות שמקורן באיברים, כגון איי לבלב11,12, בשל המיקרו-סביבה הייחודית שלו, היותו עשיר בכלי דם, עצבים וחמצן, והגישה לדימות דרך הקרנית. בעוד שהדמיית כבד תוך חיונית מאפשרת הדמיה של תאים ותהליכים באתרם, ניטור אורכי אינו אפשרי. הדמיית כבד דרך חלון בטן כרוכה בניתוח מורכב, ותנועת האיבר בתוך הגוף מקשה על מעקב של תא בודד לאורך זמן. לפיכך, שיטת הדמיה חדשנית זו מאפשרת ניטור אורכי לא פולשני של תאי כבד ברזולוציה של תא בודד.
פרוטוקול זה מחולק לשלושה חלקים. הראשון הוא בידוד של הפטוציטים ראשוניים באמצעות זילוח collagenase דו-שלבי, המותאם מ- Charni-Natan et al.13, עם ההבדל שאנו מבצעים את זילוח הכבד על העכבר המת במקום על בעלי החיים החיים המורדמים. וריאציה זו מביאה יתרונות מסוימים, כגון פחות שיקולים אתיים והימנעות משאריות הרדמה באורגניזם. בעבודה זו, אנו מייצרים ספרואידים בכבד מהחלק המועשר בהפטוציטים של הבידוד, אך זה אינו שולל את הפוטנציאל לבודד אוכלוסיות תאים אחרות שאינן פרנכימליות באמצעות פרוטוקולים מיוחדים אחרים לייצור ספרואידים של תרבות משותפת בהרכב מגוון14,15.
החלק השני של פרוטוקול זה כולל השתלה של כדורי הכבד לתוך ACE של עכברים מושתלים. זהו ניתוח מהיר (מתחת ל-10 דקות) ופשוט המבוצע בעכברים מורדמים ואינו דורש כל טיפול לאחר הניתוח. הקרנית מנקבת את עצמה ומחלימה במשך 3-5 ימים. לעיתים, במהלך תהליך הריפוי, נצפה ערפול מסוים סביב החתך, אך זה חולף תוך מספר ימים. לא חווינו מקרים של סינכיה קדמית בעיני בעלי חיים מנותחים. אנו מבצעים את הליכי ההשתלה במעבדה נקייה אך באוויר הפתוח וללא בעיות של זיהומים בעיניים המנותחות. החיסון וקליטת הספרואידים בעין אינם פוגעים בראייה או משנים את התנהגותו של בעל החיים המקבל. בפרוטוקול זה, אנו משתמשים בהרדמה איזופלורנית הן לניתוחי השתלה והן להדמיית in vivo , אשר נסבלת היטב בעכברים. בשל השפעתו התלויה במינון, ניתן להתאים אותו בקלות לאורך כל ההליכים ומביא את היתרון של הפחתת זמני שינה והתעוררות. עם זאת, ניתן להשתמש בחומרי הרדמה חלופיים בהזרקה. לאחר ההשתלה, אנו בדרך כלל מאפשרים חודש אחד עבור הספרואידים להיקלט באופן מלא, להיות כלי דם, ועצבני, לפני ביצוע התערבויות טיפוליות הדמיית in vivo . הראינו גם כי השתלה והשתלה אפשרית באמצעות ספרואידים של כבד אנושי ועכברים מושתלים מדוכאי חיסון10.
החלק השלישי של שיטה זו הוא הדמיה in vivo של ספרואידים כבד מושתלים ב ACE. פרוטוקול זה מתאר את מערך ההדמיה in vivo , המשתמש בציוד מיקרוסקופיה הנפוץ במתקני הדמיה מחקריים. יתר על כן, החומרים המיוחדים, כגון מחזיק ראש העכבר וצינורית הפלסטיק, זמינים כעת באופן מסחרי. בעזרת מערך הדמיה זה, אנו מסוגלים ללכוד חתכי z ולקבל שחזור תלת מימדי של ארכיטקטורת הספרואידים, בהתאם לעומק חדירת הלייזר וגילוי הפלואורסצנטי. ניטור תפקוד התאים בכדורי הכבד המושתלים מסתמך על הדמיה של חלבונים פלואורסצנטיים המדווחים על סוגי תאים, תפקודים תאיים ודינמיקה. לפיכך, פלטפורמת הדמיה זו יכולה להיות מנוצלת באמצעות שיטות שונות, לבד או בשילוב: (1) בדיקות פלואורסצנטיות יכולות להינתן תוך ורידי, למשל, נוגדנים כדי לסמן ולעקוב אחר תאים כמו גם צבעים פונקציונליים; (2) ספרואידים בכבד יכולים להיווצר מתאים שבודדו ממודלים של עכברי כתב המבטאים חלבונים פלואורסצנטיים ספציפיים לכבד, למשל, ספרואידים של כבד FUCCI המדווחים על דינמיקה של מחזור התא; (3) היווצרות ספרואידים בכבד במבחנה יכולה להיות משולבת עם טרנספקציה או טרנסדוקציה, כדי לצייד את הספרואידים בחלבונים פלואורסצנטיים ובביוסנסורים. למשל, וירוסים הקשורים לאדנו. בסביבות הניסוי שלנו ועל ידי שימוש בפוטון יחיד לעירור, עומק ההדמיה שניתן להשיג הוא בערך 60-100 מיקרומטר. עם זאת, הדבר תלוי בעוצמת הלייזר ובזמינות ההדמיה המולטיפוטית, במאפייני הפליטה של הבדיקה הפלואורסצנטית וברגישות הגלאים, כמו גם בזווית העין בה מושתל הספרואידים. לאחר רכישת ההדמיה, ניתוח התמונה במורד הזרם יכול להתבצע באמצעות תוכניות פופולריות כגון Image J ו- Imaris. לדוגמה, במקרה של כתב FUCCI, ניתן לספור תאים פעילים במחזור התא בירוק ולהנגיד אותם למספר הכולל של תאים אדומים כדי להעריך את פעילות מחזור התא בתוך הספרואיד המושתל. בנוסף, פלטפורמת ההדמיה ACE מאפשרת למרוח חומרים על העין (בצורה של טיפות עיניים) או להזריק ישירות לתוך ACE כדי לטפל בשתל ולנטר את התגובה שלו. לאחר המוות, הספרואידים המושתלים ניתנים לאחזור בקלות על ידי מיקרודיסקציה ידנית ויכולים לספק מידע רב ערך על ידי טכניקות ex vivo , כגון צביעה אימונופלואורסצנטית, ניתוח שעתוק וכו '.10.
טכניקה זו יש מגבלות מסוימות. הראשונה היא שמניסיוננו, העכברים המקבלים חייבים להיות לבקנים, כלומר בעלי קשתית ללא פיגמנטציה. עם ההשתלה, הספרואידים של הכבד מתכסים על ידי שכבה אחת של תאי קשתית, אשר אינה משפיעה על הכדאיות או התפקוד של הספרואידים, אך הפיגמנט בתאי הקשתית מונע הדמיה. שיקול שני הוא היציבות במהלך הדמיה תוך עינית בעכברים מורדמים. במהלך מפגשי ההדמיה in vivo , יש לעקוב מקרוב אחר ריכוז ההרדמה והנשימה של בעל החיים כדי למזער את התנועה. עם זאת, באמצעות הגדרות ההדמיה שצוינו כאן, אנו מסוגלים להשיג הדמיה ברזולוציה גבוהה ברמת התא הבודד.
לסיכום, פרוטוקול זה מתאר יישום של פלטפורמת הדמיה לא פולשנית in vivo של רקמה דמוית כבד המושתלת בעיניהם של עכברים. אנו משתמשים בהליכים קלים, ציוד נפוץ וחומרים במחיר סביר, מה שהופך אותו לגישה בת השגה עבור חוקרים רבים. מודל זה משלב את היתרונות של ספרואידים תלת-ממדיים של כבד במבחנה עם הסביבה in vivo והנגישות האופטית המסופקת על ידי ACE כדי ליצור פלטפורמה רבת ערך לחקר פיזיולוגיה ופתולוגיה של הכבד במחקר בסיסי ובמסגרות פרה-קליניות.
Disclosures
P-OB הוא מייסד שותף ומנכ"ל של Biocrine AB, IBL ו- BL הם יועצים עבור Biocrine AB.
Acknowledgements
עבודה זו נתמכה על ידי האגודה השבדית לסוכרת, קרנות מכון קרולינסקה, מועצת המחקר השבדית, קרן נובו נורדיסק, קרן משפחת ארלינג-פרסון, תוכנית מחקר אסטרטגית בסוכרת במכון קרולינסקה, קרן קנוט ואליס ולנברג, קרן Jonas & Christina af Jochnick, האגודה השבדית לסוכרת ו- ERC-2018-AdG 834860-EYELETS. ציורי הדמויות נוצרו על ידי FL-B באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
References
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248 (2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297 (2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347 (2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014 (2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767 (2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086 (2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved