יצירת פרוסות רקמת לבלב אנושית לחקר פיזיולוגיה אנדוקרינית ואקסוקרינית של הלבלב
In This Article
Summary
פרוטוקול זה מתאר כיצד ליצור פרוסות לבלב אנושיות מתורמי איברים שנפטרו כדי לחקור את תפקוד התאים בתנאים כמעט פיזיולוגיים. גישה חדשנית זו מאפשרת לחקור איים נורמליים ופגועים מבנית ואת יחסי הגומלין המורכבים בין תאים אנדוקריניים ואקסוקריניים.
Abstract
חיוני לחקור את הלבלב האנושי כדי להבין את המנגנונים הפתופיזיולוגיים הקשורים לסוכרת מסוג 1 (T1D) וסוכרת 2 (T2D), כמו גם את הפיזיולוגיה האנדוקרינית והאקסוקרינית של הלבלב. הרבה נלמד מהמחקר של איי לבלב מבודדים, אבל זה מונע לבחון את תפקודם ואת יחסי הגומלין שלהם בהקשר של הרקמה כולה. פרוסות לבלב מספקות הזדמנות ייחודית לחקור את הפיזיולוגיה של איים נורמליים, מודלקים ופגועים מבנית בסביבתם הטבעית, ובכך מאפשרות לחקור אינטראקציות בין תאים אנדוקריניים ואקסוקריניים כדי לחקור טוב יותר את הדינמיקה המורכבת של רקמת הלבלב. לפיכך, אימוץ פלטפורמת פרוסת הלבלב החי מהווה התקדמות משמעותית בתחום. פרוטוקול זה מתאר כיצד ליצור פרוסות רקמה חיה מתורמי איברים שנפטרו על ידי הטבעה של רקמות בחיתוך אגרוז וויברטום, כמו גם את השימוש בהן להערכת קריאות תפקודיות כגון הפרשה דינמית והדמיית תאים חיים.
Introduction
מחקרים על הפיזיולוגיה של האיונים הם בסיסיים להבנת הפתוגנזה של סוכרת ופיתוח גישות טיפוליות חדשות. עד כה, המחקר הסתמך על איים מבודדים, אשר חושפים את האיים לעקות מכניות ואנזימטיות, מה שככל הנראה גורם לשינויים בפיזיולוגיה של התא; יתר על כן, לא ניתן להעריך את תפקוד האיונים בהקשר של סביבת הרקמה הטבעית שלהם, אשר מושפעת ככל הנראה על ידי תאים אקסוקריניים וכלי דם בין היתר1. כאשר חוקרים לבלב מתורמים עם סוכרת סוג 1, קיים האתגר שהאיים שלהם קשים לבידוד ועלולים להתפצל במהלך הבידוד, מה שעלול לייצר אפקט ברירה על איים שאולי אינם מייצגים את האוכלוסייה in vivo2. יתר על כן, איים יופרדו מסביבתם המורכבת ומקשריהם התאיים, במיוחד מתאי החיסון החודרים הנמצאים באיים מודלקים ונפוצים יותר בפריפריה של האיונים. לכן, בעוד איים מבודדים הם כלי אבן פינה במחקר סוכרת, יש מגבלות. בתגובה, אנו מציגים פרוטוקול פורץ דרך ליצירת פרוסות לבלב חיות, המציע פתרון לאתגרים אלה.
הפיתוח והאימוץ האחרונים של טכניקות חיתוך רקמת הלבלב נחשב לפריצת דרך ביכולתנו לחקור את הביולוגיה והתפקודים המורכבים של הלבלב. חדשנות זו פתחה אפיקים חדשים למחקרים דינמיים של פיזיולוגיה של איונים ואינטראקציות בין תאים אנדוקריניים, אקסוקריניים, עצביים, וסקולריים וחיסוניים בהקשר האנטומי הטבעי שלהם. שלא כמו גישות קונבנציונליות, הגדרה זו במבחנה משמרת חלק ניכר מהציטוארכיטקטורה של האיבר, ומאפשרת קירוב קרוב יותר לביולוגיה הטבעית שלו. שיטה זו, שפותחה לראשונה בעכברים על ידי Speier ו-Rupnik בשנת 20033, הדגימה את יעילותה להערכת הדמיית סידן, אלקטרופיזיולוגיה והפרשת הורמונים עבור איתות תוך-תאי ובין-תאי 4,5,6,7,8,9. לאחר מכן יושמה פלטפורמת פרוסת הלבלב לחקר רקמת הלבלב האנושית שהושגה באמצעות ביופסיה כירורגית 4,10,11,12. הקבוצה שלנו הדגימה את ההיתכנות של השגה וניצול של פרוסות לבלב מתורמי איברים גוותיים באמצעות פעילות הרשת לתורמי איברי לבלב עם סוכרת (nPOD)13. nPOD מספקת רקמות לבלב לחוקרים מוסמכים המבצעים מחקר על סוכרת מסוג 1 בבני אדם, ומאז אימוץ פלטפורמת פרוסות הלבלב nPOD מייצרת ומפיצה באופן שגרתי פרוסות לבלב חי 14,15,16,17. מאז יישום פלטפורמת פרוסות הלבלב בשנת 2020, nPOD חילקה בהצלחה פרוסות רקמה מ-43 תורמים (כולל 12 תורמים עם סוכרת סוג 1) לחוקרים רבים. באמצעות פרוסות אלה, החוקרים ביצעו מחקר פורץ דרך על היבטים קריטיים של תפקוד האיונים ובחנו את יחסי הגומלין בין איים לבין תאי כלי הדם, מערכת העצבים ומערכת החיסון בהקשר של T1D 13,18,19,20,21,22,23,24. מחקרים רבים הדגישו את המגבלות של גישות מסורתיות והדגישו את המשמעות של טכניקות שיכולות ללכוד את יחסי הגומלין הדינמיים בתוך הלבלב 25,26,27. יכולת ההסתגלות של טכניקות חיתוך מעכבר ללבלב אנושי, יחד עם שילובן בתוכניות כמו הרשת לתורמי איברי לבלב עם סוכרת (nPOD), מדגימה את ההכרה הגוברת בפוטנציאל של השיטה לפתוח תובנות יקרות ערך על מחלות כגון סוכרת מסוג 1.
Protocol
קטעי לבלב אנושיים מתורמי רקמות משני המינים הושגו באמצעות בנק רקמות של הרשת לתורמי איברי לבלב עם סוכרת (nPOD), אוניברסיטת פלורידה. רקמות איברים מאנשים שנפטרו ללא זיהוי נקבעו כמחקר בנושאים לא אנושיים בהתאם לחוקים ולתקנות של תרומת איברים וסווגו כנושאים לא אנושיים על ידי מועצת הביקורת המוסדית של אוניברסיטת פלורידה (IRB; IRB מס' 392-2008), ויתור על הצורך בהסכמה. רקמות nPOD המשמשות במיוחד לפרויקט זה אושרו כלא אנושיות על ידי IRB של אוניברסיטת פלורידה (IRB20140093).
הערה: לקוראים חדשים לחלוטין בטכניקת הפרוסה וביישומיה כגון פריפיוז'ן והדמיית סידן, מומלץ לצבור ניסיון מעשי ולפתח מיומנויות בסיסיות באמצעות פרוסות עכבר או חולדה 3,28 לפני עבודה עם דגימות אנושיות.
1. הכנות
הערה: יש לבצע תכשירים אלה לפני הגעת הרקמות.
- הכינו את חיץ HEPES על ידי ערבוב 125 mM NaCl, 5.9 mM KCl, 2.56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES, 0.1% BSA, 2 mM L-אלנין, L-ארגינין ו-L-גלוטמין. התאימו את רמת החומציות ל-7.4 וסננו סטריליזציה.
- הוסף גלוקוז או גירויים אחרים למאגר כדי להכין פתרונות לניסוי פריפיוז'ן. עבור מאגר הבסיס להוסיף 5.5 mM גלוקוז. חיץ זה ישמש להליכי חיתוך, איסוף פרוסות ותכשירי פריפיוז'ן.
- הכינו לפחות שתי מנות לאיסוף פרוסות על ידי הוספת אפרוטינין (10 מיקרוגרם/מ"ל) למאגר הבסיסי.
- הכינו תמיסת אגרוז עם נקודת התכה נמוכה של 3.8% במאגר HEPES ללא BSA וחומצות אמינו (125 mM NaCl, 5.9 mM KCl, 2.56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES) ושמרו אותה בטמפרטורה של 37°C.
- להרכיב את הוויברטום, על ידי הנחת להב טרי במחזיק. אם רלוונטי, הגדר את זווית הלהב ל- 15° (אם אתה משתמש ב- Leica VT1200S). במידת הצורך, כייל את הוויברטום.
- הפעל את מכונת הפריפיוז'ן, בחר מספר תאים ופרוטוקול תוכנית.
- הכניסו את כל הפתרונות הדרושים למכונת הפריפיוז'ן, הפעילו את המערכת ושמרו על חימום התמיסות. המכונה מחשבת את הנפחים הדרושים של כל פתרון המשמש לפרוטוקול.
2. עיבוד רקמות
הערה: יש ליצור פרוסות מיד לאחר קבלתן. כל עיכוב עלול לגרום לקשיים בהליך ולהוביל להתפרקות רקמות.
- הניחו את רקמת הלבלב בצלחת עם חיץ בסיסי מתחת למיקרוסקופ סטריאו (איור 1A). הסר בעדינות רקמות חיבור, פיברוטיקה ושומן באמצעות מלקחיים ומספריים.
- חתכו רקמה למספר חתיכות קטנות של כ-0.5 ס"מ3 (איור 1B) באמצעות מספריים או אזמל. כתם חתיכות לבלב יבש על נייר טישו.
- מעבירים 4 חתיכות לצלחת פטרי בקוטר 35 מ"מ וממלאים את הכלים בתמיסת אגרוז עד שכל החתיכות שקועות במלואן. לאפשר agarose להתמצק לחלוטין.
- בזהירות לחתוך חתיכות מתוך agarose. הפעל את האזמל לאורך קצה המנה כדי להסיר את האגרוז ולהפריד בזהירות גושי רקמות. ודא שהחלקים מוקפים בשכבה דקה של אגרוז.
3. חיתוך
- הדביקו חתיכות רקמה על לוח המתכת של הוויברטומה על ידי הנחתן הפוכה.
- הרכיבו את הצלחת במגש ומלאו את המגש במאגר קווי בסיס (HEPES המכיל גלוקוז בסיסי של 5.5 מילימטר).
- הגדר את הוויברטום לחיתוך אוטומטי ב- 120 מיקרומטר וכוונן את מיקום ההתחלה והסיום.
- הזיזו את הלהב מעט מעל הרקמה והתחילו לחתוך במהירות איטית (0.1 מ"מ לשנייה) ומשרעת ב-0.8 מ"מ. ניתן להגביר את המהירות אם הרקמה מאפשרת זאת (איור 1C).
- אספו פרוסות בעזרת מלקחיים מעוקלים או מברשת קטנה. צברו פרוסות במאגר קו הבסיס המכיל אפרוטינין (איור 1D).
- הניחו לפרוסות לנוח לפחות שעה אחת במאגר מקו הבסיס עם אפרוטינין. הניחו את הפרוסות על שייקר אורביטלי איטי כדי לאפשר שטיפה החוצה של אנזימים המשתחררים בתהליך החיתוך.
4. בדיקה חיה/מתה
הערה: זוהי בדיקה אופציונלית שתציג כדאיות של פרוסות רקמות לאחר ההליך. עם זאת, לא ניתן לעשות שימוש חוזר בפרוסות לאחר שהן מוכתמות.
- מעבירים פרוסה בודדת למאגר מלא היטב בקו הבסיס.
- יש להוסיף דיאצטט פלואורסצאין (FDA, 50 מיקרוגרם/מ"ל), לדגור במשך דקה אחת בטמפרטורת החדר ולהגן מפני אור.
- מוסיפים פרופידיום יודיד (PI,50 מיקרוגרם/מ"ל), דוגרים למשך דקה אחת בטמפרטורת החדר ומגנים מפני אור.
- מעבירים פרוסה לבאר אחרת מלאה ב-PBS לשטיפה למשך דקה.
- העבירו פרוסות לצלחת פטרי או הרכיבו אותן על מגלשת זכוכית עם מחליק כיסוי לצורך הדמיה (איור 2A,B).
5. פריפוזיה
הערה: פרוטוקול זה מתאר כיצד לבצע פריפיוז'ן דינמי עבור פרוסות רקמות, אולם הוא מתאים גם לאיים מבודדים. תאי איילט יצטרכו הכנה עם נייר סינון ותמיסת חרוזים לפני טעינת האיים כמתואר במדריך למשתמש של המכונה. עם זאת, ניתן להשתמש באיון ובתא פרוסה יחד באותו ניסוי.
- בחרו 3 פרוסות וקצצו את האגרוז למינימום תחת סטריאומיקרוסקופ באמצעות מברשת ואזמל.
- הוסיפו טיפה של מאגר קו הבסיס (HEPES המכיל 5.5 מילימטר גלוקוז בסיסי) על הרשת של תא הפרוסה והניחו בעדינות פרוסה אחת על הרשת. חזרו על הפעולה עבור כל אחת מ-3 הפרוסות (איור 3A). אם הפרוסות קטנות מאוד, ערמו יותר מ-3 תאים כדי להגדיל את ספירת האיונים. אין להניח יותר מפרוסה אחת בכל חדר.
הערה: מספר האיים בכל פרוסה משתנה מאוד בין תורמים ותלוי בגודל הפרוסה (10-100 איים לפרוסה). בסך הכל 3 פרוסות הוכחו כמספיקות למדידת הפרשת אינסולין וגלוקגון. - עבור איים מבודדים, השתמש במינימום של 30 איים לכל עמודה להפרשת אינסולין. מומלץ להשתמש ב -100 איים לזיהוי גלוקגון. הרכיבו חלקי תא פרוסה בודדים מלמעלה למטה.
- חברו את תא הפרוסה לצינורות הזרימה והזרימה במכונה והפעילו את הפרוטוקול (איור 3C).
- השתמש בחימום התא ובמשאבת קירור המגש במהלך הפרוטוקול. שנה את לוחות האיסוף במהלך הפרוטוקול ואחסן ב -4 ° C אם הכימות מתבצע באותו יום או לאחסן ב -80 ° C עד אז.
- כאשר הפרוטוקול נעשה, להסיר תאים, לפרק ולאסוף פרוסות עבור ליזה (3% HCl באתנול מוחלט) או קיבוע (ב 4% Paraformaldehyde).
- נקו את המכונה על ידי שטיפתה במים, 10% אקונומיקה, מים ואוויר.
- כמת את הפרשת ההורמונים באמצעות ערכות זיהוי מסחריות.
הערה: איור 4 מראה רמות מוחלטות של הפרשת אינסולין וגלוקגון של 3 פרוסות כדי להעריך טווחי ריכוז.
6. הדמיית סידן
- הכינו תמיסת צבע סידן (למשל, Fluo4-AM, Calbryte) בהתאם להוראות היצרן.
- יש לדלל את הצבע בתמיסת חיץ HEPES בסיסית ולהוסיף אפרוטינין (10 מיקרוגרם/מ"ל).
- מעבירים פרוסה אחת ודגרים במשך 30-60 דקות על שייקר אורביטלי בטמפרטורת החדר ומגנים מפני אור.
- בזמן הדגירה, הכינו את מערך הדמיית הפרוסה על-ידי מילוי מזרקי הפריפוזיה והכנת צינורות (איור 5A,B).
- חבר את כל המכשירים, הפעל את תנור החימום והתחל את זרימת המשאבה. מומלץ להשתמש הן בחימום בזרימה והן במחמם פלטפורמה ובקצב זרימה של 0.5 מ"ל/דקה.
- מניחים בעדינות פרוסה בודדת בתא ההדמיה ומהדקים באמצעות נבל.
- השתמש במטרה להגדלה נמוכה כדי לזהות אזור הדמיה. שימוש בהשתקפות עוזר לזהות את אזור האיון (איור 5C).
- עבור ליעד הגדלה גבוה יותר (למשל, 20x או 40x) והתאם את המיקום בהתאם להגדרת הניסוי.
הערה: כדי להבטיח כדאיות תאים אופטימלית ושלמות איון, מומלץ שהחלקים האופטיים יהיו 1-2 שכבות תאים מתחת לפני החיתוך. - הגדר מיקום סריקה של מחסנית z או אריחים. הגדר מרווח זמן להדמיה ומשך ההקלטה. כאן, רזולוציה של לפחות 256 x 256 שימשה כדי לאפשר הבחנה של תאים בודדים, מרווח הדמיה של 5-10 שניות וטווח מחסנית z (אם רלוונטי) של 30-60 מיקרומטר עם מרווח של 10 מיקרומטר בין מישורים (שכבת תא אחת). ראה איור 6 לקבלת הגדרות הדמיה מפורטות.
הערה: הגדר את פרמטר ההדמיה כדי לקבל את הרזולוציה הטובה ביותר ואת השטח המרבי, אך הימנע מהלבנת הדגימה. - התחל הדמיה והחלף זרימת פתרון בהתאם לניסוי. לאחר שתסיים, לאסוף פרוסות לתקן אותם עבור immunohistochemistry.
Representative Results
כאשר הפרוטוקול מבוצע בהצלחה, 1 גרם של רקמת הלבלב מניב כ 100-200 פרוסות. לאחר מכן, פרוסות אלה צריכות לעבור בדיקת סטריאומיקרוסקופ כדי לזהות את אלה העשירים באיונים לפני שימשיכו בהערכות תפקודיות. הכדאיות, שנקבעת על-ידי התוויה עם פלואורסצאין דיאצטט (FDA) ופרופידיום יודיד (PI), צפויה להגיע ל-80%-90% (איור 2A). הכדאיות עשויה להיות נמוכה משמעותית במשטח החיתוך עקב נזק לתאים במהלך תהליך החיתוך. בפרוסות בנות קיימא נצפתה הפרשת הורמונים דינמית (איור 2B), שגורמת לשחרור אינסולין חזק בחשיפה לדפולריזציה גבוהה של גלוקוז וממברנה עם אשלגן כלורי (KCl).
לעומת זאת, כאשר יש עיכובים במהלך הליך החיתוך או שאיכות הרקמה אינה אופטימלית, התוצאות שונות באופן משמעותי. מספר הפרוסות המתקבלות עשוי לרדת, והערכת הכדאיות עשויה להצביע על שיעור גבוה יותר של תאים שאינם בני קיימא המסומנים ב-PI (איור 2C). במקרים אלה, ההערכה התפקודית מצביעה על תגובה מופחתת או אפילו נעדרת לדפולריזציה גבוהה של גלוקוז וקרום (איור 2D). הנתונים מניסויים תת-אופטימליים ממחישים את החשיבות של ביצוע מדויק בזמן ואיכות הרקמות, שכן הם יכולים להוביל לירידה בכדאיות הרקמה ולפגיעה בתפקוד. תוצאות שליליות אלה משמשות תזכורת חשובה לגורמים הקריטיים שיש לקחת בחשבון בהצלחת שיטה זו.
ממצאים נפוצים בדימות סידן מוצגים כמפת חום, כפי שמתואר באיור 5D, או כעקבות נפרדים עבור תאים בודדים, כפי שמוצג באיור 5E. חשוב להדגיש כי הצבע מסמן את כל סוגי התאים ללא הבחנה, ולכן גירויים ספציפיים חיוניים להבחנה בין תאים על פי תגובותיהם. כדי לזהות תאים בני קיימא, אנו משתמשים ב- KCl וממיינים את התאים בהתבסס על תגובות העולות על התגובה הבסיסית הממוצעת ביותר משתי שגיאות תקן. יתר על כן, ניתן לקבע ולהכתים פרוסות, מה שמאפשר זיהוי של סוגי תאים.
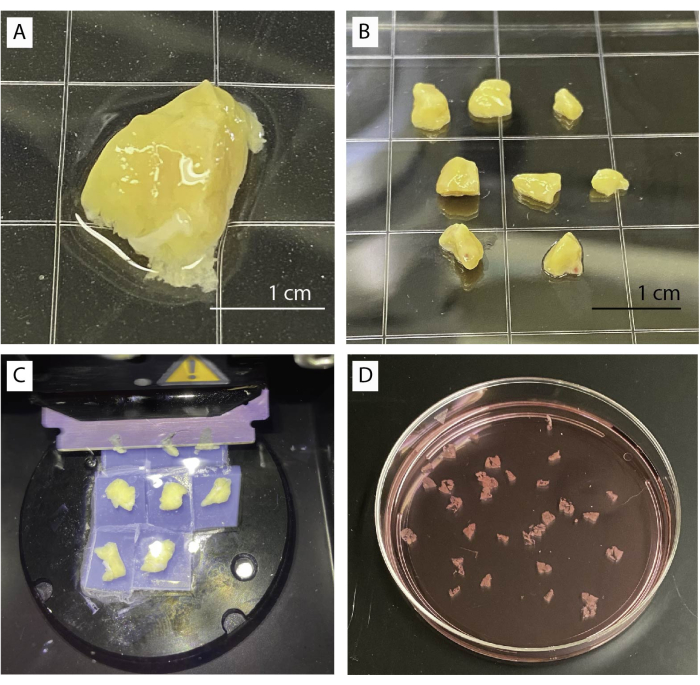
איור 1: עיבוד רקמות וחיתוך. (A) 1 גרם של רקמת לבלב לא מעובדת. (B) חתיכות לבלב מנוקות המוכנות להטמעת אגרוז. (C) הליך חיתוך באמצעות ויברטום. (D) פרוסות לבלב אנושי שזה עתה נחתכו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
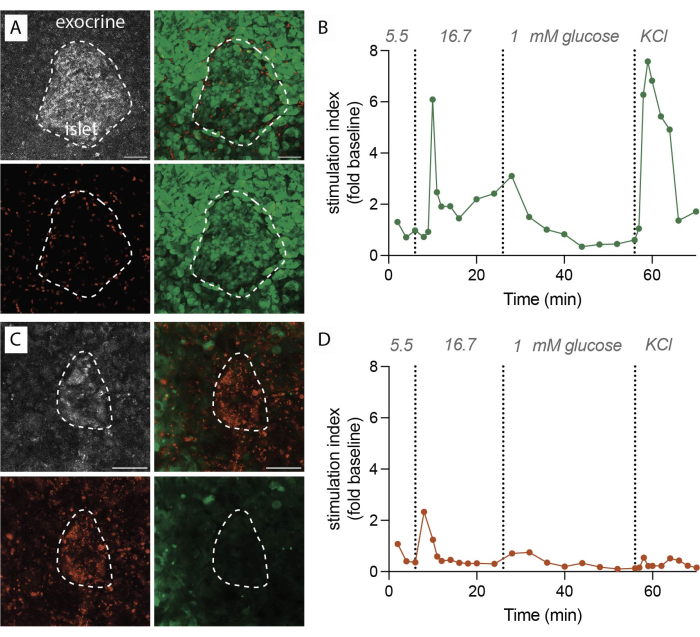
איור 2: נתוני כדאיות רקמות והפרשת אינסולין. (A) תמונות מייצגות עבור פרוסות רקמה בנות קיימא. הקרנה בעוצמה מרבית של אור לייזר מוחזר (אפור, למעלה משמאל), PI עבור תאים מתים (אדום, למטה משמאל), FDA עבור תאים חיים (ירוק, למטה מימין), ותמונות ממוזגות עבור תאים חיים ומתים (למעלה מימין). קו מקווקו מציין איון. סרגל קנה מידה 50 מיקרומטר. (B) הפרשת אינסולין דינמית של פרוסות רקמת לבלב אנושית מתורם יחיד שאינו סוכרתי. קינטיקה של אינסולין מראה תגובת שיא בשלב הראשון לאחר 6 דקות של גירוי גלוקוז גבוה, ואחריה שלב שני מישורי. הנתונים מנורמלים להפרשה הבסיסית הממוצעת של 5.5 מילימטר גלוקוז (מדד גירוי, שינוי קיפול). ההפרשה בוצעה על פרוסות מאותו תורם כפי שמוצג ב-(A). (C) תמונות מייצגות לפרוסות רקמה שאינן בנות קיימא. הקרנה בעוצמה מרבית של אור לייזר מוחזר (אפור, למעלה משמאל), PI עבור תאים מתים (אדום, למטה משמאל), FDA עבור תאים חיים (ירוק, למטה מימין), ותמונות ממוזגות עבור תאים חיים ומתים (למעלה מימין). קו מקווקו מציין איון. סרגל קנה מידה 50 מיקרומטר. (D) הפרשת אינסולין דינמית של פרוסות רקמת לבלב אנושית מתורם יחיד שאינו סוכרתי. קינטיקה של אינסולין הדגימה אובדן ברור הן של הפרשת אינסולין מגורה גלוקוז והן של דה-פולריזציה של הממברנה עם KCl. הנתונים מנורמלים להפרשה הבסיסית הממוצעת של 5.5 מילימטר גלוקוז (מדד גירוי, שינוי קיפול). ההפרשה בוצעה על פרוסות מאותו תורם כפי שמוצג ב-(C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: העמסת רקמות עבור פריפיוז'ן דינמי. (A) תאי פרוסות מוערמים. פרוסות בודדות נטענות על רשת מתכת כפי שמוצג בעלון. (B) העמסת איים מבודדים בתאי איונים. פרוסות ותאי איונים המחוברים למכונת פריפיוז'ן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
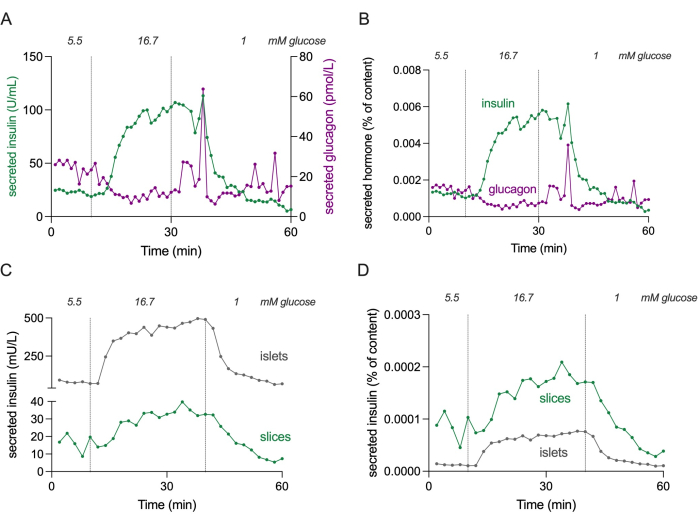
איור 4: הפרשת הורמונים בפרוסות ובאיים מבודדים. הנתונים המוצגים בלוחות (A) ו-(B) מגיעים מתורם שונה בהשוואה ללוחות (C) ו-(D). (A) הפרשת הורמון אבסולוטית מ-3 פרוסות רקמת לבלב מתורם יחיד שאינו חולה סוכרת. הפרשת אינסולין מוצגת בהפרשת גרין וגלוקגון במגנטה. (B) הפרשת הורמונים המוצגת ב-(A) מנורמלת לתכולת ההורמונים הכוללת (% מהתוכן). התוכן נמדד מכל 3 הפרוסות ששימשו בניסוי. (C) הפרשת אינסולין דינמית של איים מבודדים (100 איונים) ופרוסות רקמת לבלב (3 פרוסות) מאותו תורם שאינו סוכרתי. הנתונים מוצגים במספרים מוחלטים (mU / L). (D) הפרשת אינסולין המוצגת ב-(C) מנורמלת לתכולת האינסולין הכוללת (% מהתוכן). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
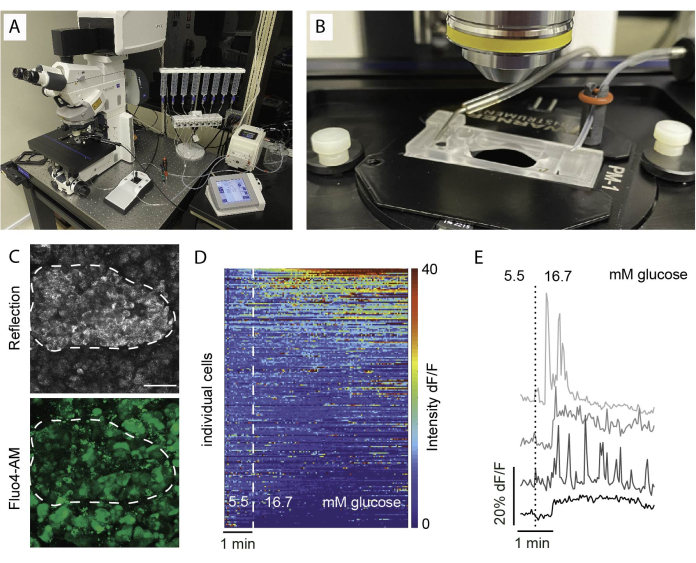
איור 5: מערך הדמיה ותוצאות צפויות. (A) התקנה לדימות פונקציונלי עם מיקרוסקופ קונפוקלי זקוף ומערך פריפיוז'ן. (B) תא הדמיה המחובר לזרימה ויציאה. (C) ערימת Z של תמונות קונפוקליות של אי בתוך פרוסת רקמה מתורם אנושי בריא, המראות אור מוחזר (למעלה) ואות Fluo4 (למטה). השתקפות משמשת לזיהוי איים בתוך הפרוסה (קו מקווקו). (D) מפת חום המראה דינמיקה במבחנה Ca2+ של תאי איון המבוטאת כעוצמה פלואורסצנטית של Fluo4 מנורמלת לעוצמת האות הבסיסית בגלוקוז של 5.5 מילימטר וגירוי עם גלוקוז גבוה (16.7 מילימול). כל שורה מייצגת תא בודד שעוקבים אחריו לאורך זמן בציר ה-x, והתגובה שלהם בעוצמה משתנה (%) של העוצמה הפלואורסצנטית מעל קו הבסיס (dF/F) המוצגת בסקאלת הצבעים מכחול (עוצמה נמוכה) לאדום (עוצמה גבוהה). (E) עקבות מייצגים של 4 תאים בודדים המראים תגובה לגלוקוז גבוה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
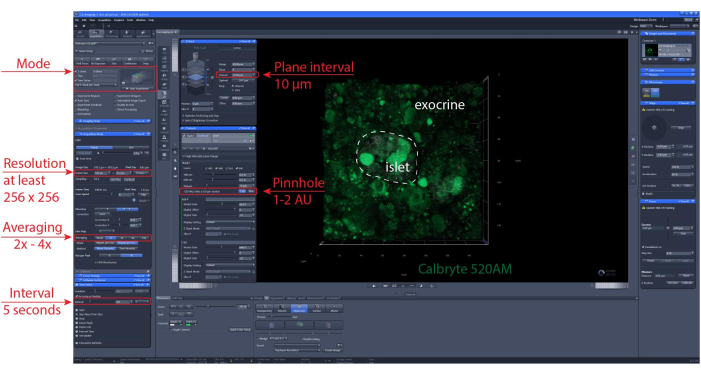
איור 6: הגדרות דימות סידן. צילום מסך של התוכנה של הגדרות מייצגות שנבחרו לביצוע הקלטות קיטועי זמן של 40 מיקרומטר (הדמיית XYZT). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כאן אנו מציגים פרוטוקול ליצירת פרוסות רקמת לבלב בנות קיימא והשימוש בהן לקריאות תפקודיות כמו הפרשת הורמונים דינמית והדמיה תפקודית. בדומה לבידוד איים אנושיים, הצלחת הליך הפרוסה מושפעת מגורמים שונים, כולל מאפייני התורם, זמן משלוח הרקמה ואיכות הרקמה25,29. לכן, חשוב לבחור בקפידה דגימות רקמה לניסוי ולשמור על זמני איסכמיה למינימום. בהקשר זה, יש לשקול בזהירות מקורות פוטנציאליים אחרים של רקמות אנושיות מלבד תורמי גופות. הכללת תורמים כירורגיים מאפשרת לשלב נתוני פרוסות פונקציונאליות עם מידע in vivo רלוונטי מאותו מטופל, מה שמחזק את הרלוונטיות התרגומית11. עם זאת, מקור רקמה זה מביא גורמים אחרים כמו ביופסיות הן בדרך כלל מחולים מבוגרים שעברו כריתת לבלב בעיקר בשל גידול מקומי. יש לציין כי ביופסיות לבלב אינן מבוצעות בהקשר של סוכרת.
בעת ביצוע הליך החיתוך בפועל, עיבוד רקמות בזמן הוא קריטי. ניתן לאחסן פרוסות למשך מספר שעות, כמתואר בפרוטוקול זה, או לגדל אותן בתרבית לפרקי זמן ממושכים, כמתואר על ידי Qadir et al.19. נכון לעכשיו, פרוטוקול זה עומד כשיטה היחידה לשמירה על כדאיות הפרוסה לאורך פרקי זמן ממושכים, עם זאת, מאמצים עתידיים צריכים להעריך שינויים פונקציונליים על פני תקופות תרבות מגוונות ולצייר השוואות עם איים מבודדים, מאותו תורם.
השלב הקריטי ביותר בתהליך הוא הכנת רקמות זהירה לפני הטמעה באגרוז. צינורות גדולים ורקמות פיברוטיות יכולים לסבך את תהליך החיתוך ועלולים להוביל לפריצת גושי רקמה מהאגרוז. אם זה קורה והחלקים נשארים בגודל סביר, ניתן לעבד אותם מחדש ולהטמיע אותם לחיתוך. שמירה על איכות רקמות טובה ועיבוד זהיר משפרת מאוד את יעילות הליך החיתוך ומניבה את הכמות והאיכות המקסימלית של הפרוסות. הזמן שחלף מהכנת הרקמה ועד ליצירת הפרוסה לא יעלה על 2-3 שעות, שכן מרווחי זמן ארוכים יותר משפיעים באופן משמעותי על כדאיות הרקמות.
במהלך פריפוזיה של פרוסה, שלב פשוט אך קריטי הוא חיתוך מדויק של הפרוסה כדי להבטיח התאמה מושלמת לתא. זה מאפשר רחצה נכונה של הרקמה וזרימה רציפה. לאחר תחילת הפרוטוקול, חיוני להימנע ממניפולציה נוספת של החדרים כדי למנוע קפיצות לא רצויות בשחרור הורמונים. יש להכין חיץ מספיק, וצינורות צריכים להגיע לתחתית התמיסה כדי למנוע יניקת אוויר ותאים מתייבשים.
עבור הדמיית סידן חשוב לבחור את תחום העניין בקפידה, בהתאם לצרכי הניסוי והעיצוב. חשוב למזער את ההלבנה על ידי בחירת פרמטרי הדמיה המפחיתים את החשיפה לאור או מקצרים את זמן הפרוטוקול הכולל. בדומה להפרשת הורמונים דינמית, שמירה על זרימת תמיסה תקינה וסביבה מחוממת היא חיונית, שכן פרוסות דורשות תנאים כמעט פיזיולוגיים לתפקוד אופטימלי (למשל, 37 מעלות צלזיוס).
פרוסות רקמת הלבלב שומרות ביעילות על שלמותו המבנית של הלבלב, ומשמרות את קשרי התא-תא בין סוגי התאים השונים שבו. כתוצאה מכך, הם מספקים חלופה לעבודה עם איים מבודדים, להקל על חקירה בו זמנית של פונקציות אנדוקריניות ואקסוקריניות ואת יחסי הגומלין שלהם. כדי להעריך את יחסי הגומלין בין סוגי תאים בודדים, חיוני להבחין ביניהם. צביעה לאחר מכן היא אפשרות אחת, אך יש לה מגבלות מבחינת בדיקות פלואורסצנטיות זמינות והאתגר של איתור שכבות תאים מדויקות. לכן, מומלץ לשלב גירויים ספציפיים לתא בפרוטוקול כדי לאפשר הבחנה תאית על בסיס תגובות. להבחנה בין סוגי תאים בפרוסות עכבר או אדם, גירויים יעילים כוללים אדרנלין עבור תאי אלפא21,30, גרלין עבור תאי דלתא31, cerulein עבור תאים acinar 5,32, חומצות מרה עבור תאים ductal33, ונוראפינפרין עבור תאי כלי דם22. גירויים דומים יכולים לשמש למדידת תגובות הפרשה. בעוד שמחקרי הדמיה מתמקדים בתאים בודדים, מחקרי הפרשה מנתחים את התגובה הקולקטיבית. לכן, חיוני לכלול מספר רב של פרוסות כדי לזהות את התוצאות הרצויות. הכמות האופטימלית עשויה להשתנות בין סוגי תאים, כאשר שלוש פרוסות מוכיחות שהן מספיקות לתאים אנדוקריניים; עם זאת, מומלץ להשתמש בפרוסות רבות יותר כדי להבטיח יכולת זיהוי ולא להסתכן בהחמצת מידע בעל ערך.
כמו כל שיטה אחרת, לפרוסות רקמה יש מגבלות שיש לקחת בחשבון בעת פירוש התוצאות. יישום גירוי המתמקד בסוגי תאים ספציפיים עלול להוביל להשפעות על סוגי תאים אחרים בפרוסה, מה שעלול לגרום ללולאות משוב. עם זאת, אלה גם חשובים למחקר ולכן תגובות שנמדדו יכולות לייצג יותר תגובה פיזיולוגית. עבור מיקוד סלקטיבי של תאים, ניתן להשתמש בפרוטוקולים מסורתיים במבחנה . חשוב לציין כי תאי אצינר מכילים אנזימי לבלב שיכולים לפרק חלבונים ולעכל את פרוסת הרקמה, וכתוצאה מכך להתפרק התאים תוך שעות ספורות. כדי לשמור על כדאיות, שימוש עקבי במעכבי טריפסין חיוני כאשר פרוסות נמצאות במצב סטטי, למרות שהיישום שלהן עלול להפריע להעברה מוצלחת של וירוסים המשמשים למטרות התוויה.
בהשוואה לבידוד איונים, שונות התורם ואיכות הרקמה יכולים להשפיע הן על כמות והן על הכדאיות של הפרוסות המתקבלות. חוסר כדאיות מספקת לאחר החיתוך עלול לגרום לתוחלת חיים קצרה ולפגוע ביכולת לתרבית את הפרוסות. יתר על כן, ספירת איים יכולה להשתנות באופן משמעותי בין תורמים, מה שהופך את הערכת תכולת האיים למאתגרת לפני ביצוע ניסויים. כתוצאה מכך, בחירה קפדנית של קריטריוני קבלת התורמים ויישום שיטות נורמליזציה מתאימות, כגון אחוז תכולת ההורמונים להפרשה או שינוי קיפול לקו הבסיס, הם קריטיים. לקבלת תוצאות עקביות, מומלץ להעריך את כדאיות פרוסת הרקמה לפני הניסוי. יתר על כן, מומלץ לשלב גירויי בקרה רלוונטיים (למשל, KCl) בניסוי. במקרים של אנליזה של תאים בודדים, כגון הדמיה, ניתן ליישם מיון מקדים של תאים בהתבסס על תגובתם לגירויי בקרה אלה. למרות האתגרים שהוזכרו, פרוסות מציעות תוספת רבת ערך לשיטות המחקר הנוכחיות.
הפרוטוקול המתואר יכול לשמש כנקודת מוצא למספר יישומים, וניתן לתפעל פרוסות לבלב, ולבחון תגובות לאחר מגוון גירויים. אנו גם מפנים את הקוראים למחקרים רבים המשתמשים בפרוסות לבלב של עכבר או אדם, ומספקים תובנות חשובות למי שמתכנן את הניסויים שלהם. בעתיד, ייתכן כי טיפולים פוטנציאליים עשויים להיחקר באמצעות פרוסות לבלב או כי מנגנוני המחלה עשויים להיות מודלים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה בוצע בתמיכת הרשת לתורמי איברי לבלב עם סוכרת (nPOD; RRID:SCR_014641), פרויקט מחקר משותף לסוכרת מסוג 1 הנתמך על ידי JDRF (nPOD: 5-SRA-2018-557-Q-R) וקרן הצדקה ליאונה מ. והארי ב. הלמסלי (Grant#2018PG-T1D053, G-2108-04793). התוכן והדעות המובעים הם באחריות המחברים ואינם משקפים בהכרח את ההשקפה הרשמית של nPOD. ארגונים לרכישת איברים (OPO) המשתפים פעולה עם nPOD כדי לספק משאבי מחקר מפורטים ב- http://www.jdrfnpod.org/for-partners/npod-partners/. המחברים אסירי תודה לתורמים ולבני משפחותיהם על תרומתם שלא תסולא בפז. עבודה זו נתמכה על ידי האגודה האמריקאית לסוכרת 4-22-PDFPM (J.K.P.) וקרן הצדקה ליאונה מ. והארי ב. הלמסלי (מענק 2015-PG-T1D-052).
Materials
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
References
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644 (2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293 (2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638 (2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469 (2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525 (2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530 (2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265 (2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207 (2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792 (2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519 (2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913 (2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399 (2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706 (2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved