Регистрация и анализ мультимодальной крупномасштабной динамики нейронного ансамбля на КМОП-интегрированной микроэлектродной матрице высокой плотности
In This Article
Summary
Здесь мы используем HD-MEA для углубления в вычислительную динамику крупномасштабных нейронных ансамблей, в частности, в гиппокампе, обонятельных луковицах и нейронных сетях человека. Фиксация пространственно-временной активности в сочетании с вычислительными инструментами дает представление о сложности нейронного ансамбля. Этот метод улучшает понимание функций мозга, потенциально выявляя биомаркеры и методы лечения неврологических расстройств.
Abstract
Крупномасштабные нейронные сети и их сложные распределенные микросхемы необходимы для создания восприятия, познания и поведения, которые возникают из паттернов пространственно-временной активности нейронов. Эти динамические паттерны, возникающие из функциональных групп взаимосвязанных нейронных ансамблей, облегчают точные вычисления для обработки и кодирования многомасштабной нейронной информации, тем самым стимулируя более высокие функции мозга. Для изучения вычислительных принципов нейронной динамики, лежащих в основе этой сложности, и исследования многомасштабного влияния биологических процессов на здоровье и болезнь, крупномасштабные одновременные записи стали инструментальными. Здесь массив микроэлектродов высокой плотности (HD-MEA) используется для изучения двух модальностей нейронной динамики - цепей гиппокампа и обонятельной луковицы из срезов мозга мышей ex-vivo и нейронных сетей из клеточных культур in-vitro индуцированных плюрипотентных стволовых клеток человека (ИПСК). Платформа HD-MEA, состоящая из 4096 микроэлектродов, позволяет проводить неинвазивные, многоцентровые, безметочные записи внеклеточных паттернов возбуждения от тысяч нейронных ансамблей одновременно с высоким пространственно-временным разрешением. Этот подход позволяет охарактеризовать несколько электрофизиологических характеристик всей сети, включая одно- и многозвенные паттерны спайковой активности и колебания локального потенциала поля. Для тщательного изучения этих многомерных нейронных данных мы разработали несколько вычислительных инструментов, включающих алгоритмы машинного обучения, автоматическое обнаружение и классификацию событий, теорию графов и другие расширенные методы анализа. Дополняя эти вычислительные конвейеры этой платформой, мы предоставляем методологию для изучения большой, многомасштабной и мультимодальной динамики от ячеистых сборок до сетей. Это потенциально может продвинуть наше понимание сложных функций мозга и когнитивных процессов в норме и болезни. Приверженность открытой науке и понимание крупномасштабной вычислительной нейронной динамики могут улучшить моделирование, вдохновленное мозгом, нейроморфные вычисления и алгоритмы нейронного обучения. Кроме того, понимание основных механизмов нарушения крупномасштабных нейронных вычислений и их взаимосвязанной динамики микросхем может привести к идентификации специфических биомаркеров, прокладывая путь к более точным диагностическим инструментам и таргетной терапии неврологических расстройств.
Introduction
Нейронные ансамбли, часто называемые клеточными сборками, играют ключевую роль в нейронном кодировании, облегчая сложные вычисления для обработки многомасштабной нейронной информации 1,2,3. Эти ансамбли лежат в основе формирования обширных нейронных сетей и их тонких микросхем4. Такие сети и их осцилляторные паттерны управляют продвинутыми функциями мозга, включая восприятие и познание. В то время как обширные исследования изучали конкретные типы нейронов и синаптические пути, более глубокое понимание того, как нейроны совместно формируют клеточные сборки и влияют на пространственно-временную обработку информации в цепях исетях, остается труднодостижимым.
Острые, ex-vivo срезы мозга являются ключевыми электрофизиологическими инструментами для изучения интактных нейронных цепей, предлагая контролируемую настройку для исследования осцилляторных паттернов нейронной функции, синаптической передачи и связей, что имеет значение для фармакологического тестирования и моделирования заболеваний 6,7,8. Этот протокол исследования выделяет две ключевые цепи мозга - гиппокампально-кортикальную (HC), участвующую в процессах обучения и памяти 9,10, и обонятельную луковицу (OB), ответственную за различение запахов 11,12,13. В этих двух областях новые функциональные нейроны непрерывно генерируются взрослым нейрогенезом на протяжении всей жизни вмозге млекопитающих. Обе схемы демонстрируют многомерные динамические паттерны нейронной активности и присущую им пластичность, которые участвуют в перепрошивке существующей нейронной сети и облегчают альтернативные стратегии обработки информации,когда это необходимо.
Острые, ex-vivo модели срезов мозга незаменимы для углубления в функциональность мозга и понимания механизмов заболевания на уровне микросхем. Тем не менее, клеточные культуры in vitro, полученные из нейронных сетей индуцированных плюрипотентных стволовых клеток человека (ИПСК), предлагают многообещающее направление трансляционных исследований, органично связывая результаты экспериментов на животных с потенциальным клиническим лечением человека17,18. Эти ориентированные на человека анализы in vitro служат надежной платформой для оценки фармакологической токсичности, обеспечивая точный скрининг лекарств и дальнейшие исследования инновационных клеточных терапевтических стратегий19,20. Признавая ключевую роль нейронной модели ИПСК, мы посвятили третий модуль этого исследования протокола тщательному изучению функциональных характеристик производных сетей и тонкой настройке связанных протоколов клеточных культур.
Эти электрогенные нейронные модули обычно изучаются с использованием таких методов, как кальций (Ca2+ визуализация), записи с патч-зажимами и микроэлектродные матрицы низкой плотности (LD-MEA). Несмотря на то, что визуализация Ca2+ позволяет картировать активность отдельных клеток, это метод, основанный на мечении клеток, которому мешает низкое временное разрешение и проблемы с долгосрочными записями. LD-MEA не обладают пространственной точностью, в то время как патч-клэмпинг, будучи инвазивным и трудоемким методом, часто дает низкий процент успеха 21,22,23. Для решения этих проблем и эффективного исследования активности в масштабах всей сети крупномасштабные одновременные нейронные записи стали ключевым подходом к пониманию вычислительных принципов нейронной динамики, лежащих в основе сложности мозга, и их влияния на здоровьеи болезни.
В этом протоколе JoVE мы демонстрируем крупномасштабный метод нейронной записи, основанный на МЭА высокой плотности (HD-MEA) для регистрации пространственно-временной активности нейронов в различных модальностях мозга, включая цепи гиппокампа и обонятельных луковиц из острых срезов мозга мышей ex-vivo (рис. 1A-C) и нейронных сетей, полученных из iPSC человека in vitro (рис. 1D-E), о которых ранее сообщала наша группа и другие коллеги26,27,28,29,30,31,32,33,34,35. HD-MEA, построенный на основе технологии комплементарного металл-оксид-полупроводник (CMOS), может похвастаться встроенной схемой и усилением, что позволяет записывать менее миллисекунды на массиве размером 7 мм2 размера36. Этот неинвазивный подход позволяет одновременно захватывать многоцентровые, безметочные внеклеточные паттерны возбуждения от тысяч нейронных ансамблей с помощью 4096 микроэлектродов с высоким пространственно-временным разрешением, выявляя сложную динамику локальных полевых потенциалов (LFP) и многоединичной спайковой активности (MUA)26,29.
Учитывая обширность данных, генерируемых с помощью этой методологии, сложная аналитическая структура имеет важное значение, но создает проблемы37. Мы разработали вычислительные инструменты, которые включают в себя автоматическое обнаружение событий, классификацию, теорию графов, машинное обучение и другие передовые методы (рис. 1F)26,29,38,39. Интегрируя HD-MEA с этими аналитическими инструментами, разрабатывается целостный подход для исследования сложной динамики от отдельных клеточных сборок до более широких нейронных сетей в различных нейронных модальностях. Этот комбинированный подход углубляет наше понимание вычислительной динамики в нормальных функциях мозга и дает представление об аномалиях, присутствующих при патологическихсостояниях. Более того, выводы, полученные в результате этого подхода, могут способствовать прогрессу в моделировании, вдохновленном мозгом, нейроморфных вычислениях и алгоритмах нейронного обучения. В конечном счете, этот метод имеет перспективы в раскрытии основных механизмов, лежащих в основе сбоев нейронных сетей, потенциальной идентификации биомаркеров и руководстве созданием точных диагностических инструментов и целенаправленных методов лечения неврологических заболеваний.
Protocol
Все эксперименты проводились в соответствии с действующими европейскими и национальными нормами (Tierschutzgesetz) и были одобрены местными властями (Landesdirektion Sachsen; 25-5131/476/14).
1. Срезы мозга ex-vivo из цепей гиппокампально-кортикальной и обонятельной луковиц на HD-MEA
- Приготовление экспериментальных решений для резки и регистрации (рис. 2А)
- В экспериментальный день приготовьте 0,5 л режущего раствора с высоким содержанием сахарозы и 1 л раствора для записи искусственной спинномозговой жидкости (аКСФ) (табл. 1А,Б).
- Добавьте все твердые химикаты в сухую мерную колбу, затем заполните часть пути двойной дистиллированной (dd) водой.
- Добавьте MgCl2 и CaCl2 из 1 М исходных растворов, затем залейте оставшуюся часть водой dd. Начните постоянно помешивать магнитной мешалкой до тех пор, пока видимые твердые частицы не растворятся ~ 5 мин.
- Используйте осмометр с температурой замерзания для проверки осмолярности в диапазоне от 350 до 360 мОсм для режущего раствора с высоким содержанием сахарозы и 315-325 мОсм для решения для регистрации aCSF.
- Используйте рН-метр для проверки рН в диапазоне 7,3-7,4 для режущего раствора с высоким содержанием сахарозы и 7,25-7,35 для регистрирующего раствора аКСФ. Начните непрерывное барботирование с 95%О2 и 5%СО2.
- Поместите режущий раствор с высоким содержанием сахарозы на лед не менее чем на 30 минут перед нарезкой и начните непрерывно пузыриться с 95% O2 и 5% CO2.
- Через 10 минут после цементации наполните стакан объемом 50 мл 30 мл режущего раствора и храните его в морозильной камере (-20 °C) в течение 20-30 минут или до частичного замораживания.
ПРИМЕЧАНИЕ: Все растворы должны быть приготовлены свежими для каждого эксперимента. Используемая здесь вода dd представляет собой автоклавную сверхчистую воду, хранящуюся при комнатной температуре (RT). Количество приготовленного раствора должно быть адаптировано к конкретному исследуемому вопросу.
- В экспериментальный день приготовьте 0,5 л режущего раствора с высоким содержанием сахарозы и 1 л раствора для записи искусственной спинномозговой жидкости (аКСФ) (табл. 1А,Б).
- Подготовка рабочих зон срезов мозга (рис. 2А)
- Принесите животное в экспериментальную комнату.
ПРИМЕЧАНИЕ: В этом протоколе использовались самки мышей C57BL/J6 в возрасте 8-16 недель, как описано ранее 26,29,32. Животному следует дать акклиматизироваться в течение не менее 30 минут после транспортировки. Следует избегать междугородних переводов (т.е. межинститутских) в тот же день, когда проводится эксперимент. Возраст, пол и штамм животного должны быть определены на основе конкретного вопроса исследования. - Пока животное акклиматизируется и раствор с высоким содержанием сахарозы остывает, разместите необходимые инструменты в каждом отведенном для этого рабочем месте (см. Таблицу материалов).
- Подготовьте рабочее место для восстановления и обслуживания мозговых срезов. Заполните камеру для восстановления срезов карбонизированным раствором для регистрации aCSF и поместите камеру в водяную баню, установленную на 32 °C. Поддерживайте непрерывную карбогенизацию на протяжении всего эксперимента.
- Подготовьте рабочее пространство для подготовки срезов мозга. Настройка вибратома - поместите лезвие в держатель лезвия вибратома и откалибруйте вибратом в соответствии с правильными настройками (скорость движения лезвия: 0,20 мм/с, амплитуда высоты: 95 мкм, угол наклона лезвия: 45°). Наполните лоток для вибратомного льда льдом, а буферный лоток - режущим раствором с высоким содержанием сахарозы и начните карбогенизацию раствора в буферном лотке.
- Подготовьте рабочее пространство для подготовки мозга. Наполните стеклянную чашку Петри диаметром 150 мм льдом и поместите внутрь пластиковую чашку для культивирования диаметром 90 мм с фильтровальной бумагой. Наполните пластиковую чашку для культур режущим раствором с высоким содержанием сахарозы и приступайте к карбогенированию. Добавьте каплю суперклея на охлажденную пластину для образцов и прикрепите агарозную форму.
ПРИМЕЧАНИЕ: Агарозная плесень готовится, по крайней мере, накануне с 3% агарозы в воде в специальной форме для мышиного мозга. - Наконец, подготовьте рабочее пространство для извлечения мозга. Накройте алюминиевую фольгу папиросной бумагой, извлеките стакан объемом 50 мл, содержащий раствор для резки с высоким содержанием сахарозы, и добавьте изофлуран в наркозную камеру.
ПРИМЕЧАНИЕ: Анестезия будет добавлена в наркозную камеру ~ за 1 минуту до помещения животного. Стакан объемом 50 мл с 30 мл режущего раствора с высоким содержанием сахарозы будет извлечен из морозильной камеры при температуре -20 °C ~ за 2 минуты до обезглавливания.
- Принесите животное в экспериментальную комнату.
- Извлечение и нарезка мозга мыши
ПРИМЕЧАНИЕ: Вся эта процедура должна быть выполнена как можно быстрее, чтобы избежать недостатка оксигенации мозга. Удаление мозга должно занимать всего 1-2 минуты от обезглавливания до погружения в слякоть с высоким содержанием сахарозы.- Обезболить животное соответствующей дозировкой изофлурана (наркозная камера 0,5 мл/1 л). Определить глубину анестезии через щипок лапы; Прежде чем продолжить, убедитесь в отсутствии рефлекса отдергивания лапы.
- Перенесите животное на папиросную бумагу в рабочей области для извлечения мозга и обезглавьте его хирургическими ножницами.
- Вставьте ножницы для радужной оболочки глаза в ствол мозга и держите нижние ножницы на одном уровне с кальварией. Разрезают вдоль сагиттального шва до тех пор, пока не будет достигнут венечный шов. Поместите ножницы для радужной оболочки глаза в глазницы и разрежьте метопический шов. Используйте изогнутые щипцы, чтобы сдвинуть стороны голварии вниз, обнажая весь мозг.
ПРИМЕЧАНИЕ: Будьте осторожны как с ножницами для радужной оболочки, так и с щипцами, чтобы не проколоть мозг при разрезании швов. - Вставьте мозг тупым краем изогнутых щипцов в стакан объемом 50 мл с 30 мл режущего раствора с высоким содержанием сахарозы. Оставьте на 1 минуту.
- Перенесите мозг в пластиковую культуральную чашку диаметром 90 мм с охлажденным карбогенизированным режущим раствором в рабочей области для подготовки мозга. Сориентируйте мозг для позиционирования в агарозной форме.
- Добавьте маленькую точку суперклея на ростральный конец формы для агарозы. Поместите мозг в форму с помощью лопатки. Убедитесь, что мозг расположен тыльной стороной вниз для горизонтального разреза.
ПРИМЕЧАНИЕ: Расположение клея в форме будет меняться в зависимости от области интереса (ROI). Для срезов гиппокампально-кортикальной (HC) и обонятельной луковицы (OB) убедитесь, что OB стабилизирована, а боковые стороны мозга свободны от клея. Слишком большое количество клея повлияет на качество нарезки и вызовет разрывы во время вибрационной нарезки. - Переместите пластину образца в буферный лоток, переместите лезвие в нужное положение под правильным углом и увеличьте высоту буферного лотка, чтобы лезвие было как можно ближе к мозгу.
- Нарежьте со скоростью 0,20 мм/с интервалом 300 мкм ткани HC и OB, затем собирайте их после каждого раунда нарезки стеклянной пипеткой Пастера.
- Оставьте ломтики в камере восстановления, заполненной aCSF, на водяной бане с температурой 32 °C на 45 минут, а затем на 1 час при RT. Убедитесь, что ломтики не перекрывают друг друга и полностью подвергаются воздействию карбогенизированного раствора.
ПРИМЕЧАНИЕ: Убедитесь, что все растворы и все упомянутые камеры содержат раствор. Регулятор давления может использоваться для поддержания постоянной карбогенизации.
2. Нейронная сеть человека на основе ИПСК in vitro на HD-MEA
ПРИМЕЧАНИЕ: Все нейроны iPSC, использованные в этом исследовании, получены коммерчески (см. таблицу материалов). Эти человеческие клетки дифференцировались из стабильных клеточных линий iPS, которые были получены из периферической крови человека или фибробластов.
- Покрытие чипов HD-MEA для культур iPSC клеток человека in vitro (рис. 2B)
- Поместите чип HD-MEA на платформу записи данных, заполните резервуар PBS и протестируйте чип перед нанесением покрытия. Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи на частоту записи 50 Гц и частоту дискретизации 18 кГц на электрод. Измените смещение усилителя , чтобы откалибровать микросхему. Советы по устранению неполадок см. в таблице 2 .
ПРИМЕЧАНИЕ: Параметры частоты записи и частоты дискретизации зависят от типа данных и индивидуальных системных требований. - Стерилизовать и предварительно подготовить HD-MEA.
- Под капотом протрите чип и стеклянное кольцо салфеткой, смоченной 96% этанолом (EtOH), затем поместите каждое устройство в стерильную чашку Петри размером 100 мм x 20 мм и заполните резервуар MEA 70% EtOH на 20 минут.
- Аспирируйте EtOH и промойте резервуар стерильной фильтрованной dd-водой 3 раза. Добавьте 1 мл среды предварительного кондиционирования и инкубируйте в течение ночи при 37 °C и 5% CO2.
ПРИМЕЧАНИЕ: Среда предварительного кондиционирования должна представлять собой раствор на основе соли, чтобы сделать поверхность HD-MEA более гидрофильной поверхностью. Это могут быть заранее подготовленные полные среды BrainPhys (BP) (не >3-месячной давности) (табл. 1С).
- Покрытие HD-MEA. На следующий день аспирируйте среду предварительного кондиционирования. Добавьте 1 мл 0,1 мг/мл поли-дл-орнитина (PDLO), чтобы покрыть всю активную область. Инкубируют при температуре 37 °C в течение ночи в инкубаторе.
- Подготовьте и подогрейте носитель для RT. Протоколы, представленные здесь, используют функциональные нейроны ИПСК человека из двух коммерческих источников; Таким образом, компоненты носителя различаются для каждого поставщика. Один протокол описан в (таблицы 1C, D).
- Аспирируйте PDLO, промойте 3 раза dd-водой и дайте стружке высохнуть под колпаком в течение 10 минут.
- Наполните чашку Петри размером 35 мм x 10 мм стерильной фильтрованной dd-водой и поместите ее рядом с чипом, чтобы поддерживать надлежащую влажность и избежать испарения засеянных клеток на следующих этапах.
- Поместите чип HD-MEA на платформу записи данных, заполните резервуар PBS и протестируйте чип перед нанесением покрытия. Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи на частоту записи 50 Гц и частоту дискретизации 18 кГц на электрод. Измените смещение усилителя , чтобы откалибровать микросхему. Советы по устранению неполадок см. в таблице 2 .
- Покрытие и поддержание ИПСК нейронов человека в HD-MEA (рис. 2B)
- Разморозьте и разбавьте клетки до желаемой концентрации клеток на микролитр (т.е. 1000 клеток/мкл для получения плотности 50 000 клеток в капле 50 мкл на HD-MEA) (Таблица 1C).
- Пипеткой наносят клеточную суспензию на поверхность активной области чипа с помощью высоколамининовой точечной среды (табл. 1D).
- Инкубируют при 37 °С с 5%СО2 в течение 45-60 мин.
- Осторожно залейте 2 мл среды в резервуар HD-MEA (таблица 1C).
- Выполните 100%-ную замену материала в 1-й день (DIV1) после посева с использованием RT-носителя (таблица 1C). Меняйте 50% носителя каждые 3-4 дня. Храните HD-MEA в инкубации при 37 °C с 5%CO2 на протяжении всего эксперимента.
ПРИМЕЧАНИЕ: Осторожно пипетируйте, чтобы избежать смещения клеток. Проверьте цвет фильтрующего материала на наличие загрязнений. Интервал и величина смены среды могут быть определены индивидуальными учебными вопросами или потребностями/спецификациями клеток. - Опционально: Проверьте ход роста клеточной культуры между DIV4 и DIV8 под вертикальным дифференциально-интерференционным контрастным микроскопом (DIC) после очистки предметного столика >70% EtOH.
3. Крупномасштабные нейронные записи ex-vivo и in vitro с HD-MEA
- Подготовка рабочего места для записи срезов мозга (рис. 2А)
- Пока срезы мозга восстанавливаются, разместите необходимые инструменты в каждом назначенном рабочем месте (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Основная настройка системы должна быть оптимизирована и протестирована задолго до дня эксперимента по срезу мозга. Перфузионная система (впускные линии, выпускные трубопроводы насоса, трубки и заземление) должна быть протестирована с помощью PBS или aCSF и HD-MEA на записывающей платформе, чтобы обеспечить чистый сигнал, повышенное соотношение сигнал-шум и отсутствие перфузионного шума. - Покройте чип HD-MEA 0,1 мг/мл PDLO для улучшения сцепления ткани с чипом и инкубируйте при 37 °C в течение 20 минут.
- Во время инкубации чипов заполните гравитационную перфузионную систему и линии регистрацией аКСФ. Обеспечьте непрерывную карбогенизацию перфузионной системы. Установите скорость потока 4,5 мл/мин и температуру 37 °C.
- Поместите чип HD-MEA на платформу регистрации данных, заполните резервуар aCSF, протестируйте систему перфузии и устраните оставшийся системный шум.
- Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи так, чтобы частота записи была равна 1 Гц, а частота дискретизации — 14 кГц/электрод. Измените смещение усилителя , чтобы откалибровать микросхему. Советы по устранению неполадок см. в таблице 2 .
ПРИМЕЧАНИЕ: Параметры частоты записи и частоты дискретизации зависят от типа данных и индивидуальных системных требований.
- Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи так, чтобы частота записи была равна 1 Гц, а частота дискретизации — 14 кГц/электрод. Измените смещение усилителя , чтобы откалибровать микросхему. Советы по устранению неполадок см. в таблице 2 .
- Убедитесь, что область записи темная, с помощью системы освещения комнаты или затененной клетки на оптическом столе.
- Совместите стереомикроскоп с резервуаром микросхемы HD-MEA и активной областью для получения изображения.
- Поместите якорь в резервуар для стружки, чтобы уравновесить.
ПРИМЕЧАНИЕ: Anchor - это изготовленная на заказ платиновая арфа с минимальным количеством проводов, способствующих насыщению кислородом; Тем не менее, некоторые из них доступны. - Добавляйте фармакологические соединения в соответствующие перфузионные пробирки.
ПРИМЕЧАНИЕ: В этом протоколе были получены как спонтанные, так и 100 мкМ фармакологически индуцированные записи, как описано выше. Фармакологические соединения могут быть адаптированы к конкретному вопросу исследования. - В рабочем пространстве для подготовки срезов мозга поместите новую пластиковую чашку для культуры диаметром 90 мм в стеклянную чашку Петри диаметром 150 мм. Добавьте aCSF и приступайте к карбонизации.
- Пока срезы мозга восстанавливаются, разместите необходимые инструменты в каждом назначенном рабочем месте (см. Таблицу материалов).
- Запись срезов HC и OB по всей цепи с использованием HD-MEA
ПРИМЕЧАНИЕ: Соединение ломтиков должно выполняться как можно быстрее, чтобы избежать недостаточной оксигенации ломтика. Сопряжение должно занимать всего ~1 мин с момента первоначального размещения микропрепарированного среза на активной области чипа до окончательного запуска перфузионной системы.- Извлеките срез из камеры для восстановления срезов мозга стеклянной пипеткой и поместите его в пластиковую чашку для культивирования диаметром 90 мм с непрерывной карбогенацией. С помощью инструмента микродиссекции изолируйте HC или OB от окружающей ткани среза мозга.
- Переместите изолированные острые срезы HC или OB стеклянной пипеткой в резервуар HD-MEA. Аккуратно выровняйте срез по активной области MEA с помощью тонкой кисти. Хорошо отсасывайте все растворы из микросхемы HD-MEA с помощью аспирационной системы.
- Аккуратно поместите якорь поверх среза с помощью щипцов.
ПРИМЕЧАНИЕ: Анкер должен быть размещен без перемещения среза, чтобы избежать потери сцепления. - Аккуратно добавьте раствор в резервуар для стружки и запустите систему перфузии.
ПРИМЕЧАНИЕ: Обеспечьте ламинарный поток от входного и выходного отверстия насоса для оптимальной записи параметров. - Убедитесь, что область записи достаточно затемнена с помощью системы освещения комнаты или с помощью затененной клетки на оптическом столе.
- Дайте срезу акклиматизироваться в течение 10 минут перед началом записи или дополнительной фармакологической модуляции.
- Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи так, чтобы частота записи была равна 1 Гц, а частота дискретизации — 14 кГц/электрод. Измените смещение усилителя , чтобы откалибровать микросхему.
ПРИМЕЧАНИЕ: Как указывалось ранее в разделе 3.1.4.1, при выполнении системных тестов обязательно применяйте те же параметры записи. - Нажмите кнопку Запись, чтобы начать сбор данных с заданными экспериментальными условиями.
- Сразу после окончательной записи сделайте световое изображение острого среза мозга. Переместите ломтик обратно в камеру для восстановления ломтика, удалите все органические материалы, связанные со стружкой, щеткой и продолжите работу со следующим ломтиком. Очистите HD-MEA, как описано в разделе 3.4.
- Подготовка рабочей области для записи ИПСК человека и записи по всей сети на HD-MEA (Рисунок 2B)
ПРИМЕЧАНИЕ: Меняйте носитель либо за день до записи, либо сразу после регистрации ИПСК человека (Таблица 1C). В исследованиях с использованием функциональных нейронов носитель меняли каждые 4 дня, а на 4, 8, 16 и 24 DIV носитель меняли сразу после записи ИПСК.- Обеспечьте стерильную рабочую среду, очистив платформу сбора данных HD-MEA >70% EtOH.
- Аккуратно поместите под капот колпачок из полидиметилсилоксана (PDMS) с опорой на кольцо HD-MEA. Переместите чип HD-MEA в рабочее пространство записи iPSC и подключите чип HD-MEA к платформе сбора данных.
- Обеспечьте достаточное затемнение области записи с помощью системы освещения в помещении или затененной клетки на оптическом столе.
- Дайте чипу HD-MEA уравновеситься в течение 10 минут перед началом записи или дополнительной фармакологической модуляции.
- Запустите программное обеспечение Brainwave. Выберите Файл > Новый сеанс записи. Установите параметры записи на частоту записи 50 Гц и частоту дискретизации 18 кГц на электрод. Измените смещение усилителя , чтобы откалибровать микросхему.
ПРИМЕЧАНИЕ: Как указывалось ранее в разделе 2.1.1, при выполнении системного теста перед нанесением покрытия и гальванического покрытия обязательно применяйте те же параметры записи. - Записывайте спонтанную активность возбуждения или фармакологически индуцированные реакции из сети ИПСК человека в каждый день плана эксперимента (т.е. 4, 8, 16, 24 DIV).
ПРИМЕЧАНИЕ: Не оставляйте чип вне инкубатора в течение >30 минут, чтобы поддерживать стабильную температуру и влажность и предотвратить температурный шок клеток. - Инкубируйте HD-MEA при 37 °C с 5%CO2 в течение всего эксперимента.
- После завершения эксперимента закрепите нейронную сеть на чипах и окрасьте для дальнейшей оптической визуализации или очистите HD-MEA напрямую, как описано в шаге 3.4.
- Очистка микросхем HD-MEA
- После эксперимента выбросьте раствор в соответствии с надлежащей утилизацией отходов и промойте dd-водой.
- Добавьте выбранное моющее средство, очистите активную зону и весь резервуар ватной палочкой и выбросьте моющее средство. Залейте моющим средством, выдержите 20 минут, затем выбросьте моющее средство.
- Тщательно смойте лабораторной водой. Затем 3-4 раза смойте dd-водой.
- Используйте давление воздуха, чтобы тщательно высушить чип HD-MEA.
4. Анализ крупномасштабных нейронных записей с HD-MEA
ПРИМЕЧАНИЕ: В то время как шаг 4.1 зависит от программного обеспечения Brainwave, шаг 4.2 может быть изменен в зависимости от типа коммерчески доступного устройства HD-MEA для каждого пользователя.
- Предварительная обработка необработанных данных и обнаружение событий
- Откройте записанный файл необработанных данных (.brw) в программном обеспечении Brainwave. Выберите Анализ > Обнаружение LFP или Обнаружение пиков.
ПРИМЕЧАНИЕ: LFP Detection использует БИХ-фильтрацию с фильтром Баттерворта4-го порядка низких частот (1-100 Гц). Алгоритмы жесткого порога включают высокий порог 150 мкВ, низкий порог -150 мкВ, энергетическое окно в диапазоне 70-120 мс, рефрактерный период 10 мс и максимальную продолжительность события 1 с. Single and MUA Spike Detection использует БИХ-фильтрацию с фильтром Баттерворта4-го порядка высоких частот (300-3500 Гц). Применяется алгоритм ПТСР с коэффициентом стандартного отклонения 8, пиковым периодом жизни 2 мс и рефрактерным периодом 1 мс. - Для записи цепей HC и OB добавьте параметр Advanced Workspace (Расширенная рабочая область ) в обнаруженный файл событий (.bxr), чтобы импортировать изображение структурного света, полученное с помощью стереомикроскопа. При исследовании крупномасштабных схем HC создайте структурные слои, содержащие зубчатую извилина (DG), хилус, Cornu Ammonis 1 (CA1), Cornu Ammonis 3 (CA3), энторинальную кору (EC) и периринальную кору (PC). При исследовании крупномасштабных схем OB создайте структурные слои, содержащие слой обонятельного нерва (ONL), слой клубочков (GL), внешний плексиформный слой (EPL), слой митральных клеток (MCL) и слой гранулярных клеток (GCL). Рассматривайте EPL и MCL как проекционный слой (PL), включая обонятельную кору (OCx).
- Откройте записанный файл необработанных данных (.brw) в программном обеспечении Brainwave. Выберите Анализ > Обнаружение LFP или Обнаружение пиков.
- Обработка данных с помощью пользовательского вычислительного конвейера Python
- Шумоподавление
- Прочтите файл .bxr с помощью специально написанного скрипта Python 26,29,32 и пакета h5py 3.6.0 python.
- Извлечение поездов спайков, относящихся к записям сети iPSC, и поездов событий LFP, относящихся к записям цепей срезов мозга HC и OB.
- Охарактеризовать события с общим числом активных электродов менее 0,1% или 10% от среднего числа активных электродов на одно среднее событие или обнаруженные события, выходящие за пределы статистически обоснованного диапазона частоты срабатывания, как случайные события и удалить их. Кроме того, примените пороговые значения амплитуды и длительности события.
ПРИМЕЧАНИЕ: Для диапазона скорострельности учитываются 0,1-15 всплесков в секунду и 0,1-60 событий LFP/мин. Это примеры пороговых значений скорости, используемых для анализируемых наборов данных. Пороговые значения скорости, амплитуды и длительности будут зависеть от индивидуальных данных. - Сохраните результирующие данные обучения событий с сопутствующей пространственно-временной информацией в формате файла .npy.
- Растерграммы
- Чтение отфильтрованных файлов событий .npy и .bxr и создание растрового графика с помощью функции Matplotlib pyplot (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html).
- Кроме того, для записей срезов мозга со специфичностью для слоев отсортируйте и сгруппируйте идентификаторы электродов на основе слоев, полученных на шаге 4.1.2.
- Средняя огневая активность
- Обработайте данные временных рядов из файла .bxr, рассчитав среднюю частоту срабатывания каждого электрода (количество событий/время записи).
- Постройте матрицу данных, где строки и столбцы представляют координаты электродов в массиве HD-MEA 64 x 64, где каждое значение матрицы означает среднюю скорость возбуждения.
- Используйте библиотеку построения графиков, такую как imshow в Matplotlib или функции тепловых карт Seaborn в Python.
- Используйте здесь «горячую» цветовую карту, создав информативную тепловую карту, которая визуально инкапсулирует пространственное распределение средних скоростей возбуждения по электродной решетке.
- Репрезентативные трассировки сигналов
- Считывание данных временных рядов из BRW-файла и создание трассировки осциллограммы с помощью функции pyplot Matplotlib. (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html).
- Введите требуемый идентификатор электрода, временной интервал и полосу частот для репрезентативной трассы сигнала. Полосы частот, определенные в этих анализах, включают низкочастотные колебания LFP (1-100 Гц) с полосовой фильтрацией δ, θ, β и γ полос частот; острая волновая рябь (КСВ) (140-220 Гц); и высокочастотные одиночные и MUA (300-3500 Гц). Полосы частот δ, θ, β и γ составляют 1-4 Гц, 5-12 Гц, 13-35 Гц и 35-100 Гц соответственно.
- Спектральная плотность мощности
- Считывание данных временных рядов из файла .brw и вычисление периодограмм для определения доминирующих частот, лежащих в основе колебательной активности в каждом временном ряду.
- Построение псевдоцветных спектрограмм частотно-временной динамики.
ПРИМЕЧАНИЕ: Спектры рассчитываются по методу Уэлча с использованием быстрого преобразования Фурье записанных LFP для оценки спектральной плотностимощности 41. - Введите желаемый идентификатор электрода, временной интервал и полосу частот для карты спектральной плотности. Полосы частот, определенные в этих анализах, включают полосы, описанные в шаге 4.2.4.
- Функциональная связность
- Для записи схемы среза мозга выполните шаги 4.2.6.2-4.2.6.4.
- Считывание данных временных рядов из файла .brw и расчет взаимной ковариации между парами активных электродов в матрице 64 x 64 с использованием коэффициента корреляции Пирсона (PCC)42.
- Подгонка векторной авторегрессионной модели к временному ряду, используя многомерную причинно-следственную связь Грейнджера для количественной оценки влияния одного временного ряда на другой.
- Примените функцию направленной передачи (DTF) для оценки направленного потока информации в коррелированных звеньях.
ПРИМЕЧАНИЕ: Функциональная связность в многоуровневой сети устанавливается путем установки порога значения корреляции, основанного на средних значениях и двух стандартных отклонениях всех значений кросс-ковариации43,44. - Для записи ИПСК выполните шаги 4.2.6.6-4.2.6.8.
- Считывание данных spiketrain из файла .bxr и вычисление матрицы 64x64 коэффициентов корреляции PCC между всеми комбинациями группированных поездов с шипами с помощью spike_train_correlation функций (https://elephant.readthedocs.io/en/v0.7.0/reference/spike_train_correlation.html).
ПРИМЕЧАНИЕ: Функциональная связность в многоуровневой сети устанавливается путем установки порога значения корреляции, основанного на средних значениях и двух стандартных отклонениях всех значений взаимной ковариации. - Кроме того, реализуйте процедуры фильтрации пространственно-временных фильтров (STF) и пороговых значений задержки в зависимости от расстояния (DdLT) в матрице связности, чтобы исключить потенциальные парные соединения, превышающие максимальную скорость распространения (установленную на уровне 400 мм/с)45.
- Извлечение отрицательных пиков из результирующих матриц взаимной корреляции с помощью операций фильтрации и пороговых значений для идентификации тормозных связей с помощью алгоритма отфильтрованной и нормализованной гистограммы взаимной корреляции (FNCCH)45.
- Преобразуйте каждую матрицу связности в файл динамического графа (.gexf).
- Карты сетевых подключений
- Лаборатория открытых данных в программе Gephi версии 9.2 (https://gephi.org) для динамического графа для построения конкретных временных интервалов.
- Примените Географическую компоновку в окне компоновки для пространственного сопоставления.
- Поместите ограничения параметров на Диапазон градусов и Вес ребер для сравнения.
- Назначьте Узловой цвет, Размер ребра и Размер градуса для лучшей визуализации.
- Шумоподавление
Representative Results
Многомодельное пространственно-временное отображение и выделение осцилляторных признаков обжига
Для количественной оценки событий LFP и спайков, возникающих в динамических нейронных ансамблях, мы исследовали синхронные крупномасштабные паттерны возбуждения в цепях HC и OB и сетях iPSC человека. В соответствии с шагами 4.1-4.2 протокола анализировали записанные схемы срезов мозга с шага 3.2 и записанные сети ИПСК с шага 3.3. Во-первых, обнаружение событий и шумоподавление были выполнены для всех записанных наборов данных и разрешены по регионам в соответствии со спецификациями схемы. Далее было построено топографическое псевдоцветное пространственное отображение средних крупномасштабных НЧП и пиковых диаграмм возбуждения, растерграмм детектируемых событий и репрезентативных 5-секундных трасс отфильтрованных сигналов (рис. 3 A-I). Топографическое псевдоцветовое картирование крупномасштабных паттернов LFP и частоты спайков было наложено на соответствующие оптические изображения HC (рис. 3A), OB (рис. 3B) и нейронной сети iPSC человека (рис. 3C). Это позволяет исследовать отдельные цепные и сетевые колебательные паттерны и отклики. Растрграммы HC и OB содержат обнаруженные счетчики событий LFP, отсортированные по уровням DG, Hilus, CA3, CA1, EC и PC цепи HC и слоям ONL, OCx, GL, PL и GCL сети ПТС за 60 секунд (рис. 3D,E). Растровая диаграмма iPSC человека отображает синхронно обнаруженные спайковые события взаимосвязанной культивируемой сети в течение 20 секунд (рис. 3G). Далее, 5-секундные репрезентативные трассировки событий с крупномасштабных мест записи HD-MEA показывают диапазон зарегистрированных колебательных частот в цепях HC (т.е. выбранный электрод в CA3) (рис. 3G) и OB (т.е. выбранный электрод в GL) (рис. 3H) и многосекционную пиковую пакетную активность в сети iPSC человека от четырех выбранных активных электродов в матрице (рис. 3I). Эти образцовые сигналы демонстрируют сигнатуры биосигналов, включая низкочастотные колебания LFP (1-100 Гц) с полосовой фильтрацией δ, θ, β и γ диапазонах частот; острая волновая рябь (КСВ) (140-220 Гц); и высокочастотные одиночные и MUA (300-3500 Гц). Наконец, анализ спектральной плотности мощности (PSD) был использован для одновременного количественного определения величины мощности определенной колебательной полосы во взаимосвязанной цепи HC и OB, зарегистрированной с помощью HD-MEA (рис. 3J,K).
Мультимодальный общесетевой функциональный коннектом
Для вывода о крупномасштабной связности многослойных нейронных сетей по одновременным срабатываниям паттернов одновременно активных нейронных ансамблей была рассчитана кросс-ковариация между парами активных электродов в детектируемых событиях в соответствии с шагом 4.2.6 протокола. Здесь коэффициент корреляции был отсортирован по слоям в цепи HC и OB или неотсортирован в сети iPSC, а затем сохранен в симметричной матрице. Функциональные коннектомы схем HC и OB были получены путем применения многомерной причинно-следственной связи Грейнджера и направленной передаточной функции (DTF) для количественной оценки влияния одного временного ряда на другой и оценки направленного потока информации в коррелированных звеньях в различных сетях. Коннектомное картирование HC (рис. 4A) и OB (рис. 4B) и визуализация сети выполнялись с помощью программы Gephi версии 9.2 (https://gephi.org). Аналогичные ограничения параметров были наложены на функциональные связи для сравнения схем срезов мозга HC и OB и проиллюстрировали 100 с функциональной связности обнаруженных событий LFP. Узлы масштабируются в соответствии с градусной интенсивностью с узловым цветом, обозначающим слой, и цветом связи, идентифицирующим внутрислойные и межслойные соединения. Функциональные коннектомы человеческих iPSC-сетей были сгенерированы путем применения пространственно-временных фильтров (STF) и дистанционных порогов задержки (DdLT) для улучшения выбора значимых связей и уточнения идентификации значимых связей путем применения анализа отфильтрованной и нормализованной кросс-корреляционной гистограммы (FNCCH). Коннектомное отображение iPSC-сетей человека на всей визуализации чипа HD-MEA (рис. 4C), выполненное с помощью Gephi. Узловой цвет указывает на возбуждающий или тормозящий вход, а цвет связи идентифицирует соединения.
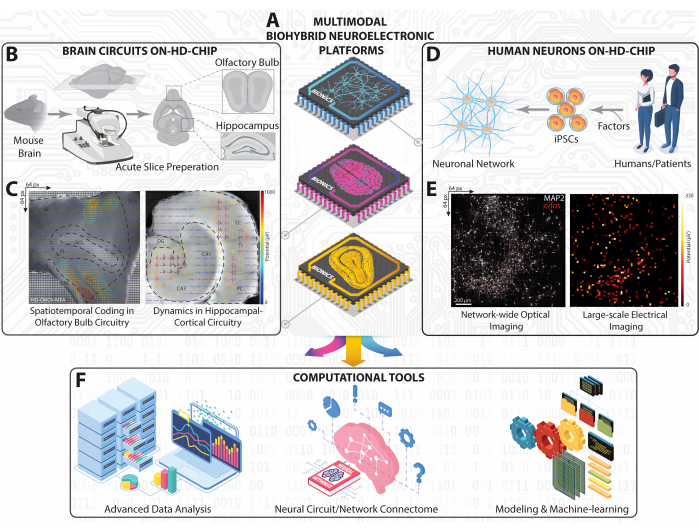
Рисунок 1: Обзор экспериментально-вычислительной платформы на крупномасштабных HD-MEA. (A) Изометрическое схематическое изображение наших мультимодальных биогибридных нейроэлектронных платформ, реализованных с использованием HD-MEA на основе КМОП для захвата нейронной динамики от нейронных цепей и сетей HC, OB и iPSC человека. (B) Схематический рабочий процесс для нарезки мозга мыши и его рабочий ландшафт для получения срезов HC и OB. (C) Топографические представления крупномасштабных картин стрельбы, записанные одновременно со всех срезов HC и OB, наложенные на оптические изображения срезов с извлеченными внеклеточными сигналами. (D) Схематическое изображение нейронной сети ИПСК, полученное от человека. (E) Флуоресцентные микрофотографии, показывающие клеточный c-fos и соматический/дендритный MAP-2 всей нейронной сети человека на чипе HD-MEA (слева), совпадающие со всей картой средней активности возбуждения (справа). (F) Вычислительная платформа, включающая расширенный анализ данных, картографирование связей и инструменты машинного обучения на основе искусственного интеллекта для анализа многомерных нейронных данных, полученных из крупномасштабных записей на HD-MEA. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Макеты рабочих областей для подготовки и записи срезов мозга ex-vivo и человеческих ИПСК in vitro . (A) Схематический рабочий процесс, иллюстрирующий настройку для подготовки срезов HC и OB, с необходимыми инструментами и оборудованием в каждом рабочем пространстве. (B) Схематическое изображение для подготовки культуры ИПСК человека, включая необходимые инструменты и устройства. Полный список материалов приведен в шагах 1.2.2, 2.1, 2.2, 3.1.1, 3.3 и в таблице материалов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
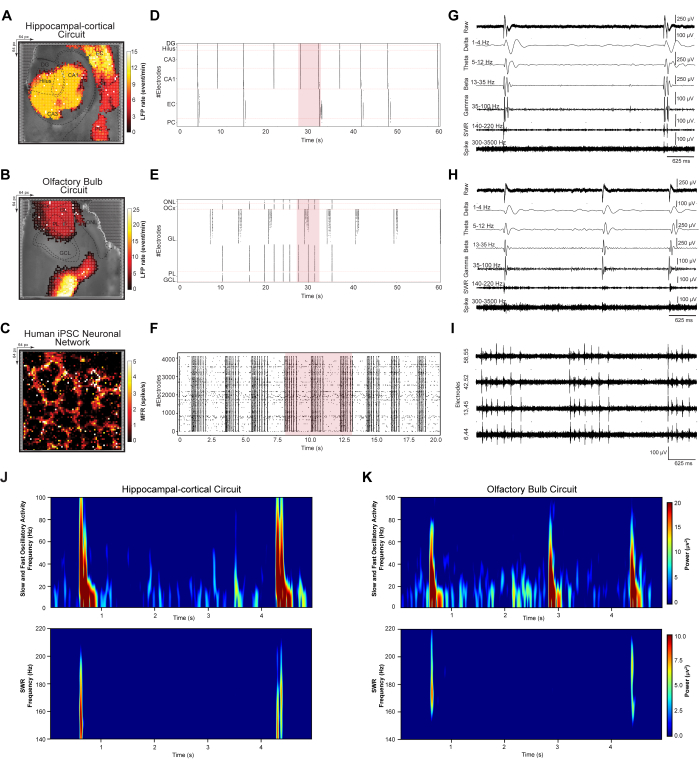
Рисунок 3: Отображение и извлечение пространственно-временных закономерностей сетевой динамики. (A-C) Пространственные карты средней LFP и скорости спайков, рассчитанные на основе пятиминутных записей, наложенных на световое изображение микроскопа. (Д-Ж) Растровые графики, отображающие обнаруженные события LFP без шума в 60-секундной подвыборке данных и пики в 20-секундной подвыборке данных. (Г-И) Репрезентативное извлечение трассировки сигнала из 5-секундного сегмента подвыборки данных растрового графика (выделен красным цветом на растровом графике), отображаемого в виде необработанных осцилляторных полос LFP (1-100 Гц); δ (1-4 Гц), θ (5-12 Гц), β (13-35 Гц) и γ (35-100 Гц) диапазонах частот; КСВ (140-220 Гц); и высокочастотные одиночные и MUA спайки (300-3500 Гц). (Дж,К) Карты спектральной плотности мощности быстрых и медленных колебательных НЧП (1-100 Гц) и КСВ (140-220 Гц). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
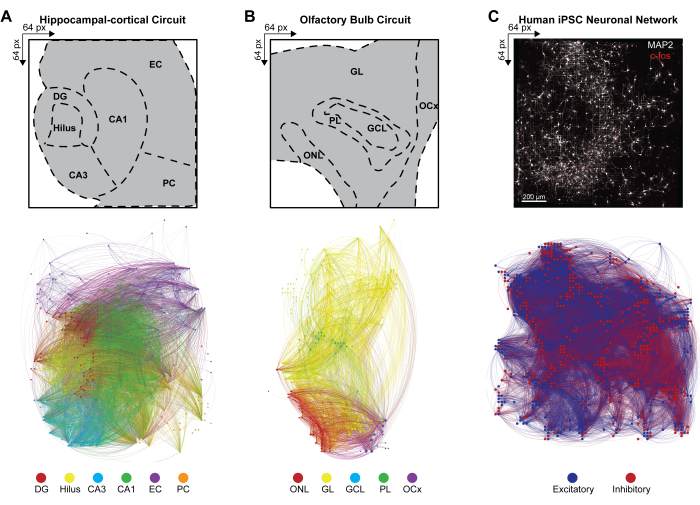
Рисунок 4: Организация мультимодальных общесетевых функциональных коннектомов. (А-С) Карты Gephi, иллюстрирующие узловую функциональную связность, где узлы соответствуют одной из примеров цветовых полос легенд (ниже), а связи (или ребра) затенены в соответствии с соединительными узлами. Примеры условных обозначений для слоев (A) HC, (B) OB и (C) iPSC отображаются в массиве 64 x 64. Слои HC и OB наносятся на 100-секундный интервал времени, чтобы эффективно уменьшить количество видимых узлов и связей для целей визуализации. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Решения для подготовки срезов мозга и сред для культур нейронов ИПСК. (A) Режущий раствор с высоким содержанием сахарозы для получения срезов мозга ex-vivo. (B) Решение для регистрации aCSF для подготовки и записи срезов мозга ex-vivo. (К-Д) Протокол среды iPSC для нейронов человека, где (C) — полная среда BrainPhys, используемая для размораживания клеток, покрытия чипов HD-MEA и культивирования HD-MEA, и (D) точечная среда, используемая для покрытия клеток HD-MEA. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Устранение распространенных проблем с записью HD-MEA. Список распространенных проблем, их потенциальных причин и решений по устранению неполадок, связанных с микросхемами HD-MEA, платформой записи, системным шумом и программным обеспечением. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Discussion
Сложная динамика пространственно-временной активности нейронов, возникающая из взаимосвязанных нейронных ансамблей, уже давно является предметом интриг в нейробиологии. Традиционные методики, такие как патч-клэмп, стандартная МЭА и визуализацияCa2+, дали ценную информацию о сложности мозга. Тем не менее, они часто не в состоянии охватить всеобъемлющую общесетевую вычислительную динамику 21,22,23. Технический протокол платформы HD-MEA, подробно описанный в этом исследовании JoVE, представляет собой значительный скачок вперед, предлагая панорамный взгляд на нейронную динамику в различных модальностях, от клеточных сборок до обширных сетей (т.е. острых срезов мозга мыши ex-vivo и iPSC-сетей человека in vitro)26,29,30,32.
Острые срезы мозга мышей ex-vivo были основополагающим инструментом в нейронных исследованиях, облегчая исследования на молекулярном и цепном уровнях 6,7. Тем не менее, проблема поддержания жизнеспособности тканей является постоянным узким местом. Протокол, описанный в этом исследовании, вносит критические изменения для оптимизации качества и долговечности этих срезов, чтобы использовать их преимущества на платформе HD-MEA. Этот протокол подчеркивает важность: - i) Достижения однородности среза, для чего использование вибратома предпочтительнее измельчителя тканей из-за его точности и минимального повреждения тканей, несмотря на компромисс в виде более длительного времени нарезки. ii) Обеспечение постоянной карбогенации на протяжении всего процесса, от экстракции до регистрации, для поддержания жизнеспособности тканей. iii) Регулирование температуры и обеспечение достаточного времени восстановления перед записью. iv) Использование агарозного блока или пресс-формы для стабилизации мозга, предотвращения разрыва и минимизации контакта с клеем. v) Поддержание оптимального расхода карбогенизированной aCSF в резервуаре HD-MEA для обеспечения здоровья среза и предотвращения таких проблем, как развязка, шум и дрейф (Таблица 2).
Как для срезов мозга мыши, так и для препаратов ИПСК человека, улучшение взаимодействия электрода с тканью имеет первостепенное значение 30,46,47. Наш протокол подчеркивает важность использования молекулы, способствующей адгезии, поли-дл-орнитина (PDLO). Эта молекула не только увеличивает площадь поверхности для обнаружения электрических сигналов, но и повышает электропроводность46. Таким образом, он способствует клеточной адгезии, росту и развитию функциональных свойств сети. Такая оптимизация играет ключевую роль в повышении эффективности платформы HD-MEA. Это, в свою очередь, обеспечивает точный и последовательный анализ микромасштабных коннектомов ex-vivo и in vitro и их пространственно-временных последовательностей возбуждения. Примечательно, что PDLO превосходит другие субстраты, такие как полиэтиленимин (PEI) и поли-l-орнитин (PLO), в стимулировании спонтанной активности возбуждения и реакции на электрические стимулы в нейронных культурах. Кроме того, PDLO был использован для функционализации поверхности на HD-MEA и показал улучшение интерфейса связи электрод-срез и увеличение отношения сигнал/шум как в OB, так и в HC срезах26,29. Добавление изготовленного по индивидуальному заказу платинового якоря еще больше расширяет интерфейс электрод-срез, что приводит к записи с более высоким соотношением сигнал/шум.
Использование HD-MEA как для срезов мозга мышей ex-vivo, так и для iPSC-сетей человека in vitro представляет собой метод, позволяющий исследовать экстенсивную, многомасштабную и мультимодальную динамику. Однако этот инновационный подход порождает значительные проблемы, особенно в области управления данными 48,49,50,51. Одна запись HD-MEA, полученная с частотой дискретизации 18 кГц/электрод, генерирует ошеломляющие 155 МБ/с данных. Объем данных быстро увеличивается, если учитывать несколько срезов, различные фармакологические состояния или длительные периоды записи. Такой приток информации требует надежной инфраструктуры хранения данных и передовых вычислительных инструментов для оптимизации обработки. Способность платформы HD-MEA одновременно собирать данные от тысяч нейронных ансамблей является одновременно и благом, и препятствием. Она дает полное представление о вычислительной динамике функций мозга, но в то же время требует уточненной аналитической структуры. В этом протоколе JoVE мы привели примеры вычислительных стратегий, включая обнаружение крупномасштабных событий, классификацию, теорию графов, частотный анализ и машинное обучение. Эти методы подчеркивают интенсивные усилия, предпринимаемые для решения проблем анализа сложных нейронных данных. Тем не менее, все еще есть значительные возможности для разработки более совершенных вычислительных инструментов для анализа этих многомерных нейронных наборов данных. Вооружившись соответствующими инструментами и методологиями, можно расширить потенциал платформы HD-MEA, предлагая глубокое понимание тонкостей функций мозга как при здоровых, так и при патологических состояниях.
По сути, платформа HD-MEA, интегрированная с подробными протоколами и вычислительными инструментами, предлагает трансформационный подход к пониманию сложных процессов работы мозга. Фиксируя крупномасштабную, многомасштабную и мультимодальную динамику, он дает бесценную информацию о таких процессах, как обучение, память и обработка информации. Более того, его применение в сетях ИПСК человека in vitro может произвести революцию в скрининге лекарств и персонализированной медицине. Однако, несмотря на то, что эта платформа представляет собой значительный прогресс в исследованиях в области нейробиологии, крайне важно признать и решить присущие ей технические проблемы. Благодаря постоянному совершенствованию и интеграции передовых вычислительных инструментов, платформа HD-MEA готова открыть новую эру точных диагностических инструментов, идентификации специфических биомаркеров и таргетной терапии неврологических расстройств.
Disclosures
Авторы заявляют об отсутствии конкурирующих или финансовых интересов.
Acknowledgements
Это исследование было поддержано институциональными фондами (DZNE), Ассоциацией им. Гельмгольца в рамках Фонда валидации им. Гельмгольца (HVF-0102) и Дрезденской международной высшей школой биомедицины и биоинженерии (DIGS-BB). Мы также хотели бы поблагодарить платформу для поведенческого тестирования животных в DZNE-Dresden (Александр Гарте, Анне Карасински, Сандра Гюнтер и Йенс Бергманн) за их поддержку. Мы хотели бы отметить, что часть рисунка 1 была создана с использованием платформы BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 150 mm Glass Petri Dish | generic | generic | Brain Preparation Workspace, Brain Slice Recording Workspace |
| 0.22 μm Sterile Filter Unit | Assorted | Assorted | Assorted |
| 90 mm Plastic Culture Dish | TPP | 93100 | Brain Preparation Workspace, Brain Slice Recording Workspace |
| Agarose | Roth | 6351.5 | Brain Preparation Workspace |
| Agarose Mold | CUSTOM | CUSTOM | Brain Preparation Workspace; Custom designed 3D Printer Design, available upon request |
| Aluminum Foil | generic | generic | Brain Extraction Workspace |
| Anesthesia chamber | generic | generic | Brain Extraction Workspace; Assorted Beaker, Bedding etc |
| Ascorbic Acid | Sigma Aldrich | A4544-25G | Solution Preparation Workspace |
| Assorted Beakers | generic | generic | Solution Preparation Workspace; 50 mL |
| Assorted Luers | Cole Parmer | 45511-00 | Brain Slice Recording Workspace |
| Assorted Volumetric flasks | generic | generic | Solution Preparation Workspace; 500 mL, 1 L |
| B27 Supplement | Life Technologies | 17504-044 | BrainXell Commercial Supplier Protocol |
| BDNF | Peprotech | 450-02 | BrainXell Commercial Supplier Protocol |
| Biological Safety Cabinet with UV Lamp | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| BrainPhys Neuronal Medium | STEMCELL Technologies | 05790 | CDI, and BrainXell Commerical Supplier Protocol |
| Brainwave Software | 3Brain AG | Version 4 | Brain Slice and Human iPSC Recording Workspace |
| BrainXell Glutamatergic Neuron Assay | BrainXell | BX-0300 | BrainXell Commercial Supplier Protocol |
| CaCl2 | Sigma Aldrich | 21115-100ML | Solution Preparation Workspace |
| Carbogen | generic | generic | All Workspaces; 95%/5% O2 and CO2 mixture |
| Cell Culture Incubator | Assorted | Assorted | Assorted |
| CMOS-based HD-MEA chip | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Conical Tubes, 50 mL, Falcon (Centrifuge Tubes) | STEMCELL Technologies | 38010 | CDI Commerical Supplier Protocol |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | Brain Slice Recording Workspace |
| Curved Forceps | FST | 11052-10 | Brain Extraction Workspace |
| DMEM/F12 Medium | Life Technologies | 11330-032 | BrainXell Commercial Supplier Protocol |
| Dulbecco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | STEMCELL Technologies | 37350 | CDI Commerical Supplier Protocol |
| Filter Paper | Macherey-Nagel | 531 011 | Brain Preparation Workspace |
| Fine Brush | Leonhardy | 773 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Forceps | VITLAB | 67895 | Brain Slice Recording Workspace |
| GDNF | Peprotech | 450-10 | BrainXell Commercial Supplier Protocol |
| Geltrex | Life Technologies | A1413201 | BrainXell Commercial Supplier Protocol |
| Glass pasteur pipette | Roth | 4518 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Glucose | Sigma Aldrich | G7021-1KG | Solution Preparation Workspace |
| GlutaMAX | Life Technologies | 35050-061 | BrainXell Commercial Supplier Protocol |
| Gravity-based Perfusion System | ALA | VC3-8xG | Brain Slice Recording Workspace |
| HD-MEA Recording platform | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Heater | Warner Instruments | TC-324C | Brain Slice Recording Workspace |
| Hemocytometer or Automated Cell Counter | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Hypo Needles | Warner Instruments | 641489 | Brain Slice Recording Workspace |
| iCell GlutaNeurons Kit, 01279 | CDI | R1061 | CDI Commerical Supplier Protocol |
| Iris Scissors | Vantage | V95-304 | Brain Extraction Workspace |
| Isoflurane | Baxter | HDG9623 | Brain Extraction Workspace |
| KCl | Sigma Aldrich | P5405-250G | Solution Preparation Workspace |
| Laminin | Sigma-Aldrich | L2020 | CDI Commerical Supplier Protocol |
| Liquid Nitrogen Storage Unit | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Magnetic Stirrer | generic | generic | Solution Preparation Workspace |
| Metal Screws | Thorlabs | HW-KIT2/M | Brain Slice Recording Workspace |
| MgCl2 | Sigma Aldrich | M1028-100ML | Solution Preparation Workspace |
| MgSO4 | Sigma Aldrich | 63138-250G | Solution Preparation Workspace |
| Microdissection Tool Holder | Braun | 4606108V | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Microdissection Tool Needle | Braun | 9186166 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Modular Stereomicroscope | Leica | CUSTOM | Brain Slice Recording Workspace; custom specifications and modifications |
| N2 Supplement | Life Technologies | 17502-048 | CDI, and BrainXell Commercial Supplier Protocol |
| NaCl | Sigma Aldrich | S3014-1KG | Solution Preparation Workspace |
| NaH2PO4 | Sigma Aldrich | S0751-100G | Solution Preparation Workspace |
| NaHCO3 | Sigma Aldrich | S5761-500G | Solution Preparation Workspace |
| Neurobasal Medium | Life Technologies | 21103-049 | BrainXell Commercial Supplier Protocol |
| Optical Cage System | Thorlabs | Assorted | Brain Slice Recording Workspace |
| Optical Table w/Breadboard | Thorlabs | SDA7590 | Brain Slice Recording Workspace |
| PDLO | Sigma Aldrich | P0671 | HD-MEA Coating, Brain Slice Recording Workspace |
| Penicillin-streptomycin, 100x | Thermo Fisher Scientific | 15140-122 | CDI Commerical Supplier Protocol |
| Pipette tips | TipONE | S1120-8810 | Brain Slice Recording Workspace |
| Pipettors | Assorted | Assorted | Assorted |
| Platinum Anchor | CUSTOM | CUSTOM | Brain Slice Recording Workspace |
| Polyethylene Tubing | Assorted | Assorted | Brain Slice Recording Workspace |
| Pump | MasterFlex | 78018-22 | Brain Slice Recording Workspace |
| Razor Blade | Apollo | 10179960 | Brain Preparation Workspace |
| Reference Electrode Cell Culture Cap | CUSTOM | CUSTOM | Human iPSC Recording Workspace; Custom designed 3D Printer Design, available upon request |
| Rubber Pipette Bulb | Duran Wheaton Kimble | 292000205 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Serological Pipettes, 1 mL, 2 mL, 5 mL, 10 mL, 25 mL | Assorted | Assorted | Assorted |
| Slice Recovery Chamber | CUSTOM | CUSTOM | Brain Slice Recovery Workspace; Custom designed 3D Printer Design, available upon request |
| Spatula | ISOLAB | 047.06.150 | Brain Preparation Workspace |
| Sucrose | Sigma Aldrich | 84100-1KG | Solution Preparation Workspace |
| Super Glue | UHU | 358221 | Brain Slice Preparation Workspace |
| Surgical Scissors | Peters Instruments | BC 344 | Brain Extraction Workspace |
| Tabletop Centrifuge | Assorted | Assorted | Assorted |
| TGF-β1 | Peprotech | 100-21C | BrainXell Commercial Supplier Protocol |
| Tissue Paper | generic | generic | Brain Extraction Workspace |
| Trypan Blue | STEMCELL Technologies | 07050 | CDI Commerical Supplier Protocol |
| Upright Microscope | Olympus | CUSTOM | Imaging Workspace; Custom specifications and modifications |
| Vacusip | Integra | 159010 | Brain Slice Recording Workspace |
| Vibratome | Leica | VT1200s | Brain Slice Preparation Workspace; Includes: Specimen plate, buffer tray, ice tray, specimen plate holding tool, vibratome blade adjusting tool |
| Vibratome Blade | Personna | N/A | Brain Slice Preparation Workspace |
| Water Bath | Lauda | L000595 | Brain Slice Recovery Workspace |
References
- Hebb, D. O. . The Organization of Behavior; A Neuropsychological Theory. , (1949).
- Cossart, R., Garel, S. Step by step: cells with multiple functions in cortical circuit assembly. Nat Rev Neurosci. 23, 395-410 (2022).
- Carrillo-Reid, L., Yuste, R. Playing the piano with the cortex: role of neuronal ensembles and pattern completion in perception and behavior. Curr Opin Neurobiol. 64, 89-95 (2020).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Neural Syntax: Cell assemblies, synapsembles, and readers. Neuron. 68 (3), 362-385 (2010).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Cho, S., Wood, A., Bowlby, M. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Curr Neuropharmacol. 5 (1), 19-33 (2007).
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Anderson, P., Morris, R., Amaral, D., Bliss, T., O'Keefe, L. . The Hippocampus Book. , (2006).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nat Neurosci. 20, 1434-1447 (2017).
- Mori, K., Nagao, H., Yoshihara, Y. The olfactory bulb: Coding and processing of odor molecule information. Science. 286 (5440), 711-715 (1999).
- Buck, L., Axel, R. A novel multigene family may encode odorant receptors: A molecular basis for odor recognition. Cell. 65 (1), 175-187 (1991).
- Bushdid, C., Magnasco, M. O., Vosshall, L. B., Keller, A. Humans can discriminate more than 1 trillion olfactory stimuli. Science. 343 (6177), 1370-1372 (2014).
- Kempermann, G. Why new neurons? Possible functions for adult hippocampal neurogenesis. J Neurosci. 23 (3), 635-638 (2003).
- Aimone, J. B., Wiles, J., Gage, F. H. Computational influence of adult neurogenesis on memory encoding. Neuron. 61 (2), 187-202 (2009).
- Nithianantharajah, J., Hannan, A. J. Enriched environments, experience-dependent plasticity and disorders of the nervous system. Nat Rev Neurosci. 7, 697-709 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Rajamohan, D., et al. Current status of drug screening and disease modelling in human pluripotent stem cells. Bioessays. 35 (3), 281-298 (2013).
- Heilker, R., Traub, S., Reinhardt, P., Schöler, H. R., Sterneckert, J. iPS cell derived neuronal cells for drug discovery. Trends Pharmacol Sci. 35 (10), 510-519 (2014).
- Zhao, S. R., Mondéjar-Parreño, G., Li, D., Shen, M., Wu, J. C. Technical applications of microelectrode array and patch clamp recordings on human induced pluripotent stem cell-derived cardiomyocytes. J Vis Exp. (186), e64265 (2022).
- Hamill, O. P., McBride, D. W. Induced membrane hypo/hyper-mechanosensitivity: A limitation of patch-clamp recording. Annu Rev Physiol. 59, 621-631 (1997).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protoc. 2 (2), 100442 (2021).
- Lee, C. H., Park, Y. K., Lee, K. Recent strategies for neural dynamics observation at a larger scale and wider scope. Biosens Bioelectron. 240, 115638 (2023).
- Urai, A. E., Doiron, B., Leifer, A. M., Churchland, A. K. Large-scale neural recordings call for new insights to link brain and behavior. Nat Neurosci. 25 (1), 11-19 (2022).
- Hu, X., Khanzada, S., Klütsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834 (2022).
- Amin, H., Marinaro, F., Tonelli, D. D. P., Berdondini, L. Developmental excitatory-to-inhibitory GABA-polarity switch is disrupted in 22q11.2 deletion syndrome: A potential target for clinical therapeutics. Sci Rep. 7 (1), 15752 (2017).
- Amin, H., Nieus, T., Lonardoni, D., Maccione, A., Berdondini, L. High-resolution bioelectrical imaging of Aβ-induced network dysfunction on CMOS-MEAs for neurotoxicity and rescue studies. Sci Rep. 7 (1), 2460 (2017).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471 (2023).
- Amin, H., et al. Electrical responses and spontaneous activity of human iPS-derived neuronal networks characterized for 3-month culture with 4096-electrode arrays. Front Neurosci. 10, 121 (2016).
- Lonardoni, D., et al. Recurrently connected and localized neuronal communities initiate coordinated spontaneous activity in neuronal networks. PLoS Comput Biol. 13 (7), e1005672 (2017).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. 2022 44th Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC). , 3111-3114 (2022).
- Rossi, L., Emery, B. A., Khanzada, S., Hu, X., Amin, H. Pharmacologically and electrically-induced network-wide activation of olfactory bulb with large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Emery, B. A., et al. Recording network-based synaptic transmission and LTP in the hippocampal network on a large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays). Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab Chip. 9, 2644-2651 (2009).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Amin, H., Maccione, A., Zordan, S., Nieus, T., Berdondini, L. High-density MEAs reveal lognormal firing patterns in neuronal networks for short and long term recordings. 2015 7th International IEEE/EMBS Conference on Neural Engineering (NER). , 1000-1003 (2015).
- Altuntac, E., et al. Bottom-up neurogenic-inspired computational model. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. J Neurosci Methods. 177 (1), 241-249 (2009).
- Welch, P. D. The use of fast Fourier transform for the estimation of power spectra: A method based on time averaging over short, modified periodograms. IEEE Transactions on Audio and Electroacoustics. 15 (2), 70-73 (1967).
- Eggermont, J. J., Munguia, R., Pienkowski, M., Shaw, G. Comparison of LFP-based and spike-based spectro-temporal receptive fields and cross-correlation in cat primary auditory cortex. PLoS One. 6 (5), e20046 (2011).
- Damos, P. Using multivariate cross correlations, Granger causality and graphical models to quantify spatiotemporal synchronization and causality between pest populations. BMC Ecol. 16, 33 (2016).
- Kaminski, M. J., Blinowska, K. J. A new method of the description of the information flow in the brain structures. Biol Cybern. 65, 203-210 (1991).
- Pastore, V. P., Massobrio, P., Godjoski, A., Martinoia, S. Identification of excitatory-inhibitory links and network topology in large-scale neuronal assemblies from multi-electrode recordings. PLoS Comput Biol. 14 (8), e1006381 (2018).
- Amin, H., Dipalo, M., De Angelis, F., Berdondini, L. Biofunctionalized 3D nanopillar arrays fostering cell guidance and promoting synapse stability and neuronal activity in networks. ACS Appl Mater Interfaces. 10 (17), 15207-15215 (2018).
- Woeppel, K., Yang, Q., Cui, X. T. Recent advances in neural electrode-tissue interfaces. Curr Opin Biomed Eng. 4, 21-31 (2017).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Curr Opin Neurobiol. 50, 92-100 (2018).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Freeman, J. Open source tools for large-scale neuroscience. Curr Opin Neurobiol. 32, 156-163 (2015).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nat Neurosci. 14 (2), 139-142 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved