Микрофлюидный подход к разрешению одномоментной и последовательной секреции цитокинов отдельных полифункциональных клеток
* These authors contributed equally
In This Article
Summary
Протокол описывает усовершенствованную микрофлюидную платформу для количественного измерения динамики секреции цитокинов отдельными мононуклеарными клетками периферической крови человека. Платформа измеряет до трех цитокинов параллельно (IL-6, TNFα и IL-1β) для каждой отдельной клетки, стимулируемой липополисахаридом в качестве примера.
Abstract
Инфекции, аутоиммунные заболевания, желательные и неблагоприятные иммунологические реакции на лечение могут привести к сложному и динамическому цитокиновому ответу in vivo. Эта реакция включает в себя многочисленные иммунные клетки, секретирующие различные цитокины для управления иммунной реакцией. Тем не менее, динамика секреции, количество и совместное появление различных цитокинов различными подтипами клеток остаются плохо изученными из-за отсутствия соответствующих инструментов для их изучения. В данной статье мы описываем протокол с использованием микрофлюидной капельной платформы, которая позволяет количественно измерять динамику секреции нескольких цитокинов параллельно на уровне отдельных клеток с временным разрешением. Это возможно благодаря инкапсуляции отдельных клеток в микрофлюидные капли вместе с мультиплексным иммуноанализом для параллельного количественного определения концентраций цитокинов, их иммобилизации для динамической флуоресцентной визуализации и анализу соответствующих изображений для получения секретируемых количеств и динамики. Протокол описывает приготовление функционализированных магнитных наночастиц, калибровочные эксперименты, подготовку клеток и инкапсуляцию клеток и наночастиц в капли для флуоресцентной визуализации и последующего анализа изображений и данных на примере мононуклеарных клеток периферической крови человека, стимулированных липополисахаридом. Представленная платформа идентифицировала отчетливое поведение секреции цитокинов для одиночных и совместно секретирующих клеток, характеризуя ожидаемую фенотипическую гетерогенность в измеряемом образце клеток. Кроме того, модульный характер анализа позволяет адаптировать и применять его для изучения различных белков, цитокинов и образцов клеток, что потенциально приводит к более глубокому пониманию взаимодействия между различными типами иммунных клеток и роли различных цитокинов, секретируемых динамически, в формировании жестко регулируемого иммунного ответа. Эти новые идеи могут быть особенно интересны при изучении иммунной дисрегуляции или при определении целевых групп населения в терапии и разработке лекарств.
Introduction
Инфекции часто вызывают сложные реакции хозяина с участием врожденной и адаптивной иммунной систем 1,2. При инфицировании или распознавании инфекционных агентов клетки-хозяева могут продуцировать разнообразный спектр хемо- и цитокинов, которые представляют собой небольшие белки, известные как критические коммуникаторы и модулаторыиммунной системы. Провоспалительные цитокины высвобождаются на ранних этапах инфекции для инициирования иммунного ответа, за которыми позже следуют противовоспалительные цитокины, которые имеют решающее значение для предотвращения повреждения тканей и последующих хронических или аутовоспалительных заболеваний. Этот баланс между устранением угрозы и защитой тканей проявляется в широком репертуаре цитокинов, выполняющих различные функции во время инфекции, что позволяет тонко настроить ответ 4,5. В этой смеси можно наблюдать уникальные сигнатуры в зависимости от патогена и сигналов, которые он вызывает, расположения тканей и иммунных клеток, из которых они происходят. Тем не менее, высвобождение цитокинов также, по-видимому, представляет собой многофункциональный биологический процесс, уникальный для каждой клеточной популяции, разнообразный по динамике секреции и индивидуальной реакции. Эта гетерогенность была описана в литературе в течение многих лет, например, среди субпопуляций Т-клеток 6,7, где исследования аутовоспалительных заболеваний и тяжелых инфекций COVID-19 показали большое функциональное разнообразие маркеров воспаления внутри и между пациентами 8,9. В последнее время появление секвенирования одиночных клеток высветило высокую пластичность и перекрестные связи между субпопуляциями в иммунном микроокружении, которые ранее не были очевидны, что указывает на то, что для захвата этой гетерогенностинеобходимы методы с использованием одиночных клеток. В то время как разрабатываются новые методы анализа транскриптома, фенотипический анализ остается сложной задачей, поскольку он требует одновременных, количественных и временных измерений секреции белка на уровне отдельных клеток. Такие измерения позволяют нам исследовать идентичность секретирующих клеток, динамику и паттерны секреции (медленная/быстрая, ранняя/поздняя, синхронная/последовательная) для репертуара или панели цитокинов. Благодаря возможности количественного и временного изучения динамики высвобождения цитокинов во время иммунного ответа, полученные выводы могут позволить понять клеточный ансамбль и индуцированный ответ.
В стандартных протоколах цитокины обычно обнаруживаются в надосадочной жидкости клеточных суспензий и сыворотке крови с помощью иммуноферментного анализа (ИФА), что дает объемные секретируемые количества. Объемные измерения не позволяют количественно оценить количество цитокинов, вырабатываемых каждой клеткой, что особенно заметно при анализе гетерогенных клеток. Альтернативные методы, такие как внутриклеточное окрашивание цитокинов, иммуноферментный анализ (ELISpot) или микрогравированные анализы (например, Isoplexis), обнаруживают цитокины, экспрессируемые отдельными клетками, но обеспечивают только конечные измерения12,13. Это означает, что динамика секреции и изменения, которые могут произойти в структуре клеточной секреции в течение инкубационного периода, игнорируются. Кроме того, измерения конечных точек не позволяют дифференцировать одновременную и последовательную секрецию цитокинов, поэтому истинная степень одновременной полифункциональности иммунных клеток в секреции цитокинов остается неясной при использовании этих методов.
Разрешение для отдельных клеток может быть достигнуто с помощью микрофлюидики капель для создания и обработки физических компартментов размером с пиколитр с целью изучения иммунных клеток по их уникальным фенотипам секреции цитокинов на уровне отдельных клеток14,15. Эти отсеки состоят из эмульсий типа вода в масле и могут быть получены с использованием микрофлюидных чипов16,17. Действительно, микрофлюидные анализы на основе капель продемонстрировали чрезвычайную универсальность, позволяя анализировать различные биологические образцы и репертуары на уровне отдельных клеток и интегрировать их с предшествующими (обработка клеток и реагентов) и нисходящими процессами (сортировка одиночных клеток, протеомика или секвенирование)18,19,20,21,22. В частности, установки, которые позволяют иммобилизовать капли, позволяют измерять функциональность одной клетки с течением времени, что ценно для анализа секреции белка18. Кроме того, интеграция мультиплексных количественных анализов облегчает проведение дополнительных исследований в ранее недоступных измерениях таких процессов, как косекреция и идентификация полифункциональных иммунных клеток23,24.
В этом протоколе мы описываем рабочий процесс на основе иммобилизованных капель для обнаружения, количественной оценки и временного измерения секреции до трех цитокинов параллельно из отдельных клеток17,23. Технология предлагает возможность параллельного мониторинга цитокиновых реакций от более чем 20 000 клеток.
Представленный рабочий процесс состоит из микрофлюидной инкапсуляции отдельных иммунных клеток и функционализированных наночастиц в капли размером 60 пл воды в масле. Иммобилизация > 100 000 капель в камере наблюдения и флуоресцентная микроскопия с временным разрешением позволяют измерить динамику секреции цитокинов в каждой капле и каждом цитокине (рис. 1A). Для каждой отдельной клетки в капле секреция цитокинов измеряется с помощью сэндвич-иммуноанализа, в котором магнитные наночастицы, функционализированные специфическим антителом захвата, связываются с секретируемым цитокином, что приводит к последующему перемещению и связыванию флуоресцентно меченых детектирующих антител (рис. 1B, C). Бусина образуется путем выравнивания магнитных наночастиц, к которым можно количественно измерить флуоресценцию в присутствии цитокина. Здесь флуоресцентное перемещение определяется как средняя интенсивность флуоресценции, обнаруженная на линии бусины, деленная на среднюю интенсивность флуоресценции оставшейся капли. Этот анализ может быть мультиплексирован для нескольких цитокинов путем смешивания по-разному функционализированных партий наночастиц и соответствующих детектирующих антител, меченных в различных флуоресцентных каналах23, что приводит к специфическим флуоресцентным перемещениям в различных каналах. С помощью настраиваемого сценария анализа можно извлечь значения флуоресцентного перемещения, а изображения могут быть преобразованы в динамические профили секреции для каждой отдельной клетки и цитокина. Таким образом, полученные наборы данных дают многочисленные данные, такие как количественное измерение секреции с течением времени, идентификация субпопуляций с совместным секретированием и распределение клеток в соответствии с секретируемыми количествами, скоростью и комбинациями цитокинов.
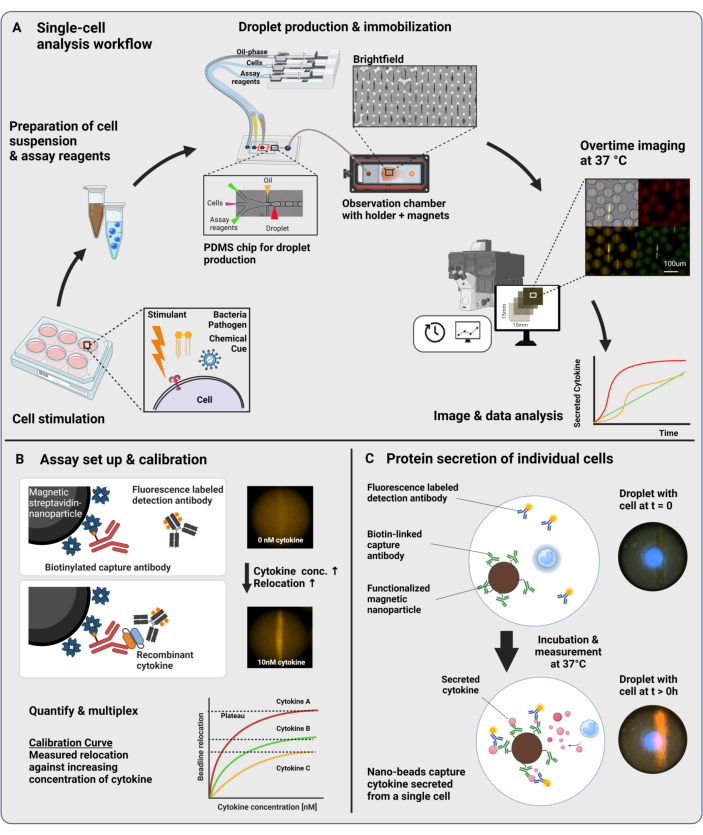
Рисунок 1: Рабочий процесс и принцип анализа. (А) Обзор рабочего процесса анализа клеток, секретирующих цитокины, после стимуляции. Одноклеточные суспензии и магнитные наночастицы получают и инкапсулируют в объемные масляно-водные эмульсии (капли) объемом 60 пЛ. Капли иммобилизуются и наночастицы выравниваются внутри магнитного поля перед измерением в течение 4 часов каждые 30 минут. Наконец, изображения анализируются, и извлекаются параметры для каждой капли, временной точки и флуоресцентного канала. Эта цифра была изменена с17. (Б) Принцип проведения биоанализа с помощью капельного сэндвича. Функционализированные наночастицы связывают секретируемые цитокины, что приводит к последующему перемещению флуоресцентно меченых детекционных антител к наночастицам. Это смещение флуоресценции количественно определено и подтверждено с помощью калибровочных экспериментов, проведенных с рекомбинантными цитокинами. Смешивание различных функционализированных наночастиц позволяет проводить мультиплексные измерения до трех цитокинов одновременно. (C) В клеточных экспериментах капли отслеживаются в течение всего времени измерения, а секретирующие клетки идентифицируются путем увеличения со временем флуоресценции на наночастицы. Схемы не соответствуют масштабу. Фигурка создана с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Protocol
Все эксперименты проводились в соответствии с этическим соглашением EK202-N-56 и были одобрены комиссией по этике ETH Zurich. Работа с клетками человека осуществлялась в ламинарном шкафу, содержащемся в лаборатории уровня биобезопасности 2.
ПРИМЕЧАНИЕ: В следующих разделах подробно описан протокол измерения секреции цитокинов с временным разрешением на уровне отдельных клеток. Описанная здесь методика применяется для стимуляции мононуклеарных клеток периферической крови (ПМЦ) липополисахаридом (ЛПС) и параллельного измерения цитокинов IL-6, TNFα и IL-1β. Однако, при необходимости, протокол может быть адаптирован к другим типам клеток, стимуляторам и цитокинам.
1. Изготовление камеры наблюдения
ПРИМЕЧАНИЕ: Чтобы избежать перемещения капель во время визуализации, подготавливается камера для наблюдения высотой примерно на 10% меньше диаметра капли.
- Подготовка резки двусторонним скотчем и верхним стеклоподъемником
- Нарисуйте или загрузите желаемую конструкцию выреза камеры на вкладке «Дизайн» программного обеспечения для резки. Конкретные размеры, используемые здесь, см. на рисунке 2E.
- Прикрепите двустороннюю клейкую ленту толщиной 32 мкм к клеевому коврику для резки с помощью ленты и поместите коврик для резки в автоматическую режущую машину.
- Вырежьте конструкцию патронника из ленты, уделяя при этом внимание срезанию длинных краев патронника в одном направлении для более легкого отсоединения в шаге 1.3.
- Храните вырезы из ленты при комнатной температуре для длительного хранения. Для кратковременного хранения храните их при температуре -20 °C и убирайте только незадолго до шага 1.3. для более удобного обращения.
- Просверлите два отверстия диаметром около 1 мм в середине одного стандартного предметного стекла микроскопа (76 мм x 26 мм x 1 мм) с расстоянием между двумя отверстиями около 3,5 см.
- Очистка и плазменная активация предметных стекол
- Очистите одно предметное стекло с отверстиями и одно без отверстий с помощью мыла. Хорошо промойте дистиллированной водой и высушите безворсовыми прецизионными салфетками.
- Поместите предметные стекла в плазменный очиститель и обработайте верхние поверхности плазмой при мощности 55 Вт в течение 10 минут. Снимите предметные стекла и перейдите к шагу 1.3.
- Камерный монтаж
- Поместите предметное стекло с отверстиями на чистую поверхность стороной, активированной плазмой, вверх, не касаясь активированной поверхности.
- Снимите защитный слой с одной стороны двустороннего скотча, в том же направлении разреза. Не прикасаясь, совместите вырез ленты с краями предметного стекла и просверленными отверстиями, и медленно положите ленту в соприкосновение со стеклосборником, начиная с короткого края.
ПРИМЕЧАНИЕ: Следите за тем, чтобы лента не растягивалась или не складывалась, так как это приведет к неправильной высоте камеры. Поскольку этот шаг подвержен ошибкам и требует некоторого практического опыта, желательно подготовить несколько стеклянных стекол параллельно. - Снимите второй защитный слой с ленты, снова по направлению резки, и поместите второе стекло без отверстий активированной поверхностью вниз. Прижмите всю поверхность двух предметных стекол друг к другу, положив сверху плоскую доску и надавливая на нее с усилием верхней части тела в течение примерно 10 секунд.
- Собрав два предметных стекла, переверните камеру так, чтобы два отверстия были обращены к вам. Приклейте нанопорты к двум отверстиям, нанеся небольшое количество УФ-отверждаемого клея в кольцо под портом и поместив порт поверх отверстия в предметном стекле. Добавьте вокруг порта кольцо из УФ-отверждаемого клея и отверждите клей с помощью УФ-лампы. Теперь камера должна выглядеть так, как показано на рисунке 2E. Сразу переходим к шагу 1.4.
ПРИМЕЧАНИЕ: УФ-излучение может повредить глаза и кожу. Носите соответствующие средства защиты.
- Флюорофильное покрытие поверхности камеры
ПРИМЕЧАНИЕ: Этот этап должен быть выполнен в течение 1 часа после плазменной обработки предметных стекол (шаг 1.2.2) для обеспечения хорошей эффективности покрытия.- Свежеприготовьте 1 мл 1% раствора фторсилана (1H,1H,2H,2H-перфтордецилтрихлорсилан) в фторированном масле (HFE-7500) и залейте его в шприц. Протолкните раствор покрытия через шприцевой фильтр из ПТФЭ и иглу 27G x 0,75 дюйма, соединенную с микротрубкой из ПТФЭ размером 0,3 мм x 0,76 мм, в камеру наблюдения.
- После 1 мин инкубации промойте раствор покрытия из камеры под давлением азота под вытяжным шкафом. Промойте камеру фторированным маслом (только HFE-7500) с помощью другого шприца в сборе.
- Хранить камеру, заполненную фторированным маслом, с закрытыми входными отверстиями при комнатной температуре (RT). После каждого эксперимента промойте клетки и капли напрямую, чтобы обеспечить хорошую сохранность покрытия.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, а камеры могут храниться и повторно использоваться в течение нескольких месяцев.
- Держатель камеры с магнитами
- Для выравнивания магнитных наночастиц подайте статическое магнитное поле на камеру наблюдения во время инкапсуляции капель и визуализации. Для этого поместите камеру в специальный держатель для микроскопии, напечатанный на 3D-принтере (см. Рисунок 2D и файл, найденный в Bounab et al.17 Supplementary Data 4), который удерживает два неодимовых магнита вдоль длинных сторон камеры.
2. Функционализация наночастиц
Примечание: Процесс функционализации наночастиц аналогичен для каждого цитокина, единственное отличие заключается в добавлении цитокин-специфических антител захвата. Функционализация каждого цитокина выполняется в разных, отдельных реакционных пробирках параллельно. До появления этого протокола антитело захвата TNFα и антитело обнаружения IL-1β мечили биотином и Alexa Fluor 647 соответственно. Конъюгацию проводили в соответствии с протоколом производителя, размещенным на веб-сайте производителя (см. ссылки в Таблице материалов), а антитела аликвотировали и хранили при температуре -20 °C.
- Добавьте 50 мкл функционализированных стрептавидином наночастиц (диаметр (Ø) 300 нм) в пробирку, предназначенную для детектирования TNFα, 50 мкл для ИЛ-1β и 100 мкл для ИЛ-6. Разбавьте раствор наночастиц 1:1 (v/v) в фосфатно-солевом буфере (PBS).
- Добавьте в каждую пробирку 1/20 (v/v) соответствующего объема биотинилированных антител захвата (исходные концентрации 0,5 мг/мл) и инкубируйте в течение 30 мин при ЛТ.
ПРИМЕЧАНИЕ: При добавлении небольших объемов в раствор наночастиц поместите объем в верхнюю часть пробирки и промойте его несколько раз вместе с основной массой раствора. Это обеспечивает правильное перемешивание и предотвращает образование агрегатов. - Добавьте в пробирку 1/100 (v/v) 1 мМ раствора D-биотина и инкубируйте в течение 5 мин при RT. В результате конечная концентрация биотина составляет 10 мкМ.
ПРИМЕЧАНИЕ: Избыток биотина блокирует свободные стороны связывания наночастиц и снижает образование нежелательных агрегатов. - Соберите частицы, поднеся неодимовый магнит близко к трубке. Подождите, пока надосадочная жидкость станет прозрачной, и выбросьте надосадочную жидкость.
ПРИМЕЧАНИЕ: Магниты, используемые во всем анализе, проявляют очень сильную притягивающую силу, которая может нанести физический вред, если два магнита случайно защелкнутся. - Чтобы уменьшить неспецифическую адсорбцию на поверхности наночастиц, немедленно ресуспендируйте наночастицы в 0,5 раза больше конечного объема стадии 2,1 Pluronic F-127 (10%) и в 0,5 раза больше объема PBS. Инкубируйте раствор в течение 30 минут при RT.
- Соберите частицы с помощью магнита, выбросьте надосадочную жидкость и ресуспендируйте в объеме, в 1 раз превышающем объем буфера хранения (RPMI 1640, 5% нокаут-заменитель сыворотки, 1% Pen/Strep, 1% рекомбинантный альбумин сыворотки крови человека (HSA), 25 мМ HEPES, 0,1% плуроновый F-127). Инкубируйте раствор в течение 30 минут при RT.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, и теперь частицы могут храниться до 1 недели при температуре 4 °C. - Непосредственно перед инкапсуляцией ресуспендируйте частицы с помощью пипетирования и смешайте сопряженные наночастицы в соотношении 2:1:1 (v/v) для IL-6:TNFα:IL-1β соответственно.
Примечание: Различные соотношения функционализированных наночастиц зависят от используемой пары антител для каждого цитокина и были определены экспериментально с помощью калибровочных образцов для получения оптимального динамического диапазона. - Промыть с помощью готового материала (RPMI 1640, 10% FBS, 1% Pen/Strep, 25 мМ HEPES) путем сбора частиц с помощью магнита, удаления надосадочной жидкости и повторного вспендривания. Повторите этот шаг, но повторно приостановите только в 0,5 раза больше объема всего носителя из шага 2.7.
- Добавьте в раствор по-разному меченые антитела для обнаружения IL-6, TNFα и IL-1β до конечной концентрации 10 нМ каждое. Теперь решение готово к использованию в экспериментах с каплями.
3. Подготовка клеток
ПРИМЕЧАНИЕ: PBMC были выделены из охристого пальто, полученного из банка крови Цюриха. Клетки замораживали и хранили в криовиалах (1 x 10,7 клеток/флакон) в жидком азоте в течение нескольких месяцев.
- Размораживание клеток
- За 1 ч до начала эксперимента оставьте готовую среду и буфер MACS (2 мМ ЭДТА, 0,5% БСА в DPBS, стерильно отфильтрованный) для нагрева на RT. Подготовьте пробирку, содержащую клетки, добавив 9 мл полной среды в пробирку объемом 15 мл и подержав ее на водяной бане при температуре 37 °C.
- Извлеките криовиальный аппарат PBMC (содержащий ~1 x 107 клеток) из хранилища в жидком азоте. Взболтайте криотрубку на водяной бане при температуре 37 °C, пока не останется лишь небольшое количество льда.
- Протрите трубку 70% EtOH и перенесите ее в шкаф с ламинарным потоком. Добавьте 1 мл предварительно подогретой полной среды в криовиальную среду, аккуратно перемешайте и перенесите все клетки в пробирку с теплой полной средой. Криовиальную камеру можно промыть 1 мл теплой сплошной среды для восстановления максимального количества клеток.
- Вращайте клетки при давлении 500 x g в течение 5 минут при RT, выбросьте надосадочную жидкость и аккуратно ресуспендируйте с помощью пипетки клеточную гранулу с 1 мл готовой среды. Добавьте 9 мл готового материала.
- Вращайте клетки при 500 x g в течение 5 минут в режиме RT. Выбросьте надосадочную жидкость и повторно суспендируйте ее в 1 мл готовой среды.
- Подсчитайте ячейки с помощью доступного счетчика ячеек. В данном случае был использован автоматизированный счетчик ячеек. Клетки подсчитывали путем смешивания 10 мкл клеточной суспензии с 10 мкл трипанового синего и переноса 10 мкл смеси на предметное стекло для подсчета клеток.
- Окрашивание и блокировка FcR
- Рассчитайте общее количество клеток и объем, необходимый для ресуспендирования клеток в соотношении 2 x 106 живых клеток/мл. Приготовьте раствор для окрашивания клеток (CellTrace Violet), разбавив исходный материал (5 мМ) в 1000 раз в PBS (рабочая концентрация 5 мкМ).
- Вращайте клетки при 500 x g в течение 5 мин при RT. Выбросьте надосадочную жидкость и повторно суспендируйте клетки в рассчитанном объеме раствора для окрашивания клеток, приготовленного на шаге 3.2.1. Инкубируйте клетки при температуре 37 °C в течение 5 минут.
- В конце инкубации охладите оставшийся в растворе краситель путем добавления полной среды (не менее чем в 2 раза больше объема раствора красителя). Вращайте ячейки при 500 x g в течение 5 минут при RT.
- Выбросьте надосадочную жидкость, ресуспендируйте клеточную гранулу в 60 мкл буфера MACS и добавьте 20 мкл человеческого блока FcR на 1 x 107 клеток. Инкубируйте клетки в течение 10 мин при РТ.
- Заполните пробирку до 10 мл буфером MACS и вращайте ячейки при 500 x g в течение 5 минут при RT.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 1 мл полной среды Подсчитайте клетки, как описано в шаге 3.1.6.
- Стимуляция клеток с помощью ЛПС
- Используя подсчет клеток, разбавьте клетки со скоростью 1 x 106 клеток/мл и перенесите по 2 мл клеток в каждую лунку в 6-луночном планшете со сверхнизким связыванием.
- Разбавьте ЛПС в готовой среде и добавьте его в лунку, содержащую клетки, до конечной концентрации ЛПС 1 мкг/мл. Инкубируйте клетки в течение 6 ч при 37 °C.
- Подготовка к инкапсуляции
- По окончании времени стимуляции перенесите клеточную суспензию в новую пробирку объемом 15 мл.
- Добавьте в пустую лунку 1 мл готового материала. С помощью скребка для ячеек отделите оставшиеся ячейки. Переложите клетки в новую пробирку объемом 15 мл. Промойте лунку 1 мл готового средства и переложите в другую пробирку объемом 15 мл.
- Поверните две пробирки при давлении 500 x g в течение 5 минут при RT и перенесите 1 мл неразбавленного раствора надосадочной жидкости (из первой пробирки, содержащей немытые клетки) в новую пробирку для дальнейшего анализа, если это необходимо (например, ИФА).
- Откажитесь от остальной надосадочной жидкости.
- Повторно суспендируйте гранулы в 0,5 мл готовой среды, объедините ячейки из одной лунки и перенесите их в центрифужную пробирку. Подсчитайте ячейки, как описано в шаге 3.1.6.
- Вращайте клетки при 500 x g в течение 5 минут при RT и отбросьте большую часть надосадочной жидкости (оставив примерно 100 μL). Не возвращая гранулу на суспендию, очень осторожно добавьте 200 мкл готовой среды.
- Выбросьте надосадочную жидкость. Ресуспендируйте клетки в полной среде в концентрации от 6,6 до 13,3 x 106 клеток/мл для достижения среднего числа клеток на каплю λ = 0,2-0,4 для инкапсуляции, как определено на шаге 8.6.
ПРИМЕЧАНИЕ: Шаги 3.4.6 и 3.4.7 следует выполнять непосредственно перед инкапсуляцией во избежание секреции цитокинов в надосадочную жидкость. Количество клеток в капле соответствует распределению Пуассона: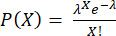 , где P показывает долю капель, содержащих X клеток, а λ — среднее количество клеток в капле.
, где P показывает долю капель, содержащих X клеток, а λ — среднее количество клеток в капле.
4. Инкапсуляция и производство капель
Примечание: Инкапсуляция клеток в капли обеспечивается микрофлюидным чипом-генератором капель, изготовление которого подробно описано в другом месте17. Альтернативы коммерчески доступны (см. пример в Таблице материалов). Подходящая конструкция чипа каплегенератора имеет два входных отверстия для водных фаз, одно входное отверстие для масляной фазы и одно выходное отверстие для генерируемых капель. Кроме того, подходящая коммерческая микросхема генератора капель должна позволять производить воду в виде фторированных капель масла объемом 40-60 пл. В соответствии с описанным здесь протоколом получаются водно-масляные эмульсии (капли) диаметром 50 мкм. Использование различных вариантов изменения протокола может привести к увеличению или уменьшению количества капель.
- Подготовка шприцевого насоса (Рисунок 2А)
- Наполните шприц объемом 1 мл 500 мкл непрерывной фазы, состоящей из 2% 008-фторповерхностно-активного вещества в фторированном масле HFE-7500. Подсоедините иглу 27G x 0,75 дюйма к микротрубке из ПТФЭ размером 0,30 мм x 0,76 мм и установите узел на шприц, а затем на шприцевой насос.
ПРИМЕЧАНИЕ: Убедитесь, что в шприце или канюле не остается воздуха, так как это препятствует постоянной скорости потока. - Подготовьте два изготовленных по индивидуальному заказу соединителя наконечника пипетки для водных фаз (Рисунок 2B): Проделайте отверстие с помощью биопсийного перфоратора Ø0,75 мм в середине выреза PDMS высотой ~5 мм с Ø6 мм. Протяните ~3 см трубки из ПТФЭ (внутренний диаметр 0,56 мм, внешний диаметр 1,07 мм) через отверстие в вырезе PDMS и вставьте узел в верхнюю часть наконечника для дозатора объемом 200 μл. Подсоедините другую сторону трубки к игле 23Gx 1,25 дюйма. Загерметизируйте соединитель, нанеся на пипетку УФ-отверждаемый клей, и отверждите его под действием ультрафиолетового излучения.
ПРИМЕЧАНИЕ: Поскольку ультрафиолетовое излучение вредно для глаз, носите защитные очки, блокирующие ультрафиолетовое излучение. - Наполните два шприца объемом 1 мл 500 мкл легкого минерального масла, прикрепите две иглы 23G с помощью специальных насадок и установите обе иглы на шприцевой насос.
- Отсадите 30 μл наночастиц и 30 μл клеточного раствора в наконечники пипеток водных фаз с помощью программного обеспечения для управления шприцевым насосом.
- Подготовьте камеру наблюдения, очистив поверхность водой, чтобы удалить грязь и пыль, и высушите ее точными салфетками. Зажмите камеру в печатном держателе камеры, оснащенном двумя неодимовыми магнитами.
ПРИМЕЧАНИЕ: Убедитесь, что магниты направлены в правильном направлении (притягиваясь друг к другу), образуя вытянутый агрегат. - Слегка наклоните камеру (30°). Откройте оба порта и вставьте бумажное полотенце в верхний порт, чтобы впитать излишки внешней фазы во время наполнения.
- Наполните шприц объемом 1 мл 500 мкл непрерывной фазы, состоящей из 2% 008-фторповерхностно-активного вещества в фторированном масле HFE-7500. Подсоедините иглу 27G x 0,75 дюйма к микротрубке из ПТФЭ размером 0,30 мм x 0,76 мм и установите узел на шприц, а затем на шприцевой насос.
- Производство капель и заполнение камер
- Подсоедините непрерывную фазу с помощью трубки к верхнему входу микрофлюидного чипа (рис. 2A, C, F). Промывайте микросхему в течение примерно 30 с непрерывной фазой, используя расход 1800 μл/ч.
- Подсоедините наконечники пипеток водных растворов к двум средним входным отверстиям (рис. 2A, C, F).
- Начните подачу водного раствора с 200 мкл/ч каждый и дайте каналам и выходному отверстию заполнить жидкостью. При использовании магнитных наночастиц из выходного отверстия чипа должен вытекать однородный раствор коричнево-красного цвета.
- Как только жидкость появится на выходе, запустите поток фторированной масляной фазы со скоростью 800 μл/ч и подождите, пока не установится стабильное образование капель, подтвержденное оттоком однородного, серого, блестящего раствора на выходе.
- После того как будет установлено стабильное производство капель, соберите образовавшиеся капли, подключив микротрубку из ПТФЭ (внутренний диаметр 0,3 мм x внешний диаметр 0,76 мм) к выходному отверстию, и направьте их в камеру наблюдения, пропустив микротрубку через модуль наконечника цельного фитинга, плотно прилегающего к пальцам (рис. 2A).
- Если происходит правильное образование капель, однородная, блестящая жидкость должна заполнить камеру с прямым фронтом снизу вверх.
- Как только камера будет заполнена, остановите поток и закройте порты заглушками, используя плотное давление пальцами.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не закрывать камеру слишком плотно. Захват или приток воздуха может привести к перемещению капель и, таким образом, к нарушению отслеживания во время измерения. - После образования капель промойте чип фторированным маслом и продуйте все напоминания о жидкости азотом, чтобы сохранить ее функцию. Чипы можно использовать многократно и хранить в течение нескольких месяцев, если они не засорятся.
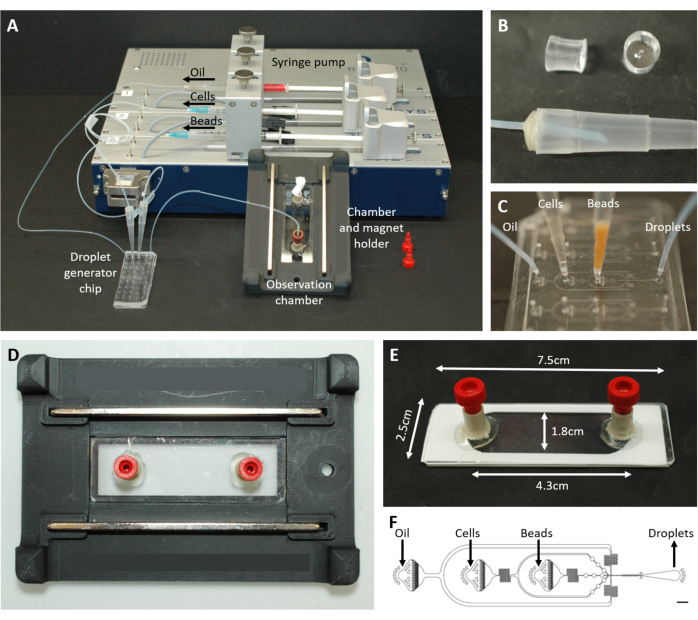
Рисунок 2: Обзор микрофлюидной установки. (A) Установка для инкапсуляции капель с помощью шприцевого насоса, чипа для генерации капель, а также камеры наблюдения и держателя микроскопа. (B) Изображение перфорированного штекера PDMS (вверху) для формирования разъема к наконечнику пипетки объемом 200 мкл (внизу), как описано в пункте протокола 4.1.2. (C) Изображения соединения трубок и наконечников пипеток с чипом для генерации капель. (D) Изображение камеры, помещенной внутрь изготовленного на заказ 3D-печатного держателя микроскопа с двумя магнитами сверху и снизу. (E) Фотография наблюдательной камеры (с белой лентой для иллюстрации). (F) Схема микрофлюидного чипа для создания капель (масштабная линейка: 750 мкм). Эта цифра была изменена с17. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Получение и измерение изображений
ПРИМЕЧАНИЕ: Получение изображений осуществляется на стандартном инвертированном эпифлуоресцентном микроскопе, заключенном в инкубатор, что позволяет проводить измерения при температуре 37 °C. Описанные здесь настройки специфичны для микроскопа Nikon Eclipse Ti2, работающего с программным обеспечением NIS Elements (V. 5.30.04), оснащенного камерой Orca Fusion, но в целом адаптируются к любым другим флуоресцентным микроскопам и камерам.
- Настройка параметров измерения
- Чтобы задать размер изображения, выберите размер массива 10 x 10 изображений. Этот массив будет содержать примерно 50 000-70 000 капель. Используйте перекрытие 1% и активируйте наложение для сшивания изображений.
- Чтобы задать количество измеряемых каналов, выберите канал DAPI для обнаружения клеток, каналы FITC, TRITC, Cy5 для обнаружения цитокинов (гранулы) и канал BF для обнаружения капель. Используйте биннинг пикселей 2 x 2 и 16-битный для битовой глубины. Настройте параметры камеры таким образом, чтобы достичь значений интенсивности пикселей в каплях, которые не достигают максимума камеры для каждого флуоресцентного канала.
ПРИМЕЧАНИЕ: Точное время воздействия и интенсивность лампы для каждого канала зависят от используемой модели и реагентов и устанавливаются перед построением калибровочных кривых (шаг 7). Использование одних и тех же настроек сбора данных при калибровке и измерениях ячеек важно для точной количественной оценки. - Чтобы настроить измерение с временным разрешением, выберите измерение каждые 30 минут для 9 измерений.
ПРИМЕЧАНИЕ: Параметры измерений могут отличаться для используемых клеток, стимуляторов, реагентов, измеряемых цитокинов, температуры инкубации и моделей микроскопа.
- Начало измерения
- Установите держатель камеры на микроскоп с помощью предметного столика формата «лунка-пластина» (рис. 2D) и переключитесь на светлопольный канал (BF) с помощью объектива 10x.
- Сосредоточьтесь на обездвиженных каплях в BF и убедитесь, что узел установлен в идеальной плоскости, панорамируя и при необходимости регулируя. Переместитесь в середину камеры для выполнения последующих шагов.
- Активируйте автоматизированную систему фокусировки (PFS) и установите ее в оптимальную плоскость измерения на канале BF так, чтобы края капель выглядели как черные, резкие круги, которые можно легко отличить от масляной фазы и фона.
ПРИМЕЧАНИЕ: Измерения также возможны без автоматической системы фокусировки, но если микроскоп оснащен ею, мы настоятельно рекомендуем использовать ее. Это повышает качество измерения больших и сильно сшитых изображений. - Пройдитесь по всем флуоресцентным каналам и установите оптимальную плоскость измерения для каждого. Для измерений перемещения по каналам FITC, TRITC и Cy5 убедитесь, что агрегат наночастиц находится в идеальном фокусе, для канала DAPI убедитесь, что ячейки находятся в фокусе.
ПРИМЕЧАНИЕ: Оптимальные фокальные плоскости и z-значения могут отличаться для всех измеряемых каналов. Обязательно сохраните отдельные смещения PFS для каждого канала. - Прежде чем начать измерение, пройдитесь по всем каналам, чтобы перепроверить отдельные очаги, и подождите 5 минут, чтобы уравновеситься, так как движение может произойти изначально, пока растворы нагреваются.
- Начните измерение. После создания первого изображения проверьте наличие каких-либо неровностей (фокус, движущиеся капли, неправильные каналы и т. д.). При необходимости перезапустите сбор данных или, в случае подачи воздуха, заправьте камеру (начните с шага 4.1.4). Оставьте сборку для получения изображения капель в течение 4 часов.
6. Анализ изображений
- Установите программное обеспечение для анализа изображений (DropMap Analyzer App v 4.023) в MatLab (https://github.com/ESPCI-LCMD/MiMB) и перенесите сгенерированный файл .nd2 из эксперимента на компьютер для анализа.
- Откройте приложение. Выберите указанные настройки, в противном случае оставьте значение по умолчанию: выбран CH1: DAPI, WD (целая капля); CH2: выбран FITC, BL (бисерная линия); CH3: выбраны TRITC, BL; CH4: выбраны Cy5, BL; Максимальный диаметр капли (мкм): 70; Обнаружение падения: Полное; Отслеживание: Да. Нажмите кнопку « Пуск » (значок фрукта), чтобы выбрать местоположение файла .nd2 и начать анализ.
- Через несколько минут программа покажет пример участка изображения (рисунок 3A). Нажимайте пробел , пока не найдете подходящую для обнаружения капель, затем нажмите Enter. На том же участке изображения нарисуйте прямоугольник в репрезентативной области для поиска пороговых параметров для обнаружения капель.
- Через несколько минут откроется еще одно окно, показывающее распределение интенсивности канала DAPI. Перетащите ползунок, чтобы обнаружить только сигнал от окрашенных ячеек, и нажмите «Готово » в правом верхнем углу.
- После сегментации изображения на отдельные капли с диаметром меньше максимального диаметра капли (мкм) программа теперь выполнит следующие шаги для каждой капли, временной точки и флуоресцентного канала без дополнительного вмешательства пользователя (см. рис. 3).
- Программное обеспечение подсчитывает перемещенные пиксели капли между временными точками (капли, перемещающиеся более чем на 40 пикселей, исключаются автоматически).
- Программное обеспечение измеряет среднее значение флуоресценции всей капли, обнаруживая и измеряя среднюю интенсивность гранул, находя самый яркий пиксель на горизонтальной линии и усредняя все интенсивности пикселей на вертикальной линии сверху вниз от капли. Это делается автоматически и используется для расчета средних значений перемещения бисерной линии (Рисунок 3B) в соответствии с уравнением:
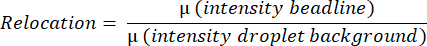
- Программное обеспечение вычисляет процент общего количества пикселей в области капель выше порога, установленного на канале DAPI.
- Полученный файл .xslx будет содержать следующие столбцы, представляющие интерес для дальнейшего анализа: DropIdX (идентификатор капли, отслеживаемой с течением времени), TrueCentroid_ t*2-1 и t+2 (координаты x и y, соответственно, центра капли для временной точки t), DiameterMicrons (диаметр капли в μм), TrackingMove (количество пикселей, перемещенных за все время измерения), FluoChannel_BL_Ratio_t (значение перемещения для FluoChannel в момент времени t), DAPI_WD_PosPxlCount_t (количество пикселей выше порогового значения во всей дропле в канале DAPI в момент времени t).
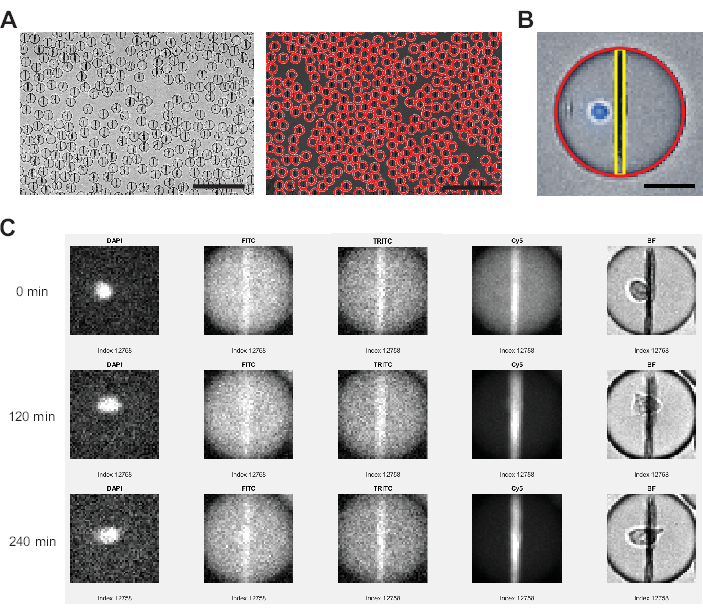
Рисунок 3: Анализ изображений, выполненный программным обеспечением для анализа изображений. (A) Капли обнаруживаются в светлопольном канале (BF) с помощью преобразования Хафа, помечая каждую каплю красным кружком. Масштабные линейки: 200 мкм. (B) В каждой капле гранула наночастиц идентифицируется с помощью самых ярких пикселей в горизонтальной плоскости и интенсивности флуоресценции, усредненной для всех пикселей, охватывающих сверху вниз капли. Кроме того, клетка идентифицируется по проценту пикселей >0 выше порогового значения для всей площади капли. Масштабная линейка: 20 мкм. (C) Программное обеспечение анализатора сравнивает интенсивность флуоресценции наночастиц с фоном капель для каналов FITC, TRITC и Cy5 во всех измеренных временных точках для каждой отдельной капли. Показаны временные точки 0, 4 (120 мин) и 9 (240 мин). Для ручной проверки правильности обнаружения капель и клеток также отображаются каналы DAPI и BF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Калибровка
ПРИМЕЧАНИЕ: Для количественного считывания калибровка концентраций цитокинов по значениям флуоресценции должна быть выполнена один раз, так как могут возникать различия между различными экспериментальными установками. Все необходимые шаги подробно описаны в предыдущих разделах протокола.
- Подготовьте наночастицы, как описано в шаге 2.
- Восстановите человеческие рекомбинантные белки IL-6, TNFα и IL-1β в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Убедитесь, что замороженные аликвоты разморажены только один раз и используются незамедлительно. - Приготовьте серию 2-кратного разведения для всех трех белков вместе с использованием полной среды (10% FBS, 1% Pen/Strep, 25 мМ HEPES) с начальной концентрацией 80 нМ до 0,625 нМ.
- Выполните инкапсуляцию, как описано на шаге 4, с функционализированными наночастицами в первой фазе и RPMI только во второй водной фазе. Это измерение служит заготовкой, а измеренное стандартное отклонение используется для последующего анализа данных.
- Подождите 5 минут и сфотографируйте капли, как описано в шаге 5. Сделайте 3 изображения с размером матрицы 2 x 2 в соответствующих флуоресцентных каналах.
- Повторите шаги 7.4 и 7.5 со всеми приготовленными калибровочными растворами, начиная с самой низкой и заканчивая самой высокой концентрацией.
- Проанализируйте изображения, как описано в шаге 6. Не используйте параметр WD для канала DAPI и установите для параметра Отслеживание значение Нет.
- В результате анализа выводятся значения смещения флуоресценции для каждой измеренной капли на одном изображении. Извлеките медиану и стандартное отклонение для каждого флуоресцентного канала. Усреднить медиану и стандартное отклонение для каждого измеренного изображения для каждой концентрации.
- Постройте калибровочную кривую, построив график усредненного медианного перемещения относительно измеренных концентраций каждого рекомбинантного белка.
- Аппроксимируйте кривые с помощью однофазной ассоциации:
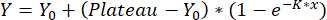 ,
,
где Y = перемещение в точке x, Y0 = перемещение заготовки измерения и x используемая концентрация. Полученная калибровочная кривая используется для количественной оценки значений перемещения, как описано в шаге 8.
ПРИМЕЧАНИЕ: Подгоняйте значения только до наибольшего измеренного перемещения и исключите значения более высоких концентраций при меньшем измеренном перемещении. Ожидается снижение измеренных значений перемещения при более высоких концентрациях, что обусловлено эффектом Хука и ограниченной связывающей способностью наночастиц.
8. Анализ данных
- Исключите капли со значением TrackingMove выше 10, т. е. которые переместились более чем на 10 пикселей в течение времени измерения.
- Определите капли, содержащие окрашенные клетки (канал DAPI) в первой временной точке, отсортировав капли со значениями, превышающими 0, в столбце DAPI_WD_PosPxlPercent_1.
- Определите капли, содержащие секретирующие клетки, применив следующие 3 критерия к флуоресцентному перемещению каждого флуоресцентного канала (FluoChannel_BL_Ratio_t колонок).
- Идентификация капель с возрастающими значениями перемещения путем сортировки по положительному наклону во время измерения.
- Идентификация капель со значениями перемещения, достигающими предела обнаружения (LOD). Капля выбирается, когда максимальное перемещение флуоресценции за время измерения превышает LOD, рассчитанный как описано в другом месте25:
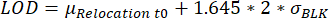 , где μ Перемещение t0 – медиана всех значений перемещения в момент времени 0, аσ BLK – стандартное отклонение бланка, измеренного во время калибровки, каждое из которых является цитокиново-специфичным.
, где μ Перемещение t0 – медиана всех значений перемещения в момент времени 0, аσ BLK – стандартное отклонение бланка, измеренного во время калибровки, каждое из которых является цитокиново-специфичным. - Проверка значимости увеличения значения перемещения путем проверки того, что изменение между максимальным и минимальным измеренным перемещением флуоресценции за время измерения превосходит:
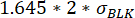 .
.
- Определите косекретирующие клетки, удовлетворяя критериям, описанным в шаге 8.3. для более чем одного флуоресцентного канала одновременно.
- Повторите шаг 8.3. для всех капель, не содержащих ячеек (DAPI_WD_PosPxlPercent_1 = 0). Используйте эти дропы для вычисления процента ложноположительных результатов.
- Определите точное значение λ измерения, случайным образом выбрав 200–500 капель и проверив их с помощью функции проверки и сортировки программного обеспечения для анализа изображений. Посчитайте количество клеток в этих каплях и вычислите:
λ = количество подсчитанных клеток / количество анализируемых капель - Рассчитайте общее количество инкапсулированных ячеек для измерения следующим образом:
Общее количество клеток = λ × количество анализируемых капель - Рассчитайте процент секретируемых клеток, используя определенное количество клеток. Кроме того, рассчитайте процент ложноположительных результатов для каждого цитокина (обычно менее 3%-5% по отношению к числу реальных положительных результатов на канал) и используйте их в качестве внутреннего контроля для согласованности и воспроизводимости эксперимента.
- Чтобы рассчитать концентрации секретируемых цитокинов, преобразуйте значения перемещения в концентрацию с помощью калибровочных уравнений, полученных на шаге 7.10.
- Рассчитайте скорость секреции (SR) между временными точками с помощью следующего уравнения.
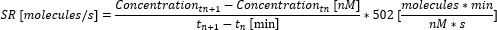
- Рассчитайте среднюю скорость секреции по результатам измерения, усреднив отдельные скорости секреции между временными точками. Если максимальное измеряемое перемещение было достигнуто до окончания измерения, установите концентрацию на максимальную измеряемую концентрацию (это значение является специфичным для цитокинов и соответствует максимальной концентрации, измеренной и использованной в калибровочной кривой на шаге 6.10) и не рассчитывайте дальнейшую концентрацию. Рассчитайте скорость секреции и усредните ее только до этого момента времени.
Примечание: Если в одном флуоресцентном канале обнаружено менее 50 секретирующих клеток, капли должны быть исследованы визуально с помощью функции проверки и сортировки, а капли, содержащие флуоресценцию или агрегаты наночастиц, могут быть исключены из анализа. - Чтобы извлечь дополнительные параметры из кривой секреции каждой отдельной клетки, выполните подгонку по методу наименьших квадратов к кривой «время-концентрация» для каждой клетки и цитокина с помощью пользовательского скрипта Python (предоставляется по запросу). Аппроксимированная функция представляет собой сигмоидальную кривую по формуле, описанной ниже (аппроксимации с R2<0,95 исключаются из следующих шагов):
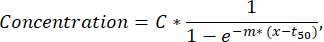
где C соответствует плато концентрации [nM], t50 — сдвигу полумаксимума [s], а m — склону холма [min-1]. Из этих параметров извлекаются следующие дескрипторы кривой, как описано ниже.- Cmax [нМ]: Максимальная измеренная концентрация.
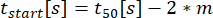 : Время начала секреции, когда посадка достигает 10% от С.
: Время начала секреции, когда посадка достигает 10% от С.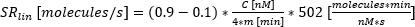 : скорость секреции как приближенный линейный наклон кривой между 10% и 90% кривой времени-концентрации.
: скорость секреции как приближенный линейный наклон кривой между 10% и 90% кривой времени-концентрации.
Representative Results
Представленная функциональная одноклеточная платформа позволила измерять несколько параметров. Во-первых, как и в случае со стандартными методами, частота секретирующих клеток отображается в конце измерения (рис. 4А). После стимуляции 1 мкг/мл липополисахарида (ЛПС) в течение 6 ч мононуклеарных клеток периферической крови (PBMC) 5,81% клеток секретировали IL-6 (n= 1270), 4,55% TNFα (n= 995) и 6,06% IL-1β (n= 1326).
Для количественной оценки секреции цитокинов были построены калибровочные кривые с известными концентрациями рекомбинантных цитокинов (рис. 4B). Эти калибровочные кривые позволяют количественно оценить концентрации цитокинов в каплях с течением времени. Например, средняя концентрация IL-6 в капле достигла плато через 90 мин для PBMC, стимулированного ЛПС, в то время как средняя концентрация IL-1β в капле увеличивалась быстрее с 90 мин, что свидетельствует о динамическом разрешении платформы и возможности экстракции субпопуляций клеток, секретирующих специфические цитокины (рис. 4C). Поскольку концентрация изменяется между точками измерения, возможен расчет скорости динамической секреции на цитокин. Учитывая среднюю скорость секреции каждого цитокина (рис. 4D), секретирующие клетки IL-6 демонстрировали постоянное снижение средней скорости секреции, в то время как клетки, секретирующие TNFα и IL-1β, показали увеличение скорости секреции через 90 минут измерения и второе снижение через 150 минут.
Кроме того, возможно кластеризация клеток в субпопуляции в зависимости от секретируемых и совместно секретируемых цитокинов (рисунок 4E). При этом IL-6 и TNFα одинарно секретируются 30,2% и 26,4% клеток, секретирующих IL-6 или TNFα соответственно, тогда как клетки с одиночной секрецией IL-1β составляют 68,8% всех клеток, секретирующих IL-1β. Кроме того, можно устранить влияние совместной секреции на концентрации и скорость секреции (рис. 4F). При рассмотрении клеток, секретирующих IL-6, было обнаружено различное количество IL-6, если клетки дополнительно продуцировали TNFα или IL-1β. Аналогичным образом, распределение усредненных скоростей секреции по результатам измерения статистически различалось между клетками, секретирующими только IL-6 или IL-6, наряду с TNFα (более высокие скорости секреции) и IL-1β (более низкие скорости секреции IL-6).
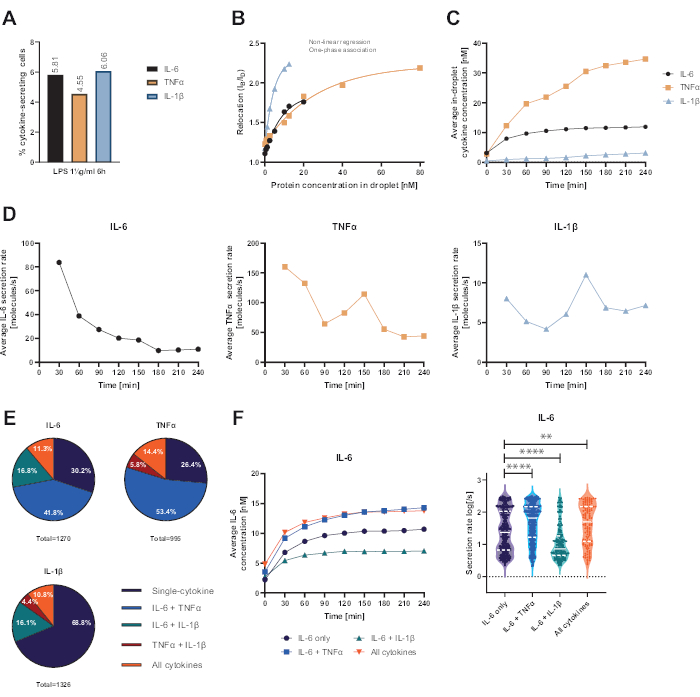
Рисунок 4: Репрезентативные результаты секреции IL-6, TNFα и IL-1β PBMC после стимуляции 1 мкг/мл ЛПС. (A) Процент секретирующих PBMC IL-6, TNFα и IL-1β в конце 4-часового измерения. (B) Мультиплексные калибровочные кривые цитокинов генерируются с известными концентрациями рекомбинантных цитокинов. Это позволяет количественно оценить клеточные эксперименты путем вычисления на основе значения перемещения концентрации цитокинов в капле. Точки подгоняли с помощью нелинейной однофазной кривой ассоциации, r2=0,9926 (IL-6), 0,9901 (TNFα), 0,9990 (IL-1β). (C) Средние секретируемые концентрации IL-6, TNFα и IL-1β, высвобождаемые при секреции PBMC в течение 4 часов измерения. (D) Средняя скорость секреции IL-6, TNFα и IL-1β за 4 часа измерения. (E) Относительный процент ко-секретирующих клеток, секретирующих IL-6, TNFα или IL-1β и их комбинации. Нормализуется ко всем секретирующим клеткам, обнаруженным для каждого цитокина. (F) Усредненные концентрации IL-6 за время измерения и распределение средней скорости секреции (log) для секретирующих клеток IL-6 с разрешением совместной секреции (n=383 только для IL-6, n=531 для IL-6 + TNFα, n= 213 для IL-6 + IL-1β и n=143 для IL-6+TNFα+IL-1β). Статистические различия в распределениях скорости секреции оценивали с помощью двусторонних, непарных, непараметрических тестов Колмогорова-Смирнова с вероятностью 95%, представлены p-значения. ** (p <0,002) и **** (p <0,0001). Полная линия представляет собой медиану, а пунктирная линия — квартили. nвсего ячеек = 21 866. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Чтобы извлечь дополнительную информацию на уровне отдельных клеток, сигмовидная функция может быть подобрана к точкам концентрации-времени каждой клетки и цитокина (рис. 5). Примерный набор данных о концентрации во времени для одной клетки и соответствующая сигмоидальная аппроксимация изображены на рисунке 5A. Здесь процедура аппроксимации методом наименьших квадратов дает следующие параметры: C, соответствующее значению верхнего плато кривой, t50 , количественно определяющее смещение кривой от нуля по времени, и склон Хилла m, описывающий крутизну восходящей части сигмовидной кривой со значениями концентрации 10% и 90%, достигнутыми на протяжении всего измерения. Из этих параметров аппроксимации можно извлечь некоторые дескрипторы кривой, как описано в шаге 7.12. дающие Cmax — наибольшее значение концентрации по данным, tstart — время начала секреции, определяемое как достижение 10% от значения концентрации на верхнем плато, и SRlin — скорость секреции в течение восходящей части кривой.
Для классификации клеточных субпопуляций дескрипторы кривых, полученные из всех подходящих одиночных клеток, были классифицированы по трем категориям: значенияCmax были сгруппированы на низкие, средние и высокие дляначала t на ранние, средние и поздниелинии SR на медленные, средние и быстрые секреторы. Чтобы проиллюстрировать эту классификацию, показаны четыре примерные кривые секреции одиночных клеток и соответствующие им дескрипторы кривых (рис. 5A-D), где кривая A демонстрирует характеристики раннего низкого секретора со средней скоростью, кривая B является ранним, медленным и высоким секретором, кривая C является ранним быстрым высоким секретором, а кривая D показывает позднюю низкую секрецию. Важно отметить, что пороговые значения для этих критериев специфичны для клеток, цитокинов и параметров анализа и должны быть адаптированы для каждого исследовательского вопроса. Кроме того, здесь рассматривалась только секреция IL-6 PBMC после стимуляции ЛПС в дозе 1 г/мл в течение 6 ч, что означает, что большинство клеток были ранними и высокосекреторными с 80% и 79% соответственно (рис. 5E-F). Что касается скорости секреции, то наблюдался биполярный ответ: 55% секретирующих клеток IL-6 являются медленными секреторами, а 39% — быстрыми секреторами (рис. 5G).
Чтобы лучше охарактеризовать поведение секреции, дескрипторы кривых для каждой клетки были построены относительно друг друга и выделены различные кластеры (рис. 5H-J). Четкой корреляции междуt-началом иCmax нет (рис. 5H): две самые большие популяции были ранними низкосекреторными и высокосекреторными независимо от начала секреции. Рассматривая связь междуt-началом и SRlin (рис. 5I), большинство клеток были ранними медленными секреторами с четкой популяцией ранних высоких секреторов и небольшим количеством медленных/средних и поздних секреторов. Что касается корреляций SRlin и Cmax (рис. 5J), то быстрых низко- и средних секреторов практически не было, а только большая популяция быстрых низких секреторов. Кроме того, существовала большая популяция быстрых секреторов, которая не зависела от максимальной измеренной концентрации, и две популяции высоких секреторов секретировались либо медленно, либо быстро. Подводя итог, можно сделать вывод, что исследование взаимосвязи между дескрипторами кривой для отдельных клеток дает гораздо более детальный анализ и потенциально может извлечь новые биологические данные из измерений секреции отдельных клеток.
С помощью представленного выше анализа мы извлекли динамику секреции ко-секретирующих клеток (рис. 6). Два примера кривых показывают различную динамику совместной секреции IL-6 и TNFα из двух одиночных клеток с одновременным началом обоих цитокинов (рис. 6A) или последовательным началом секреции, при этом IL-6 секретируется первым (рис. 6B). Для классификации всех ко-секретирующих клеток была определена задержка секреции в 60 минут, где все клетки, начинающие секрецию в этом диапазоне, считаются одновременными секреторами, а все клетки с более длительными задержками считаются последовательными секреторами. Этот анализ также позволил проследить, какой цитокин секретируется в первую очередь. Для IL-6 и TNFα в основном одновременная косекреция наблюдалась в 76% клеток (рис. 6C), в то время как для IL-6 и IL-1β последовательная косекреция наблюдалась в 86% клеток, причем IL-6 в большинстве случаев был первым цитокином, секретируемым (рис. 6D).
Рассматривая время начала секреции для различных цитокинов для всех отдельных ко-секретирующих клеток, в проведенных экспериментах не наблюдалось четкой корреляции между временем начала секреции. При совместной секреции IL-6 и TNFα (рис. 6E) наблюдался более крупный вертикальный кластер около 0 минут, соответствующий ко-секретирующим клеткам, более распространенным, начиная с IL-6. При совместной секреции IL-6 и IL-1β (рис. 6F) большинство клеток начали секретировать IL-6 в начале измерения, в то время как IL-1β в основном секретировался позже. Таким образом, представленный здесь анализ позволил идентифицировать различные субпопуляции секреторов и сложную динамику совместной секреции цитокинов.
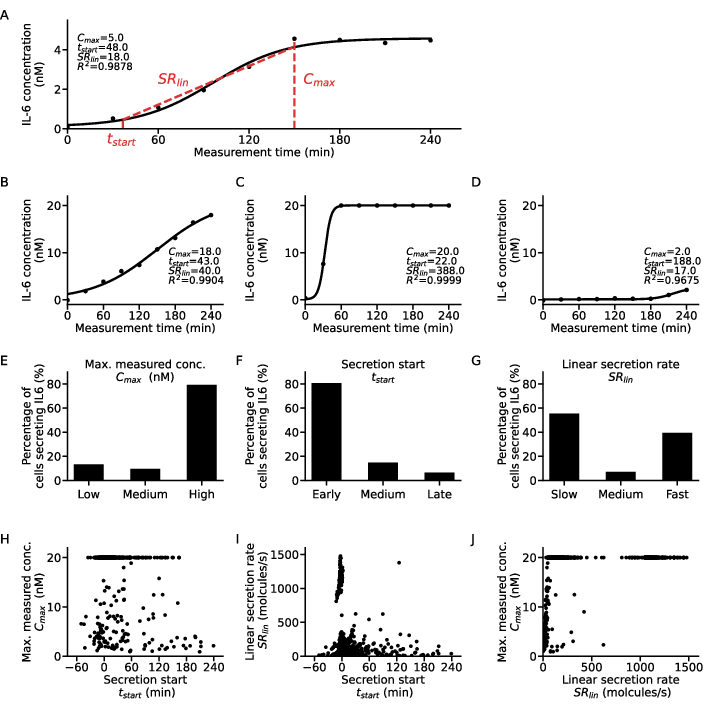
Рисунок 5: Подробный анализ различных динамических паттернов секреции для отдельных кривых секретирующих клеток IL-6. (A) Репрезентативные данные о концентрации цитокинов в одиночных клетках за время измерения с подогнанной сигмовидной кривой и извлеченными параметрами. (Б-Г) Три примерные кривые концентрации цитокинов в одиночных клетках для различных типов секреторов цитокинов обнаружены для секреции IL-6 после стимуляции ЛПС. (Э-Г) Процентное соотношение секретирующих IL-6 клеток, которые классифицируются по различным типам секреторов по следующим критериям (n=633): E. Cmax: низкая <5 нМ, высокая >19,5 нМ,F. t. начало: раннее <30 мин, позднее > 120 мин, G. SRlin: медленный <250 молекул/с, быстрый >750 молекул/с. (H-J) Соотношение между тремя дескрипторами кривой секреции Cmax, tstart и SRlin для каждой отдельной ячейки (n=633). Большая популяция при Cmax = 20 нМ является результатом достижения верхнего предела обнаружения анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
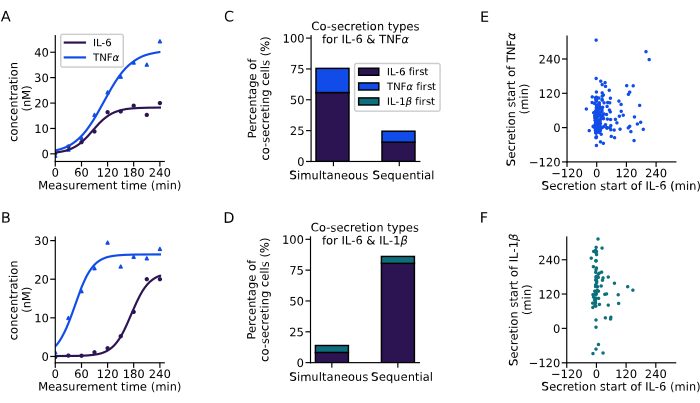
Рисунок 6: Извлечение паттернов ко-секреции из кривых концентрации одиночных клеток. (A-B) Репрезентативные кривые концентраций для одиночных клеток, совместно секретирующих IL-6 и TNFα (A) одновременно и (B) последовательно, соответственно. (К-Д) Процент клеток, проявляющих одновременную и последовательную косекрецию IL-6 и TNFα (n=249) или IL-6 и IL-1β (n=72) соответственно. Последовательная секреция определяется через задержку между началом секреции цитокинов более 60 минут. Цвета указывают на то, какой из цитокинов начал секрецию первым. (Э-Ж) Связь между временем начала секреции для различных цитокинов для каждой секретирующей клетки (nIL6-TNFα=249, nIL6-IL1β=72). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Discussion
Высвобождение и секреция цитокинов часто исследуются в иммунологии и клинической медицине3. Несбалансированная секреция цитокинов может привести к пагубным последствиям для пациентов, страдающих от инфекций, а также при неврологических заболеваниях, воспалениях или раке 26,27,28. Несмотря на то, что их важность для здоровья и болезней хорошо известна, изучение цитокинов и их секретирующих клеток остается сложной задачей, поскольку современные методологии не способны точно обнаруживать и количественно определять цитокины, происходящие из одной клетки, с временным разрешением. Для представленного здесь рабочего процесса был использован установленный протокол стимуляции с помощью PBMC и измерена их секреция IL-6, TNF-α и IL-1β. Выбор использования PBMC вместо отдельных, очищенных субпопуляций обусловлен предыдущей заявкой на исследование синдромов высвобождения цитокинов (CRS)23, состояния, характеризующегося высокой концентрацией провоспалительных цитокинов в плазме крови, включая IL-6, TNF-α и IL-1β29. Поскольку СВЦ обычно связан не только с одной популяцией, мы использовали PBMC, поскольку они будут присутствовать in vivo. Тем не менее, клеточные субпопуляции могут быть очищены и оценены индивидуально, если этого требует научный вопрос. Время инкубации, условия стимуляции и диапазоны динамического анализа были оптимизированы для измерения секреции трех цитокинов, представляющих интерес. Представленный здесь рабочий процесс и данные демонстрируют, как настроить, откалибровать, количественно оценить, измерить и проанализировать секрецию нескольких цитокинов одной клетки с временным разрешением. Этот протокол дает представление о том, как многофункциональный анализ секреции цитокинов может обеспечить большое функциональное и динамическое разнообразие цитокинов, секретируемых у пациентов.
Несколько важнейших аспектов описанного протокола анализа позволяют получить уникальное биологическое считывание. Во-первых, инкапсуляция одной клетки в микрофлюидные капли позволила извлечь данные для каждой отдельной клетки. События инкапсуляции нескольких клеток могут быть обнаружены и отсортированы с помощью анализа изображений, в зависимости от исследовательского вопроса. Во-вторых, включение нескольких независимых флуоресцентных иммунологических анализов и выравнивание функционализированных наночастиц позволило количественно измерить до трех концентраций цитокинов параллельно. Это мультиплексирование позволило проанализировать паттерны совместной секреции цитокинов на уровне отдельных клеток. В-третьих, иммобилизация капель позволила измерить и соотнести секрецию цитокинов для каждой секретирующей клетки, а также позволила отличить коокционную секрецию от последовательной. Временное разрешение однозначно предоставило данные о паттернах секреции и субпопуляциях различных типов секреторов. Наконец, параллельный анализ изображений позволил эффективно извлекать и отслеживать большие объемы данных измерений с более чем 20 000 отдельных ячеек. Извлечение из отдельных кривых секреции в дальнейшем позволило обнаружить фенотипические субпопуляции и функциональные возможности.
Помимо уникального считывания, анализ также имеет технические преимущества по сравнению со стандартным анализом цитокинов. Благодаря небольшому размеру инкапсуляционных компартментов (около 60 пл) абсолютные количества секретируемых цитокинов могут быть обнаружены непосредственно из биологического источника с пределами обнаружения, соответствующими секреции клеток. При миниатюризации анализа также используются меньшие количества дорогостоящих биореагентов. Кроме того, для установки требуется очень мало специализированного оборудования, которое часто уже доступно в биологических и биоинженерных лабораториях. Флуоресцентные микроскопы широко доступны, а шприцевые насосы часто используются в биоинженерных лабораториях или могут быть приобретены по относительно низкой цене. Если присутствует клеточная культура, стоимость полного оборудования, необходимого для проведения экспериментов, составляет около 148 000 евро, причем большая часть приходится на автоматизированный эпифлуоресцентный микроскоп (130 000 евро). Тем не менее, такой инструмент часто можно встретить в биологических лабораториях, а остальная часть стоимости распределяется на шприцевой насос (13 000 евро, но есть и более дешевые альтернативы) и более мелкое оборудование. Изготовление капельного чипа и камеры наблюдения очень хорошо описано17 и может быть выполнено за пределами чистых помещений с необходимой инфраструктурой, такой как печи и плазменные очистители, присутствующие в большинстве биоинженерных лабораторий. В качестве альтернативы различные поставщики могут поставлять заинтересованным лабораториям чипы для каплевидных генераторов. Благодаря небольшим необходимым объемам анализ является экономичным и простым в настройке.
Чтобы обеспечить высочайшую степень воспроизводимости, мы определили несколько критических шагов для успеха протокола. Распространенной проблемой для начинающих пользователей является перемещение капель во время измерения. В то время как аналитическое программное обеспечение может в некоторой степени отслеживать отдельные капли, чрезмерное движение приводит к потере разрешения отдельных клеток и неточным результатам. Смещения можно избежать за счет использования надлежащим образом герметичных измерительных камер, правильного размера капель и размеров камеры, короткого периода равновесия перед началом измерения и правильной концентрации поверхностно-активного вещества. Еще одним важным этапом является точная фокусировка перед началом измерения. Неправильная фокусировка приводит к значительному снижению значений релокации флуоресценции и занижению количества секретируемых цитокинов. Наконец, в зависимости от поставленного вопроса и протокола, правильное время между различными этапами имеет первостепенное значение для воспроизводимости. В частности, время ожидания между заполнением камеры и началом измерения должно быть постоянным, в противном случае окно измерения секретируемых цитокинов может быть упущено.
К ограничениям представленной технологии можно отнести ограниченную возможность дальнейшего манипулирования клетками после инкапсуляции. Поэтому в настоящее время невозможно добавлять или удалять стимуляторы, антитела или дополнительные реагенты. Кроме того, поскольку клетки инкапсулированы в изолированный биореактор, во время измерения не может происходить никаких взаимодействий между клетками (контактная или паракринная сигнализация). Это ограничение можно частично преодолеть с помощью предварительной массовой инкубации. Кроме того, возможны усиленные аутокринные эффекты от секретируемых цитокинов, и эти эффекты не могут быть количественно оценены или исключены с уверенностью, поскольку измеряются только секретируемые цитокины, обнаруженные антителами. Таким образом, изолированный взгляд на секрецию цитокинов всегда должен быть описан в контексте соответствующего вопроса и приложения. Тем не менее, это ограничение также может быть использовано для детального изучения инкапсулированных кратных, дуплетов и триплетов, если это представляет интерес. Это дало бы интересную установку, полезную для исследования межклеточного контакта или вопросов, основанных на паракринных ситуациях. Наконец, динамический диапазон анализа также ограничен и требует адаптации к конкретному применению. Здесь мы адаптировали динамический диапазон анализа к ожидаемому секретируемому количеству измеряемых цитокинов.
Для дальнейшего расширения возможностей и применимости этого анализа в будущем может быть рассмотрен ряд разработок в биологических, технических аспектах и аспектах анализа данных. С биологической точки зрения, измерение дополнительных цитокинов, других секретируемых белков, метаболических или клеточных поверхностных маркеров может быть интегрировано путем адаптации анализа. Кроме того, этот анализ может быть интегрирован в рабочий процесс наряду с другими клеточными анализами для расширения показаний (например, окрашивание проточной цитометрией или секвенирование). Кроме того, удобство использования анализа может быть упрощено, например, путем создания интегрированного микрофлюидного чипа для создания капель и наблюдения, тем самым потенциально обеспечивая более широкое применение за пределами биоинженерных лабораторий в клинических условиях. Что касается анализа данных, извлечение и отслеживание информации из изображений может быть расширено за счет повышения автоматизации и использования подходов машинного обучения, например, для определения присутствия и положения клетки (клеток) и гранул в каждой капле без флуоресцентного мечения. Это откроет дополнительные флуоресцентные каналы, которые можно будет использовать для иммунологических анализов, что приведет к параллельному измерению еще большего количества цитокинов.
Представленный анализ и связанные с ним протоколы и анализ могут быть применены для различных потенциальных случаев использования, связанных с динамикой секреции цитокинов. В частности, анализ потенциально может решить фундаментальные иммунологические вопросы, такие как определение типа клеток и специфичных для активации профилей секреции цитокинов, полифункциональность клеток, секретирующих цитокины, или временная и поддерживающая механизмы цитокинового баланса. Кроме того, в клинических приложениях платформа может позволить раскрыть роль цитокинов во время активных или хронических воспалительных реакций, как это наблюдается при COVID-1930, или предоставить инструмент для стратификации пациентов и персонализации лечения на основе уникальных сигнатур, таких как при аутовоспламенении31. В заключение следует отметить, что количественная оценка секреции цитокинов из отдельных клеток с временным разрешением является крайне необходимым методом, поскольку она выясняет, как конкретный препарат, инфекция, генетическое изменение или стимуляция ex vivo вызывают определенную реакцию.
Disclosures
Специальные аспекты, такие как измерение гранул клеток, были запатентованы.
Acknowledgements
Этот проект был поддержан грантом #2021-349 Стратегического направления «Персонализированное здравоохранение и связанные с ним технологии» (PHRT) домена ETH (Швейцарские федеральные технологические институты), стартовым грантом Европейского исследовательского совета (грант #803,336) и Швейцарским национальным научным фондом (грант #310030_197619). Кроме того, мы благодарим Гильема Шенона и Жана Бодри за их работу и разработку первого анализатора DropMap.
Materials
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
References
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved