הערכה גליקולית-איכותית מהירה של חלבונים רקומביננטיים באמצעות מערכת אוטומטית לחלוטין
In This Article
Summary
בעבר פותחה מערכת לניתוח אוטומטי ומהיר של גליקנים על חלבונים. מאמר זה מציג את הפרוטוקול ל"ניתוח גליקו-איכותני", המותאם למגוון רחב של משתמשים, כגון אלה העוסקים בניתוח מבנים גליקניים בביו-פרמצבטיקה ובחומרים גליקוקו-מצומדים אחרים.
Abstract
גליקוזילציה של חלבונים, שינוי קריטי לאחר תרגום, משפיעה על היציבות, היעילות והאימונוגניות של חלבונים רקומביננטיים, כולל תרופות ביולוגיות. מבנים גליקניים מפגינים הטרוגניות משמעותית, המשתנה בהתאם לסוגי תאי הייצור, תנאי התרבית ושיטות הטיהור. כתוצאה מכך, ניטור והערכה של מבני גליקן של חלבונים רקומביננטיים הוא חיוני, במיוחד בייצור ביו-פרמצבטי. מיקרו-מערך לקטין (lectin microarray), טכניקה משלימה לספקטרומטריית מסות, מתהדר ברגישות גבוהה ובקלות שימוש. עם זאת, זה בדרך כלל לוקח יותר מיום כדי להניב תוצאות. כדי להתאים אותו למחקר שאינו גליקו-מדעי או לפיתוח תהליכי מוצר תרופתי, יש צורך בחלופה אוטומטית בעלת תפוקה גבוהה. לכן, פותחה מערכת פרופיל הגליקן האוטומטית המלאה הראשונה בעולם, המשתמשת בקונספט הטכנולוגי "מערך חרוזים בקצה יחיד (BIST)". מערכת זו מאפשרת הכנה ואחסון של חרוזי לקטין משותקים ביחידות של 1,000, עם הזמנות החדרה מקבילות הניתנות להתאמה אישית למטרות שונות. מאמר זה מציג פרוטוקול מעשי למחקר המערב חלבונים רקומביננטיים "מוסמכים גליקו". לאחר בדיקת תגובתיות שלהם כנגד 12 מצומדים פוליאקרילאמיד-גליקן, נבחרו 15 לקטינים כדי להגביר את הרבגוניות של המערכת. בנוסף, תהליך תיוג הדגימה עבר אופטימיזציה על ידי מעבר מ-Cy3 לביוטין, מה שהפחית את זמן העיבוד הכולל ב-30 דקות. לקבלת אישור נתונים מיידי, אותות קושרי לקטין מוצגים כקוד נקודה בצג העליון. אמינות המערכת אושרה באמצעות בדיקות שחזור יומיומיות, בדיקות חזרתיות ובדיקות אחסון ארוכות טווח, עם מקדם שונות של <10%. למנתח גליקו מהיר וידידותי למשתמש זה יש יישומים פוטנציאליים בניטור האיכות של גליקופרוטאינים אנדוגניים לצורך הערכה ואימות של סמנים ביולוגיים. שיטה זו מאפשרת ניתוח עבור אלה חדשים במדע הגליקו, ובכך מרחיבה את התועלת המעשית שלה.
Introduction
גליקוזילציה של חלבונים היא שינוי חיוני לאחר התרגום שיש להעריך בתרופות ביולוגיות. פרופילי הגליקן של חלבונים יכולים להשתנות בהתאם לתנאי התרבית, תהליכי הטיהור והתאים המארחים1. מכשירים פשוטים נדרשים כדי לאשר גליקוזילציה בתוך צינור התהליך הביולוגי. ההערכה היא כי מעל 50% מהחלבונים המופרשים והממברנות in vivo משתנים עם גליקנים מרובים, המשתנים בהתאם לשושלת התא, השלב ההתפתחותי ומצב המחלה, כגון הופעת ממאירות2. ניטור פרופילי גליקן טומן בחובו פוטנציאל משמעותי לזיהוי סמנים אבחוניים ייחודיים ומטרות תרופתיות. מכשירים אוטומטיים המסוגלים למדוד במהירות דגימות בקנה מידה גדול מבוקשים מאוד כדי לאמת ולאמת גליקוזילציה חריגה כזו ממאות דגימות חולים בצנרת הגילוי.
טכנולוגיית Microarray שולבה בגליקומיקס להערכת פרופיל גליקן של גליקופרוטאינים3. בשיטה זו, מספר לקטינים, שהם חלבונים קושרי גליקן, משותקים על משטח כגון מגלשת זכוכית. טכנולוגיית ניתוח גליקנים מבוססת אינטראקציה זו אינה מחייבת שחרור גליקנים מחלבוני ליבה מראש, מה שמפשט את התהליך עבור חוקרים חדשים בתחום הגליקוטכנולוגיה. למרות השימוש הנרחב בה, עבור יישומים תעשייתיים כגון ייצור ביולוגי, נדרשה מערכת אוטומטית המסוגלת לנטר גליקנים במהירות ובקלות עבור מספר גדול יותר של יעדי ניתוח. כדי להתמודד עם זה, דווח בעבר על מערכת פרופיל גליקן אוטומטית המבוססת על מושג ייחודי המכונה "מערך חרוזים בקצה יחיד" (BIST), שפותחה במקור עבור גנוטיפ. מערכת זו מפשטת את התהליך עם מכשיר אוטומטי בעל תפוקה גבוהה מסוג קופסה אחת4. באמצעות קצוות שבהם מסודרים חרוזים קבועים בלקטין שונים במקביל 4,5, הוקמה שיטה לניתוח מבני גליקן שהשתנו בגליקופרוטאינים ונקראה GlycoBIST (להלן "מערכת פרופיל גליקן אוטומטית") (איור 1A). ניתן לקבע לקטין על 1,000 חרוזים ולייבש אותו כדי לשמור על פעילות במשך שנה, גם לפני וגם אחרי האריזה בחוד. לאחר שקצוות ומחסניות המכילים ריאגנטים כגון נוגדן אנטי-סטרפטאבידין (SA-HRP) המסומן על-ידי HRP מוגדרים במכשיר האבטיפוס של המדידה (התקן למדידת תגובה אוטומטית, ראו טבלת חומרים), החוד מתפקד כאוטופיפטה. סורק זיהוי כימילומינסנציה בחלק האחורי הפנימי של המכשיר מכמת את האותות של שמונה קצוות בו זמנית. הנתונים הכמותיים משמונת הטיפים הללו מוצגים באופן קומפקטי ובו-זמני כקודי נקודות במסך המגע של המכשיר לאישור מהיר של תוצאות המדידה. יתר על כן, הערך המיוצג כמקסימום של הפסגה הנמדדת מועבר מהמכשיר כנתונים גולמיים, והוא מאפשר גרפים על-ידי חוקרים בודדים (איור 1A, לוח תחתון).
במאמר זה, המחברים מתארים שיטה משופרת של תיוג חלבונים באמצעות ביוטין, המקצרת את זמן העיבוד ל-30 דקות. חלבוני המטרה עוברים ביוטינילציה מראש ומזוהים על-ידי SA-HRP (איור 1B). קצה GlycoBIST סטנדרטי (טיפ מיוחד לפרופיל גליקן אוטומטי) עם 15 לקטינים נבחרים נבנה כדי להשיג את פרופיל הגליקופרוטאין גליקן הרב-תכליתי להבנה אנליטית.
Protocol
פרטי הריאגנטים והציוד ששימש למחקר זה מפורטים בטבלת החומרים.
1. הכנת הטיפ המיוחד לפרופיל גליקן אוטומטי
- הביאו את החרוזים המיובשים הקבועים בלקטין, המאוחסנים ב -4 מעלות צלזיוס בשקית אטומה, לספסל ואפשרו להם לחזור לטמפרטורת החדר (~ 23 מעלות צלזיוס).
הערה: פעולה זו מונעת עיבוי על החרוזים, מה שעלול לפגוע באיכותם. שיטה זו להכנת חרוזי קיבוע לקטין דווחה בעבר5. - הניחו מטלית אנטי-סטטית על השולחן והניחו את המבטל הסטטי הנייד מול סביבת העבודה. זה מאפשר לבצע את העבודה הבאה על הספסל עם הגנה אנטיסטטית (איור 2A).
- הכניסו חרוזים לקצה הריק באמצעות פינצטה אנטיסטטית כך ששני חרוזי ספייסר ימוקמו בין החרוזים מקבעי הלקטין (איור 1A).
- סחטו בעדינות את החלק העליון של הקצה עם פטמות כדי לסגור את הפתח, והיזהרו לא לחתוך את הקצה אחרי שכל החרוזים מולאו (איור 2B).
הערה: פעולה זו נועדה לאבטח את החרוזים בתוך הקצה. מומלץ לעצב את הפטמה כדי למנוע חיתוך של הקצה (איור 2C). - יישרו את הקצה ביד אם הוא כפוף.
- יש לאחסן את החוד המוכן בטמפרטורה של 4°C בשקית אטומה עם חומר ייבוש עד לצורך.
הערה: לפני השימוש בטיפ, יש להביא אותו לטמפרטורת החדר לפני פתיחת השקית האטומה והוצאתה. הלחות מפחיתה באופן דרסטי את תגובתיות הלקטינים.
2. הכנת האנליטים
- ארוז מראש את מגיב הביוטינילציה לניתוח שגרתי.
הערה: לניתוח שגרתי, כדאי לארוז מראש את מגיב הביוטינילציה (Biotin-(AC5)2 Sulfo-Osu, ראה טבלת חומרים) במנות קטנות כדלקמן לניתוח מהיר. מומלץ לייבש ולאחסן את מגיב הביוטינילציה, שכן אסטר סוקסינימיל שלו רגיש בדרך כלל להידרוליזה.- ממיסים את מגיב הביוטינילציה במים שעברו דה-יוניזציה.
- מוציאים 10 מיקרוגרם של מגיב לתוך צינורות באמצעות פיפטה.
- יבשו את הצינורות עם מגיב ביוטינילציה ברכז ואקום מקורר ואחסנו אותם עם חומר מייבש בטמפרטורה של 4°C בשקית אטומה לאור עד לשימוש.
- הוסף את תמיסת האנליט (חלבון 200 ng eq) לצינור המכיל את מגיב הביוטינילציה המיובש שהוכן בשלב 2.1.
הערה: שים לב להרכב החיץ המשמש להמסת ודילול האנליטים, בהתאם לתכונות מגיב הביוטינלציה המשמש. לדוגמה, הימנע משימוש בריאגנטים ראשוניים של אמין כמאגרים לצימוד אמין. זה ימנע ירידה ביעילות הביוטינילציה של האנליטים. - מערבבים היטב על ידי מערבולת, ואז מסתובבים כלפי מטה (1000 x גרם במשך 5 שניות בטמפרטורת החדר) בצנטריפוגה שולחנית כדי להפיל את הנוזל על המכסה לתחתית הצינור.
- לדגור על הצינורות במשך שעה אחת בטמפרטורת החדר, מוגן מפני אור.
- דללו את דגימות הביוטינילציה פי 10 במאגר ה-Probing (1% Triton X-100, 0.5 M Glycine, 1 mM CaCl2 ו-1 mM MnCl2 ב-TBS) כדי להשבית ריאגנטים של ביוטינילציה שלא הגיבו.
הערה: במקרה של תגובות על ידי צימוד אמין, מגיב הביוטינילציה הבלתי מגיב נצרך על ידי התגובה עם חיץ המכיל מגיב אמין ראשוני כגון Tris in TBS, אשר מונע את הביוטינילציה של לקטינים וחומרים אחרים המשותקים על החרוזים במדידה הבאה. - יש לדגור בטמפרטורת החדר, מוגן מפני אור, למשך שעתיים.
- להעריך את יעילות הביוטינילציה של האנליטים באמצעות כתמים מערביים, תוך שימוש בסטרפטאווידין המסומן על ידי HRP כבדיקת זיהוי במידת הצורך. עיין בספרות על שיטות הכתמה מערביות6.
3. הכנת ריאגנטים לפרופיל גליקן עם מכשיר מדידת התגובה האוטומטי
- דללו את הסטרפטאווידין המצומד על ידי HRP בתמיסת החסימה ביחס של 1:3000.
- מערבבים בנפחים שווים של מצע א' ומצע ב' (ראו טבלת חומרים). יש להשתמש ב-160 מיקרוליטר של מצע מעורב לדגימה.
- יש להוציא את תמיסת החסימה, לשטוף חיץ (0.1% Triton X-100/TBS), TBS, תמיסת סטרפטאבידין מצומדת HRP, וכל מצע לבארות ייעודיות של מחסנית עם 10 מאגרים נוזליים.
הערה: הנפח והמיקום המומלצים של פתרונות למילוי כל באר של מחסנית התגובה מתוארים להלן. עם זאת, ניתן לשנות את הפתרונות ואת סידור הבאר במכשיר מדידת התגובה האוטומטית בהתאם לצורך.- הוסף 0.2 מ"ל של סטרפטאבידין עם תווית HRP שהוכן בשלב 3.1. לבאר #2 באמצעות פיפטה. הבאר נקראת #1 מקדמת המחסנית.
- הוסף 0.2 מ"ל של פתרון חסימה לבאר #3 באמצעות פיפטה.
- הוסף 1 מ"ל של TBS לבארות #4 ו #6 באמצעות פיפטה.
- הוסף 1 מ"ל של חיץ כביסה לבארות #7 ו #8 באמצעות פיפטה.
- הוסף 0.16 מ"ל של תערובת המצע לבאר #10 באמצעות פיפטה.
- אשר כי בארות #1, #5, ו #9 ריקים.
- הוסף את האנליטים שהוכנו בשלב 2 למיקרו-צינור 2 מ"ל חלבון נמוך ספיגה בורג.
- פתח את דלת הכניסה של התקן מדידת התגובה האוטומטי.
- הגדר את המאגרים הנוזליים שהוכנו בשלב 3.3, את הקצוות שהוכנו ב-1 ואת האנליטים שהוכנו בשלב 3.4 במיקומים המיועדים של התקן מדידת התגובה האוטומטית (איור 2D) באופן הבא. כל מדידה מבוצעת בכיוון קו אנכי אחד.
- הניחו קצה אחד שהוכן בשלב 1 בכל חור במיקום הסמל הצהוב "a" באיור 2D.
הערה: שוב, אם שומרים בקירור, הביאו את הטיפים לטמפרטורת החדר לפני פתיחת השקית האטומה. לקטינים מאבדים את האות שלהם באופן דרמטי בגלל לחות. - הסר את מכסה הצינור המכיל את האנליט שהוכן בשלב 3.4 והכנס אותו לכל חור במיקום "b" באופן דומה.
- הכנס את המחסנית המכילה את הנוזל שהוכן בשלב 3.3, תוך זהירות שלא לשפוך אותו במיקום "c".
- הסירו את כל "קופסת האשפה" באיור 2D כשהיא מלאה, השליכו את תכולתה לפח האשפה והחזירו את "קופסת האשפה" למקומה המקורי.
הערה: הטיפים שהגיבו נאספים באופן אוטומטי ב"קופסת האשפה" לאחר המדידה.
- הניחו קצה אחד שהוכן בשלב 1 בכל חור במיקום הסמל הצהוב "a" באיור 2D.
4. פרופיל גליקן עם מכשיר מדידת התגובה האוטומטי
- הפעל את מתג ההפעלה בצד היחידה הראשית.
- געו בכפתור "התחל אבחון" המוצג על המסך (איור 3A). תוכנית האבחון העצמי מופעלת באופן אוטומטי. לאחר זמן מה, תוכנית האבחון העצמי הושלמה, ומסך HOME מופיע (איור 3B).
הערה: ניתן לבצע את הפעולות הבאות על-ידי נגיעה בסמלים המתאימים. "Assay" כדי להתחיל מדידה. "תחזוקה" כדי לאשר כל שגיאת מערכת. "היסטוריה" להצגת נתוני מדידה קודמים. - געו ב"Assay" המוצג במסך HOME כדי לבחור את הפרוטוקול (איור 3B).
- בחר את "BAssaySTD" של שיטת הבדיקה (איור 3C) ולאחר מכן לחץ על "הבא" בפינה השמאלית התחתונה.
- הזינו את שם הדגימה (איור 3D) עבור כל דגימה לפי הצורך ולאחר מכן געו ב"הבא" בפינה השמאלית התחתונה.
- הזינו את שם הקצה (איור 3E) המשמש עבור כל דגימה לפי הצורך ולאחר מכן געו ב"הבא" בפינה השמאלית התחתונה.
- אשרו את ההערות מימין (איור 3F), ואם אין בעיה, געו ב"התחל" בפינה השמאלית התחתונה למדידה.
- אשרו את מעבר המסך למצב ריצה (איור 3G) והמתינו עד שהחץ "סיום" יסומן. במידת הצורך, גע ב"הפסק" כדי להפסיק את מצב ההפעלה.
הערה: הפעולות הנשלטות באופן אוטומטי על-ידי התקן מדידת התגובה האוטומטי הן כדלקמן: (1) חרירי מיקרופיפטה אוטומטיים בתוך המכשיר מחברים עד שמונה קצוות בו זמנית (ראו את הסמל הצהוב "a" באיור 2D); (2) לשאוף/לפרוק שוב ושוב את התמיסה בצינור המכיל את האנליט למשך 5 דקות; (3) להעביר לתמיסת החסימה ולשאוף/לפרוק למשך 5 דקות; (4) העברה ל-TBS ושאיפה/פריקה למשך 2 דקות; (5) העברה לתמיסת סטרפטווידין המסומנת על-ידי תוכנית המענה ההומניטרי ושאיפה/פריקה למשך 5 דקות; (6) להעביר למאגר הכביסה ולשאוף/לפרוק למשך 7 דקות; (7) העברה ל-TBS ושאיפה/פריקה למשך 2 דקות; (8) להעביר לתערובת המצע ולשאוף בבת אחת; (9) לסרוק את הכימילומינסנציה של שמונה קצוות בו זמנית בגב המכשיר כדי לקבל נתוני שיא; (10) השליכו טיפים משומשים לארגז האשפה; (11) הזרבובית חוזרת למצב ההתחלתי. - ודא שהמסך השתנה למצב התוצאה (איור 3H) עם השלמת המדידה. שמונת קודי הנקודות מוצגים בו-זמנית על המסך לצורך אימות קל.
הערה: גע ב"היסטוריה" בפינה השמאלית התחתונה כדי להציג את תרשים הסריקה (איור 3I,J), גרף עמודות (איור 3K,L), טבלה (איור 3M) ופרטים (איור 3N) כתוצאה על המסך. הצג את התוצאות מנתיבים אחרים מהרשימה הנפתחת "נתיב". - הכנס זיכרון USB ליציאת ה- USB בצד היחידה הראשית וגע ב"ייצוא" בפינה השמאלית התחתונה של מצב התוצאה כדי לשמור את הנתונים של כל הנתיבים בנפרד בזיכרון ה- USB.
- יצא את הנתונים הגולמיים (איור 3M) כקובץ CSV באמצעות יציאת USB לניתוח נתונים נוסף ולגרפים בודדים ב- Excel. "ערך" של הטבלה מציין את עוצמת האות של כל לקטין. ערכי העוצמה מייצגים את הערך המרבי של נתוני השיא (איור 3I,J) בסריקה של קצוות שהגיבו.
הערה: ניתן להגדיר את סף החילוץ המרבי. בהתאם לאנליטים, האות בחלק חרוזי הספייסר עשוי להיות גבוה יותר בסך הכל, ובמקרה זה הערך בחלק המרווח מופחת כרקע.
Representative Results
ראשית, התפלגות האות מוצגת עבור כל לקטין כדי להבין את המאפיינים של מערך חרוזי הלקטין (lectin bead ordery). הוכנה ספרייה של חרוזים קבועים בלקטין (1,000 חרוזים כל אחד). חמישה עשר חרוזים נקטפו באופן אקראי מתוך 1,000 ונוספו לקצה אחד. תרשים טיפוסי מוצג בתחתית איור 1A, ומייצג כמעט את אותה עוצמת אות שנצפתה בין 15 החרוזים ששיתקו את אותו לקטין. הליך מדידה זה יכול להיות מיושם כדי לאשר ייצור חרוזי לקטין בעבודת יד לפני השימוש בפרופיל גליקן. לדוגמה, שישה טיפים משמשים למדידה סימולטנית כדי לחשב את מקדם השונות (CV) מהאותות על 90 החרוזים. דוגמה טיפוסית מוצגת בטבלה 1. כאשר ספריית החרוזים הקבועים בלקטין הורחבה כדי להכיל 28 לקטינים שונים, 25 מתוך 28 לקטינים הדגימו יכולת שחזור גבוהה עם קורות חיים של פחות מ-10%.
לאחר מכן, הנתונים עבור מערך חרוזי לקטין עם 15 לקטינים שונים מוצגים. 15 הלקטינים המוצגים בטבלה 2 נבחרו עבור מערך חרוזי הלקטין (lectin beady). בנוסף, נמדדו 12 פוליאקרילאמיד (PAA) מונו/די/טריסכרידים המפורטים בטבלה 3. לאחר הערכת אמינות המדידה באמצעות תצוגת קידוד נקודות על המסך, הנתונים הגולמיים יוצאו מהתקן מדידת התגובה האוטומטי (ראה פרוטוקול שלב 4.11), ונוצר גרף באקסל באמצעות ערכי שיא התגובה בכל סכריד (איור 4A). ערכים אלה שימשו לאחר מכן לניתוח רכיבים עיקריים כדי להמחיש את המתאם בין 15 הלקטינים שנבחרו לבין הסוכרים שהגיבו (איור 4B,C). זה הביא להבדל מובהק בתבנית הקישור של כל לקטין לעומת 12 סוכרי PAA שמוצגים באיור 4A. כאן, תוקפו של כל אות מוצג כמתייחס לרשימות קודמות משולבות של ספציפיותלקטין וסכריד 7,8 (עיין גם בספציפיות זו בטבלה 2). כאשר AAL נקשר לטרמינל α-Fuc, Sia-Lex ו-Lex, ניתוח גליקן אוטומטי אישר את הזיהוי של AAL במולקולות המכילות פוקוז (איור 4A). SSA ו-MAL (ראה טבלה 2 עבור השמות המלאים של לקטינים וקיצורים נתונים) זיהו את Siaα2-6Gal/GalNAc ואת Siaα2-3Gal, בהתאמה. MAL במערך החרוזים יכול להיקשר גם ל- 3'-O-sulfo-Galβ3GalNAc ו- LacNAc. זה עולה בקנה אחד עם תוצאות קודמות שנותחו באמצעות למידת מכונה7, שבהן MAL מעדיף את 3'-O-sulfo-Gal באופן דומיננטי, בעוד LacNAc אינו דומיננטי9. RCA120, לקטין המזהה גל, הגיב בחוזקה עם טרמינל β-גל, כולל Lac/LacNAc, והורשה להיקשר ל-Siaα2-6Lac אך לא ל-Siaα2-3Lac. ECA היה תגובתיות עם LacNAc הרבה יותר גבוה מאשר Lac. ל-WFA הייתה ספציפיות רחבה יותר, שהכירה לא רק ב-α/β-GalNAc אלא גם בטרמינל β-גל כפי שדווח 7,10. GSL II, המזהה GlcNAc ו-N-גליקנים תלת-אנטניים של טטרה-אנטנות גלקטוזיליות, לא נקשר לאף סכרידים למעט GlcNAc אחד בין האנליטים המוכנים. GRFT, המזהה N-גליקנים מסוג מנוז גבוה, הגיב עם α-Man. ABA, Jacalin ו- MAH שימשו בדרך כלל לזיהוי O-גליקנים. מכיוון ש-ABA מעדיף את מבני Galβ1-3GalNAcα-Thr/Ser (T) וסיאליל-T, ABA במערך החרוזים הגיב בחוזקה עם 3'-O-sulfo-Galβ1-3GalNAc וקשור חלש ל-α-GalNAc. ABA זיהה גם את β-GlcNAc, בהתאם לדיווחים הקודמים על קשירה ל-N-גליקנים אגלקטוסילטים7. Jacalin יש ספציפיות רחבה יחסית ולכן הגיב עם α-mannose, β-GalNAc, βGal, α-GalNAc, 3'-O-sulfo-Galβ1-3GalNAc. MAH זיהה באופן ספציפי 3'-O-סולפט-Galβ1,3GalNAc כפי שדווח בעבר7. ארבעת הלקטינים השיוריים, NPA, LCA, PHA-L ו-PHA-E, זיהו את המבנה הפנימי של N-גליקן שלא נכלל בסוכרי PAA שהוכנו ולכן לא הייתה להם זיקה לכל האנליטים.
באמצעות הנתונים המתקבלים, ניתן להבהיר את הדמיון בין הלקטינים התורמים לקשירה לכל סכריד על-ידי שרטוטם על גרף ניתוח רכיבים עיקריים (איור 4B). כל הסוכרים שתרמו לשונות באיור 4B יוצגו על-ידי eigenvector, שיטה לניתוח סטטיסטי שבה יחס התרומה מיוצג על-ידי וקטור (איור 4C). ראוי לציין כאן כי הסוכרים מגיבים לתרום לכל לקטין ללא משוא פנים. לקטינים אינם מפגינים ייחודיות לסוג אחד בלבד של סכרידים. לדוגמה, נוכחותם של גליקנים מורכבים נקבעת על ידי זיהוי חלקי של גליקנים מסוימים בתוך גליקנים מורכבים בבני אדם. Jacalin, אשר מזהה O-גליקנים (ראו את הספציפיות בטבלה 2), יכול לזהות את מבנה 3'suTF ואת α-GalNAc בין הסוכרים ששימשו במחקר זה, ולכן 3'suTF ו-α-GalNAc שורטטו (איור 4C) כנגד כיוון המיקום של Jacalin (נקודה חומה) ששורטט באיור 4B. WFA יכול לזהות α/β-GalNAc בין הסוכרים ששימשו במחקר זה; לכן, α/β-GalNAc באיור 4C שורטט באותו כיוון כמו WFA ששורטט באיור 4B. לעומת זאת, α-GalNAc משורטט בין WFA לבין Jacalin כי זה מבנה סכריד כי Jacalin מסוגל להיקשר בקלות. כל 11 הסוכרים ששורטטו במחקר זה עולים בקנה אחד עם הספציפיות (קשירת סכרידים) של לקטינים שדווחו בעבר 7,8, מה שמצביע על כך שהשיטה המוצעת היא שיטת מדידה אמינה. יתר על כן, הווקטורים העצמיים המתאימים לכל סכריד מפוזרים, מה שתומך בכך ש-15 הלקטינים נבחרו עם הטיה מינימלית כדי להבטיח כיסוי מקיף בניתוח. כתוצאה מכך, החוד שהתחדש ב-15 לקטינים אלה הוגדר כקצה הגליקוביסט הסטנדרטי (טבלה 2).
בדוגמה המעשית יותר, מוצרי חלבון מטוהרים עברו את מדידת הקצה (איור 5). תירוגלובולין בקר, בעל אתר N-גליקוזילציה ומכיל N-גליקנים מורכבים, היברידיים ועתירי מנוז מסוג 11, נותחו. הקצה הסטנדרטי הצביע על תגובתיות מוגברת של לקטינים מסוימים לסוכרים8 (עיין בספציפיות בטבלה 2): PHA-E, המזהה חיתוך GlcNAc; GRFT, זיהוי N-גליקנים מסוג מנוז; SSA, הכרה Siaα2-6Gal/GalNAc; RCA120, זיהוי לקטוז ו- LacNAc; ו-AAL, זיהוי פוקוז. מבנים גליקניים אלה קיימים ב-N-גליקנים מורכבים, היברידיים ועתירי מנוז, דבר המצביע על כך שניתן להעריך ביעילות את מבנה ה-N-גליקן של תירוגלובולין11. יתר על כן, תירוגלובולין שטופל בסיאלידאז A, אנזים המעכל חומצה סיאלית, הראה תגובתיות מופחתת עם SSA, המזהה חומצה סיאלית, ותגובתיות מוגברת עם RCA120, WFA ו- ECA, אשר מזוהים בקלות רבה יותר לאחר הסרת חומצות סיאליות. נוכחותם של מבני O-גליקן בתירוגלובולין בקר לא דווחה בעבר. כצפוי, לא הייתה הכרה של O-גליקן בתירוגלובולין עם או בלי טיפול בסיאלידאז בניתוח הגליקן האוטומטי.
בדיקת שכפול בתוך ריצה באמצעות 15 הלקטינים שנבחרו מוצגת כדי להבין את עמידות המדידה (טבלה 4). לבדיקה זו הוכנו שבעה טיפים סטנדרטיים לאנליטים וטיפ נוסף לבקרה שלילית, וכל שמונת הטיפים נמדדו בו זמנית. הליך זה חזר על עצמו שלוש פעמים ביום אחד. "Mix Analytes", שילוב של אנליטים שהוביל לקבלת אותות משמעותיים על כל הלקטינים, הוכנו לבקרת האיכות של מערך החרוזים. ה-Mix Analytes נוסחו על-ידי ערבוב מתאים של אריתרופויאטין מעוכל בסיאלידאז (EPO), EPO מעוכל בסיאלידאז וגלקטוזידאז, IgA אנושי, מטריצה מטאלופרוטאינאז 3 (MMP3) ותירוגלובולין. כל גליקופרוטאין (200 ננוגרם) סומן ב-10 מיקרוגרם של מגיב ביוטינילציה ב-PBS המכיל טריטון X-100. במידת הצורך, בוצעו טיפולי sialidase ו galactosidase כמתואר בהוראות. לאחר העיכול, המוצרים הודגרו בבלוק חום ב 75 ° C במשך 10 דקות כדי להשבית את האנזים. הכמויות המתאימות של גליקופרוטאינים ביוטינילטים (3 ng של EPO, 8 ng של IgA אנושי, 5 ng של MMP3, ו 15 ng של thyroglobulin) היו מעורבים מיד לפני הניתוח. תוצאות המדידה הצביעו על כך שערך קורות החיים המרבי היה 13.5%, וממוצע קורות החיים עבור 15 הלקטינים היה 8.2%, מה שמעיד על יכולת שחזור גבוהה.
בנוסף, בדיקת שכפול יומיומית מוצגת כדי להבין שינויים עקב תאריך המדידה (טבלה 5). טיפים סטנדרטיים ומיקס אנליטים הוכנו מראש, ומדידות של שבעה טיפים חזרו על עצמן מדי יום במשך חמישה ימים רצופים. התוצאות הראו כי לרוב הלקטינים היו קורות חיים של פחות מ-10%. עם זאת, כמה לקטינים, כגון LCA ו- ECA, הציגו קורות חיים גבוהים יותר. ממוצע קורות החיים של 15 לקטינים למחזור היה עד 7.7%, וערכי קורות החיים הממוצעים במשך 5 ימים היו פחות מ-10%, מה שמעיד על יכולת שחזור גבוהה. צוין כי Jacalin, בשל העיכול העצמי של MMP3 ב Mix Analyte, הוכיח שחזור זמני נמוך. לכן, יש לזהות אנליטי מתאים יותר שיחליף את MMP3.
כדי להבין את יציבותם של חרוזים קבועים בלקטין מוצגת בדיקת יציבות ארוכת טווח באמצעות חרוזים מיובשים אלה הקבועים בלקטין (טבלה 6). טיפים סטנדרטיים, ריאגנטים לבדיקה ומיקס אנליטים הוכנו מראש, והמדידות בוצעו לאחר 12 חודשי אחסון. חמשת הסוגים הנ"ל של אנליטים ביוטינילטים אוחסנו בנפרד ועורבבו לפני המדידה. התוצאות הראו כי קורות החיים הממוצעים של 15 הלקטינים היו פחות מ-10%, אפילו עד 12 חודשים לאחר אחסון יבש. זה מצביע על היתכנות של מדידות מהירות ומדויקות על ידי אחסון טיפים רבים (עד 1,000) מאותו מגרש בבת אחת.
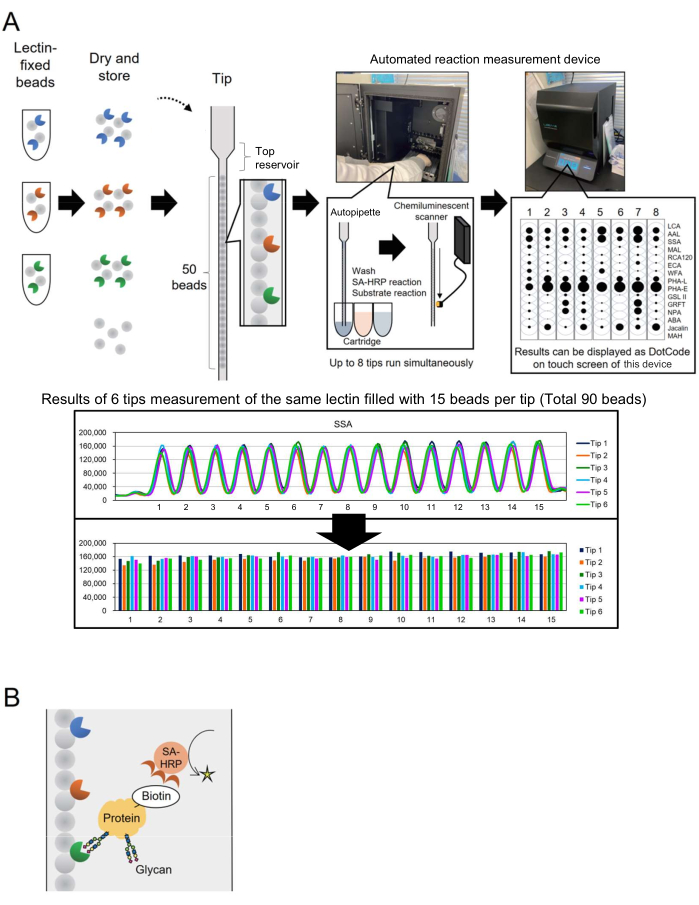
איור 1: סכמות של מכשיר ושיטת ניתוח "מערך חרוזים בקצה אחד". (A) סכימה של מערכת פרופיל גליקן אוטומטית. חרוזים קבועים לקטין ניתן לייבש ולאחסן בקצוות. כאשר קצוות ומחסניות המכילים ריאגנטים כגון נוגדן אנטי-סטרפטאווידין (SA-HRP) המסומן על-ידי HRP מוגדרים במכשיר המדידה (התקן למדידת תגובה אוטומטית) ומופעלים, החוד מתפקד כאוטופיפטה. סורק זיהוי הכימילומינסנציה בחלקו האחורי של המכשיר מכמת אותות משמונה קצוות בו זמנית. נתונים כמותיים מוצגים כקודי נקודות על מסך המגע של המכשיר לאישור מהיר של תוצאות המדידה. החלק התחתון מציג את התוצאות של מדידת 90 חרוזים עם אותו לקטין. תוצאות המדידה מועברות מהמכשיר ומוצגות בגרפים על ידי החוקר הבודד. (B) סכימת שיטת הזיהוי המשמשת בניסוי זה. חלבוני המטרה עוברים קדם-ביוטינילציה ומזוהים באמצעות SA-HRP. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: תמונות של חומרים והתקנה ליצירת פרופיל גליקן אוטומטי באמצעות התקן מדידת התגובה האוטומטי. (A) תיאור של חרוזים מקבעי לקטין ארוזים בקצה. מרימים את החרוזים בפינצטה אנטיסטטית על השטיחון האנטיסטטי וממלאים את הקצה בחרוזים. (B) צביטת הקצה עם פטמה. חלק עליון קל של החרוז העליון נסחט. (C) פטמה לכיווץ הקצות. הפלסטיק (עיגול צהוב) נצבט כדי למנוע מהם לחתוך לחלוטין. (ד) סידור החומרים המשמשים במכשיר מדידת התגובה האוטומטי. A: TIPS, B: צינור המכיל אנליטים, ו- C: יש להכניס מחסניות המכילות נוזל למקומן, בהתאמה. בארגז האשפה, הטיפים שהגיבו נאספים לאחר המדידה. ניתן להסיר את התיבה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
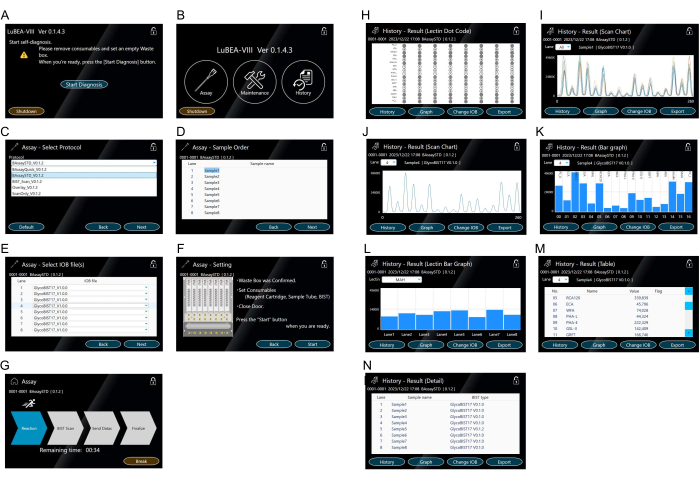
איור 3: מסך מגע למניפולציה של מכונה. (A) תוכנית האבחון העצמי מופעלת באופן אוטומטי כאשר החשמל מופעל. (B) מסך HOME מציג "Assay", "Maintenance" ו-"History". (ג-ג) הפעלת מצב "Assay". בחירת שיטת Assay (C). ניתן לרשום פרוטוקולים מרובים מראש. קלט של סדר מדגם (אנליטי) (D). בחירת סוג העצה (E). אישור הגדרות שיטת הבדיקה (F) והפעלת הבדיקה מהמסך "התחל בדיקה" (G). (ח-נ) ייצוג התוצאה ב"היסטוריה". Lectin dotcode (H) מוצג לאחר השלמת הבדיקה או ממצב "היסטוריה". תרשים סריקה של 15 לקטינים מוצג על המסך עבור כל הדגימות (I) או עבור כל דגימה (J). תרשים הסריקה מוצג כגרף עמודות (K). ניתן לבחור תרשימי עמודות עבור נתיבים אחרים מהרשימה הנפתחת "נתיב". גרף עמודות המשווה שמונה נתיבים של דגימות ללקטין (L). ניתן לבחור לקטינים אחרים מהרשימה הנפתחת "Lectin". טבלה המציגה ערכים כמותיים (M). תיעוד שיטת המדידה שבוצעה (N). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
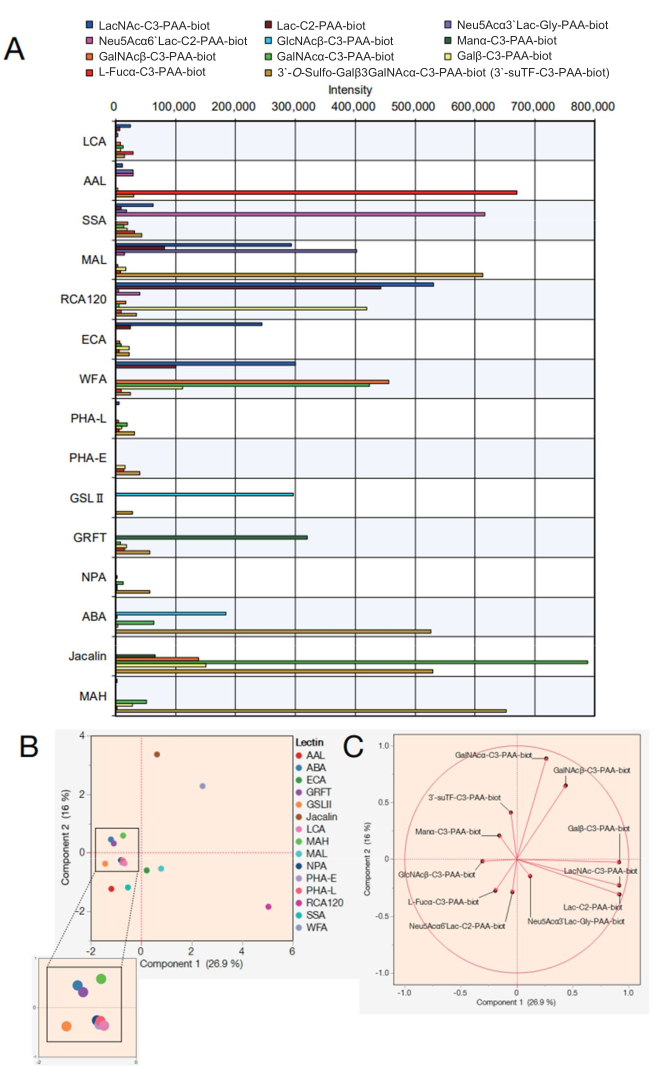
איור 4: הערכת תגובתיות עם סוכרי PAA במערכת פרופיל גליקן אוטומטית. (A) גרף המתאר את תגובתיות הלקטינים עם סוכרי PAA שונים הותאם לערכי בקרה שליליים. (ב) ניתוח רכיבים עיקריים בהתבסס על הנתונים שב-(א). (C) וקטורים עצמיים מהניתוח ב-(B). תוכנת ניתוח תואמת שימשה עבור חלקים (B) ו- (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
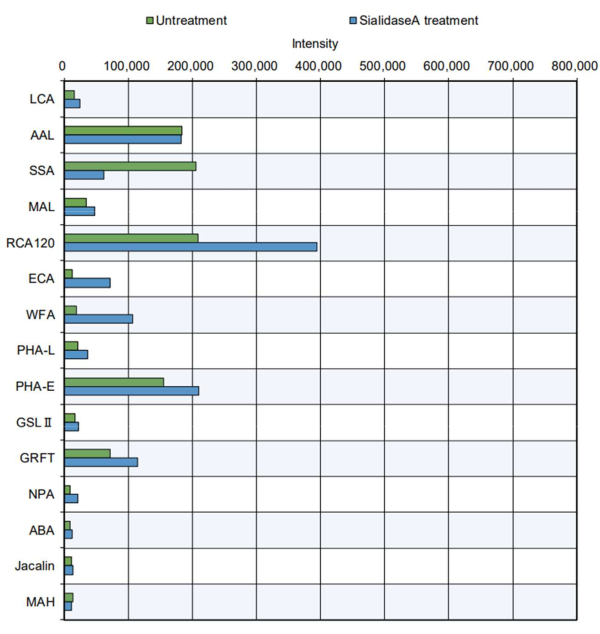
איור 5: אימות תגובתיות של GlycoBIST באמצעות חלבון thyroglobulin מטוהר מפרות. הכנת הדגימה ללא טיפול בוצעה באותם תנאי עיכול כמו החיץ בלבד, למעט תוספת של sialidase A. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: בדיקת חזרתיות עם חרוזים קבועים בלקטין. נבדקה יכולת החזרתיות של תגובתיות עבור 28 לקטינים. האנליטים הגיבו עם כל טיפ. EPO: אריתרופואיטין, PSA: אנטיגן ספציפי לערמונית, Tf: טרנספרין, M2BP: חלבון קושר Mac-2, hIgG: IgG אנושי, MMP3: מטריצה metalloproteinase 3, (Sia+): sialidase A-digested analytes, (Sia+, Gal+): sialidase A ו galactosidase-digested analytes, Ab: נוגדן. DSA: Datura stramonium agglutinin, HypninA2: Hypnea japonica agglutinin, WGA: נבט חיטה agglutinin, UDA: Urtica dioica agglutinin, BPL: Bauhinia purpurea lectin, Orysata: Oryza sativa lectin, LSL-N: Laetiporus sulphureus lectin N-terminal domain, SNA: Sambucus nigra lectin, BanLec: בננה lectin, MPA: Maclura pomifera agglutinin, TxLC-I: Tulipa gesneriana agglutinin, AOL: Aspergillus oryzae lectin, ACG: Agrocybe cylindracea galectin. CV: מקדם השונות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: רשימת הלקטינים המהווים את הטיפ הסטנדרטי לפרופיל גליקן אוטומטי. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: סוכרי PAA המשמשים כתקנים למערכת פרופיל גליקן אוטומטית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: תוצאות בדיקת השחזור בתוך הריצה. CV: מקדם השונות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: תוצאות מבחן השחזור בין הימים. CV: מקדם השונות. אנא לחץ כאן כדי להוריד טבלה זו.
לוח 6: תוצאות מבחן היציבות ארוך הטווח. CV: מקדם השונות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
במחקר זה פותחה טכניקת הערכה מהירה לגליקוזילציה המשתמשת בטכנולוגיית "מערך חרוזים בקצה אחד". המחקר הנוכחי הציג טיפ סטנדרטי של GlycoBIST, המיועד הן לחוקרי גליקוזילציה והן לחוקרים שאינם גליקוזיליים, כדי להקל על הערכת גליקוזילציה שגרתית ומקיפה. מיקרו-מערך לקטין (lectin microarray), המכיל בדרך כלל 20-100 לקטינים12,13, נמצא בשימוש נרחב בהערכות. עם זאת, בהתחשב בייחודיות החופפת של חלק מהלקטינים במיקרו-מערך והמגוון המוגבל יחסית של גליקופורמים על גליקופרוטאין מטרה בהשוואה לגליקומיקס של דגימות קליניות גולמיות, היה צפוי כי 15 לקטינים יספיקו להערכה פשוטה יותר של פרופיל גליקן ממוקד.
השלב הקריטי בפרוטוקול הוא לאפשר לחרוזים המשותקים בלקטין או לקצוות המלאים בחרוזים אלה לחזור לטמפרטורת החדר לאחר האחסון לפני השימוש בהם למדידות. בפרט, נצפה כי עיבוי מחליש את האותות; לכן, מומלץ לא לפתוח את שקית האחסון עד שהיא חוזרת לטמפרטורת החדר. לאחסון ריאגנטים של ביוטינילציה, חיוני גם להתייבש לחלוטין לפני האחסון. תהליך ייבוש לא מספיק מפחית את יעילות הביוטינילציה לחלבון בגלל ההידרוליזה של מגיב הביוטינילציה14.
לגבי שינויים ופתרון בעיות, נבדקה שיטה לצמצום השונות, במיוחד בכל הנוגע לשיטת המדידה במכשיר מדידת התגובה האוטומטי. בפרט, כאשר נפח החיץ במאגר המשמש לניתוח הוא 150 μL, בועות נכנסות לקצה, מה שמוביל ליעילות תגובה מופחתת וכתוצאה מכך לשונות גדולה בערכים. לכן, מומלץ להציב לפחות 200 μL של חיץ במאגר.
כמות הנוזלים שממלאת את הקצוות במהלך פיפטינג אוטומטי היא גם גורם חשוב. הקצוות אינם יכולים לגרש לחלוטין את הנוזל כשהוא עובר לשלב התגובה הבא. לכן, בכמות לא קטנה, המאגר מהשלב הקודם מועבר לשלב הבא, והמאגר הקודם נשאר באזור העליון של התמיסה שהוכנסה כאשר שואפים את המאגר החדש. לכן, המצע ותמיסות אחרות צריכים להיות מספיק שואפים כדי למלא את המאגר העליון (ראו איור 1A). בהתחשב בחוסר ההפיכות של תגובות נוגדנים על המכשיר, חשוב לנקוט משנה זהירות ולהימנע מטעויות במהלך ההתקנה הראשונית.
מגבלה אחת של השיטה היא שהיא מוגבלת לחלבונים מסיסים שמקורם בסרום ובתרבית. בשיטה הנוכחית, לקטין אינו מקושר באופן קוולנטי לחרוז, ולכן הוא אינו מסוגל לנתח דגימות המכילות ריכוזים גבוהים של חומרים פעילי שטח, כגון תמציות תאים ורקמות. כתוצאה מכך, יש צורך בשיפורים עתידיים כדי להתמודד עם מגבלות אלה.
חשיבותו של מערך חרוזי הלקטין טמונה ביכולת ההחלפה וההרחבה של מיני הלקטין הקבועים על החרוזים. לדוגמה, בניתוח דיפרנציאלי בקנה מידה גדול (>1,000 דגימות) באמצעות מערכת פרופיל גליקן אוטומטית, משתמשים יכולים להתאים מערך של 15 לקטין בקצה בהתבסס על פרופיל גליקן ראשוני מבוסס מיקרו-מערך לקטין של גליקופרוטאין המטרה (<100 דגימות). יתר על כן, היציבות הגבוהה של חרוזי הלקטין הקבועים מאפשרת התנסות מיידית מתכנון החוד הראשוני ועד למדידה בהליכים שגרתיים. לא רק 25 מתוך 28 לקטינים שהוכיחו אמינות גבוהה (טבלה 1), אלא כל לקטין שמעניין את המשתמש יכול לשמש ליצירת מערכת פרופיל גליקן אוטומטית מותאמת אישית עבור הניסויים הספציפיים שלו, לאחר בדיקת האמינות השגרתית שהוזכרה לעיל. גישה זו הובילה לתכנון מערך חרוזים אפשרי של 120 לקטין של שמונה סוגים שונים של טיפים למדידה מורחבת בשילוב עם מערכת פרופיל גליקן סטנדרטית.
מחקר קודם התמקד בביסוס הליך זיהוי של גליקופרוטאינים בעלי תווית Cy3 בקנה אחד עם מיקרו-מערךלקטין 15. שיטה זו הוגבלה ל-13 לקטינים במקביל בקצה בגלל הפרעות פלואורסצנטיות. השיטה הנוכחית, המשתמשת בתוויות זיהוי HRP, מכילה 15 חרוזים קבועים בלקטין ושני חרוזי ביקורת (חיוביים ושליליים) בקצה. בנוסף, biotinylation של דגימות קיצר את תהליך הניתוח.
שיטה אנליטית זו יכולה להיות מיושמת לא רק למחקר אקדמי, אלא גם למחקר רפואי ופרמצבטי, מזון, קוסמטיקה ותחומים תעשייתיים אחרים. בעוד שטכנולוגיות מיקרו-מערך לקטין וגליקופרוטאומיקה מבוססות היטב, הגישה של מחקר זה נותרה משמעותית עבור האוטומציה המלאה שלה ויכולתה לניתוח מהיר עם פחות צעדים. בעתיד, שיפורים בניתוח זה יבוצעו בשיטה כמותית על ידי נרמול האות באמצעות גליקופרוטאינים מסוימים, תוך שימוש בחרוזים קבועים נוגדנים לצד חרוזים קבועים לקטין בקצה.
Disclosures
AO, TO, NT, HS, KK, MA, SY, TM, KN, OS ו- KS הם עובדים של Precision System Science Co., Ltd.
Acknowledgements
עבודה זו נתמכה על ידי תוכנית העברת טכנולוגיה ניתנת להתאמה וחלקה באמצעות מו"פ מונחה מטרה (A-STEP), במימון סוכנות המדע והטכנולוגיה היפנית (JST), תחת מענק מספר JPMJTR204A ובחלקה על ידי האגודה היפנית לקידום המדע (JSPS) KAKENHI מענק מספר 23H02680 ל- AK. ברצוננו להודות ל-Editage (www.editage.jp) על עריכת השפה האנגלית.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
References
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103 (2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved