כימות בליעה מיקרוגליאלית של חומר סינפטי באמצעות ציטומטריית זרימה
In This Article
Summary
כאן אנו מציגים שני פרוטוקולים לכימות בליעת מיקרוגליאה של סינפסות חיוביות vGLUT1 וסינפטוזומים גולמיים מסומנים באדום pHRodo באמצעות ציטומטריית זרימה.
Abstract
מיקרוגליה ממלאת תפקיד מרכזי בעידון סינפטי במוח. ניתוח של בליעת מיקרוגליאה של סינפסות חיוני להבנת תהליך זה; עם זאת, השיטות הקיימות כיום לזיהוי בליעה מיקרוגליאלית של סינפסות, כגון אימונוהיסטוכימיה (IHC) והדמיה, הן מייגעות וגוזלות זמן. כדי להתמודד עם אתגר זה, אנו מציגים כאן בדיקות in vitro ו - in vivo* המאפשרות כימות מהיר ובתפוקה גבוהה של בליעת מיקרוגליה של סינפסות באמצעות ציטומטריית זרימה.
בגישת in vivo* , ביצענו צביעת vGLUT1 תוך-תאית בעקבות בידוד תאים טרי ממוחות עכברים בוגרים כדי לכמת בליעה של סינפסות vGLUT1+ על ידי מיקרוגליה. בבדיקת בליעת סינפטוזום במבחנה , השתמשנו בתאים שזה עתה בודדו ממוח העכבר הבוגר כדי לכמת את הבליעה של סינפטוזומים בעלי תווית אדומה של pHrodo על-ידי מיקרוגליה. פרוטוקולים אלה יחד מספקים גישה חסכונית בזמן לכימות בליעת מיקרוגליאה של סינפסות ומייצגים חלופות מבטיחות לשיטות מבוססות ניתוח תמונה עתירות עבודה. על ידי ייעול הניתוח, בדיקות אלה יכולות לתרום להבנה טובה יותר של תפקיד תאי המיקרוגליה בעידון סינפטי במודלים שונים של מחלות.
Introduction
מיקרוגליה הם תאי החיסון השוכנים של מערכת העצבים המרכזית (CNS)1. הם סורקים כל הזמן את המיקרו-סביבה שלהם ומספקים מעקב 1,2. יתר על כן, לעתים קרובות הם מתקשרים עם סינפסות ומתווכים כוונון עדין של הפעילות הסינפטית3. לפיכך, הם התגלו כשחקן מפתח בתהליך של עידון סינפטי.
תפקידם של תאי מיקרוגליה בעידון סינפטי באמצעות בליעת סינפסות הוכח על ידי קבוצות מחקר שונות 3,4,5,6,7. שיבושים בתהליך זה יכולים לתרום לפתולוגיה של הפרעות נוירו-התפתחותיות וניווניות כגון סכיזופרניה ואלצהיימר8. עידון סינפטי חריג על ידי מיקרוגליה כבר זוהה במודלים שונים של הפרעות נוירולוגיות 5,9,10. לכן, זיהוי מנגנונים מובחנים העומדים בבסיס בליעת הסינפסות במיקרוגליה הוא בעל חשיבות עליונה להבנת הפתופיזיולוגיה של הפרעות נוירו-התפתחותיות וניווניות8.
התמקדות בבליעה מיקרוגליאלית של סינפסות טומנת בחובה פוטנציאל גדול הן להתערבות בהתקדמות המחלה והן להשגת תובנות לגבי המנגנונים הבסיסיים של הפרעות נוירו-התפתחותיות וניווניות. כדי להקל על חקירות כאלה, יש צורך בגישות מהירות ובעלות תפוקה גבוהה. הגישות המתודולוגיות הנוכחיות כוללות בדיקות in vivo, ex vivo ו- in vitro המאפשרות זיהוי של חומר סינפטי בתוך מיקרוגליה. באופן כללי, הזיהוי של בליעת מיקרוגליה של סינפסות מסתמך במידה רבה על אימונוהיסטוכימיה (IHC) וגישות מבוססות מיקרוסקופיה 5,6,11, שהן עתירות עבודה ומראות מגבלות בניתוח מספר רב של מיקרוגליה.
בהתחשב במגבלות טכניות אלה, חקירת מתודולוגיות חלופיות היא הכרחית. כדי להתגבר על כך, ביצענו אופטימיזציה של גישה מבוססת ציטומטריית זרימה, המאפשרת ניתוח יעיל, בלתי משוחד ובתפוקה גבוהה של בליעת מיקרוגליה של סינפסות. בחרנו בהיפוקמפוס כאזור העניין העיקרי בשל הרמה הגבוהה של עיצוב מחדש סינפטי ופלסטיות12, אך ניתן להתאים את הפרוטוקול לאזורי מוח שונים. בעוד ציטומטריית זרימה כבר שימשה במחקרים קודמים כדי לזהות בליעת מיקרוגליאה של סינפסות 13,14,15, אנו מספקים כאן מתודולוגיה שלב אחר שלב המשתמשת בנוגדן vGLUT1 מצומד פלואורופור הזמין כיום מסחרית. יתר על כן, אנו מספקים גישה משלימה במבחנה לסינון בתפוקה גבוהה של בליעת מיקרוגליאה של חומר סינפטי באמצעות סינפטוזומים גולמיים.
Protocol
מבט כללי על הליך הניסוי מומחש באופן גרפי באיור 1A. כל הניסויים הכרוכים בטיפול בבעלי חיים בוצעו בהתאמה קפדנית לחוק הגרמני להגנה על בעלי חיים ואושרו על ידי המשרד האזורי לבריאות ולשירותים חברתיים בברלין (Landesamt für Gesundheit und Soziales, ברלין, גרמניה). העכברים שוכנו בכלובים מאווררים בתנאי מעבדה סטנדרטיים עם מחזור אור/חושך של 12:12 שעות במתקן ליבת בעלי החיים של מרכז מקס דלבריק לרפואה מולקולרית (MDC). מזון ומים סופקו עד לליביטום. ראה טבלה 1 להרכב מאגרים וריאגנטים וטבלת החומרים לפרטים הקשורים לכל הריאגנטים, המכשירים והחומרים המשמשים בפרוטוקול זה. עבור הבדיקה הספציפית vGLUT1, השתמשנו במונח in vivo* לאורך כל כתב היד כדי להכיר בכך שציטומטריית זרימה דורשת הומוגניזציה של רקמות ובידוד תאים, ותאי מיקרוגליה מפגינים כ-95% כדאיות לאחר הליך הבידוד (איור 1B ואיור משלים S1). לכן, הם שומרים על יכולתם לבלוע חומר סינפטי ex vivo, לתקופה קצרה, עד הקיבוע. לפיכך, הכימות של מיקרוגליה vGLUT1+ כולל הן in vivo והן לטווח קצר ex vivo הבלעה עד לשלב הקיבוע.
1. צביעת vGLUT1 תוך תאית לזיהוי בליעה in vivo* של סינפסות גלוטמטרגיות על ידי מיקרוגליה
הערה: הליך בידוד התאים הבא מותאם מ- 16. כל שלבי בידוד התאים צריכים להתבצע על קרח.
- להרדים את העכברים באמצעות הזרקה intraperitoneal של pentobarbital. יש לערבב את העכברים תוך לבדי עם 10 מ"ל של מלח חוצץ פוספט חוצץ (DPBS) קר כקרח של Dulbecco למשך ~2 דקות.
הערה: עכבר אחד משמש לכל דגימה (n). - הוציאו את המוח מהגולגולת ושמרו אותו ב-1 מ"ל של תווך תאי עצב.
הערה: תווך תא עצבי, כגון מדיום Hibernate-A, משמש כדי להבטיח כדאיות גבוהה של תאים לאחר תהליך דיסוציאציה רקמתי. - העבירו את המוח לצלוחית פטרי מלאה ב-1 מ"ל של תווך תאי עצב קרים כקרח ונתחו את ההיפוקמפוס כפי שתואר קודם לכן17.
- מעבירים את ההיפוקמפוס להומוגנייזר Dounce מלא ב-1 מ"ל של תווך תאי עצב ומנתקים את הרקמה באמצעות המזיק הרופף עם כ~25 משיכות עדינות.
- מניחים מסננת 70 מיקרומטר על צינור פוליפרופילן 5 מ"ל ומוסיפים 500 מיקרומטר של תווך תא עצבי. מעבירים את הרקמה הומוגנית לצינור הפוליפרופילן 5 מ"ל דרך המסננת.
- שטפו את ההומוגנייזר של Dounce 2x עם 1 מ"ל של תווך תא עצבי קר וצנטריפוגו את הדגימות ב 400 × גרם במשך 8 דקות.
- שאפו את הסופרנאטנט והשהו מחדש את הגלולה ב-500 מיקרוליטר של DPBS קר כקרח באמצעות פיפטינג עדין. ודא מתלה הומוגני והשלם את הנפח הסופי עד 1.5 מ"ל באמצעות DPBS.
- הוסף 500 μL של תמיסת פרקול איזוטונית לדגימה, השהה אותה מחדש בעדינות וצפה אותה בעוד 2 מ"ל של DPBS קר.
- צנטריפוגה הדגימות ב 3,000 × גרם במשך 10 דקות עם האצה מלאה וללא בלימה. שואפים את השכבה העליונה, כמו גם את דיסק המיאלין בשלב האמצעי.
הערה: כל שלבי הצנטריפוגה הבאים מתבצעים ב- 4 oC אם לא צוין אחרת. - הוסף 4 מ"ל של DPBS קר וצנטריפוגה את הדגימות ב 400 × גרם במשך 10 דקות. לשאוף את supernatant ולהשהות מחדש את התאים ב 100 μL של תמיסת צביעה קיימא לתיקון לדגור את הדגימות במשך 30 דקות ב 4 ° C.
- הוסף 1 מ"ל של DPBS קר לדגימה וצנטריפוגה את הדגימות ב 300 × גרם למשך 5 דקות. השליכו את הסופרנאטנט והוסיפו 100 מיקרוליטר של תמיסת צביעה CD16/CD32 (1/200 במאגר FACS). מערבולת במשך ~ 5 שניות ודגרה במשך 10 דקות ב 4 ° C.
הערה: צביעת CD16/CD32 היא טיפול מקדים למזעור קשירה לא ספציפית של נוגדנים לתאים נושאי FcR, כגון מיקרוגליה, לפני יישומים כגון ציטומטריית זרימה. - הוסף 1 מ"ל של חיץ FACS לדגימה וצנטריפוגה ב 300 × גרם למשך 5 דקות. שאפו את הסופרנאטנט והוסיפו 100 μL של תערובת מאסטר צביעה-I (1/100 אנטי-CD11b/ אנטי-CD45 + 1/200 אנטי-Ly6C/ אנטי-Ly6G במאגר FACS אחד). דגרו על הדגימות במשך 20 דקות בטמפרטורה של 4 מעלות צלזיוס בחושך.
- הוסף 1 מ"ל של חיץ FACS לדגימה וצנטריפוגה ב 300 × גרם למשך 5 דקות.
- השהה מחדש את הגלולה ב 250 μL של חיץ קיבוע. יש לדגור ב-4°C למשך 25 דקות.
- הוסף 2 מ"ל של 1x permeabilization (PERM) חיץ וצנטריפוגה 300 × גרם למשך 5 דקות.
- השליכו את הסופרנאטנט והוסיפו 100 μL של vGLUT1 או תמיסת צביעה של בקרת איזוטיפ. מערבול במשך ~ 5 שניות ולדגור את הדגימות ב 4 ° C במשך 50 דקות.
- הוסף 2 מ"ל של 1x PERM Buffer וצנטריפוגה 300 × גרם למשך 5 דקות. השליכו את הסופרנאטנט והוסיפו 2 מ"ל של חיץ FACS לדגימות.
- צנטריפוגה ב 300 × גרם במשך 5 דקות ולהשליך את supernatant. השהה מחדש את התאים במאגר FACS של 250 מיקרומטר והעבר את הדגימות דרך מסנן מסננת של 40 מיקרומטר.
- נתח את עוצמת הפלואורסצנטיות vGLUT1 ממיקרוגליה יחידה/בת קיימא/CD11b++/CD45+ באמצעות ציטומטריית זרימה. השתמשו במקרופאגים של הטחול כבקרה שלילית לכל ניסוי.
- בודד טחול על ידי דחיסה עדינה של רקמת טחול טחון דרך מסנן מסננת של 70 מיקרומטר פעמיים. שטפו את המסננים עם 40 מ"ל של DPBS ואספו את המתלה בצינור חרוטי של 50 מ"ל.
- צנטריפוגה 350 × גרם למשך 10 דקות ולהשעות מחדש את הגלולה המתקבלת בתמיסה של 1 מ"ל של חיץ ליזה של תאי דם אדומים. דוגרים במשך 10 דקות על קרח.
- הוסף 10 מ"ל של DPBS לדגימה לאחר הדגירה והצנטריפוגה ב 350 × גרם למשך 10 דקות.
- המשך בשלבי הצביעה המוסברים בין שלבים 1.11 ו- 1.17.
הערה: אסטרטגיית ה-gating מוצגת באיור משלים S2 כדי להגדיר מקרופאגים של הטחול כ-CD11b ++/ CD45 ++/ אוכלוסיית תאים בת קיימא. - אסטרטגיית Gating (איור 1)
- שער ראשי: התאם את אזור הפיזור הקדמי (FSC-A) [ציר x] ואת אזור הפיזור הצדדי (SSC-A) [ציר y] כך שיכלול את אוכלוסיית תאי המיקרוגליה באזור המגודר ולא יכלול את הפסולת התאית.
- התאם את אזור הפיזור קדימה (FSC-A) [ציר x] ואת גובה הפיזור קדימה (FSC-H) [ציר y] כדי לא לכלול כפילויות. סינגלים מופיעים באלכסון בתרשים נקודה זה.
- התאם CD11b-PECy7 [ציר y] ו- CD45-APC [ציר x] ושער את האוכלוסייה עם רמת שטח גבוהה של CD11b ורמה בינונית של CD45 כמיקרוגליה.
- אל תכלול תאים מתים בשער השלילי של ציר FITC[y]. אופציונלי: לא לכלול גם תאים חיוביים עבור Ly6C ו- Ly6G-FITC בשער FITC-שלילי כדי לא לכלול מקרופאגים הקשורים למערכת העצבים המרכזית מהניתוח.
הערה: בניגוד לתאים חיים, תאים מתים עם קרומים פגומים מאפשרים לצבע הכדאיות הניתנת לתיקון להיכנס לציטופלסמה, מה שמגדיל את כמות סימון החלבון18. לפיכך, תאים מתים יהיו בהירים יותר מתאים חיים, הכלולים בשער המוגדר. - כוונן CD45-APC [ציר x] ו- vGLUT1-PE [ציר y]; האוכלוסייה שנמצאת מעל שער הסף, שבה לא זוהו אירועים חיוביים בדגימת הטחול (בקרה שלילית ביולוגית פנימית, איור 1E) נחשבת לחלק החיובי vGLUT1 בדגימה.
2. איתור בליעה חוץ גופית של סינפטוזומים גולמיים על ידי מיקרוגליה
- הכנת סינפטוזום גולמי ותיוג pHrodo אדום
הערה: כל השלבים הבאים צריכים להתבצע על קרח.- בצע את שלבים 1.1 עד 1.2.
- העבירו את המוח לצלוחית פטרי מלאה ב-1 מ"ל של מדיום תאי עצב קרים כקרח ונתחו בזהירות את ההיפוקמפוס. תמיד לשמור את צלחת פטרי על קרח. השתמשו בהיפוקמפי לבידוד תאי מיקרוגליה בשלב הבא.
- העבר את שאר המוח (למעט המוח הקטן ופקעת הריח) להומוגנייזר Dounce מלא ב -1 מ"ל של מגיב מיצוי חלבון סינפטי ונתק בעדינות את הרקמה באמצעות המזיק הרופף עם כ~ 30 שביתות. יש להשלים את מעכב הפרוטאז בטבליה אחת לכל 10 מ"ל של מגיב המיצוי ולבודד סינפטוזומים בהתאם להוראות היצרן.
הערה: ריאגנטים למיצוי חלבונים סינפטיים, כגון SynPER19, משמשים להכנת סינפטוזומים המכילים חלבונים פעילים ביולוגית לפני ואחרי סינפטיים. - ממיסים את כדורית הסינפטוזום הגולמי ב-500 מיקרוליטר של תמיסת 0.1 M Na2CO3 . מכתימים את דגימת הסינפטוזום עם 10 μL של 0.2 mM pHrodo אדום. יש לדגור על דגימות הסינפטוזום הגולמי בטמפרטורת החדר (24-25 מעלות צלזיוס) למשך שעה וחצי בתסיסה עדינה.
- הוסף 1 מ"ל של DPBS קר לדגימה, צנטריפוגה למשך דקה אחת במהירות מלאה (20,815 × גרם), ושאפו את הסופרנאטנט.
- חזור על שלב 2.1.5 עבור 7x בסך הכל כדי להסיר pHrodo Red מוגזם לא מאוגד מהדגימות.
- לאחר הצנטריפוגה האחרונה, בצע בדיקת BCA סטנדרטית כדי לכמת את ריכוזי החלבון של הדגימה.
- אופציונלי: להקפיא דגימות סינפטוזום ב-DPBS עם 5% DMSO באמצעות חנקן נוזלי ולשמר אותן למשך 3 שבועות בטמפרטורה של -80°C. כסו את הצינורות ברדיד אלומיניום כדי לשמור על חשיפה מינימלית לאור.
- In vitro בדיקת בליעת סינפטוזום גולמי באמצעות מיקרוגליה בוגרת מבודדת טרייה
- הכינו aCSF ואזן אותו עם 95% O2:5% CO2 למשך 30 דקות.
הערה: עבור השלבים 2.2.2-2.2.4, בצע את הוראות היצרן להכנת תמיסת עיכול מבוססת פפאין. - הוסף 4 מ"ל של aCSF בקבוקון 2 בערכת פפאין. מניחים את הבקבוקון באמבט מים של 37 מעלות צלזיוס למשך ~ 10 דקות עד שתמיסת הפפאין נראית ברורה.
- הוסף 400 μL של aCSF בקבוקון 3 בערכת פפאין. מערבבים בעדינות במשך ~10 פעמים על ידי פיפטינג איטי.
- הוסף 200 μL מבקבוקון 3 לבקבוקון 2 (משוחזר בשלב 2.2.3). שמור את שאר הבקבוקון 3.
- קח את ההיפוקמפוס שנותח בשלב 2.1.2 וטחן את ההיפוקמפוס המנותח באמצעות אזמל.
- העבר את ההיפוקמפי הטחון לצינור דיסוציאטור רקמות מלא 2 מ"ל של תמיסת אנזים שהוכנה בשלב 2.2.5. הכנס את הצינור לדיסוציאטור הרקמה והפעל את התוכנית: 37C_ABDK_01 (לוקח ~ 30 דקות).
- מניחים את הדגימות באמבט מים ב 37 ° C למשך ~ 20 דקות ו triturate את התערובת כל 5 דקות באמצעות צינור 1 מ"ל מבלי ליצור בועות.
הערה: יש להמשיך בתהליך זה עד שהרקמה מנותקת לחלוטין ונראית הומוגנית לחלוטין כדי להבטיח דיסוציאציה יעילה. כל שלבי הצנטריפוגה הבאים מתבצעים ב 4 oC אם לא צוין אחרת. - הסר בזהירות את מתלה התאים העכור לצינור וצנטריפוגה חדשים של 15 מ"ל ב 300 × גרם למשך 5 דקות.
- במהלך תקופה זו של 5 דקות, הכינו את תערובת השטיפה הבאה (5 מ"ל) לדגימה; הוסף 500 μL של פתרון מעכב אלבומין-ovomucoid reconstituted שסופק בערכת papain ל 4.5 מ"ל של aCSF. מוסיפים את התמיסה הנותרת בבקבוקון 3 משלב 2.2.5 לתערובת השטיפה.
- השליכו את הסופרנאטנט משלב 2.2.8 ומיד השהו מחדש את גלולת התא בתמיסת תערובת השטיפה.
- העבירו את הדגימה דרך מסנן 70 מיקרומטר לצינור מיקרוצנטריפוגה חדש של 5 מ"ל. צנטריפוגה את הדגימות ב 300 × גרם במשך 5 דקות.
- המשך עם שלב הצנטריפוגה ההדרגתית של Percoll שהוסבר קודם לכן בשלבים 1.7-1.9.
- השהה מחדש את התאים בזהירות במאגר צביעת MACS על ידי צנרת איטית למעלה ולמטה. לדגור את הדגימות במשך 15 דקות ב 4 ° C.
- הוסף 1 מ"ל של חיץ MACS לכל דגימה וצנטריפוגה ב 300 × גרם למשך 8 דקות.
- להשעות מחדש את התאים ב 500 μL של מאגר MACS.
- מקם את עמודות הבחירה החיובית במפריד המגנטי. אזן את העמודות על-ידי שטיפתן עם 3 מ"ל של מאגר MACS.
- מערבבים בעדינות ומורחים 500 μL של תרחיף התא על העמודה. שטוף את העמודות 3x עם 3 מ"ל של מאגר MACS.
- הסר את העמודים מהמפריד המגנטי והנח אותם על צינורות חרוטיים של 15 מ"ל. הוסף 5 מ"ל של מאגר MACS לעמודה ומיד לשטוף את התאים באמצעות plumper. צנטריפוגה את הדגימות ב 300 × גרם במשך 10 דקות.
- במהלך תקופה זו, להכין 20 מ"ל של 40% FBS ב DPBS. לחמם מראש 1 מ"ל של DMEM לכל מדגם עד 37 °C באמבט מים.
- ממיסים את גלולת התא הסופית ב 1 מ"ל של DMEM שחומם מראש. זרעו סביב ~ 150,000-200,000 תאים ב 500 μL של DMEM שחומם מראש לכל באר בצלחת 24 בארות. כבקרה, זרעו מספר דומה של תאים ב 1-2 בארות נוספות. בדוק את מפגש התאים בכל הבארות באמצעות מיקרוסקופ אור.
הערה: אם אזור היעד במוח הוא היפוקמפוס או אזורי מוח קטנים יחסית, ניתן לאגד 5 עכברים לכל דגימה (n) כדי לבודד ~150,000 מיקרוגליה. עבור המוח כולו, עכבר אחד לכל n יספיק כדי להשיג מספר דומה של תאים באמצעות שני פרוטוקולי הבידוד. לחלופין, ~ 40,000 תאים יכולים להיות מצופים בלוחות 96 בארות בנפח סופי של 100 μL כדי להתחיל את בדיקת הבליעה. פעולה זו מפחיתה את מספר התאים המנותחים, אך גם מפחיתה את מספר העכברים המשמשים לכל n. מחסור בחלבון עקב חוסר FCS ב- DMEM יגרום לפאגוציטוזה. - לדגור על הצלחת במשך 1-2 שעות באינקובטור (37 ° C ו 5% CO2).
הערה: שלב זה נועד לתאים להתאושש מההשפעות המועדות ללחץ של הליך הבידוד לפני תחילת בדיקת הבליעה התפקודית. - קח 250 μL של בינוני מכל באר לאט מאוד, להוסיף 250 μL של DMEM טרי שחומם מראש לכל באר, ולהוסיף 3 מיקרוגרם של pHRodo סינפטוזומים מסומנים אדום בחלק העליון. בדוק את מפגש התאים בכל הבארות באמצעות מיקרוסקופ אור.
- עבור בארות הבקרה השליליות, הוסף את אותה כמות של סינפטוזומים ללא תווית לבאר הנוספת שנזרעה עם תאים.
- עבור בארות בדיקה, ודא כי באר 1 מכיל רק תאים; באר 2 מכילה תאים+ סינפטוזומים ללא תווית; באר-3 מכיל תאים+ 3 מיקרוגרם של pHrodo אדום; באר 4 מכיל DMEM + 3 מיקרוגרם של pHrodo אדום.
- לדגור את התאים עם סינפטוזומים במשך 2 שעות באינקובטור (37 ° C ו 5% CO2).
- מוציאים את המדיום ושוטפים את הבארות ב-DPBS קר. הוסף 200 μL של תמיסת טריפסין/EDTA לכל באר כדי לנתק את התאים למשך 35 שניות.
- הוסף 1 מ"ל של 40% FBS ב- DPBS לכל באר והעבר את התאים לצינור פוליפרופילן 5 מ"ל דרך המסננת. שמור הן את הצלחת ואת הצינור על קרח במהלך תהליך זה כדי להקל על ניתוק של תאים.
- שטפו כל באר פעמיים באמצעות 500 מיקרוליטר של DPBS קר כקרח. צנטריפוגה הדגימות שנאספו ב 500 × גרם במשך 5 דקות.
- יש להשהות מחדש את התאים בתמיסת הצביעה המכילה 1/200 CD16/CD32 ב-100 מיקרוליטר של חיץ FACS ולדגור במשך 10 דקות על קרח.
- לאחר הדגירה, מוסיפים CD11b ו-CD45 לתמיסת הצביעה עם ריכוז סופי של 1/100 מכל אחד. לדגור על הדגימות במשך 20 דקות ב 4 ° C בחושך.
- שטפו את הדגימות עם 1 מ"ל של חיץ FACS וצנטריפוגו אותן ב 300 × גרם במשך 10 דקות.
- השהה מחדש את הגלולה במאגר FACS של 250 מיקרוליטר ותעד לפחות 100,000 אירועים בסך הכל באמצעות ציטומטריית זרימה. נתח את עוצמת הפלואורסצנטיות האדומה pHrodo ממיקרוגליה CD11b ++/CD45+ .
- אסטרטגיית גאטינג (איור 2C)
- התאם את השער הראשי: אזור פיזור קדמי (FSC-A) [ציר x] ואזור פיזור צד (SSC-A) [ציר x] כדי לכלול את אוכלוסיית תאי המיקרוגליה באזור המגודר ולא לכלול את הפסולת התאית.
- התאם את אזור הפיזור קדימה (FSC-A) [ציר x] ואת גובה הפיזור קדימה (FSC-H) [ציר y] כדי לא לכלול כפילויות. סינגלים מופיעים באלכסון בתרשים נקודה זה.
- התאם CD11b-PECy7 [ציר y] ו- CD45-APC [ציר x] ושער את האוכלוסייה עם CD11b ברמת פני שטח גבוהה ורמה בינונית של CD45 כמיקרוגליה.
- חשב את עוצמת הפלואורסצנטיות החציונית של pHrodo-PE מאוכלוסייה זו. השתמש באותם תאים מודגרים עם סינפטוזומים ללא תווית כמו הבקרה השלילית.
- הכינו aCSF ואזן אותו עם 95% O2:5% CO2 למשך 30 דקות.
Representative Results
בפרויקט זה, ביצענו אופטימיזציה והצגנו שני פרוטוקולים למדידה in vivo* ובליעת סינפסות במבחנה על ידי מיקרוגליה. בפרוטוקול הראשון, התמקדנו בבליעת in vivo* של סינפסות חיוביות vGLUT1. כנקודת מוצא, השתמשנו בפרוטוקול14 שפורסם בעבר. עם זאת, נוגדני FACS המשמשים בפרוטוקול זה הופסקו והוספנו שלבי אופטימיזציה רבים וכן שיטה חדשנית לבידוד מיקרוגליה16. לכן כדאי לשתף את הקהילה המדעית בפרוטוקול המוצג כאן כעדכון מקיף לפרוטוקולים שכבר פורסמו.
כדי לכמת את בליעת המיקרוגליה של סינפסות, השתמשנו בעכברים זכרים C57BL/6N בגילאי 11-14 שבועות. ההיפוקמפוס נבחר כאזור העניין העיקרי בשל הרמה הגבוהה של שיפוץ סינפטי ופלסטיות12. ניתחנו את עוצמת הפלואורסצנטיות (MFI) של vGLUT1-PE (vGLUT1-PE) בהיפוקמפוס של עכברי C57BL/6N. מקרופאגים של טחול שמקורם באותם בעלי חיים שימשו כבקרה ביולוגית שלילית לכל ניסוי. בחנו את הנוגדן vGLUT1 על-ידי הדגמת אות פלואורסצנטי vGLUT1-PE גבוה יותר מתאי מיקרוגליה בהיפוקמפוס בהשוואה לבקרת האיזוטיפ ולמקרופאגים של הטחול (איור 1B-E)
יתר על כן, השווינו את בליעת המיקרוגליה של סינפסות במוח הקטן כמו גם בפקעת הריח (כהתייחסות נוספת לפלסטיות סינפטית גבוהה)20. מצאנו אות פלואורסצנטי vGLUT1 גבוה יותר במיקרוגליה מפקעת הריח, ואות נמוך יותר במוח הקטן בהשוואה להיפוקמפוס (איור 1F). עוצמת האות הנמוכה ביותר זוהתה במקרופאגים של הטחול, ושימשה כבקרה שלילית פנימית (איור 1E). בנוסף, השתמשנו בעכברי Vglut-IRES-Cre/ChR2-YFP כדי לבדוק את התגובה החיסונית של נוגדן vGLUT1 שלנו. YFP מבוטא על-ידי תאי עצב גלוטמטרגיים של עכברים אלה, מה שמצביע על כך שאוכלוסיית ה-YFP החיובית צריכה לכלול גם חלק חיובי vGLUT1. באמצעות פרוטוקול צביעה זה, זיהינו 98.7% מהאוכלוסייה החיובית ל-YFP כחיוביים ל-vGLUT1, מה שמאמת את יעילות הנוגדן שלנו (איור משלים S3).
בסך הכל, תוצאות אלה מאמתות את היעילות של נוגדן vGLUT1 ואת פרוטוקול הצביעה המוצג. אנו מראים כי פרוטוקול זה והנוגדן יכולים לשמש בביטחון לכימות בליעת invivo* של סינפסות בתפוקה גבוהה ומהירה בהשוואה לגישות ניסיוניות אחרות.
במעבר לשיטת המבחנה , בודדנו תאי מיקרוגליה בוגרים ודגרנו עליהם באמצעות סינפטוזומים שבודדו לאחרונה עם תווית אדומה של pHrodo שבודדו מאותן חיות כדי לכמת את הבליעה החוץ-גופית שלהם (איור 2A). תייגנו סינפטוזומים עם pHrodo אדום, אשר באופן טבעי מגביר את האות הפלואורסצנטי ב- pH21 החומצי שמסביב. בודדנו סינפטוזומים וחשפנו אותם לערכי pH שונים (pH = 4 ו- pH = 11). לאחר שאישרנו את העלייה באות הפלואורסצנטי ב-pH נמוך כניסוי הוכחת עיקרון (איור 2B), דגרנו על הסינפטוזומים האלה עם מיקרוגליה שזה עתה בודדה במשך 1.5-2 שעות. כבקרה, דגרנו על מיקרוגליה עם סינפטוזומים ללא תווית. לאחר מכן, ניתחנו את אות הפלואורסצנטיות pHrodo Red-PE ממיקרוגליה CD11b++/CD45+ וצפינו בפלואורסצנטיות PE חיובית, שהייתה דומה לזו שהתקבלה מסינפטוזומים ב-pH=4 (איור 2C). לפיכך, שיטה זו מספקת ניתוח מהיר ובתפוקה גבוהה של בליעת מבחנה של סינפטוזומים וניתן להרחיב אותה לפלאקים עמילואידיים או לבליעה של מטרות פוטנציאליות אחרות בעקבות שלבי אופטימיזציה נדרשים. ואכן, Rangaraju et al. כימתו את הבליעה של עמילואיד בטא על ידי מיקרוגליה באמצעות גישה דומה מבוססת ציטומטריה זרימה22. לסיכום, שתי שיטות אלה מספקות כימות חזק, יעיל ובתפוקה גבוהה של בליעת מיקרוגליה של סינפסות הן in vivo* והן in vitro.
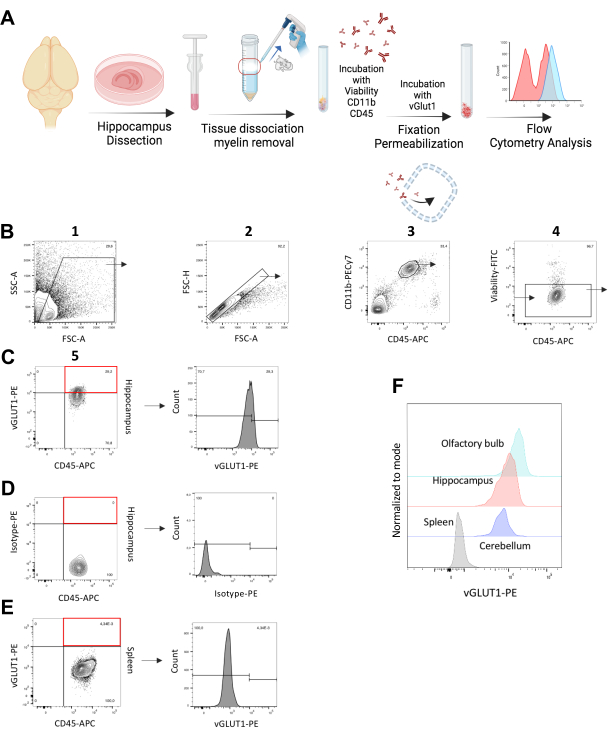
איור 1: ניתוח של בליעת מיקרוגליאה של סינפסות vGLUT1+ in vivo*. (A) המחשה גרפית של תהליך העבודה הניסיוני המתאר שלבים של צביעת vGLUT1 תוך תאית. (B) אסטרטגיית Gating להגדרת אוכלוסיית תאים יחידה/CD11b++/CD45+/ בת קיימא מההיפוקמפוס. אוכלוסייה זו שימשה לניתוח vGLUT1-MFI וכן לכימות אחוז מיקרוגליה vGLUT1+ בהיפוקמפוס. השער המוצג עם המלבן האדום מציין את שבר התא vGLUT1+ במדגם הכולל. (C) ההיסטוגרמה מציינת עוצמת פלואורסצנטיות vGLUT1-PE. (D) השער המוצג עם המלבן האדום אינו מציין שבר תא חיובי המציג תגובתיות חיסונית של איזוטיפ-PE. ההיסטוגרמה מציינת את עוצמת הפלואורסצנטיות של איזוטיפ-PE. (E) השער המוצג עם המלבן האדום אינו מציין שבר תאים חיובי המציג תגובתיות חיסונית vGLUT1-PE במקרופאגים של הטחול. ההיסטוגרמה מציינת עוצמת פלואורסצנטיות vGLUT1-PE. השער המצוין בהיסטוגרמה מתחיל ברמה, שבה vGLUT1-MFI מהטחול מסתיים (~ 104) ומשמש לניתוח החלק החיובי vGLUT1 בדגימות המוח. (F) ההיסטוגרמה השכובה מראה השוואה של עוצמת פלואורסצנטיות PE של מקרופאגים בטחול (אפור) ותאי מיקרוגליה מההיפוקמפוס (אדום), המוח הקטן (סגול) ופקעת הריח (תכלת). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
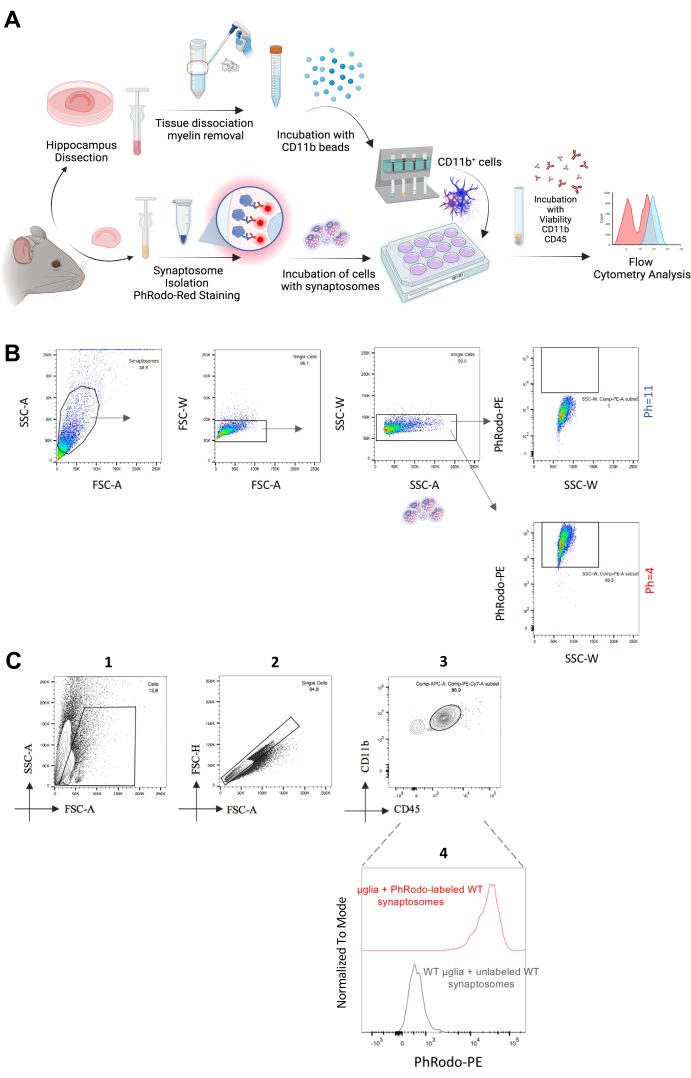
איור 2: אנליזה של בליעת מיקרוגליאה של סינפסות סינפטוזומים במבחנה. (A) המחשה גרפית של תהליך העבודה הניסיוני המתארת שלבים של בדיקת בליעת סינפטוזום במבחנה. (B) סינפטוזומים המודגרים בשני ערכי pH שונים מראים אות פלואורסצנטי נמוך של pHrodo Red-PE ב-pH=11 ופלואורסצנטיות גבוהה של pHrodoRed-PE ב-pH=4. (C) אוכלוסיית תאים בודדים/CD11b++/CD45+ שימשה לניתוח עוצמת הפלואורסצנטיות של pHrodo Red-PE. מיקרוגליה מודגרת עם סינפטוזומים לא מוכתמים שימשו כבקרה שלילית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: רשימת המאגרים והריאגנטים המשמשים בפרוטוקול זה. אנא לחץ כאן כדי להוריד טבלה זו.
איור משלים S1: תמונה מייצגת של תאי מיקרוגליה בוגרים שזה עתה בודדו. התמונה התקבלה באמצעות מיקרוסקופ אור עם מטרה של פי 20 בעקבות פרוטוקול דיסוציאציה של רקמות מבוסס פפאין ובידוד מבוסס MACS של מיקרוגליה CD11b+. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
איור משלים S2: תרשימי FACS מייצגים המדגימים את אסטרטגיית הגאטינג להגדרת מקרופאגים בטחול. הטחול שימש כבקרה שלילית בניסויים לכל ריצת ניסוי בעת בדיקת בליעת מיקרוגליאה של סינפסות בהיפוקמפוס. חלקות FACS שניתנו לעיל מגדירות את מקרופאגים הטחול כאוכלוסייה CD11b++/CD45++/בת קיימא. אוכלוסייה זו שימשה לקביעת סף לכימות מיקרוגליה vGLUT1+ בדגימות המוח השוכנות מעל שער סף זה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S3: תרשימי FACS מייצגים המדגימים את אסטרטגיית gating לבדיקת יעילות נוגדן vGLUT1. (A) המחשה גרפית של זרימת העבודה הניסיונית המתארת שלבים של צביעת vGLUT1. נוירונים גלוטמטרגיים YFP+ שימשו לבדיקת התגובה החיסונית של נוגדן vGLUT1. (B) אסטרטגיית Gating להגדרת אוכלוסיית YFP+ מההיפוקמפוס של עכברי Vglut-IRES-Cre//ChR2-YFP ששימשו כבקרה חיובית לבדיקת היעילות של נוגדן vGLUT1 FACS. חלק YFP+ היה מגודר כדי לציין סינפסות גלוטמטרגיות. באוכלוסייה זו נותחה התגובה החיסונית של נוגדן vGLUT1 כדי לבדוק את התגובה החיסונית של הנוגדן. בהשוואה לבקרת האיזוטיפ (C); 97.9% ממקטע התאים החיובי ל-YFP מזוהה כ-(D) vGLUT1-חיובי. (E) ההיסטוגרמה השכובה מציינת את ההשוואה של פלואורסצנטיות PE בין האיזוטיפ לבין נוגדן vGLUT1. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
עידון סינפטי באמצעות אינטראקציה מיקרוגליה-סינפסה הוא תחום מחקר מסקרן בתחום הנוירואימונולוגיה, המציע תובנות מבטיחות על תפקידם של מיקרוגליה בהפרעות נוירודגנרטיביות ונוירו-התפתחותיות. בשנת 2011; Paolicelli et al. סיפקו ראיות לנוכחות של חומר סינפטי בתוך מיקרוגליה, ושפכו אור על מעורבותם בתהליך הבליעה הסינפטי4. מחקר מסקרן אחר השתמש בדימות בהילוך מהיר ובמודל תרבית פרוסות מוח אורגנוטיפיות ex vivo ודיווח כי תאי מיקרוגליה עוסקים בתהליך פגוציטי המכונה טרוגוציטוזה, שבו הם בולעים מבנים פרה-סינפטיים ולא את המבנה הסינפטי כולו23. פרסום עדכני מאוד המשתמש במודל עכבר מהונדס חדש המאפשר מדידה של פאגוציטוזה ברקמה שלמה הראה גיזום על ידי ברגמן-גליה in vivo עם למידה מוטורית24. לפיכך, יש מספיק ראיות המצביעות על מעורבותם של תאי גלייה בבליעה סינפטית, כולל מיקרוגליה. עם זאת, המידה שבה פונקציה מיקרוגליאלית זו משפיעה על התהליך הדינמי והסלקטיבי של גיזום סינפטי דורשת ראיות נוספות.
אף על פי כן, כימות הבליעה המיקרוגליאלית של סינפסות משמש אינדיקטור רב ערך ומספק תובנה חלקית לגבי הדינמיקה המורכבת של אינטראקציות מיקרוגליה-סינפסה, במיוחד עידון סינפטי. סקירה מקיפה סיכמה את הפרוטוקולים הנוכחיים המשמשים לחקר בליעת מיקרוגליה של סינפסות25. ברצוננו להדגיש כי הפרוטוקולים שלנו מותאמים על בסיס פרוטוקולים קיימים שכבר נמצאים בשימוש. השיטות המוצגות במחקר זה מספקות כימות מהיר ובתפוקה גבוהה של בליעת מיקרוגליאות של סינפסות באזורי מוח מנותחים שונים. בהתאם לאזור המוח, ניתוח של לפחות 10,000 תאי מיקרוגליאה ביומיים לכל היותר אפשרי עבור שתי המתודולוגיות, מה שהופך אותם בעלי ערך לבדיקת מודלים עכבריים מרובים במקביל.
אנו מכירים בכך שהכימות של מיקרוגליה vGLUT1+ כולל הן בליעת in vivo והן בטווח קצר ex vivo עד לשלב הקיבוע. לכן, אנו מציעים כי הבדיקה שלנו מציגה דרך מהירה ואמינה לכמת חומר סינפטי בתוך מיקרוגליה כצעד ראשוני לפני אימות in vivo באמצעות גישות כגון IHC.
חסרון נוסף של ניתוח ציטומטריית זרימה הוא הזמינות המוגבלת של נוגדנים לסמנים סינפטיים, במיוחד עבור סינפסות מעכבות. זה מאתגר למצוא זמינים מסחרית, נוגדנים מצומדים ישירות המראים אות בהיר עבור סמנים אלה. בהתחשב בזמן האופטימיזציה הנרחב הנדרש לבדיקת נוגדנים שונים המכוונים לסמנים סינפטיים, חשוב לשתף את ההליכים הממוטבים היטב עם הקהילה המדעית עבור צביעה תוך תאית עם נוגדנים שונים, כפי שאנו עושים כאן במחקר זה.
בנוגע לניתוח נתונים במחקר זה, השתמשנו בפקדי איזוטיפ כבקרות שליליות טכניות כדי להסביר קשירה לא ספציפית של נוגדן vGLUT1, שכן הם מספקים אומדן לקשירה לא ספציפית של נוגדן בדגימה תוך אופטימיזציה של בדיקות מבוססות ציטומטריה של זרימה26. עם זאת, בקרות איזוטיפ עברו אופטימיזציה בעיקר לזיהוי אות הרקע הלא ספציפי מהליכי צביעת פני השטח ואינן אופטימליות לבקרות צביעה תוך תאיות27,28. לכן, אין להסתמך עליהם כדי להבחין בין האוכלוסייה השלילית לחיובית בעת ביצוע צביעה תוך תאית, הכוללת שלבי קיבוע וחלחול שיכולים להשפיע על זיהוי אנטיגן, אוטופלואורסנציה ובהירות פלואורופור29. הליכי צביעה תוך-תאיים כאלה מחייבים שימוש בבקרות פנימיות ביולוגיות מתאימות כדי להגדיר את אוכלוסיית התאים החיובית המוכתמת עבור סמן תוך-תאי29. לכן, בהתחשב בכך שאנו משתמשים בפרוטוקול צביעה תוך-תאי, השתמשנו בבקרה שלילית ביולוגית פנימית (מקרופאגים של הטחול) והגדרנו את הגבול בין האוכלוסייה החיובית לשלילית על פי מקרופאגים של הטחול שבודדו מאותם עכברים. הבחנו בין האוכלוסייה החיובית שמעל השער, שבה אין אירועים חיוביים vGLUT1, לבין המקרופאגים בטחול שמשמשים כבקרה ביולוגית שלילית (איור 1).
שתי השיטות המוצגות במחקר זה מציעות פוטנציאל גדול לניתוח ראשוני של בליעת מיקרוגליה של סינפסות באופן מהיר ובתפוקה גבוהה, תוך ניתוח מעל 10,000 תאים מאזורי מוח קטנים וזה לא בר השגה עם טכניקות מיקרוסקופיה סטנדרטיות. לכן, שיטות אלה מציעות יתרון משמעותי על פני שיטות עבודה וזמן רב יותר ועוד, לספק ניתוח מקיף יותר של בליעה סינפטית על ידי מתן אפשרות ניתוח של מספר גדול יותר של מיקרוגליה. בנוסף, שיטת המבחנה המוצגת במחקר זה שימושית במיוחד לבדיקת ההשפעה של טיפולים שונים על בליעת המיקרוגליאה של הסינפסות. הוא מאפשר כימות ישיר של השפעת הטיפול על תאי מיקרוגליה ללא הגורמים המבלבלים הקשורים לסוגי תאים אחרים. בנוסף, הוא משמש כגישה עקיפה להוכחת השפעה פוטנציאלית של מיקרו-סביבה או סוגי תאים אחרים על תהליך הבליעה הסינפטית. לכן, אנו מסיקים כי שיטות אלה, במיוחד כאשר נעשה שימוש במקביל, מציעים חלופות אינטואיטיביות ויתרון לניתוח של בליעת מיקרוגליאה של חומרים סינפטיים.
עם זאת, ניתוח של מיקרוגליה מבודדת טרייה על ידי בדיקות phagocytic מבוסס FACS ex vivo עשוי להוות כמה חסרונות. ראשית, חיוני להשתמש בפרוטוקולים ממוטבים היטב המייצרים תאי מיקרוגליה מבודדים טריים מהמוח הבוגר תוך הימנעות מהפעלת ex vivo ותגובת לחץ של מיקרוגליה. Dissing-Olesen et al. שילבו את השימוש במעכבי שעתוק ותרגום כדי להתגבר על בעיה זו על ידי שימוש בהליך דיסוציאציה של רקמות ב 37 oC30. Mattei et al., לעומת זאת, הציגו פרוטוקול דיסוציאציה של רקמות מכניות קרות כדי להימנע מגרימת ביטוי ex vivo של גנים הקשורים ללחץ16 והתאמנו פרוטוקול זה בחלק הראשון כדי למנוע הפעלה ex vivo של תגובת מיקרוגליה הקשורה ללחץ לפני צביעת vGLUT1 תוך תאית. השתמשנו בפרוטוקול דיסוציאציה אנזימטית של רקמות בחלק השני לפני בדיקת בליעת סינפטוזום במבחנה , בהתחשב בתפוקה הגבוהה יותר של מיקרוגליה לאחר דיסוציאציה של רקמות מבוססות פפאין (הנתונים לא מוצגים). מיקרוגליה נשארת באופן בלתי נמנע בטמפרטורה של 37 מעלותצלזיוס בתנאי תרבית כאשר היא מודגרת עם סינפטוזומים, ודגירה בטמפרטורה של 37 מעלותצלזיוס אכן יכולה לגרום לשינויים במיקרוגליה כחסרונות נפוצים של כל בדיקות המבחנה והליכי תרבית התא. לכן, אנו מציעים להשתמש בשני הפרוטוקולים המוצגים במקביל כדי להגיע למסקנה רחבה יותר במונחים של בליעת מיקרוגליאה של סינפסות.
יתר על כן, חשוב להגדיר בקפידה את אסטרטגיית gating לבחירת מיקרוגליה CD11b++/CD45+ על ידי התחשבות בנוכחותם של תאים חיסוניים אחרים בפרנכימה במוח המבטאים גם סמנים אלה31. חשוב מכך, כאשר בוחרים סמנים המיועדים ספציפית למיקרוגליה (למשל, TMEM119, P2RY12), חשוב לקחת בחשבון שהם יכולים לעבור שינויים ברמות הביטוי שלהם במהלך מצבים פתולוגיים ודלקתיים32 , ויש לשקול שינויים כאלה לפני הקמת פאנל FACS לכימות בליעת מיקרוגליאה של סינפסות. לבסוף, חשוב להדגיש שאף אחת מהשיטות שנדונו קודם לכן, כולל גישות ה-IHC והמיקרוסקופיה in vivo , אינה יכולה לבדה ללכוד את הגיזום הפעיל והסלקטיבי של סינפסות על ידי מיקרוגליה. שיטות אלה אינן מסוגלות להבחין בין גיזום פעיל על ידי מיקרוגליה לבין נבלות פסיבית של פסולת סינפטית בתוך פרנכימה במוח. לכן, כאשר מעריכים ודנים בנתונים, חובה להבחין בבירור בין מושגים מובחנים אלה.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
אנו מודים לרגינה פיסקה על הסיוע הטכני בבידוד תאי מיקרוגליה ולד"ר קאיו אנדרטה פיגיירדו על עזרתו ברכישת תמונות מיקרוסקופיה באיור משלים S1. אנו מודים למתקן FACS של MDC על התמיכה הטכנית שלהם. כתב יד זה מציג באופן חלקי את הנתונים המייצגים שהוגשו לכתב העת מוח, התנהגות וחסינות בשנת 2024. איור 1A, איור 2A ואיור משלים S3A נוצרו באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Dounce Homogenizer | Active Motif | Cat# 40401 | |
| 5 mL Tubes | Eppendorf | Cat# 0030119452 | |
| Anti-CD11b | ThermoFisher Scientific | Cat# 25-0112-82 | |
| Anti-CD45 | BD | Cat# 559864 | |
| Anti-Ly6C | BD | Cat# 553104 | |
| Anti-Ly6G | BD | Cat# 551460 | |
| BCA Protein Assay Kit | Pierce | Cat# 23227 | |
| C-Tubes | Miltenyi Biotech | Cat# 130-096-334 | |
| CD11b MicroBeads | Miltenyi Biotech | Cat# 130-093-634 | |
| CD16/CD32 Antibody | Thermo Fisher Scientific | Cat#14-0161-82 | |
| Cytofix/Cytoperm Kit | BD | Cat# 554714 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | Cat# 41966029 | |
| Dulbecco´s Phosphate Buffered Saline (DPBS) | Gibco | Cat# 14190144 | |
| Falcon Round-Bottom Polystyrene Test Tubes | Thermo Fisher Scientific | Cat# 08-771-23 | |
| fixable viability dye | Thermo Fisher Scientific | Cat# L34969 | |
| Hibernate A medium | ThermoFisher | Cat# A1247501 | |
| LS-columns | Miltenyi Biotech | Cat# 130-042-401 | |
| Papain Dissociation System | Worthington | Cat# LK003150 | |
| Percoll | Th.Geyer | Cat# 17-0891-02 | |
| Petri dishes | Thermo Fisher Scientific | Cat# 11339283 | |
| pHrodoRed | Thermo Fisher Scientific | Cat# P36600 | |
| Protease inhibitor | Roche | Cat# 5892970001 | |
| Red Blood Cell Lysis Buffer | Sigma | Cat# 11814389001 | |
| Steritop E-GP Sterile Filtration System | Merck | Cat# SEGPT0038 | |
| SynPer Solution | ThermoFisher | Cat# 87793 | |
| vGLUT1 Antibody | Miltenyi Biotech | Cat# 130-120-764 |
References
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and Disease. Annu Rev Physiol. 79, 619-643 (2017).
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci. 10 (11), 1387-1394 (2007).
- Tremblay, M. &. #. 2. 0. 0. ;., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biol. 8 (11), e1000527 (2010).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Schafer, D. P., et al. Microglia contribute to circuit defects in Mecp2 null mice independent of microglia-specific loss of Mecp2 expression. eLife. 5, e15224 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 74 (4), 691-705 (2012).
- Filipello, F., et al. The microglial innate immune receptor TREM2 is required for synapse elimination and normal brain connectivity. Immunity. 48 (5), 979-991 (2018).
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nat Med. 23 (9), 1018-1027 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Di Liberto, G., et al. Neurons under T cell attack coordinate phagocyte-mediated synaptic stripping. Cell. 175 (2), 458-471 (2018).
- Bisht, K., et al. Dark microglia: A new phenotype predominantly associated with pathological states. Glia. 64 (5), 826-839 (2016).
- Weerasinghe-Mudiyanselage, P. D. E., et al. Structural plasticity of the hippocampus in neurodegenerative diseases. Int J Mol Sci. 23 (6), 3349 (2022).
- Aw, E., Zhang, Y., Carroll, M. Microglial responses to peripheral type 1 interferon. J Neuroinflammation. 17 (1), 340 (2020).
- Brioschi, S., et al. Detection of synaptic proteins in microglia by flow cytometry. Front Mol Neurosci. 13, 149 (2020).
- Norris, G. T., et al. Neuronal integrity and complement control synaptic material clearance by microglia after CNS injury. JEM. 215 (7), 1789-1801 (2018).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), 7944 (2020).
- Jaszczyk, A., Stankiewicz, A. M., Juszczak, G. R. Dissection of mouse hippocampus with its dorsal, intermediate and ventral subdivisions combined with molecular validation. Brain Sci. 12 (6), 799 (2022).
- Fixable viability dyes for flow cytometry. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/flow-cytometry/flow-cytometry-assays-reagents/cell-viability-assays-flow-cytometry/fixable-viability-dyes-flow-cytometry.html (2024)
- SynPER synaptic protein extraction reagent. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/87793?gclid=CjwKCAiAi6uvBhADE_iwAWiyRdigrNHuDkIAVVsaW8OaC3VJNgrPEm1I64E2P (2024)
- Wu, A., Yu, B., Komiyama, T. Plasticity in olfactory bulb circuits. Curr Opin Neurol. 64, 17-23 (2020).
- pHrodo indicators for pH determination. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/brands/molecular-probes/key-molecular-probes-products/phrodo-indicators.html (2024)
- Rangaraju, S., et al. Differential phagocytic properties of CD45low microglia and CD45high brain mononuclear phagocytes-activation and age-related effects. Front Immunol. 9, 405 (2018).
- Weinhard, L., et al. Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction. Nat Commun. 9 (1), 1228 (2018).
- Morizawa, Y. M., et al. Synaptic pruning through glial synapse engulfment upon motor learning. Nat Neurosci. 25 (11), 1458-1469 (2022).
- Morini, R., et al. Strategies and tools for studying microglial-mediated synapse elimination and refinement. Front. Immunol. 12, 640937 (2021).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: J. Int Soc Anal Cytol. 69 (9), 1037-1042 (2006).
- . Strategies for intracellular flow cytometry success Available from: https://www.biocompare.com/Editorial-Articles/582159-Strategies-for-Intracellular-Flow-Cytometry-Success/ (2022)
- . Isotype control antibodies, Key points Available from: https://www.antibodies.com/primary-antibodies/isotype-control-antibodies#:~:text=Isotype%20controls%20should%20be%20used (2024)
- Flow cytometry intracellular staining controls. Bio-Rad Available from: https://www.bio-rad-antibodies.com/flow-cytometry-intracellular-controls.html (2024)
- Dissing-Olesen, L., et al. FEAST: A flow cytometry-based toolkit for interrogating microglial engulfment of synaptic and myelin proteins. Nat Commun. 14, 6015 (2023).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of general and discriminating markers of differential microglia phenotypes. Front Cell Neurosci. 14, 198 (2020).
- van Wageningen, T. A., et al. Regulation of microglial TMEM119 and P2RY12 immunoreactivity in multiple sclerosis white and grey matter lesions is dependent on their inflammatory environment. Acta Neuropathol Commun. 7 (1), 206 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved