揭开查加斯病小鼠模型的体内生物发光成像的神秘面纱,用于药物疗效研究
In This Article
Summary
此处提供的方案描述了在 克氏锥虫 感染的生物发光模型中进行药物疗效研究的详细步骤,重点是数据采集、分析和解释。此外,还提供了故障排除和质量控制程序,以最大限度地减少技术问题。
Abstract
为了控制和减少美洲锥虫病、利什曼病和非洲人类锥虫病等人类原生动物疾病对公共卫生的影响,有必要加快新药和疫苗的开发。然而,这个过程充满了困难,例如高度复杂的寄生虫生物学和疾病发病机制,并且与被忽视的热带病一样,研发资金相对有限。因此,能够充分再现感染和疾病关键特征同时提供合理利用资源的 体外 和 体内 研究模型对于推进这些疾病的研究至关重要。一个例子是用于美洲锥虫病的 体内 生物发光成像 (BLI) 小鼠模型,该模型可对表达荧光素酶的克 氏锥 虫寄生虫产生的长波长光进行高灵敏度检测。尽管这项技术已成为 体内药物疗效 研究的标准方法,但由于缺乏关于设备处理和质量控制程序应用的适当实践培训,即使合适的 BLI 设备随时可用,研究小组也可能难以实施它。考虑到这种情况,该协议旨在指导从规划实验到数据采集和分析,其细节有助于在对 BLI 经验很少或没有经验的研究小组中实施协议,无论是针对美洲锥虫病还是其他传染病小鼠模型。
Introduction
美洲锥虫病在拉丁美洲流行,影响全球约 700 万人1。每年,超过 50,000 人死亡,约 70 亿美元的经济损失是由这种疾病的致残性质造成的2。美洲锥虫病是由原生动物克氏锥虫引起的,这是一种异异型鞭毛寄生虫,能够感染美洲的哺乳动物(野生和家养)和锥蝽媒介(半翅目、Reduviidae)3,并在那里建立了媒介传播。其他重要的感染途径包括输血、器官移植、口服(通过摄入被感染的锥蝽污染的食物)4 和先天性传播。非媒介传播途径导致美洲锥虫病向非流行地区传播 3,5。
美洲锥虫病表现为两个临床阶段。在大多数情况下,急性期无症状。有症状的感染通常与非特异性体征有关,例如发热、疲劳、肌痛、淋巴结肿大、脾肿大和肝肿大。急性期也常与未闭寄生虫血症和寄生虫的全身循环有关。高达 10% 的确诊病例可能发生死亡,尤其是口腔感染6。慢性期通常以长时间没有任何症状为特征。随着时间的推移,大约三分之一的几十年前感染的患者表现出心脏表现,通常伴有纤维化和心肌炎症,和/或胃肠道疾病,主要与巨食管和/或巨结肠综合征的发展有关3,5,6。
恰加斯病的病因治疗仅包括两种药物:苄硝唑和硝呋替莫。这些抗寄生虫药已经上市 50 多年,具有相当大的毒性和有限的疗效 5,7,8。因此,迫切需要为美洲锥虫病患者开发新的、安全的、更有效的治疗方法。
更复杂、更准确的技术现在可以获得老问题的答案,从而在寻找美洲锥虫病的新治疗方法方面取得进展。从这个意义上说,科学界从转基因寄生虫中受益匪浅,用于感染过程的体内研究和药物疗效评估 9,10,11,12。基于生物发光成像 (BLI) 系统的纵向测定允许在治疗方案期间和之后评估疗效,从而鉴定出具有杀锥虫活性的化合物10,13。BLI 方法通过定量转基因克氏毛萤火虫 CL Brener Luc::Neon 谱系11 产生的光,组成型表达红移萤火虫荧光素酶12,直接测量循环或组织和器官中的寄生虫负荷。
尽管如此,在美洲锥虫病 BLI 动物模型和药物疗效研究建立近 10 年后,只有少数研究小组主导了这项技术。这一事实不仅是由于获得适当成像设备的机会减少,而且缺乏培训和结构化、详细的协议的可用性。与其他方法相比,这种方法具有几个优势,其他方法依赖于通过显微镜、血清学或通过 qPCR 进行器官/组织感染评估来评估寄生虫血症以进行寄生虫 DNA 检测,因为它可以改善小鼠健康状况并减少动物使用,从而有可能在体内产生更强大和综合的数据。此外,这种方法可以说更敏感,因为它能够在药物治疗后随时检测内脏器官中的寄生虫病灶10,12。因此,该协议旨在通过详细说明技术程序来指导寄生虫学和其他传染病的研究小组在其实验室中建立该方法。在这里,我们分享了通过在巴西实施美洲锥虫病 BLI 模型获得的经验,这是拉丁美洲的首个此类模型,这是被忽视疾病药物倡议 (DNDi) 协调的药物发现工作的一部分。
Protocol
本协议中描述的所有程序均根据圣保罗大学 Instituto de Ciências Biomédicas 动物伦理委员会预先制定的准则14 提交、批准和执行:协议 CEUA ICB/USP no 5787250522。
1. 解决方案
注:考虑 10 mL/kg 的预给药体积(小鼠 20 g 重量为 200 μL)15,16。例如,制备 15 mg/mL 的工作溶液以达到 150 mg/kg 的动物剂量。
- 羟丙基甲基纤维素悬浮液 (HPMC-SV)
注:所需的试剂是 0.5% (w/v) 羟丙基甲基纤维素 (HPMC)、0.4% (v/v) Tween 80 和 0.5% (v/v) 苯甲醇。- 对于 200 mL 的载体溶液,称取 1 g HPMC 并溶于 64 mL 热超纯水中。搅拌 2 分钟。
- 加入 120 mL 冰冷的超纯水并搅拌 1 小时。加入 1 mL 苯甲醇。
- 然后使用反向移液技术加入 0.8 mL 的 Tween 80 并继续搅拌,直到溶液变得透明。
- 调整溶液,使最终体积为 200 mL。将 HPMC-SV 在冷藏 (4 °C) 下储存最多 3 个月。
- 苄硝唑
- 计算所需的复合溶液量,如下:
化合物溶液的体积 = (每天的剂量数 x 天数 x 待治疗的小鼠数 x 每只小鼠的给药体积) + 30% 额外。 - 考虑到所需剂量,称取必要量的苄硝唑 (BZ)。对于根治性治疗,口服剂量 100 mg/kg,每天一次,持续 10 天,在 CD 慢性模型17 中达到 100% 治愈。
- 考虑到所需的最终体积,计算达到 5% (v/v) DMSO 浓度的适量,并将 BZ 完全溶解在纯 DMSO 中。
- 将适当体积的载体添加到玻璃管中,以达到 95% (v/v) HPMC-SV 的浓度。将溶解在 DMSO 中的 BZ 转移到含有 HPMC-SV 的玻璃管中。强烈均质悬浮液并将其储存在 4 °C。
例如:BZ 制剂的最终体积 = 10 mL(步骤 1.2.1)
BZ 的量 = 100 毫克(步骤 1.2.2)
5% DMSO = 0.5 mL(步骤 1.2.3)和 95% HPMC-SV = 9.5 mL(步骤 1.2.4) - 在每次给药前,将制剂置于37°C的超声水浴中5分钟,并在动物给药前剧烈匀浆。
- 计算所需的复合溶液量,如下:
- 环磷酰胺
- 将所需量的环磷酰胺溶于超纯水中,得到 12.5 mg/mL 溶液。
- 通过过滤对溶液进行消毒并储存在 4 °C。
- Giemsa 染色
- 将 0.6 mg Giemsa 粉末试剂溶于 50 mL 甲醇中。加入 25 mL 甘油并混合。使用滤纸和漏斗去除沉淀物。将储备液储存在室温 (RT) 下,避光保存。
- 在 90 mL 混合磷酸盐缓冲液(pH 7.2 下,20.5 M Na2HPO4、65.4 M KH2PO4 )中稀释 10 mL Giemsa 溶液,制备工作溶液。
2. 克氏锥虫 培养
- 在生物安全柜 (BSC) 中工作,在 LIT 培养基(68.44 mM NaCl、5.36 mM KCl、112.7 mM Na2HPO4、5 g/L 胰蛋白胨、5 g/L 肝脏输注肉汤、0.03 M 血红素、4.16 mM 葡萄糖)中培养 4 x 106 个上鞭毛体/mL,补充有 10% (v/v) 胎牛血清 (FBS), 100 μg/mL 青霉素、100 U/mL 链霉素和 150 μg/mL 潮霉素作为 28 °C 下的选择性药物。 寄生虫通常在 3-4 天内达到稳定期。
- 通过在 28 °C 下将 3 x 108 个表鞭毛体在 10 mL Grace 昆虫培养基中与 10% (v/v) FBS 在 15 mL 锥形管中孵育 7-10 天,诱导变环生成以获得感染性寄生虫。
- 通过 Giemsa 染色涂片评估分化率。为此,将 20 μL 分化的寄生虫涂抹在载玻片中并干燥 10 分钟。
- 在通风橱中,用纯甲醇覆盖载玻片进行样品固定,并完全干燥(1-2 分钟)。用 Giemsa 工作溶液覆盖载玻片 20 分钟。
- 用蒸馏水轻轻清洗载玻片。在显微镜下,计算准环锥鞭毛体的百分比。如果达到至少 10% 的区分率,请继续执行下一步。
- 离心寄生虫(120 x g 10 分钟)并用 10 mL DPBS 重悬沉淀。再次离心并将寄生虫重悬于 5 mL 补充有 10% (v/v) FBS、100 μg/mL 青霉素和 100 U/mL 链霉素的 DMEM 中。
- 在 25 cm2 培养瓶中,在 37 °C 和 5% CO2 中,在加湿培养箱18 中对 1.66 x 105 LLC-MK2 细胞(来自猕猴的肾上皮细胞)进行感染。
- 组织培养的锥鞭毛体 (TCT) 在 8-9 天后释放到培养基中。用 TCT 以 1:40 的感染倍数 (MOI) 感染新鲜的 LLC-MK2 细胞单层。
3. 用流式细胞仪分析 克氏锥虫 种群同质性
- 收集 CL Brener Luc::Neon 和 CL Brener 野生型菌株的 TCT,以 120 x g 离心 10 分钟,并将 TCT 重悬于 DPBS 中。调整寄生虫密度以达到 1 x 106/mL。
- 通过流式细胞仪基于 mNeonGreen 荧光(例如 506/em. 517 nm)19 进行群体分析,为每个样品获取至少 20,000 个事件。
注:荧光种群百分比是通过比较野生型与转染的寄生虫获得的。为了继续小鼠感染,应达到 CL Brener Luc::Neon 谱系的至少 95% 的荧光寄生虫种群(补充图 1)。
4. 小鼠实验性感染
注:为了增加寄生虫的数量,经常从免疫缺陷小鼠那里获得血流锥鞭毛体 (BT)10,13。在这里,使用 BALB/C 小鼠的化学免疫抑制来获得 BT。为此,通过以 62.5 mg/kg 的间隔以 96 小时的间隔腹膜内注射四次环磷酰胺 (CTX) 来实现轻度免疫抑制,这与克氏锥虫感染同时进行。
- 在 T. cruzi 感染前 62.5 天通过腹膜内注射 (ip) 施用 1 mg/kg 无菌环磷酰胺。
- 通过腹膜内途径,用 0.2 mL DPBS 中的 1 x 104 个 TCT 感染每只小鼠。注意处理病原体和针头时发生事故的高风险。在 BSC 中进行感染,在整个过程中戴上手套和面罩。
- 通过直接观察血液中的 BT(Pizzi-Brener 方法)每天监测寄生虫血症20。在寄生虫血症高峰期,感染后 (dpi) 约 13-17 天,进行血液采集。为此,用 100 mg/kg 氯胺酮和 10 mg/kg 甲苯噻嗪麻醉小鼠。
- 当小鼠完全麻醉时21,使用 1 mL 注射器进行心脏穿刺,该注射器连接到含有 50 μL 3.8% (w/v) 柠檬酸钠的 24 G X3/4 针头。拔下针头,轻轻地将血液放入离心管中。
- 在 BSC 中,在氯化铵钾 (ACK) 裂解缓冲液中稀释等分试样的血液,并在 Neubauer 腔室中计数寄生虫。重复此过程至少两次,因为小血凝块会影响寄生虫计数。
注:为防止计数错误,请调整稀释因子以避免在 Neubauer 腔室中计数低于 30 和高于 300 个锥鞭毛体。 - 通过在 DPBS 中混合必要量的纯血,将寄生虫密度调节至 5 x 103 BT/mL。
- 使用 26 G 针(较窄的针头导致寄生虫裂解),通过腹膜内途径,用每只小鼠 0.2 mL DPBS (5 x 103 BT/mL) 中的 1 x 103 BT 感染非免疫抑制的 BALB/c 小鼠22。腹膜内注射体积后,将针头放在鼠标内 5 秒以避免回流。
- 将受感染的小鼠暂时放在一个带有纸巾的盒子中,以识别潜在的渗漏或出血,然后将小鼠放回笼子中。
5. 活体 成像
注意:此处使用的术语表如下:
成像会话:在给定的一天对某个实验的所有组进行生物发光采集。 图 1A 显示了该过程的概述。
成像回合:在三只小鼠的亚组中进行的手术,从 D-荧光素注射到麻醉恢复。建议每个实验组包含 6 只小鼠,因为小鼠的寄生虫负荷的内在变异性以及影响 BLI 定量的其他因素如下所述。
成像采集:由成像设备进行拍摄以量化生物发光,从而产生照片的图像叠加和量化的生物发光显示为伪彩色刻度。
成像程序:本实验方案中讨论的所有步骤。
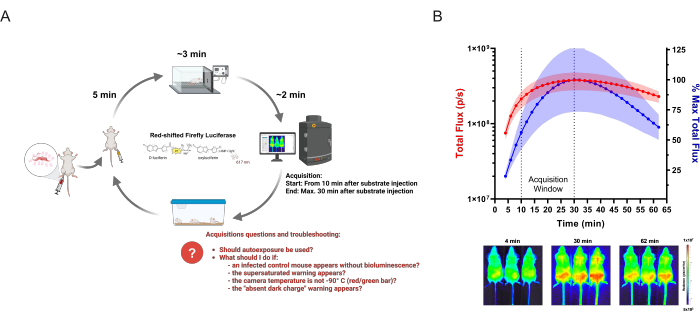
图 1:获取 BLI 数据。(A) 以美洲锥虫病生物发光小鼠模型为例,应用于传染病研究的采集工作流程示意图。通过在既定时间点上通过体内成像分析感染转基因克氏锥虫的小鼠。在每轮成像中,向最多三只小鼠的一组注射150mg / kg的酶底物(D-荧光素)。5分钟后,在氧气中以2.5%(v / v)异氟醚进行麻醉。当完全静止时,将小鼠置于成像系统中,并按照定义的设置开始采集。成像后,小鼠从麻醉中恢复并被送回笼子。常见问题以及研究人员在采集过程中可能遇到和面临的问题以红色突出显示。此方案已从 Lewis et al. (2014)12(使用 BioRender.com:UD26KWEVS2 创建)修改而来。(B) D-荧光素/红移萤火虫荧光素酶 (PpyRE9h) 的体内动力学。麻醉克氏毛滴虫寄生虫血症峰值 (n = 3) 的小鼠并注射 150 mg/kg D-荧光素。获取图像 1 小时(曝光时间:2 分钟;合并:4)。顶部:腹侧总通量 (p/s) 量化(左 Y 轴,红色)和最高平均测量值的百分比(右 Y 轴,蓝色)。数据显示为平均值 (曲线) 和标准差 (阴影区域)。底部:第一个 (4 分钟)、最高 BLI 信号 (30 分钟) 和最后一个 (62 分钟) 时间点的采集图像。请单击此处查看此图的较大版本。
- 检查 Acquisition 窗口中的绿色条,以验证电荷耦合器件 (CCD) 相机是否处于低温 (-90 °C) 状态。单击条形(绿色或红色)以可视化温度。
注意:根据成像设备手册,成像设备和软件应始终开启,以保持 CCD 低温。 - 验证是否执行了自动背景调整。为此,请单击 Acquisition > Background > View available Dark Charge。将出现一个包含多个设置组合的列表。
注意:此过程可减少发光噪声。如果所选配置导致的值高于 1000,则根据公式“曝光时间 x (binning²)”,则不应忽略暗电荷。根据软件配置,分箱可以显示为数字(分箱因子)或从“小”到“大”的范围。范围和分档因子之间的对应关系可以在设备手册中找到。 - 如果未显示 活动窗口 (软件底部的白色区域),请在 菜单视图 > 活动窗口 启用它。
- 通过单击 “采集窗口”>“视野”来设置成像区域。选项 C (13.2 cm) 获得 3 只小鼠, 选项 D (22 cm) 获得 5 只小鼠。
- 通过单击 Acquisition > Auto-Save 并选择自动保存选项,然后为每个时间点选择或创建一个新文件夹。
- 在成像区域铺一张哑光黑纸,并将分区玻片垂直放置在入口之间。如果制造商没有提供幻灯片,请使用磨砂黑纸 (3 厘米 x 15 厘米)。
- 调整成像室的内部区域,以将玻璃鼻锥与麻醉入口相适应。使用小块黑色电工胶带将麻醉系统连接到平台上(图像区域外)。
注意:在某些版本的成像设备中,激光定义成像区域。如果此工具不可用,请通过软件获取图像以检查成像区域内的分区载玻片。 - 将异氟醚蒸发器设置为成像和感应室的氧气中 2.5% (v/v)。通过压力表检查气体是否流经系统21。
注意:如果成像设备没有连接吸入麻醉系统,则可以使用其他麻醉选项,例如注射甲苯噻嗪和氯胺酮23。在这种情况下,小鼠恢复缓慢,死亡风险高24。 - 用 D-荧光素填充注射器(31 G 针头)(制备 D-荧光素的综合方案由不同的供应商提供)25,26,保护它们免受阳光直射,并准备一些塑料容器或额外的笼子用纸巾覆盖内部。
- 在附近放置一个时钟/手表以轻松跟踪时间,并放置一个实验室笔记本来记录小鼠组、荧光素注射时间和手术过程中的任何其他信息。
- 称量所有小鼠并记录它们的体重。用钢笔记号笔或尾巴上的纹身标记每只鼠标。在整个实验过程中保持小鼠识别的良好显示。此步骤也可以在采集前一天执行。
注意:标记不应占据较大的主体区域,因为墨水可能会干扰生物发光信号。不同颜色的永久性标记也有助于区分各组。 - 要启动成像会话,请注册背景发光图像(设置: 曝光时间:5 分钟; Binning: 'large' 或 '16', f/stop: 1) 没有鼠标的成像室。此程序有助于识别设备上的自动发光光源或意外问题。
注意:由于 BLI 基于酶促反应,因此时间是实验的基本特征。在开始处理动物之前,请检查上面列出的所有项目和设备设置。 - 在前 3 只小鼠中注射 150 mg/kg (ip) 的 D-荧光素,而不到达内脏器官。将小鼠放入容器盒中,以评估 D-荧光素是否泄漏(亮黄色溶液)。如果发生这种情况,请记下并记录小鼠组和 D-荧光素注射时间。
- 等待 5 分钟,然后将小鼠转移到麻醉诱导室。打开系统。小鼠完全麻醉大约需要 3 分钟(没有反应,如颤抖腿、尾巴等)21.
- 打开成像设备的门,打开流向成像室的麻醉剂,同时关闭感应室。
- 将每个鼠标放在鼻锥位置:从鼠标 1-3,从左到右侧。轻轻地将小鼠腹面朝上容纳在激光显示的成像区域内。在住宿期间,验证老鼠的 ID 和位置。不要强行进入鼻锥中部分麻醉的小鼠。
- 将隔板放在小鼠之间,然后关闭成像设备的门。
- 在软件 Acquisition (采集) 窗口中调整采集设置,如下所示:
- 对于未感染的小鼠, 暴露时间 = 5 分钟 / 像素合并 = “大” 或 “16”
(用于设置阈值的最数学敏感的配置集)。 - 对于急性模型中受感染的小鼠: 暴露时间 = 2 分钟/ 分档 = 'medium' 或 '4'。
- 对于慢性模型中受感染的小鼠: 暴露时间 = 5 分钟/ 像素合并 = '大' 或 '16'。
- 对于未感染的小鼠, 暴露时间 = 5 分钟 / 像素合并 = “大” 或 “16”
- 验证 D-荧光素注射时间是否在开始采集前至少 10 分钟进行。如果没有,请等待必要的时间以在荧光素酶信号峰值期间获得图像(图 1B);否则,单击 Acquire 开始成像采集。
- 映像开始后,将出现 Image Labels 窗口。在框中填写有关每组的适当信息,包括荧光素注射时间、实验、小鼠识别、时间点以及任何其他有助于保存记录的所需信息。此信息将包含在测量表文件中。
- 验证成像采集结束时是否显示警告标志 Saturated Image 。饱和图像是不可接受的。如果发生这种情况,请减少像素合并并获取新图像。记下分析中要考虑的笔记。
- 获取图像后,打开成像机门,将小鼠转向背视图(背面朝上)。再次执行客户获取并相应地标记它。
- 在此成像采集结束时,关闭麻醉剂流。轻轻地将小鼠从成像室中取出并将它们放入容器中。
- 在观察麻醉恢复的同时记录小鼠的体重。记录手术过程中发现的任何异常行为或身体异常。一旦老鼠恢复活动,就把它们放在笼子里。
注意:验证每个采集的图像的 BLI 强度。采集结束后,记录的生物发光图像和照片将以不应考虑的自动刻度显示在软件上。在 工具调色板 窗口上设置数据分析中定义的比例(如下所述)。
6. 数据分析
注意:上述协议基于商业 体内 成像软件。但是,软件免许可证版本可以执行最基本的分析。软件详细信息可在 材料表中找到。
- 打开文件。
- 通过选择 Menu File > Browser > Select the folder (图2A - 步骤1)打开包含从某个成像时间点采集的数据的文件夹(图2A - 步骤1)。
注意:将以表格格式打开一个新窗口,所有采集的数据都保存在所选文件中。它将显示 点击编号 符号,这是软件自动提供的图像 ID(数据和小时数字)、研究人员在采集期间在 图像标签 窗口中提供的信息以及采集设置。所有这些数据都有助于对可用于分析的图像进行排序,因为不能使用饱和图像。 - 选择与所选图像相关的多行,包括未感染的控件。记下实验室笔记本中的映像 ID 以及在映像会话期间注册的信息。
- 通过单击组合所选图像 Load as Group.此过程将创建一个新的序列图像。因此,可以同时调整所有图像的特征。将新序列图像保存在与步骤 6.1 中使用的文件夹不同的新文件夹中,以便在需要时重新分析原始数据。
- 在序列图像中,通过单击 “选项”>“显示”>“选择合并因子 ”来确定用于每个图像的合并(图 2A - 步骤 2)。获取的像素合并因子将显示在序列中每张图像的顶部。
- 将所有分箱因子更正为相同的数字。为此,请双击要调整的图像。在 “工具调色板 ”窗口 >“图像调整 ”部分,选择合适的合并因子(图 2A - 步骤 3) - 有关合并因子的选择,请参见步骤 5.18。在所有发散图像中执行此过程。
注:此过程直接影响 BLI 定量(表 1),并在讨论部分进一步讨论。
- 通过选择 Menu File > Browser > Select the folder (图2A - 步骤1)打开包含从某个成像时间点采集的数据的文件夹(图2A - 步骤1)。
- 设置比例。
- 根据未感染的对照区分有效的生物发光信号(根据设备手册超过 600 计数)。为此,双击未感染小鼠的图像。然后,在新窗口的左上角,选择 Counts 选项 Units 字段。然后,将 Color Scale 调整为最小值 600。生成的图像将是设置最小辐射比例的基线。
- 在序列窗口处于活动状态时,在 Units 字段中选择选项 Radiance。调整 色阶 和 颜色表 在工具调色板中。为此,请禁用 Color Scale Limits 区域中的 Individual 框。
- 标记对 数刻度 和 手动 框(图 2A - 步骤 4)。根据未感染的对照(如步骤 6.8 中观察到的)和具有最高信号的区域设置为最大值(如 图 2A 中的箭头所示)设置最小刻度数字。
注意:体内 2D 光测量是一种相对量化。由于每个设备的版本和校准不同,可以找到不同的刻度值。因此,代表性结果中证明的值不能适合在其他设备上进行的其他实验,但根据内部对照(未感染和未处理的感染)同样有效。 - 为所有图像设置相同的比例后,双击每个图像,最大化窗口,然后使用 Export Graphics (导出图形 ) 按钮以图像格式(.jpg、.tiff 等)导出图像视图,并按 treatment_miceID_time点命名文件。(图 2A - 步骤 5)。对所有图像执行此过程。
- 执行测量。
- 从序列中选择任何图像并双击它。在 Tool Palette 窗口> ROI 工具部分,单击 方形 按钮(图 2B - 步骤 1)并绘制一个覆盖整个鼠标的矩形。
- 单击创建的 ROI 的边框,然后为每个鼠标复制并粘贴相同的 ROI(在图像中产生三个 ROI)。通过单击 ROI 工具 部分上的保存来保存 ROI。通过选中 Apply to Sequence 框,然后单击 Load ,为所有图像应用保存的 ROI。 保存的 ROI 将用于整个实验中的所有小鼠。
- 调整每只鼠标的 ROI 位置,以更好地适应动物在测量区域中的位置。标记所有小鼠后,单击 “测量 ROI” 按钮(图 2B - 步骤 2)。此时将出现 ROI Measurements Table 。选择 测量类型:辐射度;image attributes:所有可能的值;ROI 尺寸:厘米。然后,点击 选择全部 按钮,然后 复制 按钮。
- 将数据直接粘贴到表格分析软件(电子表格)中。或者,以 .csv 或 .txt 格式导出文件。
- 处理数据。
- 在表格分析软件中,按组(治疗、对照、未感染、未处理等)组织数据。
- 寄生虫载量显示为全身生物发光。因此,排列数据以匹配同一小鼠的腹侧和背侧总通量值,并将它们相加。
- 计算考虑每组的求和值的平均值和标准差(例如: 补充表 1)。将数据绘制到绘图和统计软件中。
- 在图像或幻灯片演示软件中准备带有生物发光图像的面板。将每只小鼠放在一列中,将每个时间点放在行中,以构建药物疗效矩阵,以促进数据的可视化和解释。
注意:有一个选项可以将图像直接构建到成像软件中,而无需执行步骤 6.2.4(查看>图像布局窗口)。但是,软件界面和工具限制了数据组织。
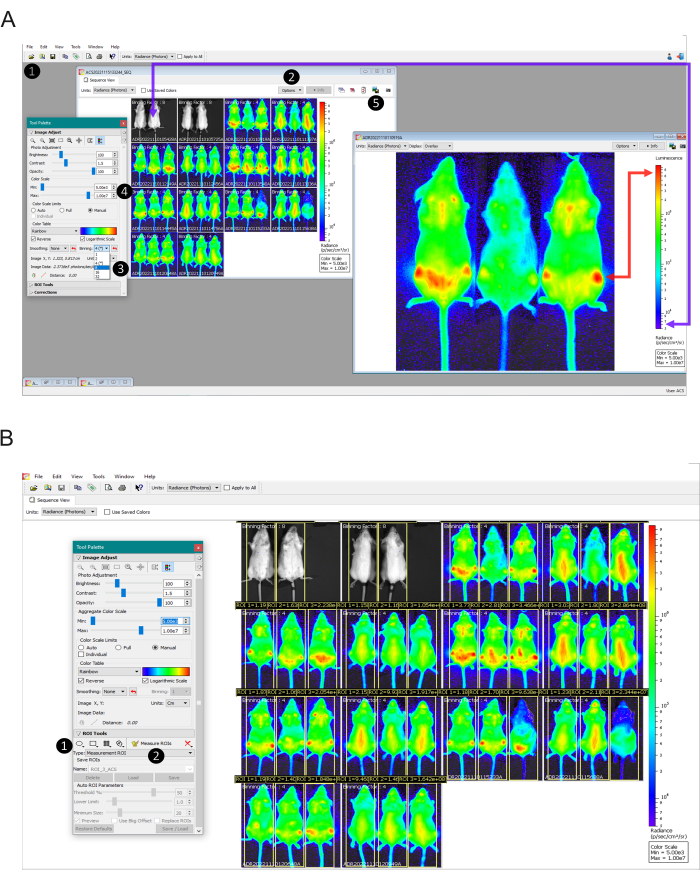
图 2:从设置图像比例到量化发光的数据分析步骤。 (A) 用于图像数据处理的 Living Image Software 视图。第 1 步:使用 浏览器 工具。第 2 步:确定用于每次采集的像素合并(将显示在单个图像的顶部)。第 3 步:将受感染小鼠的所有图像设置为相同的分档因子,并对未感染的小鼠应用分档因子 16。第 4 步:根据未感染的小鼠(紫色箭头)手动设置色标,该小鼠应在屏幕上显示为非生物发光,而感染和未处理的小鼠位于最高的生物发光焦点(红色箭头),应显示为红色。第5步: 要获取没有任何书面信息的图像,请双击每张图像并使用 导出图形 按钮。(b) 感兴趣区域视图 (ROI) 工具。第 1 步:绘制一个完全覆盖小鼠的 ROI,然后为每只动物复制并粘贴相同的 ROI。保存调整后的 ROI 并将其应用于实验中的所有图像。第 2 步:点击 Measure ROIs 按钮生成要导出为 .csv 或 .txt 的表格。 请单击此处查看此图的较大版本。
7. 离体 程序
- 在小鼠中腹腔注射 150 mg/kg D-荧光素(每 体外 一轮)并等待 3 分钟。使用 100 mg/kg 氯胺酮和 10 mg/kg 甲苯噻嗪腹腔注射麻醉小鼠。
- 在生物安全柜中,当小鼠对捏爪子完全没有反应时,切开小鼠皮肤以露出腹膜(不打开腹膜腔)和左侧腋窝的组织。通过切开腋动脉和血管进行放血。
- 使用一次性巴斯德移液器收集血液。然后通过心脏左心室灌注 10 mL 0.3 mg/mL 的 D-荧光素在 DPBS 溶液中。
- 将选定的器官放在培养皿上预先建立的位置上,并将它们浸泡在 0.3 mg/mL d-荧光素溶液中。此过程必须在最多 30 分钟内执行。
- 使用 5 分钟的曝光时间和分档 16 获取切除器官(心脏、肺、胸腺、肝脏、股四头肌、肠系膜、脾脏、肾脏、肾上腺、内脏脂肪、食道、胃、小肠、盲肠、结肠、脑、皮下脂肪、子宫、性腺脂肪、膀胱和腹膜)的发光图像,具体取决于信号强度(饱和图像不可接受)22。
注意:必须在未感染的小鼠之前对未感染的小鼠执行相同的过程,以设置阈值。
Representative Results
使用基于组成型表达荧光素酶的转基因寄生虫的适当小鼠模型,可以复制对宿主造成最小伤害的关键人类克 氏锥虫 感染特征,从而允许通过宿主的全身 BLI 以纵向(终生)方式实时跟踪寄生虫,长达数月12。
图 3 显示了 BALB/c 小鼠从感染后第 1 天到 150 dpi 的 CL Brener Luc::Neon 感染时间进程。在前 20 dpi 中,生物发光推断的寄生虫负荷增加,典型的寄生虫血症峰值,随后由于小鼠免疫控制,寄生虫负荷急剧下降。因此,感染的急性期被认为是前 50 dpi。当感染达到 100-150 dpi 的恒定生物发光速率时,即定义为慢性期。
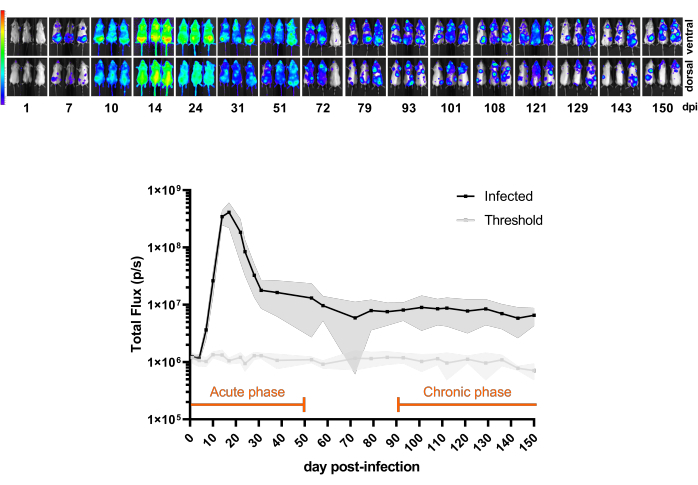
图 3:了解模型。 BALB/c 小鼠 CL Brener Luc::Neon 感染的动力学 (n = 11)。上图:通过腹膜内注射 1 x 10³ 血流锥鞭毛体感染后 150 天 (dpi) 来自不同时间点的腹侧和背侧生物发光图像。辐射中生物发光信号的热图比例(在 Log10 中)(p/s/cm2/sr)。颜色代码:紫色 = 5 x 103;红色 = 1 x 107.下图:全身小鼠总通量 (p/s) 中的生物发光信号定量。数据表示为均值 (线条) 和标准差 (阴影区域)。在该小鼠模型中为感染的急性和慢性期定义的时期以橙色突出显示。未感染小鼠的发光平均值 (n = 3) 显示为阈值(浅灰线)。 请单击此处查看此图的较大版本。
治疗结果也可以预测,因为感染的主要阶段在小鼠模型中得到了很好的再现。因此,BLI 现在通过概念验证研究应用于转化科学,这些研究支持有关化合物疗效潜力和开发管道进展的决策10,27。在急性小鼠模型中,当感染达到寄生虫血症高峰(约 14-21 dpi)时应开始口服治疗,其特征是血液中大量锥鞭毛体(约 1 x 105 个锥鞭毛体/mL - 数据未显示)和全身感染。在慢性期,小鼠治疗从 100 dpi 开始,此时寄生虫负荷相对较低,亚专利寄生虫血症稳定。
为了证明上述方案在抗寄生虫药评估中的应用,我们比较了用于治疗查加斯病的标准药物苄硝唑 (BZ) 和泊沙康唑 (Posa) 的治疗效果,泊沙康唑 (Posa) 是一种甾醇 14α-脱甲基酶 (CYP51) 抑制剂,在查加斯病的临床试验中失败,并且也被证明在体外和体内作为抗克氏锥虫的抗寄生虫剂无效,包括本协议中描述的 BLI 模型 13,18,28,29,30。
对于急性小鼠模型,每组 6 只小鼠通过管饲法31 口服治疗 20 天,用 20 mg/kg 的 Posa 或 100 mg/kg 的 BZ,每天一次。小鼠也用 BZ 以 100 mg/kg 每天一次治疗 5 天,以评估短期治疗的效果。化合物消除后(治疗结束后 10 天),BLI 阴性小鼠受到免疫抑制,当未实现寄生虫学治愈时,这种情况会促进感染复发(图 4A)。Posa 处理导致治疗结束时生物发光推断的寄生虫负荷减少了 99.49% ± 0.27%(平均值±标准差),并且在药物化合物消除期间保持与未感染小鼠的相似水平(小鼠 #3 除外,在 40 dpi 时具有瞬态信号,小鼠 #2 在 44 dpi 时表现出较弱的 BLI 斑点)。与未治疗组相比,BZ 治疗 20 天后,治疗结束时生物发光推断的寄生虫负荷降低了 100% ± 0.01%。相比之下,用 BZ 短期处理 5 天导致 99.98% ± 0.03 dpi 时减少 19%(类似于阈值水平)。然而,在这种情况下,BLI 降低是短暂的,并且在随后的采集中,所有小鼠都表现出感染再激活(图 4B)。
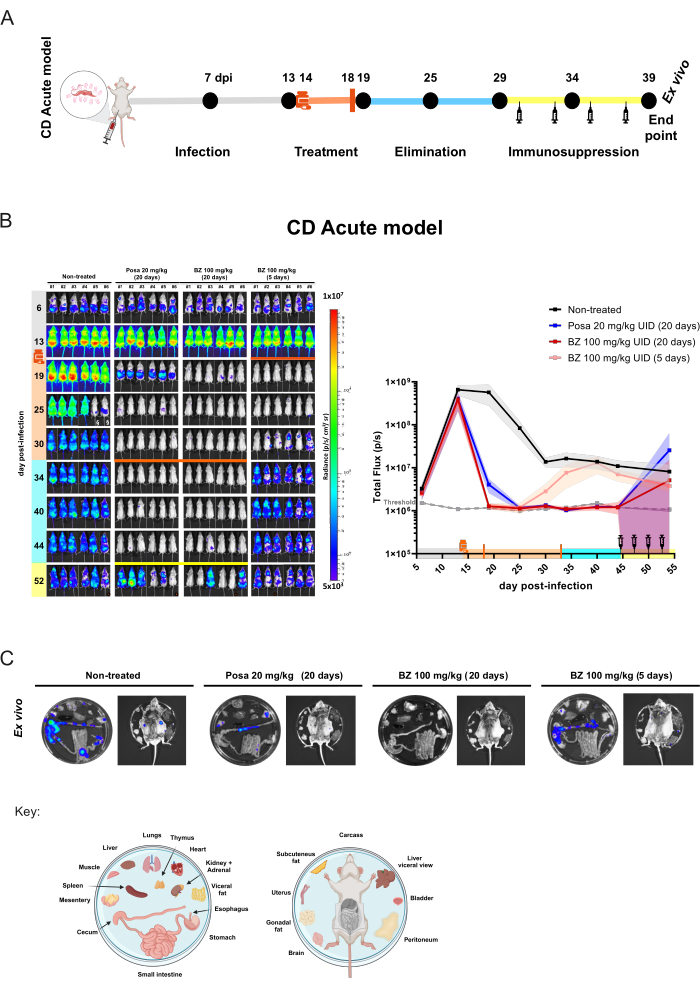
图 4:在恰加斯病急性模型中使用生物发光成像获得的概念验证实验设计和结果。(A) 急性恰加斯病小鼠模型中用于化合物疗效评估临床前研究的时间线过程示意图。黑点:成像时间点。药瓶和橙色条:分别是治疗开始和结束。注射器图标:环磷酰胺注射液。DPI:感染后 dI。颜色代码:灰色 = 未经治疗的感染;橙色 = 治疗期;蓝色 = 化合物消除阶段;黄色 = 免疫抑制期。(B) 克氏锥虫的治疗时间进程。左图:BALB/c 小鼠的腹侧生物发光图像 (i) 未处理或处理 20 天,(ii) 20 mg/kg 的泊沙康唑 (Posa),(iii) 100 mg/kg 的苄硝唑 (BZ) 处理 20 天,以及 (iv) 100 mg/kg 的 BZ 处理 5 天,(n = 6/组)。所有治疗均通过管饲法 (10 mL/kg) 口服给药,每天一次。Log10 比例热图表示生物发光信号强度,从低水平(蓝色)到高(红色)。右图:生物发光成像数据的全身量化。数据表示为均值 (线条) 和标准差 (阴影区域)。关键:药瓶:治疗开始 (14 dpi);橙色条:治疗结束 (18 dpi/33 dpi);注射器 ICON 环磷酰胺注射液(从第 44-53 天开始);橙点:通过离体程序分析的小鼠;§ 由于尿液中 D-荧光素渗漏而排除的数据。(C) 器官和组织中克氏锥虫病灶检测的离体程序。板分布键显示在图的底部 (使用 BioRender.com 创建:ZY26LG8AOF)。与 vivo 面板中所示的辐射度刻度相同。请单击此处查看此图的较大版本。
在该模型中,抗寄生虫治疗可能会将寄生虫载量降低到 1000 个寄生虫的 BLI 检测限以下。因此,小鼠表现为 BLI 阴性10。为了确保实现寄生虫学治愈,有必要使用环磷酰胺治疗促进小鼠的免疫抑制29,32。药物治疗后仍具有检测不到寄生虫负荷的小鼠在免疫抑制后会变为 BLI 阳性。这种效果在急性模型中的 Posa 治疗中得到了更广泛的体现,它促进了寄生虫的复发。在该实验中,对生物发光信号最低的小鼠进行 ex vivo 程序,以评估寄生虫组织嗜性(图 4C)。未经治疗的小鼠显示出强烈的生物发光信号,尤其是在胃肠道 (TGI) 和相关组织(如内脏脂肪和肠系膜)中。此外,皮肤是与寄生虫持久性相关的部位。用 Posa 处理的小鼠呈现强度较低的生物发光斑点,这些斑点更局限于结肠、肠系膜和内脏脂肪。另一方面,在用根治性治疗方案治疗的小鼠中,作为 BZ 100 mg/kg 持续 20 天,即使在免疫抑制下也没有检测到生物发光信号。因此,考虑到在促进生物发光信号上升到 1000 个寄生虫10 的阈值水平以上,并通过暴露内脏器官提高敏感性后,认为 BZ 100 mg/kg 持续 20 天提供无菌治愈。无菌治愈的评估先前已通过不同的技术验证10、13、17、33、34。
类似的研究设计应用于慢性模型(图 5A),其中小鼠 (n = 6/组) 在感染后第 100 天开始接受治疗。此时,口服 Posa 20 mg/kg、100 mg/kg 的 BZ 或 10 mg/kg,每天一次,持续 20 天。药物消除期后,BLI 阴性小鼠受到免疫抑制。此外,为了评估无菌治愈,对免疫抑制阶段结束时仍为 BLI 阴性的小鼠进行 离体 分析。
在慢性感染中,用 20 mg/kg 的 Posa 处理导致治疗结束时生物发光推断的寄生虫负荷降低 95.03% ± 6.18%,并且在药物消除期间保持在与未感染小鼠相似的水平。免疫抑制后,大多数小鼠表现出不同水平的 BLI 信号和分布(图 5B)。 离体 程序显示,一只用 Posa 治疗的全身 BLI 阴性小鼠在结肠中有一个生物发光点,可通过 离体 检查检测到(图 5C)。
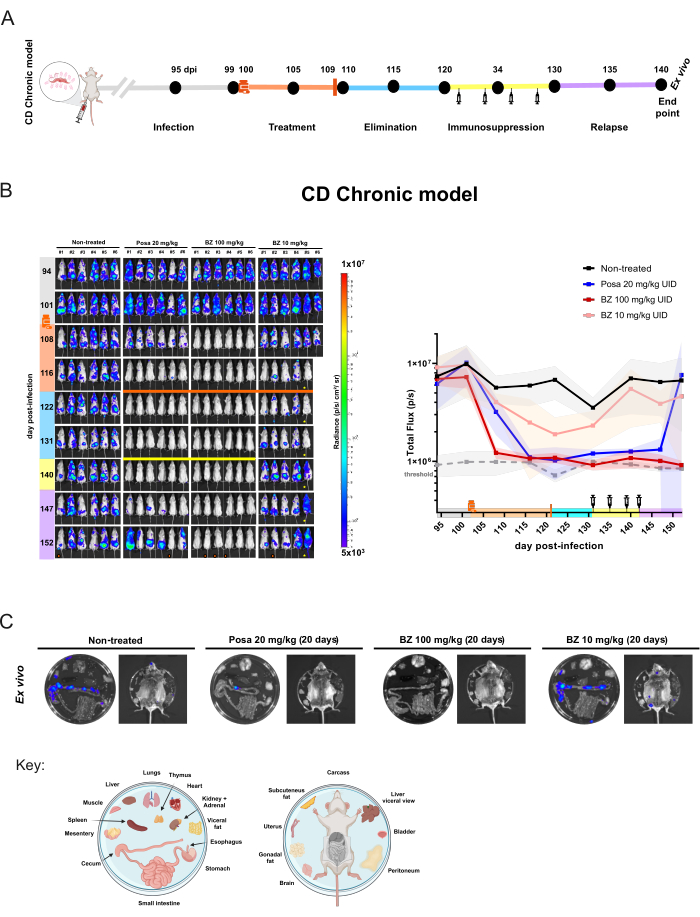
图 5:通过生物发光成像在克氏锥虫感染慢性模型中获得的药物评估实验设计和结果。 (A) 慢性恰加斯病小鼠模型的实验设计示意图。黑点:成像时间点。药瓶和橙色条:分别是治疗开始和结束。注射器图标:环磷酰胺注射液。Dpi:感染后 dI。颜色代码:灰色 = 未经治疗的感染;橙色 = 治疗期;蓝色 = 化合物消除阶段;黄色 = 免疫抑制;淡紫色 = 复发。(B) 美洲锥虫病慢性模型中治疗效果的纵向评价。左图:BALB/c 小鼠的腹侧 BLI (i) 未处理或用 (ii) 泊沙康唑 (Posa) 以 20 mg/kg 的剂量处理 20 天;(iii) 苄硝唑 (BZ) 为 100 mg/kg,和 (iv) BZ 为 10 mg/kg(n = 6/组)。所有治疗均通过管饲法口服给药,每天一次。右图:腹侧和背侧总通量原始数据的总和。关键:药瓶:治疗开始 (102 dpi);橙色条:治疗结束 (121 dpi);黄色条和注射器图标:环磷酰胺注射(从第 131-142 天开始)。橙点:通过离体程序分析的小鼠。!小鼠在麻醉期间死亡。 小鼠显示腹部异常。热图比例 (Log10) 以辐射单位表示生物发光强度,从低水平(3 × 105 为蓝色)到高(1 × 107 为红色)。(C) 组织中克氏锥虫嗜性的离体分析。用 100 mg/kg 的 Posa 和 BZ 处理后免疫抑制的体内 BLI 阴性小鼠或未处理组和 BZ 为 10 mg/kg 组中信号最低的小鼠的切除器官的生物发光检测。板分布键显示在图的底部(使用 BioRender.com:ZY26LG8AOF 创建)。辐射度标度等于体内面板。请单击此处查看此图的较大版本。
小鼠显示腹部异常。热图比例 (Log10) 以辐射单位表示生物发光强度,从低水平(3 × 105 为蓝色)到高(1 × 107 为红色)。(C) 组织中克氏锥虫嗜性的离体分析。用 100 mg/kg 的 Posa 和 BZ 处理后免疫抑制的体内 BLI 阴性小鼠或未处理组和 BZ 为 10 mg/kg 组中信号最低的小鼠的切除器官的生物发光检测。板分布键显示在图的底部(使用 BioRender.com:ZY26LG8AOF 创建)。辐射度标度等于体内面板。请单击此处查看此图的较大版本。
用 100 mg/kg 的 BZ 处理在 122 dpi 时将生物发光降低到阈值水平 (93.87% ± 2.14%),并向前直到实验结束。考虑到 离体 分析,BZ 实现了 100% 的治愈率 (6/6 只小鼠),因为即使检查免疫抑制和内部器官,也没有小鼠出现生物发光信号的恢复。这意味着没有复发。尽管如此,较低浓度的 BZ 治疗方案导致生物发光略有降低 (85.95% ± 18.43%)但没有治愈,因为小鼠在所有后续时间点继续显示可检测的生物发光信号焦点。因此,该模型允许定量区分无效治疗(泊沙康唑和苄硝唑次优治疗)和有效治疗(苄硝唑的最佳剂量和治疗时间)。
补充图 1:通过测量报告基因 mNeonGreen 荧光对 克氏锥虫 群体荧光素酶表达进行感染前分析。 由 CL Brener Luc::Neon 寄生虫组成型表达的 mNeonGreen 荧光蛋白的流式细胞术。通过 mNeonGreen 荧光强度(X 轴)绘制寄生虫数量(Y 轴)的归一化直方图。内部图例显示了分析的菌株和形式、荧光中位数和荧光群的百分比。门系由 CL Brener 野生型 (WT) 菌株定义为非荧光对照。 请点击此处下载此文件。
补充表 1:BLI 测量中的分析表示例。 从急性模型感染后第 19 天的生物发光成像定量中获得的原始数据,如图 4B 所示的代表性结果。组描述:作为未感染的小鼠对照(n = 3 /组);载体作为未经治疗的感染小鼠;泊沙康唑 (Posa) 20 mg/kg,持续 20 天;苄硝唑 (BZ) 100 mg/kg,持续 20 天;100 mg/kg 的 BZ 处理 5 天 (n = 6/组)。 请点击此处下载此文件。
Discussion
生物发光成像是一种突破性的方法,它允许使用可见光和红外电磁辐射光谱来检测报告基因。因此,无需使用放射性标记物来追踪您的标本35。BLI 适用于啮齿动物模型和其他小型物种。它对临床前研究非常有用,因为它更安全,并且允许多次成像,从而最大限度地减少动物不适。此外, 由于 可以结合生物发光、荧光和其他技术(如正电子发射断层扫描)36,因此体内成像非常灵活。
光学成像受光学物理特性(如吸收和散射)的约束。所有组织吸收和散射不同波长的光的方式不同37.一个关键步骤是选择报告基因,而不考虑化学反应产生的光的发射波长。虽然在生物发光测定中,报告基因表达水平在体外可能很高,但在进行到体内设置时可能无法达到相同的表达水平。在该方案中,我们使用了红移 Photinus pyralis 荧光素酶 (PpyRE9H)38 密码子优化版本用于锥虫9,它在 617 nm 处发光,是最适合体内研究的化合物之一39。波长超过 600 nm 的发色团较少被人体内源性发色团吸收和散射,尤其是血红蛋白和黑色素。因此,红光可以穿过几厘米的组织,使光子甚至可以从内脏组织内部到达 CCD 相机39,40。
成像设置中令人担忧的一个领域是缺乏对其功能和效果的全面了解。像素合并是一种预处理技术,可将连续检测器获取的信息组合成一个更大的像素。此过程增强了信噪比,降低了背景噪声并提高了灵敏度。但是,它会降低空间分辨率精度,导致图像像素化41,42。这种权衡是成像策略中的一个重要考虑因素。
基于美洲锥虫病34 的目标产品概况和目标候选药物概况,概念验证研究侧重于检测 克氏锥虫 的敏感性,并帮助确定新的候选药物是否可以实现无菌治愈(表现为在几轮免疫抑制后没有复发)。因此,我们使用最高的像素合并因子来执行 BLI,而不会使图像过度饱和。当图像超饱和时,使用较低的像素合并因子执行新的采集。在分析过程中,将对需要不同像素合并的图像进行数学校正。这样,最终数据应使用相同的分箱表示。 表 1 显示了在同一图像和 ROI 中应用不同的合并因子时获得的不同值。
表 1:分箱设置对 BLI 定量的影响。 急性模型 (d13) 和慢性模型 (d118) 图像的三个 ROI 的量化,在不同的分箱因子中进行分析。 请点击此处下载此表格。
由于目前临床上存在美洲锥虫病的情况,药物发现工作旨在完全消除寄生虫(寄生虫学治愈)27,34。因此,体内临床前方案包括克服 BLI 技术敏感性局限性的方法。其中一种方法是用环磷酰胺治疗小鼠,以减少控制寄生虫负荷的免疫反应。另一种策略是减少组织深度并去除阻碍光线通向相机的肌肉、皮肤和毛皮层。通过离体程序,可以检测到小的生物发光点,显示寄生虫病灶低于体内 BLI 阈值,如图 5C 所示,由 Posa 处理的小鼠的离体结果。
设计一个试点实验来评估模型本身和感染动力学对于建立准确的抗寄生虫药物疗效评估实验至关重要。因此,研究人员将能够提前定义适当的 BLI 设置和感染时间过程。在探索性实验中,一种有助于定义采集设置的工具是“Autoexposure”。使用此工具,研究人员可以确定三个设置(曝光时间、 像素合并和 F/Stop)的优先级,以获得最佳图像。特别是,研究人员应确保在 CCD 相机的动态范围内采集图像,没有过饱和度或曝光不足,这可以通过刻度的最小和最大限制以及自动曝光功能(菜单 编辑 > 首选项 > 选项卡采集 > 选项卡自动曝光).在该协议中,相机光圈设置为最大值(F/Stop:1),并为急性和慢性模型定义了不同的曝光时间和像素合并因子。这些设置提供了时间可预测性,以便同时执行不同的图像轮次。考虑到报告基因方法基于酶促反应,底物在小鼠中的生物分布和荧光素酶动力学都会影响生物发光信号,从而影响感染定量(图 1B)。因此,在酶动力学的不同时刻采集图像会引入无法解释或校正的数据可变性,并影响总通量(光子/秒/cm2/球面度)计算。此外, 克氏锥虫 感染在小鼠中表现出动态的空间定位 (不同的区域和组织、深度和寄生虫负荷)。因此,如果另一个较强信号源满足定义的自动曝光标准,则确定要采集的计数值可能会错过较弱的信号源(组织更深处某个位置的寄生虫数量较少)。
Living Image 软件的一个棘手功能是以自动色标显示采集的图像。没有选项可以预设比例以根据所选的比例值自动显示全新的采集图像(参见协议步骤 6.2)。这种情况迫使研究人员手动将图像逐个更改为所选的最大值和最小值。因此,没有经验且未受过良好培训的用户在采集会话期间无法获得正确的读数,他们可能会误导数据或丢失该时间点的重要信息。为此,试点实验是有益的。
关于概念验证实验设计,最常见的问题之一是如何选择治疗持续时间和剂量。对于新的化学实体,这些参数通常由化合物在体外的效力和选择性,结合药物代谢和药代动力学 (DMPK) 生成的数据以及在体内试验功效之前进行的耐受性研究来确定。总之,在确定能够选择性杀死细胞内寄生虫的化合物后,在体外进行第一次 ADME 实验(吸收、分布、代谢和排泄),以估计化合物的水溶性、细胞通透性和代谢稳定性等参数。如果化合物在体外特性(通常在靶标候选物谱中定义)显示出良好的平衡,那么这些候选物将在健康小鼠中进行体内药代动力学 (PK) 研究,该研究概述了血液(也可能在组织中)中的化合物暴露,并提供了不同剂量水平下耐受性的一般概念17,34,43.理想情况下,大多数传染病的 PK 评估目标是确定达到高于 EC50/EC90 浓度44 的游离血浆浓度(校正血浆蛋白结合)的可行性 - 杀死或至少抑制 50% 或 90% 寄生虫生长的有效浓度,分别 - 足够长的时间。如果在一定剂量水平下实现了足够的暴露,那么这种方案可以在使用 Chagas BLI 模型的疗效研究期间使用。对于药物重新定位研究,应提供体外和体内 PK 数据。药物再分析的一个良好开端是 PubChem45 等化学数据库,它提供公认的数据,这些数据可以使用异速生长缩放46 转换为小鼠,以估计要测试的安全和无毒治疗方案。然而,情况并非总是如此。PK 研究在学术科学中仍然是一个被忽视的领域,很少有制药公司公布他们的 PK 结果。药物发现科学界建议将体内 PK 评估与药物疗效测定(药效学)47 一起包括在内。因此,临床前成像同时与化合物测量兼容,并且这种相关方法增强了数据的稳健性。
此外,在整个实验过程中都会监测小鼠的处理、体重和健康状况。毒性和副作用的迹象,如驼背、颤抖、失去平衡、不愿移动、不愿进食或饮水、虚脱或群体中或个体小鼠状况存在的任何其他异常,应在临床前研究中登记和报告。光学成像的目标之一是确保动物的健康。因此,人道终点应用于具有“鬼脸量表48”中描述的疼痛迹象的小鼠。此外,在 BLI 采集期间每周对小鼠称重,更常见的是在药物给药和 CTX 治疗期间称重。根据动物福利法规,体重减轻超过 20% 的小鼠必须立即进行人道安乐死。
克氏锥虫生物发光模型现在是发现和开发美洲锥虫病新疗法的最先进的实验模型。该模型复制了克氏锥虫感染和美洲锥虫病49 的关键特征,允许实时监测寄生虫血症和区分与已知作用方式相关的具有不同疗效特征的化合物。BLI 是一种增强识别感染组织自信的技术。它能够精确选择感染组织以用于广泛的方法,包括已经应用于克氏锥虫研究的所有经典方法50,51。此外,它还允许研究人员探索尖端技术并开发新技术33。此外,BLI 根据 3Rs 原则10,35 同时改善动物福祉和更合理地使用动物。
几个专注于被忽视的热带病的研究小组被放置在没有活体成像设备的国家。为了克服当前情况,全球生物成像 (Global BioImaging) 及其相关联盟等新的国际网络促进了提供对成像核心设施的开放访问并改善工作人员和成像科学家的培训的行动52,53。这些举措,以及像这样的友好用户协议,可以为所有研究人员提供使高端技术大众化的条件。该方法在临床前药物发现中的实施提供了可靠的疗效读数和临床结果的预测价值,有助于查加斯病的药物发现。
Disclosures
作者无需声明利益冲突。
Acknowledgements
作者感谢 Amanda Franscisco、John Kelly 和 Fanny Escudié 提供药物疗效测定的 BLI 培训和支持,感谢 John Kelly 和 Simone Calderano 提供寄生虫,感谢 Gabriel Padilla 对动物研究的支持。A.C.S 获得了 CAPES PSDE 奖学金,在伦敦卫生和热带医学学院(英国)接受培训。作者还要感谢圣保罗大学科学研究核心设施 (CEFAP-USP) 的流式细胞术和成像研究 (FLUIR) 平台为 IVIS 光谱设备分析提供的技术支持,以及遗传学和卫生控制实验室 ICB-USP 为小鼠进行无特定病原体质量控制的实验后测定。该项目由 DNDi 资助。DNDi 感谢其公共和私人捐助者,自 2003 年成立以来,他们为所有 DNDi 活动提供了资金。DNDi 捐助者的完整名单可在 https://dndi.org/about/donors/ 上找到。
Materials
| Name | Company | Catalog Number | Comments |
| BD LSRFortessa™ X-20 Cell Analyzer | BD Biosciences | ||
| Weighing Balance (animal facility) | Available from several suppliers | ||
| IVIS Spectrum In Vivo Imaging System | Revvity (former PerkinElmer) | ||
| FlowJ Software v10.7.1 | BD Biosciences | ||
| Living Image Software for Spectrum v4.7.1 | Revvity (former PerkinElmer) | License Free Analysis Software called 'Aura Imaging' could be used for the most basic features provided by Spectral Instruments Imaging (Bruker company) (https://spectralinvivo.com/software/) | |
| Microsoft Office software | Microsoft | ||
| GraphPad Prism v8.4.0 | GraphPad Software Inc. | ||
| DMEM Low Glucose | Vitrocell | D0025 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| Foetal Bovine Serum (FBS) | Gibco | 16000-044 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Trypsin 0.5% EDTA | Gibco | 25300-062 | |
| LIT medium | In house | ||
| Hygromycin B (50 mg/mL) | Gibco | 10687010 | |
| Grace′s Insect Medium | Sigma-Aldrich | G9771 | |
| HEPES | Sigma-Aldrich | 54457 | |
| IVISBrite d-luciferin potassium salt | Revvity (former PerkinElmer) | 122799 | Also could be used: VivoGlo Luciferin, in vivo grade (Promega/P1043); D-Luciferin, Monopotassium Salt (Thermo Scientific/88293) or PierceD-Luciferin, Monosodium* Salt (Thermo Scientific/88291); D-Luciferin, Potassium Salt (GoldBio/LUCK or eLUCK); D-Luciferin, Sodium* Salt (GoldBio/LUCNA or eLUCNA) *Sodium or potassium salt differences relies minimal chances on solubility, however do not affect in vivo performance. |
| DPBS | Gibco | 21600-044 | |
| Cyclophosphamide (CTX) | Sigma-Aldrich | C0768-5g | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | |
| (Hydroxypropyl)methyl cellulose (HPMC) | Sigma-Aldrich | 09963-25G | |
| Benzyl alcohol | Sigma-Aldrich | 402834 | |
| Tween 80 | Sigma-Aldrich | P1754-1L | |
| Benznidazole | ELEA | ||
| Posaconazole (Noxafil commercial formulation) | Schering-Phough | ||
| Giemsa | Available from several suppliers | ||
| gavage needle (stainless-steel straight) - 22GA | Aton | CA2003 | |
| 1 mL Syringe and 31G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 26G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 24G X¾ needle | Available from several suppliers | ||
| Sterile Syringe Filter 0.2 µm | Available from several suppliers | ||
| A4 Matte Black paper 120gr or thicker | Paper Color/ Canson (Available from several suppliers) | ||
| aluminum foil | Available from several suppliers | ||
| Neubauer chamber | Available from several suppliers |
References
- WHO fact sheet. Chagas disease (also known as American trypanosomiasis). WHO, World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/chagas-disease (2023)
- Lee, B. Y., Bacon, K. M., Bottazzi, M. E., Hotez, P. J. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis. 13 (4), 342-348 (2013).
- Bern, C. Chagas' disease. N Engl J Med. 373 (5), 456-466 (2015).
- Shikanai-Yasuda, M. A., Carvalho, N. B. Oral transmission of Chagas disease. Clin Infect Dis. 54 (6), 845-852 (2012).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Front Public Health. 7, 166 (2019).
- Perez-Molina, J. A., Molina, I. Chagas disease. Lancet. 391 (10115), 82-94 (2018).
- Field, M. C., et al. Anti-trypanosomatid drug discovery: An ongoing challenge and a continuing need. Nat Rev Microbiol. 15 (7), 447 (2017).
- Kratz, J. M. Drug discovery for chagas disease: A viewpoint. Acta Trop. 198, 105107 (2019).
- McLatchie, A. P., et al. Highly sensitive in vivo imaging of Trypanosoma brucei expressing 'red-shifted' luciferase. PLoS Negl Trop Dis. 7 (11), e2571 (2013).
- Lewis, M. D., Francisco, A. F., Taylor, M. C., Kelly, J. M. A new experimental model for assessing drug efficacy against Trypanosoma cruzi infection based on highly sensitive in vivo imaging. J Biomol Screen. 20 (1), 36-43 (2015).
- Costa, F. C., et al. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Negl Trop Dis. 12 (4), e0006388 (2018).
- Lewis, M. D., et al. Bioluminescence imaging of chronic Trypanosoma cruzi infections reveals tissue-specific parasite dynamics and heart disease in the absence of locally persistent infection. Cell Microbiol. 16 (9), 1285-1300 (2014).
- Francisco, A. F., et al. Limited ability of posaconazole to cure both acute and chronic Trypanosoma cruzi infections revealed by highly sensitive in vivo imaging. Antimicrob Agents Chemother. 59 (8), 4653-4661 (2015).
- du Sert, N. P., et al. The arrive guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410 (2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. J Am Assoc Lab Anim Sci. 50 (5), 614-627 (2011).
- Francisco, A. F., et al. Nitroheterocyclic drugs cure experimental Trypanosoma cruzi infections more effectively in the chronic stage than in the acute stage. Sci Rep. 6, 35351 (2016).
- Moraes, C. B., et al. Nitroheterocyclic compounds are more efficacious than CYP51 inhibitors against Trypanosoma cruzi: implications for Chagas disease drug discovery and development. Sci Rep. 4, 4703 (2014).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 10 (5), 407-409 (2013).
- de Araújo-Jorge, T. C., de Castro, S. L. . Chagas Disease: Manual for Animal Experimentation. , (2000).
- JoVE. JoVE Science Education Database. Anesthesia Induction and Maintenance. JoVE. , (2023).
- Taylor, M. C., et al. Exploiting genetically modified dual-reporter strains to monitor experimental Trypanosoma cruzi infections and host-parasite interactions. Methods Mol Biol. 1955, 147-163 (2019).
- Keyaerts, M., et al. Inhibition of firefly luciferase by general anesthetics: effect on in vitro and in vivo bioluminescence imaging. PLoS One. 7 (1), e30061 (2012).
- Jiron, J. M., et al. Comparison of isoflurane, ketamine-dexmedetomidine, and ketamine-xylazine for general anesthesia during oral Procedures in rice rats (Oryzomys palustris). J Am Assoc Lab Anim Sci. 58 (1), 40-49 (2019).
- GoldBio. GoldBio Luciferin In Vivo Handbook - a detailed method for Luciferin preparation and administration for model animals. GoldBio Protocol Available from: https://goldbio.com/documents/1068/Luciferin%20in%20vivo%20handbook.pdf (2013)
- Revity. Preparation of IVISbriteTM D-Luciferin for in vitro and in vivo bioluminescent assays. Revvity Standard Operate Procedure (Tech Notes) Available from: https://resources.perkinelmer.com/lab-solutions/resources/docs/SOP_LuciferinPrep_InVitroInVivo_BLI-Assays.pdf (2023)
- Chatelain, E., Scandale, I. Animal models of Chagas disease and their translational value to drug development). Expert Opin Drug Discov. 15 (12), 1381-1402 (2020).
- Khare, S., et al. Antitrypanosomal treatment with benznidazole is superior to posaconazole regimens in mouse models of Chagas disease. Antimicrob Agents Chemother. 59 (10), 6385-6394 (2015).
- Bustamante, J. M., Craft, J. M., Crowe, B. D., Ketchie, S. A., Tarleton, R. L. New, combined, and reduced dosing treatment protocols cure Trypanosoma cruzi infection in mice. J Infect Dis. 209 (1), 150-162 (2014).
- Molina, I., et al. Randomized trial of posaconazole and benznidazole for chronic Chagas' disease. N Engl J Med. 370 (20), 1899-1908 (2014).
- JoVE. Science Education Database. Compound Administration II. JoVE. , (2023).
- Pukhalsky, A. L., Toptygina, A. P., Viktorov, V. V. Immunosuppressive action of cyclophosphamide in mice: Contribution of some factors to determination of strain differences. Int J Immunopharmacol. 15 (4), 509-514 (1993).
- Francisco, A. F., et al. Comparing in vivo bioluminescence imaging and the Multi-Cruzi immunoassay platform to develop improved Chagas disease diagnostic procedures and biomarkers for monitoring parasitological cure. PLoS Negl Trop Dis. 16 (10), e0010827 (2022).
- Kratz, J. M., et al. The translational challenge in Chagas disease drug development. Mem Inst Oswaldo Cruz. 117, e200501 (2022).
- Youn, H., Hong, K. -. J. In vivo noninvasive small animal molecular imaging. Osong Public Health Res Perspect. 3 (1), 48-59 (2012).
- Refaat, A., et al. In vivo fluorescence imaging: success in preclinical imaging paves the way for clinical applications. J Nanobiotechnology. 20 (1), 450 (2022).
- Pirovano, G., Roberts, S., Kossatz, S., Reiner, T. Optical imaging modalities: Principles and applications in preclinical research and clinical settings. J Nucl Med. 61 (10), 1419-1427 (2020).
- Branchini, B. R., Southworth, T. L., Khattak, N. F., Michelini, E., Roda, A. Red- and green-emitting firefly luciferase mutants for bioluminescent reporter applications. Anal Biochem. 345 (1), 140-148 (2005).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10 (4), 041210 (2005).
- O'Neill, K., Lyons, S. K., Gallagher, W. M., Curran, K. M., Byrne, A. T. Bioluminescent imaging: a critical tool in pre-clinical oncology research. J Pathol. 220 (3), 317-327 (2010).
- Mennel, L., et al. A photosensor employing data-driven binning for ultrafast image recognition. Sci Rep. 12 (1), 14441 (2022).
- Yoo, Y., Im, J., Paik, J. Low-light image enhancement using adaptive digital pixel binning. Sensors. 15 (7), 14917-14931 (2015).
- Moraes, C. B., et al. Accelerating drug discovery efforts for trypanosomatidic infections using an integrated transnational academic drug discovery platform. SLAS Discov. 24 (3), 346-361 (2019).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharm Stat. 10 (2), 128-134 (2011).
- Kim, S., et al. PubChem 2023 update. Nucleic Acids Res. 51, D1373-D1380 (2023).
- Sharma, V., McNeill, J. H. To scale or not to scale: the principles of dose extrapolation. Br J Pharmacol. 157 (6), 907-921 (2009).
- Barrow, J. C., Lindsley, C. W. The importance of PK-PD. J Med Chem. 66 (7), 4273-4274 (2023).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7 (6), 447-449 (2010).
- Lewis, M. D., Kelly, J. M. Putting infection dynamics at the heart of Chagas disease. Trends Parasitol. 32 (11), 899-911 (2016).
- Brener, Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 4, 389-396 (1962).
- Cummings, K. L., Tarleton, R. L. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 129 (1), 53-59 (2003).
- . Global BioImaging Available from: https://globalbioimaging.org (2024)
- Pfander, C., et al. Euro-BioImaging - Interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience. 25 (2), 103800 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved