在三维纤维蛋白水凝胶中形成人胸腺类器官
* These authors contributed equally
In This Article
Summary
在这里,我们描述了一种在 3D 纤维蛋白水凝胶中生长的人 iPSC 衍生的胸腺类器官的形成方案,旨在支持胸腺上皮细胞 (TEC) 成熟和延长维持,以及体外胸腺生成。
Abstract
功能性和自我耐受的 T 细胞库的产生是一个复杂的过程,主要取决于胸腺微环境,主要取决于其细胞外基质 (ECM) 的特性。胸腺上皮细胞 (TEC) 在胸腺生成中至关重要,通过过滤自反应性克隆来培育和选择发育中的 T 细胞。经验证明,TEC 对 ECM 提供的物理和化学线索特别敏感,经典的单层细胞培养会导致功能迅速丧失,直到它们死亡。由于这种精细的维护加上相对罕见性,尽管在体外模拟胸腺生物学的风险很高,但仍然缺乏能够大规模和随着时间的推移忠实地模拟 TEC 生态位的模型。在这里,我们描述了多细胞人胸腺类器官模型的形成,其中 TEC 区室来源于人诱导的多能干细胞 (iPSC),并与原代早期胸腺细胞祖细胞在三维 (3D) 基于纤维蛋白的水凝胶中重新聚集。该模型满足了当前对可扩展培养系统的需求,该系统可在体外复制胸腺微环境并展示功能,即在数周内产生 T 细胞和支持胸腺类器官生长的能力。因此,我们提出了一种通过 iPSC 衍生的类器官实现胸腺功能的实用体外模型,这将有利于 TEC 生物学和离体 T 细胞生成的研究。
Introduction
胸腺是主要的淋巴器官,在产生有效且耐受的免疫系统中起着至关重要的作用 1,2,3。早期胸腺祖细胞 (ETP) 从骨髓迁移到胸腺,在那里它们扩增并分化为功能性 T 细胞 1,2,4,5。这些过程由一个特殊的群体,即胸腺上皮细胞 (TEC) 介导2,6,7。TEC 来源于胸腺上皮祖细胞 (TEP)8,9,由皮质 TEC (cTEC) 和髓质 TEC (mTEC) 组成,它们在创建 T 细胞迁移、扩增和成熟所需的专用 3D 微环境中发挥特定作用。TEC 主要通过提供生长和分化因子 1,10,11 以及通过自身抗原呈递负向选择无功能和不耐受的胸腺细胞来介导 T 细胞发育 5,7,12。发育中的 T 细胞和 TEC 之间的复杂相互作用在 TEC 细胞群的成熟和 3D 组织中也起着核心作用,这一过程称为胸腺串扰 1,11。胸腺细胞群之间的相互作用在很大程度上依赖于细胞外基质 (ECM) 形成的特定微环境。胸腺 ECM 与胸腺细胞群处于动态互惠状态,影响基因调控,并通过酶或基质蛋白的分泌不断重塑13。ECM 通过修饰生长因子和细胞因子的生物利用度、通过膜结合受体(如整合素)直接信号传导以及通过物理力塑造细胞骨架来影响细胞14。胸腺 ECM 成分(如胶原蛋白和层粘连蛋白)已被证明对生长因子 TGFb 和 FGF 具有高亲和力,这对 TEC 维持至关重要,并通过形成复合物来修复它们。胸腺 ECM 可塑性、弹性模量和密度在指导 TEC 命运和塑造胸腺的区室化方面也起着至关重要的作用,这对其功能至关重要。这些线索强调了考虑 ECM 及其 3D 结构以模拟体外胸腺的重要性。原代 TEC 在经典细胞培养设置中培养时会迅速去分化、失去功能并最终死亡这一事实支持了这一点 15,16,17。
已经开发了培养模型,以从人胸腺外植体中扩增功能性 TEC 群体,以保存 ECM 的结构及其为 TEC 提供的关键线索 18,19,20。该培养系统能够在体外成功扩增和维持功能性 TECs 群体,但无法维持超过 7 至 8 天的培养18。因此,开发一种能够在体外和长期复制胸腺微环境及其功能的可访问、实用的 3D 培养系统是该领域的关键赌注。最近,基于水凝胶的 3D 培养系统的开发导致了几种人工胸腺类器官系统的出现,构成了体外胸腺建模的重大进展 15,16,21,22。通过将人原代 ETP 与诱导多能干细胞 (iPSC) 衍生的人 TEP 重新聚集到球状体中,并将其接种在纤维蛋白水凝胶上,我们开发了一种人胸腺类器官 (hTO) 共培养系统。
本研究中材料和水凝胶设置的选择旨在复制胸腺 ECM 的天然结构,同时保持实用性和扩大工艺规模的能力,以获得负担得起且丰富的实验材料来源15。该 hTO 系统显示出多谱系分化潜力,可支持 ETP 的生产性胸腺生成23。该类器官系统构成了研究胸腺内细胞相互作用以及正常和病理人类淋巴细胞生成建模的可靠工具。iPS 细胞的使用还将基因编辑功能引入模型。在过去 15 年中,iPSC 有效分化为功能性胸腺组织一直是该领域的长期目标,并且在破译 TEC 谱系命运信号 21,24,25,26,27 方面取得了重大进展。为了满足对这种体外 3D 胸腺模型的需求,本技术说明描述了逐步生成 iPSC 衍生的人胸腺类器官的方法和技术细节,重点是水凝胶支架的形成、细胞微质量的再聚集和接种,以及类器官的培养和收获。
Protocol
hiPSC 细胞系 hiN.Fm.m.Lon71.019 由雄性成纤维细胞产生,并通过 mRNA 转染重编程。hiPSC 细胞系 hiN.Fm.f.Lon80.002 由雌性成纤维细胞产生,并通过 mRNA 转染重编程。hiPSC 细胞系 hiN.Fs.f.MIPS203.003 由雌性成纤维细胞产生,并通过重组仙台病毒载体感染进行重编程。所有细胞系均由 Nantes iPSC 平台提供。患者知情同意将他们的细胞用于研究目的(匿名收集,Lonza,猫 # CC-2511)。根据宣言 DC-2017-2987 下的法国 CODECOH 法规,通过解离当天从南特医院 (CHU Nantes) 接受儿科心脏手术的患者那里获得的产后人类胸腺样本作为匿名丢弃废物来分离原发性 ETP。
1. iPSC 向 TEP 身份定向分化
注:自 Lai 和 Jin 发表的第一篇证明小鼠胚胎干细胞 (EScs) 向胸腺上皮身份分化28 的工作以来,一些研究已经开发并优化了描述人类 iPS 细胞定向分化为 TEP 身份的方案 21,24,25,26,27,29.这些研究导致表达胸腺上皮身份标志物(如 FOXN1 和 PAX9)的 TEP 24,25,28,30 以及功能标志物(如 DLL4 和 AIRE26)的分化,但缺乏 TEC 成熟标志物24,25.两种方法已被证明支持分化的 TEP 成熟为成熟的 TEC 身份:移植到体内模型(如小鼠)29 中,以及重新聚集到在气液界面设置中培养的 3D 胸腺类器官系统中21。这两个系统都证明了 3D 结构在维持和支持能够支持体内或体外 T 淋巴细胞生成蛋白的功能性 TEC 群体成熟方面发挥的关键作用 15,24,25,31。
- 对于本研究中使用的胸腺类器官系统,按照 Provin 等人 23 中开发和详述的方案,将 iPS 细胞分化为 TEP 身份。
2. 从儿科胸腺样本中分离原代 ETP
注意:ETP 是源自骨髓的祖细胞,产生 T 细胞谱系和胸腺内的树突状细胞,并表现出以下表型:CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33。
- 去除珠的制备
- 前一天,将磁性细胞分离珠(材料表)转移到 15 mL 试管中,并用 4 mL 分离缓冲液(PBS + 0.1% BSA + 2 mM EDTA)洗涤。
- 将试管放入磁力架中,去除上清液,并加入 2 mL 分离缓冲液。
- 将小鼠抗人 CD3、CD4 和 CD8 抗体添加到珠子中,并在 4 °C 下搅拌孵育 45 分钟。将试管放入磁力架中,在隔离缓冲液中洗涤数次,然后重悬于 20 mL 分离缓冲液中。
- 胸腺样本解离
- 将新鲜的胸腺样品转移到装满RPMI1640的培养皿中(材料表)。用无菌解剖剪刀和钳子将其切成约 1 毫米3 大小的块。
- 使用 25 mL 移液器,冲洗培养基和碎片数次(培养基应变得浑浊),然后让碎片沉淀并将一半的培养基收集到 50 mL 试管中。添加更多培养基并重复,直到培养基保持透明。
- 根据需要将培养基收集到任意数量的 50 mL 试管中,并以 200 x g 的速度旋转试管 5 分钟。
- 去除上清液并将沉淀重悬于 10 mL 红细胞裂解液中(材料表)。在室温 (RT) 下孵育 5 分钟,并加入 20 mL 洗涤缓冲液(PBS + 0.5% BSA + 4 mM EDTA + 1% 青霉素/链霉素)。
- 以 200 x g 旋转 5 分钟并去除上清液。将沉淀重悬于 10 mL 洗涤缓冲液中,通过 70 μm 网状过滤器过滤,并对细胞进行计数。
- ETP 富集
- 细胞计数后,用洗涤缓冲液将体积调节至每管 10 mL。加入所需量的细胞分离珠(每 2 亿个细胞,在 20 mL 分离缓冲液中使用 500 μL 珠子),并在 4 °C 下搅拌孵育 30 分钟。
- 将试管放在磁力架上 2 分钟,然后小心地将上清液收集在干净的试管中。取出试管并用 20 mL 分离缓冲液清洁珠子。涡旋试管,将其放回磁力架上并收集上清液。重复此步骤两次。
- 将上清液以 200 x g 旋转 5 分钟。将沉淀重悬于 2 mL 分离缓冲液中并计数细胞。
- ETP 隔离
- 将浓度调整至每毫升 2 亿个细胞,并收集少量细胞作为未染色的对照。
- 用小鼠抗人谱系 (Lin)(CD3、CD4、CD8、CD14、CD19、CD56)、CD7 和 CD34 抗体标记细胞(对所有 Lin 标志物使用相同的荧光染料)。在 4 °C 孵育 45 分钟。
- 在等体积的洗涤缓冲液中洗涤细胞。将细胞以 200 x g 离心 5 分钟,将沉淀重悬于 1 mL 中,并对细胞进行计数。
- 将体积调节至每毫升 5000 万个细胞的浓度,并通过 70 μm 网状过滤器过滤细胞。
- 添加所选的活力标记物,并使用 70 μm 喷嘴通过流式细胞术对活的 Lin-CD34 + CD7 + 细胞进行分类。
3. 3D胸腺类器官培养
- TEP 准备
- ETP 分离后,立即在第 13-15 天控制 TEP 培养物的质量。确保细胞达到汇合并形成带有凸起的致密单层(图 1)。
- 要收获分化的 TEP,请用 DPBS -/- 洗涤细胞,将其去除,每孔加入 1 mL TrypLE(材料表),并在 37 °C 下孵育 5-7 分钟。
- 每孔加入 1 mL XVIVO10(材料表),多次冲洗以分离细胞,转移到 15 mL 试管中,并以 200 x g 离心 5 分钟。
- 去除上清液,将沉淀重悬于 1 mL XVIVO10 中,并对细胞进行计数。
注意:为了提前评估分化的功效,请分别使用培养物,并通过 RT-qPCR 验证 FOXN1 和 PAX9 的表达,并通过流式细胞术验证分化产量(计算为 EPCAM + CD205 + 细胞的分数,应高于 50%)(图 1)。在这个分化阶段,几乎所有 EPCAM+ 细胞的 CD205 也呈阳性,证明其前体身份11。
- ETP 准备
- ETP 分离后,立即以 200 x g 旋转收集管 5 分钟。将沉淀重悬于 1 mL XVIVO10 中并计数细胞。
- 胸腺类器官聚集
- 移液合适体积,以每毫升 2,00,000 TEP 和 40,000 ETP 的浓度混合两种细胞悬液,轻轻上下移液一次以匀浆。
- 根据 表 1 添加合适的补充剂,并将每孔 100 μL 混合细胞悬液接种在低结合 U 形底 96 孔板中。使用多通道移液器增加产量;然而,经典的单吸头移液器限制了珍贵细胞的损失。将板在 37 °C 和 5% CO2 下孵育过夜。
- 水凝胶的制备
注:用于水凝胶形成、类器官接种和培养基分布的实验设置如图 2 所示。- 第二天(类器官培养阶段的第 1 天),解冻凝血酶 (10 U/mL)、抑肽酶 (26,000 U/mL) 和纤维蛋白原 (8 mg/mL) 的等分试样(材料表)。在冰上解冻凝血酶和抑肽酶,在 37 °C 水浴中解冻纤维蛋白原(不要放在冰上,因为它会沉淀)。不要涡旋,而是将等分试样放在引擎盖下,并通过轻轻移液使它们均质化。
- 按照 表 2 中所示的比率,为产生的类器官数量准备所需数量的悬挂插入物。使用无菌钳将插入物放入培养孔中,并在培养板中至少留出一列或一行为空。
- 准备与要灌注的凝胶一样多的 1.5 mL 试管。在每个试管中,首先移液所需体积的纤维蛋白原和抑肽酶,如 表 2 中所述。
- 第二次,将所需体积的凝血酶加入单个试管中,快速冲洗 2 次,不产生气泡以使试剂均质化,然后吸取试管的全部内容物,并将混合物快速冲洗到悬挂插件中。将移液器垂直放置在插件中心的上方,轻轻冲洗试剂混合物,不要产生气泡。
注:在此步骤中,执行速度至关重要,因为试剂会在几秒钟内聚合,正确混合它们以避免在凝胶中形成结块或密度不均匀。使用每个孔的不同 1.5 mL 试管,一次处理一个孔(如果一个试管重复用于多个孔,剩余的固体凝胶块可能会堵塞移液器的吸头)。如果由于凝血酶的高活性而导致聚合发生得太快,请使用 1:2 稀释。灌注后,凝胶必须透明至略微半透明,并且在几秒钟后当板垂直倾斜时仍会流动。 - 在 37 °C 下孵育至少 1 小时,直到透明溶液凝固并变成不透明的白色,并且当板垂直倾斜时,凝胶牢固地保持在原位(图 2A)。
- 类器官接种
- 验证聚合步骤的质量。确保微团形成球形细胞团,紧凑的核心被较低密度的 ETP 光晕包围(图 3)。
- 切开 P200 锥体的尖端并用防粘附溶液清洗(材料表)。要收获细胞团,请将板倾斜到几乎垂直的位置:微团将沉到孔的下壁,并且可以通过在吸液时逐渐将移液器吸头推到孔底部来轻松恢复。
- 按照 表 1 中所示的比例,在不用移液器吸头接触凝胶的情况下小心地沉积水凝胶,将质量接种在水凝胶顶部(图 2B)。即使类器官在这个阶段看起来是自由漂浮的,但当用培养基溶胀时,凝胶会软化,类器官会依偎在上层。在显微镜下检查 P96 孔中没有留下类器官。
- 根据 表 1 和 表 2 准备所需体积的培养基,在每个孔中,通过沿着插入壁移液,在不接触水凝胶顶部缓慢添加四分之一的体积,通过将移液器放置在悬挂插入物的臂之间,将剩余的四分之三添加到孔底部(图 2C)。
- 将 1 mL PBS 放入空培养孔中,以保持板内的湿度。在 37 °C 和 5% CO2 下孵育。
- 胸腺类器官培养
- 第 2 天,检查类器官是否接种良好:水凝胶必须保持在原位,并且类器官不得沉淀在插入物的底部。
- 按照 表 1 和 表 2 准备所需量的培养基。将吸液孔的尖端对准悬挂插件的臂之间,确保不要接触凝胶,以去除培养基。通过以相同的方式定位移液器添加新的培养基。
- 每 2 天更换一次培养基,2 至 4 天后(TEP 分化开始后的第 18 天)切换到第二相培养基(表 1)。
注意:类器官批次可以以这种方式在培养物中维持长达 6 周。
- 类器官收获
- 准备一个 15 mL 试管,每孔含 1 mL TrypLE 进行收获。
- 切开 P1000 锥体的尖端,并将其涂在抗粘附溶液中。将移液器吸头垂直放在插入物的中心,轻轻移液凝胶(注意不要在膜上穿孔)并转移到 TrypLE 管中。用 TrypLE 洗涤插入物的膜,并转移至试管中。
- 在 37 °C 下孵育 15 分钟,每隔 5 分钟轻轻涡旋。确保凝胶和类器官解离。
- 15 分钟后,在 70 μm 网状过滤器上过滤并以 200 x g 离心 5 分钟。将沉淀重悬于洗涤缓冲液中,然后继续选择分析方法。
Representative Results
该协议的工作流程总结于 图 4 中。对于这个 3D 类器官培养模型,我们采用了一种凝血酶和纤维蛋白原水凝胶,由于它提供的物理和机械信号,我们的团队以前曾使用这种水凝胶来维持原代小鼠 mTEC几天 34。聚合后,凝胶应呈现松散的海绵状网状结构(图 5)。
在初始接种和附着阶段之后,类器官在凝胶表面和最上层逐渐生长和发育。根据凝胶特性、接种条件和接种在凝胶上的类器官数量,类器官形成球形到长方形结构(图 6),偶尔合并形成更大的结构。培养第一周后,在类器官中观察到组织的两个特定亚水平:首先,我们观察到由大细胞从类器官照射并在各个方向定植水凝胶形成的长细胞表面投影状结构(图 6 和 图 7)。其次,我们观察到由集中在这些细胞投影周围的较小细胞形成的簇状结构。尽管我们无法分离出两种细胞类型来证实研究假设,但这种现象让人想起胸腺皮层中发现的 3D 排列,这是由单个 cTEC 与大量更小的发育 T 细胞相互作用形成的,称为胸腺护士细胞复合物11 (图 8)。
在类器官培养阶段的几个时间点,我们通过流式细胞术评估了胸腺类器官的细胞组成,并确定了几个关键区室:TEC(表征为 EPCAM+ CD45-)、胸腺细胞(EPCAM-CD45+CD3+)(图 9),以及包含胸腺造血非胸腺细胞亚群的 EPCAM-CD45+ CD3-隔室。更多细节可以在 Provin 等人 23 中找到。
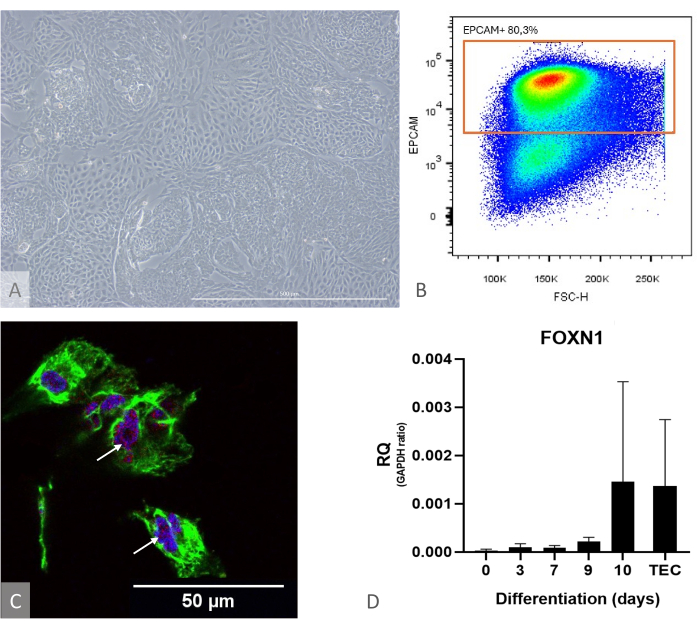
图 1:iPSC 到 TEP 的分化表征。 (A) D13 处 iPSC 到 TEP 分化的示例,倒置相差显微镜,400 倍。比例尺:500 μm。(B) 点图示例,分化第 14 天 DAPI 细胞中 EPCAM + 细胞的比例,图像来自 FlowJo 10.0.7。(C) 在 iPSC 到 TEP 分化的第 16 天对 DAPI(蓝色)、PAX9(红色)和 KRT8(绿色)、免疫荧光和共聚焦成像进行免疫染色。白色箭头指向抗 PAX9 染色的示例。比例尺:50 μm (D) iPS 到 TEP 分化过程中 FOXN1 (RQ 到 GAPDH) 的表达水平。TEC:阳性对照参考,从儿科胸腺样本中分离的原代人 TEC。来自 Prism 的图形(GraphPad 版本 8.0.1)。 请单击此处查看此图的较大版本。
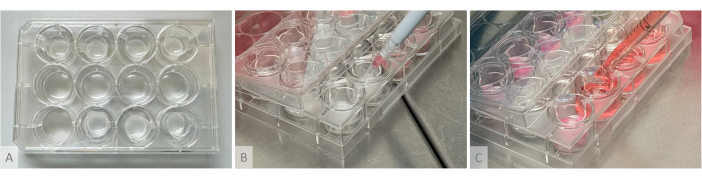
图 2:水凝胶形成、类器官接种和培养基分布的实验装置。 (A) 将水凝胶浇铸到顶部和底部行的悬挂插件中的培养板。(B) 类器官接种:将含有 1 个类器官的切割移液管锥体放置在水凝胶上方,不接触水凝胶,将类器官轻轻接种在凝胶表面。(C) 通过将移液器的尖端定位在悬挂插件的臂之间,将培养基沉积在培养孔中。 请单击此处查看此图的较大版本。
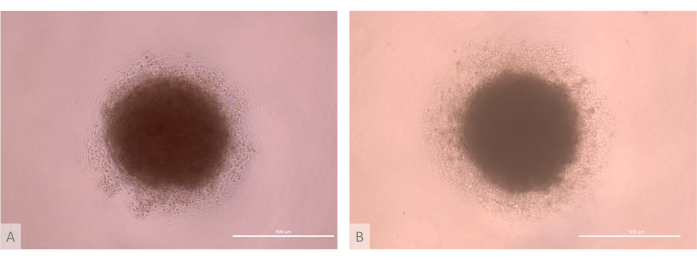
图 3:接种前胸腺类器官培养物的 D0(完整方案的第 13-15 天)。 (A) 用源自 Lon71.019 iPS 系的 TEC 产生的类器官。(B) 用源自 MIPS203.003 iPS 系的 TEC 产生的类器官。倒置相差显微镜,1000 倍。比例尺:500 μm。 请单击此处查看此图的较大版本。
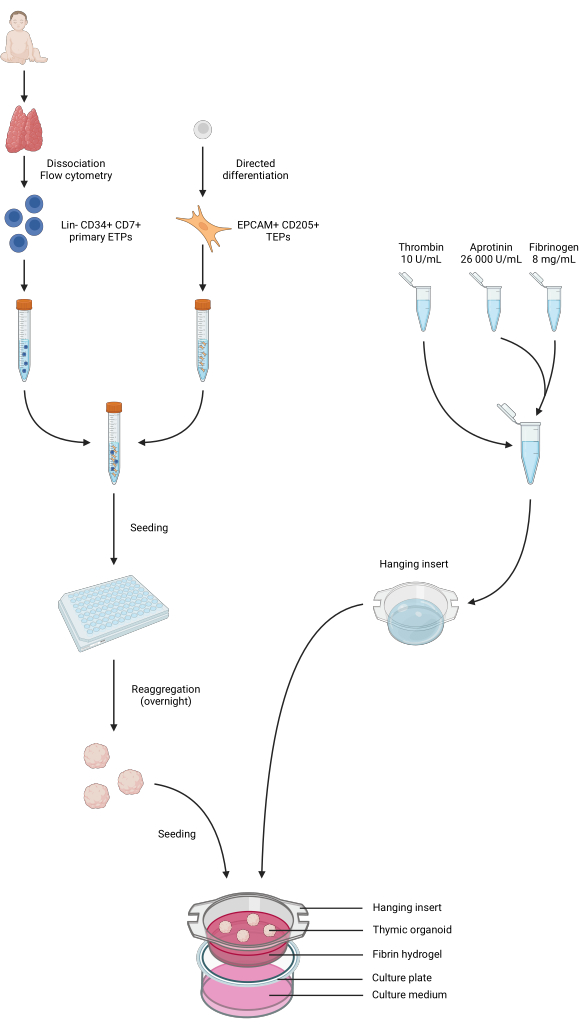
图 4:协议所有步骤的汇总表示。 收集儿科胸腺样本并解离,通过流式细胞术对原代 Lin- CD34 + CD7 + ETP 进行分类。iPS 细胞的分化是朝着 TEP 身份进行的。将 ETP 和 iPS 衍生的 TEP 合并并接种在低结合 96 孔板中,并在一夜之间聚集到胸腺类器官中。由抑肽酶、纤维蛋白原和凝血酶制备纤维蛋白水凝胶,并浇铸到悬挂插入物中。聚合后,将类器官接种在水凝胶上,并将 1 相培养基添加到孔中。类器官在培养物中保存长达 6 周。在 BioRender 中创建,AG26EFCZOM发布许可。 请单击此处查看此图的较大版本。
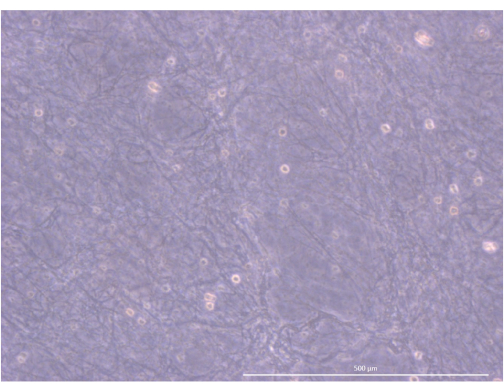
图 5:水凝胶的组织和结构。 倒置相差显微镜,1000 倍。比例尺:500 μm。 请点击此处查看此图的较大版本。
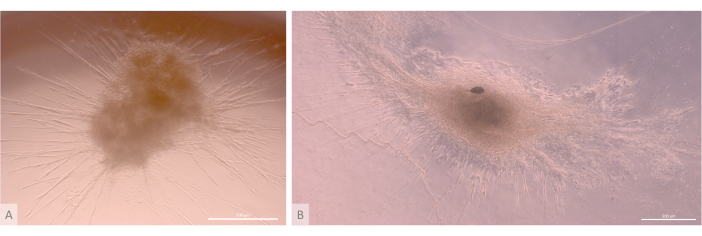
图 6:成熟的类器官和三维结构。 (A) 3D 培养第 24 天的胸腺类器官,MIPS203.003 iPS 线。(B) 3D 培养第 32 天胸腺类器官的合成图像,Lon71.019 iPS 线。倒置相差显微镜。比例尺:500 μm。 请单击此处查看此图的较大版本。
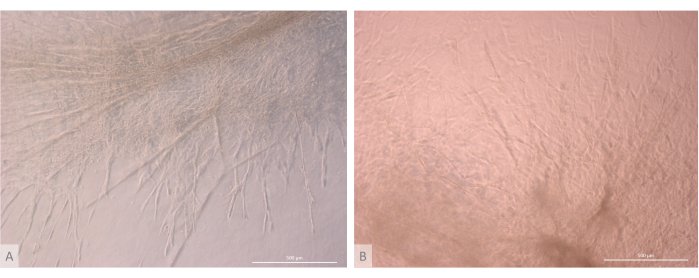
图 7:胸腺类器官的结构细节。 (A) 3D 培养第 32 天的胸腺类器官,L71.019 iPS 线。(B) 3D 培养第 27 天的胸腺类器官,L80.002 iPS 线。倒置相差显微镜,400 倍。比例尺:500 μm。 请单击此处查看此图的较大版本。
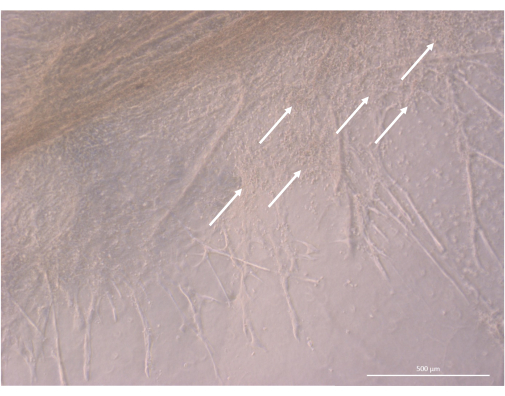
图 8:3D 培养第 32 天的胸腺类器官的结构细节。 白色箭头指向在 TEC 细胞附近增殖的小胸腺细胞簇。倒置相差显微镜,400 倍。比例尺:500 μm。 请点击此处查看此图的较大版本。
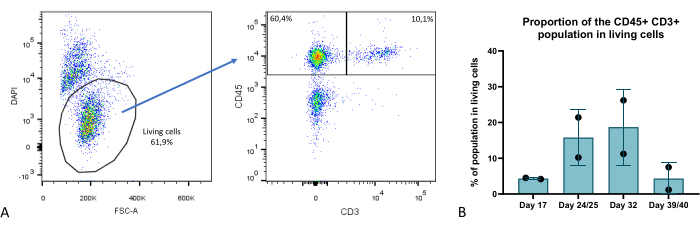
图 9:胸腺类器官中 T 细胞区室的比例。 (A) 点图示例,3D 培养第 35 天胸腺类器官中活 (DAPI-) 细胞中 CD45+ CD3+ 细胞的比例,图像来自 FlowJo 10.0.7。CD45 + CD3 - 组分包括造血非胸腺细胞。(B) 在 3D 培养的第 17、24/25、32 和 39/40 天,胸腺类器官中活细胞中 CD45 + CD3 + 细胞的比例,n=2 在技术上一式两份或一式三份,来自 Prism 的图表(GraphPad 版本 8.0.1)。 请单击此处查看此图的较大版本。
| 单位 | 第 1 阶段培养基第 14 天至第 18 天 | 第 2 阶段 中等 第 19 天开始 | |
| 基础 | XVIVO10 | XVIVO10 | |
| BMP4 | 纳克/毫升 | 50 | |
| FGF8 | 纳克/毫升 | 10 | |
| FGF10 | 纳克/毫升 | 10 | |
| IGF1 | 纳克/毫升 | 10 | |
| EGF | 纳克/毫升 | 10 | |
| 等级 L | 纳克/毫升 | 50 | 50 |
| IL7 | 纳克/毫升 | 5 | 5 |
| FLT3 L | 纳克/毫升 | 5 | 5 |
| 云函数 | 纳克/毫升 | 10 | 10 |
| 谷氨酰胺 | 纳克/毫升 | 1% | 1% |
表 1:补充剂及其各自的浓度。
| 抑肽酶 (μL) | 凝血酶 (μL) | 纤维蛋白原 (μL) | 1 相培养基 | 类器官 (单位) | |
| 24 孔板 | 5 | 75 | 75 | 1 | 3 到 5 |
| 12 孔板 | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| 6 孔板 | 16 | 240.8 | 240.8 | 3.2 | 8 至 9 |
表 2:在 6、12 和 24 孔板中制备水凝胶和接种类器官所需的组分比例。
Discussion
与 2D 中的经典单层培养或更先进的最先进的 3D 模型(如 RTOC(聚集胸腺器官培养))相比,我们在这里描述的模型呈现出显着的改进。从技术角度来看,该模型提供了更高的可扩展性和可重复性,因为 TEC 来源于自我更新的 iPS 细胞。它还允许在 iPSC 阶段进行基因编辑,以便更轻松地在 TEC 中敲入或敲除研究。本研究中所示的胸腺类器官的存活率非常显著,与 2D 或 RTOC 培养相比,它提供了显着的改善,已证明 T 细胞生成长达 6 周(图 9)。因此,胸腺 3D 结构和 ECM 特性的重建导致我们的胸腺类器官中持续的胸腺功能,即从最成熟的胸腺细胞区室产生 T 细胞的能力,最近的胸腺移民在 3D 培养的第 4 周左右,产生 CD4 + 和 CD8 + T 细胞23。
由于胸腺微环境支持强烈的扩增和分化活动,因此适当的气体交换是任何体外胸腺模型中的关键参数。事实上,在维持在富集双氧气氛或气液界面的模型中观察到了改善的结果21,35。我们的观察结果支持这一点,并强调了在空气界面下方的水凝胶顶部正确接种类器官的重要性。聚合缺陷导致粘稠到液体水凝胶,将导致类器官在插入物底部下沉并阻碍其生长。与芯片内皮细胞共培养是一种很有前途的替代方案,可以通过增加血管形成来打破这一屏障。本研究中产生的胸腺类器官的大小仅限于 5 毫米左右,据称是由于核心区域缺乏气体和营养交换。因此,血管化将允许扩大培养规模,并结合工艺优化,允许生产包含数百万个 TEC 和 T 细胞的类器官。水凝胶的密度也是一个关键参数,鉴于酶对冻融循环的敏感性,其跨批次的可重复性是该方案的主要限制之一。水凝胶灌注步骤是方案中的关键步骤;我们建议在任何计划实验前 1 小时通过灌注一枚水凝胶进行测试,以检查试剂活性。如果酶活性不足导致聚合受损,并且考虑到 iPSC 衍生的 TEP 的成本,我们建议除了使用新鲜试剂等分试样重新开始实验步骤外,没有其他故障排除方法。TEC 是 ECM 的重要生产者;然而,鉴于最近对胸腺成纤维细胞作用的理解进展,将辐照成纤维细胞群添加到类器官模型中可能会很有趣。该群体可以分泌生长因子和 ECM,这些生长因子和 ECM 将参与复制胸腺环境,对 TEC 和 T 细胞分化和维持产生积极影响。这种胸腺类器官模型的另一个重要限制是缺乏适当的皮质-髓质分离。因为胸腺的荚膜成纤维细胞已被证明可以塑造皮层的形成,所以将它们添加到培养模型中可能有助于解决这一限制。因此,该协议引入了胸腺复杂体外模型的基础。它结合了 iPSC 胸腺分化、基于 3D 水凝胶的培养和体外淋巴细胞生成领域的最新进展。该模型可以进一步优化,以解决可扩展性并增加其复杂性,例如,通过添加间充质和血管隔室。因此,它可能会产生有价值的免疫研究平台或基于个性化 T 细胞的细胞疗法的应用。
Disclosures
作者声明他们没有利益冲突。
Acknowledgements
我们要感谢由 Laurent David 领导的法国南特 iPSC 核心工厂的成员。这项工作得到了 JP-罕见病JTC2019计划 TARID 项目 (EJPRD19-208) 的支持,该项目由 ANR (ANR-19-RAR40011-5) 资助给 M.G.,由 la Région Pays de la Loire 资助给 M.G.,由 ANR (ANR-22-CE15-0045) 资助给 M.G. 和“SATT Ouest Valorisation”项目 OrgaTreg 到 M.G. N.P. 得到了“la fondation d'entreprise ProGreffe”的支持。M.d.A. 得到了“la Fondation pour la Recherche Médicale”的支持。我们感谢南特的 iPSC 核心设施,在 IBiSA 和 Biogenouest 的支持下,使用他们的资源和技术支持。这项工作部分由国家研究署通过投资未来计划 ANR-11-LABX-0016-01 支持的 Labex IGO 计划资助。
Materials
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
References
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved