היווצרות אורגנואידים של בלוטת התימוס האנושית בהידרוג'לים תלת מימדיים של פיברין
* These authors contributed equally
In This Article
Summary
במאמר זה אנו מתארים פרוטוקול להיווצרות אורגנואידים אנושיים של בלוטת התימוס המופקת מתאי גזע פלוריפוטנטיים (iPSC) הגדלים בהידרוג'לים תלת-ממדיים של פיברין, במטרה לתמוך בהבשלת תאי אפיתל תימיים (TEC) ובתחזוקה ממושכת, כמו גם במבחנה, כמו גם במבחנה.
Abstract
יצירת רפרטואר תאי T פונקציונלי וסובלני לעצמו הוא תהליך מורכב התלוי במיקרו-סביבה התימית, ובעיקר, בתכונות המטריצה החוץ-תאית שלה (ECM). תאי אפיתל תימיים (TECs) חיוניים לתימופויזה, טיפוח ובחירה של תאי T מתפתחים על ידי סינון שיבוטים תגובתיים עצמיים. TECs הוכחו אמפירית כרגישים במיוחד לרמזים פיזיקליים וכימיים המסופקים על ידי ECM ותרבית תאים חד-שכבתית קלאסית מובילה לאובדן מהיר של פונקציונליות עד מותם. בגלל תחזוקה עדינה זו בשילוב עם נדירות יחסית, ולמרות הסיכונים הגבוהים במידול ביולוגיה של בלוטת התימוס במבחנה, מודלים המסוגלים לחקות נאמנה את נישת TEC בקנה מידה גדול ולאורך זמן עדיין חסרים. במאמר זה אנו מתארים את היווצרותו של מודל אורגנואיד תימי אנושי רב-תאי, שבו תא ה-TEC נגזר מתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) ומצטבר מחדש עם אבות ראשוניים מוקדמים של תימוציט בהידרוג'ל תלת-ממדי (תלת-ממדי) מבוסס פיברין. מודל זה עונה על הצרכים הנוכחיים למערכת תרבית ניתנת להרחבה המשחזרת את המיקרו-סביבה התימנית ex vivo ומדגימה פונקציונליות, כלומר היכולת לייצר תאי T ולתמוך בצמיחת אורגנואיד בלוטת התימוס במשך מספר שבועות. לפיכך, אנו מציעים מודל מעשי במבחנה של פונקציונליות בלוטת התימוס באמצעות אורגנואידים שמקורם ב-iPSC שיועיל למחקר על ביולוגיה של TEC ועל ייצור תאי T ex vivo.
Introduction
בלוטת התימוס היא איבר לימפואידי ראשוני הממלא תפקיד חיוני ביצירת מערכת חיסון מוכשרת וסובלנית 1,2,3. אבות תימיים מוקדמים (ETPs) נודדים ממח העצם אל בלוטת התימוס, שם הם מתרחבים ומתמיינים לתאי T פונקציונליים 1,2,4,5. תהליכים אלה מתווכים על ידי אוכלוסייה מיוחדת, תאי אפיתל תימיים (TECs)2,6,7. TECs מופקים מאבות אפיתל תימיים (TEPs)8,9 וכוללים TECs קליפת המוח (cTECs) ו-TECs מדולריים (mTECs) הממלאים תפקידים ספציפיים ביצירת המיקרו-סביבה התלת-ממדית המיוחדת הדרושה לנדידה, הרחבה והתבגרות של תאי T. TECs מתווכים את התפתחות תאי T בעיקר על ידי מתן גורמי גדילה והתמיינות 1,10,11 ועל ידי בחירה שלילית של תימוציטים לא פונקציונליים ולא סובלניים באמצעות הצגת אנטיגנים עצמיים 5,7,12. האינטראקציות המורכבות בין תאי T מתפתחים לבין תאי TEC ממלאים גם הם תפקיד מרכזי בהבשלה ובארגון התלת-ממדי של אוכלוסיות TEC בתהליך המכונה crosstalkתימי 1,11. אינטראקציות בין אוכלוסיות התאים של בלוטת התימוס מסתמכות במידה רבה על מיקרו-סביבה ספציפית המעוצבת על-ידי המטריצה החוץ-תאית (ECM). ECM תימי נמצא במצב של הדדיות דינמית עם אוכלוסיות תאים תימיים, משפיע על בקרת גנים ומעוצב מחדש כל הזמן בתמורה על ידי הפרשת אנזימים או חלבוני מטריצה13. ה-ECM משפיע על התאים באמצעות שינוי הזמינות הביולוגית של גורמי גדילה וציטוקינים, איתות ישיר באמצעות קולטנים הקשורים לקרום כגון אינטגרינים, ועל ידי עיצוב שלדים ציטו-שלדים באמצעות כוחות פיזיקליים14. רכיבי ECM תימיים, כגון קולגן ולמינין, הוכחו כבעלי זיקה גבוהה לגורמי גדילה TGFb ו- FGFs, החיוניים לתחזוקת TEC ולקיבועם על ידי יצירת קומפלקסים. פלסטיות ECM תימית, מודולוס אלסטי וצפיפות ממלאים גם הם תפקיד מכריע בהוראת גורל TEC ובעיצוב המידור של בלוטת התימוס, החיונית לתפקודו. רמזים אלה מדגישים את החשיבות של התחשבות ב-ECM ובמבנה התלת-ממדי שלו כדי לחקות את בלוטת התימוס ex vivo. נקודה זו נתמכת על ידי העובדה כי TECs ראשוניים מתמיינים במהירות, מאבדים את הפונקציונליות שלהם, ובסופו של דבר מתים כאשר מעובדים בתצורות תרבית תאים קלאסיות 15,16,17.
מודלים תרבותיים פותחו כדי להרחיב אוכלוסיות TEC פונקציונליות מצמחים תימיים אנושיים על מנת לשמר את המבנה של ECM ואת הרמזים החיוניים שהוא מספק ל- TECs 18,19,20. מערכת תרבות זו הצליחה להרחיב ולתחזק בהצלחה אוכלוסייה של TECs פונקציונליים במבחנה, אך לא יכלה להתקיים מעבר ל-7 עד 8 ימי תרבות18. לפיכך, פיתוח מערכת תרבות תלת ממדית נגישה ומעשית המסוגלת לשחזר את המיקרו-סביבה התימנית ואת הפונקציונליות שלה במבחנה ובטווח הארוך הוא עניין מכריע בתחום. לאחרונה, הפיתוח של מערכות תרבית תלת ממדיות מבוססות הידרוג'ל הוביל להופעתן של מספר מערכות אורגנואידים תימיים מלאכותיים, המהוות התקדמות משמעותית עבור מודלים תימיים חוץ גופיים 15,16,21,22. פיתחנו מערכת תרבית משותפת של אורגנואיד תימי אנושי (hTO) באמצעות צבירה מחדש של ETPs ראשוניים אנושיים עם TEPs אנושיים שמקורם בתאי גזע פלוריפוטנטיים מושרים (iPSC) לספרואידים וזריעתם על הידרוג'ל פיברין.
הבחירה במערך החומר וההידרוג'ל במחקר זה נועדה לשחזר את המבנה המקורי של ה-ECM התימי תוך שמירה על מעשיות ויכולת להרחיב את התהליך כדי להשיג מקור חומר זול ושופע לניסויים15. מערכת hTO זו מראה פוטנציאל התמיינות רב-שושלת ויכולה לתמוך בתימופויזיס פרודוקטיבי מ-ETPs23. מערכת אורגנואידים זו מהווה כלי אמין לחקר אינטראקציות תאיות תוך תימיות ולמידול לימפופואזיס אנושי נורמלי ופתולוגי. השימוש בתאי iPS מכניס גם יכולות עריכת גנים לתוך המודל. התמיינות יעילה של iPSC לרקמה תימית תפקודית הייתה מטרה ארוכת שנים של התחום במשך 15 השנים האחרונות, והתקדמות משמעותית הושגה עם פענוח גורל שושלת TEC המסמן 21,24,25,26,27. כדי לענות על הצורך במודל תימי תלת-ממדי במבחנה כזה, הערה טכנית זו מתארת את השיטות והפרטים הטכניים ליצירה שלב אחר שלב של אורגנואידים אנושיים של בלוטת התימוס האנושית שמקורם ב-iPSC, תוך התמקדות בהיווצרות פיגומים הידרוג'ליים, צבירה מחדש וזריעה של מיקרומסה של תאים, תרבית אורגנואידים וקציר.
Protocol
קו hiPSC hiN.Fm.m.Lon71.019 נוצר מפיברובלסטים בוגרים זכרים ותוכנת מחדש באמצעות טרנספקציית mRNA. קו hiPSC hiN.Fm.f.Lon80.002 נוצר מנקבות פיברובלסטים בוגרות ותוכנת מחדש באמצעות טרנספקציית mRNA. קו hiPSC hiN.Fs.f.MIPS203.003 נוצר מפיברובלסטים בוגרים של נקבות ותוכנת מחדש באמצעות זיהום וקטורי נגיפי רקומביננטי של סנדאי. כל קווי התאים סופקו על ידי פלטפורמת נאנט iPSC. חולים נתנו הסכמה מדעת לשימוש בתאים שלהם למטרות מחקר (אוסף אנונימי, Lonza, cat # CC-2511). ETPs ראשוניים מבודדים על ידי דיסוציאציה של דגימות תימיות אנושיות לאחר הלידה המתקבלות כפסולת מושלכת אנונימית מחולים שעברו ניתוח לב ילדים בבית החולים נאנט' (CHU נאנט) באותו יום, בהתאם לתקנות CODECOH הצרפתיות תחת הצהרה DC-2017-2987.
1. הבחנה מכוונת של iPSCs כלפי זהות TEP
הערה: מאז העבודות הראשונות שפורסמו על ידי לאי וג'ין המדגימות את ההתמיינות של תאי גזע עובריים מורינים (EScs) לקראת זהות אפיתל תימית28, מספר מחקרים פיתחו וייעלו פרוטוקולים המתארים את ההתמיינות המכוונת של תאי iPS אנושיים לזהות TEP 21,24,25,26,27,29 . מחקרים אלה מובילים להבחנה בין TEPs המבטאים סמני זהות אפיתליאליים תימיים כגון FOXN1 ו- PAX9 24,25,28,30, כמו גם סמני פונקציונליות כגון DLL4 ו- AIRE26, אך חסרים סמני התבגרות TEC24,25. שתי גישות הוכחו כתומכות בהבשלה של TEPs מובחנים לזהות TEC בוגרת: השתלה במודל in vivo כגון עכברים29, וצבירה מחדש למערכות אורגנואידים תימיות תלת-ממדיות המעובדות במערך ממשק אוויר-נוזל21. שתי המערכות הדגימו את התפקיד המכריע שממלא המבנה התלת-ממדי בשמירה ותמיכה בהבשלה של אוכלוסיות TEC פונקציונליות המסוגלות לתמוך בלימפופואזיס T in vivo או in vitro T 15,24,25,31.
- עבור מערכת האורגנואידים התימיים ששימשה במחקר זה, בצע את ההתמיינות של תאי iPS לקראת זהות TEP בעקבות פרוטוקול שפותח ומפורט ב- Provin et al.23.
2. בידוד של ETPs ראשוניים מדגימה תימית בילדים
הערה: ETPs הם אבות שמקורם במח עצם היוצרים את שושלת תאי T ולתאים דנדריטיים בתוך בלוטת התימוס ומציגים את הפנוטיפ הבא: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- הכנת חרוזי הדלדול
- יום לפני, להעביר חרוזי בידוד תאים מגנטיים (טבלה של חומרים) לצינור 15 מ"ל ולשטוף עם 4 מ"ל של מאגר בידוד (PBS + 0.1% BSA + 2 mM EDTA).
- הניחו את הצינור במעמד המגנטי, הסירו את הסופרנטנט והוסיפו 2 מ"ל של חיץ בידוד.
- הוסף נוגדנים נגד עכבר CD3, CD4 ו- CD8 לחרוזים ודגור במשך 45 דקות ב 4 ° C תחת תסיסה. הניחו את הצינור במעמד המגנטי, שטפו אותו מספר פעמים במאגר בידוד והשעו אותו מחדש ב-20 מ"ל של מאגר בידוד.
- דיסוציאציה של דגימת בלוטת התימוס
- מעבירים דגימות תימוס טריות לצלחת פטרי מלאה RPMI1640 (טבלת חומרים). חותכים אותו עם מספריים סטריליים דיסקציה צבת לחתיכות על 1 מ"מ3 גודל.
- עם פיפטה 25 מ"ל, לשטוף את המדיום ואת שברים מספר פעמים (המדיום צריך להפוך מעונן), ולאחר מכן לאפשר את השברים לשקוע ולאסוף מחצית המדיום לתוך צינור 50 מ"ל. מוסיפים עוד מדיום וחוזרים על הפעולה עד שהמדיום נשאר נקי.
- אספו את המדיום לכמה שיותר צינורות של 50 מ"ל לפי הצורך, וסובבו את הצינורות ב 200 x גרם במשך 5 דקות.
- הסר את supernatant ו resuspend את הכדורים ב 10 מ"ל של תמיסת ליזה של תאי דם אדומים (טבלה של חומרים). יש לדגור בטמפרטורת החדר (RT) למשך 5 דקות ולהוסיף 20 מ"ל של מאגר כביסה (PBS + 0.5% BSA + 4 mM EDTA + 1% פניצילין/סטרפטומיצין).
- סובבים ב 200 x גרם במשך 5 דקות ולהסיר את supernatant. יש להשהות מחדש את הכדוריות ב-10 מ"ל של חיץ כביסה, לסנן דרך מסנן רשת של 70 מיקרומטר ולספור את התאים.
- העשרת ETP
- לאחר ספירת התאים, התאימו את עוצמת הקול ל -10 מ"ל לכל צינור באמצעות מאגר הכביסה. הוסף את הכמות הנדרשת של חרוזי בידוד תאים (לכל 200 מיליון תאים, השתמש 500 μL של חרוזים ב 20 מ"ל של חיץ בידוד) ודגור ב 4 ° C תחת תסיסה במשך 30 דקות.
- הניחו את הצינור על המעמד המגנטי למשך 2 דקות, ואספו בזהירות את הסופרנאטנט בצינור נקי. הסר את הצינור ונקה את החרוזים עם 20 מ"ל של חיץ בידוד. סובבו את הצינור, הניחו אותו בחזרה על המעמד המגנטי ואספו את הסופרנטנט. חזור על שלב זה פעמיים.
- סובבו את הסופרנאטנטים במהירות של 200 x גרם במשך 5 דקות. להשהות מחדש את הכדוריות ב 2 מ"ל של מאגר בידוד ולספור את התאים.
- בידוד ETP
- התאימו את הריכוז ל-200 מיליון תאים למ"ל ואספו נפח קטן כבקרה לא מוכתמת.
- תייג את התאים עם שושלת אנטי-אנושית של עכבר (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 ונוגדנים CD34 (השתמש באותו פלואורוכרום עבור כל סמני לין). יש לדגור ב-4°C למשך 45 דקות.
- שטפו את התאים בנפח שווה של מאגר כביסה. סובב את התאים ב 200 x גרם במשך 5 דקות, להשעות את הגלולה ב 1 מ"ל, ולספור את התאים.
- התאימו את הנפח לריכוז של 50 מיליון תאים למ"ל וסננו את התאים דרך מסנן רשת של 70 מיקרומטר.
- הוסף את סמן הכדאיות לבחירה ומיין תאי Lin- CD34+ CD7+ חיים לפי ציטומטריית זרימה באמצעות זרבובית 70 מיקרומטר.
3. 3D תרבית אורגנואידים תימית
- הכנת TEP
- מיד לאחר בידוד ETP, שלוט באיכות תרבית TEP בימים 13-15. ודאו שהתאים מגיעים למפגש ויוצרים שכבה חד-שכבתית צפופה עם בליטות (איור 1).
- כדי לקצור את TEPs ממוין, לשטוף את התאים עם DPBS-/-, להסיר אותו, להוסיף 1 מ"ל של TrypLE (טבלה של חומרים) לכל באר, לדגור ב 37 ° C במשך 5-7 דקות.
- הוסף 1 מ"ל של XVIVO10 (טבלה של חומרים) לכל באר, לשטוף מספר פעמים כדי לנתק את התאים, להעביר צינור 15 מ"ל, ולסובב ב 200 x גרם במשך 5 דקות.
- הסר את supernatant, להשעות מחדש את הגלולה ב 1 מ"ל של XVIVO10, ולספור את התאים.
הערה: כדי להעריך את יעילות ההתמיינות מבעוד מועד, השתמש היטב בתרבית בנפרד ואמת את הביטוי של FOXN1 ו-PAX9 על-ידי RT-qPCR ואת תפוקת ההתמיינות על-ידי ציטומטריית זרימה (מחושב כשבר של תאי EPCAM+ CD205+, שאמור להיות מעל 50%) (איור 1). בשלב זה של התמיינות, כמעט כל תאי EPCAM+ חיוביים גם עבור CD205, המעידים על זהותם המבשרת11.
- הכנת ETP
- מיד לאחר בידוד ETP, סובב את צינור האיסוף ב 200 x גרם במשך 5 דקות. להשעות את הגלולה ב 1 מ"ל של XVIVO10 ולספור את התאים.
- צבירת אורגנואידים תימיים
- פיפטה את הנפחים המתאימים ומאגדת את שני מתלי התאים בריכוז של 2,00,000 TEP ו 40,000 ETP למ"ל, פיפטה עדינה למעלה ולמטה פעם אחת כדי הומוגניזציה.
- הוסף את התוספים המתאימים לפי טבלה 1, וצלחת 100 μL של תרחיף התא המעורב לכל באר בלוחות U תחתונים בעלי קשירה נמוכה 96 בארות. השתמש פיפטה רב ערוצית עבור פלט מוגבר; עם זאת, פיפטה קלאסית בעלת קצה אחד מגבילה אובדן נפחים של תאים יקרים. לדגור על הצלחות ב 37 ° C ו 5% CO2 במשך הלילה.
- הכנת ההידרוג'לים
הערה: מערך הניסוי המשמש ליצירת הידרוג'ל, זריעת אורגנואידים ופיזור מדיום תרבית מוצג באיור 2.- למחרת (יום 1 של שלב תרבית האורגנואידים), להפשיר aliquots של תרומבין (10 U / mL), Aprotinin (26,000 U / mL), ו פיברינוגן (8 מ"ג / מ"ל) (טבלה של חומרים). להפשיר את טרומבין ו aprotinin על קרח ואת פיברינוגן באמבט מים 37 מעלות צלזיוס (לא לשים אותו על קרח, כפי שהוא יהיה לזרז). אין לערבל, אלא להניח את aliquots מתחת למכסה המנוע הומוגנית אותם על ידי pipetting עדין.
- הכינו כמה תוספות תלויות לפי הצורך למספר האורגנואידים המיוצרים בהתאם ליחסים המוצגים בטבלה 2. מניחים את התוספות לבארות התרבית באמצעות צבת סטרילית, ומשאירים לפחות טור אחד או שורה אחת ריקה בצלחת התרבית.
- הכינו כמה שיותר צינורות של 1.5 מ"ל כמו ג'לים ליצוק. בכל צינור, פיפטה תחילה את הנפחים הנדרשים של פיברינוגן ואפרוטנין כמפורט בטבלה 2.
- בפעם השנייה, להוסיף את נפח תרומבין הנדרש לתוך צינור אחד, במהירות לשטוף 2 פעמים מבלי ליצור בועות כדי הומוגניזציה של ריאגנטים, ולאחר מכן לצייר את כל התוכן של הצינור במהירות לשטוף את התערובת לתוך הכנס התלוי. מקמו את הפיפטה במאונך מעל מרכז האינסרט ושטפו בעדינות את תערובת הריאגנט מבלי ליצור בועות.
הערה: בשלב זה, מהירות הביצוע היא קריטית מכיוון שריאגנטים יעברו פילמור תוך מספר שניות, וחשוב לערבב אותם בצורה נכונה כדי למנוע היווצרות גושים או צפיפות לא אחידה בג'ל. המשך באר אחת בכל פעם באמצעות צינור שונה של 1.5 מ"ל עבור כל באר (אם נעשה שימוש חוזר בצינור למספר בארות, גושי ג'ל מוצקים שנותרו עלולים לחסום את קצה הפיפטה). אם הפילמור מתרחש מהר מדי בגלל הפעילות הגבוהה של הטרומבין, השתמש בדילול 1:2. מיד לאחר היציקה, הג'לים חייבים להיות שקופים עד מעט שקופים ועדיין לזרום לאחר מספר שניות כאשר הצלחת מוטה אנכית. - דגרו במשך שעה אחת לפחות בטמפרטורה של 37°C עד שהתמיסה השקופה מתמצקת והופכת ללבנה אטומה, והג'לים נשארים יציבים במקומם כאשר הצלחת מוטה אנכית (איור 2A).
- זריעה אורגנואידית
- ודא את האיכות של שלב הצבירה. ודאו שהמיקרו-מסות יוצרות מסות תאים כדוריות, עם ליבה קומפקטית שמוקפת בהילה בצפיפות נמוכה יותר של ETPs (איור 3).
- חתכו את קצה חרוט P200 ושטפו אותו בתמיסה נוגדת היצמדות (Table of Materials). כדי לקצור את מסת התא, הטו את הצלחת למצב כמעט אנכי: המיקרו-מסות ישקעו אל הקיר התחתון של הבארות וניתן יהיה לשחזר אותן בקלות על ידי דחיפה הדרגתית של קצה הפיפטה לתחתית הבאר תוך כדי שאיפה.
- זרעו את המסה בחלק העליון של ההידרוג'לים על-ידי הפקדתם בעדינות מבלי לגעת בג'ל עם קצה הפיפטה, בהתאם ליחסים המוצגים בטבלה 1 (איור 2B). גם אם האורגנואידים נראים צפים חופשי בשלב זה, כאשר הם נפוחים ממדיום התרבית, הג'ל יתרכך, והאורגנואידים יתמקמו בשכבה העליונה. בדקו תחת המיקרוסקופ שלא נותר אורגנואיד בבארות P96.
- הכינו את הנפח הנדרש של מדיום התרבית לפי טבלה 1 וטבלה 2, ובכל באר הוסיפו לאט רבע מהנפח בחלק העליון של ההידרוג'לים מבלי לגעת בהם על ידי פיפטינג לאורך דפנות ההחדרה ואת שלושת רבעי הנותרים בתחתית הבאר על ידי מיקום הפיפטה בין זרועות האינסרט התלוי (איור 2C).
- מניחים 1 מ"ל של PBS בבארות התרבית הריקות כדי לשמור על לחות בצלחת. יש לדגור ב-37°C וב-5% CO2.
- תרבית אורגנואידים תימית
- ביום השני, בדקו אם האורגנואידים נזרעו היטב: ההידרוג'לים כנראה נשארו במקומם, והאורגנואידים כנראה לא שקעו בתחתית העלון.
- הכינו את כמות אמצעי התרבות הנדרשת לפי טבלה 1 וטבלה 2. הסר את המדיום על ידי הכוונת קצה חרוט השאיפה בין זרועות הכנס התלוי, תוך הקפדה לא לגעת בג'ל. מוסיפים את המדיום החדש על ידי מיקום פיפטה באותו אופן.
- שנה את התווך כל יומיים, ועבור למדיום השלב השני (טבלה 1) לאחר 2 עד 4 ימים (ביום ה-18 שלאחר תחילת התמיינות TEP).
הערה: ניתן לשמור את אצווה אורגנואיד בתרבית באופן זה עד 6 שבועות.
- קציר אורגנואידים
- הכינו צינור של 15 מ"ל עם 1 מ"ל של טריפל לכל באר לקציר.
- חתכו את קצה חרוט P1000 וציפו אותו בתמיסה נגד היצמדות. מחזירים בעדינות את הג'ל על ידי הנחת קצה הפיפטה אנכית במרכז התוספות (נזהרים לא לנקב את הממברנה) ומעבירים לצינור הטריפל. שוטפים את קרום האינסרט עם TrypLE ומעבירים גם לצינור.
- יש לדגור בטמפרטורה של 37°C למשך 15 דקות, ולערבל בעדינות במרווחים של 5 דקות. ודא שהג'לים והאורגנואידים מתנתקים.
- לאחר 15 דקות, מסננים מסנן רשת בגודל 70 מיקרומטר ומסתובבים במהירות של 200 x גרם למשך 5 דקות. השהה מחדש את הגלולה במאגר הכביסה והמשך לשיטה האנליטית של בחירה.
Representative Results
זרימת העבודה של הפרוטוקול מסוכמת באיור 4. עבור מודל תרבית אורגנואידים תלת-ממדי זה, אימצנו הידרוג'ל תרומבין ופיברינוגן ששימש בעבר את הצוות שלנו כדי לשמור על mTECs עכבר ראשוניים במשך כמה ימים, הודות לרמזים הפיזיים והמכניים שהוא סיפק34. לאחר פילמור, הג'ל אמור להציג מבנה רשת רופף דמוי ספוג (איור 5).
לאחר שלב הזריעה וההתקשרות הראשוני, האורגנואידים גדלו והתפתחו בהדרגה הן על פני השטח והן בתוך השכבות העליונות של הג'ל. בהתאם לתכונות הג'ל, תנאי הזריעה ומספר האורגנואידים שנזרעו על הג'ל, האורגנואידים יצרו מבנים כדוריים עד מלבניים (איור 6) ומדי פעם התמזגו ליצירת מבנים גדולים יותר. שתי תת-רמות מסוימות של הארגון נצפו בתוך האורגנואידים לאחר השבוע הראשון של התרבית: ראשית, צפינו במבנים ארוכים דמויי הקרנה של פני התא שנוצרו על-ידי תאים גדולים המקרינים מהאורגנואידים ומאכלסים את ההידרוג'ל לכל הכיוונים (איור 6 ואיור 7). שנית, צפינו במבנים דמויי צביר שנוצרו על-ידי תאים קטנים יותר שהתרכזו סביב הקרנות התאים האלה. אף על פי שלא הצלחנו לבודד את שני סוגי התאים כדי לאשש את השערת המחקר, תופעה זו מזכירה סידורים תלת-ממדיים שנמצאים בתוך קליפת המוח התימית, שנוצרו על-ידי אינטראקציה של cTECs בודדים עם מספר גדול של תאי T מתפתחים קטנים בהרבה, הידועים כקומפלקסים של תאי אחות תימיים11 (איור 8).
בכמה נקודות זמן במהלך שלב תרבית האורגנואידים, הערכנו את ההרכב התאי של האורגנואידים התימיים לפי ציטומטריית זרימה וזיהינו כמה תאים מרכזיים: TEC (מאופיין כ-EPCAM+ CD45-), תימוציטים (EPCAM- CD45+ CD3+) (איור 9), כמו גם תא EPCAM- CD45+ CD3 הכולל תת-קבוצות המטופויטיות תימיות שאינן תימוציטים. פרטים נוספים ניתן למצוא ב Provin et al.23.
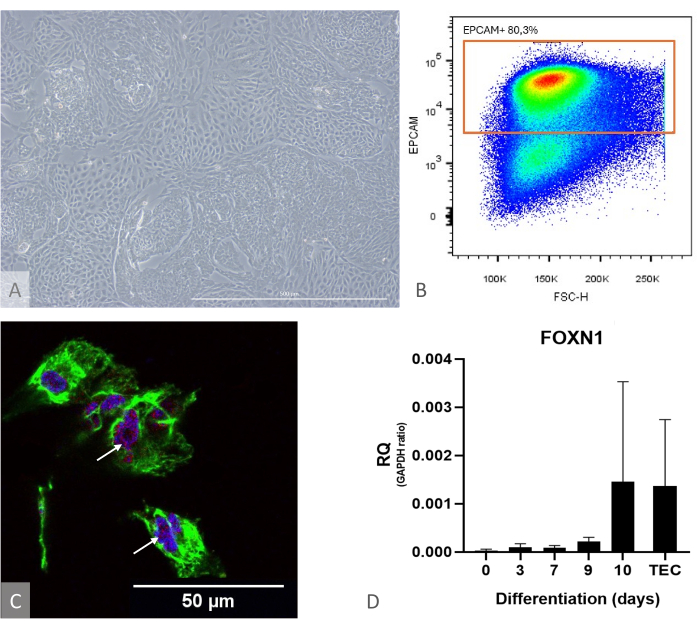
איור 1: אפיון התמיינות iPSC ל-TEP. (A) דוגמה להתמיינות iPSC ל-TEP ב-D13, מיקרוסקופ ניגודיות פאזה הפוכה, 400x. סרגל קנה מידה: 500 מיקרומטר. (B) דוגמה לתרשים נקודה, היחס של תאי EPCAM+ בין תאי DAPI ביום 14 להתמיינות, תמונה מתוך FlowJo 10.0.7. (C) צביעה חיסונית כנגד DAPI (כחול), PAX9 (אדום) ו-KRT8 (ירוק), אימונופלואורסנציה והדמיה קונפוקלית ביום ה-16 של התמיינות iPSC ל-TEP. חיצים לבנים מצביעים על דוגמאות לצביעה נגד PAX9. סרגל קנה מידה: 50 מיקרומטר (D) רמת ביטוי של FOXN1 (RQ ל-GAPDH) במהלך הבחנה בין iPS ל-TEP. TEC: ייחוס בקרה חיובית, TECs אנושיים ראשוניים שבודדו מדגימות בלוטת התימוס בילדים. גרף מפריזמה (GraphPad גרסה 8.0.1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
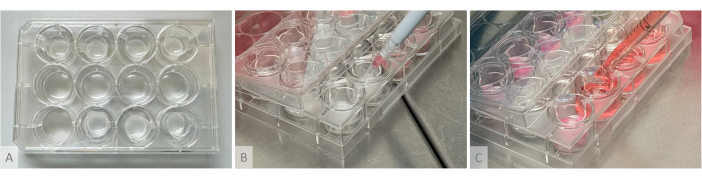
איור 2: מערך ניסיוני ליצירת הידרוג'ל, זריעת אורגנואידים ופיזור מדיום תרבית. (A) צלחת תרבית עם הידרוג'לים יצוקים לתוספות תלויות המונחות בשורה העליונה והתחתונה. (B) זריעת אורגנואידים: חרוט הפיפטה החתוך המכיל אורגנואיד אחד מונח מעל ההידרוג'ל מבלי לגעת בו, והאורגנואיד נזרע בעדינות על פני השטח של הג'ל. (ג) מדיום התרבות מופקד היטב בתרבות על ידי מיקום קצה הפיפטה בין זרועות התוספת התלויה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
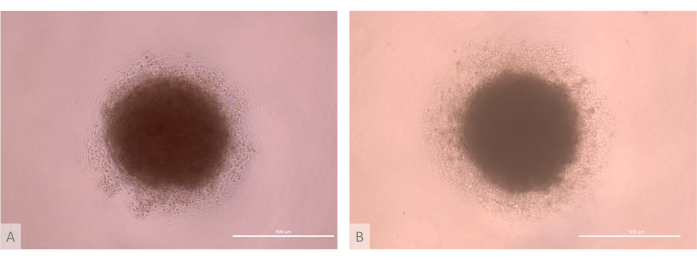
איור 3: D0 של תרבית אורגנואידים תימיים לפני הזריעה (ימים 13-15 של הפרוטוקול המלא). (A) אורגנואיד המיוצר באמצעות TECs הנגזרים מקו Lon71.019 iPS. (B) אורגנואיד המיוצר עם TECs הנגזרים מקו MIPS203.003 iPS. מיקרוסקופ ניגודיות פאזה הפוכה, 1000x. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
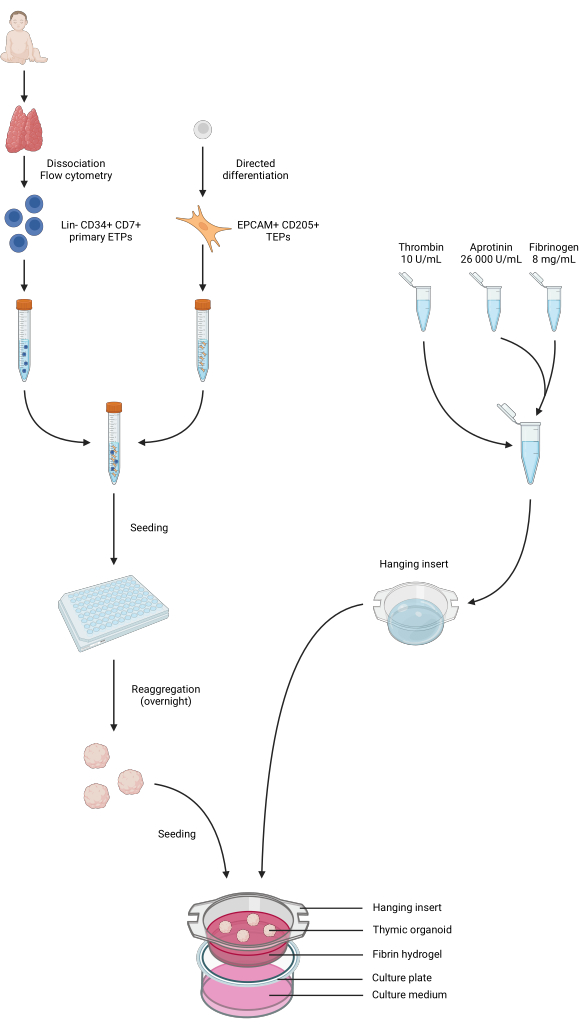
איור 4: ייצוג מסכם של כל שלבי הפרוטוקול. דגימות בלוטת התימוס בילדים נאספו ומנותקות, ו-ETPs ראשוניים של Lin- CD34+ CD7+ מוינו לפי ציטומטריית זרימה. התמיינות תאי iPS נעשתה לקראת זהות TEP. ETPs ו-TEPs שמקורם ב-iPS אוגמו ונזרעו בצלחות בעלות קישור נמוך של 96 בארות ונצברו לאורגנואידים תימיים בן לילה. הידרוג'ל פיברין הוכנו מאפרוטנין, פיברינוגן ותרומבין ונוצקו לתוספות תלויות. לאחר פילמור, האורגנואידים נזרעו על גבי ההידרוג'לים, ומדיום התרבית שלב 1 נוסף לבארות. האורגנואידים נשמרו בתרבית עד 6 שבועות. נוצר ב- BioRender, רישיון פרסום AG26EFCZOM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
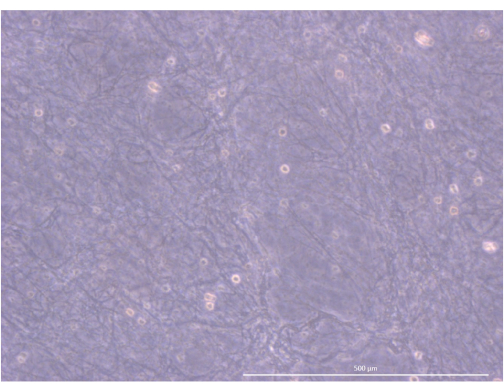
איור 5: ארגון ומבנה ההידרוג'ל. מיקרוסקופ ניגודיות פאזה הפוכה, 1000x. סרגל קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
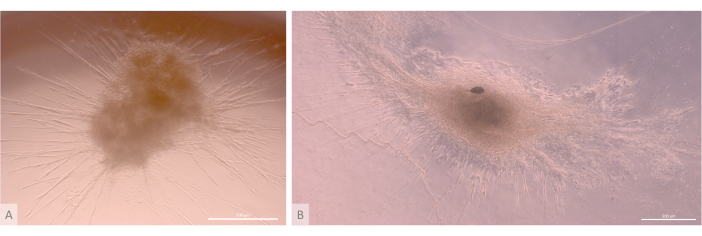
איור 6: אורגנואידים בוגרים ומבנה תלת-ממדי. (A) אורגנואיד תימי ביום ה-24 לתרבית תלת-ממדית, קו MIPS203.003 iPS. (B) תמונה מורכבת של אורגנואיד תימי ביום ה-32 לתרבית תלת-ממדית, קו Lon71.019 iPS. מיקרוסקופ ניגודיות פאזה הפוכה. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
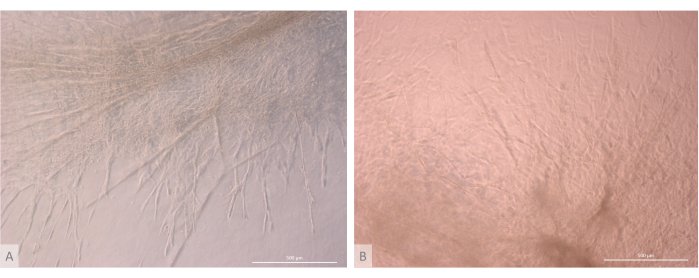
איור 7: פרטי מבנה של אורגנואידים תימיים. (A) אורגנואיד תימי ביום 32 לתרבית תלת-ממדית, קו L71.019 iPS. (B) אורגנואיד תימי ביום ה-27 של תרבית תלת-ממדית, קו L80.002 iPS. מיקרוסקופ ניגודיות פאזה הפוכה, 400x. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
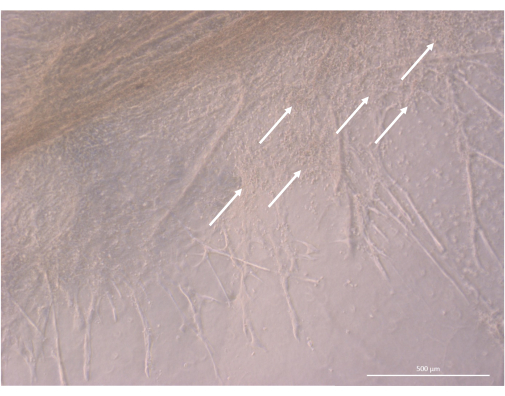
איור 8: פרט מבנה של אורגנואיד תימי ביום ה-32 של התרבית התלת-ממדית. חיצים לבנים מצביעים על צבירים של תימוציטים קטנים המתרבים בסמיכות לתאי TEC. מיקרוסקופ ניגודיות פאזה הפוכה, 400x. סרגל קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
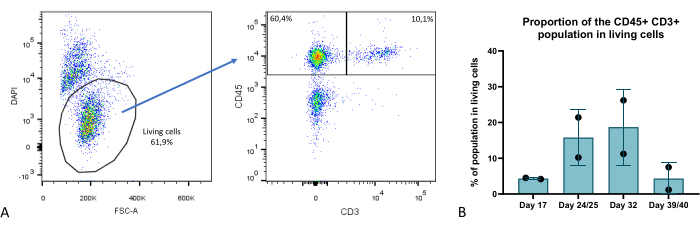
איור 9: פרופורציה של תא T בתוך אורגנואידים תימיים. (A) דוגמה לתרשים נקודה, פרופורציה של תאי CD45+ CD3+ בתוך התאים החיים (DAPI-) באורגנואידים תימיים ביום 35 של תרבית תלת ממדית, תמונה מתוך FlowJo 10.0.7. מקטע CD45+ CD3 מכיל תאים המטופויטיים שאינם תימוציטים. (B) חלקם של תאי CD45+ CD3+ בתוך תאים חיים באורגנואידים תימיים בימים 17, 24/25, 32 ו-39/40 של תרבית תלת-ממדית, n=2 בגרף טכני כפול או משולש מפריזמה (GraphPad גרסה 8.0.1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| יחידה | שלב 1 בינוני יום 14 עד יום 18 | שלב 2 בינוני יום 19 ואילך | |
| בסיס | XVIVO10 | XVIVO10 | |
| BMP4 | נ"ג/מ"ל | 50 | |
| FGF8 | נ"ג/מ"ל | 10 | |
| FGF10 | נ"ג/מ"ל | 10 | |
| IGF1 | נ"ג/מ"ל | 10 | |
| EGF | נ"ג/מ"ל | 10 | |
| דרגה L | נ"ג/מ"ל | 50 | 50 |
| IL7 | נ"ג/מ"ל | 5 | 5 |
| FLT3 L | נ"ג/מ"ל | 5 | 5 |
| SCF | נ"ג/מ"ל | 10 | 10 |
| גלוטמקס | נ"ג/מ"ל | 1% | 1% |
טבלה 1: תוספים וריכוזיהם בהתאמה.
| אפרוטינין (μL) | טרומבין (μL) | פיברינוגן (μL) | שלב 1 בינוני | אורגנואידים (יחידה) | |
| 24 צלחת באר | 5 | 75 | 75 | 1 | 3 עד 5 |
| 12 צלחת באר | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| 6 צלחת באר | 16 | 240.8 | 240.8 | 3.2 | 8 עד 9 |
טבלה 2: יחסי הרכיבים הנדרשים להכנת הידרוג'לים ולזריעת אורגנואידים בצלחות בנות 6, 12 ו-24 בארות.
Discussion
בהשוואה לתרבות חד-שכבתית קלאסית בדו-ממד או אפילו למודלים תלת-ממדיים מתקדמים ומתקדמים יותר כגון RTOC (reaggregated thymus organ culture), המודל שאנו מתארים כאן מציג שיפורים משמעותיים. מנקודת מבט טכנית, מודל זה מציע מדרגיות ויכולת שחזור משופרות מכיוון ש- TECs נגזרים מתאי iPS המתחדשים מעצמם. זה גם מאפשר עריכת גנים בשלב iPSC עבור מחקרים קלים יותר ב- TECs. השרידות של האורגנואידים התימיים שהוצגו במחקר הזה היא יוצאת דופן ומספקת שיפור משמעותי בהשוואה לתרביות דו-ממדיות או RTOC, עם ייצור תאי T מוכחים במשך עד 6 שבועות (איור 9). לפיכך, המבנה מחדש של המבנה התלת-ממדי התימי ותכונות ה-ECM מוביל לפונקציונליות תימית מתמשכת באורגנואידים התימיים שלנו, כלומר, היכולת לייצר תאי T מתא התימוציט הבוגר ביותר, מהגרים תימיים חדשים בסביבות שבוע 4 של תרבית תלת-ממדית, עם יצירה של תאי T CD4+ ו-CD8+23.
מאחר שהמיקרו-סביבה התימנית תומכת בפעילות התפשטות והתמיינות אינטנסיבית, חילופי גזים תקינים הם פרמטר מכריע בכל מודל של בלוטת התימוס במבחנה. ואכן, תוצאות משופרות נצפו במודלים שנשמרו באטמוספירה מועשרת של דו-חמצן או בממשקי אוויר-נוזל21,35. התצפיות שלנו תומכות בנקודה זו ומדגישות את החשיבות של זריעה אורגנואידית נכונה בחלק העליון של ההידרוג'ל ממש מתחת לממשק האוויר. פגמים בפילמור המובילים להידרוג'לים צמיגים עד נוזליים יגרמו לשקיעת אורגנואידים בתחתית התוספות ויפריעו לצמיחתם. תרבות משותפת עם תאי אנדותל על שבב היא חלופה מבטיחה שיכולה לשבור את המחסום הזה על ידי הוספת כלי דם. גודלם של אורגנואידי בלוטת התימוס המיוצרים במחקר זה מוגבל לכ-5 מ"מ, לכאורה בשל מחסור בגזים ובחילופי חומרים מזינים באזורי הליבה. הווסקולריזציה תאפשר אפוא הרחבת תרבית, ובשילוב עם אופטימיזציה של תהליכים, תאפשר ייצור אורגנואידים המכילים מיליוני תאי TEC ותאי T. צפיפות ההידרוג'ל היא גם פרמטר מכריע, ויכולת ההתרבות שלו בין אצוות היא אחת המגבלות העיקריות של הפרוטוקול, בהתחשב ברגישות האנזימים למחזורי הקפאה והפשרה. שלב יציקת ההידרוג'ל הוא שלב קריטי בפרוטוקול; אנו ממליצים לבצע בדיקה על ידי יציקת הידרוג'ל אחד 1 שעות לפני כל ניסוי מתוכנן כדי לבדוק את פעילות המגיב. במקרה של פעילות אנזימטית לא מספקת המובילה לפילמור לקוי ובהתחשב בעלות של TEPs הנגזרים מ- iPSC, אנו ממליצים לא לפתור בעיות אחרות מאשר להתחיל את הפרוטוקול שוב עם אליציטוטים ריאגנטים טריים. TECs הם יצרנים חשובים של ECM; עם זאת, בהתחשב בהתקדמות האחרונה בהבנת התפקיד של פיברובלסטים תימיים, זה יכול להיות מעניין להוסיף אוכלוסייה של פיברובלסטים מוקרנים לתוך מודל אורגנואידים. אוכלוסייה זו יכולה להפריש גורמי גדילה ו-ECM שישתתפו ברבייה של הסביבה התימית, עם השפעות חיוביות על התמיינות תאי TEC ו-T ותחזוקתם. מגבלה חשובה נוספת של מודל אורגנואיד זה של בלוטת התימוס היא היעדר הפרדה תקינה של קורטיקו-מדולריה. מאחר שהוכח כי הפיברובלסטים הקופסיים של בלוטת התימוס מעצבים את היווצרות קליפת המוח, הוספתם למודל התרבית יכולה לעזור להתמודד עם מגבלה זו. לפיכך, פרוטוקול זה מציג את הבסיס של מודלים מורכבים במבחנה של בלוטת התימוס. הוא משלב את ההתקדמות האחרונה שנעשתה בתחומים של התמיינות תימית iPSC, תרביות מבוססות הידרוג'ל תלת מימדי, ולימפופואזיס במבחנה. מודל זה יכול להיות משוכלל עוד יותר כדי לטפל במדרגיות ולהגדיל את המורכבות שלה, למשל, על ידי הוספת תאים מזנכימליים וכלי דם. לפיכך זה יכול להוביל לפלטפורמות מחקר יקרות ערך על חסינות או יישומים בטיפול תאי מותאם אישית מבוסס תאי T.
Disclosures
המחברים מצהירים כי אין להם ניגוד עניינים.
Acknowledgements
אנו רוצים להודות לחברי מתקן הליבה iPSC של נאנט, צרפת, בראשות לורן דוד. עבודה זו נתמכה על ידי תוכנית JTC2019 למחלות נדירות JP-Rare TARID (EJPRD19-208) שמומנה על ידי ANR (ANR-19-RAR40011-5) ל- M.G. על ידי מענק RFI Bioregate (ThymIPS) מ- la Région Pays de la Loire ל- M.G., על ידי ANR (ANR-22-CE15-0045) ל- M.G. ופרויקט "SATT Ouest Valorisation" OrgaTreg ל- M.G. N.P. נתמך על ידי "la fondation d'entreprise ProGreffe". M.D.A. נתמך על ידי "la Fondation pour la Recherche Médicale". אנו מודים למתקן הליבה iPSC של נאנט, הנתמך על ידי IBiSA ו- Biogenouest, על השימוש במשאבים ובתמיכה הטכנית שלהם. עבודה זו מומנה חלקית על ידי תוכנית Labex IGO הנתמכת על ידי סוכנות המחקר הלאומית באמצעות השקעה של התוכנית העתידית ANR-11-LABX-0016-01.
Materials
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
References
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved