Расширенное моделирование аневризмы брюшной аорты у мышей с помощью комбинации топической эластазы и перорального ß-аминопропионитрила
In This Article
Summary
Этот протокол описывает методический хирургический подход к моделированию прогрессирующих аневризм брюшной аорты у мышей путем комбинации прямого нанесения эластазы в инфраренальную аорту и введения ß-аминопропионитрила через питьевую воду.
Abstract
Мышиная модель аневризмы брюшной аорты (АБА) на основе местной эластазы усиливается в сочетании с питьевой водой, обогащенной бета-аминопропионитрилом (БАПН), для надежного образования истинных инфраренальных аневризм с поведением, имитирующим человеческие АБА. Местное применение эластазы к адвентиции инфраренальной аорты вызывает структурное повреждение эластических слоев стенки аорты и инициирует дилатацию аневризмы. Совместное применение BAPN, ингибитора лизилоксидазы, способствует устойчивой дегенерации стенок за счет снижения сшивки коллагена и эластина. Эта комбинация приводит к образованию больших АБА, которые постепенно расширяются, образуют внутрипросветный тромб и способны к разрыву. Совершенствование хирургических методов, таких как кольцевая изоляция всего инфраренального сегмента аорты, может помочь стандартизировать процедуру для последовательного и тщательного применения эластазы поджелудочной железы свиней, несмотря на различные операторы и анатомические различия у мышей. Таким образом, модель эластазы/BAPN представляет собой усовершенствованный подход к хирургическому индуцированию АБА у мышей, что может лучше повторить аневризмы человека и предоставить дополнительные возможности для изучения роста аневризмы и риска разрыва.
Introduction
Аневризма определяется как патологическое расширение кровеносного сосуда, превышающее 50% от диаметра здорового сосуда1. Несмотря на то, что аневризмы брюшной аорты (АБА) являются часто встречающимся заболеванием у стареющего населения, с частотой встречаемости примерно >5% мужчин > возрасте 65 лет, не существует направленных терапевтических стратегий для лечения АБА1. В настоящее время лечение АБА ограничено снижением факторов риска и хирургической коррекцией с помощью открытой или эндоваскулярной хирургии в зависимости от диаметра аорты или скорости роста2. Наибольшую опасность АБА представляет разрыв аневризмы, который при отсутствии лечения приводит к летальному исходу, и восстановление в таких чрезвычайных условиях может привести к риску смертности до 90%1.
Патофизиология АБА сложна, многофакторна и до конца не изучена3. Особенности АБА человека включают истинное расширение аневризмы стенки аорты с инфильтрацией воспалительных клеток, наличие внутрипросветного тромба и прогрессирующую дилатацию, которая приводит к возможному разрыву 3,4. Кроме того, АБА связаны с преклонным возрастом, имеют преобладание мужского пола 9:1 и чаще всего встречаются в подколенной аорте5. Моделирование всех особенностей и поведения человеческих АБА у животных остается постоянной проблемой6.
Современное моделирование АБА в основном проводится на мышах, и аневризмы обычно индуцируются с помощью одного из трех методов - инфузией ангиотензина II (AngII) с помощью подкожно имплантированного осмотического насоса и прямым применением хлорида кальция (CaCl2) или эластазы в аорту7. В последнем методе панкреатическая эластаза (СИЗ) свиней наносится на сегмент инфраренальной аорты и вызывает ферментативную деградацию волокон эластина в эластической ламели оболочки. Это структурное повреждение приводит к ослаблению стенки аорты и расширению аневризмы наружу. Использование только топической эластазы, однако, приводит к относительно небольшим инфраренальным аневризмам, которые не могут постепенно увеличиваться или разрываться с течением времени. Совсем недавно Lu et al. усовершенствовали эту модель, дополнительно вводя β-аминопропионитрил (BAPN), необратимый ингибитор лизилоксидазы, своиммышам, получавшим эластазу. Предотвращая сшивание эластиновых и коллагеновых волокон, добавки BAPN вызывают прогрессирующее расширение поврежденных эластазой аорт до точки разрыва. Кроме того, модель эластазы/BAPN имеет более высокую частоту встречаемости АБА, чем модель топической эластазы, а образующиеся аневризмы также больше и содержат внутрипросветный тромб8.
В модели эластазы/BAPN степень хирургической диссекции и воздействие эластазы на аорту могут повлиять на успех и воспроизводимость этой модели. В этой рукописи мы описываем, что одновременное введение питьевой воды BAPN и местное применение эластазы в аорте после кольцевой изоляции всего инфраренального сегмента аорты улучшает воспроизводимость, учитывает анатомические различия между животными и приводит к увеличению скорости индукции АБА, размеров аневризмы и частоты разрывов. В этой статье мы опишем стандартизированный подход к надежному индуцированию прогрессирующих аневризм брюшной аорты у мышей с использованием комбинации местной воды с добавлением эластазы и BAPN.
Protocol
Протоколы для животных одобрены Комитетом по уходу за животными и их использованию Университетом Висконсин-Мэдисон (M005792).
1. Содержание животных
- Выращивайте мышей на стандартном техническом чау. Используйте взрослых мышей или молодых взрослых мышей (в возрасте 8-12 недель).
ПРИМЕЧАНИЕ: Использование взрослых особей гарантирует, что животные достигли полной зрелости и ограничивает любую вероятность того, что изменения диаметра аорты могут быть связаны с ростом животного. Для этого исследования мы использовали самцов и самок мышей C57BL/6J в возрасте 22-24 недель на момент операции. Лу и его коллеги не наблюдали существенных различий в аневризматическом ответе между молодыми и пожилыми мышами8. Кроме того, в то время как большинство моделирования аневризмы выполняется у самцов мышей, эта модель успешно индуцирует АБА как у самцов, так и у самок мышей9. - Определите продолжительность исследования и распределите животных в лечебную или фиктивную (контрольную) группы. Мышам группы лечения вводят 0,2% питьевой воды БАТН и проводят хирургическое вмешательство с местным применением активной эластазы в инфраренальную аорту. Вводить неочищенную воду контрольным животным и подвергать их хирургическому вмешательству с нанесением денатурированной эластазы на инфраренальную аорту.
2. Начало приема питьевой воды с добавлением B-аминопропионитрила (BAPN)
- За два дня до операции начните лечение мышей на питьевой воде с 0,2% БАТН. Приготовьте воду BAPN в больших объемах и храните ее в темноте при температуре 4 °C до 28 дней. Убедитесь, что вода BAPN достигает комнатной температуры, прежде чем давать ее мышам.
ПРИМЕЧАНИЕ: Мы рекомендуем заменять воду BAPN в клетках каждые 7 дней на протяжении всего исследования.
3. Подготовка материала в день операции
- Разрежьте хирургические перчатки на полоски размером 5 мм х 10 мм, которые позже будут использоваться для изоляции аорты перед лечением эластазой. Подготовьте хирургическую простыню, вырезав овал размером ~ 1,5 см x 3 см в центре хирургической простыни. Разверните марлю размером 2 в x 2 и разрежьте пополам, чтобы получилась полоска марли примерно 2,5 см x 10 см, которую позже можно использовать для втягивания содержимого брюшной полости. Автоклавируйте все хирургические инструменты (см. Таблицу материалов) и настройте стерильное операционное поле, как показано на примере на рисунке 1.
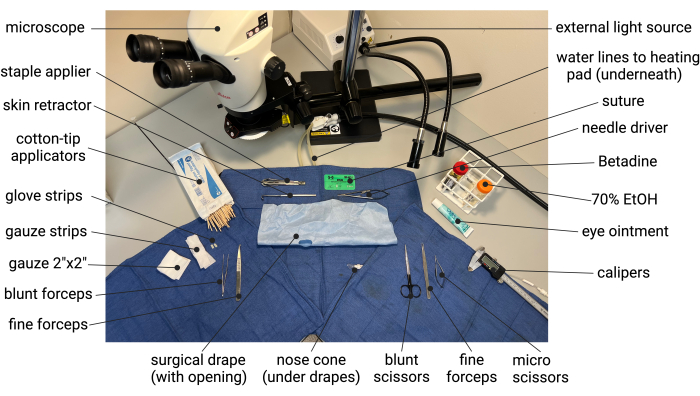
Рисунок 1: Пример установки стерильной хирургии при подготовке к мышиной модели АБА с эластаза/BAPN. Сокращения: BAPN = ß-аминопропионитрил; АБА = аневризма брюшной аорты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Подготовьте кейдж для послеоперационного восстановления, поместив чистую клетку под тепловую лампу и положив рядом с ней физиологический раствор, чтобы он нагрелся до температуры тела (37 °C). Убедитесь, что тепловая лампа надежно расположена так, чтобы каркас для восстановления и физиологический раствор были теплыми, но не превышали 37 °C. Включите водяной насос, чтобы начать циркуляцию теплой воды через грелку.
4. Подготовка животных к операции
- Поместите мышей в индукционную камеру и обезболите их 5% изофлураном в дозе 200 мл/мин с помощью электронного испарителя с низким расходом. Находясь под наркозом, взвесьте каждую мышь и введите 0,6 мг/кг бупренорфина ЭР и 20 мг/кг карпрофена подкожно для обезболивания. Используйте электрические триммеры для стрижки шерсти, чтобы подстричь шерсть на животе, от нижней части живота до нижней части кзифозного отростка. Используйте марлю или лабораторную салфетку, чтобы удалить лишние волосы. Верните мышей в клетку и подождите не менее 20 минут, пока анальгезия начнет действовать, прежде чем приступать к операции.
- По прошествии не менее 20 минут с момента введения анальгезии поместите мышь в индукционную камеру для анестезии и снова введите 5% изофлуран в дозе 200 мл/мин с помощью электронного испарителя с низким расходом до тех пор, пока мышь не будет седативирована.
- Извлеките мышь с седативными препаратами из индукционной камеры и положите ее лежа на операционное поле. Нанесите гель для глаз и закрепите носовой конус хирургическим пластырем. Уменьшите дозу вводимого ингаляционного изофлурана до поддерживающей скорости 1-2% при дозе 50 мл/мин. Закрепите переднюю и заднюю лапы мыши хирургической лентой.
- Осмотрите нижнюю часть брюшной полости мыши на предмет наличия мочевого пузыря. Осторожно надавите на мочевой пузырь между большим, указательным и средним пальцами, чтобы вызвать опорожнение; Тем временем используйте кусок марли, чтобы отводить мочу.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не загрязнить операционное поле. - Начните дезинфекцию брюшной полости с нанесения скраба на основе йода или хлоргексидина и 70% спирта с помощью ватных тампонов. Начните с центра живота и двигайтесь наружу круговыми движениями 3 раза. Дайте участку ненадолго высохнуть между нанесениями.
- Проверьте отсутствие реакции на щипки ног, чтобы убедиться, что анестезия адекватна. Убедитесь, что носовой конус и конечности надежно закреплены. Наденьте хирургическую простыню на мышь так, чтобы отверстие было непосредственно над хирургически подготовленной брюшной полостью.
ПРИМЕЧАНИЕ: Не перетаскивайте простыню через мышь, чтобы избежать возможного загрязнения.
5. Хирургическая индукция АБА
- Попадание в брюшную полость:
- Вымойте руки и наденьте чистые нитриловые или стерильные хирургические перчатки. Перед контактом с операционным полем всегда распыляйте перчатки с 70% EtOH и трите руки в перчатках друг о друга, пока они не высохнут.
- Используйте тупые щипцы для фиксации кожи в области средней линии живота. Хирургическими ножницами сделайте небольшой надрез на коже, затем продлите разрез в продольном направлении, примерно на 2-3 см в длину.
- С помощью щипцов подтяните прямые мышцы, чтобы определить полупрозрачную белую линию. С помощью ножниц войдите в брюшную полость через белую линию, затем протяните вдоль белой линии проксимально и дистально.
- Обнажение брюшной аорты:
- Смочите полоску марли и два тампона с ватным наконечником подогретым физиологическим раствором. Создайте брюшной валик, плотно свернув один конец марли наполовину, оставив щедрый хвост.
- Используйте кожный ретрактор для втягивания правой брюшной стенки.
- Используя смоченные тампоны с ватным наконечником, выполните право-медиальную висцеральную ротацию, осторожно протягивая тонкий и толстый кишечник к левому верхнему квадранту, и визуализируйте аорту и нижнюю полую вену (IVC). Используйте брюшной валик, чтобы убрать кишечник из поля зрения - заправьте свернутый конец марли под кишечник, а затем поверните хвостовой конец вокруг и наружу от тела, чтобы аккуратно запеленать кишечник. Слегка натяните хвост марли, чтобы удержать кишечник вне поля зрения. Отрегулируйте брюшной перекат и кожный ретрактор, чтобы получить оптимальный обзор органов забрюшинного пространства, как показано на рисунке 2A.
ПРИМЕЧАНИЕ: Брюшной валик помогает сохранить кишечник влажным и защитить его от случайного повреждения хирургическими инструментами. Убедитесь, что марля остается влажной во время процедуры, чтобы предотвратить пересыхание кишечника. Будьте осторожны, чтобы не втягивать кишечник с силой, так как это может вызвать перегиб верхней брыжеечной артерии и сосудистой сети кишечника, что потенциально может привести к ишемическому повреждению. Кроме того, при первоначальной чистке тонкой кишки будьте осторожны с тонкой полупрозрачной присадкой между толстой кишкой и нижней печенью (гепатоколической связкой), которая, если не соблюдать осторожность, может легко оторвать капсулу печени и вызвать кровотечение. Если во время втягивания возникает напряжение на этой связке, резко разделите ее ножницами.
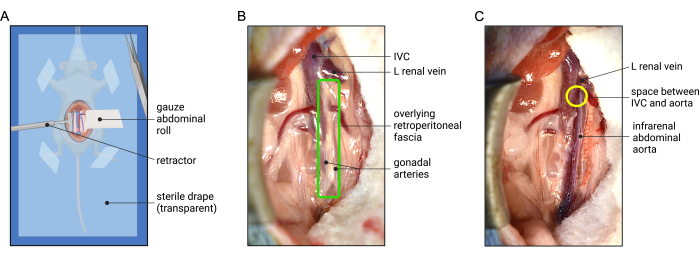
Рисунок 2: Изображение абдоминальной ретракции и оптимальный хирургический вид для обнажения инфраренальной аорты мыши. (A) Наложение марлевого брюшного валика помогает втянуть внутрибрюшные органы, в то время как противоположный ретрактор помогает обеспечить визуализацию забрюшинного пространства. Стерильная хирургическая простыня (прозрачная для индикации ориентации животного) накладывается на животное, находящееся под наркозом, чтобы помочь сохранить стерильность. (В) Забрюшинная фасция (зеленая коробка) покрывает аорту спереди. (C) Пример инфраренальной аорты после рассечения забрюшинной фасции. Изоляция аорты от НПВ может быть достигнута путем открытия в потенциальном пространстве между аортой и НПВ, расположенном дистальнее левой почечной вены, пересекающейся спереди (желтый круг). Сокращение: IVC = нижняя полая вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Окружная диссекция и изоляция инфраренальной аорты:
- Убедитесь, что НПВ и инфраренальная аорта находятся на виду. Начните обнажение аорты, сначала войдя в забрюшинную фасцию и разделив ее (Рисунок 2B). Определите гонадные (яичковые или яичниковые) артерии, которые проходят параллельно вдоль передней инфраренальной аорты (рисунок 2B и рисунок 3). С помощью щипцов резко разделите фасцию между гонадными артериями и продолжайте продольно, чтобы обнажить аорту спереди (рис. 2C).
ПРИМЕЧАНИЕ: Фасция RP представляет собой тонкий, полупрозрачный слой соединительной ткани, который содержит лимфатические сосуды и спланхническое сплетение. Необходимо рассекать через фасцию РП, чтобы обнажить аорту. Однако не стоит рассекать через соединительную ткань аорты адвентицию. Разрыв адвентиции (белой соединительной ткани) обнажит среду (выглядит ярко-красным), и аорта, скорее всего, разорвется в этом месте после применения эластазы. - Далее начните изолировать брюшную аорту от НПВ. Начните это рассечение с небольшого промежутка между IVC и аортой, расположенного чуть ниже нижнего края левой почечной вены, пересекающей аорту (рис. 2C). С помощью кончиков щипцов аккуратно раздвиньте волокна соединительной ткани между аортой и IVC и продолжайте работать по окружности вокруг аорты на этом уровне.
ПРИМЕЧАНИЕ: НПВ очень тонкостенный и плотно прилегает к аорте тонким слоем волокнистой соединительной ткани. Будьте осторожны, чтобы по возможности избегать работы с IVC или чистки IVC. Рассечение правой стороны аорты от НПВ сначала (перед рассечением левой стороны аорты от окружающей мускулатуры) поможет аорте «отпасть» от НПВ. - Продолжайте тупо рассекать плоскость между аортой и IVC, двигаясь каудально по направлению к бифуркации аорты. Прекратите дальнейшую дистальную диссекцию после достижения бифуркации аорты.
ПРИМЕЧАНИЕ: Примите дополнительные меры предосторожности при расслоении вокруг нижней брыжеечной артерии (ИМА), которая обычно расположена рядом с центральным отделом инфраренальной аорты и проходит латерально через IVC. - Как только правый край аорты отделится от НПВ, вернитесь проксимально к уровню левой почечной вены. Рассеките фасцию RP от латерального левого края аорты, работая по окружности вокруг аорты, пока аорта не будет полностью изолирована. На рисунке 3 приведена соответствующая анатомия забрюшинного расслоения.
ПРИМЕЧАНИЕ: Будьте осторожны при рассечении за аортой, так как существует высокая вариабельность расположения и количества поясничных вен и артерий. На рисунке 4 приведены участки с высоким риском кровотечения при таком рассечении. - Внимательно осмотрите то, чтобы аорта была максимально изолирована по окружности от IVC и окружающей мускулатуры, с тщательным рассечением вокруг сегментов аорты, связанных IMA и поясничными артериями.
- Поместите полоску перчатки вдоль правого и левого краев аорты, как показано на рисунке 5А. Постарайтесь охватить как можно большую часть IVC.
- Используйте ручные штангенциркули, чтобы измерить самый широкий диаметр аорты и запишите три измерения. Распылите на кончики суппортов 70% EtOH до и после измерений. Избегайте прямого контакта с аортой наконечниками суппорта, чтобы предотвратить загрязнение.
ПРИМЕЧАНИЕ: Также можно использовать фотографии с помощью откалиброванного микроскопа, совместимого с камерой.
- Убедитесь, что НПВ и инфраренальная аорта находятся на виду. Начните обнажение аорты, сначала войдя в забрюшинную фасцию и разделив ее (Рисунок 2B). Определите гонадные (яичковые или яичниковые) артерии, которые проходят параллельно вдоль передней инфраренальной аорты (рисунок 2B и рисунок 3). С помощью щипцов резко разделите фасцию между гонадными артериями и продолжайте продольно, чтобы обнажить аорту спереди (рис. 2C).
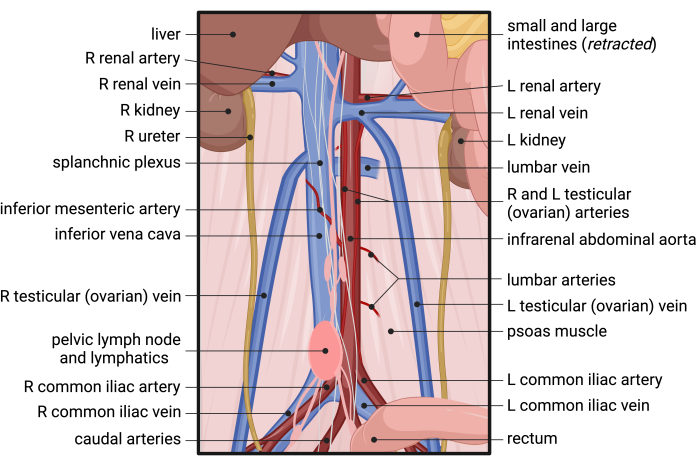
Рисунок 3: Анатомия кровоснабжения нижней части живота, таза и забрюшинного пространства мыши. Сокращения: R = правый; L = левый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
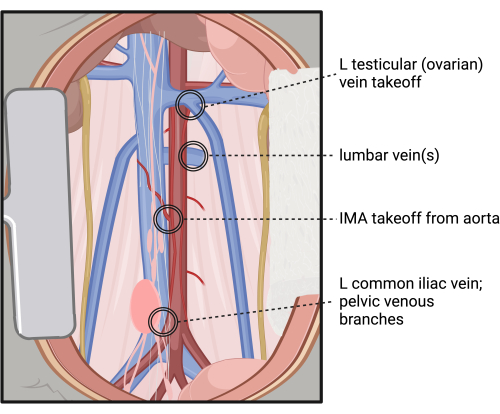
Рисунок 4: Участки с высоким риском травм и кровотечений во время забрюшинной диссекции и кольцевой изоляции инфраренальной аорты. Сокращения: L = левый; IMA = нижняя брыжеечная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
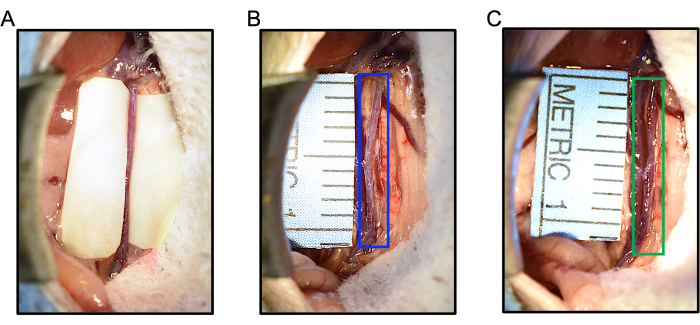
Рисунок 5: Интраоперационные реакции на применение эластазы или симуляцию во время модели ААА у мышей эластазы/BAPN. (A) Сегменты перчатки размещаются по всей длине аорты перед применением эластазы, чтобы помочь защитить IVC и кишечник от воздействия эластазы, сохраняя при этом аорту пропитанной эластазой (B) Применение денатурированной эластазы не вызывает расширения аорты (синий ящик). Максимальный диаметр аорты составлял 0,627 мм на исходном уровне, затем 0,607 мм после 5 мин местного введения денатурированной эластазы. (В) Применение эластазы вызывает расширение аорты через 5 минут лечения. В этом примере аорта (зеленая) расширилась до 0,953 мм с 0,607 мм, увеличившись в диаметре на 57%. Сокращения: BAPN = ß-аминопропионитрил; АБА = аневризма брюшной аорты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Применение эластазы:
- Используйте тампон с ватным наконечником, чтобы промокнуть лишнюю кровь или жидкость из аорты.
- Далее положите поверх аорты кусок сухой марли размером 10 мм х 2 мм. С помощью пипетки дозируйте 5 мкл эластазы (или контрольной денатурированной эластазы) для насыщения марли и аорты. Аккуратно сложите кусочки перчатки вокруг аорты.
ПРИМЕЧАНИЕ: Для приготовления денатурированной эластазы для использования в фиктивных или контрольных группах кипятите эластазу при 100 °C в течение 30 минут. - Подождите 5 минут, чтобы эластаза подействовала на аорту. Во время этого инкубационного периода, при необходимости, снимите часть напряжения, создаваемого брюшным валиком и кожным ретрактором.
ПРИМЕЧАНИЕ: Из-за периодического эффекта эластазы, мы рекомендуем исследователям использовать одну и ту же бутылку эластазы для всех экспериментов в рамках данного исследования. При введении каждой новой бутылки эластазы мы рекомендуем проводить процедуру «доза-ответ», чтобы не допустить чрезмерного количества ранних разрывов (до 4 недель). Продолжительность применения эластазы также может быть скорректирована в диапазоне от 4 до 6 минут в зависимости от реакции на эластазу. - Через 5 минут сбросьте втягивание кишечника и разверните кусочки перчатки. Орошайте брюшную полость 1 мл теплого 0,9% стерильного физиологического раствора, при этом аккуратно снимая марлю и кусочки перчатки с аорты. Впитайте физиологический раствор в области живота марлей размером 10 см х 10 см. Повторите орошение брюшной полости в общей сложности 3 х 3 мл.
- Используйте ручные штангенциркули, чтобы повторно измерить самый широкий диаметр аорты после нанесения эластазы и запишите 3 раза. На рисунке 5B, C приведены примеры дилатации аорты для лечения фиктивной и активной эластаза.
ПРИМЕЧАНИЕ: Средние значения трех измерений пре- и постэластазы могут быть использованы для расчета процентного изменения диаметра аорты при лечении. Как правило, сразу после лечения эластазой наблюдается заметное расширение на ~30-50%, что может помочь обеспечить функциональность эластазы и адекватное лечение аорты. Диаметр аорты не должен изменяться при применении денатурированной эластазы или может быть немного меньше (вероятно, от спазма).
- Закрытие брюшной полости:
- Осторожно удалите брюшной валик из-под кишечника и выведите его из организма. При необходимости нанесите дополнительный физиологический раствор на кишечник, чтобы предотвратить прилипание к брюшному валику во время удаления. Убедитесь, что кишечник выглядит розовым и достаточно перфузированным.
ПРИМЕЧАНИЕ: Нет необходимости пытаться вернуть кишечник обратно в исходное положение; Попытка сделать это может привести к перекручиванию кишечника или внутренним грыжам. - Повторите аппроксимацию брюшной фасции с помощью бегового нерассасывающегося монофиламентного шва 5-0. Закройте кожу 3-4 скобами.
- Осторожно удалите брюшной валик из-под кишечника и выведите его из организма. При необходимости нанесите дополнительный физиологический раствор на кишечник, чтобы предотвратить прилипание к брюшному валику во время удаления. Убедитесь, что кишечник выглядит розовым и достаточно перфузированным.
6. Послеоперационный уход за животными
- Поместите мышь в клетку для восстановления с тепловой лампой. Следите за тем, чтобы температура в клетке была теплой, а не горячей.
- Введите 0,5-1 мл подкожной жидкости болюсно с содержанием 0,9% нормального физиологического раствора.
- Дайте мыши самостоятельно восстановиться в теплой клетке в течение ~20 минут, пока она не станет активной в соответствии с институциональным протоколом, затем вернитесь в клетку.
- В соответствии с протоколом учреждения ввести карпрофен в дозе 20 мг/кг через 24 ч после операции на 1-й день после операции и продолжать ежедневно в течение 3 дней.
7. Измерение аорты и забор тканей
- После эвтаназии с изофлураном и вывиха шейки матки вновь открыть брюшную полость. Продлите разрез через грудину, чтобы получить доступ к грудной клетке. Иссекаем правое предсердие и перфузируем левый желудочек 10 мл холодного 1% раствора DPBS в течение 2 минут. Резекция легких, печени и селезенки.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не травмировать кишечник; Разлив кишечного содержимого может повлиять на анализ тканей. - Обнажите брюшную аорту и измерьте максимальный диаметр инфраренальной аорты, как описано выше. Продолжайте рассекать всю аорту и сердце. После того, как сердце и аорта будут изолированы, перережьте все артериальные ветви и общие подвздошные артерии, оставив короткие сегменты аорты нетронутыми. Поместите сердце и аорту на контрастный фон рядом с линейкой и изображением.
8. Анализ данных и отчетность
- Чтобы учесть человеческую ошибку, измерьте диаметр аорты как минимум в 3 раза каждый при использовании ручных штангенциркулей, а затем сообщите диаметр как усредненное значение.
- Определите АБА как увеличение диаметра здоровой аорты на 50%. Обязательно включите в результаты исследования как общий диаметр аорты, так и процентное изменение диаметра.
Representative Results
В этом исследовании использовались самцы и самки мышей C57BL/6J в возрасте 22-24 недель. Инфраренальные аорты обрабатывали 5 мкл фермента эластазы (6,9 мг белка/мл, 6 ЕД/мг белка) или денатурированной эластазы в течение 5 мин. У самцов мышей, получавших эластазу, было отмечено увеличение диаметра аорты на 43,4% после 5-минутного воздействия эластазы по сравнению с необработанными исходными диаметрами аорты, в то время как обработанные женские аорты увеличились на 33,6% (P = 0,0342). Диаметр аорты фиктивных сосудов практически не изменился в течение 5 минут воздействия денатурированной эластазы (мужчины 0,5%; женщины -2,8%). Среди 12 обработанных и 6 фиктивных мышей не было смертей, связанных с хирургическим вмешательством. Данные 28-дневного исследования представлены в таблице 1. Из самок мышей, получавших лечение, 3 из 6 умерли от разрыва АБА; один на 20-й день после операции и два на 25-й день (Рисунок 6). Разрывов АБА у мужчин, получавших лечение, не было. АБА (определяемые как увеличение >50% от исходного диаметра аорты или смерть от разрыва АБА) были успешно индуцированы у всех обработанных мышей (12 из 12). Через 28 дней средний диаметр АБА у самцов, получавших лечение, составлял 2,86 ± 0,31 мм, со средним процентом изменения 257 ± 54%, в то время как диаметр ААА у выживших самок мышей, получавших лечение, составлял 3,60 ± 1,87 мм, со средним процентным изменением 417 ± 286% (Рисунок 7). У фиктивных мышей не наблюдалось относительно никаких изменений в диаметре аорты.
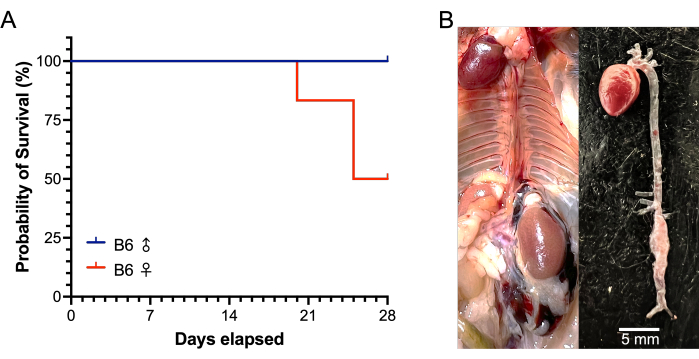
Рисунок 6: Выживаемость самцов и самок мышей B6 во время 28-дневной модели эластазы/BAPN АБА. (А) Разрыв АБА произошел у 3 из 6 обработанных самок мышей (одна мышь через 20 дней, затем две мыши через 25 дней), в то время как среди 6 обработанных мышей-самцов разрывов не было через 28 дней. (B) Репрезентативные изображения при вскрытии самки мыши, погибшей от разрыва ААА. Разрыв АБА проявляется большой забрюшинной гематомой (слева) и наличием инфраренальной АБА с дефектом стенки (справа). Сокращения: BAPN = ß-аминопропионитрил; АБА = аневризма брюшной аорты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
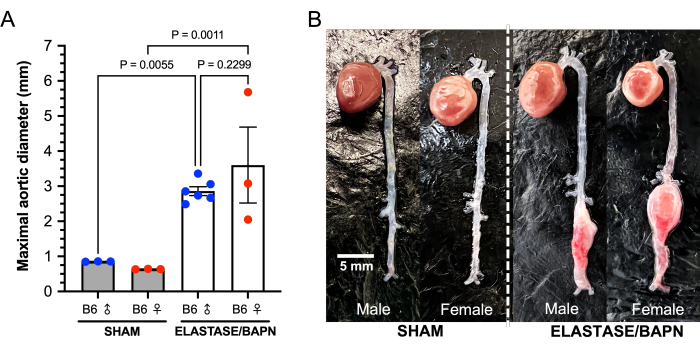
Рисунок 7: Максимальные диаметры аорты у эластазы/BAPN и фиктивных мышей самцов и самок B6 через 28 дней. (A) Обработанные мыши демонстрируют значительно больший диаметр инфрареналы через 28 дней по сравнению с фиктивными. (B) Комбинация эластазы и BAPN успешно продуцирует большие инфраренальные ААА как у самцов, так и у самок мышей B6. Сокращения: BAPN = ß-аминопропионитрил; АБА = аневризма брюшной аорты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| 86 самцов Шам | 86 самка Шам | 86 мужской эластаза/8APN | 86 женский эластаза/8APN | |||
| Количество мышей | 3 | 3 | 6 | 6 | ||
| Возраст (недели) | 22,3 ± 0,0 | 22,7 ± 0,7 | 23,1 ± 0,2 | 23,2 ± 0,2 | ||
| Вес (г; во время операции) | 36,3 ± 2,5 | 23.7 ± 1.2 | 32,8 ± 1,7* | 23,7 ± 0,8 | ||
| Диаметр аорты перед лечением (мм) | 0,89 ± 0,02 | 0,75 ± 0,04 | 0,81 ± 0,07 | 0,73 ± 0,09 | ||
| Диаметр аорты после лечения (мм) | 0,90 ± 0,03 | 0,73 ± 0,01 | 1,15 ± 0,03** | 0,98 ± 0,12** | ||
| Процентное изменение после 5-минутного лечения (%) | 0,5 ± 4,4 | -2.8 ± 5.3 | 43,4 ± 10,2*** | 33,6 ± 4,5*** | ||
| Заболеваемость АБА (%) | 0 / 3 | 0 / 3 | 6 / 6 | 6 / 6 | ||
| Разрывы АБА на 28 дней | 0 / 3 | 0 / 3 | 0 / 6 | 3 / 6 | ||
| Выживаемость до 28 дней | 3 / 3 | 3 / 3 | 6 / 6 | 3 / 6 | ||
| Максимальный диаметр аорты в 28 дней (мм) | 0,85 ± 0,01 | 0,64 ± 0,01 | 2,86 ± 0,31* | 3,60 ± 1,87** | ||
| Процентное изменение диаметра аорты через 28 дней (%) | -4 ± 2 | -16 ± 2 | 257 ± 54* | 417 ± 286** | ||
Таблица 1: Результаты 28-дневной модели мышиной модели АБА эластаза/BAPN. Данные являются средними ± SD. *P<0,05, **P<0,005, ***P<0,0001 по сравнению с симуляцией того же пола с помощью одностороннего теста Фишера ANOVA. Сокращения: BAPN = ß-аминопропионитрил; АБА = аневризма брюшной аорты.
Discussion
Понимание сложной патофизиологии АБА имеет решающее значение для улучшения лечения заболевания аневризмы аорты. В то время как активно разрабатываются новые стратегии для улучшения результатов хирургического вмешательства, АБА по-прежнему широко распространены в нашем стареющем обществе, а разрыв аневризмы остается основной причиной смертив Соединенных Штатах. Таким образом, неудовлетворенные потребности в стратегиях выявления, профилактики и лечения АБА требуют дальнейших фундаментальных исследований аневризмы11.
Животные модели, которые точно и эффективно повторяют особенности и поведение человеческих АБА, необходимы для механистических исследований патофизиологии аневризмы и выявления потенциальных терапевтических мишеней. В то время как современные животные модели могут имитировать основные аспекты аневризматических изменений, которые происходят при заболеваниях человека, ни одна модель не представляет в полной мере истинную сложность человеческих АБА. В настоящее время мыши являются наиболее широко распространенным видом для моделирования животных ААА. Исследователи должны учитывать различные сильные и слабые стороны каждой мышиной модели для своего конкретного исследования аневризмы, например, те, которые профессионально описаны в обзорах Daugherty et al. и Busch et al.12,13.
Использование эластазы для индуцирования АБА у грызунов было впервые описано Anidjar et al. в 1990 г.14. Перфузия аорты панкреатической эластазой свиньи с помощью шприцевого насоса создает начальное расширение примерно от 50% до 70%, и расширенные сегменты благоприятно демонстрируют схожие патологические особенности человеческих АБА, такие как медиальная дегенерация и адвентициальное воспаление. Однако классическая модель перфузии, возможно, является наиболее технически сложной моделью аневризмы, и аневризмы, которые обычно образуются ко второй неделе, начинают постепенно рассасываться после этого. Затем Bhamidipati et al. в 2012 году продемонстрировали, что адвентитивное применение эластазы также может успешно индуцировать подобные аневризмы, которые более воспроизводимы при размере15. Гораздо менее сложная модель, модель топической эластазы, получила широкое распространение в исследованиях аневризмы. Дополнительная методология и преимущества модели топической эластазы обсуждаются в статье о методах Xue и коллег16.
Модель эластазы/BAPN мышиной АБА была разработана Лу и коллегами в 2017году8. Введение 0,2% BAPN в питьевую воду улучшило многие критические замечания классической модели местной эластазы, в результате чего теперь возникают аневризмы, которые постоянно расширяются до точки разрыва АБА. В своем исследовании 2017 года они продемонстрировали, что мыши в группе, получавшей эластазу/BAPN, имели значительно более высокие показатели образования АБА по сравнению с группой эластазы (93% против 65%, P < 0,01), которые также имели более позднюю стадию АБА. В течение 100-дневного периода исследования АБА в группе эластазы/БАПН продолжали расширяться до >800% исходного диаметра и образовывали внутрипросветный тромб (53,8%), а 46,2% спонтанно разрывались до конца эксперимента. Эта модель позволила исследователям изучить факторы, которые могут влиять на прогрессирование и стабильность аневризмы с течением времени.
Berman et al. дополнительно исследовали модель эластазы/BAPN, варьируя концентрацию местной эластазы, продолжительность исследования, время введения BAPN и влияние пола животных9. Лечение 5 мкл высококонцентрированной эластазы (5 мг/мл или 10 мг/мл) приводило к более крупным аневризмам, чем 2,5 мг/мл в течение 56 дней. Распространенность образования внутрипросветных тромбов также зависела от концентрации эластазы, которая наблюдалась у 28,6% мышей, получавших 5 мг/мл, и у 62,5% мышей, получавших 10 мг/мл. Они также продемонстрировали, что модель эластазы/BAPN может вызывать аневризмы у самок мышей. Несмотря на то, что было изучено только несколько самок мышей (n = 5), они обнаружили, что аневризмы у самок были более склонны к разрыву (2 из 5 мышей) и были значительно больше, чем у самцов АБА через 56 дней.
В этой статье мы стремимся предложить метод, позволяющий устранить одно из самых больших ограничений хирургического моделирования, которое заключается в вариативности хирургической процедуры. Без четкого консенсуса относительно степени расслоения и площади аорты, обрабатываемой эластаза, результаты этой модели могут сильно различаться у животных, исследователей и учреждений. Мы наблюдали многочисленные анатомические различия у мышей, включая количество и размер поясничных артерий и вен, а также расположение ИМА, отрыв левой гонадной вены, среди прочего, что может быть ограничивающим при попытке лечения только части или конкретного сегмента инфраренальной аорты. В данной работе мы показываем, что круговое рассечение по всей длине инфраренальной аорты от левой почечной артерии проксимально до дистально бифуркации аорты помогает обеспечить воспроизводимые степени воздействия аорты, несмотря на анатомические различия, одновременно увеличивая успех индукции аневризмы и обеспечивая четкие границы для оператора. Кроме того, размер и более переднее положение НПВ, как правило, покрывают большую часть аорты, что может повлиять на объем обрабатываемой аорты, если она не изолирована от НПВ. В то время как удаление забрюшинной фасции необходимо для обнажения аорты, важно не полностью рассекать соединительную ткань адвентиции от аорты и обнажать любой из слоев среды, так как это обычно приводит к разрыву в течение 5-минутного инкубационного периода эластазы. Это может служить дополнительным внутренним контролем в степени вскрытия с помощью этой модели, но может быть разочаровывающей кривой обучения при принятии этой модели. Кроме того, операторы узнают о зонах повышенного риска (Рисунок 4), которые могут быть легко травмированы во время операции и привести к неконтролируемому кровотечению.
Несмотря на то, что важно, чтобы процедурные шаги этой модели были последовательными, продолжительность исследования и время проведения интервального ультрасонографии могут варьироваться в зависимости от цели исследования. Дилатация аорты начинается сразу после применения эластазы, однако в исследованиях с использованием этой модели обычно наблюдают за мышами в течение 28 днейпосле операции, как в этом примере эксперимента. Увеличение продолжительности исследования следует рассматривать при изучении прогрессирующих АБА, долгосрочного роста, образования внутрипросветного тромба или разрыва.
Дополнительные периоперационные меры, такие как поддержание температуры тела животного и гидратационного статуса, могут помочь улучшить выживаемость животных при этой инвазивной процедуре. Использование грелки во время операции и помещение в теплую клетку для восстановления может помочь избежать переохлаждения. Солевой раствор следует подогреть перед тем, как использовать его для орошения брюшной полости. Болюсное введение подкожной жидкости сразу после операции может компенсировать незаметные потери жидкости во время операции и помочь животному поддерживать достаточную гидратацию во время непосредственной фазы восстановления. При бережном обращении с тканями и последовательном методическом подходе модель эластазы/BAPN может быть выполнена опытным оператором в период от 30 до 45 минут на мышь и надежно получить АБА с очень низким периоперационным осложнением.
Наши результаты показывают, что комбинация BAPN в дополнение к кольцевой диссекции инфраренальной аорты перед применением эластазы дает большие, постоянно расширяющиеся АБА с большим диаметром и частотой разрыва через более короткие периоды. В этом эксперименте АБА были успешно индуцированы у всех самцов (6 из 6) и самок (6 из 6) мышей, получавших активную эластазу. Воздействие эластазы в течение 5 мин приводило к немедленному увеличению диаметра аорты примерно на 30-40%, что способствует подтверждению успешного и последовательного применения эластазы в группах лечения. Как и Berman et al., мы показали, что эта модель может индуцировать АБА у самок мышей, которые также имеют большую реакцию на разрыв, чем самцы. Половина самок мышей (3 из 6) разорвалась в течение 28 дней, по сравнению с 0 из 6 самцов, однако самки мышей весят меньше, чем самцы. Самцы мышей продемонстрировали увеличение диаметра АБА на 257% по сравнению с -4% самцов в контрольной группе, в то время как выжившие самки показали увеличение диаметра на 417% по сравнению с -16% у самок в контрольной группе. Диаметры аорты существенно не различались между выжившими самцами и самками мышей, получавших лечение через 28 дней, из-за большего количества разрывов в группе самок. Мы предполагаем, что фиктивные мыши демонстрируют меньший диаметр аорты к концу исследования, поскольку аорта имеет тенденцию к незначительному расширению во время первоначального рассечения, а затем образует рубцовую ткань к 28 дням.
Модель эластаза/BAPN имеет определенные ограничения. Круговая диссекция аорты требует тонких хирургических навыков, но помогает улучшить воспроизводимость и степень индукции аневризмы. Подобно модели топической эластазы, в активности фермента эластазы также присутствует пакетный эффект, поэтому, как упоминалось ранее, важно использовать одну и ту же бутылку эластазы для всех животных в данном эксперименте. В то время как частота внутрипросветного тромба и разрыва АБА увеличивается со временем и тяжестью аневризмы, они не гарантированы и не полностью предсказуемы в данной модели.
Таким образом, модель эластазы/BAPN производит крупные, истинные инфраренальные ААА как у самцов, так и у самок мышей, которые постепенно расширяются с течением времени, образуют внутрипросветный тромб и способны к разрыву. Эти сильные стороны этой мышиной модели помогают лучше воспроизвести некоторые виды поведения и характеристики аневризм у людей. Несмотря на техническую сложность, тщательное и тщательное рассечение аорты может усилить аневризматическую реакцию. В настоящее время метод эластазы/BAPN является усовершенствованной моделью для изучения инфраренальных аневризм брюшной аорты.
Disclosures
Авторы данной рукописи не могут заявить об отсутствии конфликта интересов.
Acknowledgements
Это исследование было поддержано Национальным институтом сердца, легких и крови (NHLBI) Национальных институтов здравоохранения (NIH) под номером 1R01HL149404-01A1 (BL) и премией Национальной исследовательской службы имени Рут Л. Киршштейн T32 HL 007936 Центру сердечно-сосудистых исследований Университета Висконсин-Мэдисон (JB). Рисунки создавались или редактировались с помощью Biorender.com. Статистический анализ проводился с помощью программного обеспечения GraphPad Prism 10.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 L induction chamber | Kent Scientific Corporation | SOMNO-0530XXS | anesthesia induction chamber |
| 0.9% sodicum chloride injection, USP, 20 mL | Hospira | NDC 0409-4888-03 | normal saline |
| 3 mL syringe Luer-Lok Tip with BD PrecisionGlide Needle 22 G x 3/4 | BD | REF 309569 | syringe, 22 G needle |
| 3-Aminopropionitrile Fumarate | TCI | A0796 | BAPN |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134-25G | BAPN |
| Avant Delux gauze sponges, 2" x 2" 4-Ply | Medline | NON26224 | gauze sponges |
| Balding clipper | Whal Clipper Corporation | 8110 | hair clippers |
| betadine surgical scrub (povidone-iodine, 7.5%) | Avrio | NCD 67618-154-16 | betadine surgical scrub |
| blunt forceps | ROBOZ | RS-5130 | blunt forceps |
| Buprenorphine ER-lab | ZooPharm | BERLAB0.5 | buprenorphine |
| carprofen | Norbrook | NDC 55529-131-11 | carprofen |
| CASTROVIEJO 5.75" straight with lock | ROBOZ | RS-6412 | Castroviejo needle driver |
| cotton tipped wood applicators, 6" | Dynarex | No. 4302 | cotton tipped wood applicators |
| DESMARRES 5.5' rectractor | ROBOZ | RS-6672 | skin rectractor |
| digital caliper, 0-150 mm | World Precision Instruments | 501601 | digital caliper |
| DPBS (1x) | Gibco | 14190-144 | DPBS |
| Elastase from porcine pancrease Type I | Sigma-Aldrich | E1250-10MG | elastase >4.0 units/mg protein |
| Ethanol 200 proof | Decon Labs, Inc | 2701 | ethanol diluted to 70% |
| eye lube | Optixcare | 14716 | eye lube |
| Germinator 500 dry sterilizer | CellPoint Scientific, Inc | 5-1450 | dry bead sterilizer |
| heat therapy mat | Adroit Medical Systems | V016 | heat therapy mat |
| heat therapy pump | Adroit Medical Systems | HTP-1500 | heat therapy pump |
| isoflurane, USP | Akorn Animal Health | NCD 59399-106-01 | isoflurane |
| L-10 pipette | Rainin | LTS 0.5-10 uL | pipette |
| Low profile anesthesia mask, small | Kent Scientific Corporation | SOMNO-0801 | anesthesia nose cone |
| micro dissector scissors | ROBOZ | RS-5619 | micro dissector scissors |
| microscope | Leica | S9i | microscope |
| Nii-LED high intensity LED illuminatorLED exertnal light | Nikon Instruments, Inc | 83359 NII-LED | external dissection light |
| nylon 5-0 monofilament, black non-absorbable suture | Oasis | MV-661-V | 5-0 nylon suture |
| polyisoprene surgical gloves, GAMMEX Non-Latex PI Micro, size 7.5 | Ansell | 20685975 | non-latex surgical gloves |
| Reflex 7 mm stainless steel wound clips | CellPoint Scientific, Inc | 203-1000 | wound clips |
| scale | Ohaus | Compass CR2200 | scale |
| SomnofFlo Accessory Kit | Kent Scientific Corporation | 10-8000-71 | tubing for electronic vaporizer |
| SomnoFlo electronic vaporizer | Kent Scientific Corporation | SF2992 | low-flow electronic vaporizer |
| SomnoPath Flow Diverter | Kent Scientific Corporation | SP1016 | flow diverter for electronic vaporizer |
| SS/45 sharp forceps | ROBOZ | RS-4941 | sharp forceps |
| surgical scissors | ROBOZ | RS-6010SC | surgical scissors |
| vessel forceps | Dumont | VES 0.35 | vessel forceps |
References
- Kent, K. C. Clinical practice. Abdominal aortic aneurysms. New Engl J Med. 371 (22), 2101-2208 (2014).
- Wanhainen, A., et al. European Society for Vascular Surgery Guidelines on the management of aorto-iliac abdominal aortic aneurysms. Eur J Vasc Endocasc Surg. 57 (1), 8-93 (2019).
- Shimizu, K., Mitchell, R. N., Libby, P. Inflammation and cellular immune responses in abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 26 (5), 987-994 (2006).
- Shen, Y. H., et al. Aortic aneurysms and dissections series. ArteriosclerThromb Vasc Biol. 40 (3), e37-e46 (2020).
- Stanley, J. C., Veith, F., Wakefield, T. W. Current Therapy in Vascular and Endovascular Surgery E-Book. Elsevier Health Sciences. , (2014).
- Morgan, S., et al. Identifying novel mechanisms of abdominal aortic aneurysm via unbiased proteomics and systems biology. Front Cardiovasc Med. 9, 889994 (2022).
- Yin, L., Kent, E. W., Wang, B. Progress in murine models of ruptured abdominal aortic aneurysm. Front Cardiovasc Med. 9, 950018 (2022).
- Lu, G., et al. A novel chronic advanced stage abdominal aortic aneurysm murine model. J Vasc Surg. 66 (1), 232-242 (2017).
- Berman, A. G., et al. Experimental aortic aneurysm severity and growth depend on topical elastase concentration and lysyl oxidase inhibition. Sci Rep. 12 (1), 99 (2022).
- Deaths, percent of total deaths, and death rates for the 15 leading causes of death in 5-year age groups, by race, and sex. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/nchs/nvss/mortality/lcwk1.htm (2015)
- Dansey, K. D., et al. Epidemiology of endovascular and open repair for abdominal aortic aneurysms in the United States from 2004 to 2015 and implications for screening. J Vasc Surg. 74 (2), 414-424 (2021).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS Vasc Sci. 2, 219-234 (2021).
- Anidjar, S., et al. Elastase-induced experimental aneurysms in rats. Circulation. 82 (3), 973-981 (1990).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Xue, C., Zhao, G., Zhao, Y., Chen, Y. E., Zhang, J. Mouse abdominal aortic aneurysm model induced by perivascular application of elastase. J Vis Exp. (180), e63608 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved