Valutazione dell'attività di riparazione della rottura del doppio filamento del DNA utilizzando saggi reporter ad alto rendimento e quantitativi basati sulla luminescenza
In This Article
Summary
Presentiamo protocolli per la valutazione della competenza del percorso di riparazione a doppio filamento di rottura nelle cellule utilizzando una suite di substrati reporter extracromosomici basati sulla luminescenza.
Abstract
La riparazione delle rotture del doppio filamento del DNA (DSB) è fondamentale per il mantenimento della stabilità del genoma e della vitalità cellulare. La riparazione del DSB (DSBR) nelle cellule è mediata attraverso diversi meccanismi: ricombinazione omologa (HR), giunzione di estremità non omologa (NHEJ), giunzione di estremità mediata da microomologia (MMEJ) e ricottura a filamento singolo (SSA). I saggi cellulari sono essenziali per misurare la competenza e la modulazione di queste vie in risposta a vari stimoli.
Qui, presentiamo una serie di saggi reporter extracromosomici che misurano ciascuno la ricostituzione di un gene reporter della nanoluciferasi da parte di una delle quattro principali vie DSBR nelle cellule. Dopo la trasfezione transitoria nelle cellule di interesse, la riparazione dei substrati reporter specifici del percorso può essere misurata in meno di 24 ore mediante la rilevazione della luminescenza della nanoluciferasi (NanoLuc).
Questi robusti saggi sono quantitativi, sensibili, titolabili e suscettibili di un formato di screening ad alto rendimento. Queste proprietà forniscono ampie applicazioni nella ricerca sulla riparazione del DNA e nella scoperta di farmaci, integrando il kit di strumenti attualmente disponibile di saggi DSBR cellulari.
Introduction
Le rotture del doppio filamento del DNA (DSB) rappresentano una classe particolarmente tossica di danno al DNA1 a causa del quale le cellule hanno sviluppato più vie di riparazione DSB (DSBR) per riparare queste lesioni. I quattro principali meccanismi DSBR sono la ricombinazione omologa (HR), l'unione di estremità non omologa (NHEJ), l'unione di estremità mediata da microomologia (MMEJ) e la ricottura a filamento singolo (SSA)2,3. Le vie DSBR contribuiscono al mantenimento dello sviluppo e della fisiologia dei tessuti sani e proteggono da malattie come il cancro. Inoltre, questi meccanismi di riparazione hanno un potenziale terapeutico per lo sviluppo di modulatori di piccole molecole nell'oncologia di precisione. Ad esempio, il targeting della DNA polimerasi θ (Polθ), un enzima cardine nella via di riparazione della MMEJ, ha suscitato interesse a causa della sua letalità sintetica con deficit di HR nel cancro4.
La comprensione del DSBR ha quindi ampie implicazioni cliniche e sono necessari saggi cellulari funzionali in grado di misurare l'attività di tutte le principali vie del DSBR5. I saggi devono essere adatti sia per l'interrogazione genetica che farmacologica e possono essere distribuiti su modelli cellulari di interesse. Per supportare gli sforzi di scoperta di farmaci a piccole molecole, i saggi devono essere altamente sensibili, titolabili, avere tempi di consegna rapidi ed essere scalabili a formati ad alto rendimento adatti allo screening dei composti.
In generale, il DSBR è stato precedentemente misurato utilizzando sistemi di analisi reporter basati sulla fluorescenza integrati stabilmente nel genoma cellulare6. Tuttavia, mentre la ricapitolazione fisiologica del DSBR cromosomico è un netto vantaggio, tali saggi sono limitati a un modello ospite in cui il reporter è integrato, utilizzano la preparazione e l'analisi del campione ad alta intensità di lavoro mediante citometria a flusso e hanno una produttività, un tempo di risposta, una robustezza e una sensibilità limitati, tutte caratteristiche essenziali necessarie per gli sforzi di scoperta farmacologica.
Qui descriviamo una serie di saggi reporter DSBR che consentono la valutazione dei quattro principali percorsi DSBR. La suite di substrati per saggi reporter è descritta nella Figura 1 e ulteriormente descritta in una recente pubblicazione7. Sono extracromosomici, consentendo la loro introduzione nelle cellule mediante semplice trasfezione transitoria, e l'incorporazione di un gene reporter8 della nanoluciferasi, che deve essere ricostituito mediante l'impegno con specifici meccanismi DSBR, genera sensibilità, robustezza e scalabilità. Le seguenti varianti di substrato reporter DSBR sono incluse nel protocollo (Figura 1):
MMEJ indipendente dalla resezione: Questo substrato lineare è composto da una regione centrale di DNA a doppio filamento (dsDNA) con sporgenze di DNA a filamento singolo (ssDNA), che imitano le estremità9 del DNA resecate. Quattro microomologie nucleotidiche ai termini delle regioni dell'ssDNA codificano il codone iniziale per il gene reporter. La riparazione di questo substrato attraverso MMEJ ripristina il gene reporter open reading frame (ORF).
MMEJ dipendente dalla resezione: L'esone del gene reporter N-terminale è interrotto da un segmento contenente un codone di stop, che è affiancato da 8 microomologie di coppie di basi (bp). La resezione terminale nucleolitica è necessaria prima della riparazione mediata da MMEJ per ripristinare il gene reporter intatto.
Schietto NHEJ: Il gene reporter è suddiviso in sezioni N- e C-terminali, di cui quest'ultima è posta a monte del promotore. Il DSB è prodotto utilizzando EcoRV e richiede la legatura diretta (senza elaborazione finale) da parte di NHEJ per il ricongiungimento di entrambe le porzioni di gene reporter e il ripristino dell'ORF reporter.
NHEJ non schietto: Il DSB si trova all'interno di un introne e avrà estremità coesive o non coese a seconda della scelta dell'enzima di restrizione. La riparazione di questo substrato mediante NHEJ richiede che la legatura sia preceduta dalla lavorazione finale.
Modello lungo HR: L'esone N-terminale del gene reporter è interrotto da un segmento di DNA contenente siti di restrizione, che sostituiscono 22 bp della sequenza genica reporter originale. Per ripristinare questa sequenza, la riparazione mediante HR utilizza il modello di omologia da 2,5 kilobasi (kb) posizionato a valle dell'esone C-terminale.
Modello breve HR: Il sito di restrizione necessario per generare il DSB sostituisce parte della sequenza genica reporter nativa e introduce un codone di stop in-frame. Come la versione modello lungo, questo substrato HR richiede il modello di omologia a valle (360 bp) per una riparazione e un ripristino accurati dell'ORF reporter.
SSA: Questo substrato contiene un codone di stop prematuro situato all'interno dell'esone N-terminale del gene reporter. La rimozione di questo codone di stop e il ripristino della sequenza genica reporter intatta richiedono la riparazione mediante SSA, che comporta una resezione bidirezionale a lungo raggio prima dell'allineamento delle omologie.
Per la generazione del DSB, alcuni dei substrati reporter possono essere digeriti con I-SceI (Figura 1). Ciò genererà un substrato lineare con estremità non coese nei reporter MMEJ dipendenti dalla resezione, NHEJ non smussato, HR e SSA long template, che hanno siti I-SceI tandem in orientamenti invertiti. Nel substrato reporter HR modello corto, la digestione del singolo sito I-SceI genererà estremità coese. I plasmidi NHEJ non smussati, MMEJ resezione dipendente, HR e SSA modello lungo possono anche essere digeriti con HindIII, che produrrà estremità coesive complementari.
Forniamo protocolli per la generazione dei substrati del saggio reporter e descriviamo come possono essere eseguiti i saggi, fornendo dettagli su come possono essere utilizzati per quantificare il DSBR, comprese le risposte titolabili a piccole molecole, la valutazione della potenza cellulare, l'attività sul bersaglio e la selettività del percorso.
Protocol
1. Preparazione e controllo qualità (QC) dei substrati reporter
NOTA: I plasmidi che codificano i substrati reporter possono essere propagati in ceppi standard di Escherichia coli (ad esempio, DH5α e derivati) e recuperati mediante isolamento plasmidico. I dettagli del plasmide (dimensioni e resistenza agli antibiotici) sono descritti nella Tabella 1 e nella Figura 1.
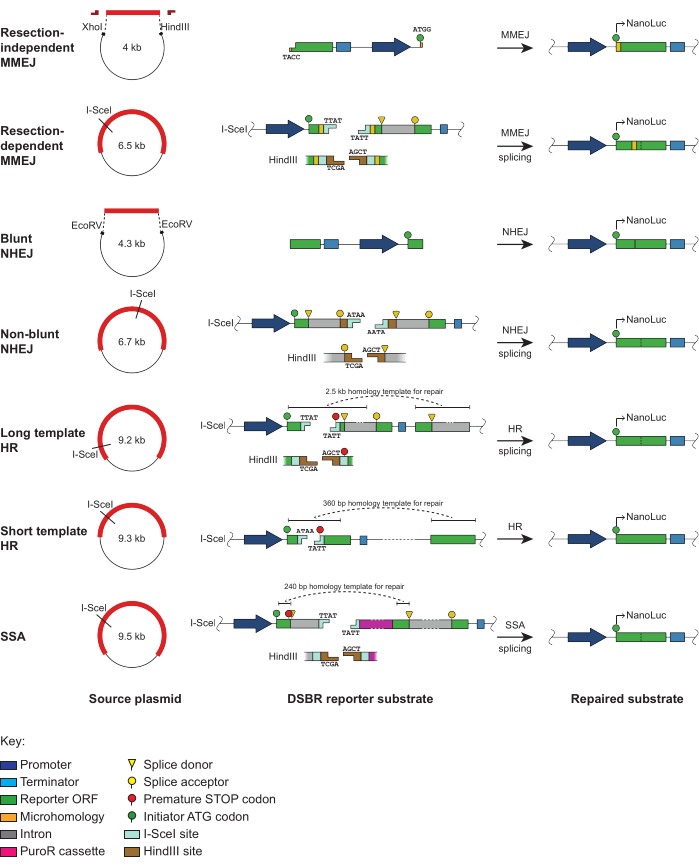
Figura 1: Schemi dei saggi reporter DSBR extracromosomici basati su NanoLuc. Rappresentazione schematica dei substrati reporter DSBR, inclusa la loro posizione all'interno di ciascun plasmide sorgente, le caratteristiche della sequenza principale e il layout finale dopo la riparazione specifica del percorso. Il nucleo del substrato MMEJ indipendente dalla resezione viene asportato dal plasmide sorgente mediante digestione con XhoI/HindIII, dopodiché i cappucci devono essere legati a entrambe le estremità per produrre il substrato per MMEJ. Il substrato reporter NHEJ smussato è generato dall'escissione dal plasmide sorgente con EcoRV. I substrati reporter MMEJ resezione dipendente, NHEJ non smussato, HR modello lungo e SSA sono generati dalla linearizzazione dei plasmidi sorgente utilizzando I-SceI (che produce estremità non coese) o HindIII (che produce estremità coesive). Il substrato reporter HR short template è generato dalla linearizzazione del plasmide sorgente utilizzando I-SceI (che produce estremità coesive). La riparazione di ciascun substrato reporter da parte della via DSBR bersaglio ricostituisce una nanoluciferasi ORF intatta che codifica per NanoLuc funzionale. Questa figura è stata adattata da Rajendra et al.7. Abbreviazioni: DSBR = riparazione della rottura del doppio filo; NanoLuc = Nanoluciferasi; MMEJ = giunzione terminale mediata da microomologia; NHEJ = giunzione di estremità non omologa; HR = ricombinazione omologa; SSA = ricottura a filo singolo; ORF = cornice di lettura aperta. Clicca qui per visualizzare una versione più grande di questa figura.
- Preparazione del substrato reporter MMEJ indipendente dalla resezione (Figura 1 e Figura 2A-C)
- Preparazione dei cappucci ssDNA/dsDNA (Figura 2A)
- Risospendere singolarmente i quattro oligonucleotidi elencati nella Tabella 2 in tampone di ricottura (20 mM Tris pH 7,5, 50 mM NaCl in acqua di biologia molecolare) per generare una soluzione madre a 100 μM.
- Ricottura di cappucci in acciaio inox/dsDNA
- Miscelare 50 μl di oligonucleotidi lunghi e corti (soluzione madre da 100 μM) per il tappo sinistro del passaggio 1.1.1.1 in una provetta da 0,2 mL.
- Ripetere per gli oligonucleotidi del cappuccio destro.
- Utilizzando un termociclatore, incubare ciascuna miscela di oligonucleotidi a 99 °C per 5 minuti, quindi scendere a 10 °C a 1 °C/min.
NOTA: Questo produrrà i cappucci sinistro e destro ricotto.
- (Controllo qualità, facoltativo) Verifica della ricottura degli oligonucleotidi mediante elettroforesi
- Elettroforesi 100 ng di ciascun prodotto dalla fase 1.1.1.2 insieme a singoli oligonucleotidi dalla fase 1.1.1.1 e una scala di DNA a basso peso molecolare in un gel di acrilammide-tris-borato-EDTA (TBE) al 20% a 200 V per 80 minuti.
- Colorare il gel con un tampone di corsa TBE contenente un colorante di DNA fluorescente appropriato per la visualizzazione sia di ssDNA che di dsDNA per almeno 10-15 minuti.
- Visualizzare la fluorescenza su un sistema di documentazione su gel (Figura 2A).
NOTA: I passaggi da 1.1.1.3.1 a 1.1.1.3.3 vengono utilizzati per verificare che i tappi siano ricotti correttamente. Le dimensioni apparenti per il tappo sinistro e il tappo destro dovrebbero essere rispettivamente ~120 bp e ~175 bp.
- Purificazione del nucleo del substrato reporter (Figura 2B)
- Miscelare 100 μg del plasmide del nucleo reporter con 4 μL di HindIII e 4 μL di XhoI (4 U/μg di plasmide per ogni enzima) e 20 μL di tampone 10x. Portare il volume totale a 200 μl con acqua bidistillata (ddH2O) e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
NOTA: Per la digestione di quantità maggiori o minori, scalare la reazione in modo proporzionale. - Incubare la reazione di digestione a 80 °C per 20 minuti per riscaldare gli enzimi di restrizione inattivi.
- Aggiungere 40 μl di fosfatasi alcalina (plasmide 2 U/μg) e 27 μl di tampone 10x alla miscela di reazione del passaggio 1.1.2.2. Incubare a 37 °C per 2 ore per defosforilare il plasmide.
NOTA: Aumentare o diminuire la reazione della bilancia secondo necessità. - Aggiungere 60 μl di colorante di caricamento 6x alla reazione del passaggio 1.1.2.3. Elettroforesi insieme a una scala di DNA ad alto peso molecolare in un gel all'1,5 % (p/v) di agarosio-Tris-acetato-EDTA (TAE) contenente un colorante fluorescente di dsDNA a 120 V per 2,5 ore o fino a quando le bande non sono sufficientemente risolte.
- Visualizzare la fluorescenza su un sistema di documentazione su gel (Figura 2B).
- Asportare il frammento del nucleo del reporter (~1,5 kb) dal gel utilizzando un bisturi pulito, facendo attenzione a non contaminarlo con la spina dorsale del vettore (~2,5 kb).
- Estrarre il frammento del nucleo del reporter utilizzando un kit di estrazione del gel, seguendo le istruzioni del produttore.
- Misurare la concentrazione e la qualità del DNA (A260/280) mediante spettrofotometria.
- Miscelare 100 μg del plasmide del nucleo reporter con 4 μL di HindIII e 4 μL di XhoI (4 U/μg di plasmide per ogni enzima) e 20 μL di tampone 10x. Portare il volume totale a 200 μl con acqua bidistillata (ddH2O) e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
- Legatura del nucleo del substrato reporter con cappucci ssDNA/dsDNA e purificazione del substrato reporter finale (Figura 2C)
- Miscelare 30 μg del frammento del nucleo reporter del passaggio 1.1.2.7 con 3,85 μL di ciascun tappo sinistro e destro ricotto del passaggio 1.1.2 (rapporto molare circa 6:1 del DNA del cappuccio:nucleo), 30 μL di tampone ligasi 10x e 1,5 μL di DNA ligasi T4 (20 U/μg di DNA). Portare il volume totale della reazione a 300 μL con ddH2O e incubare per una notte a 16 °C per legare i cappucci al frammento del nucleo reporter.
NOTA: Aumentare o diminuire la reazione della bilancia secondo necessità. - (Controllo qualità, facoltativo) Elettroforesi 200 ng del prodotto risultante dalla fase 1.1.3.1 insieme al nucleo del substrato reporter e a una scala di DNA ad alto peso molecolare in un gel di agarosio-TAE allo 0,7% (p/v) contenente un colorante fluorescente di dsDNA a 120 V per almeno 1,5 ore. Verificare che la banda corrispondente al prodotto ligato migri a una velocità leggermente più lenta rispetto al nucleo del substrato reporter non legato (Figura 2C).
NOTA: Questo passaggio del controllo qualità serve a verificare che la legatura dei cappucci al frammento del nucleo del reporter sia avvenuta correttamente. - Purificare il DNA dalla reazione di digestione nel passaggio 1.3.1. utilizzando il metodo preferito (ad esempio, un metodo basato su perline o colonne), seguendo le istruzioni del produttore.
NOTA: La fase di purificazione 1.1.3.3 riduce sostanzialmente la presenza di cappucci non legati.
- Miscelare 30 μg del frammento del nucleo reporter del passaggio 1.1.2.7 con 3,85 μL di ciascun tappo sinistro e destro ricotto del passaggio 1.1.2 (rapporto molare circa 6:1 del DNA del cappuccio:nucleo), 30 μL di tampone ligasi 10x e 1,5 μL di DNA ligasi T4 (20 U/μg di DNA). Portare il volume totale della reazione a 300 μL con ddH2O e incubare per una notte a 16 °C per legare i cappucci al frammento del nucleo reporter.
- Misurare la concentrazione e la qualità del DNA (A260/280) mediante spettrofotometria.
- Preparazione dei cappucci ssDNA/dsDNA (Figura 2A)
- Preparazione del substrato reporter NHEJ smussato (Figura 1 e Figura 2D,E)
- Miscelare 100 μg del plasmide del nucleo reporter con 5 μL di EcoRV (plasmide 5 U/μg) e 20 μL di tampone 10x. Portare il volume totale a 200 μl con ddH2O e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
NOTA: Per la digestione di quantità maggiori o minori, scalare la reazione in modo proporzionale. - Incubare la reazione di digestione a 65 °C per 20 minuti per riscaldare l'enzima di restrizione inattivato.
- Aggiungere 50 μl di colorante di caricamento 6x alla reazione del passaggio 1.2.2. Elettroforesi insieme a una scala di DNA ad alto peso molecolare in un gel di agarosio-TAE all'1,5% (p/v) contenente una colorazione fluorescente di dsDNA a 120 V per 2 ore o fino a quando le bande non sono sufficientemente risolte.
- Visualizzare la fluorescenza su un sistema di documentazione su gel (Figura 2D).
- Asportare il substrato reporter (~1,7 kb) dal gel utilizzando un bisturi pulito, facendo attenzione a non contaminarlo con la spina dorsale vettoriale (~2,6 kb).
- Estrarre il frammento del nucleo del reporter utilizzando un kit di estrazione con gel, seguendo le istruzioni del produttore (Figura 2E).
- Misurare la concentrazione e la qualità del DNA (A260/280) mediante spettrofotometria.
- Miscelare 100 μg del plasmide del nucleo reporter con 5 μL di EcoRV (plasmide 5 U/μg) e 20 μL di tampone 10x. Portare il volume totale a 200 μl con ddH2O e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
- Preparazione di substrati reporter basati su I-SceI (Figura 1)
NOTA: Questi substrati includono MMEJ dipendente dalla resezione (Figura 2F), NHEJ non smussato (Figura 2G), modello lungo HR (Figura 2H), modello corto HR (Figura 2I) e SSA (Figura 2J).- Miscelare 100 μg del plasmide del nucleo reporter con 50 μL di I-SceI (5 U/μg di plasmide) e 60 μL di tampone 10x. Portare il volume totale a 600 μl con ddH2O e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
NOTA: Per la digestione di quantità maggiori o minori, scalare la reazione in modo proporzionale. I plasmidi NHEJ non smussati, MMEJ resezione dipendente, HR e SSA long template possono anche essere digeriti con HindIII, che genererà estremità coesive complementari. - Incubare la reazione di digestione a 65 °C per 20 minuti per riscaldare e inattivare I-SceI. Impostare la temperatura a 80 °C durante questa fase se invece è stato utilizzato HindIII per la digestione.
- Purificare il DNA dalla reazione di digestione inattivata nella fase 1.3.2 utilizzando il metodo preferito (ad esempio, un metodo basato su perline o colonne), seguendo le istruzioni del produttore.
- Misurare la concentrazione e la purezza del DNA (A 260/280) mediante spettrofotometria.
- Miscelare 100 μg del plasmide del nucleo reporter con 50 μL di I-SceI (5 U/μg di plasmide) e 60 μL di tampone 10x. Portare il volume totale a 600 μl con ddH2O e incubare a 37 °C per 2 ore o tutta la notte per digerire il plasmide.
- Controllo qualità dei substrati reporter
- Elettroforesi 200 ng del substrato reporter insieme a una scala di DNA ad alto peso molecolare in un gel di agarosio-TAE allo 0,7% (p/v) contenente una colorazione fluorescente di dsDNA a 120 V per 2 ore o fino a quando le bande non sono sufficientemente risolte. Caricare il plasmide reporter originale non tagliato accanto come controllo.
- Verificare che siano rispettate le bande definite della dimensione corretta per ciascun substrato reporter (fare riferimento alla Tabella 1 e alla Figura 2F-J).
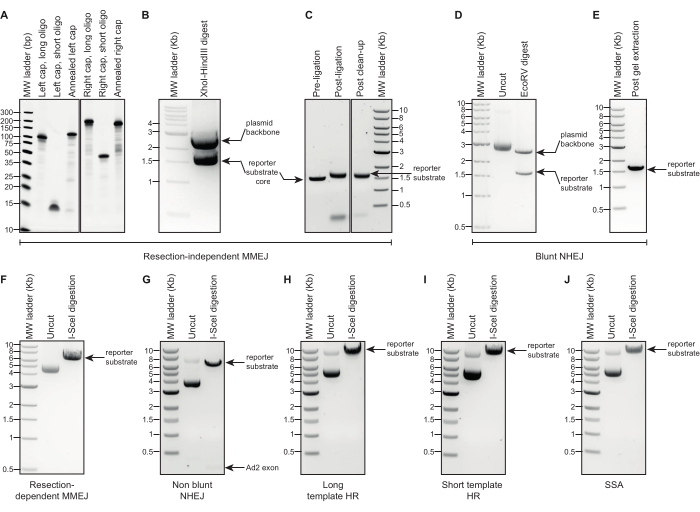
Figura 2: Analisi elettroforetiche su gel della generazione di substrati reporter DSBR. (A-C) Immagini rappresentative dall'analisi elettroforetica su gel degli intermedi e del costrutto finale necessari per la generazione del substrato reporter MMEJ indipendente dalla resezione. Le immagini adiacenti nei pannelli (A) e (C) provengono dagli stessi gel; Le corsie irrilevanti sono state omesse. (D,E) Immagini rappresentative dall'analisi elettroforetica su gel per il plasmide sorgente, i prodotti digeriti da EcoRV e il costrutto finale estratto da gel necessari per la generazione del substrato reporter NHEJ smussato. (F-J) Immagini rappresentative dall'analisi elettroforetica su gel di plasmidi sorgente e costrutti DSBR linearizzati per i substrati reporter I-Scedigeriti da I: MMEJ dipendente dalla resezione, NHEJ non smussato, HR modello lungo, HR modello corto, SSA. Abbreviazioni: DSBR = riparazione della rottura del doppio filo; MMEJ = giunzione terminale mediata da microomologia; NHEJ = giunzione di estremità non omologa; HR = ricombinazione omologa; SSA = ricottura a filo singolo. Clicca qui per visualizzare una versione più grande di questa figura.
2. Trasfezione transitoria di substrati reporter DSBR
NOTA: Una panoramica del flusso di lavoro sperimentale dei saggi e alcune potenziali permutazioni sono delineate nella Figura 3. Il protocollo seguente descrive un esperimento che utilizza cellule HEK-293, in cui queste vengono trasfettate in modo inverso con il substrato reporter. I numeri sottostanti possono essere aumentati o diminuiti in base al numero di pozzetti da utilizzare per piastra. Le seguenti fasi sono calcolate per un saggio eseguito in una piastra a 96 pozzetti; vedi Discussione per ulteriori considerazioni.
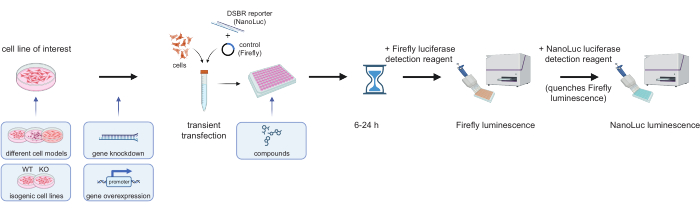
Figura 3: Flusso di lavoro sperimentale per i saggi reporter DSBR. Le cellule di interesse vengono trasfettate con il substrato DSBR linearizzato (che codifica per un ORF NanoLuc che deve essere riparato attraverso uno specifico evento di riparazione del DNA) e un plasmide Firefly (controllo della trasfezione). Quindi, 6-24 ore dopo la trasfezione, la luminescenza Firefly e la luminescenza NanoLuc possono essere lette in sequenza dopo l'aggiunta di reagenti Nano-Glo Dual-Luciferas. Esempi di permutazioni alle fasi principali (mostrate all'interno di riquadri azzurri) possono essere utilizzate per testare come la modulazione genetica (knockout, knockdown o sovraespressione) o il trattamento farmacologico influenzino la competenza della via DSBR nelle cellule. Abbreviazioni: DSBR = riparazione della rottura del doppio filo; NanoLuc = Nanoluciferasi; WT = tipo selvatico; KO = knockout. Clicca qui per visualizzare una versione più grande di questa figura.
- (Facoltativo) Se si valuta l'impatto dei composti sul saggio reporter, erogare i composti disciolti nel veicolo (ad esempio, dimetilsolfossido [DMSO]) nei pozzetti di una piastra a 96 pozzetti secondo un layout sperimentale predefinito. Normalizza la concentrazione dei veicoli in tutti i pozzi.
NOTA: Si consigliano repliche tecniche. Includi i pozzetti di controllo (ad esempio, solo per i veicoli). - In una provetta da 1,5 mL, diluire il plasmide di controllo Firefly (luciferasi di controllo) e il substrato reporter NanoLuc DSBR (luciferasi reporter) generati negli step 1.1, 1.2 o 1.3, in 500 μL di tampone di trasfezione. Utilizzare 0,66 μg di plasmide di luciferasi di controllo per 1 × 106 cellule. Vedere la Tabella 3 per le quantità di substrato reporter NanoLuc DSBR da utilizzare.
NOTA: Un plasmide di controllo positivo che esprime costitutivamente la luciferasi reporter può essere utilizzato per convalidare le condizioni di configurazione e trasfezione dello strumento o per verificare la presenza di effetti non specifici sulla luciferasi reporter stessa. Come punto di partenza, raccomandiamo 0,1 μg di plasmide di luciferasi reporter e 0,66 μg di plasmide di luciferasi di controllo per 1 × 106 cellule. - Aggiungere il reagente di trasfezione a base lipidica al DNA diluito dal passaggio 2.2 secondo il rapporto raccomandato dal produttore (ad es. 1:2, μg di reagente DNA:μL per il reagente descritto nella Tabella dei materiali), mescolare bene agitando brevemente e incubare per 10 minuti a temperatura ambiente.
- Raccogliere le cellule mediante tripsinizzazione, risospenderle in un terreno fresco contenente il 10% di siero fetale bovino (FBS) e contarle.
- Trasferire 3 × 106 cellule in una provetta da 15 mL e risospendere in 8,5 mL di terreno.
- Aggiungere la miscela di trasfezione del DNA del passaggio 2.3 nella sospensione cellulare e mescolare più volte per inversione.
- Piastra 80 μl di sospensione cellulare (circa 2,7 × 104 cellule) per pozzetto.
NOTA: La sospensione contenente cellule e la miscela di trasfezione del DNA possono essere dispensate sulla piastra mediante pipettaggio manuale o utilizzando un gestore di liquidi automatizzato per esperimenti ad alta produttività. - Incubare a 37 °C/5% CO2 per 24 ore.
3. Rilevamento della luminescenza
- Preparazione dei reagenti
- Seguire le istruzioni del produttore per la preparazione e l'aggiunta dei reagenti luciferasi reporter (NanoLuc) e di controllo (Firefly), che forniscono i substrati per entrambe le luciferasi (furimazina e 5'-fluoroluciferina, rispettivamente):
- Preparare il reagente luciferasi di controllo. Ricostituire secondo le istruzioni del produttore e mescolare per inversione fino a quando il substrato della luciferasi non è completamente sciolto.
- Preparare il reagente luciferasi reporter fresco secondo le istruzioni del produttore. Calcolare la quantità di reagente necessaria per aggiungere 80 μL/pozzetto e aggiungere il substrato in un volume appropriato di tampone di saggio in un rapporto 1:100 (substrato di luciferasi:tampone). Per una piastra a 96 pozzetti, diluire 88 μL di substrato di luciferasi in 8.800 μL di tampone e mescolare per inversione.
NOTA: Queste quantità includono una franchigia di circa il 10%. Una volta ricostituito, il reagente di controllo della luciferasi può essere conservato secondo le istruzioni del produttore per un uso futuro. Il reagente luciferasi reporter deve essere preparato fresco per ogni utilizzo.
- Rilevamento seriale della luminescenza da luciferasi di controllo e reporter (piastra a 96 pozzetti)
- Lasciare che la piastra e i reagenti della luciferasi raggiungano la temperatura ambiente.
- Aggiungere 80 μL di reagente luciferasi di controllo per pozzetto.
- Agitare la piastra per 3 minuti su un agitatore orbitale a 450 giri/min.
- Misurare il segnale di luminescenza della luciferasi di controllo con un lettore di piastre di luminescenza.
NOTA: Leggere l'emissione a 580 nm (filtro passa-banda da 80 nm) o la luminescenza totale per pozzetto. Questa luminescenza viene utilizzata come misura dell'efficienza di trasfezione e della densità cellulare e può anche informare sulla tossicità cellulare causata dai trattamenti di prova. - Aggiungere 80 μL di reagente luciferasi reporter per pozzetto.
NOTA: Questo reagente inibirà la luciferasi di controllo; Contiene anche il substrato per la luciferasi reporter. - Agitare la piastra per 3 minuti su un agitatore orbitale a 450 giri/min.
- Lasciare riposare la piastra per 7 minuti a temperatura ambiente.
- Misurare il segnale di luminescenza della luciferasi reporter con un lettore di piastre di luminescenza.
NOTA: Leggere l'emissione a 470 nm (filtro passa-banda da 80 nm) o, in alternativa, la luminescenza totale per pozzetto. Questa luminescenza fornisce informazioni sulla quantità di substrato reporter che è stato riparato dal percorso DSBR di interesse. - Esportazione delle letture della luminescenza per l'analisi a valle.
4. Analisi dei dati
- Dividere il segnale di luminescenza della luciferasi reporter (NanoLuc) per il segnale di luminescenza della luciferasi di controllo (Firefly) proveniente dallo stesso pozzetto per calcolare il segnale del saggio. Applicare tale calcolo a tutti i pozzetti come mostrato nell'equazione (1).
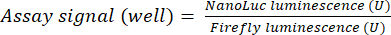 (1)
(1) - Calcolare la media dei segnali di analisi per i pozzetti di controllo (ad esempio, solo per il veicolo).
- Normalizzare i segnali di analisi per i pozzetti di prova alla media dei pozzetti di controllo utilizzando l'equazione (2) per calcolare la riparazione (%) per pozzetto.
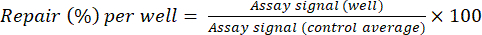 (2)
(2) - (Opzionale, montaggio a curva) Se si testano dosi di più composti, tracciare la riparazione calcolata (%) rispetto alla concentrazione del composto e adattare una curva dose-risposta utilizzando un modello di regressione non lineare. Utilizzare questa curva per la successiva interpolazione EC50 .
Representative Results
La riparazione di ciascuno dei saggi reporter può essere rilevata e quantificata utilizzando la stessa procedura. La corretta riparazione di un substrato attraverso la sua via di riparazione affine nelle cellule ricostituirà un ORF intatto e funzionale che codifica per NanoLuc. Questo segnale di luminescenza può essere rilevato utilizzando un lettore di piastre.
La co-trasfezione con un plasmide intatto che codifica per la luciferasi Firefly funge da controllo della trasfezione. Questo controllo ha due scopi. In primo luogo, fornisce uno standard per normalizzare il segnale NanoLuc, in quanto non dovrebbe essere influenzato dalla modulazione del DSBR con mezzi genetici o farmacologici. In secondo luogo, può fornire un'indicazione di perturbazioni cellulari fuori bersaglio che influiscono sul segnale della luciferasi, come la modulazione del ciclo cellulare, gli effetti sulla trascrizione/traduzione o la tossicità generale.
Il rapporto tra NanoLuc e Firefly funge da lettura surrogata della riparazione. I valori di luminescenza possono essere esportati e analizzati normalizzando i due segnali della luciferasi all'interno dello stesso pozzetto. Nel caso di studi di perturbazione genetica (ad esempio, confronto tra siRNA wild-type e KO o siRNA non mirati e bersaglio), la riparazione è solitamente normalizzata al campione parentale (cellule wild-type o cellule trattate con siRNA di controllo non mirato). Nel caso della modulazione farmacologica, i valori di un campione trattato con composto sono normalizzati al valore prodotto dal trattamento con veicolo.
La convalida completa della suite di reporter descritta è stata recentemente pubblicata7. I dati che esemplificano la caratterizzazione della modulazione genetica e farmacologica del DSBR sono mostrati nella Figura 4 (adattata da 7). Polθ è il mediatore chiave del MMEJ e si prevede che la perdita o l'inibizione di questo enzima ablasse specificamente il MMEJcellulare 3,10. Utilizzando una linea cellulare in cui POLQ, il gene che codifica per Polθ, è stato eliminato11, il test reporter MMEJ indipendente dalla resezione dimostra che il MMEJ è effettivamente quasi completamente soppresso. La valutazione dei segnali di luminescenza NanoLuc e Firefly mostra che il difetto di riparazione osservato è guidato da una riduzione del segnale NanoLuc (codificato dal substrato reporter) mentre il segnale Firefly (controllo) è imperturbato (Figura 4A-C). Al contrario, la valutazione della competenza NHEJ utilizzando il reporter NHEJ con estremità smussata dimostra che il knockout POLQ non inibisce la riparazione del substrato reporter (Figura 4D-F). Insieme, questi dati genetici supportano il ruolo specifico di Polθ nella riparazione mediata da MMEJ. Queste osservazioni sono completamente riassunte farmacologicamente con ART55812,13, un inibitore altamente potente e specifico del dominio polimerasi di Polθ (Figura 4G), dove si osserva un'inibizione titolabile di MMEJ, che deriva da una diminuzione specifica del segnale di NanoLuc e non del Firefly (Figura 4H). Inoltre, e in accordo con i dati genetici, non vi è alcun effetto sull'NHEJ (Figura 4I, J). Insieme, questi dati evidenziano come questi reporter possano essere utilizzati per caratterizzare la modulazione genetica delle vie DSBR e mostrare la potenza cellulare e la specificità del bersaglio/via di piccole molecole.
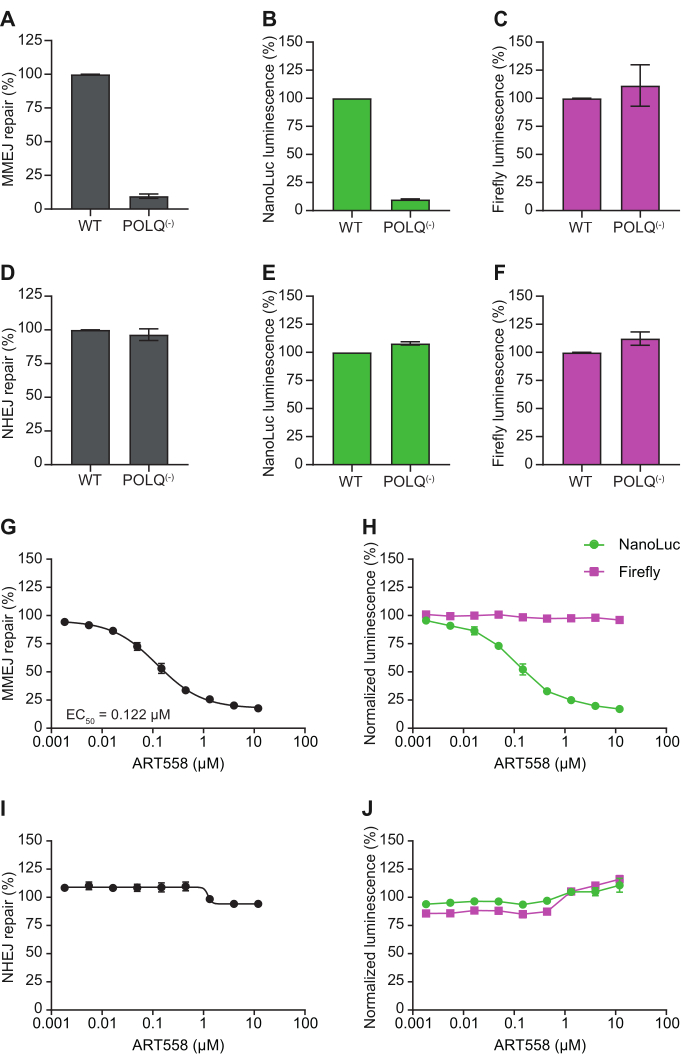
Figura 4: Effetti del knockout genetico e dell'inibizione farmacologica di Polθ sui segnali reporter MMEJ e NHEJ. Le cellule eHAP1 WT e POLQ(-) sono state trasfettate con un plasmide di controllo Firefly e con (A-C) il reporter MMEJ indipendente dalla resezione o (D-F) reporter NHEJ con estremità smussata. La percentuale di riparazione MMEJ o NHEJ è il rapporto tra la luminescenza di NanoLuc e la luminescenza di Firefly, normalizzata al controllo trattato con DMSO, 24 ore dopo la trasfezione. I dati rappresentano il SEM medio ± di tre repliche biologiche, ciascuna con una media di 8 repliche tecniche. Le cellule HEK-293 sono state trasfettate con un plasmide di controllo Firefly e (G,H) il reporter MMEJ indipendente dalla resezione o il reporter NHEJ con estremità smussata (I,J) e trattate con l'inibitore della polimerasi Polθ ART558. La percentuale di riparazione è il rapporto tra la luminescenza di NanoLuc e la luminescenza di Firefly, normalizzata al controllo trattato con DMSO, 24 ore dopo la trasfezione. La percentuale di inibizione dei singoli segnali di luminescenza in (G) e (I) è stata calcolata rispetto al controllo trattato con DMSO e mostrata rispettivamente in (H) e (J). I dati rappresentano il SEM medio ± di 2 repliche biologiche, ciascuna con una media di 4 repliche tecniche. Questa figura è stata adattata da Rajendra et al.7. Abbreviazioni: NanoLuc = Nanoluciferasi; MMEJ = giunzione terminale mediata da microomologia; NHEJ = giunzione di estremità non omologa; WT = tipo selvaggio. Clicca qui per visualizzare una versione più grande di questa figura.
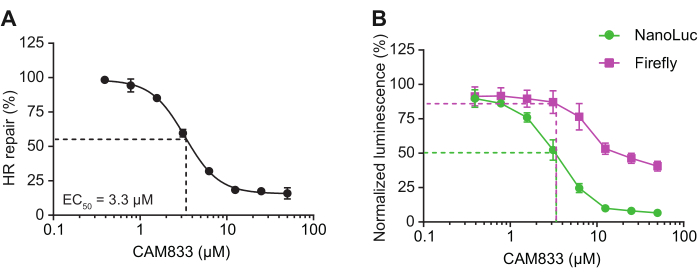
Figura 5: Inibizione del segnale del reporter HR da parte dell'inibitore di RAD51 CAM833. (A) Le cellule HEK-293 sono state trasfettate con il substrato reporter HR long template, un plasmide di controllo della luciferasi Firefly, e trattate con l'inibitore di RAD51 CAM83314. La luminescenza di NanoLuc e Firefly è stata letta 16 ore dopo la trasfezione. La percentuale di riparazione HR è il rapporto tra la luminescenza NanoLuc e la luminescenza Firefly, normalizzata al controllo trattato con DMSO. Le linee tratteggiate evidenziano la percentuale di inibizione HR e la concentrazione di CAM833 alla curva EC50. I dati rappresentano il SEM medio ± di 2 repliche biologiche, ciascuna con una media di 4 repliche tecniche. (B) La percentuale di inibizione dei singoli segnali di luminescenza in (A) è stata calcolata rispetto al controllo trattato con DMSO. Le linee tratteggiate evidenziano la percentuale di inibizione di NanoLuc e Firefly a 3,33 μM CAM833 (EC50). La diminuzione del segnale Firefly a concentrazioni di CAM833 ≥ 10 μM è indicativa della tossicità del composto ad alte dosi; tuttavia, la riduzione del segnale di NanoLuc è osservata a concentrazioni in cui il segnale Firefly non è influenzato, suggerendo che CAM833 induce l'inibizione della frequenza cardiaca sul bersaglio. Questa figura è stata adattata da Rajendra et al.7. Abbreviazioni: NanoLuc = Nanoluciferasi; HR = ricombinazione omologa. Clicca qui per visualizzare una versione più grande di questa figura.
| Substrato reporter | Plasmide sorgente (dimensione in kb, resistenza) | Generazione DSB | Dimensione prevista del substrato del reporter finale (kb) | |||
| MMEJ indipendente dalla resezione | 4.0, Kan | Code resecate di 3' attraverso la legatura dei cappucci | 1.6 | |||
| MMEJ resezione dipendente | 6.5, Kan | I-SceI (non coeso), HindIII (coeso) | 6.5 | |||
| Smussato NHEJ | 4.3, Kan | Termina con l'escissione dal plasmide mediante EcoRV | 1.7 | |||
| NHEJ non smussato | 6.7, Kan | I-SceI (non coeso), HindIII (coeso) | 6.5 | |||
| Modello lungo HR | 9.2, Kan | I-SceI (non coeso), HindIII (coeso) | 9.2 | |||
| Modello breve HR | 9.3, Amplificatore | I-SceI (coeso) | 9.3 | |||
| SSA | 9.5, Kan | I-SceI (non coeso), HindIII (coeso) | 9.5 | |||
Tabella 1: Plasmidi del substrato reporter. Abbreviazioni: DSB = rottura a doppio filo; MMEJ = giunzione terminale mediata da microomologia; NHEJ = giunzione di estremità non omologa; HR = ricombinazione omologa; SSA = ricottura a filo singolo; Kan = kanamicina; Amp = ampicillina.
| Sequenza (5'-3') | Fornitore | Purificazione | Funzione | ||
| 5'[Phos]TCGAGGACTTGGTCCAGGTT GTAGCCGGCTGTCTGTCGCCAGTCC CCAACGAAATCTTCGAGTGTGAAGACCAT | Sigma | PAGINA | Cappuccio sinistro, oligonucleotide lungo | ||
| 5'[Phos]GCCGGCTACAACCTGGACCAAGTCC | Sigma | PAGINA | Tappo sinistro, oligonucleotide corto | ||
| 5'[Phos]AGCTTTATTGCGGTAGTTTATCA CAGTTAAATTGCTAACGCAGTCAGTGG GCCTCGGCGGCCAAGCTAGGCAATCC GGTACTGTTGGTAAAGCCACCATGG | Sigma | PAGINA | Tappo destro, oligonucleotide lungo | ||
| 5'[Phos]CGAGGCCCACTGACTGCGTTA GCAATTTAACTGTGATAAACTACCGCAATAA | Sigma | PAGINA | Tappo destro, oligonucleotide corto | ||
Tabella 2: Oligonucleotidi per cappucci per la generazione di substrato reporter MMEJ indipendente dalla resezione. Abbreviazioni: ssDNA = DNA a filamento singolo; dsDNA = DNA a doppio filamento; MMEJ = giunzione terminale mediata da microomologia; PAGE = elettroforesi su gel di poliacrilammide. Le microomologie sono sottolineate.
| Saggio reporter | DNA substrato reporter NanoLuc (μg DNA/1x106 cellule) | Plasmide luciferasi di controllo Firefly (μg DNA/1x106 cellule) |
| MMEJ indipendente dalla resezione | 0.5 | 0.66 |
| MMEJ resezione dipendente | 1 | 0.66 |
| Smussato NHEJ | 0.5 | 0.66 |
| NHEJ non smussato | 0.5 | 0.66 |
| Modello lungo HR | 1 | 0.66 |
| Modello breve HR | 2 | 0.66 |
| SSA | 1 | 0.66 |
Tabella 3: Quantità di DNA per la trasfezione transitoria dei substrati reporter NanoLuc e del plasmide luciferasi di controllo Firefly (HEK-293, formato piastra a 96 pozzetti). Abbreviazioni: MMEJ = giunzione terminale mediata da microomologia; NHEJ = giunzione di estremità non omologa; HR = ricombinazione omologa; SSA = ricottura a filo singolo.
Discussion
Qui, abbiamo descritto i protocolli per la generazione e l'implementazione di una suite di reporter basati sulla luminescenza extracromosomica per misurare la competenza cellulare delle quattro principali vie DSBR (HR, NHEJ, MMEJ e SSA)7. I substrati reporter possono essere introdotti nelle cellule mediante trasfezione transitoria e utilizzati per valutare l'attività del DSBR utilizzando una lettura sensibile e robusta della luminescenza di NanoLuc basata su piastra, che viene ricostituita dopo l'interazione con percorsi DSBR cellulari affini.
Diverse fasi della generazione del substrato reporter, la trasfezione dei substrati in cellule e l'interpretazione dei dati sono fondamentali per il successo dell'esecuzione di questi saggi. Sebbene vengano utilizzate tecniche standard di biologia molecolare per generare i substrati reporter, la visualizzazione del processo mediante elettroforesi su gel garantisce la massima qualità e purezza dei substrati prima della trasfezione. Poiché questi saggi si basano sulla trasfezione transitoria, si applicano considerazioni comuni per questi metodi. Questi includono l'ottimizzazione della densità di semina, le condizioni di trasfezione (compresi i reagenti e le quantità di DNA) e la valutazione dell'idoneità nei formati di trasfezione diretta e inversa. Questi saggi reporter sono stati eseguiti con successo con una serie di protocolli di elettroporazione e lipofezione e le opzioni devono essere esplorate a fondo prima di eseguire questi saggi. È inoltre necessario prestare attenzione a ispezionare i segnali NanoLuc e Firefly dei componenti piuttosto che solo il segnale di riparazione composito derivato dalla normalizzazione del segnale NanoLuc (substrato reporter) al segnale Firefly (controllo). Gli artefatti possono derivare dal fatto che il rapporto è guidato da cambiamenti nel segnale Firefly. Ad esempio, la valutazione dell'inibizione in modalità dose-risposta utilizzando un composto altamente specifico dovrebbe sopprimere il segnale NanoLuc in modo titolabile senza perturbare il segnale Firefly, che dovrebbe rimanere stabile (Figura 4G, H). Tuttavia, nei casi in cui i segnali Firefly sono perturbati, gli impatti utili sulla riparazione possono ancora essere determinati identificando una finestra di dose in cui il segnale Firefly non è influenzato (Figura 5).
Rispetto ai saggi reporter DSBR più utilizzati più di frequente, questi saggi reporter basati sulla luminescenza extracromosomica presentano alcuni vantaggi distinti. Poiché le vie DSBR sono altamente conservate, anche se il macchinario cellulare varia tra i modelli cellulari, i saggi possono comunque riportare la competenza DSBR e la scelta della via. Ciò apre la valutazione del DSBR a qualsiasi modello di interesse per l'utente, a condizione che le condizioni ottimali di trasfezione transitoria siano stabilite in anticipo.
L'uso della nanoluciferasi come gene reporter offre anche vantaggi rispetto alle opzioni fluorescenti, che sono state utilizzate tradizionalmente nei saggi reporter DSBR. NanoLuc è a maturazione rapida e la luminescenza viene rilevata con elevata sensibilità utilizzando un lettore di piastre8. Accoppiato alla velocità di riparazione del substrato (poiché i substrati reporter vengono trasfettati in cellule con estremità DSB pronte per la riparazione), questo formato di saggio reporter DSBR è ideale per la rapida inversione di tendenza e la robustezza quantitativa necessarie per lo screening di piccole molecole come parte di una cascata di scoperta di farmaci industriali. Infatti, abbiamo recentemente descritto l'implementazione del saggio reporter MMEJ indipendente dalla resezione nella cascata di scoperte utilizzata per l'identificazione di inibitori di piccole molecole del dominio13 della polimerasi Polθ.
C'è anche flessibilità nell'implementazione dei saggi reporter per affrontare domande specifiche sulle perturbazioni genetiche e farmacologiche del DSBR (Figura 3). Ad esempio, prima della trasfezione dei substrati reporter, le cellule possono essere trasfettate con siRNA contro un gene di interesse per 48-72 ore. In alternativa, gli effetti della sovraespressione genica sulle vie DSBR possono essere testati eseguendo la trasfezione plasmidica 24-48 ore prima della trasfezione dei substrati reporter. Per gli studi farmacologici, il presente protocollo descrive già come l'uso di piccole molecole possa essere incorporato nel flusso di lavoro standard, ma formati alternativi possono includere alterazioni nei regimi di trattamento dei composti, come pre-incubazioni o washout.
La scalabilità della trasfezione transitoria potrebbe anche supportare approcci di screening su larga scala in cui la trasfezione batch dei substrati reporter viene eseguita prima dello screening. Inoltre, la durata del test dalla trasfezione alla lettura può anche essere variata. Sebbene la durata standard possa essere di 16-24 ore, alcuni saggi possono essere letti in appena 6 oree 7. Nel determinare la durata del test devono essere prese in considerazione anche le preoccupazioni relative alla tossicità di piccole molecole o siRNA che possono compromettere la vitalità cellulare.
In sintesi, i saggi delineati in questo studio e completamente descritti in una recente pubblicazione7 forniscono una valutazione rapida e robusta della competenza DSBR cellulare. Sono altamente sensibili e titolabili, il che li rende suscettibili di studi genetici e farmacologici. Fondamentalmente, poiché i substrati reporter possono essere introdotti nelle cellule mediante trasfezione transitoria, hanno il potenziale per essere utilizzati in qualsiasi modello di cellula trasfetabile di interesse, piuttosto che essere limitati a specifiche linee cellulari da un'integrazione stabile come nel caso dei reporter DSBR cromosomici. Tuttavia, una chiara limitazione di questi saggi extracromosomici reporter è che la mancanza di integrazione nel genoma potrebbe non ricapitolare completamente il contesto fisiologico e cromatinizzato della riparazione del DNA e i suoi segnali regolatori e orchestrazione associati15. A tal fine, i saggi reporter extracromosomici sono complementari ai metodi esistenti di valutazione DSBR e ampliano il kit di risorse adatte sia per la ricerca di base che per la scoperta di farmaci.
Disclosures
D.G., E.R., B.M., A.G., S.J.B., G.C.M.S e H.M.R.R. sono tutti dipendenti e azionisti di Artios Pharma Ltd. G.C.M.S. è un azionista di AstraZeneca PLC. S.J.B. è uno scienziato fondatore e azionista di Artios Pharma Ltd. È stato depositato un brevetto su alcuni dei reporter delineati in questo studio (WO 2021/001647). Promega è la fonte della tecnologia NanoLuc® e dei polinucleotidi NanoLuc® modificati. Artios Pharma è stata autorizzata da Promega a generare i polinucleotidi NanoLuc® modificati.
Acknowledgements
Tutto il lavoro è stato finanziato da Artios Pharma Ltd. Figure 1 e Figure 3 sono state create con Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 10x TBE buffer | Thermo Fisher | AM9863 | |
| 20% TBE-acrylamide gel | Invitrogen | EC6315BOX | |
| 50x TAE buffer | Fisher Scientific | BP13321 | |
| 6x Gel Loading Dye, Purple | NEB | B7024S | |
| 96-well white plate (with transparent bottom and lid) | Porvair | 204012 | |
| Agarose | Cleaver Scientific | CSL-AG500 | |
| AMPure XP beads | Beckman Coulter | A63881 | For bead-based purification of DNA |
| Antarctic phosphatase and 10X buffer | NEB | M0289L | |
| CLARIOstar | BMG Labtech | 430-101 | Plate reader |
| Countess II Automated Cell Counter | Thermo Fisher | AMQAX1000 | Cell counter |
| Custom oligonucleotides | Sigma-Aldrich | Custom order | For resection-independent MMEJ substrate. See Table 2. |
| D300e | Tecan | 30100152 | DMSO-based compound dispenser |
| D300e D4+ cassette | Tecan | 30097371 | High volume cassette for D300e compound dispenser |
| D300e T8+ cassette | Tecan | 30097370 | Low volume cassette for D300e compound dispenser |
| Dimethyl sulfoxide, cell culture grade | Sigma-Aldrich | D2650-100ML | Vehicle for compounds, used in Figure 4 and Figure 5 |
| DSBR reporter source plasmids | Artios | Available to the academic community upon request | |
| EcoRV-HF and 10x CutSmart buffer | NEB | R3195M | |
| Ethanol absolute | VWR | 20821.365 | |
| Foetal Bovine Serum | PAN-Biotech | P30-3031 | |
| GeneRuler Ultra Low Range DNA Ladder | Thermo Fisher | SM1211 | Low molecular weight DNA ladder |
| HEK-293 cells | ATCC | CRL-1573 | Example cell line used in protocol |
| HindIII-HF and 10x CutSmart buffer | NEB | R3104M | |
| HyClone Molecular Biology grade water | Fisher Scientific | 10275262 | |
| I-SceI and 10x Tango Buffer | Invitrogen | ER1771 | |
| Isopropanol | VWR | 20842.33 | |
| JetPRIME reagent and buffer | PolyPlus | 114-15 | Lipid-based transfection reagent |
| MegaStar 1.6 | VWR | 521-1749 | Centrifuge for 15 or 50 mL tubes |
| MEM Eagle | PAN-Biotech | P04-08056 | Culture medium for HEK-293 cells |
| Microplate shaker | Fisherbrand | 15504070 | Microplate orbital shaker |
| MicroStar 17R | VWR | 521-1647 | Centrifuge for 1.5 or 2 mL tubes |
| MultiDrop | Thermo Fisher | 5840300 | Cell or water-based reagent dispenser |
| MultiDrop Standard Cassette | Thermo Fisher | 24072670 | Cassette for MultiDrop reagent dispenser |
| NanoDLR Stop & Glo Buffer and Substrate | Promega | N1630 or N1650 | Reporter luciferase (NanoLuc) reagent to quench Firefly luminescence and detect NanoLuc luminescence. Part of the Nano-Glo Dual-Luciferase Reporter Assay System kit |
| ONE-Glo EX Luciferase Assay Buffer and Substrate | Promega | N1630 or N1650 | Control luciferase (Firefly) assay reagent to detect Firefly. Part of the Nano-Glo Dual-Luciferase Reporter Assay System kit |
| PBS (without calcium or magnesium) | PAN-Biotech | P04-36500 | |
| pGL4 Firefly plasmid (or similar) | Promega | E1310 (or equivalent) | Firefly control plasmid |
| pNL1.1 NanoLuc plasmid (or similar) | Promega | N1091 (or equivalent) | NanoLuc control plasmid, for adjustment of equipment settings/optimisation experiments |
| QIAquick Gel Extraction Kit | Qiagen | 28706 | |
| Quick-Load Purple 1 kb DNA Ladder | NEB | N0552S | High molecular weight DNA ladder |
| Sodium Acetate (3 M), pH 5.5 | Thermo Fisher | AM9740 | For pH adjustment during gel extraction with QIAquick Gel Extraction Kit |
| SYBR Gold (10,000x) | Invitrogen | S11494 | For visualisation of ssDNA and dsDNA |
| SYBR Safe (10,000x) | Invitrogen | S33102 | For visualisation of dsDNA only |
| T4 DNA Ligase and 10x Ligase buffer | NEB | M0202L | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 | For measurement of viability during cell counting |
| Trypsin-EDTA solution; 0.25% Trypsin and 0.53 mM EDTA | Sigma-Aldrich | T4049-100ML | |
| XhoI and 10x CutSmart buffer | NEB | R0146M |
References
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461 (7267), 1071-1078 (2009).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nat Rev Mol Cell Biol. 20 (11), 698-714 (2019).
- Ramsden, D. A., Carvajal-Garcia, J., Gupta, G. P. Mechanism, cellular functions and cancer roles of polymerase-theta-mediated DNA end joining. Nat Rev Mol Cell Biol. 23 (2), 125-140 (2022).
- Ceccaldi, R., et al. Homologous-recombination-deficient tumours are dependent on Polθ-mediated repair. Nature. 518 (7538), 258-262 (2015).
- van de Kooij, B., van Attikum, H. Genomic reporter constructs to monitor pathway-specific repair of DNA double-strand breaks. Front Genet. 12, 809832 (2021).
- Gunn, A., Stark, J. M. I-SceI-based assays to examine distinct repair outcomes of mammalian chromosomal double strand breaks. Methods Mol Biol. 920 (9), 379-391 (2012).
- Rajendra, E., et al. titratable and high-throughput reporter assays to measure DNA double strand break repair activity in cells. Nucleic Acids Res. 52 (4), 1736-1752 (2024).
- Hall, M. P., et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem. Biol. 7 (11), 1848-1857 (2012).
- Wyatt, D. W., et al. Essential roles for polymerase θ-mediated end joining in the repair of chromosome breaks. Mol Cell. 63 (4), 662-673 (2016).
- Wood, R. D., Doublié, S. Genome protection by DNA polymerase θ. Annu Rev Genet. 56, 207-228 (2022).
- Belan, O., et al. POLQ seals post-replicative ssDNA gaps to maintain genome stability in BRCA-deficient cancer cells. Mol Cell. 82 (24), 4664-4680 (2022).
- Zatreanu, D., et al. Polθ inhibitors elicit BRCA-gene synthetic lethality and target PARP inhibitor resistance. Nat Commun. 12 (1), 3636 (2021).
- Stockley, M. L., et al. Discovery, characterization, and structure-based optimization of small-molecule in vitro and in vivo probes for human DNA polymerase theta. J Med Chem. 65 (20), 13879-13891 (2022).
- Scott, D. E., et al. A small-molecule inhibitor of the BRCA2-RAD51 interaction modulates RAD51 assembly and potentiates DNA damage-induced cell death. Cell Chem Biol. 28 (6), 835-847 (2021).
- Schep, R., et al. Impact of chromatin context on Cas9-induced DNA double-strand break repair pathway balance. Mol Cell. 81 (10), 2216-2230 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved