Оценка активности репарации двухцепочечного разрыва ДНК с использованием высокопроизводительных и количественных репортерных анализов на основе люминесценции
In This Article
Summary
Мы представляем протоколы для оценки эффективности пути репарации двухцепочечного разрыва в клетках с использованием набора экстрахромосомных репортерных субстратов на основе люминесценции.
Abstract
Репарация двухцепочечных разрывов ДНК (DSB) имеет решающее значение для поддержания стабильности генома и жизнеспособности клеток. Репарация DSB (DSBR) в клетках опосредована несколькими механизмами: гомологичной рекомбинацией (HR), негомологичным соединением концов (NHEJ), микрогомологически опосредованным соединением концов (MMEJ) и одноцепочечным отжигом (SSA). Клеточные анализы необходимы для измерения эффективности и модуляции этих путей в ответ на различные стимулы.
Здесь мы представляем набор внехромосомных репортерных анализов, каждый из которых измеряет восстановление репортерного гена нанолюциферазы одним из четырех основных путей DSBR в клетках. После транзиторной трансфекции в клетки, представляющие интерес, репарация чувствительных к путям репортерных субстратов может быть измерена менее чем за 24 ч путем детектирования люминесценции нанолюциферазы (NanoLuc).
Эти надежные анализы являются количественными, чувствительными, титруемыми и поддаются высокопроизводительному формату скрининга. Эти свойства обеспечивают широкое применение в исследованиях репарации ДНК и открытии лекарств, дополняя доступный в настоящее время набор инструментов клеточного анализа DSBR.
Introduction
Двухцепочечные разрывы ДНК (DSB) представляют собой особенно токсичный класс повреждений ДНК1, из-за которых клетки развили множественные пути репарации DSB (DSBR) для восстановления этих повреждений. Четырьмя основными механизмами DSBR являются гомологичная рекомбинация (HR), негомологичное соединение концов (NHEJ), микрогомологически опосредованное соединение концов (MMEJ) и одноцепочечный отжиг (SSA)2,3. Пути DSBR способствуют поддержанию здорового развития тканей и физиологии и защищают от таких заболеваний, как рак. Кроме того, эти механизмы репарации обладают терапевтическим потенциалом для разработки низкомолекулярных модуляторов в прецизионной онкологии. Например, нацеливание на ДНК-полимеразу θ (Polθ), ключевой фермент в пути репарации MMEJ, привлекло интерес из-за ее синтетической летальности при дефиците HR при раке4.
Таким образом, понимание DSBR имеет широкое клиническое применение, и необходимы функциональные клеточные анализы, способные измерять активность всех основных путей DSBR5. Анализы должны быть пригодны как для генетических, так и для фармакологических исследований и использоваться на представляющих интерес клеточных моделях. Чтобы поддержать усилия по разработке низкомолекулярных лекарств, анализы должны быть высокочувствительными, титруемыми, иметь быстрый оборот и быть масштабируемыми до высокопроизводительных форматов, подходящих для скрининга соединений.
В целом, DSBR ранее измерялся с использованием репортерных аналитических систем на основе флуоресценции, стабильно интегрированных вгеном клетки6. Тем не менее, в то время как физиологическая рекапитуляция хромосомного DSBR является явным преимуществом, такие анализы ограничены моделью хозяина, в которую интегрирован репортер, используют трудоемкую подготовку образцов и анализ с помощью проточной цитометрии, а также имеют ограниченную пропускную способность, время выполнения, надежность и чувствительность — все это важные характеристики, необходимые для разработки лекарств.
Здесь мы описываем набор репортерных анализов DSBR, которые позволяют оценить четыре основных пути DSBR. Набор субстратов для репортерного анализа представлен на рисунке 1 и более подробно описан в недавней публикации7. Они являются внехромосомными, что позволяет им внедряться в клетки путем простой транзиторной трансфекции, а включение репортерного гена8 нанолюциферазы, который должен быть восстановлен путем взаимодействия со специфическими механизмами DSBR, порождает чувствительность, надежность и масштабируемость. В протокол включены следующие варианты субстрата репортера DSBR (рисунок 1):
Резекционно-независимый MMEJ: Этот линейный субстрат состоит из основного участка двухцепочечной ДНК (дцДНК) с выступами одноцепочечной ДНК (одноцепочечной ДНК), которые имитируют резецированные концы ДНК9. Четыре нуклеотидные микрогомологии на концах областей одноцепочечной ДНК кодируют стартовый кодон для репортерного гена. Репарация этого субстрата с помощью MMEJ восстанавливает открытую рамку считывания репортерного гена (ORF).
Резекционно-зависимый MMEJ: N-концевой экзон репортерного гена прерывается сегментом, содержащим стоп-кодон, который фланкирован 8 микрогомологиями пар оснований (.о.). Нуклеолитическая резекция конца требуется перед MMEJ-опосредованной репарацией для восстановления интактного репортерного гена.
Блант Нхей: Репортерный ген расщепляется на N- и C-концевые участки, последний из которых размещается выше промотора. DSB производится с использованием EcoRV и требует прямого лигирования (без обработки конца) NHEJ для повторного соединения обеих частей репортерного гена и восстановления репортерного ORF.
Нетупой NHEJ: DSB расположен внутри интрона и будет иметь связующие или несвязные концы в зависимости от выбора фермента рестрикции. Ремонт этого субстрата NHEJ требует лигирования, которому предшествует конечная обработка.
Длинный шаблон HR: N-концевой экзон репортерного гена прерывается сегментом ДНК, содержащим сайты рестрикции, которые заменяют 22.о. исходной последовательности репортерного гена. Для восстановления этой последовательности при репарации с помощью HR используется гомологический шаблон размером 2,5 килооснования (кб), помещенный ниже по потоку от С-концевого экзона.
Короткий шаблон HR: Сайт рестрикции, необходимый для генерации DSB, заменяет часть нативной последовательности репортерного гена и вводит стоп-кодон в кадре. Как и версия с длинным шаблоном, эта HR-подложка требует нисходящего шаблона гомологии (360.н.) для точного ремонта и восстановления ORF репортера.
SSA: Этот субстрат содержит преждевременный стоп-кодон, расположенный в N-концевом экзоне репортерного гена. Удаление этого стоп-кодона и восстановление интактной последовательности репортерного гена требует репарации с помощью SSA, которая включает в себя двунаправленную дальнюю резекцию перед выравниванием гомологий.
Для получения DSB некоторые из репортерных субстратов могут быть расщеплены с помощью I-SceI (рис. 1). Это позволит получить линейную подложку с несвязными концами в резекционно-зависимых MMEJ, нетупых NHEJ, длинных шаблонах HR и SSA, которые имеют тандемные сайты I-SceI в инвертированных ориентациях. В коротком шаблоне подложки HR-репортера усвоение одного сайта I-SceI приведет к созданию связных концов. Нетупые NHEJ, резекционно-зависимые MMEJ, длинные матрицы HR и SSA плазмиды также могут быть расщеплены с помощью HindIII, что приведет к получению комплементарных когезивных концов.
Мы предоставляем протоколы для создания субстратов репортерного анализа и описываем, как эти анализы могут быть выполнены, предоставляя подробную информацию о том, как они могут быть использованы для количественной оценки DSBR, включая титруемые ответы на малые молекулы, оценку клеточной активности, целевой активности и селективности путей.
Protocol
1. Подготовка и контроль качества (КК) репортерных подложек
Примечание: Плазмиды, кодирующие репортерные субстраты, могут размножаться в стандартных штаммах Escherichia coli (например, DH5α и производные) и восстанавливаться путем выделения плазмид. Детали плазмид (размер и устойчивость к антибиотикам) описаны в таблице 1 и на рисунке 1.
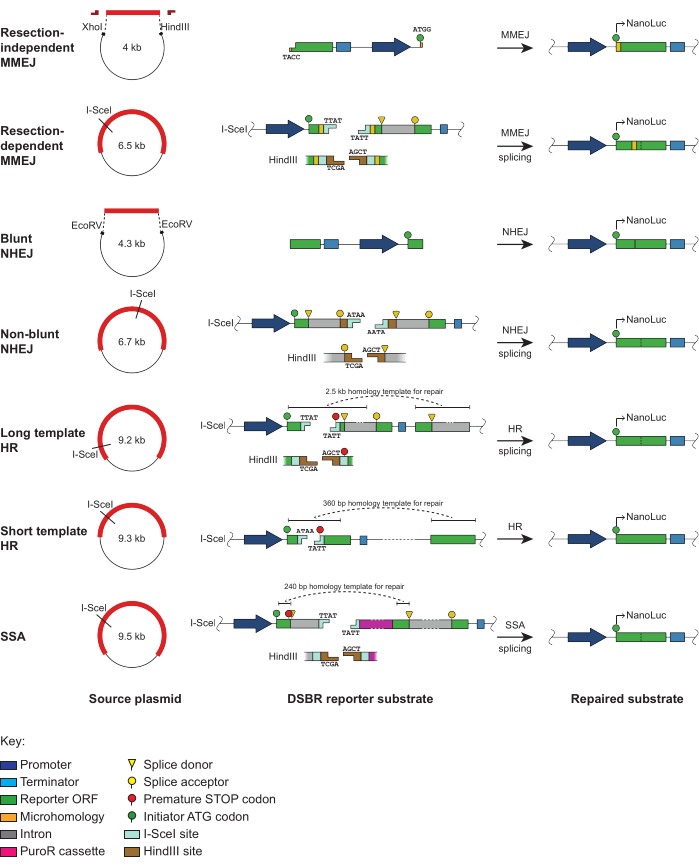
Рисунок 1: Схемы внехромосомных репортерных анализов DSBR на основе NanoLuc. Схематическое изображение подложек репортеров DSBR, включая их расположение в каждой исходной плазмиде, особенности главной последовательности и окончательную компоновку после репарации, специфичной для конкретного пути. Независимое от резекции ядро субстрата MMEJ вырезают из исходной плазмиды путем разложения с помощью XhoI/HindIII, после чего колпачки должны быть перевязаны с обоих концов для получения субстрата для MMEJ. Тупой репортерный субстрат NHEJ создается путем эксцизии из исходной плазмиды с помощью EcoRV. Резекционно-зависимые MMEJ, нетупые NHEJ, длинные матричные HR и репортерные субстраты SSA генерируются путем линеаризации исходных плазмид с использованием либо I-SceI (который дает некогезивные концы), либо HindIII (который создает когезивные концы). Короткий шаблон подложки HR reporter генерируется путем линеаризации исходной плазмиды с помощью I-SceI (который создает связующие концы). Репарация каждого репортерного субстрата по целевому пути DSBR восстанавливает интактную нанолюциферазу ORF, кодирующую функционал NanoLuc. Эта цифра была адаптирована из Rajendra et al.7. Сокращения: DSBR = ремонт двухцепочечного разрыва; NanoLuc = нанолюцифераза; MMEJ = микрогомологически опосредованное соединение концов; NHEJ = негомологичное соединение концов; HR = гомологичная рекомбинация; SSA = одноцепочечный отжиг; ORF = открытая рамка для чтения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Получение резекционно-независимого репортерного субстрата MMEJ (Рисунок 1 и Рисунок 2А-С)
- Получение капсул ssDNA/dsDNA (Рисунок 2A)
- Ресуспендируйте четыре олигонуклеотида, перечисленные в таблице 2 , по отдельности в буфере для отжига (20 мМ Tris pH 7,5, 50 мМ NaCl в воде молекулярно-биологического качества) для получения исходного раствора при 100 мкМ.
- Отжиг колпачков ss/dsDNA
- Смешайте по 50 мкл длинного и короткого олигонуклеотидов (100 мкМ стокового раствора) для левого колпачка из шага 1.1.1.1 в пробирке объемом 0,2 мл.
- Повторите то же самое для олигонуклеотидов правой крышки.
- Используя термоамплификатор, инкубируйте каждую смесь олигонуклеотидов при 99 °C в течение 5 минут, затем уменьшите температуру до 10 °C при 1 °C/мин.
ПРИМЕЧАНИЕ: При этом получаются отожженные левая и правая крышки.
- (Контроль качества, по желанию) Верификация олигонуклеотидного отжига методом электрофореза
- Электрофорез 100 нг каждого продукта из стадии 1.1.1.2 вместе с отдельными олигонуклеотидами из стадии 1.1.1.1 и лестницей низкомолекулярной ДНК в 20% геле акриламид-трис-борат-ЭДТА (КЭ) при 200 В в течение 80 мин.
- Окрашивайте гель проточным буфером TBE, содержащим соответствующий флуоресцентный краситель ДНК для визуализации как одноцепотной, так и дцДНК в течение не менее 10-15 минут.
- Визуализируйте флуоресценцию в системе документирования геля (рис. 2A).
ПРИМЕЧАНИЕ: Шаги с 1.1.1.3.1 по 1.1.1.3.3 используются для проверки правильности отжига крышек. Видимые размеры для левой и правой крышки должны составлять ~120.о. и ~175.о. соответственно.
- Очистка ядра репортерной подложки (рис. 2B)
- Смешайте 100 μг плазмиды ядра репортера с 4 μЛ HindIII и 4 μЛ XhoI (4 Ед/μг плазмиды для каждого фермента) и 20 μЛ 10-кратного буфера. Доведите общий объем до 200 мкл с помощью дважды дистиллированной воды (ddH2O) и инкубируйте при 37 °C в течение 2 часов до ночи для переваривания плазмиды.
ПРИМЕЧАНИЕ: Для разложения больших или меньших количеств масштабируйте реакцию пропорционально. - Инкубируйте реакцию пищеварения при 80 °C в течение 20 мин для нагревания инактивирующих рестрикционных ферментов.
- Добавьте 40 мкл щелочной фосфатазы (2 ЕД/мкг плазмида) и 27 мкл 10-кратного буфера в реакционную смесь на стадии 1.1.2.2. Инкубировать при 37 °C в течение 2 ч для дефосфорилирования плазмиды.
ПРИМЕЧАНИЕ: При необходимости увеличивайте или уменьшайте масштаб реакции. - Добавьте 60 мкл 6-кратного загрузочного красителя в реакцию, начиная с шага 1.1.2.3. Электрофорез вместе с высокомолекулярной лестницей ДНК в геле с молекулярной массой 1,5 % (w/v) агароз-трис-ацетат-ЭДТА (TAE), содержащем флуоресцентный краситель дцДНК при напряжении 120 В в течение 2,5 ч или до достаточного рассасывания полос.
- Визуализируйте флуоресценцию на системе документирования геля (рис. 2B).
- Вырежьте фрагмент ядра репортера (~1,5 кб) из геля с помощью чистого скальпеля, стараясь не загрязнить основу вектора (~2,5 кб).
- Извлеките фрагмент ядра репортера с помощью набора для экстракции гелем, следуя инструкциям производителя.
- Измерьте концентрацию и качество ДНК (A260/280) с помощью спектрофотометрии.
- Смешайте 100 μг плазмиды ядра репортера с 4 μЛ HindIII и 4 μЛ XhoI (4 Ед/μг плазмиды для каждого фермента) и 20 μЛ 10-кратного буфера. Доведите общий объем до 200 мкл с помощью дважды дистиллированной воды (ddH2O) и инкубируйте при 37 °C в течение 2 часов до ночи для переваривания плазмиды.
- Лигирование ядра репортерного субстрата колпачками ssDNA/dsDNA и очистка конечного субстрата репортера (рис. 2C)
- Смешайте 30 μг фрагмента ядра репортера, полученного на шаге 1.1.2.7, с 3,85 μL каждого отожженного левого и правого колпачка, полученного на шаге 1.1.2 (приблизительно 6:1 молярное соотношение ДНК кап:ядро), 30 μL 10-кратного лигазного буфера и 1,5 μЛ Т4-ДНК-лигазы (20 Ед/μг ДНК). Довести общий объем реакции до 300 мкл с помощьюddH2O и инкубировать в течение ночи при 16 °С для литирования колпачков до фрагмента ядра репортера.
ПРИМЕЧАНИЕ: При необходимости увеличивайте или уменьшайте масштаб реакции. - (Контроль качества, по желанию) Электрофорез 200 нг полученного продукта на стадии 1.1.3.1 вместе с ядром репортерного субстрата и высокомолекулярной лестницей ДНК в 0,7% (масс./об.) агарозного геля TAE, содержащего флуоресцентное окрашивание дцДНК при 120 В в течение не менее 1,5 ч. Убедитесь, что полоса, соответствующая лигированному продукту, мигрирует немного медленнее, чем ядро нелигированного репортерного субстрата (рисунок 2C).
ПРИМЕЧАНИЕ: Этот шаг контроля качества предназначен для проверки правильности лигирования колпачков к фрагменту ядра репортера. - Очистите ДНК от реакции пищеварения на шаге 1.3.1. используя предпочтительный метод (например, метод на основе валиков или метод на основе столбцов), следуя инструкциям производителя.
ПРИМЕЧАНИЕ: Ступень очистки 1.1.3.3 существенно снижает присутствие нелигированных колпачков.
- Смешайте 30 μг фрагмента ядра репортера, полученного на шаге 1.1.2.7, с 3,85 μL каждого отожженного левого и правого колпачка, полученного на шаге 1.1.2 (приблизительно 6:1 молярное соотношение ДНК кап:ядро), 30 μL 10-кратного лигазного буфера и 1,5 μЛ Т4-ДНК-лигазы (20 Ед/μг ДНК). Довести общий объем реакции до 300 мкл с помощьюddH2O и инкубировать в течение ночи при 16 °С для литирования колпачков до фрагмента ядра репортера.
- Измерьте концентрацию и качество ДНК (A260/280) с помощью спектрофотометрии.
- Получение капсул ssDNA/dsDNA (Рисунок 2A)
- Приготовление тупой репортерной подложки NHEJ (Рисунок 1 и Рисунок 2D,E)
- Смешайте 100 μг плазмиды ядра репортера с 5 μL EcoRV (5 Ед/μг плазмида) и 20 μL 10-кратного буфера. Доведите общий объем до 200 мкл с ddH2O и инкубируйте при 37 °C в течение 2 ч до ночи для переваривания плазмиды.
ПРИМЕЧАНИЕ: Для разложения больших или меньших количеств масштабируйте реакцию пропорционально. - Инкубируйте реакцию пищеварения при 65 °C в течение 20 минут, чтобы нагреть инактивированный фермент рестрикции.
- Добавьте 50 мкл 6-кратного загрузочного красителя в реакцию, начиная с шага 1.2.2. Электрофорез вместе с высокомолекулярной лестницей ДНК в 1,5% (масс./об.) агарозном геле TAE, содержащем флуоресцентный краситель дцДНК при напряжении 120 В в течение 2 ч или до тех пор, пока полосы не будут достаточно растворены.
- Визуализируйте флуоресценцию на системе документирования геля (Рисунок 2D).
- Вырежьте репортерный субстрат (~1,7 кб) из геля с помощью чистого скальпеля, стараясь не загрязнить основу вектора (~2,6 кб).
- Извлеките фрагмент ядра репортера с помощью набора для экстракции гелем, следуя инструкциям производителя (рис. 2E).
- Измерьте концентрацию и качество ДНК (A260/280) с помощью спектрофотометрии.
- Смешайте 100 μг плазмиды ядра репортера с 5 μL EcoRV (5 Ед/μг плазмида) и 20 μL 10-кратного буфера. Доведите общий объем до 200 мкл с ddH2O и инкубируйте при 37 °C в течение 2 ч до ночи для переваривания плазмиды.
- Приготовление репортерных подложек на основе I-SceI (Рисунок 1)
ПРИМЕЧАНИЕ: Эти субстраты включают резекционно-зависимый MMEJ (рисунок 2F), нетупой NHEJ (рисунок 2G), длинный шаблон HR (рисунок 2H), короткий шаблон HR (рисунок 2I) и SSA (рисунок 2J).- Смешайте 100 μг плазмиды репортерного ядра с 50 μL I-SceI (5 Ед/μг плазмида) и 60 μL 10-кратного буфера. Доведите общий объем до 600 мкл с помощью ddH2O и инкубируйте при 37 °C в течение 2 ч до ночи для переваривания плазмиды.
ПРИМЕЧАНИЕ: Для разложения больших или меньших количеств масштабируйте реакцию пропорционально. Нетупые NHEJ, резекционно-зависимые MMEJ, длинные матрицы HR и SSA плазмиды также могут быть расщеплены с помощью HindIII, что приведет к созданию комплементарных когезивных концов. - Инкубируйте реакцию пищеварения при 65 °C в течение 20 минут, чтобы нагреть инактивацию I-SceI. Установите температуру на 80 °C во время этого этапа, если вместо этого для разложения использовался HindIII.
- Очистите ДНК от инактивированной реакции расщепления на шаге 1.3.2 с использованием предпочтительного метода (например, метода на основе гранул или колонок), следуя инструкциям производителя.
- Измерьте концентрацию и чистоту ДНК (A260/280) с помощью спектрофотометрии.
- Смешайте 100 μг плазмиды репортерного ядра с 50 μL I-SceI (5 Ед/μг плазмида) и 60 μL 10-кратного буфера. Доведите общий объем до 600 мкл с помощью ddH2O и инкубируйте при 37 °C в течение 2 ч до ночи для переваривания плазмиды.
- Контроль качества репортерных материалов
- Электрофорез 200 нг репортерного субстрата вместе с высокомолекулярной лестницей ДНК в 0,7% (масс./об.) агарозного геля TAE, содержащего флуоресцентный краситель dsDNA, при 120 В в течение 2 ч или до тех пор, пока полосы не будут достаточно растворены. Загрузите оригинальную неразрезанную репортерную плазмиду в качестве элемента управления.
- Убедитесь, что для каждой подложки репортера соблюдены определенные полосы правильного размера (см. Таблицу 1 и Рисунок 2F-J).
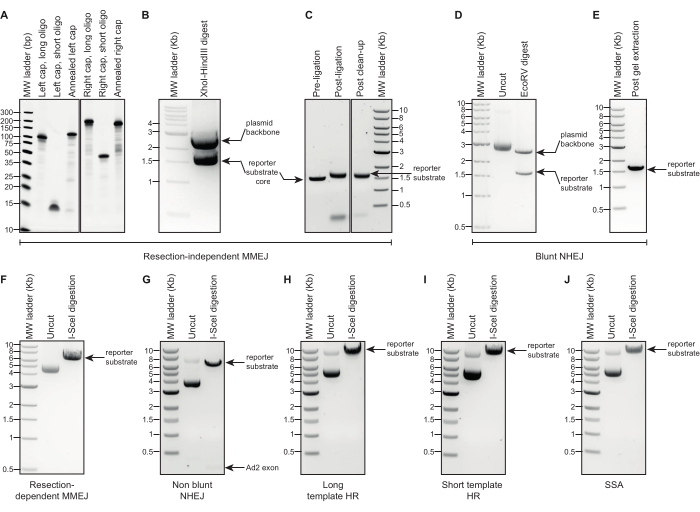
Иллюстрация 2: Гель-электрофоретический анализ генерации подложки репортера DSBR. (А-С) Репрезентативные изображения гелевых электрофоретических анализов промежуточных продуктов и окончательной конструкции, необходимой для создания независимой от резекции репортерной подложки MMEJ. Соседние изображения на панелях (А) и (С) сделаны из тех же гелей; Нерелевантные полосы были опущены. (Д,Э) Репрезентативные изображения гель-электрофоретического анализа на исходную плазмиду, продукты, расщепленные EcoRV, и конечную конструкцию, экстрагированную гелем, необходимые для создания тупой репортерной подложки NHEJ. (Ф-Дж) Репрезентативные изображения гелевых электрофоретических анализов исходных плазмид и линеаризованных конструкций DSBR для субстратов I-SceI-интерпретированных репортеров: резекционно-зависимый MMEJ, нетупой NHEJ, длинный шаблон HR, короткий шаблон HR, SSA. Сокращения: DSBR = ремонт двухцепочечного разрыва; MMEJ = микрогомологически опосредованное соединение концов; NHEJ = негомологичное соединение концов; HR = гомологичная рекомбинация; SSA = одноцепочечный отжиг. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Переходная трансфекция репортерных субстратов DSBR
ПРИМЕЧАНИЕ: Обзор экспериментального процесса анализов и некоторые потенциальные перестановки представлены на рисунке 3. В приведенном ниже протоколе описан эксперимент с использованием клеток HEK-293, в котором они подвергаются обратной трансфекции репортерным субстратом. Приведенные ниже цифры могут быть увеличены или уменьшены в зависимости от количества скважин, используемых на одной пластине. Следующие шаги рассчитаны для анализа, выполненного в одном 96-луночном планшете; дополнительные соображения см. в разделе Обсуждение.
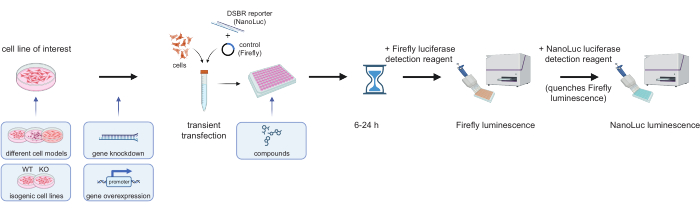
Рисунок 3: Экспериментальный рабочий процесс для репортерных анализов DSBR. Представляющие интерес клетки трансфицируют линеаризовавшимся субстратом DSBR (кодирующим NanoLuc ORF, который необходимо репарировать с помощью определенного события репарации ДНК) и плазмидой Firefly (контроль трансфекции). Затем, через 6-24 ч после трансфекции, люминесценция Firefly и люминесценция NanoLuc могут быть последовательно считаны после добавления реагентов Nano-Glo Dual-Luciferase. Примеры перестановок основных этапов (показаны в светло-голубых рамках) могут быть использованы для проверки того, как генетическая модуляция (нокаут, нокдаун или сверхэкспрессия) или фармакологическое лечение влияют на владение DSBR-путями в клетках. Сокращения: DSBR = ремонт двухцепочечного разрыва; NanoLuc = нанолюцифераза; WT = дикий тип; KO = нокаут. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- (Дополнительный) При оценке влияния соединений на репортерный анализ дозируйте растворенные в носителе соединения (например, диметилсульфоксид [ДМСО]) в лунки 96-луночной пластины в соответствии с заранее определенной экспериментальной схемой. Нормализация концентрации транспортных средств на всех скважинах.
ПРИМЕЧАНИЕ: Рекомендуется использовать технические реплики. Включите контрольные колодцы (например, предназначенные только для транспортных средств). - В пробирке объемом 1,5 мл разбавляют контрольную плазмиду Firefly (контрольную люциферазу) и репортерный субстрат NanoLuc DSBR (репортерную люциферазу), полученные на этапах 1.1, 1.2 или 1.3, в 500 мкл трансфекционного буфера. Используйте 0,66 мкг контрольной люциферазной плазмиды на 1 × 106 клеток. В таблице 3 приведено количество используемой репортерной подложки NanoLuc DSBR.
Положительная контрольная плазмида, которая конститутивно экспрессирует репортерную люциферазу, может быть использована для валидации условий настройки и трансфекции прибора или для проверки неспецифических эффектов на саму репортерную люциферазу. В качестве отправной точки мы рекомендуем 0,1 мкг репортерной люциферазной плазмиды и 0,66 мкг контрольной люциферазной плазмиды на 1 × 106 клеток. - Добавьте в разбавленную ДНК реагент на основе липидов с этапа 2.2 в соотношении, рекомендованном производителем (например, 1:2, мкг ДНК:мкл реагента для реагента, описанного в Таблице материалов), хорошо перемешайте путем кратковременного вортексирования и инкубируйте в течение 10 мин при комнатной температуре.
- Соберите клетки путем трипсинизации, ресуспендируйте их в свежей среде, содержащей 10% фетальной бычьей сыворотки (FBS), и подсчитайте их.
- Перенесите 3 × 106 клеток в пробирку объемом 15 мл и ресуспендируйте в 8,5 мл среды.
- Добавьте смесь для трансфекции ДНК с шага 2.3 в клеточную суспензию и перемешайте несколько раз методом инверсии.
- В тарелку вносят 80 мкл клеточной суспензии (примерно 2,7 × 104 клеток) на лунку.
ПРИМЕЧАНИЕ: Суспензия, содержащая клетки, и смесь для трансфекции ДНК могут быть нанесены на планшет либо путем ручного пипетирования, либо с помощью автоматического обработчика жидкостей для экспериментов с более высокой производительностью. - Инкубировать при 37 °C/5%CO2 в течение 24 часов.
3. Обнаружение люминесценции
- Приготовление реагентов
- Следуйте инструкциям производителя по приготовлению и добавлению репортеров (NanoLuc) и контрольных (Firefly) люциферазных реагентов, которые обеспечивают субстраты для обеих люциферазы (Furimazine и 5'-Fluoroluciferin, соответственно):
- Приготовьте реактив для контроля люциферазы. Восстановите в соответствии с инструкциями производителя и перемешайте методом инверсии до полного растворения люциферазного субстрата.
- Приготовьте свежий реактив люциферазы в соответствии с инструкцией производителя. Рассчитайте количество реагента, необходимое для добавления 80 л/лунку и добавьте субстрат в соответствующий объем буфера для анализа в соотношении 1:100 (люциферазный субстрат:буфер). Для одного 96-луночного планшета разведите 88 мкл люциферазного субстрата в 8 800 мкл буфера и перемешайте путем инверсии.
ПРИМЕЧАНИЕ: Эти количества включают примерно 10% превышения. После восстановления контрольный реагент люциферазы можно хранить в соответствии с инструкциями производителя для дальнейшего использования. Реактив люциферазы должен быть приготовлен в свежем виде для каждого использования.
- Последовательное детектирование люминесценции по контрольным и репортерным люциферазам (96-луночный планшет)
- Дайте планшету и реактивам люциферазы нагреться до комнатной температуры.
- Добавьте 80 мкл контрольного реагента люциферазы на лунку.
- Встряхните пластину в течение 3 минут на орбитальном вибростенде со скоростью 450 об/мин.
- Измерьте сигнал люминесценции контрольной люциферазы с помощью считывателя люминесцентных пластин.
ПРИМЕЧАНИЕ: Считывание излучения при длине волны 580 нм (полосовой фильтр 80 нм) или общая люминесценция на лунку. Эта люминесценция используется в качестве меры эффективности трансфекции и плотности клеток, а также может информировать о клеточной токсичности, вызванной тестовыми обработками. - Добавьте 80 мкл реагента репортерной люциферазы на лунку.
ПРИМЕЧАНИЕ: Этот реагент будет ингибировать контрольную люциферазу; Он также содержит субстрат для репортера люциферазу. - Встряхните пластину в течение 3 минут на орбитальном вибростенде со скоростью 450 об/мин.
- Оставьте тарелку отдыхать на 7 минут при комнатной температуре.
- Измерьте сигнал люминесценции репортера люциферазой с помощью считывателя люминесцентной пластины.
ПРИМЕЧАНИЕ: Считывание излучения при длине волны 470 нм (полосовой фильтр 80 нм) или, в качестве альтернативы, общая люминесценция на лунку. Эта люминесценция дает информацию о количестве репортерной подложки, которая была восстановлена интересующим путем DSBR. - Экспорт показаний люминесценции для последующего анализа.
4. Анализ данных
- Для расчета сигнала анализа разделите сигнал люминесценции репортерной люциферазы (NanoLuc) на сигнал люминесценции контрольной люциферазы (Firefly), исходящий из той же лунки. Примените этот расчет ко всем скважинам, как показано в уравнении (1).
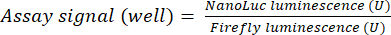 (1)
(1) - Рассчитайте среднее значение сигналов анализа для контрольных скважин (например, только для транспортных средств).
- Нормализуйте сигналы анализа для тестовых скважин до среднего значения контрольной скважины с помощью уравнения (2) для расчета ремонта (%) на скважину.
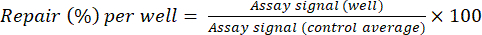 (2)
(2) - (Опционально, подгонка кривой) При тестировании нескольких доз соединения постройте график расчетной репарации (%) в зависимости от концентрации соединения и подгоньте кривую «доза-реакция» с использованием нелинейной регрессионной модели. Используйте эту кривую для последующей интерполяции EC50 .
Representative Results
Восстановление каждого из репортерных анализов может быть обнаружено и количественно определено с помощью одной и той же процедуры. Правильная репарация субстрата с помощью родственного ему пути репарации в клетках восстановит неповрежденный, функциональный ORF, кодирующий NanoLuc. Этот сигнал люминесценции может быть обнаружен с помощью считывателя пластин.
Ко-трансфекция с интактной плазмидой, кодирующей люциферазу светлячка, служит контролем трансфекции. Этот контроль служит двум целям. Во-первых, он обеспечивает стандарт для нормализации сигнала NanoLuc, поскольку он должен быть невозмущен модуляцией DSBR генетическими или фармакологическими средствами. Во-вторых, он может указывать на нецелевые клеточные возмущения, которые влияют на сигнал люциферазы, такие как модуляция клеточного цикла, влияние на транскрипцию/трансляцию или общая токсичность.
Отношение NanoLuc к Firefly служит суррогатным считыванием ремонта. Значения люминесценции могут быть экспортированы и проанализированы путем нормализации двух сигналов люциферазы из одной лунки. В случае исследований генетических возмущений (например, сравнение дикого типа и KO или нецелевых и целевых минографических миРНК) репарация обычно нормализуется по отношению к родительскому образцу (клеткам дикого типа или клеткам, обработанным нецелевыми контрольными миРНК). В случае фармакологической модуляции значения из образца, обработанного соединением, нормализуются до значения, полученного при обработке носителем.
Недавно была опубликована полная валидация описанного набора репортеров7. Данные, иллюстрирующие характеристику генетической и фармакологической модуляции DSBR, показаны на рисунке 4 (адаптировано из 7). Polθ является ключевым медиатором MMEJ, и прогнозируется, что потеря или ингибирование этого фермента приведет к специфической абляции клеточного MMEJ 3,10. Используя клеточную линию, в которой POLQ, ген, кодирующий Polθ, был нокаутирован11, независимый от резекции репортерный анализ MMEJ показывает, что MMEJ действительно почти полностью подавлен. Оценка компонентных сигналов люминесценции NanoLuc и Firefly показывает, что наблюдаемый дефект репарации обусловлен снижением сигнала NanoLuc (закодированного репортерной подложкой), в то время как сигнал Firefly (контроль) является невозмущенным (рис. 4A-C). В отличие от этого, оценка уровня владения NHEJ с использованием репортера NHEJ с тупым концом показывает, что нокаут POLQ не препятствует восстановлению субстрата репортера (рис. 4D-F). В совокупности эти генетические данные подтверждают специфическую роль Polθ в MMEJ-опосредованной репарации. Эти наблюдения полностью фармакологически повторяются с ART55812,13, недавно описанным высокомощным и специфичным ингибитором полимеразного домена Polθ (рисунок 4G), где наблюдается титруемое ингибирование MMEJ, которое происходит от специфического снижения NanoLuc, а не сигнала Firefly (рисунок 4H). Кроме того, в соответствии с генетическими данными, нет никакого влияния на NHEJ (рис. 4I, J). Вместе эти данные показывают, как эти репортеры могут быть использованы для характеристики генетической модуляции путей DSBR и демонстрации клеточной активности и специфичности малых молекул в отношении мишени/пути.
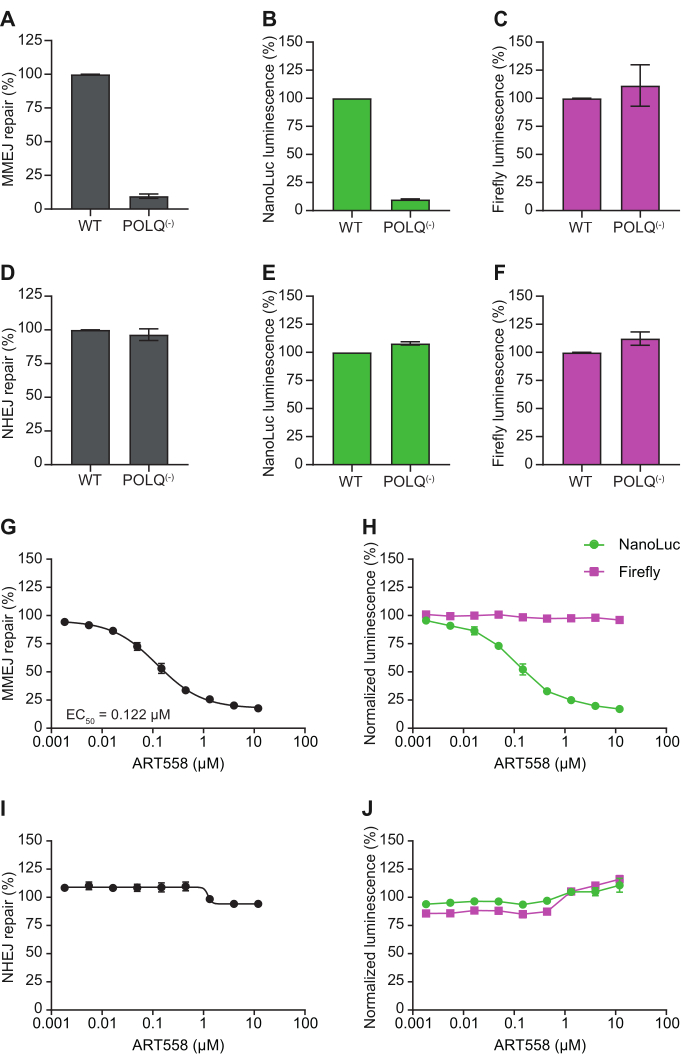
Рисунок 4: Влияние генетического нокаута и фармакологического ингибирования Polθ на репортерные сигналы MMEJ и NHEJ. Клетки eHAP1 WT и POLQ(-) трансфицировали контрольной плазмидой Firefly и независимым от резекции репортером MMEJ (A-C) или репортером NHEJ с тупым концом (D-F). Процент репарации MMEJ или NHEJ представляет собой отношение люминесценции NanoLuc к люминесценции Firefly, нормализованное к контролю, обработанному DMSO, через 24 ч после трансфекции. Данные представляют собой среднее значение ± SEM трех биологических репликатов, каждая из которых содержит в среднем 8 технических реплик. Клетки HEK-293 трансфицировали контрольной плазмидой Firefly и (G,H) независимым от резекции репортером MMEJ или репортером NHEJ с тупым концом (I,J) и обрабатывали ингибитором полимеразы Polθ ART558. Процент репарации представляет собой отношение люминесценции NanoLuc к люминесценции Firefly, нормализованное к контролю, обработанному ДМСО, через 24 ч после трансфекции. Процентное ингибирование отдельных сигналов люминесценции в пунктах (G) и (I) было рассчитано относительно контроля, обработанного ДМСО, и показано соответственно в (H) и (J). Данные представляют собой среднее значение ± SEM 2 биологических репликатов, каждая из которых имеет в среднем 4 технические репликации. Эта цифра была адаптирована из Rajendra et al.7. Сокращения: NanoLuc = нанолюцифераза; MMEJ = микрогомологически опосредованное соединение концов; NHEJ = негомологичное соединение концов; WT = дикий тип. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
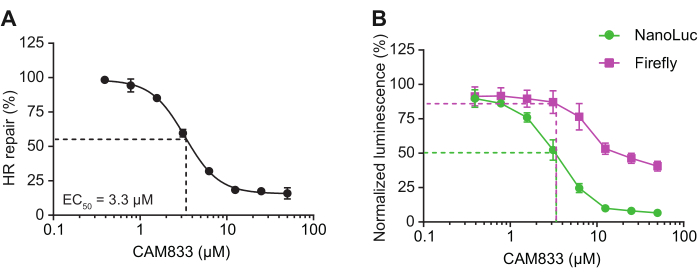
Рисунок 5: Ингибирование сигнала репортера HR ингибитором RAD51 CAM833. (A) Клетки HEK-293 трансфицировали субстратом длинного шаблона репортера HR, контрольной плазмидой люциферазы Firefly и обрабатывали ингибитором RAD51 CAM83314. Люминесценцию NanoLuc и Firefly считывали через 16 ч после трансфекции. Процент репарации HR представляет собой отношение люминесценции NanoLuc к люминесценции Firefly, нормализованное к контролю, обработанному ДМСО. Пунктирными линиями выделено процентное ингибирование ЧСС и концентрация CAM833 на кривой EC50. Данные представляют собой среднее значение ± SEM 2 биологических репликатов, каждая из которых имеет в среднем 4 технические репликации. (В) Процентное ингибирование отдельных сигналов люминесценции в (А) рассчитывали относительно контрольной группы, обработанной ДМСО. Пунктирными линиями выделено процентное ингибирование NanoLuc и Firefly при 3,33 мкМ CAM833 (EC50). Снижение сигнала Firefly при концентрациях CAM833 ≥ 10 мкМ свидетельствует о токсичности соединений при высоких дозах; однако снижение сигнала NanoLuc наблюдается при концентрациях, где сигнал Firefly не подвержен влиянию, что позволяет предположить, что CAM833 индуцирует ингибирование ЧСС на цели. Эта цифра была адаптирована из Rajendra et al.7. Сокращения: NanoLuc = нанолюцифераза; HR = гомологичная рекомбинация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Репортерный субстрат | Исходная плазмида (размер в кб, сопротивление) | Генерация DSB | Ожидаемый размер подложки конечного репортера (кб) | |||
| Резекционно-независимый MMEJ | 4.0, Кан | Резецированные 3'-хвосты путем лигирования колпачков | 1.6 | |||
| Резекционно-зависимый MMEJ | 6.5, Кан | I-SceI (несвязный), HindIII (целостный) | 6.5 | |||
| Блант NHEJ | 4.3, Кан | Тупые концы при иссечении из плазмиды EcoRV | 1.7 | |||
| Нетупой NHEJ | 6.7, Кан | I-SceI (несвязный), HindIII (целостный) | 6.5 | |||
| Длинный шаблон HR | 9.2, Кан | I-SceI (несвязный), HindIII (целостный) | 9.2 | |||
| Краткий шаблон HR | 9.3, Ампер | I-SceI (целостный) | 9.3 | |||
| SSA | 9.5, Кан | I-SceI (несвязный), HindIII (целостный) | 9.5 | |||
Таблица 1: Плазмиды репортерного субстрата. Сокращения: DSB = двухцепочечный разрыв; MMEJ = микрогомологически опосредованное соединение концов; NHEJ = негомологичное соединение концов; HR = гомологичная рекомбинация; SSA = одноцепочечный отжиг; Кан = канамицин; Амф = ампициллин.
| Последовательность (5'-3') | Поставщик | Очистка | Функция | ||
| 5'[Phos]TCGAGGACTTGGTCCAGGTT GTAGCCGGCTGTCTCTGTCGCCAGTCC CCAACGAAATCTTCGAGTGAAGACCAT | Сигма | СТРАНИЦА | Левый колпачок, длинный олигонуклеотид | ||
| 5'[Phos]GCCGGCTACAACCTGGACCAAGTCC | Сигма | СТРАНИЦА | Левый колпачок, короткий олигонуклеотид | ||
| 5'[Phos]AGCTTTATTGCGGTTTATCA CAGTTAAATTGCTAACGCAGTCAGTGG GCCTCGGCGGCCAAGCTAGGCAATCC GGTACTGTTGGTAAAGCCACCATGG | Сигма | СТРАНИЦА | Правый колпачок, длинный олигонуклеотид | ||
| 5'[Phos]CGAGGCCCACTGACTGCGTTA GCAATTTAACTGTGATAAACTACCGCAATAA | Сигма | СТРАНИЦА | Правый колпачок, короткий олигонуклеотид | ||
Таблица 2: Олигонуклеотиды для колпачков для получения резекционно-независимого репортерного субстрата MMEJ. Сокращения: ssDNA = одноцепочечная ДНК; dsDNA = двухцепочечная ДНК; MMEJ = микрогомологически опосредованное соединение концов; PAGE = электрофорез в полиакриламидном геле. Микрогомологии выделены.
| Пробирный анализ Reporter | ДНК репортерного субстрата NanoLuc (μг ДНК/1x106 клеток) | Люциферазная плазмида для контроля светлячков (μг ДНК/1x106 клеток) |
| Резекционно-независимый MMEJ | 0.5 | 0.66 |
| Резекционно-зависимый MMEJ | 1 | 0.66 |
| Блант NHEJ | 0.5 | 0.66 |
| Нетупой NHEJ | 0.5 | 0.66 |
| Длинный шаблон HR | 1 | 0.66 |
| Краткий шаблон HR | 2 | 0.66 |
| SSA | 1 | 0.66 |
Таблица 3: Количество ДНК для транзиторной трансфекции субстратов репортеров NanoLuc и плазмиды люциферазы контроля Firefly (HEK-293, формат 96-луночных планшетов). Сокращения: MMEJ = микрогомологически опосредованное соединение концов; NHEJ = негомологичное соединение концов; HR = гомологичная рекомбинация; SSA = одноцепочечный отжиг.
Discussion
В данной работе мы описали протоколы для создания и реализации набора репортеров на основе экстрахромосомной люминесценции для измерения клеточного мастерства четырех основных путей DSBR (HR, NHEJ, MMEJ и SSA)7. Репортерные субстраты могут быть введены в клетки путем транзиторной трансфекции и использованы для оценки активности DSBR с использованием чувствительного и надежного считывания люминесценции NanoLuc на основе пластин, которое восстанавливается при взаимодействии с родственными клеточными путями DSBR.
Несколько этапов генерации репортерного субстрата, трансфекции субстратов в клетки и интерпретации данных имеют решающее значение для успешного проведения этих анализов. Несмотря на то, что для создания репортерных субстратов используются стандартные методы молекулярной биологии, визуализация процесса с помощью гель-электрофореза обеспечивает высочайшее качество и чистоту субстратов до трансфекции. Поскольку эти анализы основаны на транзиторной трансфекции, применяются общие соображения для этих методов. К ним относятся оптимизация плотности посева, условий трансфекции (включая реагенты и количество ДНК), а также оценка пригодности в форматах прямой и обратной трансфекции. Эти репортерные анализы были успешно проведены с использованием ряда протоколов электропорации и липофектии, и перед проведением этих анализов следует полностью изучить возможные варианты. Следует также позаботиться о проверке компонентных сигналов NanoLuc и Firefly, а не только композитного сигнала восстановления, полученного путем нормализации сигнала NanoLuc (репортерная подложка) к сигналу Firefly (контроль). Артефакты могут возникать из-за того, что соотношение обусловлено изменениями в сигнале Firefly. Например, оценка ингибирования в режиме «доза-реакция» с использованием высокоспецифичного соединения должна подавлять сигнал NanoLuc титруемым образом, не нарушая сигнал Firefly, который должен оставаться стабильным (рис. 4G, H). Тем не менее, в тех случаях, когда сигналы Firefly возмущены, полезное влияние на репарацию все еще может быть определено путем определения окна дозы, в котором сигнал Firefly не подвержен влиянию (рис. 5).
По сравнению с наиболее часто используемыми репортерными анализами DSBR, эти репортерные анализы на основе внехромосомной люминесценции имеют некоторые явные преимущества. Поскольку пути DSBR высоко консервативны, даже если клеточный механизм различается в зависимости от модели клеток, анализы все равно могут сообщать об уровне владения DSBR и выборе пути. Это открывает возможность оценки DSBR для любой модели, представляющей интерес для пользователя, при условии, что оптимальные условия трансфекции переходных процессов будут установлены заранее.
Использование нанолюциферазы в качестве репортерного гена также имеет преимущества по сравнению с флуоресцентными вариантами, которые традиционно использовались в репортерных анализах DSBR. NanoLuc быстро созревает, а люминесценция обнаруживается с высокой чувствительностью с помощью планшетного ридера8. В сочетании со скоростью восстановления субстрата (поскольку репортерные субстраты трансфицируются в клетки с готовыми к восстановлению концами DSB), этот формат репортерного анализа DSBR идеально подходит для быстрого выполнения и количественной надежности, необходимых для скрининга малых молекул в рамках каскада промышленных разработок лекарств. Действительно, недавно мы описали реализацию независимого от резекции репортерного анализа MMEJ в каскаде открытий, используемом для идентификации низкомолекулярных ингибиторов полимеразного домена Polθ13.
Кроме того, существует гибкость в проведении репортерных анализов для решения конкретных вопросов о генетических и фармакологических нарушениях DSBR (Рисунок 3). Например, перед трансфекцией репортерных субстратов клетки могут быть трансфицированы миРНК против гена, представляющего интерес, в течение 48-72 ч. В качестве альтернативы, влияние сверхэкспрессии генов на пути DSBR можно проверить, выполнив трансфекцию плазмид за 24-48 ч до трансфекции репортерных субстратов. Что касается фармакологических исследований, то в настоящем протоколе уже описано, как использование малых молекул может быть включено в стандартный рабочий процесс, но альтернативные форматы могут включать изменения в режимах обработки соединениями, такие как предварительная инкубация или промывка.
Масштабируемость транзиторной трансфекции может также поддерживать широкомасштабные подходы к скринингу, при которых периодическая трансфекция репортерных субстратов выполняется до скрининга. Кроме того, продолжительность анализа от трансфекции до считывания также может варьироваться. Хотя стандартная продолжительность может составлять 16-24 часа, некоторые анализы могут быть прочитаны всего за 6 часов7 часов. Опасения по поводу токсичности малых молекул или миРНК, которые могут поставить под угрозу жизнеспособность клеток, также должны учитываться при определении продолжительности анализа.
Таким образом, анализы, изложенные в этом исследовании и полностью описанные в недавней публикации7 , обеспечивают быструю и надежную оценку квалификации клеточного DSBR. Они обладают высокой чувствительностью и титруемостью, что делает их пригодными как для генетических, так и для фармакологических исследований. Важно отметить, что, поскольку репортерные субстраты могут быть введены в клетки путем транзиторной трансфекции, они имеют потенциал для использования в любой интересующей нас модели трансфицируемой клетки, а не ограничиваются конкретными клеточными линиями путем стабильной интеграции, как в случае с хромосомными репортерами DSBR. Тем не менее, явным ограничением этих репортерных экстрахромосомных анализов является то, что отсутствие интеграции в геном может не полностью повторять физиологический, хроматинизированный контекст репарации ДНК и связанные с ним регуляторные сигналыи оркестровку. С этой целью внехромосомные репортерные анализы дополняют существующие методы оценки DSBR и расширяют инструментарий ресурсов, пригодных как для фундаментальных исследований, так и для разработки лекарств.
Disclosures
D.G., E.R., B.M., A.G., S.J.B., G.C.M.S и H.M.R.R. являются сотрудниками и акционерами Artios Pharma Ltd. G.C.M.S. является акционером AstraZeneca PLC. S.J.B. является ученым-основателем и акционером Artios Pharma Ltd. На некоторых из отчетников, указанных в этом исследовании, был подан патент (WO 2021/001647). Promega является источником технологии NanoLuc® и модифицированных полинуклеотидов NanoLuc®. Компания «Артиос Фарма» получила разрешение от компании Promega на производство модифицированных полинуклеотидов NanoLuc®.
Acknowledgements
Все работы финансировались компанией Artios Pharma Ltd. Рисунок 1 и Рисунок 3 были созданы совместно с Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 10x TBE buffer | Thermo Fisher | AM9863 | |
| 20% TBE-acrylamide gel | Invitrogen | EC6315BOX | |
| 50x TAE buffer | Fisher Scientific | BP13321 | |
| 6x Gel Loading Dye, Purple | NEB | B7024S | |
| 96-well white plate (with transparent bottom and lid) | Porvair | 204012 | |
| Agarose | Cleaver Scientific | CSL-AG500 | |
| AMPure XP beads | Beckman Coulter | A63881 | For bead-based purification of DNA |
| Antarctic phosphatase and 10X buffer | NEB | M0289L | |
| CLARIOstar | BMG Labtech | 430-101 | Plate reader |
| Countess II Automated Cell Counter | Thermo Fisher | AMQAX1000 | Cell counter |
| Custom oligonucleotides | Sigma-Aldrich | Custom order | For resection-independent MMEJ substrate. See Table 2. |
| D300e | Tecan | 30100152 | DMSO-based compound dispenser |
| D300e D4+ cassette | Tecan | 30097371 | High volume cassette for D300e compound dispenser |
| D300e T8+ cassette | Tecan | 30097370 | Low volume cassette for D300e compound dispenser |
| Dimethyl sulfoxide, cell culture grade | Sigma-Aldrich | D2650-100ML | Vehicle for compounds, used in Figure 4 and Figure 5 |
| DSBR reporter source plasmids | Artios | Available to the academic community upon request | |
| EcoRV-HF and 10x CutSmart buffer | NEB | R3195M | |
| Ethanol absolute | VWR | 20821.365 | |
| Foetal Bovine Serum | PAN-Biotech | P30-3031 | |
| GeneRuler Ultra Low Range DNA Ladder | Thermo Fisher | SM1211 | Low molecular weight DNA ladder |
| HEK-293 cells | ATCC | CRL-1573 | Example cell line used in protocol |
| HindIII-HF and 10x CutSmart buffer | NEB | R3104M | |
| HyClone Molecular Biology grade water | Fisher Scientific | 10275262 | |
| I-SceI and 10x Tango Buffer | Invitrogen | ER1771 | |
| Isopropanol | VWR | 20842.33 | |
| JetPRIME reagent and buffer | PolyPlus | 114-15 | Lipid-based transfection reagent |
| MegaStar 1.6 | VWR | 521-1749 | Centrifuge for 15 or 50 mL tubes |
| MEM Eagle | PAN-Biotech | P04-08056 | Culture medium for HEK-293 cells |
| Microplate shaker | Fisherbrand | 15504070 | Microplate orbital shaker |
| MicroStar 17R | VWR | 521-1647 | Centrifuge for 1.5 or 2 mL tubes |
| MultiDrop | Thermo Fisher | 5840300 | Cell or water-based reagent dispenser |
| MultiDrop Standard Cassette | Thermo Fisher | 24072670 | Cassette for MultiDrop reagent dispenser |
| NanoDLR Stop & Glo Buffer and Substrate | Promega | N1630 or N1650 | Reporter luciferase (NanoLuc) reagent to quench Firefly luminescence and detect NanoLuc luminescence. Part of the Nano-Glo Dual-Luciferase Reporter Assay System kit |
| ONE-Glo EX Luciferase Assay Buffer and Substrate | Promega | N1630 or N1650 | Control luciferase (Firefly) assay reagent to detect Firefly. Part of the Nano-Glo Dual-Luciferase Reporter Assay System kit |
| PBS (without calcium or magnesium) | PAN-Biotech | P04-36500 | |
| pGL4 Firefly plasmid (or similar) | Promega | E1310 (or equivalent) | Firefly control plasmid |
| pNL1.1 NanoLuc plasmid (or similar) | Promega | N1091 (or equivalent) | NanoLuc control plasmid, for adjustment of equipment settings/optimisation experiments |
| QIAquick Gel Extraction Kit | Qiagen | 28706 | |
| Quick-Load Purple 1 kb DNA Ladder | NEB | N0552S | High molecular weight DNA ladder |
| Sodium Acetate (3 M), pH 5.5 | Thermo Fisher | AM9740 | For pH adjustment during gel extraction with QIAquick Gel Extraction Kit |
| SYBR Gold (10,000x) | Invitrogen | S11494 | For visualisation of ssDNA and dsDNA |
| SYBR Safe (10,000x) | Invitrogen | S33102 | For visualisation of dsDNA only |
| T4 DNA Ligase and 10x Ligase buffer | NEB | M0202L | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 | For measurement of viability during cell counting |
| Trypsin-EDTA solution; 0.25% Trypsin and 0.53 mM EDTA | Sigma-Aldrich | T4049-100ML | |
| XhoI and 10x CutSmart buffer | NEB | R0146M |
References
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461 (7267), 1071-1078 (2009).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nat Rev Mol Cell Biol. 20 (11), 698-714 (2019).
- Ramsden, D. A., Carvajal-Garcia, J., Gupta, G. P. Mechanism, cellular functions and cancer roles of polymerase-theta-mediated DNA end joining. Nat Rev Mol Cell Biol. 23 (2), 125-140 (2022).
- Ceccaldi, R., et al. Homologous-recombination-deficient tumours are dependent on Polθ-mediated repair. Nature. 518 (7538), 258-262 (2015).
- van de Kooij, B., van Attikum, H. Genomic reporter constructs to monitor pathway-specific repair of DNA double-strand breaks. Front Genet. 12, 809832 (2021).
- Gunn, A., Stark, J. M. I-SceI-based assays to examine distinct repair outcomes of mammalian chromosomal double strand breaks. Methods Mol Biol. 920 (9), 379-391 (2012).
- Rajendra, E., et al. titratable and high-throughput reporter assays to measure DNA double strand break repair activity in cells. Nucleic Acids Res. 52 (4), 1736-1752 (2024).
- Hall, M. P., et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem. Biol. 7 (11), 1848-1857 (2012).
- Wyatt, D. W., et al. Essential roles for polymerase θ-mediated end joining in the repair of chromosome breaks. Mol Cell. 63 (4), 662-673 (2016).
- Wood, R. D., Doublié, S. Genome protection by DNA polymerase θ. Annu Rev Genet. 56, 207-228 (2022).
- Belan, O., et al. POLQ seals post-replicative ssDNA gaps to maintain genome stability in BRCA-deficient cancer cells. Mol Cell. 82 (24), 4664-4680 (2022).
- Zatreanu, D., et al. Polθ inhibitors elicit BRCA-gene synthetic lethality and target PARP inhibitor resistance. Nat Commun. 12 (1), 3636 (2021).
- Stockley, M. L., et al. Discovery, characterization, and structure-based optimization of small-molecule in vitro and in vivo probes for human DNA polymerase theta. J Med Chem. 65 (20), 13879-13891 (2022).
- Scott, D. E., et al. A small-molecule inhibitor of the BRCA2-RAD51 interaction modulates RAD51 assembly and potentiates DNA damage-induced cell death. Cell Chem Biol. 28 (6), 835-847 (2021).
- Schep, R., et al. Impact of chromatin context on Cas9-induced DNA double-strand break repair pathway balance. Mol Cell. 81 (10), 2216-2230 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved