通过数字液滴聚合酶链反应定量纯化载体样品中的腺相关病毒基因组
In This Article
Summary
腺相关病毒 (AAV) 载体基因组拷贝的精确定量至关重要,但尚未建立标准化方案。该方案描述了一种经过验证的方法,用于制备纯化的 AAV 样品和进行数字液滴聚合酶链反应 (dd_PCR) 以可靠地定量病毒基因组滴度。
Abstract
腺相关病毒 (AAV) 是一种非致病性病毒,用作将治疗基因转移到患者体内的递送载体。在基于 AAV 的基因治疗产品的临床前和临床研究中,准确定量载体制备中 AAV 基因组拷贝数对于生物工艺优化和剂量计算至关重要。目前,缺乏 AAV 病毒基因组滴定的共识方案。在这里,我们提出了一种数字液滴 PCR (dd_PCR) 方案,用于定量纯化载体样品中的病毒基因组。样品用 DNase I 处理,以去除未包装的污染物 DNA。然后将 DNase 处理的样品与适当的引物探针组(根据目标 AAV 基因组设计)和 PCR 试剂混合,然后加载到液滴发生器中。将制备的液滴转移到 PCR 板中,在那里进行 PCR 扩增和分析。病毒基因组滴度根据浓度(拷贝数/μL)计算,并考虑样品稀释度。成功的测量表明阳性和阴性液滴云明显分离,至少有 10,000 个可接受的液滴,显示值介于 10 拷贝/μL 和 10,000 拷贝/μL 之间,重复之间的变异系数 (CV) 低于 20%。可靠的病毒基因组滴定将有助于开发安全有效的基于 AAV 的基因治疗产品。
Introduction
基因疗法是治疗遗传疾病的一种常用治疗方式。任何给定基因疗法的设计都特定于目标适应症的相关病理学,但所有基因疗法都涉及将遗传物质在细胞内递送到目标细胞,以引发治疗效果1。基因治疗可进一步分为几类,包括功能丧失突变的基因替换、功能获得异常的基因沉默和基因编辑技术。无论采用何种具体策略,治疗性核酸材料(称为转基因)都必须包装在载体中,以实现靶向细胞内递送2。
尽管有多种病毒和非病毒载体系统可用于基因治疗开发,但由于这组病毒具有广泛的病毒嗜性和低免疫原性,因此经常选择腺相关病毒 (AAV) 1,2。迄今为止,已有 7 种利用 AAV 进行治疗性基因递送的基因疗法获得欧洲药品管理局 (EMA) 或美国食品药品监督管理局 (FDA) 的批准,针对从血友病(例如 Roctavian)到脊髓性肌萎缩症(例如 Zolgensma)的疾病3。
基于 AAV 的基因疗法的生产源于对野生型 AAV 本身的理解。AAV 是细小病毒科中的一种小型 DNA 病毒,包含 13 种主要血清型 (AAV1-13)3。AAV 基因组由一个 ~4.7 kb 的单链 DNA 分子组成,包含两个主要的开放阅读框 (ORF),它们编码基因组复制、衣壳组装和包装(rep、 cap)所必需的必需病毒基因。病毒基因组的 5' 和 3' 末端两侧是回文核苷酸序列,称为倒置末端重复序列 (ITR)。这些 ITR 形成发夹状结构,在基因组复制和从 头 病毒基因组包装成新合成的病毒衣壳中起着至关重要的作用。AAV 是一种辅助依赖性病毒,因此需要表达来自其他病毒的辅助基因,例如单纯疱疹病毒 (HSV) 或腺病毒 (AdV) 才能具有复制能力1。
为了产生 AAV,采用合适的基于细胞的表达系统来促进病毒衣壳蛋白的表达并随后组装成从头病毒颗粒,然后包封 ITR 侧翼的选定转基因(也称为载体基因组)。该过程通常利用三重质粒系统,包括 (1) 携带来自辅助病毒的辅助基因的质粒,(2) 编码必需病毒元件 (rep/cap) 的质粒,以及 (3) 携带治疗性表达盒的质粒(通常称为转移质粒)4。转移质粒中治疗性表达盒两侧存在独特的反向末端重复序列 (ITR) 包装信号,确保了转基因的特异性包装,同时大部分排除了其他质粒上存在的病毒基因。将这种三质粒系统共转染到基于细胞的表达平台(通常为 HEK293T 个细胞)中,可产生适用于基因治疗应用的转导能力、复制缺陷型病毒颗粒 3,4。
必须评估与基于 AAV 的基因疗法的生产相关的许多关键质量属性 (CQA),以确保预期医药产品的效力、纯度和安全性4。这些 CQA 包括病毒滴度、衣壳含量和聚集。病毒滴度本身是任何给定制剂中存在的病毒颗粒数量(衣壳滴度)和载体基因组数量(载体基因组滴度)的组合。理想情况下,这两个滴度之间的比例应该是 1:1,因为每个病毒颗粒应包含一个载体基因组,但生物合成过程中载体基因组包装效率低下会导致共产生空衣壳或部分填充的衣壳(包含部分载体基因组序列和/或非载体基因组序列的衣壳)5。此类杂质的存在可能会引起不必要的免疫反应并竞争载体结合位点,从而增加免疫毒性的风险并降低完整衣壳的转导率6。因此,AAV 基因组的准确定量对于确定病毒滴度和衣壳含量至关重要。这既影响了基础研究,也影响了基因治疗行业,该行业需要准确的剂量才能保持医药产品的安全性和有效性。
数字液滴聚合酶链反应 (dd_PCR) 已与病毒滴度的定量密切相关,因为它可用于确定任何给定制剂中存在的载体基因组的数量7。数字 PCR 本身于 1990 年代首次推出 8,9,dd_PCR是该技术的增强功能,可实现高通量样品处理10,11。在dd_PCR中,将 20 μL 实时荧光定量 PCR 反应物分成大约 20,000 个油包覆的液滴,当放置在标准 96 孔板上时,最多可产生 96 个此类反应。与传统的定量 PCR (qPCR) 相比,dd_PCR 具有多种优势,包括更高的灵敏度、更高的精度以及更直接和绝对的靶序列定量,而无需标准曲线。此外,dd_PCR 中的高水平分配降低了 PCR 抑制剂的影响,并最大限度地减少了某些模板优先扩增造成的偏倚可能性,使其成为载体基因组滴定分析测量的有吸引力的选择。
Protocol
此处描述的方案旨在以高精度定量纯化的、内部生产的 AAV9 载体的病毒基因组滴度,其中绿色荧光蛋白 (GFP) 作为转基因12 (表 1)。然而,该方案适用于任何 AAV 血清型和任何载体基因组设计,前提是引物/探针组旨在靶向感兴趣的特定载体基因组。材料 表中列出了本研究中使用的试剂、引物、探针和设备的详细信息。
1. 储备液的制备
注:在 PCR 工作站制备样品稀释所需的所有储备液,以避免外源 DNA 污染。
- 准备 10x PCR 检测缓冲液,由 500 mM KCl、100 mM Tris-HCl、15 mM MgCl2 和 0.01% (w/v) BSA 组成。测量溶液的 pH 值并将其调节至 8.3。
注意:该溶液可在室温下保存长达 1 个月。 - 准备 AAV 稀释缓冲液,其中包含 1x PCR 检测缓冲液、0.2 ng/μL 鲑鱼精子剪切 (sss) DNA 和 0.1% 普朗尼克 F-68。每次测定时新鲜制备此溶液,并将其保持在 4 °C。
注:如果没有普洛沙姆 F-68,可以使用泊洛沙姆 188 非离子表面活性剂等替代品。
2. 样品制备 - DNase I 处理和连续稀释
注:为了去除可能降低载体基因组滴定准确性的 DNA 污染物,可以在使用 DNase 进行 PCR 扩增之前去除 AAV 样品中存在的游离 DNA(包括剩余的质粒 DNA 或未包膜的病毒基因组)。这是可能的,因为载体基因组被封装在 AAV 衣壳中,因此在 PCR 反应本身的变性步骤之前无法获得(参见步骤 5)。此外,由于任何给定样品中的载体基因组编号都是未知的,因此有必要对样品进行连续稀释,以确保测量值保持在可检测的上限和下限内。在 PCR 工作站上执行所有样品操作。除非另有说明,否则请将所有样品保存在冰上。
- 通过短暂涡旋然后离心来混合选择用于分析的 AAV 样品,以确保所有液体都保留在包含样品的试管底部。
- 对于 DNase 处理,将 45 μL 含有 1x DNase I 缓冲液、0.1% 普鲁尼克 F-68 和 0.04 U/μL DNase I 的无 DNase 水溶液加入 0.2 mL PCR 8 管联管中。
- 将 5 μL 样品转移到含有 DNAse 溶液的试管中。涡旋样品并短暂离心以确保所有液体都留在底部。
- 在热循环仪中,将样品在 37 °C 下孵育 1 小时,然后冷却至 4 °C。 达到 4 °C 后尽快置于冰上。
- 使用新鲜的 0.2 mL PCR 8 联管,在 AAV 稀释缓冲液中对 DNase 处理的样品进行适当稀释。推荐的样品稀释度取决于预期的 vg 滴度(表 2),但每个样品至少需要 2 种不同的稀释度,并且每次稀释一式两份。确保在取出任何体积之前严格 (2,000-3,000 rpm) 涡旋样品 5 秒。
- 连续稀释后,涡旋样品并离心,以确保所有液体都留在试管底部。
- 包括一个已知 vg 滴度的阳性对照和一个阴性对照(仅限 AAV 稀释缓冲液),也称为无模板对照 (NTC)。
注:阳性对照可以是内部生产的 AAV 或商业 AAV 参考物质,其中包括引物/探针的靶序列。
3. 制备dd_PCR预混液
注:在载体基因组中选择合适的靶序列,并按照已发布的指南13 设计用 FAM 或 HEX 报告荧光团标记的正向引物、反向引物和水解探针。靶向转基因的引物优于靶向 ITR 的引物,因为转基因对载体基因组设计具有特异性,并且与 ITR 的发夹形成相关的二级结构会阻碍引物的有效结合。此外,如果存在包含截短载体基因组片段的部分填充衣壳并且仍然包含任一 ITR 序列,则 ITR 引物可能会高估 AAV 滴度14。在专用的独立工作站(PCR 前室)中制备 dd_PCR 预混液。这个房间应与制备样品的房间分开,以避免交叉污染。
- 让引物、探针和dd_PCR超混合液试剂达到室温 (20-25 °C)。然后,涡旋所有试剂并短暂离心试管以收集试管底部的所有液体。
- 根据 表 3 中描述的体积和浓度,通过混合正向和反向引物、探针、dd_PCR超混合物和不含 DNase 的水,根据所需的反应次数,在单独的微量离心管中制备一体积的 dd_PCR 预混液。
- 涡旋预混液,然后短暂离心试管,以确保所有液体都留在试管底部。
注意:始终准备比所需体积 (n + 1) dd_PCR的预混液体积,以解决移液体积损失。
- 涡旋预混液,然后短暂离心试管,以确保所有液体都留在试管底部。
- 将 19.8 μL 预混液转移到新鲜的 0.2 mL PCR 8 管条上的每个试管中。
4. 液滴生成
注:样品和 dd_PCR 预混液在上样到液滴发生柱之前分别混合。在 PCR 工作站进行所有操作,最好是与制备样品的位置不同的工作站,以避免扩增子污染。或者,在制备样品后彻底清洁 PCR 工作站。
- 将 2.2 μL 稀释样品转移到 PCR 8 管联管每管中 19.8 μL 体积的 dd_PCR 预混液中,并充分混合。涡旋并短暂离心,以确保所有液体都留在底部。
- 将 20 μL 该溶液转移到液滴发生柱中间“样品”行的孔中。避免液滴发生柱中出现气泡;这可能会导致仪器出现错误,并且无法生成液滴。
注:由于小柱为 8 孔格式,PCR 试管联管也是如此,因此建议使用 8 通道移液器。 - 将 60 μL 液滴发生油转移到液滴发生柱下“油”行上的孔中。
注意:切勿将液滴发生柱的孔留空;用探针缓冲液控制填充空样品孔dd_PCR(具有上述相应的体积)。 - 在液滴发生液柱上放置橡胶垫圈,然后将其放入液滴发生器中。
- 产生液滴后,使用 8 通道移液器将 42.5 μL 溶液从 dd_PCR 芯片缓慢转移到多孔 PCR 板中。
注:以 45 度角缓慢移液,以避免移液时液滴在液体中剪切。目视检查板,确保所有孔中都填充了相同量的液体,并且液滴在孔中显示为不透明层。 - 在热封机中用铝箔盖在 180 °C 下密封板 5 秒。
注意:目视检查所有孔是否密封。如果没有,请在 180 °C 下再重复 5 秒。 密封板可在 4 °C 下保存长达 4 小时,然后在热循环仪中dd_PCR扩增。
5. dd_PCR放大
注意:热循环仪应放置在与 PCR 前室不同的房间内,以便在空间上将 PCR 前活性与 PCR 扩增分开,并避免由于扩增子污染而导致假阳性结果。
- 将板放入热循环仪(带有 96 深孔反应模块)中进行 PCR 扩增并牢固关闭。
- 将热循环仪配置为在 表 4 中描述的条件下以 40 μL 的反应体积运行。在程序设置中包括预热步骤,并确保盖子加热至 99 °C。
- PCR 程序结束后,将板在 4 °C 下保持至少 15 分钟,以确保板完全冷却。
注意:在必须读取液滴之前,板可以在 4 °C 下保持 48-72 小时。
6. 液滴读数
- 将板加载到微滴读数仪中,在系统软件中输入以下信息,然后继续读数。
注:实验类型 = 直接定量;超混合液 = dd_PCR 探针的超混合液(无 dUTP);检测类型 = 每个通道单个靶标;目标信息,信号通道 1 = FAM 通道或十六进制通道,具体取决于所使用的探头。 - 注释样品,以便可以从数据文件中有效地确定和识别每个样品的位置。
7. 数据分析
- 使用微滴检测仪制造商提供的兼容软件进行数据分析。
- 进行系统适用性测试以评估分析的整体性能(以及因此的可靠性)。
- 检查 PCR 板上每个孔测得的事件计数(液滴数)。理想情况下,事件计数介于 15,000 到 20,000 之间。如果事件计数为 <10,000,则必须从分析中排除此值。
- 评估 1D 或 2D 振幅 图,并检查是否存在滴雨。
- 转到 数据表 选项卡并将数据导出到 Excel 文件。
- 按照以下步骤计算 vg 滴度:
- dd_PCR 的工作范围为 10-10 000 拷贝/μL。从分析中排除任何 <10 拷贝/μL 的值。本文使用的 dd_PCR 设备的推荐范围为 25-5000 拷贝/μL。
注:数据分析软件将根据 PCR 反应体积 (40 μL) 提供载体基因组编号,但这并未考虑样品制备过程中应用的稀释因子。 - 使用以下关系式考虑整个样品制备过程中的各种稀释因子,计算每体积样品 vg 滴度(通常表示为 vg/mL):
注:浓度(从数据分析中获得的值)x 10(DNase I 预处理稀释液)x 10(PCR 预混液稀释液)x 1000(μL 至 mL)选定的样品稀释液(在 AAV 稀释缓冲液中 - 例如, 表 2)。 - 计算同一样品的重复样品之间和不同稀释度之间的变异系数 (%CV)。
注: %CV 的计算方法是将标准差除以平均值。如果不同稀释度之间的 %CV 为 >20 %,则不应认为该值准确。 - 检查阴性对照和阳性对照的值。阴性对照应小于 5 拷贝/μL。
- dd_PCR 的工作范围为 10-10 000 拷贝/μL。从分析中排除任何 <10 拷贝/μL 的值。本文使用的 dd_PCR 设备的推荐范围为 25-5000 拷贝/μL。
Representative Results
可以使用适当的软件对结果进行可视化。对于每个孔,1D 振幅图显示相对于其振幅的所有液滴。预计正液滴和负液滴之间会有明显的区别。如果在正负液滴云之间发现超过 10% 的总液滴(这种现象称为液滴雨),则需要重新测量样品(见 图 1)。有关滴雨的更多信息,请参阅讨论。
可以创建一个数据表来汇总所有记录的信息,包括样品名称、可接受的液滴数(事件计数)和浓度(拷贝数/μL)。理想情况下,事件计数应介于 15,000 到 20,000 个接受的 droplet 之间。如果井的事件计数低于 10,000,则应从分析中排除该数据点。 表 5 中提供了输出数据的示例。
vg 滴度可以根据浓度(拷贝数/μL)计算,并考虑样品稀释度。dd_PCR的工作范围为 10-10,000 拷贝/μL。低于 10 拷贝/μL 的值应排除在分析之外。应计算样品以及阳性和阴性对照的 vg 滴度。阳性对照的测量值的变异系数 (%CV) 应低于理论值的 20%。阴性对照应小于 5 拷贝/μL。此外,还应计算每个样品重复和不同稀释度之间的 %CV。如果不同稀释度之间的 %CV 超过 20%,则该值可能被认为不准确,并且可能需要重新测量样品。
成功测量的特点是阳性和阴性液滴云清晰分离,至少 10,000 个可接受的液滴,值在 10 拷贝/μL 和 10,000 拷贝/μL 之间,重复之间的 %CV 低于 20%。
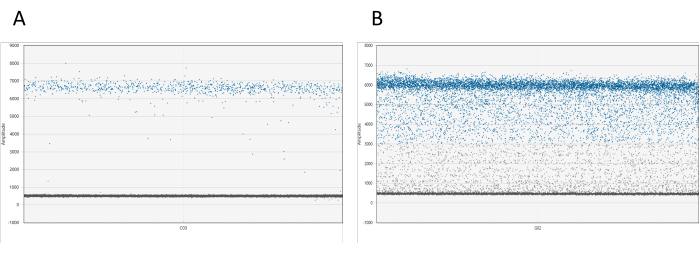
图 1:dd_PCR 液滴的可视化。 (A) 1D 振幅图显示了正液滴和负液滴的明确分离,表明液滴分配成功。(B) 该图显示正负液滴分离不佳,称为液滴雨,这表明分配不理想或检测存在潜在问题。 请单击此处查看此图的较大版本。
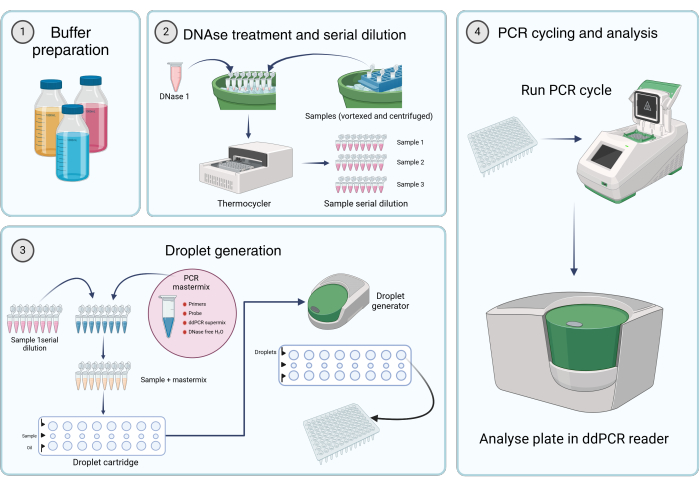
图 2:使用数字液滴 PCR 定量病毒基因组的工作流程。 (1) 根据制造商的说明或方案的第 1 步(储备溶液的制备)制备缓冲液、试剂和溶液。(2) 将 45 μL DNase I 溶液分装到 8 管 PCR 联管的每管中。涡旋并短暂离心样品后,将 5 μL 样品加入其中一个试管中。将 DNase I 和含有样品的八管 PCR 条在热循环仪中于 37 °C 孵育 1 小时,然后连续稀释样品。(3) 如前所述制备 PCR 预混液,并将 19.8 μL 分装到 8 管 PCR 试管的每管中。将步骤 2 中的样品系列稀释液添加到预混液中。20 μL 预混液 plus
将样品溶液加载到小柱的中间行中,并将 60 μL 液滴发生油转移到液滴发生柱的下孔中。然后将小柱放入液滴发生器中,并根据指定的条件运行。液滴生成后,将小柱顶行的 42.5 μL 转移到多孔 PCR 板中。(4) 将 PCR 板装入 PCR 热循环仪中,根据提供的条件运行。使用 dd_PCR 读数仪分析板。 请单击此处查看此图的较大版本。
表 1:精度数据。 下表列出了四组质量控制 (QC) 样品的精密度数据,每组样品具有五种浓度 (QC1-QC5)。每个 QC 测量 5 次。显示了不同运行之间的变异系数 (%CV),代表重复性 (A),以及不同样品组之间的变异系数 (%CV),代表中等精密度 (B)。 请点击此处下载此表格。
表 2:样品稀释度。 该表显示了基于预期病毒基因组滴度 (vg/mL) 的推荐样品稀释度。建议总共稀释 3 次,以确保至少有两个值在测定的工作范围内。 请点击此处下载此表格。
表 3:dd_PCR预混液成分。 下表概述了 dd_PCR 预混液的组成,其中包括正向和反向引物 (909 nM)、探针 (227 nM) 和探针dd_PCR超混合物(无 dUTP,1x)。 请点击此处下载此表格。
表 4:热循环条件。 下表详细介绍了推荐的 PCR 程序,其中包括:(1) 在 95 °C 下孵育 10 分钟,用于衣壳破碎和酶活化,(2) 在 94 °C 下 30 秒用于 DNA 变性,在 60 °C 下循环 1 分钟用于退火和延伸,(3) 在 98 °C 下孵育 10 分钟,用于酶灭活, (4) 保持在 4 °C。 退火温度可能需要根据所使用的引物/探针组进行优化。 请点击此处下载此表格。
表 5:实际 AAV 运行的输出数据示例。 下表提供了实际 AAV 运行的输出数据示例,其中一个样品以两种不同的稀释度测量,每种稀释度一式两份。病毒基因组 (vg) 滴度(以 vg/mL 为单位)使用以下公式计算:10(DNase I 预处理)x 10(在预混液中稀释)x 1,000(μL 至 mL)x 在 AAV 稀释缓冲液中稀释。STDEV 表示标准差,CV 表示变异系数。 请点击此处下载此表格。
Discussion
准确定量载体制备物中 AAV 载体基因组拷贝对于基于 AAV 的基因治疗产品的开发至关重要。有几种方法可用于确定 vg 滴度,其中定量 PCR (qPCR) 和 dd_PCR 是两种最广泛使用和接受的技术。dd_PCR 通常优于 qPCR,因为它独立于扩增效率、更高的精度和更强的稳定性15。文献中有许多通过 dd_PCR 进行载体基因组滴定的方案,每种方案都有自己的样品制备方法 15,16,17。然而,缺乏合格的共识协议。本文提出了一种经过验证的适用 dd_PCR 方案,用于定量纯化载体样品中的 AAV 载体基因组(图 2)。
执行此方案时,密切注意样品处理至关重要。交叉污染对准确评估 vg 滴度构成重大挑战;因此,样品最好在 PCR 工作站下处理,以避免外源 DNA 污染。此外,正确执行 DNase 孵育对于在不破坏衣壳和可能消化包装载体基因组的情况下去除未包装的污染 DNA 至关重要。许多方案包括热灭活和蛋白酶 K 处理 16,17,18。然而,在内部方法开发过程中,发现过度加热不利于 vg 滴定,并且无需蛋白酶 K 处理(数据未显示)。
随着 dd_PCR 在定量病毒基因组中越来越受欢迎,制造商发布了详细的应用指南,其中包含设计和优化 dd_PCR 检测的指南19。此外,还提供了故障排除信息。在实践中,当分析设计正确时,最常见的问题包括液滴雨和低液滴计数。液滴雨通常是由于引物/探针难以接近扩增子引起的,但有几种策略可以解决这个问题。例如,温度梯度实验可以帮助确定最佳退火温度。此外,稀释样品以降低 DNA 量(建议小于 66 ng)或使用切开扩增子区域外的特定酶进行限制性酶切,可以提高模板的可及性。建议每 μg DNA 添加 10 U 限制性内切酶通常是有效的。液滴数低(少于 10,000 个)的问题通常是由于样品移液不良和小柱中的油造成的。建议使用适当的吸头缓慢移液,以避免剪切液滴。虽然 dd_PCR 分析很稳定,但一个限制是获得结果的时间延长。从样品处理到液滴读取的过程需要几个小时,当需要快速获得结果时,这可能是一个缺点。
在 AAV 基因治疗生命周期的所有阶段,都需要对载体制备中的 AAV 基因组拷贝进行准确定量。具体来说,它对于优化生产和纯化工艺、进行临床前研究以及确定基于 AAV 的基因治疗产品的临床剂量非常重要。此处介绍的 dd_PCR 方案具有广泛的适用性,可用于具有不同血清型和转基因的纯化 AAV 产品。
Disclosures
IVH、BM 和 EH 是 Tavira Therapeutics 的联合创始人。其他作者声明没有利益冲突。
Acknowledgements
这项研究是由佛兰德斯政府的“法兰德斯复原力”补贴促成的,该补贴源自“欧洲恢复和复原力基金”(RRF) (VV021/13)。 图 2 是使用 Biorender.com 创建的。
Materials
| Name | Company | Catalog Number | Comments |
| 8-channel pipette 10 µL | Eppendorf | 3,12,50,00,010 | |
| 8-channel pipette 200 µL | Eppendorf | 3,12,50,00,036 | |
| 8-channel pipette 300 µL | Eppendorf | 3,12,50,00,052 | |
| 8-well PCR strip | Sarstedt | 72.991.002 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| C1000 Touch Thermal Cycler with 96–Deep Well Reaction Module | Bio-Rad | 1851197 | |
| ddPCR Buffer Control for Probes 9 mL (2 x 4.5 mL) | Bio-Rad | 1863052 | |
| ddPCR Supermix for Probes (No dUTP) (2 x 1 mL) | Bio-Rad | 1863023 | |
| ddPCR 96-Well Plates (pkg of 25) | Bio-Rad | 12001925 | |
| ddPCR Droplet Reader Oil (2 x 1L) | Bio-Rad | 1863004 | |
| DG8 Cartridge Holder | Bio-Rad | 1863051 | |
| DG8 Cartridges for QX200/QX100 (pkg of 24) | Bio-Rad | 1864008 | |
| DG8 Gaskets for QX200/QX100 (pkg of 24) | Bio-Rad | 1863009 | |
| DNase I (10U/µL) + buffer | Roche | 4716728001 | |
| Droplet Generation Oil for Probes (10 x 7 mL) | Bio-Rad | 1863005 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 0.1-10 μL, 34 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078500 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 20-300 μL, 55 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078560 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 2-100 μL, 53 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078543 | |
| Forward lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Forward primer: 5'-GAACGGCATCAAGGTGAACT-3' | |
| Lyopohilized probe and master stock at 100 µM | IDT | GFP as target sequence. PrimeTime Eco Probe: /56-FAM/CAAGATCCG/ZEN/CCACAACATCGAGGA/3IABkFQ/ | |
| Magnesium Chloride (MgCl2) | Chemlab Analytical | CL00.1381 | |
| Nuclease free water | IDT | 11-04-02-01 | |
| PCR Plate Heat Seal, foil, pierceable (pkg of 100) | Bio-Rad | 1814040 | |
| Pluronic F-68 non-ionic surfactant (100x) | Thermo Fisher Scientific | 24040032 | |
| Potassium Chloride (KCl) | Honeywell research chemicals | 31248 | |
| QX manager software | Bio-Rad | Software to analyse ddPCR data | |
| QX200 Droplet Generator | Bio-Rad | 1864002 | |
| QX200 Droplet Reader | Bio-Rad | 1864003 | |
| Reagent reservoir | VWR | 613-1181 | |
| Reverse lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Reverse primer: 5'-TGCTCAGGTAGTGGTTGTCG-3' | |
| SafeSeal reaction tube, 1.5 mL | Sarstedt | 72.706.200 | |
| Salmon Sperm DNA, sheared (10 mg/mL) | Thermo Fisher Scientific | AM9680 | |
| TE buffer | IDT | Accompanied by primers when ordering | |
| Tris hydrochloride (Tris-HCl) | Roche | 10812846001 |
References
- Balakrishnan, B., Jayandharan, G. R. Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther. 14 (2), 86-100 (2014).
- Srivastava, A. In vivo tissue-tropism of adeno-associated viral vectors. Curr Opin Virol. 21, 75-80 (2016).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Gimpel, A. L., et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 20, 740-754 (2021).
- Brimble, M. A., et al. Preventing packaging of translatable P5-associated DNA contaminants in recombinant AAV vector preps. Mol Ther Methods Clin Dev. 24, 280-291 (2022).
- Wright, J. F. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, (2019).
- Sidransky, D., et al. Identification of ras oncogene mutations in the stool of patients with curable colorectal tumors. Science. 256 (5053), 102-105 (1992).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci USA. 96 (16), 9236-9241 (1999).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem. 84 (2), 1003-1011 (2012).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods Mol Biol. 1950, 51-83 (2019).
- . Planning droplet digital PCR experiments Available from: https://www.bio-rad.com/en-in/life-science/learning-center/introduction-to-digital-pcr/planning-ddpcr-experiments (2024)
- Dorange, F., Le Bec, C. Analytical approaches to characterize AAV vector production & purification: Advances and challenges. Cell Gene Ther Insights. 4 (2), 119-129 (2018).
- Lock, M., et al. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Ther Methods. 25 (2), 115-125 (2014).
- Prantner, A., Maar, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18 (1), e0280242 (2023).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570 (2019).
- Suoranta, T., Laham-Karam, N., Yla-Herttuala, S. Optimized protocol for accurate titration of adeno-associated virus vectors. Hum Gene Ther. 32 (19-20), 1270-1279 (2021).
- Droplet digital PCR applications guide. Bulletin 6407 Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6407.pdf (2024)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved