כימות גנומים נגיפיים הקשורים באדנו בדגימות וקטוריות מטוהרות על ידי תגובת שרשרת של פולימראז טיפתי דיגיטלי
In This Article
Summary
כימות מדויק של עותקים גנומיים וקטוריים הקשורים לנגיף אדנו (AAV) הוא קריטי, אך פרוטוקול סטנדרטי טרם נקבע. פרוטוקול זה מתאר שיטה מתוקפת להכנת דגימות AAV מטוהרות וביצוע תגובת שרשרת פולימראז טיפתית דיגיטלית (dd_PCR) כדי לכמת באופן אמין את טיטר הגנום הנגיפי.
Abstract
נגיף הקשור לאדנו (AAV) הוא וירוס לא פתוגני המשמש ככלי משלוח להעברת גנים טיפוליים לחולים. כימות מדויק של מספר העתק גנום AAV בהכנות וקטוריות חיוני לאופטימיזציה של תהליכים ביולוגיים ולחישוב מינון הן במחקרים פרה-קליניים והן במחקרים קליניים של מוצרי ריפוי גנטי מבוססי AAV. נכון לעכשיו, פרוטוקול קונצנזוס לטיטרציה של גנום נגיפי AAV חסר. כאן, אנו מציגים פרוטוקול PCR טיפתי דיגיטלי (dd_PCR) לכימות גנומים נגיפיים בדגימות וקטוריות מטוהרות. דגימות מטופלות עם DNase I כדי לחסל DNA מזהם לא ארוז. דגימות שטופלו ב-DNase מעורבבות לאחר מכן עם ערכת בדיקות פריימר מתאימה (שתוכננה בהתאם לגנום היעד AAV) וריאגנטים PCR, ולאחר מכן נטענות לתוך מחולל טיפות. הטיפות המוכנות מועברות לצלחת PCR, שם מתבצעת ומנותחת הגברה של PCR. טיטר הגנום הנגיפי מחושב על בסיס הריכוז (עותקים/μL), תוך התחשבות בדילול הדגימה. מדידה מוצלחת מראה הפרדה ברורה בין ענני הטיפות החיוביות והשליליות, יש לפחות 10,000 טיפות מקובלות, מראה ערך בין 10 עותקים/μL ל-10,000 עותקים/μL, ויש לה מקדם שונות (CV) בין חזרות נמוך מ-20%. טיטרציה אמינה של הגנום הנגיפי תסייע בפיתוח מוצרי ריפוי גנטי בטוחים ויעילים מבוססי AAV.
Introduction
ריפוי גנטי הוא שיטה טיפולית נפוצה לטיפול בהפרעות גנטיות. התכנון של כל טיפול גנטי נתון הוא ספציפי לפתולוגיה הקשורה של אינדיקציית המטרה, אך כל הטיפולים הגנטיים כרוכים בהעברה תוך תאית של חומר גנטי לתאי המטרה על מנת לעורר אפקט טיפולי1. ניתן לסווג את הטיפול הגנטי למספר קטגוריות, כולל החלפת גנים למוטציות של אובדן תפקוד, השתקת גנים עבור חריגות ברווח-תפקוד, וטכניקות עריכת גנים. ללא קשר לאסטרטגיה הספציפית שננקטה, חומר חומצת הגרעין הטיפולי (המכונה טרנסגן) חייב להיות ארוז בתוך וקטור על מנת להשיג אספקה תוך תאית ממוקדת2.
למרות שמגוון מערכות וקטוריות ויראליות ולא ויראליות זמינות לפיתוח ריפוי גנטי, וירוסים הקשורים לאדנו (AAVs) נבחרים לעתים קרובות בשל הטרופיזם הנגיפי הרחב והאימונוגניות הנמוכה הקשורים לקבוצה זו של וירוסים 1,2. עד כה, שבעה טיפולים גנטיים המשתמשים ב- AAV להעברת גנים טיפולית השיגו אישור מסוכנות התרופות האירופית (EMA) או ממנהל המזון והתרופות האמריקאי (FDA) המתמקדים במחלות החל מהמופיליה (למשל, Roctavian) ועד ניוון שרירים בעמוד השדרה (למשל, Zolgensma)3.
ייצור טיפולים גנטיים מבוססי AAV נובע מהבנה של ה-AAV הפראי עצמו. AAV הוא נגיף DNA קטן ממשפחת Parvoviridae הכולל 13 סרוטיפים עיקריים (AAV1-13)3. גנום AAV מורכב ממולקולת DNA חד-גדילית ~ 4.7 kb המכילה שתי מסגרות קריאה פתוחות עיקריות (ORFs) המקודדות את הגנים הנגיפיים החיוניים הדרושים לשכפול גנום, הרכבת קפסיד ואריזה (rep, cap). הגנום הנגיפי מוקף בשני הקצוות של 5' ו-3' על ידי רצפי נוקלאוטידים פלינדרומיים, המכונים חזרות טרמינליות הפוכות (ITR). ITR אלה יוצרים מבנים דמויי סיכות שיער הממלאים תפקידים מכריעים בשכפול גנום ובאריזה של גנומים נגיפיים דה נובו לתוך קפסידים נגיפיים מסונתזים חדשים. AAV הוא וירוס תלוי עוזר, ולכן דורש ביטוי של גנים נלווים מנגיפים אחרים, כגון וירוס הרפס סימפלקס (HSV) או אדנו-וירוס (AdV) על מנת להפוך לכשיר שכפול1.
על מנת לייצר AAVs, מערכת ביטוי מתאימה מבוססת תאים משמשת כדי להקל על ביטוי חלבוני הקפסיד הנגיפיים ולאחר מכן הרכבה לחלקיקים נגיפיים דה נובו, ולאחר מכן אנקפסידציה של טרנסגן נבחר מאגף ITR (המכונה גם גנום וקטורי). תהליך זה משתמש בדרך כלל במערכת פלסמיד משולשת, הכוללת (1) פלסמיד המכיל גנים מסייעים שמקורם בנגיף עוזר, (2) פלסמיד המקודד את האלמנטים הנגיפיים החיוניים (rep/cap), ו-(3) פלסמיד הנושא את קלטת הביטוי הטיפולי (המכונה בדרך כלל פלסמיד העברה)4. הנוכחות הייחודית של אותות אריזה חוזרים טרמינליים הפוכים (ITR) הצמודים לקלטת הביטוי הטיפולי בפלסמיד ההעברה מבטיחה אריזה ספציפית של הטרנסגן, תוך התעלמות בעיקר מהגנים הנגיפיים הקיימים בפלסמידים האחרים. העברה משותפת של מערכת תלת-פלסמיד זו לפלטפורמת ביטוי מבוססת תאים (בדרך כלל HEK293T תאים) מביאה לייצור חלקיקים נגיפיים בעלי יכולת התמרה וחסרי שכפול המתאימים לשימוש ביישומי ריפוי גנטי 3,4.
ישנן מספר תכונות איכות קריטיות (CQAs) הקשורות לייצור טיפולים גנטיים מבוססי AAV שיש להעריך על מנת להבטיח את העוצמה, הטוהר והבטיחות של המוצר הרפואי המיועד4. CQAs אלה כוללים titer וירוסים, תוכן capsid, וצבירה. טיטר הנגיף עצמו הוא שילוב של מספר החלקיקים הנגיפיים (titer capsid) ומספר הגנומים הווקטוריים (titer גנום וקטורי) הקיימים בכל תכשיר נתון. באופן אידיאלי, היחס בין שני הטיטרים הללו צריך להיות 1:1 מכיוון שכל חלקיק נגיפי צריך להכיל גנום וקטורי אחד, אך חוסר יעילות באריזת גנום וקטורי במהלך הביוסינתזה גורם לייצור משותף של קפסידים ריקים או מלאים חלקית (אלה המכילים רצפי גנום וקטוריים חלקיים ו/או רצפי גנום שאינם וקטוריים)5. נוכחותם של זיהומים כאלה עלולה לעורר תגובות חיסוניות בלתי מוצדקות ולהתחרות על אתרים קושרי וקטורים, ובכך להגדיל את הסיכון לרעילות חיסונית ולהפחית את קצב ההתמרה של קפסידים מלאים6. כימות מדויק של גנום AAV חיוני אפוא לביסוס תכולת הטיטר והקפסיד של הנגיף. זה משפיע הן על המחקר הבסיסי והן על תעשיית הריפוי הגנטי, הדורשת מינון מדויק על מנת לשמור הן על הבטיחות והן על היעילות של מוצרים רפואיים.
תגובת שרשרת של פולימראז טיפתי דיגיטלי (dd_PCR) הפכה קשורה קשר הדוק לכימות של טיטר וירוסים מכיוון שניתן להשתמש בה כדי לקבוע את מספר הגנומים הווקטוריים הקיימים בכל הכנה נתונה7. PCR דיגיטלי עצמו הוצג לראשונה בשנות התשעים 8,9 dd_PCR הוא שיפור לטכנולוגיה זו המאפשרת עיבוד דגימהבתפוקה גבוהה 10,11. בשנת dd_PCR, תגובת PCR בזמן אמת של 20 μL מחולקת לכ-20,000 טיפות עטופות בשמן, ונותנת עד 96 תגובות כאלה כאשר היא מאוכלסת על צלחת סטנדרטית של 96 בארות. בהשוואה ל-PCR כמותי קונבנציונלי (qPCR), dd_PCR מציע מספר יתרונות, כולל רגישות מוגברת, דיוק מוגבר וכימות ישיר ומוחלט יותר של רצפי מטרה ללא צורך בעקומות סטנדרטיות. יתר על כן, רמת החלוקה הגבוהה ב-dd_PCR מפחיתה את ההשפעה של מעכבי PCR וממזערת את הפוטנציאל להטיה מהגברה מועדפת של תבניות מסוימות, מה שהופך אותה לאופציה אטרקטיבית למדידה אנליטית של טיטרציה גנומית וקטורית.
Protocol
הפרוטוקול המתואר כאן נועד לכמת את טיטר הגנום הנגיפי של וקטור AAV9 מטוהר המיוצר בתוך הבית עם חלבון פלואורסצנטי ירוק (GFP) כטרנסגן12 ברמת דיוק גבוהה (טבלה 1). עם זאת, פרוטוקול זה חל על כל סרוטיפ AAV וכל תכנון גנום וקטורי, בתנאי שערכות הפריימר/בדיקה מתוכננות להתמקד בגנום הווקטורי הספציפי המעניין. פרטים על הריאגנטים, הפריימרים, הגשושיות והציוד ששימשו במחקר זה מפורטים בטבלת החומרים.
1. הכנת פתרונות מלאי
הערה: הכן את כל פתרונות המלאי הדרושים לדילול דגימות בתחנת עבודה PCR כדי למנוע זיהום מ- DNA זר.
- הכן מאגר בדיקת PCR 10x, המורכב מ- 500 mM של KCl, 100 mM של Tris-HCl, 15 mM של MgCl2 ו- 0.01% (w/v) BSA. למדוד את ה- pH של הפתרון ולהתאים אותו ל 8.3.
הערה: ניתן לשמור פתרון זה בטמפרטורת החדר עד חודש אחד. - הכינו את מאגר דילול AAV, המורכב ממאגר בדיקת PCR 1x, DNA גזוז זרע סלמון 0.2 ng/μL (sss) ו-F-68 פלורוני 0.1%. הפוך פתרון זה טרי עם כל בדיקה ולשמור אותו על 4 ° C.
הערה: אם F-68 פלורוני אינו זמין, ניתן להשתמש בחלופה כגון פולוקסמר 188 פעילי שטח לא יוניים.
2. הכנת דגימות - טיפול DNase I ודילול סדרתי
הערה: על מנת להסיר מזהמי DNA שעלולים להוריד את הדיוק של טיטרציית הגנום הווקטורי, ניתן להסיר DNA חופשי שנמצא בדגימת AAV (כולל DNA פלסמיד שנותר או גנומים נגיפיים שאינם עטופים) לפני הגברת PCR באמצעות DNase. זה אפשרי מכיוון שהגנומים הווקטוריים עטופים בתוך קפסידים AAV ולכן אינם נגישים עד לשלב הדנטורציה של תגובת ה-PCR עצמה (ראה שלב 5). יתר על כן, מכיוון שמספר הגנום הווקטורי בכל דגימה נתונה אינו ידוע, יש צורך לבצע דילול סדרתי של הדגימות כדי להבטיח שהמדידות יישארו בגבולות העליונים והתחתונים הניתנים לגילוי. בצע את כל המניפולציות לדוגמה בתחנת עבודה PCR. יש לשמור את כל הדגימות על קרח אלא אם צוין אחרת.
- ערבבו את דגימת ה-AAV שנבחרה לניתוח על ידי ערבול קצר ולאחר מכן צנטריפוגה כדי להבטיח שכל הנוזלים יישארו בתחתית הצינור המכיל את הדגימה.
- לטיפול ב-DNase, יש להוסיף 45 μL של תמיסה המכילה 1x DNase I buffer, 0.1% פלורוני F-68 ו-0.04 U/μL DNase I במים נטולי DNase לתוך צינור פס PCR בעל 8 צינורות.
- העבר 5 μL של דגימה לתוך הצינור המכיל את תמיסת DNAse. מערבלים את הדגימות וצנטריפוגות לזמן קצר כדי להבטיח שכל הנוזל נשאר בתחתית.
- ב thermocycler, לדגור את הדגימות במשך 1 שעה ב 37 ° C, ולאחר מכן להתקרר עד 4 °C (75 °F). מניחים על קרח בהקדם האפשרי לאחר 4 °C (75 °F).
- באמצעות רצועת 8 צינוריות PCR טרייה של 0.2 מ"ל, בצע דילולים מתאימים של הדגימה שטופלה ב- DNase במאגר דילול AAV. דילולי הדגימה המומלצים תלויים בטיטר VG הצפוי (טבלה 2), אך שואפים לפחות ל-2 דילולים שונים לכל דגימה ומריצים כל דילול בכפילות. הקפד לערבל בקפדנות (2,000-3,000 סל"ד) את הדגימות במשך 5 שניות לפני הוצאת נפח כלשהו.
- לאחר דילול סדרתי, מערבלים את הדגימות והצנטריפוגה כדי להבטיח שכל הנוזל יישאר בתחתית הצינורות.
- כלול בקרה חיובית של איזה טיטר vg ידוע, ובקרה שלילית (מאגר דילול AAV בלבד) המכונה גם פקד ללא תבנית (NTC).
הערה: הבקרה החיובית יכולה להיות AAV המיוצר בתוך החברה או חומר ייחוס AAV מסחרי, הכולל את רצף המטרה של הפריימרים/הגשושית.
3. הכנת תערובת מאסטר dd_PCR
הערה: בחר רצף מטרה מתאים בתוך הגנום הווקטורי ותכנן פריימר קדמי, פריימר הפוך ובדיקות הידרוליזה המסומנות בפלואורופורים FAM או HEX reporter בהתאם להנחיות שפורסמו13. פריימרים המכוונים לטרנסגן מועדפים על פני פריימרים המכוונים ל-ITR מכיוון שהטרנסגן ספציפי לעיצוב הגנום הווקטורי, והמבנה המשני הקשור להיווצרות סיכות השיער של ה-ITR יכול לעכב קשירת פריימר יעילה. יתר על כן, פריימרים של ITR עשויים להעריך יתר על המידה טיטרים AAV אם קיימים קפסידים מלאים חלקית המכילים קטעי גנום וקטורי קטוע ועדיין מכילים אחד מרצפי ITR14. הכינו את תערובת האב dd_PCR בתחנת עבודה ייעודית ונפרדת (חדר טרום PCR). חדר זה צריך להיות נפרד מזה שבו הדגימות מוכנות כדי למנוע זיהום צולב.
- אפשר לפריימר, לבדיקה ולריאגנטים dd_PCR של סופרמיקס להגיע לטמפרטורת החדר (20-25 מעלות צלזיוס). לאחר מכן, מערבלים את כל הריאגנטים וצנטריפוטים קצרים את הצינורות כדי לאסוף את כל הנוזלים בתחתית הצינור.
- הכינו נפח של תערובת מאסטר dd_PCR בצינור מיקרוצנטריפוגה נפרד בהתאם למספר התגובות הנדרש על ידי שילוב הפריימרים קדימה ואחורה, גשוש, סופרמיקס dd_PCR ומים נטולי DNase בהתאם לנפחים ולריכוזים המתוארים בטבלה 3.
- מערבבים את תערובת האב ולאחר מכן צנטריפוגות לזמן קצר את הצינור כדי להבטיח שכל הנוזל נשאר בתחתית הצינור.
הערה: הכינו תמיד נפח נוסף של תערובת מאסטר dd_PCR מהנדרש (n + 1) כדי להסביר אובדן נפח צנרת.
- מערבבים את תערובת האב ולאחר מכן צנטריפוגות לזמן קצר את הצינור כדי להבטיח שכל הנוזל נשאר בתחתית הצינור.
- העבר 19.8 μL של תערובת האב לתוך כל צינור על 0.2 מ"ל PCR טרי 8-צינור רצועה.
4. יצירת טיפות
הערה: דגימות ומיקס מאסטר dd_PCR מעורבבים בנפרד לפני הטעינה למחסנית המייצרת טיפות. בצע את כל המניפולציות בתחנת עבודה PCR, רצוי שונה מהמקום שבו הוכנו הדגימות, כדי למנוע זיהום אמפליקון. לחלופין, נקו היטב את תחנת העבודה PCR לאחר הכנת הדגימות.
- העבר 2.2 μL של הדגימה המדוללת לנפח 19.8 μL של תערובת האב dd_PCR בכל צינור של רצועת 8 צינורות PCR וערבב היטב. מערבולת וצנטריפוגה קצרה כדי להבטיח שכל הנוזל יישאר בתחתית.
- העבר 20 μL של פתרון זה לתוך הבארות הכלולות בשורה האמצעית "דגימה" של מחסנית המייצרת טיפות. הימנע מבועות במחסנית המייצרת טיפות; זה יכול לגרום למכשיר לתת שגיאות, וטיפות לא ייווצרו.
הערה: מכיוון שהמחסניות הן בפורמט 8 בארות, וכך גם רצועות צינור PCR, מומלץ להשתמש בפיפט בן 8 ערוצים. - העבר 60 μL של נפט ייצור טיפות לבארות הכלולות בשורה התחתונה "נפט" של מחסנית ייצור טיפות.
הערה: לעולם אל תשאיר באר של המחסנית המייצרת טיפות ריקה; מלא היטב את הדגימה הריקה בבקרת מאגר dd_PCR עבור בדיקות (עם הנפח המתאים שתואר לעיל). - מניחים אטם גומי מעל המחסנית המייצרת טיפות ומניחים אותו במחולל הטיפות.
- לאחר יצירת הטיפות, השתמש פיפטה 8 ערוצים כדי להעביר לאט 42.5 μL פתרון משבב dd_PCR לצלחת PCR רב באר.
הערה: פיפטה לאט ובזווית של 45 מעלות כדי למנוע חיתוך טיפות בנוזל בזמן פיפט. בדוק חזותית את הצלחת כך שכל הבארות מלאות באותה כמות של נוזל וטיפות נראות כשכבה אטומה בבאר. - אטמו את הצלחת עם כיסוי רדיד אלומיניום במכונה לאיטום חום למשך 5 שניות ב-180°C.
הערה: בדוק חזותית שכל הבארות אטומות. אם לא, חזור על 5 שניות נוספות ב- 180 מעלות צלזיוס. ניתן לשמור את הצלחת האטומה עד 4 שעות ב-4°C לפני הגברה dd_PCR במחזור תרמי.
5. הגברה dd_PCR
הערה: יש למקם את המחזור התרמי בחדר נפרד מחדר טרום PCR כדי להפריד מרחבית פעילויות טרום PCR מהגברת PCR ולהימנע מתוצאות חיוביות כוזבות עקב זיהום אמפליקון.
- הניחו את הצלחת במחזור תרמי (עם מודול תגובת באר בעומק 96) להגברת PCR וסגרו אותה היטב.
- הגדר את thermocycler לפעול בתנאים המתוארים בטבלה 4 ובנפח תגובה של 40 μL. כלול שלב חימום מראש בהגדרות התוכנית וודא שהמכסה מחומם ל- 99 ° C.
- כאשר תוכנית ה-PCR מסתיימת, יש לשמור את הצלחת בטמפרטורה של 4°C למשך 15 דקות לפחות כדי להבטיח שהצלחת תתקרר במלואה.
הערה: ניתן לשמור את הצלחת במשך 48-72 שעות ב 4 ° C לפני שיש לקרוא את הטיפות.
6. קריאת טיפות
- טען את הצלחת לקורא טיפות, הזן את המידע הבא בתוכנת המערכת והמשך בקריאה.
הערה: סוג ניסוי = כימות ישיר; Supermix = dd_PCR supermix עבור בדיקות (ללא dUTP); סוג Assay = יעד יחיד לכל ערוץ; מידע יעד, ערוץ אות 1 = ערוץ FAM או ערוץ HEX בהתאם לבדיקה המשומשת. - הוסף ביאורים לדוגמאות כדי שניתן יהיה לקבוע ולזהות ביעילות את המיקום של כל דגימה מתוך קובץ הנתונים.
7. ניתוח נתונים
- בצע את ניתוח הנתונים באמצעות התוכנה התואמת שסופקה על ידי יצרן קורא הטיפות.
- לבצע בדיקת התאמה למערכת כדי להעריך את הביצועים הכוללים (ולכן, אמינות) של הבדיקה.
- בדוק את ספירת האירועים (מספר הטיפות) שנמדדו עבור כל באר בלוח ה- PCR. באופן אידיאלי, מספר האירועים הוא בין 15,000 ל -20,000. אם ספירת האירועים היא <10,000, יש להוציא ערך זה מהניתוח.
- הערך את תרשים המשרעת 1D או 2D ובדוק נוכחות של גשם טיפתי.
- עבור אל כרטיסיית טבלת הנתונים וייצא את הנתונים לקובץ Excel.
- חשב vg titer לפי השלבים הבאים:
- טווח העבודה של dd_PCR הוא 10-10,000 עותקים/μL. אל תכלול כל ערך שהוא <10 עותקים/μL מהניתוח. הטווח המומלץ עבור ציוד dd_PCR המשמש כאן הוא 25-5000 עותקים/μL.
הערה: תוכנת ניתוח הנתונים תספק מספר גנום וקטורי בהתאם לנפח תגובת ה-PCR (40 μL), אך הדבר אינו לוקח בחשבון את גורמי הדילול המופעלים במהלך הכנת הדגימה. - חישוב המדגם vg titer לכל נפח (מבוטא בדרך כלל כ- vg/mL) על ידי שקלול גורמי הדילול השונים לאורך הכנת הדגימה באמצעות היחס הבא:
הערה: ריכוז (ערך שהתקבל מניתוח נתונים) x 10 (דילול DNase I לפני הטיפול) x 10 (דילול תערובת מאסטר PCR) x 1000 (μL עד mL) דילול מדגם נבחר (במאגר דילול AAV - לדוגמה, טבלה 2). - חישוב מקדם השונות (%CV) בין העותקים המשוכפלים ובין הדילולים השונים של אותו מדגם.
הערה: %CV מחושב על ידי חלוקת סטיית התקן בממוצע. אם %CV בין הדילולים השונים הוא >20%, הערך לא צריך להיחשב מדויק. - בדוק את ערכי הבקרה השלילית והחיובית. הבקרה השלילית צריכה להיות פחות מ- 5 עותקים/μL.
- טווח העבודה של dd_PCR הוא 10-10,000 עותקים/μL. אל תכלול כל ערך שהוא <10 עותקים/μL מהניתוח. הטווח המומלץ עבור ציוד dd_PCR המשמש כאן הוא 25-5000 עותקים/μL.
Representative Results
ניתן להמחיש את התוצאות באמצעות תוכנה מתאימה. עבור כל באר, תרשים המשרעת 1D מציג את כל הטיפות ביחס למשרעת שלהן. צפויה הפרדה ברורה בין טיפות חיוביות לשליליות. אם יותר מ-10% מכלל הטיפות נמצאות בין ענני הטיפות החיוביות והשליליות (תופעה המכונה גשם טיפתי), יש צורך למדוד מחדש את הדגימה (ראו איור 1). מידע נוסף על גשם טיפתי זמין בדיון.
ניתן ליצור טבלת נתונים כדי לסכם את כל המידע המוקלט, כולל שם המדגם, מספר הטיפות המקובלות (ספירת אירועים) וריכוז (עותקים/μL). באופן אידיאלי, מספר האירועים צריך להיות בין 15,000 ל -20,000 טיפות מקובלות. אם ספירת האירועים עבור באר נמוכה מ- 10,000, יש לא לכלול את נקודת הנתונים בניתוח. דוגמה לנתוני הפלט מובאת בטבלה 5.
ניתן לחשב את טיטר vg על בסיס הריכוז (עותקים/μL), תוך התחשבות בדילול דגימה. טווח העבודה של dd_PCR הוא 10-10,000 עותקים/μL. יש לא לכלול בניתוח ערכים מתחת ל-10 עותקים/μL. יש לחשב את titer vg עבור דגימות, כמו גם את הבקרות החיוביות והשליליות. הערך הנמדד של הבקרה החיובית צריך להיות בעל מקדם שונות (%CV) נמוך מ-20% ביחס לערך התיאורטי. הבקרה השלילית צריכה להיות קטנה מ- 5 עותקים/μL. בנוסף, יש לחשב את %CV בין חזרות ודילולים שונים עבור כל דגימה. אם %CV בין דילולים שונים עולה על 20%, הערך עשוי להיחשב לא מדויק, וייתכן שיהיה צורך למדוד מחדש את הדגימה.
מדידה מוצלחת מאופיינת בהפרדה ברורה בין ענני הטיפות החיוביות והשליליות, לפחות 10,000 טיפות מקובלות, ערך בין 10 עותקים/μL ל-10,000 עותקים/μL, ו-%CV בין חזרות הנמוכות מ-20%.
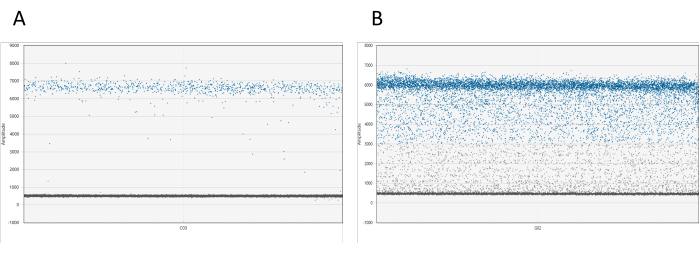
איור 1: הדמיה של dd_PCR טיפות. (A) תרשים המשרעת ה-1D מדגים הפרדה ברורה בין טיפות חיוביות ושליליות, דבר המצביע על חלוקת טיפות מוצלחת. (B) העלילה מראה הפרדה גרועה של טיפות חיוביות ושליליות, המכונה גשם טיפתי, מה שמרמז על חלוקה לא אופטימלית או בעיות פוטנציאליות עם הבדיקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
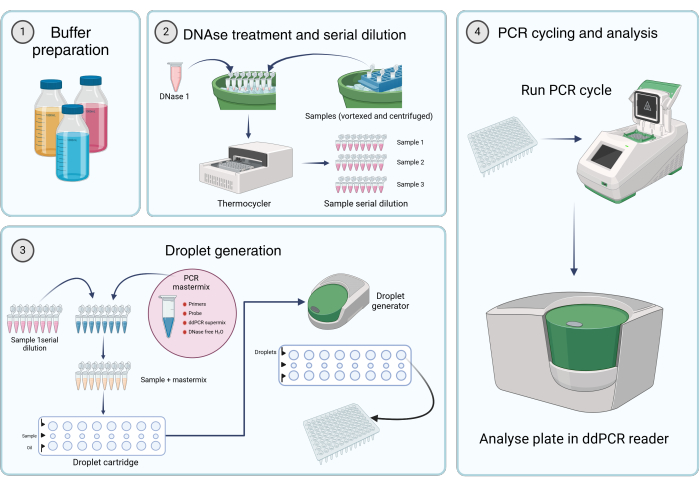
איור 2: זרימת עבודה לכימות גנומים נגיפיים באמצעות PCR טיפתי דיגיטלי. (1) חוצצים, ריאגנטים ותמיסות מוכנים בהתאם להוראות היצרן או לשלב 1 של הפרוטוקול (הכנת פתרונות מלאי). (2) 45 μL של תמיסת DNase I מחוברת לכל צינור של רצועת PCR בעלת 8 צינורות. לאחר ערבול וצנטריפוגה קצרה של הדגימות, מתווסף 5 μL של הדגימה לאחד הצינורות. ה- DNase I ורצועת PCR המכילה דגימה המכילה שמונה צינורות מודגרים בתרמוסייקלר למשך שעה אחת ב- 37 מעלות צלזיוס, ולאחר מכן דילול סדרתי של הדגימות. (3) תערובת המופת של PCR מוכנה כמתואר, ו-19.8 μL מוכנס לכל צינור של רצועת PCR בעלת 8 צינורות. דילולים טוריים לדוגמה משלב 2 מתווספים לתערובת המאסטר. 20 μL של mastermix פלוס
פתרון לדוגמה נטען לשורה האמצעית של המחסנית, ו 60 μL של נפט דור טיפות מועבר לבארות התחתונות של מחסנית המייצרת טיפות. לאחר מכן המחסנית ממוקמת בגנרטור הטיפות ופועלת בהתאם לתנאים שצוינו. לאחר יצירת טיפות, 42.5 μL מהשורה העליונה של המחסנית מועבר צלחת PCR רב באר. (4) לוחית ה-PCR נטענת לתוך תרמוסייזר PCR ופועלת בהתאם לתנאים הקבועים. הצלחת מנותחת באמצעות קורא dd_PCR. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: נתונים מדויקים. טבלה זו מציגה נתונים מדויקים מארבע קבוצות של דגימות בקרת איכות (QC), שבכל אחת מהן חמישה ריכוזים (QC1-QC5). כל QC נמדד חמש פעמים. מקדם השונות (%CV) בין ריצות שונות, המייצג חזרתיות (A), ובין קבוצות שונות של דגימות, המייצגות דיוק ביניים (B), מוצג. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: דילולים לדוגמה. הטבלה מציגה את דילול הדגימות המומלץ בהתבסס על טיטר הגנום הנגיפי הצפוי (vg/mL). בסך הכל מומלץ לבצע שלושה דילולים כדי להבטיח שלפחות שני ערכים נמצאים בטווח העבודה של הבדיקה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: dd_PCR הרכב תערובת ראשי. טבלה זו מתארת את הרכב תערובת האב dd_PCR, הכוללת פריימר קדימה ואחורה (909 ננומטר), בדיקה (227 ננומטר) וסופרמיקס dd_PCR עבור בדיקות (ללא dUTP, 1x). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: תנאי תרמו-מחזור. הטבלה מפרטת את תוכנית ה-PCR המומלצת, הכוללת: (1) דגירה של 10 דקות ב-95°C להפרעה בקפסיד והפעלת אנזים, (2) 40 מחזורים של 30 שניות ב-94°C לדנטורציה של DNA, ודקה אחת ב-60°C לחישול והארכה, (3) דגירה של 10 דקות ב-98°C לנטרול אנזימים, ו-(4) החזקה בטמפרטורה של 4°C. טמפרטורת החישול עשויה לדרוש אופטימיזציה בהתבסס על ערכת הפריימר/בדיקה שבה נעשה שימוש. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: דוגמה לנתוני פלט מריצת AAV בפועל. הטבלה מספקת דוגמה לנתוני פלט מריצת AAV בפועל, שבה מדגם אחד נמדד בשני דילולים שונים, כל אחד בכפילות. טיטר הגנום הנגיפי (vg) (ב- vg/mL) מחושב באמצעות הנוסחה הבאה: 10 (DNase I לפני הטיפול) x 10 (דילול בתערובת האב) x 1,000 (μL עד mL) x דילול במאגר דילול AAV. STDEV מייצג סטיית תקן, ו- CV מציין את מקדם השונות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
כימות מדויק של עותקי גנום וקטורי AAV בהכנות וקטוריות חיוני לפיתוח מוצרי ריפוי גנטי מבוססי AAV. קיימות מספר שיטות לקביעת טיטר vg, כאשר PCR כמותי (qPCR) dd_PCR הן שתי הטכניקות הנפוצות והמקובלות ביותר. dd_PCR מועדף לעתים קרובות על פני qPCR בשל עצמאותו מיעילות הגברה, דיוק גבוה יותר ועמידות גבוהה יותר15. פרוטוקולים רבים לטיטרציה של גנום וקטורי על ידי dd_PCR זמינים בספרות, כל אחד עם שיטות הכנת דגימה משלו 15,16,17. עם זאת, חסר פרוטוקול קונצנזוס מוסמך. מאמר זה מציג פרוטוקול dd_PCR מאומת לכימות גנומים וקטוריים AAV בדגימות וקטוריות מטוהרות (איור 2).
תשומת לב רבה לטיפול בדגימות היא קריטית בעת ביצוע פרוטוקול זה. זיהום צולב יכול להוות אתגר משמעותי בהערכה מדויקת של טיטרים vg; לכן, הדגימות מעובדות בצורה הטובה ביותר תחת תחנת עבודה PCR כדי למנוע זיהום עם DNA זר. בנוסף, ביצוע נכון של דגירה DNase הוא חיוני כדי לחסל DNA מזהם לא ארוז מבלי לשבש את הקפסיד ואולי לעכל את הגנום הווקטורי הארוז. פרוטוקולים רבים כוללים נטרול חום וטיפול בפרוטאינאז K 16,17,18. עם זאת, במהלך פיתוח השיטה בתוך הבית, נמצא כי חימום מוגזם מזיק לטיטרציה vg, וטיפול בפרוטאינאז K היה מיותר (הנתונים לא הוצגו).
ככל dd_PCR הופך פופולרי יותר ויותר לכימות גנומים נגיפיים, היצרנים פרסמו מדריכי יישום מפורטים עם הנחיות לתכנון ואופטימיזציה של מבחני dd_PCR19. מידע לפתרון בעיות זמין גם כן. בפועל, כאשר הבדיקה מתוכננת נכון, הבעיות השכיחות ביותר כוללות גשם טיפות וספירת טיפות נמוכה. גשם טיפתי נגרם לעתים קרובות על ידי נגישות לקויה של פריימר/בדיקות לאמפליקון, אך מספר אסטרטגיות יכולות לטפל בבעיה זו. לדוגמה, ניסוי שיפוע טמפרטורה יכול לעזור לקבוע את טמפרטורת החישול האופטימלית. בנוסף, דילול דגימות כדי להוריד את כמות הדנ"א (מומלץ להיות פחות מ-66 ננוגרם) או ביצוע תקציר הגבלה עם אנזימים ספציפיים שחותכים מחוץ לאזור האמפליקון יכולים לשפר את נגישות התבנית. המלצה של 10 U של אנזים הגבלה לכל מק"ג של DNA היא בדרך כלל יעילה. הבעיה של ספירת טיפות נמוכה (פחות מ -10,000) נובעת לעתים קרובות מצנרת לקויה של הדגימה והשמן במחסניות. מומלץ לבצע פיפטינג איטי עם טיפים מתאימים כדי למנוע גזירה של הטיפות. בעוד שמבחן dd_PCR הוא חזק, מגבלה אחת היא הזמן הממושך לתוצאה. התהליך מטיפול לדוגמה לקריאת טיפות לוקח מספר שעות, מה שיכול להיות חיסרון כאשר התוצאות נדרשות במהירות.
כימות מדויק של עותקי גנום AAV בהכנות וקטוריות נחוץ לאורך כל שלבי מחזור החיים של הטיפול הגנטי AAV. באופן ספציפי, חשוב לייעל תהליכי ייצור וטיהור, ביצוע מחקרים פרה-קליניים וקביעת מינונים קליניים עבור מוצרי ריפוי גנטי מבוססי AAV. פרוטוקול dd_PCR המוצג כאן ישים באופן נרחב וניתן להשתמש בו על מוצרי AAV מטוהרים עם סרוטיפים וטרנסגנים שונים.
Disclosures
IVH, BM ו-EH הם מייסדים משותפים של Tavira Therapeutics. המחברים האחרים מצהירים כי אין ניגוד עניינים.
Acknowledgements
מחקר זה התאפשר הודות לסבסוד "חוסן פלנדריה" מהממשלה הפלמית, שמקורו ב"מתקן ההתאוששות והחוסן האירופי" (RRF) (VV021/13). איור 2 נוצר באמצעות Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 8-channel pipette 10 µL | Eppendorf | 3,12,50,00,010 | |
| 8-channel pipette 200 µL | Eppendorf | 3,12,50,00,036 | |
| 8-channel pipette 300 µL | Eppendorf | 3,12,50,00,052 | |
| 8-well PCR strip | Sarstedt | 72.991.002 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| C1000 Touch Thermal Cycler with 96–Deep Well Reaction Module | Bio-Rad | 1851197 | |
| ddPCR Buffer Control for Probes 9 mL (2 x 4.5 mL) | Bio-Rad | 1863052 | |
| ddPCR Supermix for Probes (No dUTP) (2 x 1 mL) | Bio-Rad | 1863023 | |
| ddPCR 96-Well Plates (pkg of 25) | Bio-Rad | 12001925 | |
| ddPCR Droplet Reader Oil (2 x 1L) | Bio-Rad | 1863004 | |
| DG8 Cartridge Holder | Bio-Rad | 1863051 | |
| DG8 Cartridges for QX200/QX100 (pkg of 24) | Bio-Rad | 1864008 | |
| DG8 Gaskets for QX200/QX100 (pkg of 24) | Bio-Rad | 1863009 | |
| DNase I (10U/µL) + buffer | Roche | 4716728001 | |
| Droplet Generation Oil for Probes (10 x 7 mL) | Bio-Rad | 1863005 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 0.1-10 μL, 34 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078500 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 20-300 μL, 55 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078560 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 2-100 μL, 53 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078543 | |
| Forward lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Forward primer: 5'-GAACGGCATCAAGGTGAACT-3' | |
| Lyopohilized probe and master stock at 100 µM | IDT | GFP as target sequence. PrimeTime Eco Probe: /56-FAM/CAAGATCCG/ZEN/CCACAACATCGAGGA/3IABkFQ/ | |
| Magnesium Chloride (MgCl2) | Chemlab Analytical | CL00.1381 | |
| Nuclease free water | IDT | 11-04-02-01 | |
| PCR Plate Heat Seal, foil, pierceable (pkg of 100) | Bio-Rad | 1814040 | |
| Pluronic F-68 non-ionic surfactant (100x) | Thermo Fisher Scientific | 24040032 | |
| Potassium Chloride (KCl) | Honeywell research chemicals | 31248 | |
| QX manager software | Bio-Rad | Software to analyse ddPCR data | |
| QX200 Droplet Generator | Bio-Rad | 1864002 | |
| QX200 Droplet Reader | Bio-Rad | 1864003 | |
| Reagent reservoir | VWR | 613-1181 | |
| Reverse lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Reverse primer: 5'-TGCTCAGGTAGTGGTTGTCG-3' | |
| SafeSeal reaction tube, 1.5 mL | Sarstedt | 72.706.200 | |
| Salmon Sperm DNA, sheared (10 mg/mL) | Thermo Fisher Scientific | AM9680 | |
| TE buffer | IDT | Accompanied by primers when ordering | |
| Tris hydrochloride (Tris-HCl) | Roche | 10812846001 |
References
- Balakrishnan, B., Jayandharan, G. R. Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther. 14 (2), 86-100 (2014).
- Srivastava, A. In vivo tissue-tropism of adeno-associated viral vectors. Curr Opin Virol. 21, 75-80 (2016).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Gimpel, A. L., et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 20, 740-754 (2021).
- Brimble, M. A., et al. Preventing packaging of translatable P5-associated DNA contaminants in recombinant AAV vector preps. Mol Ther Methods Clin Dev. 24, 280-291 (2022).
- Wright, J. F. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, (2019).
- Sidransky, D., et al. Identification of ras oncogene mutations in the stool of patients with curable colorectal tumors. Science. 256 (5053), 102-105 (1992).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci USA. 96 (16), 9236-9241 (1999).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem. 84 (2), 1003-1011 (2012).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods Mol Biol. 1950, 51-83 (2019).
- . Planning droplet digital PCR experiments Available from: https://www.bio-rad.com/en-in/life-science/learning-center/introduction-to-digital-pcr/planning-ddpcr-experiments (2024)
- Dorange, F., Le Bec, C. Analytical approaches to characterize AAV vector production & purification: Advances and challenges. Cell Gene Ther Insights. 4 (2), 119-129 (2018).
- Lock, M., et al. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Ther Methods. 25 (2), 115-125 (2014).
- Prantner, A., Maar, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18 (1), e0280242 (2023).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570 (2019).
- Suoranta, T., Laham-Karam, N., Yla-Herttuala, S. Optimized protocol for accurate titration of adeno-associated virus vectors. Hum Gene Ther. 32 (19-20), 1270-1279 (2021).
- Droplet digital PCR applications guide. Bulletin 6407 Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6407.pdf (2024)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved