Количественная оценка аденоассоциированных вирусных геномов в очищенных образцах векторов методом цифровой капельной полимеразной цепной реакции
In This Article
Summary
Точное количественное определение копий векторного генома аденоассоциированного вируса (AAV) имеет решающее значение, но стандартизированный протокол еще не разработан. В этом протоколе описан валидированный метод подготовки очищенных образцов AAV и проведения цифровой капельной полимеразной цепной реакции (dd_PCR) для надежного количественного определения титра вирусного генома.
Abstract
Аденоассоциированный вирус (AAV) является непатогенным вирусом, используемым в качестве средства доставки для передачи терапевтических генов пациентам. Точное количественное определение числа копий генома AAV в векторных препаратах имеет важное значение для оптимизации биопроцессов и расчета дозировки как в доклинических, так и в клинических исследованиях продуктов генной терапии на основе AAV. В настоящее время отсутствует консенсусный протокол для титрования вирусного генома AAV. В данной работе мы представляем протокол цифровой капельной ПЦР (dd_PCR) для количественной оценки вирусных геномов в очищенных векторных образцах. Образцы обрабатывают ДНКазой I для удаления неупакованной загрязняющей ДНК. Затем обработанные ДНКазой образцы смешиваются с соответствующим набором праймер-зондов (разработанным в соответствии с целевым геномом AAV) и реагентами ПЦР, а затем загружаются в генератор капель. Подготовленные капли переносят в ПЦР-планшет, где проводят ПЦР-амплификацию и анализ. Титр вирусного генома рассчитывается на основе концентрации (копий/мкл) с учетом разведений образца. Успешное измерение показывает четкое разделение положительных и отрицательных капельных облаков, имеет не менее 10 000 принятых капель, показывает значение от 10 копий/мкл до 10 000 копий/мкл и имеет коэффициент вариации (CV) между повторами менее 20%. Надежное титрование вирусного генома поможет в разработке безопасных и эффективных продуктов генной терапии на основе AAV.
Introduction
Генная терапия — это терапевтический метод, обычно используемый для лечения генетических заболеваний. Дизайн любой конкретной генной терапии специфичен для ассоциированной патологии целевого показания, но все генные терапии включают внутриклеточную доставку генетического материала к клеткам-мишеням с целью достижения терапевтическогоэффекта. Генную терапию можно разделить на несколько категорий, включая замену генов при мутациях, приводящих к потере функции, подавление экспрессии генов при аномалиях усиления функции и методы редактирования генов. Независимо от конкретной используемой стратегии, терапевтический материал нуклеиновой кислоты (называемый трансгеном) должен быть упакован в вектор для достижения целенаправленной внутриклеточной доставки.
Несмотря на то, что для разработки генной терапии доступно множество вирусных и невирусных векторных систем, аденоассоциированные вирусы (AAV) часто выбирают из-за широкого вирусного тропизма и низкой иммуногенности, связанных с этой группой вирусов. На сегодняшний день семь методов генной терапии, использующих AAV для терапевтической доставки генов, получили одобрение Европейского агентства по лекарственным средствам (EMA) или Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и нацелены на заболевания, варьирующиеся от гемофилии (например, Roctavian) до спинальной мышечной атрофии (например, Zolgensma).
Производство генной терапии на основе AAV проистекает из понимания самого AAV дикого типа. AAV — это небольшой ДНК-вирус из семейства Parvoviridae, включающий 13 основных серотипов (AAV1-13)3. Геном AAV состоит из одноцепочечной молекулы ДНК размером ~4,7 kb, содержащей две основные открытые рамки считывания (ORF), которые кодируют основные вирусные гены, необходимые для репликации генома, сборки капсида и упаковки (rep, cap). Вирусный геном фланкирован как на 5', так и на 3'-концах палиндромными нуклеотидными последовательностями, называемыми инвертированными концевыми повторами (ITR). Эти ITR образуют шпилькообразные структуры, которые играют решающую роль в репликации генома и упаковке вирусных геномов de novo во вновь синтезированные вирусные капсиды. AAV является хелпер-зависимым вирусом и, следовательно, требует экспрессии вспомогательных генов других вирусов, таких как вирус простого герпеса (ВПГ) или аденовирус (AdV), чтобы стать компетентным в репликации1.
Для получения AAV используют подходящую клеточную систему экспрессии, способствующую экспрессии вирусных белков капсида и последующей сборке в вирусные частицы de novo, с последующей инкапсуляцией выбранного трансгена с ITR-флангом (также называемого векторным геномом). В этом способе обычно используется тройная плазмидная система, содержащая (1) плазмиду, содержащую хелперные гены, полученные от вируса-хелпера, (2) плазмиду, кодирующую основные вирусные элементы (rep/cap), и (3) плазмиду, несущую кассету терапевтической экспрессии (обычно называемую транспортной плазмидой)4. Уникальное присутствие сигналов упаковки с инвертированным концевым повтором (ITR), фланкирующих кассету терапевтической экспрессии в транспортной плазмиде, обеспечивает специфическую упаковку трансгена, в то время как вирусные гены, присутствующие на других плазмидах, в основном исключаются. Котрансфекция этой трехплазмидной системы в клеточную платформу экспрессии (обычно HEK293T клеток) приводит к получению трансдукционно-компетентных вирусных частиц с дефицитом репликации, пригодных для использования в генной терапии 3,4.
Существует ряд критических характеристик качества (CQA), связанных с производством генной терапии на основе AAV, которые должны быть оценены для обеспечения эффективности, чистоты и безопасности предполагаемого лекарственного препарата4. Эти CQA включают титр вируса, содержание капсида и агрегацию. Титр вируса сам по себе представляет собой комбинацию количества вирусных частиц (титра капсида) и количества векторных геномов (титров векторного генома), присутствующих в любом данном препарате. В идеале соотношение между этими двумя титрами должно быть 1:1, поскольку каждая вирусная частица должна содержать один векторный геном, но неэффективность упаковки векторного генома во время биосинтеза приводит к совместному производству пустых или частично заполненных капсид (содержащих частичные векторные последовательности генома и/или невекторные последовательности генома)5. Присутствие таких примесей потенциально может вызывать необоснованные иммунные реакции и конкурировать за сайты связывания переносчиков, тем самым увеличивая риск иммунотоксичности и снижая скорость трансдукции полныхкапсидов6. Таким образом, точное количественное определение геномов AAV имеет важное значение для установления титра вируса и содержания капсида. Это влияет как на фундаментальные исследования, так и на индустрию генной терапии, которая требует точной дозировки для поддержания безопасности и эффективности лекарственных препаратов.
Цифровая капельная полимеразная цепная реакция (dd_PCR) стала тесно связана с количественной оценкой титра вируса, поскольку ее можно использовать для определения количества векторных геномов, присутствующих влюбом конкретном препарате. Сама цифровая ПЦР была впервые представлена в 1990-х годах 8,9 и dd_PCR является усовершенствованием этой технологии, позволяющим осуществлять высокопроизводительную обработку образцов10,11. В dd_PCR ПЦР-реакция объемом 20 мкл в реальном времени разбивается примерно на 20 000 капель в масляной оболочке, что дает до 96 таких реакций при размещении на стандартном 96-луночном планшете. По сравнению с обычной количественной ПЦР (кПЦР), dd_PCR имеет ряд преимуществ, включая повышенную чувствительность, повышенную точность и более прямое и абсолютное количественное определение целевых последовательностей без необходимости использования стандартных кривых. Кроме того, высокий уровень секционирования в dd_PCR снижает влияние ингибиторов ПЦР и сводит к минимуму вероятность смещения от преимущественной амплификации определенных шаблонов, что делает его привлекательным вариантом для аналитического измерения титрования векторного генома.
Protocol
Описанный здесь протокол предназначен для количественной оценки титра вирусного генома очищенного, собственного производства вектора AAV9 с зеленым флуоресцентным белком (GFP) в качестве трансгена12 с высокой точностью (Таблица 1). Тем не менее, этот протокол применим к любому серотипу AAV и любому дизайну векторного генома, при условии, что наборы праймеров/зондов предназначены для нацеливания на конкретный векторный геном, представляющий интерес. Подробная информация о реагентах, праймерах, зондах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Приготовление исходных растворов
ПРИМЕЧАНИЕ: Приготовьте все исходные растворы, необходимые для разведения образца, на рабочей станции ПЦР, чтобы избежать загрязнения чужеродной ДНК.
- Приготовьте 10-кратный буфер для ПЦР-анализа, который состоит из 500 мМ KCl, 100 мМ Tris-HCl, 15 мМ MgCl2 и 0,01 % (w/v) BSA. Измерьте pH раствора и отрегулируйте его до 8,3.
ПРИМЕЧАНИЕ: Этот раствор можно хранить при комнатной температуре до 1 месяца. - Приготовьте буфер для разведения AAV, который состоит из 1x буфера для ПЦР-анализа, 0,2 нг/мкл ДНК спермы лосося (sss) и 0,1 % плуронового F-68. Готовьте этот раствор свежим при каждом анализе и поддерживайте его при температуре 4 °C.
ПРИМЕЧАНИЕ: Если плуроновый F-68 недоступен, можно использовать альтернативу, такую как неионогенное поверхностно-активное вещество Poloxamer 188.
2. Подготовка образцов - обработка ДНКазой I и серийное разведение
ПРИМЕЧАНИЕ: Для удаления загрязнителей ДНК, которые могут снизить точность титрования векторного генома, свободная ДНК, присутствующая в образце AAV (включая оставшуюся плазмидную ДНК или неинкапсулированные вирусные геномы), может быть удалена перед амплификацией ПЦР с использованием ДНКазы. Это возможно, поскольку векторные геномы инкапсулированы в капсиды AAV и, следовательно, недоступны до стадии денатурации самой ПЦР-реакции (см. шаг 5). Кроме того, поскольку номер векторного генома в любом конкретном образце неизвестен, необходимо выполнить серийное разведение образцов, чтобы гарантировать, что измерения остаются в пределах верхнего и нижнего обнаруживаемых пределов. Все манипуляции с образцом выполняйте на рабочей станции ПЦР. Храните все образцы на льду, если не указано иное.
- Смешайте выбранный для анализа образец AAV, кратковременно сделав его вихревым, а затем центрифугируя, чтобы убедиться, что вся жидкость остается на дне пробирки, содержащей образец.
- Для обработки ДНКазой добавьте 45 мкл раствора, содержащего 1x буфер ДНКазы I, 0,1% плуроновой F-68 и 0,04 Ед/мкл ДНКазы I в воде, не содержащей ДНКазы, в 8-пробирочную полосковую пробирку ПЦР объемом 0,2 мкл.
- Перенесите 5 мкл образца в пробирку с раствором ДНКазы. Сделайте образцы вихревыми и кратковременно центрифугируйте, чтобы убедиться, что вся жидкость остается на дне.
- В термоамплификаторе инкубируйте образцы в течение 1 часа при 37 °C, затем охладите до 4 °C. Положите на лед как можно скорее после достижения 4 °C.
- Используя свежую 8-пробирочную полоску для ПЦР объемом 0,2 мл, сделайте соответствующие разведения образца, обработанного ДНКазой, в буфере для разведения AAV. Рекомендуемые разведения образца зависят от ожидаемого титра vg (Таблица 2), но стремитесь как минимум к 2 различным разведениям на образец и запускайте каждое разведение в двух экземплярах. Убедитесь, что вы тщательно (2 000-3 000 об/мин) перебрасываете образцы в течение 5 секунд, прежде чем извлекать какой-либо объем.
- После серийного разбавления пробы подвергаются вихревому охлаждению и центрифуге, чтобы убедиться, что вся жидкость остается на дне пробирок.
- Включите положительный контроль, для которого известен титр vg, и отрицательный контроль (только буфер разбавления AAV), который также называется контролем без шаблона (NTC).
ПРИМЕЧАНИЕ: Положительным контролем может быть AAV собственного производства или коммерческий эталонный материал AAV, который включает в себя целевую последовательность праймеров/зонда.
3. Приготовление мастер-микса dd_PCR
Примечание: Выберите подходящую последовательность-мишень в векторном геноме и спроектируйте прямой праймер, обратный праймер и гидролизные зонды, меченные репортерными флуорофорами FAM или HEX, в соответствии с опубликованнымирекомендациями. Праймеры, нацеленные на трансген, являются предпочтительными по сравнению с праймерами, нацеленными на ITR, поскольку трансген специфичен для дизайна векторного генома, а вторичная структура, связанная с формированием шпильки ITR, может препятствовать эффективному связыванию праймеров. Более того, праймеры ITR могут завышать титры AAV, если частично заполненные капсиды, содержащие усеченные фрагменты векторного генома, присутствуют и все еще содержат любую из последовательностей ITR14. Приготовьте dd_PCR мастер-смесь на отдельном рабочем месте (комнате для предварительного ПЦР). Это помещение должно быть отделено от того, где готовятся образцы, чтобы избежать перекрестного загрязнения.
- Дайте грунтовке, зонду и реагентам dd_PCR супермикс нагреться до комнатной температуры (20-25 °C). После этого нанесите вихревую обработку всех реагентов и кратковременно центрифугируйте пробирки, чтобы собрать всю жидкость на дне пробирки.
- Приготовьте объем dd_PCR мастер-смеси в отдельной микроцентрифужной пробирке в соответствии с необходимым количеством реакций, объединив прямой и обратный праймеры, зонд, dd_PCR супермикс и воду, не содержащую ДНКазы, в соответствии с объемами и концентрациями, описанными в таблице 3.
- Сделайте вортексом основную смесь, а затем кратковременно центрифугируйте пробирку, чтобы убедиться, что вся жидкость остается на дне пробирки.
ПРИМЕЧАНИЕ: Всегда подготавливайте дополнительный dd_PCR объем основной смеси, чем требуется (n + 1), чтобы учесть потерю объема пипетирования.
- Сделайте вортексом основную смесь, а затем кратковременно центрифугируйте пробирку, чтобы убедиться, что вся жидкость остается на дне пробирки.
- Перелейте 19,8 мкл мастер-смеси в каждую пробирку на свежую 8-пробирочную полоску объемом 0,2 мл ПЦР.
4. Генерация капель
ПРИМЕЧАНИЕ: Образцы и мастер-микс смешиваются отдельно перед загрузкой dd_PCR картридж, генерирующий капли. Все манипуляции выполняйте на рабочей станции ПЦР, желательно отличной от той, где были подготовлены пробы, во избежание загрязнения ампликоном. В качестве альтернативы можно тщательно очистить рабочую станцию ПЦР после подготовки образцов.
- Переведите 2,2 мкл разведенного образца в объем 19,8 мкл мастер-смеси dd_PCR каждую пробирку 8-пробирочной полоски для ПЦР и хорошо перемешайте. Сделайте вихревую и кратковременную центрифугирование, чтобы убедиться, что вся жидкость остается на дне.
- Перелейте 20 мкл этого раствора в лунки, расположенные в среднем ряду «образец» картриджа, генерирующего капли. Избегайте образования пузырей в картридже, генерирующем капли; Это может привести к тому, что прибор будет выдавать ошибки, и капли не будут генерироваться.
ПРИМЕЧАНИЕ: Поскольку картриджи имеют 8-луночный формат, как и полоски для ПЦР-пробирок, рекомендуется использовать 8-канальную пипетку. - Перекачайте 60 μл каплевидного масла в лунки, расположенные в нижнем «масляном» ряду картриджа, генерирующего каплю.
ПРИМЕЧАНИЕ: Никогда не оставляйте лунку картриджа, генерирующего капли, пустой; Заполните пустую лунку для образца dd_PCR буферным регулятором для зондов (с соответствующим объемом, описанным выше). - Наденьте резиновую прокладку на картридж, генерирующий капли, и поместите его в генератор капель.
- После того, как капли будут сгенерированы, с помощью 8-канальной пипетки медленно переведите 42,5 мкл раствора с dd_PCR чипа на многолуночный ПЦР-планшет.
ПРИМЕЧАНИЕ: Делайте пипетку медленно и под углом 45 градусов, чтобы избежать попадания капель в жидкость во время пипетирования. Визуально осмотрите пластину, чтобы все лунки были заполнены одинаковым количеством жидкости и капли были видны в виде непрозрачного слоя в лунке. - Запечатайте пластину крышкой из алюминиевой фольги в термосварочной машине в течение 5 секунд при температуре 180 °C.
ПРИМЕЧАНИЕ: Визуально убедитесь, что все колодцы герметизированы. Если нет, повторите еще 5 с при 180 °C. Герметичная пластина может храниться до 4 часов при температуре 4 °C перед dd_PCR амплификацией в термоамплификаторе.
5. Усиление dd_PCR
ПРИМЕЧАНИЕ: Термоамплификатор должен быть размещен в отдельной комнате от комнаты для предварительной ПЦР, чтобы пространственно отделить активность перед ПЦР от амплификации ПЦР и избежать ложноположительных результатов из-за загрязнения ампликоном.
- Поместите планшет в термоамплификатор (с реакционным модулем на 96 лунок) для амплификации ПЦР и надежно закройте его.
- Настройте амплификатор для работы в условиях, описанных в таблице 4 , и при реакционном объеме 40 μL. Включите в настройки программы этап предварительного нагрева и убедитесь, что крышка нагрета до 99 °C.
- Когда программа ПЦР будет завершена, держите планшет при температуре 4 °C не менее 15 минут, чтобы убедиться, что планшет полностью охлажден.
ПРИМЕЧАНИЕ: Пластину можно хранить в течение 48-72 часов при температуре 4 °C, прежде чем капли должны быть считаны.
6. Считывание капель
- Загрузите пластину в считыватель капель, введите следующую информацию в системное программное обеспечение и продолжите чтение.
ПРИМЕЧАНИЕ: Тип эксперимента = Прямая количественная оценка; Supermix = dd_PCR супермикс для зондов (без dUTP); Тип анализа = одна мишень на канал; Информация о цели, сигнальный канал 1 = канал FAM или HEX-канал в зависимости от используемого зонда. - Аннотируйте образцы таким образом, чтобы можно было определить и эффективно идентифицировать положение каждой выборки из файла данных.
7. Анализ данных
- Выполняйте анализ данных с помощью совместимого программного обеспечения, предоставленного производителем считывателя капель.
- Проведите испытание на пригодность системы для оценки общей производительности (и, следовательно, надежности) анализа.
- Проверьте количество событий (количество капель), измеренное для каждой лунки на ПЦР-планшете. В идеале количество мероприятий должно составлять от 15 000 до 20 000. Если количество событий равно < 10 000, то это значение должно быть исключено из анализа.
- Оцените график 1D или 2D амплитуды и проверьте наличие капельного дождя.
- Перейдите на вкладку таблицы данных и экспортируйте данные в файл Excel.
- Рассчитайте титр vg, выполнив следующие действия:
- Рабочий диапазон dd_PCR составляет 10-10 000 копий/мкл. Исключите из анализа любое значение, составляющее <10 копий/мкл. Рекомендуемый диапазон для используемого здесь оборудования dd_PCR составляет 25-5000 копий/мкл.
ПРИМЕЧАНИЕ: Программное обеспечение для анализа данных предоставит номер векторного генома в соответствии с объемом ПЦР-реакции (40 μл), но при этом не учитываются коэффициенты разбавления, применяемые во время подготовки образца. - Рассчитайте титр vg образца на объем (обычно выражаемый как vg/мл) с учетом различных коэффициентов разбавления в процессе подготовки образца с использованием следующего соотношения:
ПРИМЕЧАНИЕ: Концентрация (значение, полученное в результате анализа данных) x 10 (разведение ДНКазы I перед обработкой) x 10 (разведение мастер-смеси ПЦР) x 1000 (от μл до мл) выбранного разведения образца (в буфере для разведения AAV - например, Таблица 2). - Рассчитайте коэффициент вариации (% CV) между репликами и между различными разведениями одного и того же образца.
ПРИМЕЧАНИЕ: %CV вычисляется путем деления стандартного отклонения на среднее. Если %CV между различными разведениями составляет >20 %, то это значение не следует считать точным. - Проверьте значения отрицательного и положительного контроля. Отрицательный контроль должен быть менее 5 копий/мкл.
- Рабочий диапазон dd_PCR составляет 10-10 000 копий/мкл. Исключите из анализа любое значение, составляющее <10 копий/мкл. Рекомендуемый диапазон для используемого здесь оборудования dd_PCR составляет 25-5000 копий/мкл.
Representative Results
Результаты можно визуализировать с помощью соответствующего программного обеспечения. Для каждой скважины на графике 1D амплитуды отображаются все капли относительно их амплитуды. Ожидается четкое разделение между положительными и отрицательными каплями. Если между положительными и отрицательными облаками капли обнаружено более 10% от общего числа капель (явление, называемое капельным дождем), необходимо повторно измерить образец (см. рис. 1). Дополнительная информация о капельном дожде доступна в обсуждении.
Можно создать таблицу данных для обобщения всей записанной информации, включая название образца, количество принятых капель (количество событий) и концентрацию (копий/мкл). В идеале количество принятых капель должно составлять от 15 000 до 20 000 принятых капель. Если количество событий для скважины меньше 10 000, точка данных должна быть исключена из анализа. Пример выходных данных приведен в таблице 5.
Титр vg может быть рассчитан на основе концентрации (копий/мкл) с учетом разведения пробы. Рабочий диапазон dd_PCR составляет 10-10 000 копий/мкл. Значения ниже 10 копий/мкл следует исключить из анализа. Следует рассчитать титр vg для образцов, а также положительный и отрицательный контроль. Измеряемая величина положительного контроля должна иметь коэффициент вариации (%CV) менее 20% относительно теоретического значения. Отрицательный контроль должен быть менее 5 копий/мкл. Кроме того, следует рассчитать %CV между повторами и различными разведениями для каждого образца. Если %CV между различными разведениями превышает 20%, значение может быть сочтено неточным, и может потребоваться повторное измерение образца.
Успешное измерение характеризуется четким разделением положительных и отрицательных облаков капель, по меньшей мере 10 000 принятых капель, значением от 10 копий/мкл до 10 000 копий/мкл и %CV между повторами менее 20%.
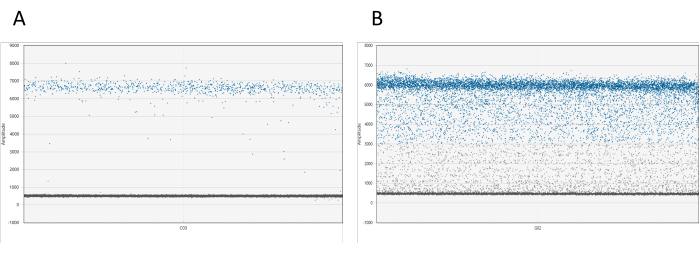
Рисунок 1: Визуализация капель dd_PCR. (A) График амплитуды 1D демонстрирует четкое разделение положительных и отрицательных капель, что указывает на успешное разделение капель. (B) На графике показано плохое разделение положительных и отрицательных капель, известное как капельный дождь, что предполагает неоптимальное разделение или потенциальные проблемы с анализом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
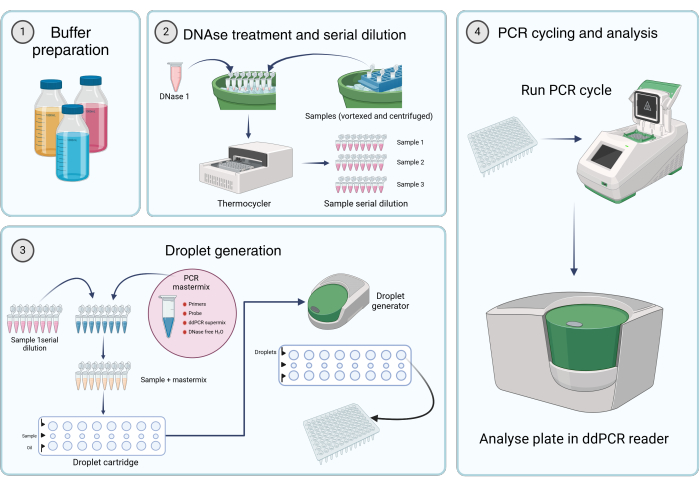
Рисунок 2: Рабочий процесс количественного определения вирусных геномов с помощью цифровой капельной ПЦР. (1) Буферы, реагенты и растворы готовятся в соответствии с инструкциями производителя или шагом 1 протокола (Приготовление исходных растворов). (2) 45 мкл раствора ДНКазы I аликвотируется в каждую пробирку 8-пробирочной ПЦР-полоски. После вортексирования и кратковременного центрифугирования образцов в одну из пробирок добавляют 5 мкл образца. ДНКазу I и восьмипробирочную ПЦР-полоску, содержащую образец, инкубируют в термоамплификаторе в течение 1 ч при 37 °C, после чего проводят серийное разведение образцов. (3) Мастермикс для ПЦР готовят, как описано, и 19,8 мкл аликвотируется в каждую пробирку 8-пробирочной ПЦР-полоски. Образцы серийных разведений с шага 2 добавляются в мастермикс. 20 μL мастермикса плюс
Раствор образца загружается в средний ряд картриджа, а 60 μл каплегенерирующего масла переносится в нижние отверстия каплегенерирующего картриджа. Затем картридж помещается в каплегенератор и работает в соответствии с заданными условиями. После образования капель 42,5 мкл из верхнего ряда картриджа переносится на многолуночный ПЦР-планшет. (4) Планшет для ПЦР загружается в термоамплификатор для ПЦР и работает в соответствии с предоставленными условиями. Пластина анализируется с помощью считывателя dd_PCR. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Данные о точности. В этой таблице представлены данные о прецизионности четырех наборов образцов контроля качества (QC), каждый из которых имеет пять концентраций (QC1-QC5). Каждый контроль качества измерялся пять раз. Показан коэффициент вариации (% CV) между различными прогонами, представляющий повторяемость (A), и между различными наборами образцов, представляющий промежуточную точность (B). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Разведение проб. В таблице приведены рекомендуемые разведения образцов на основе ожидаемого титра вирусного генома (vg/мл). В общей сложности рекомендуется провести три разведения, чтобы гарантировать, что по крайней мере два значения находятся в рабочем диапазоне анализа. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: dd_PCR состав мастер-микса. В этой таблице представлен состав мастер-микса dd_PCR, который включает в себя прямой и обратный праймер (909 нМ), зонд (227 нМ) и dd_PCR супермикс для щупов (без dUTP, 1x). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Условия термоциклирования. В таблице подробно описана рекомендуемая программа ПЦР, которая включает: (1) 10-минутную инкубацию при 95 °C для разрушения капсида и активации фермента, (2) 40 циклов по 30 с при 94 °C для денатурации ДНК и 1 минуту при 60 °C для отжига и удлинения, (3) 10-минутную инкубацию при 98 °C для деактивации ферментов, и (4) выдержка при 4°С. Температура отжига может потребовать оптимизации в зависимости от используемого набора грунтовки/щупа. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 5: Пример выходных данных из реального прогона AAV. В таблице приведен пример выходных данных из фактического прогона AAV, где один образец был измерен в двух разных разведениях, каждый из которых дублировался. Титр вирусного генома (vg) (в vg/мл) рассчитывается по следующей формуле: 10 (предварительная обработка ДНКазы I) x 10 (разведение в мастер-смеси) x 1000 (μL to mL) x разведение в буфере для разведения AAV. STDEV представляет собой стандартное отклонение, а CV указывает на коэффициент вариации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Discussion
Точное количественное определение копий генома вектора AAV в векторных препаратах имеет важное значение для разработки продуктов генной терапии на основе AAV. Существует несколько методов определения титра vg, при этом количественная ПЦР (кПЦР) и dd_PCR являются двумя наиболее широко используемыми и принятыми методами. dd_PCR часто предпочитают количественной ПЦР из-за ее независимости от эффективности амплификации, более высокой точности и большей надежности15. В литературе имеются многочисленные протоколы титрования векторного генома методом dd_PCR, каждый из которых имеет свои методы пробоподготовки 15,16,17. Тем не менее, существует нехватка квалифицированного протокола консенсуса. В данной статье представлен валидированный протокол dd_PCR для количественной оценки геномов векторов AAV в очищенных образцах векторов (рис. 2).
Пристальное внимание к работе с образцами имеет решающее значение при выполнении этого протокола. Перекрестное загрязнение может представлять значительную проблему для точной оценки титров vg; поэтому образцы лучше всего обрабатывать под рабочей станцией ПЦР, чтобы избежать загрязнения чужеродной ДНК. Кроме того, правильное проведение инкубации ДНКазы имеет решающее значение для уничтожения неупакованной загрязняющей ДНК без нарушения капсида и потенциального переваривания упакованного векторного генома. Многие протоколы включают тепловую инактивацию и лечение протеиназой К 16,17,18. Тем не менее, в ходе разработки собственного метода было обнаружено, что чрезмерный нагрев вреден для титрования vg, а лечение протеиназой К не является необходимым (данные не показаны).
Поскольку dd_PCR становится все более популярным для количественного определения вирусных геномов, производители опубликовали подробные руководства по применению с рекомендациями по разработке и оптимизации анализов dd_PCR19. Также доступна информация об устранении неполадок. На практике, когда анализ правильно составлен, наиболее частыми проблемами являются дождь из капель и низкое количество капель. Дождь из капель часто вызван плохим доступом праймера/зондов к ампликону, но несколько стратегий могут решить эту проблему. Например, эксперимент с температурным градиентом может помочь установить оптимальную температуру отжига. Кроме того, разбавление образцов для снижения количества ДНК (рекомендуется менее 66 нг) или выполнение рестрикционного расщепления с определенными ферментами, которые выходят за пределы ампликонной области, может улучшить доступность шаблонов. Рекомендуемая концентрация фермента рестрикции в 10 ЕД на мкг ДНК обычно эффективна. Проблема низкого количества капель (менее 10 000) часто связана с плохим пипетированием образца и маслом в картриджах. Рекомендуется медленное пипетирование с соответствующими наконечниками, чтобы избежать сдвига капель. Несмотря на то, что dd_PCR анализ надежен, одним из ограничений является увеличенное время получения результата. Процесс от обработки образца до считывания капель занимает несколько часов, что может быть недостатком, когда результаты нужны быстро.
Точное количественное определение копий генома AAV в векторных препаратах необходимо на всех этапах жизненного цикла генной терапии AAV. В частности, это важно для оптимизации процессов производства и очистки, проведения доклинических исследований и определения клинических дозировок для продуктов генной терапии на основе AAV. Представленный здесь протокол dd_PCR широко применим и может быть использован на очищенных продуктах AAV с различными серотипами и трансгенами.
Disclosures
IVH, BM и EH являются соучредителями Tavira Therapeutics. Остальные авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Это исследование стало возможным благодаря субсидии «Устойчивость Фландрии» от фламандского правительства, предоставленной «Европейским фондом восстановления и устойчивости» (RRF) (VV021/13). Рисунок 2 создан с помощью Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 8-channel pipette 10 µL | Eppendorf | 3,12,50,00,010 | |
| 8-channel pipette 200 µL | Eppendorf | 3,12,50,00,036 | |
| 8-channel pipette 300 µL | Eppendorf | 3,12,50,00,052 | |
| 8-well PCR strip | Sarstedt | 72.991.002 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| C1000 Touch Thermal Cycler with 96–Deep Well Reaction Module | Bio-Rad | 1851197 | |
| ddPCR Buffer Control for Probes 9 mL (2 x 4.5 mL) | Bio-Rad | 1863052 | |
| ddPCR Supermix for Probes (No dUTP) (2 x 1 mL) | Bio-Rad | 1863023 | |
| ddPCR 96-Well Plates (pkg of 25) | Bio-Rad | 12001925 | |
| ddPCR Droplet Reader Oil (2 x 1L) | Bio-Rad | 1863004 | |
| DG8 Cartridge Holder | Bio-Rad | 1863051 | |
| DG8 Cartridges for QX200/QX100 (pkg of 24) | Bio-Rad | 1864008 | |
| DG8 Gaskets for QX200/QX100 (pkg of 24) | Bio-Rad | 1863009 | |
| DNase I (10U/µL) + buffer | Roche | 4716728001 | |
| Droplet Generation Oil for Probes (10 x 7 mL) | Bio-Rad | 1863005 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 0.1-10 μL, 34 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078500 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 20-300 μL, 55 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078560 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 2-100 μL, 53 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078543 | |
| Forward lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Forward primer: 5'-GAACGGCATCAAGGTGAACT-3' | |
| Lyopohilized probe and master stock at 100 µM | IDT | GFP as target sequence. PrimeTime Eco Probe: /56-FAM/CAAGATCCG/ZEN/CCACAACATCGAGGA/3IABkFQ/ | |
| Magnesium Chloride (MgCl2) | Chemlab Analytical | CL00.1381 | |
| Nuclease free water | IDT | 11-04-02-01 | |
| PCR Plate Heat Seal, foil, pierceable (pkg of 100) | Bio-Rad | 1814040 | |
| Pluronic F-68 non-ionic surfactant (100x) | Thermo Fisher Scientific | 24040032 | |
| Potassium Chloride (KCl) | Honeywell research chemicals | 31248 | |
| QX manager software | Bio-Rad | Software to analyse ddPCR data | |
| QX200 Droplet Generator | Bio-Rad | 1864002 | |
| QX200 Droplet Reader | Bio-Rad | 1864003 | |
| Reagent reservoir | VWR | 613-1181 | |
| Reverse lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Reverse primer: 5'-TGCTCAGGTAGTGGTTGTCG-3' | |
| SafeSeal reaction tube, 1.5 mL | Sarstedt | 72.706.200 | |
| Salmon Sperm DNA, sheared (10 mg/mL) | Thermo Fisher Scientific | AM9680 | |
| TE buffer | IDT | Accompanied by primers when ordering | |
| Tris hydrochloride (Tris-HCl) | Roche | 10812846001 |
References
- Balakrishnan, B., Jayandharan, G. R. Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther. 14 (2), 86-100 (2014).
- Srivastava, A. In vivo tissue-tropism of adeno-associated viral vectors. Curr Opin Virol. 21, 75-80 (2016).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Gimpel, A. L., et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 20, 740-754 (2021).
- Brimble, M. A., et al. Preventing packaging of translatable P5-associated DNA contaminants in recombinant AAV vector preps. Mol Ther Methods Clin Dev. 24, 280-291 (2022).
- Wright, J. F. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, (2019).
- Sidransky, D., et al. Identification of ras oncogene mutations in the stool of patients with curable colorectal tumors. Science. 256 (5053), 102-105 (1992).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci USA. 96 (16), 9236-9241 (1999).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem. 84 (2), 1003-1011 (2012).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods Mol Biol. 1950, 51-83 (2019).
- . Planning droplet digital PCR experiments Available from: https://www.bio-rad.com/en-in/life-science/learning-center/introduction-to-digital-pcr/planning-ddpcr-experiments (2024)
- Dorange, F., Le Bec, C. Analytical approaches to characterize AAV vector production & purification: Advances and challenges. Cell Gene Ther Insights. 4 (2), 119-129 (2018).
- Lock, M., et al. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Ther Methods. 25 (2), 115-125 (2014).
- Prantner, A., Maar, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18 (1), e0280242 (2023).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570 (2019).
- Suoranta, T., Laham-Karam, N., Yla-Herttuala, S. Optimized protocol for accurate titration of adeno-associated virus vectors. Hum Gene Ther. 32 (19-20), 1270-1279 (2021).
- Droplet digital PCR applications guide. Bulletin 6407 Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6407.pdf (2024)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved