Çarpışma Teorisi
Atomlar, moleküller veya iyonlar birbirleriyle reaksiyona girmeden önce çarpışmalıdır. Kimyasal bağlar oluşturmak için atomların birbirine yakın olması gerekir. Bu öncül, reaksiyon hızlarını etkileyen faktörler de dahil olmak üzere kimyasal kinetikle ilgili birçok gözlemi açıklayan bir teorinin temelidir.
Çarpışma teorisi, (i) reaksiyon hızının reaktan çarpışmalarının hızıyla orantılı olduğu, (ii) reaksiyona giren türlerin üründe birbirine bağlanan atomlar arasında temasa izin veren bir yönde çarpıştığı ve (iii) çarpışmanın, reaksiyona giren türlerin değerlik kabuklarının karşılıklı penetrasyonu için yeterli enerjiyle meydana geldiği varsayımlarına dayanmaktadır; böylece elektronlar yeniden düzenlenebilir ve yeni bağlar (ve yeni kimyasal türleri) oluşturabilir.
Örneğin, yüksek sıcaklık ve basınçta meydana gelen karbon monoksit ile oksijen arasındaki bir gaz fazı reaksiyonunda, ilk adım iki molekül arasındaki bir çarpışmadır.
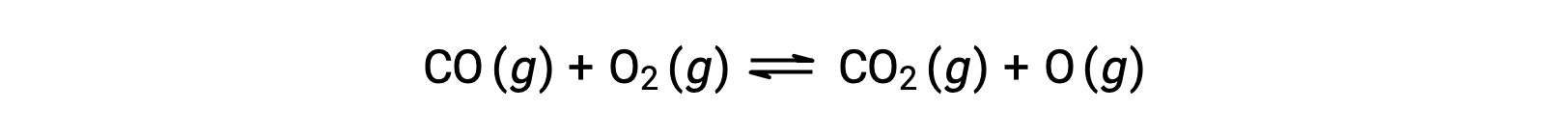
Bununla birlikte, iki molekülün çarpıştığı birçok farklı olası göreceli yönelim olabilir. Bu nedenle, çarpışan moleküllerin oryantasyonu, aralarında meydana gelen bir reaksiyonun fizibilitesini kısmen belirlemede büyük öneme sahiptir.
Bir durumda, karbon monoksit molekülünün oksijen tarafı, oksijen molekülü ile çarpışabilir. Başka bir durumda, karbon monoksit molekülünün karbon tarafı oksijen molekülü ile çarpışabilir. İkinci durumun, iki oksijen atomuna (O = C = O) bağlı merkezi bir karbon atomu ile karbondioksit oluşumuyla sonuçlanması daha olasıdır.
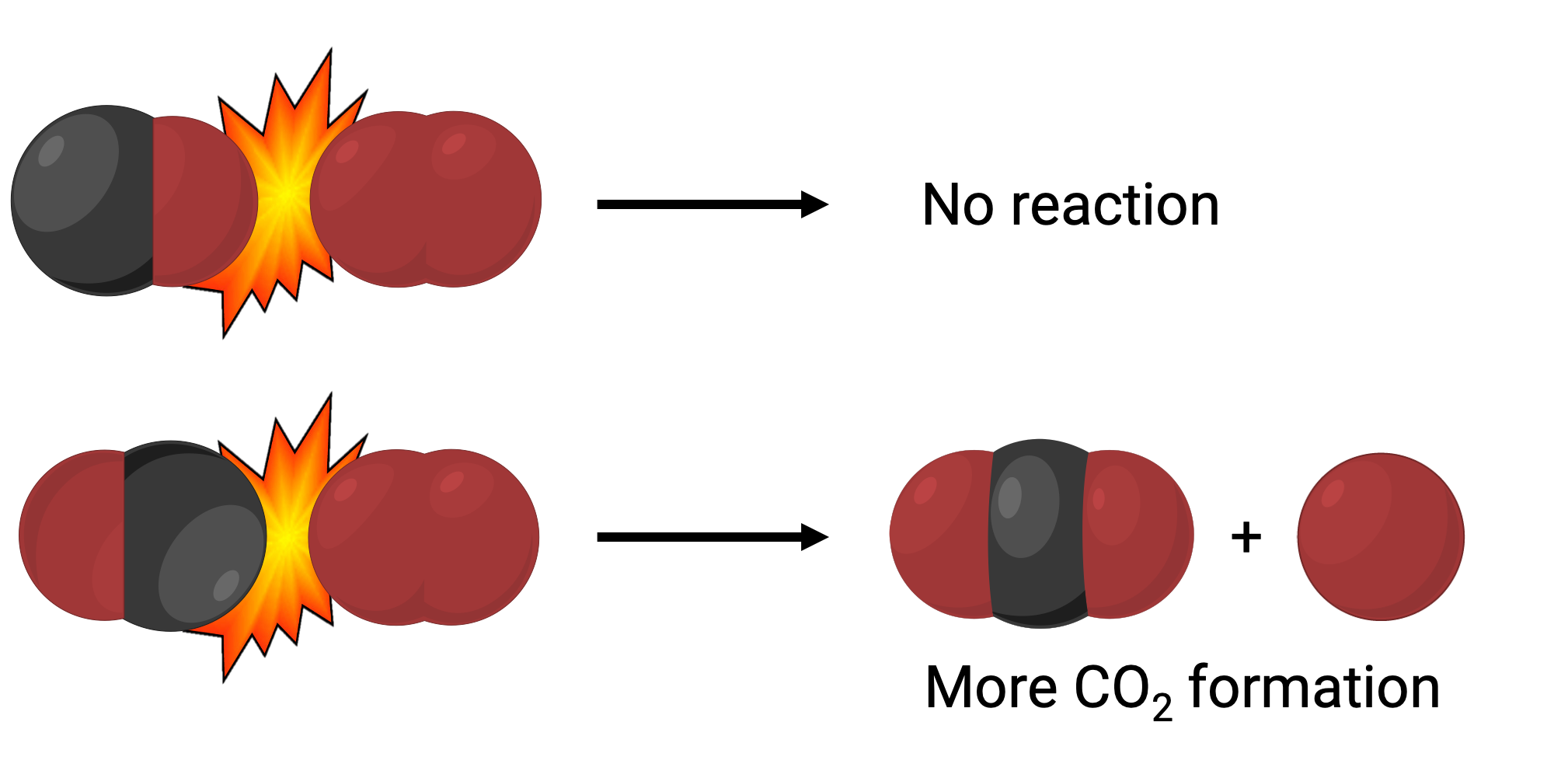
Yine de, çarpışma doğru yönde gerçekleşse bile, reaksiyonun karbondioksit oluşturmaya devam edeceğinin garantisi sınırlıdır. Bunun nedeni, doğru yönlendirmeye ek olarak, çarpışmanın, ürün oluşumuyla sonuçlanması için aktivasyon enerjisi adı verilen yeterli enerji ile de gerçekleşmesi gerektiğidir. Tepkimeye giren türler hem doğru yönelim hem de yeterli aktivasyon enerjisi ile çarpıştığında, aktive edilmiş kompleks veya geçiş durumu adı verilen kararsız bir tür oluşturmak için birleşirler. Bu türler kısa ömürlüdür ve çoğu analitik araç tarafından genellikle tespit edilemez. Bazı durumlarda, gelişmiş spektral ölçümler geçiş durumlarını gözlemleyebilir.
Çarpışma teorisi, sıcaklık arttıkça neden çoğu reaksiyon oranının arttığını açıklar; sıcaklık artışı ile çarpışma sıklığı artar. Daha fazla çarpışma, çarpışmaların enerjisinin yeterli olduğu varsayılarak daha hızlı reaksiyon hızı anlamına gelir.
Aktivasyon Enerjisi
Reaktifler arasındaki çarpışma sırasında bir ürün oluşturmak için gereken minimum enerjiye aktivasyon enerjisi (Ea) denir. Gerekli aktivasyon enerjisi ile reaksiyona giren moleküllerin çarpışmasıyla sağlanan kinetik enerji arasındaki fark, bir kimyasal reaksiyonun hızını etkileyen birincil faktördür. Aktivasyon enerjisi moleküllerin ortalama kinetik enerjisinden çok daha büyükse, reaksiyon yavaş gerçekleşecektir, çünkü sadece birkaç hızlı hareket eden molekül reaksiyona girmek için yeterli enerjiye sahip olacaktır. Aktivasyon enerjisi moleküllerin ortalama kinetik enerjisinden çok daha küçükse, moleküllerin büyük bir kısmı yeterince enerjik olacak ve reaksiyon hızla ilerleyecektir.
Reaksiyon diyagramları, ilgilenilen bir reaksiyonun çeşitli özelliklerini göstermek için kimyasal kinetikte yaygın olarak kullanılmaktadır. Bir kimyasal sistemin enerjisinin bir reaksiyona girerken, reaktanları ürünlere dönüştürürken nasıl değiştiğini gösterir.
Örneğin, bir ekzotermik reaksiyon için aşağıdaki reaksiyon diyagramını düşünün:A + B → C + D;
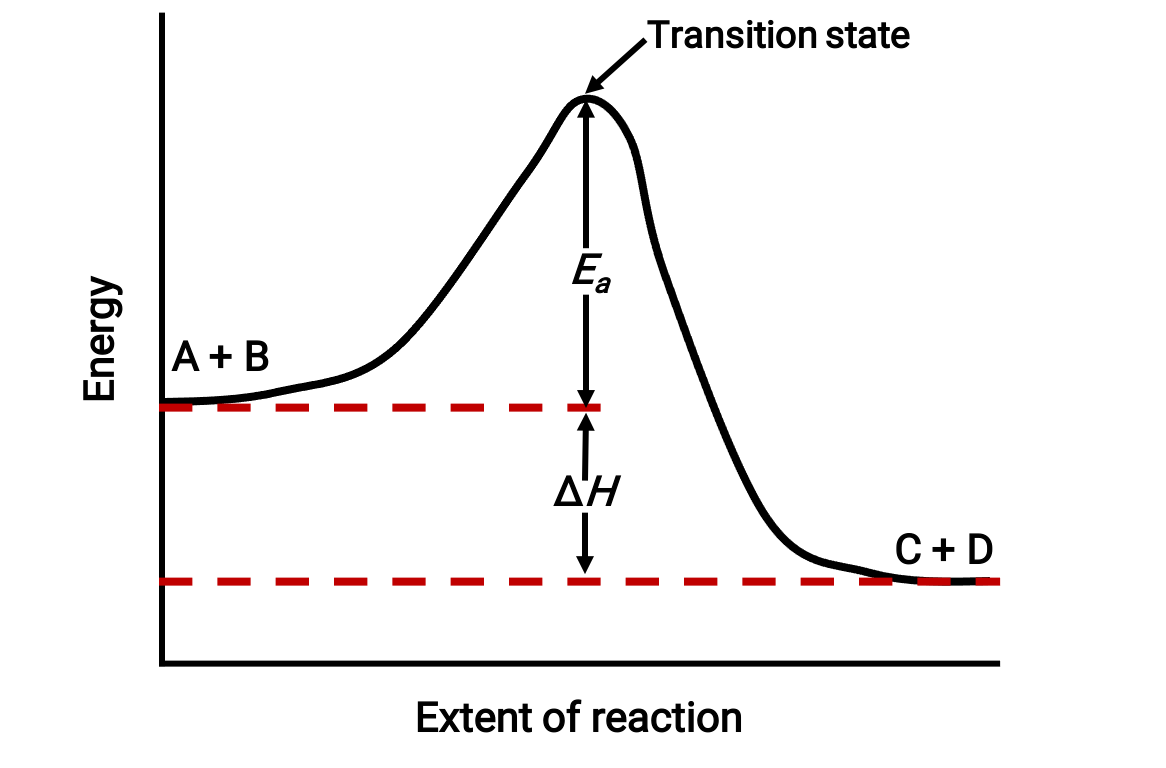
Diyagram, soldan sağa görüntülenir. Başlangıçta, sistem yalnızca reaktanlardan (A + B) oluşur. Yeterli enerjiye sahip reaktan moleküller çarpıştığında, yüksek enerjili aktive edilmiş bir kompleks veya geçiş durumu oluştururlar. Kararsız geçiş durumu daha sonra bozulur ve kararlı ürünler (C + D) verir.
Diyagram, reaksiyonun aktivasyon enerjisini Ea, reaktanlar ve geçiş durumu arasındaki enerji farkı olarak gösterir. Reaktifler ve ürünler arasındaki enerji farkı, reaksiyonun entalpi değişimine karşılık gelir (ΔH). Bu durumda reaksiyon ekzotermiktir (ΔH<0), çünkü sistem entalpisinde bir azalma sağlar.
Arrhenius Denklemi
Arrhenius denklemi, k = Ae− Ea / RT , birçok kimyasal reaksiyon için aktivasyon enerjisi ve hız sabiti k ile ilişkilidir.
Bu denklemde R, 8.314 J / mol· K değerine sahip ideal gaz sabitidir, T kelvin cinsinden sıcaklıktır, Ea, mol başına joule cinsinden aktivasyon enerjisidir, e, 2,7183 sabitidir ve A, çarpışmaların sıklığı ve reaksiyona giren moleküllerin yönelimi ile ilgili frekans faktörü. Arrhenius denklemi, çarpışma teorisinin varsayımlarına güzel bir şekilde uyum sağlar. Frekans faktörü A, reaksiyon koşullarının reaktan moleküller arasında doğru yönlendirilmiş çarpışmaları ne kadar iyi desteklediğini gösterir. Etkili bir şekilde yönlendirilmiş çarpışma olasılığının artması, A için daha büyük değerlere ve daha hızlı reaksiyon hızlarına neden olur.
Üstel terim, e−Ea/RT, aktivasyon enerjisinin reaksiyon hızı üzerindeki etkisini tanımlar. Kinetik moleküler teoriye göre, maddenin sıcaklığı, onu oluşturan atomların veya moleküllerin ortalama kinetik enerjisinin bir ölçüsüdür; daha düşük bir aktivasyon enerjisi, yeterince enerji verilmiş moleküllerin daha önemli bir kısmına ve daha hızlı bir reaksiyona neden olur.
Üstel terim ayrıca sıcaklığın reaksiyon hızı üzerindeki etkisini de tanımlar. Daha yüksek bir sıcaklık, aktivasyon bariyerini (Ea) aşmak için yeterli enerjiye ( RT ) sahip olan daha büyük bir molekül fraksiyonunu temsil eder. Bu, hız sabiti için daha yüksek bir değer ve buna bağlı olarak daha hızlı reaksiyon hızı sağlar.
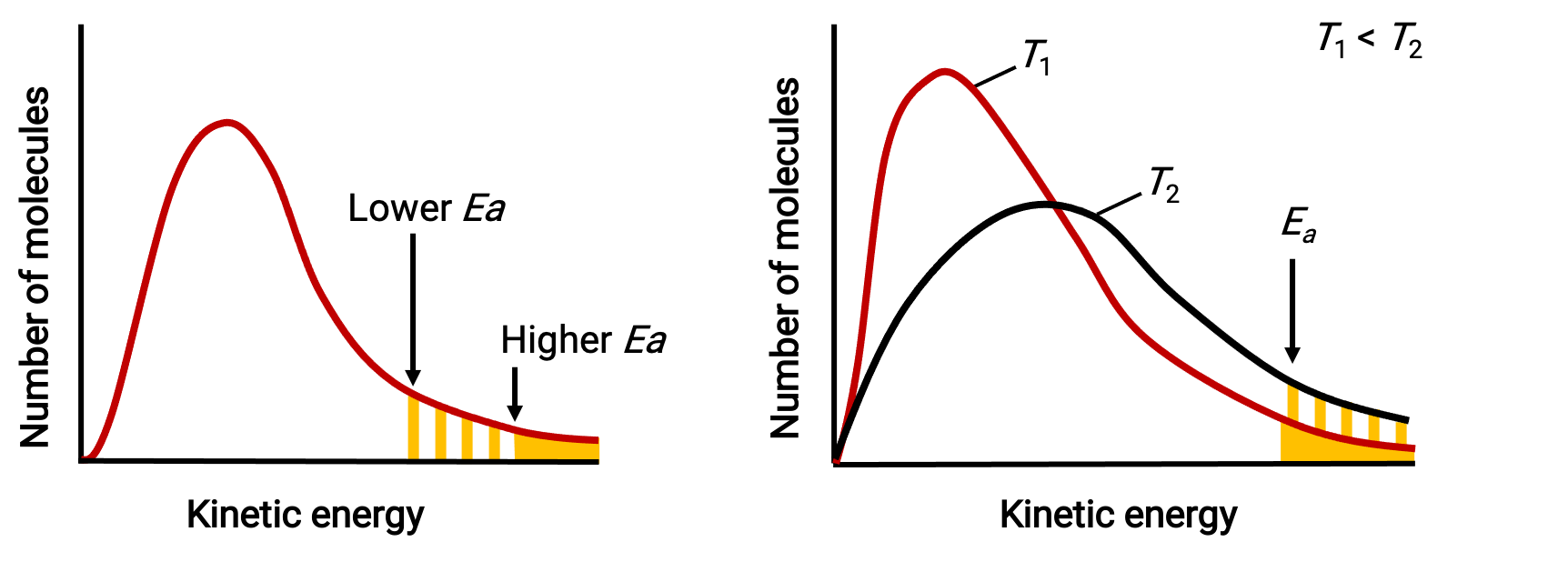
Belirli bir sıcaklıkta iki farklı aktivasyon enerjisini aşan enerjiye sahip molekül sayısını ve iki farklı sıcaklıkta belirli bir aktivasyon enerjisini gösteren moleküler enerji dağılımları
Bu metin bu kaynaktan uyarlanmıştır:Openstax, Chemistry 2e, Section 12.5: Collision Theory.
Bölümden 13:

Now Playing
13.7 : Reaksiyon Oranında Sıcaklık Bağımlılığı
Kimyasal Kinetik
80.5K Görüntüleme Sayısı

13.1 : Reaksiyon Hızı
Kimyasal Kinetik
50.3K Görüntüleme Sayısı

13.2 : Reaksiyon Hızını Ölçme
Kimyasal Kinetik
23.9K Görüntüleme Sayısı

13.3 : Hız Yasasının Konsantre Hali
Kimyasal Kinetik
29.4K Görüntüleme Sayısı

13.4 : Dereceli Reaksiyonları Tanımlama
Kimyasal Kinetik
54.4K Görüntüleme Sayısı

13.5 : Entegre Oran Yasası: Konsantrasyonun Zamana Bağımlılığı
Kimyasal Kinetik
33.8K Görüntüleme Sayısı

13.6 : Bir Reaksiyonun Yarı Ömr
Kimyasal Kinetik
33.7K Görüntüleme Sayısı

13.8 : Arrhenius Grafikleri
Kimyasal Kinetik
37.6K Görüntüleme Sayısı

13.9 : Reaksiyon Mekanizmaları
Kimyasal Kinetik
24.8K Görüntüleme Sayısı

13.10 : Oran Belirleyici Adımlar
Kimyasal Kinetik
31.2K Görüntüleme Sayısı

13.11 : Kataliz
Kimyasal Kinetik
26.3K Görüntüleme Sayısı

13.12 : Enzimler
Kimyasal Kinetik
80.1K Görüntüleme Sayısı
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır