18.1 : Redoks Denklemlerinin Dengelenmesi
Elektrokimya, elektriksel ve kimyasal reaksiyonların dönüşümünde yer alan bilimdir. Bu tür reaksiyonlara redüksiyon-oksidasyon veya redoks reaksiyonları denir. Bu önemli reaksiyonlar, bir veya daha fazla reaktan element için oksidasyon durumlarındaki değişikliklerle tanımlanır ve reaktan türleri arasında elektron transferini kapsayan bir reaksiyon alt kümesini içerir. Bir alan olarak Elektrokimya, redoks kimyasının temel ilkeleri ve endüstriyel ölçekli metalurjik işlemlerden elektrikli araçlar için sağlam, şarj edilebilir pillere kadar çeşitli teknolojiler hakkında yeterli bilgi vermek için gelişmiştir. Elektron transferini içeren reaksiyonlar Elektrokimya çalışması için gerekli olduğundan, redoks kimyasının kısa bir incelemesi aşağıdakileri içerir.
Oksidasyon Numaraları
Tanım olarak, bir redoks reaksiyonu, bir veya daha fazla reaktan için oksidasyon sayısında veya oksidasyon durumunda bir değişim içerir. Bir elementin oksidasyon sayısı, atomlarının elektronik ortamının saf elementin atomlarına kıyasla nasıl farklılaştığının bir değerlendirmesidir. Bu tanımla, bir elementteki bir atom, sıfır oksidasyon numarası taşır. Eğer bileşik, iyonik olsaydı, bir atom için oksidasyon sayısı bileşikteki atomun yüküne eşittir. Bu nedenle, bir moleküldeki tüm atomlar için oksidasyon sayılarının toplamı molekülün yüküne eşittir.
İyonik Bileşikler
Basit iyonik bileşikler, bu formalizmin en basit örnekleridir, çünkü elementler iyonik yüklerine eşit oksidasyon sayılarına sahiptir. Sodyum klorür, NaCl, Na+ katyonlarından ve Cl− anyonlarından oluşur, sodyum ve klor için oksidasyon sayıları sırasıyla +1 ve −1'dir. Kalsiyum florür, CaF2, kalsiyum ve florin, +2 ve −1 için oksidasyon numaraları ile Ca+2 katyonları ve F− anyonlarından oluşur.
Kovalent Bileşikler
Kovalent bileşikler formalizm kullanımında daha zordur. Su, polar kovalent O−Hbağları yoluyla bir O atomuna bağlanmış iki H atomundan oluşan kovalent bir bileşiktir. Bir O−H bağı oluşturan paylaşılan elektronlar, daha elektronegatif O atomuna daha güçlü bir şekilde çekilir. Böylece oksijen, elementel oksijendeki bir O atomuna kıyasla kısmi bir negatif yük kazanır. Sonuç olarak, bir su molekülündeki H atomları, hidrojen gazındaki hidrojen atomlarına kıyasla kısmi bir pozitif yük sergiler. Her su molekülü için kısmi negatif ve pozitif yüklerin toplamı sıfırdır, bu da su molekülünü nötr hale getirir.
O−H su bağları içindeki paylaşılan elektronların polarizasyonu tamamlansaydı, sonuç elektronların H'den O'ya tamamen aktarılması ve suyun O2− anyonları ve H+ katyonlarından oluşan iyonik bir bileşik olması gerekirdi. Ve böylece, sudaki oksijen ve hidrojen için oksidasyon sayıları sırasıyla −2 ve +1'dir. Aynı mantığı karbon tetraklorür, CCl4'e uygulamak, karbon için +4 ve klor için −1 oksidasyon sayıları verir. Nitrat iyonunda, NO3−, azot için oksidasyon sayısı +5'tir ve oksijen için −2'dir, moleküldeki −1 yüküne eşittir:
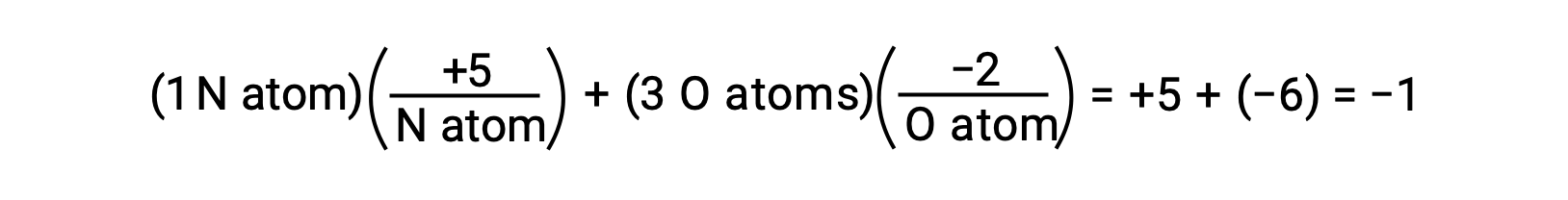
Redoks Denklemlerinin Dengelenmesi
Aşağıda gösterilen dengesiz denklem, sodyum klorürün ayrışmasını açıklar:
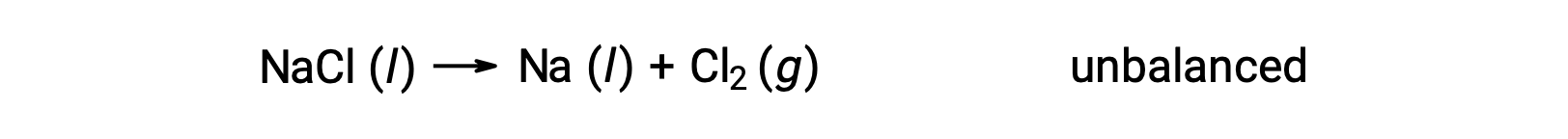
Bu reaksiyon, bir redoks reaksiyonu kriterine karşılık gelir, çünkü Na için oksidasyon sayısı +1'den 0'a düşer (indirgeme geçirilerek) ve Cl için −1'den 0'a yükselir (oksidasyon geçirilerek). Denklem durumu, NaCl ve Na için 2 stokiyometrik katsayısı eklenerek kolayca dengelenir:
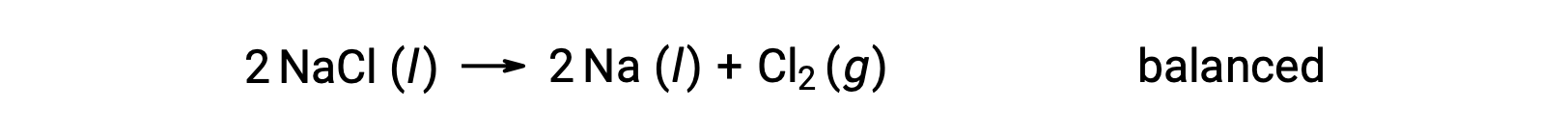
Sulu çözeltilerde meydana gelen redoks reaksiyonları elektrokimyada yaygın olarak görülür ve birçoğu reaktan veya ürün olarak su veya iyonları, H+ (aq) ve OH− (aq) içerir.
Bu durumlarda, redox reaksiyonlarını temsil eden denklemler sadece dengelemek için çok zor olabilir ve yarı reaksiyon yöntemi olarak bilinen sistematik bir yaklaşımın kullanımı yardımcı olur. Bu yaklaşım aşağıdaki adımları içerir:
- Denklemi bileşen iskelet oksidasyon ve indirgeme yarı reaksiyonlarına bölün.
- Her yarı reaksiyonu O ve H dışındaki tüm elementler için dengeleyin.
- Denklemde gerektiği gibi su molekülleri ekleyerek O atomları için her yarım reaksiyonu dengeleyin.
- Denklem için gerekli olan protonları ekleyerek H atomları için her yarım reaksiyonu dengeleyin.
- Son olarak, gerektiğinde elektron ekleyerek elementler üzerindeki yükleri dengeleyin.
- Yarı reaksiyonları, oksidasyon yarı reaksiyonunda kaybedilen elektron sayısını, indirgeme yarı reaksiyonunda kazanılan elektron sayısına eşitlemek için gereken herhangi bir tamsayı ile çarpın.
- Her iki yarı reaksiyonu da ekleyin ve denklemin her iki tarafındaki ortak türleri çıkararak daha da basitleştirin.
- Reaksiyon alkali bir ortamda gerçekleşirse, protonları nötralize etmek için Adım 7'de elde edilen denkleme OH iyonları ekleyin (denklemin her iki tarafına eşit sayıda eklenir) ve basitleştirin.
- Atomlar üzerindeki yüklerin dengelendiğinden emin olmak için denklemi kontrol edin.
Bu metin bu kaynaklardan uyarlanmıştır: Openstax, Chemistry 2e, Chapter 17: Introduction, ve Openstax, Chemistry 2e, Section17.2: Review of Redox Chemistry.
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır