Method Article
Görselleştirme ve Miktar hücre içi Etkileşimleri Neisseria meningitidis ve İnsan
Bu Makalede
Özet
Neisseria meningitidis (Nm), gram negatif bir insana özgü solunum patojen, insan α-aktinin bağlayabilirsiniz . Burada insan beyninin mikrovasküler endotel hücreleri (HBMECs) içine bakteriyel girmesinden sonra intraselüler α-aktinin bakterinin colocalisation görselleştirilmesi için bir protokol mevcut.
Özet
Neisseria meningitidis (Nm, meningokok) Opc protein adhesin ve insan epitel ve endotel hücreleri için etkili bir invasin olarak hareket edebilir bir yüzey ifade ayrılmaz dış membran proteini,. Biz Opc, integrin ligandlar gibi vitronectin olarak ilk bağlamak için Opc gerektiren bir süreç için önemli reseptörleri ve bu hücre ifade reseptörleri 1 ile endotel yüzeyinde bulunan integrinler belirledik. Bu süreç endotel hücreleri bakteri istilası 2 yol açar. Daha yakın zamanda, biz, insan hücrelerinde 3 tüm hücre lizatları bulunan bir 100kDa protein Opc bir etkileşim gözlemlenmiştir . Konak hücre proteinlerinin elektroforezi ile ayrılmış ve nitroselüloz için lekelenen Opc eksprese Nm ile kaplanmış olduğu başlangıçta bu etkileşim gözlenmemiştir. Etkileşim doğrudan ve ara moleküller dahil etmedi. Kütle spektrometresi, α-aktinin olarak protein kimliği kurdu. Α-aktinin, incelenen sekiz hücre hatları herhangi bir ifade ettiği gibi herhangi bir yüzey bulundu, ve hedef hücre içine bakteri girişini serum kurşun varlığında endotel hücreleri ile Opc etkileşimleri gibi, intraselüler etkileşen iki protein olasılığını inceledi. Bunun için, kültürlü insan beyin mikrovasküler endotel hücreleri (HBMECs) ile enfekte Opc uzun süre ve içselleştirilmiş bakteri ve α-aktinin yerleri için Nm ifade konfokal mikroskobu ile incelendi. Biz, bakteriyel internalizasyonunda sekiz saatlik bir süre sonra önemli sitoskeletal protein, Nm colocalisation zamana bağımlı bir artış gözlenmiştir. Buna ek olarak, kantitatif görüntüleme yazılımı kullanımı α-aktinin ve diğer hücre iskeleti proteinleri Nm colocalisation göreceli bir önlem almak için olanak sağladı. Işlem aynı zamanda insan epitel hücreleri için geçerli olmasına rağmen, biz burada, görselleştirme ve bakteriyel insan endotel hücre içine girmesinden sonra hücre içi proteinler bakterinin colocalisation ölçümü için bir protokol mevcut.
Protokol
1. İmmünofloresan Protokolü
Tohumculuk, Enfeksiyon ve immüno-boyama
Aşağıdaki yordamlar, uygun güvenlik düzeyi doku kültürü ve mikrobiyolojik laboratuvar olanakları gerektirir.
1. GÜN
A. enfeksiyon için hedef hücreler hazırlanması
- Tohum HBMECs cam lamelleri% 50 izdiham (~ 1.5x10 4 hücre / cm 2) (16 mm çapında), 12 plaka (iyi 3,8 cm 2 büyüme alanı /) içine yerleştirilir .
Büyüme orta: RPMI 1640% 15 ısı ile inaktive edilmiş (56 ° C, 30dk) FBS, 2 mM glutamin, 1 mM sodyum piruvat, 100 U / ml penisilin / streptomisin,% 1 (v / v) MEM elzem olmayan bir amino ile desteklenmiş asitler çözüm ve% 1 MEM vitaminleri çözüm. - 37 ° C gecelik (O / N) üzerinde Kültür,% 5 CO2 inkübatör.
B. Bakteriyel kültürü
- 37% 10 ısıtılmış at kanı ile takviye gerekli orta örneğin Beyin Kalp İnfüzyon (BHI) agar plaklarına faiz yükü büyümeye O / N% 5 CO 2 atmosfer 4 ° C (16-18 saat).
2. GÜN
A. Of Bakteriyel (N. meningitidis) Süspansiyon hazırlanması
- 10 mcL kültür döngüsü kullanarak, 2 mL PBSB (kalsiyum ve magnezyum ile PBS) gecelik bakteri kültürünün bir süspansiyon olun.
- Büyük bakteriyel büyüklükler oda sıcaklığında (RT) 5 dakika boyunca stand süspansiyon bırakarak yerleşmek için izin verin.
- Pelet bozmadan, steril bir tüpe süspansiyon üst 1 ml (hisse senedi inokulum) aktarın.
- Stok inokulum bakteri sayıları tahmin etmek için, 1 ml hacimli 0.1M NaOH% 1 SDS içeren tüplere alikotları (20-50 mcL) ekleyin ve hafifçe karıştırın çözünebilmesi.
- 260nm (A260) absorbans belirleyerek çözüm nükleik asit içeriği ölçün. Bizim ellerde, 1 tekabül A260 5x10 8 koloni birimleri şekillendirme / ml (kob / ml). Bu PBSB stok inokulum dilüsyonları bir dizi hazırlamak agar plakaları üzerinde kaplama ve O / N inkübasyondan sonra koloniler sayma kontrol edilebilir.
- Enfeksiyon orta stok inokulum bir kısım sulandırınız [decomplemented (% 2 ile desteklenmiş M199 (56 ° C, 30dk) normal insan serumu (NHS)], hedef hücreleri enfeksiyon için gerekli olan bakteri yoğunluğu elde etmek için.
- Laboratuvarımızda, hedef hücre başına 200-300 bakteri enfeksiyon oranı rutin kullanılır.
B. Hücre Kültürü Enfeksiyonu
- Kültürlü hedef hücreleri 3 kez antibiyotiklerin herhangi bir iz kaldırmak için Hank orta lamelleri yıkayın.
- % 5 CO 2, 3 saat 8 saat 37 taze hazırlanmış bakteri süspansiyonları (yukarıda açıklandığı gibi) ° C ile hücreleri enfekte.
- Enfeksiyon döneminin sonunda, 4, 30-45 dakika süreyle RT veya O / N% 2 paraformaldehid 500 mcL (PFA) hücreleri PBS ile üç defa yıkamak ve düzeltmek ° C
- Yukarıda gösterilen konsantrasyon ve saatte Paraformaldehit fiksasyon, bakteriyel ve hücresel morfoloji korunması için uygun olduğu tespit edilmiştir.
- Paraformaldehid kapalı yıkadıktan sonra,% 0.1 Triton X-100 10 dakika süreyle PBS içinde seyreltilmesi kuluçka tarafından paraformaldehid sabit hücreler permeabilise.
- Örnekleri PBS ile 3 kez yıkayın.
- Immüno-boyama geçin veya alternatif olarak, 4,% 1 BSA / PBST O / N 500 mcL örnekleri terk ° C
3. GÜN
Immüno-boyama
Hücre içi bakteri boyama ve aşağıdaki gibi α-aktinin uygun birincil ve ikincil antikor kullanımı ile sırayla veya aynı anda yapılabilir; tüm işlemleri 12 kuyucuğu yapılabilir.
- Blok 500 mcL% 3 ile permeabilised hücreleri içeren lamelleri RT 30-60 dakika BSA / PBST (PBS Triton X-100% 0.05 içeren)
- PBS ile yıkadıktan sonra, 12 plaka her lamel yeni bir kuru, iyi transfer.
- Bakteri ve α-aktinin karşı primer antikor ekleyin; lamel yüzeyini kapsayacak şekilde dikkatlice ilave seksen 100 mcL lamel ortalama antikor yeterli olacaktır. 1s için oda sıcaklığında inkübe edin.
- Biz aynı anda α-aktinin (Abcam) karşı Neisseria meningitidis (laboratuar kaldırılan) ve fare monoklonal antikor (mAb) karşı tavşan poliklonal antiserum kullanılır. Bazı deneylerde, anti-α-aktinin yerine, aktin ve vimentin karşı mAb (Sigma) kullanıldı.
- Inkübasyon sonunda, iyi PBS 200 mcL eklemek için yeni bir de içeren 500 mcL PBS lamel ve yer kaldırın.
- 5 dakika sonra, pipetleme tarafından PBS çıkarın ve sonra taze PBS ekleyin. Iki kez tekrarlayın. Lamelleri bir aktarınyeni kuru kuyu.
- Karanlıkta 1s için oda sıcaklığında inkübe;% 1 BSA / PBST seyreltilmiş farklı fluorochromes konjuge uygun sekonder antikor ekleyin.
- Bakteriyel tespiti için, biz TRITC ile konjuge anti-tavşan Ig kullanılan ve α-aktinin ve diğer iskelet protein tespiti için, konjuge anti-fare Ig kullanılan ya FITC (Sigma) veya Alexa Fluor 488 - (Invitrogen).
- Inkübasyon sonunda, 4 ve 5. adımları olarak yıkayın.
- Sayaç karanlık RT az 5 dakika için 0.6 mg / ml PBS içinde DAPI (DNA leke) ile leke.
- PBS ile durulayın.
- Montaj orta bir damla slaytlar (e, g. Mowiol veya Vectashield) Mount lamelleri (hücreleri aşağı bakacak şekilde)
- 4 ° C karanlıkta saklayın
- Örnekler mikroskop altında gözlem için hazır.
2. Konfokal Lazer Tarama Mikroskobu (CLSM)
Gözlemlemek ve hücre içi bakteri ve iskelet elemanları görüntülerini yakalamak için, Leica DM I6000 ters Epifloresans mikroskop bağlı bir Leica SP5-Kelime Size Neyi Çağrıştırıyor konfokal lazer tarama mikroskobu kullanılarak immunolabelled örnekleri ve çekilen görüntülerin kullandı. Tüm görüntüleri Leica yazılımı ile 63x NA 1.4 yağ daldırma amaç ve süreci kullanılarak toplanmıştır.
CLSM prosedürü:
- CLSM prosedürü başlatmak için, objektif bir damla immersiyon yağı ekleyin ve mikroskop aşamasında örnek slayt, lamel-yüzü aşağı yerleştirin.
- Mikroskop görsel moduna ayarlayın ve mikroskop göz parçaları kullanılarak ilgi alanı bulmak.
- Leica Yazılım kullanarak, xyz satın alma modunu seçin.
- 512 x 512 formatında (kare boyutu) seçin. Colocalisation çalışmalar için, yüksek çözünürlük, daha doğru görüntü; mikroskop çözünürlük sınırı göz önünde tutmak. Daha sonra çift yönlü X modunda, tarama hızı artacak seçin ve fotoğraf beyazlatma azaltmaya yardımcı olur.
- Sıralı tarama ayarlarını ayarlayın. "Sıra" fonksiyonu tıklayın ve tarama modlarından birini seçin. Biz modu "satırları arasındaki" kullanabilirsiniz.
- DAPI (mavi), Alexa Fluor TRITC için 488 (yeşil) ve 561 nm (kırmızı) için 488 nm 405 nm: Seçiniz lazer sekonder antikor konjuge fluorochromes göre kirişler. Photomultiplier Tube (PMT) sırasıyla 1, 2, ve 3 etkinleştirin. Doğru emisyon dalga boyu algılamak için PMT ayarlarını yapın.
- Z yığınları veya seri ("başlamak") üst ve alt ("son") ayarlayın. Sonra, gerekli "z adım boyutu" olarak ayarlayın.
- Neisseria meningitidis bir Diplococcus (Şekil 1G) ve her coccus yaklaşık çapı 0.5 mm yana, 0.20 mm z-adım boyutu en az iki kez her coccus tarama olasılığını artırmak için seçildi. 0.2 mm - 0.1 optimum çözümü için adım boyutu içinde de.
- Sinyal gürültü oranı artırmak için 3 hat ortalama seçerek son tarama parametrelerini ayarlayın.
- "Start" tuşuna tıklayarak, çift ya da üçlü lekeli görüntüler farklı dalga boylarında farklı kromoforlar arasında çapraz tartışma ortadan kaldırmak için sıralı tarama elde edilir.
- Iki fluorochromes colocalisation bir göstergesi için seçilen kanallar tek bir görüntü birleştirme "overlay" fonksiyonu seçin, örneğin, Alexa 488 (yeşil) ve (kırmızı) TRITC fluorochromes hem colocalise zaman, sarı renk kaplanan görüntü görünecektir .
- Z yığınları veya seri mümkün colocalisation görselleştirmek için gerekli bir 2B görüntü yapımı için "maksimum projeksiyon" fonksiyonunu kullanarak derleyin. Colocalisation daha detaylı analiz, her optik bölümün analizi ile elde edilebilir.
- Z yığınları veya seri aldıktan sonra, çeşitli unsurları içi lokalizasyonu (Şekil 1E) görselleştirilmesi için dik bir görüntü elde etmek için verileri işlemek.
3. Colocalisation, ölçümü
İstatistiksel analizler konfokal tarama mikroskobu görüntüleri Volocity yazılım (Doğaçlama, Perkin Elmer) ile yapılmaktadır. Bu yazılım Manders ve ark (1993) 5 açıklandığı gibi colocalisation analiz için özel olarak tasarlanmış bir araç sağlar. Colocalisation dijital floresan görüntüleme bağlamında her kanalda aynı voksel (piksel hacmi) yerde bir sinyal tespiti olarak tarif edilebilir. Iki kanal aynı örnek alan (Volocity kullanım kılavuzu) alınan iki farklı fluorochromes görüntüler oluşur. İstatistiksel analizler aşağıda açıklanan Kantitatif Colocalisation Analizi Volocity yazılım kullanarak (Doğaçlama, Perkin Elmer) ile yapılmaktadır.
Kantitatif Colocalisation Analizi
- Volocity yazılımı kullanarak CLSM görüntüleri ile bir kütüphane oluşturun.
- Üst çubuktaki görüntü "genişletilmiş odak" ı seçin. Bu araç, analiz edilmesi gereken bir 2B görüntü z yığınları derlemek.
- "Ko" aracını seçin. Analiz edilmesi için iki kanal aynı renk derinliğine sahip olmalıdır.
- Sayısallaştırılmış olacak bu bölgeyi seçin. Herhangi bir arka plan çıkarmak için eşik değerlerini ayarlayın.
- "Ko oluşturmak" seçerek colocalisation çıktı oluşturun. Colocalisation istatistikler, daha önce seçilen ilgi bölgeler için oluşturulur.
- Seç Manders 'katsayıları R (üst üste katsayısı) ve (colocalisation katsayısı).
- Manders 'katsayıları toplam piksel yoğunluğu karşı normalize olarak boyanma yoğunluğu duyarlı değildir; böylece bir antijen boyama diğerinden daha güçlüdür istihdam edilebilir.
- Manders 5,6 katsayısı R bindirme gerçek colocalisation derecesi temsil eder, yani piksel piksel sayısı ile karşılaştırıldığında colocalise sayısı.
- Öte yandan, colocalisation katsayısı, Benim, daha bol benzer parçaları (bu durumda bakterilerin, kırmızı) daha bol benzer parçaları (bu durumda α-aktinin, yeşil) floresan katkı açıklar, yani kırmızı piksel sayısı kırmızı piksel sayısı ile karşılaştırıldığında, yeşil piksel ile örtüşüyor.
- Manders 'katsayıları, 1, 0 hiçbiri yüksek colocalisation olan, 1 ve 0 arasında değişir, ancak daha kolay yorumlanması için yüzdesi olarak ifade edilebilir.
- Veri sunumu için bir Excel belgesi ihracat istatistikleri değerleri.
4. Temsilcisi Sonuçlar
Hücre içi yerelleştirme Opc ifade Neisseria meningitidis ve α-aktinin
Α-aktinin (gösterilmemiştir), 3 ve 8 saat, 3 saat enfeksiyon deneylerde daha az olduğu ortaya çıktı Nm belirtilen colocalisation yukarıda açıklandığı için Nm ile enfekte insan beyninin mikrovasküler endotel hücreleri Konfokal görüntüleme, 8 saat boyunca enfekte kültürleri ile karşılaştırıldığında ( Şekil 1 AF). Opc ifade Meningokoklar α-aktinin kanıtlanabilir colocalisation> 5 çoğaltmak deneylerde her zaman gözlendi. Yukarıda açıklandığı gibi birkaç konfokal görüntüleri kullanarak colocalisation istatistiksel analizi gerçekleştirildi. Genel olarak, HBMEC ile enfekte Opc-ifade Meningokoklar, yeşil (α-aktinin) ve kırmızı (Nm) piksel>% 25 örtüşme (Şekil 2B, katsayısı R Overlap) elde edildi. Vimentin nadir içselleştirilmiş bakteri ve ya aktin ve vimentin etiketlenmesi yapıldı α-aktinin, deney aksine, zaman zaman colocalisation aktin ama gözlenmiştir (Figure. 2B).
Bu veriler de her kısmın göreceli bolluk dikkate alır katsayısı My kullanılarak analiz edildi. Daha bol sinyali (bu durumda yeşil, α-aktinin) daha az bol sinyali (kırmızı, bakteri bu durumda) ortaya her zaman ortaya çıkma sıklığı bir ölçüsüdür. Bu önlem, içselleştirilmiş Meningokok (Şekil 2A ve C) çevresinde α-aktinin, ortaya çarpıcı bir seviyesini gösterir.
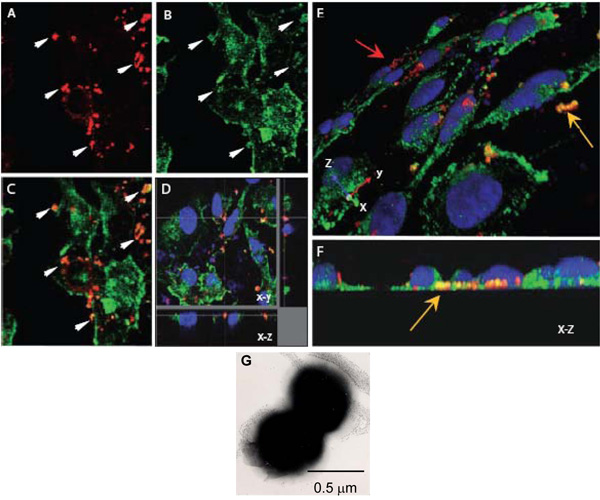
Şekil 1. N. içi etkileşimleri değerlendirmek için Konfokal lazer tarama mikroskopisi α-aktinin ile meningitidis. AH. Lamelleri yetişen konfluent endotel mono tabakaları Opc-ifade (AF) N. ile enfekte olmuş meningitidis. 8 saat sonra, yapışık olmayan bakteriler yıkandı, hücreleri paraformaldehid ile sabit ve% 0.1 Triton X-100 ile permeabilised. Daha sonra, yukarıda açıklandığı gibi bakteri ve α-aktinin (bakteri, kırmızı α-aktinin, yeşil) boyandı.
AC. Nm (A) veya α-aktinin (B) yerini xy resimlerini gösteren bir alan. (C) Bindirme görüntüsünün sarı-turuncu renkli colocalisation düşündüren göründüğü çeşitli bölgelerinde gösterir. Oklar (A) ve (B) α-aktinin birikimi yüksek derecede bakterilerin çevresinde meydana gelmiş görünüyor bölgelerde gösterir.
D., bir hücrenin üssünde bulunan, hücre içi bakteri çevresinde virüslü bir HBMEC tek tabaka belirten colocalisation Optik diseksiyonu.
Yine, bu bölgede genel α-aktinin leke olarak bu colocalisation düşük, α-aktinin yanlışlıkla yakınlığı nedeniyle değildir.
E ve F Üç boyutlu görüntüleri, yukarıdaki gibi işlenmiş enfekte HBMEC mono tabakaları. Apikal yüzey (E) oblik bir görünüm yapışkan bakteri gösterir lekeli kırmızı (kırmızı ok) endotel hücreleri (sarı ok) bazal yüzeyler doğru bulunan birkaç bakteri belirgin turuncu / sarı renkli ise. (F) bir son on XZ kesit. Bazal konumu daha net bir şekilde görülebilir.
G. N. olumsuz lekeli bir elektron mikroskobu görüntü onun gösteren meningitidisgelen baskın diplococcal. Her coccus çapı yaklaşık 0,5 mikron.
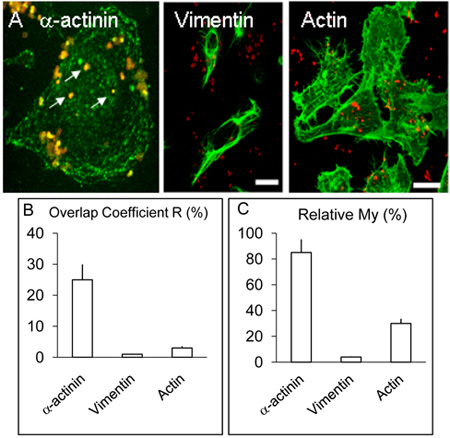
Şekil 2. HBMEC hücrelerin yerleri ve α-aktinin, aktin ve vimentin dağıtım.
A. HBMEC, Etkilenmiş mono tabakaları efsanesi yukarıda açıklanan ancak α-aktinin için ek olarak, bazı lamelleri α-aktinin için benzer bir prosedür aktin ve vimentin tespiti için kullanılan tedavi edildi. Yukarıdaki gibi, α-aktinin birkaç içselleştirilmiş bakteriler (beyaz oklar) etrafında yoğunlaştı. Vimentin ve aktin kayda değer seviyelere bakteri ile colocalise vermedi. Bar 20 mikron temsil eder.
Katsayıları R ve My B. ve C. değerleri üçten fazla deneyler yukarıda açıklandığı gibi Volocity yazılımı kullanılarak elde edilmiştir.
Tartışmalar
Bağlayıcı olasılığı içselleştirilmiş Opc HBMEC ifade α-aktinin Neisseria meningitidis bakteri colocalisation muayene ve sitoskeletal 3 ve 8 saat kuluçka süresinden sonra enfekte hücrelerde protein kullanılarak incelendi. Konfokal mikroskopi, Neisseria meningitidis ile α-aktinin colocalisation göstermiştir olabilir. Özellikle, bakteriler 3 saat içselleştirmiş olmasına rağmen, bu zaman noktasında α-aktinin küçük colocalisation vardı. Sitoskeletal protein ile Bakteriyel dernek intrasellüler ikamet 8 saat enfeksiyon döneminden sonra uzun bir süre gerektirir, bakteri sayısının önemli ölçüde yakın ilişki görünüşte α-aktinin vardı. Alfa-aktinin, çok fonksiyonlu bir protein ve sitoskeletal elemanı ile bakteriyel etkileşimleri, mevcut çalışmaların bir konudur hedef hücre fonksiyonu üzerinde önemli bir etkisi olabilir.
Colocalisation Kantitasyonu yukarıda açıklandığı gibi, titiz bir örnek hazırlık gerektirir. Özellikle dikkat süresi ve antikor dilüsyonları engelleme, sabitleme örnek verilmelidir. En iyi sinyal gürültü oranı için optimum konsantrasyonlarını belirlemek için ön deneyler, her birincil ve ikincil antikor titre edilmesi gerekir. Deneyimlerimize göre, montaj orta Mowiol Daha iyi görüntü üretti.
Açıklamalar
Teşekkürler
Çalışmalar Wellcome Trust ve Menenjit UK tarafından finanse edilmiştir. HBMEC hücre hattı Dr. KS Kim tarafından sağlanmıştır. Konfokal görüntüleme ve elektron mikroskobu Wolfson bio Tesisi, University of Bristol yapıldı. Bay Alan Leard Dr Mark Jepson (University of Bristol), ve Sayın Alan Tilley (Perkin Elmer) Biz de onların yardım ve tavsiye için teşekkür etmek istiyorum.
Malzemeler
1. Konfokal Lazer Tarama Mikroskobu (CLSM):
Leica SP5 konfokal görüntüleme sistemi: Bu sistem, AOTF bir kombinasyonu (acousto optik arasında ayarlanabilir filtre) ve Kelime Size Neyi Çağrıştırıyor (acousto optik demeti splitter) kullanarak, belirli dalga boyları ile uyarma kolaylaştırır.
2-Yazılım:
Leica konfokal yazılımı LCS, Leica Microsystems, Almanya.
Volocity 5, Doğaçlama, Perkin Elmer, ABD.
Referanslar
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır