Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bağışıklık Hücreleri murin aorta içinde Sitometrisi Analizi
Bu Makalede
Özet
Bu yazıda, aorta bağışıklık kompozisyonu araştırmak için flow sitometri tabanlı bir yöntem sunmaktadır. Kağıt aynı zamanda çevresindeki adventisya ve damar duvarında ayrı ayrı inceleyerek sağlayan ek bir teknik göstermektedir. Bu yöntem, aort lökositlerin fenotipik analizler gerçekleştirmek ve ateroskleroz çalışmalar için çeşitli immünolojik testleri uygulamak için imkanlar açılır.
Özet
Ateroskleroz, orta ve büyük boy damarların köpük hücreleri, bağışıklık hücreleri, damar endotel ve düz kas hücreleri, trombositler, ekstrasellüler matriks ve geniş nekroz ile zengin bir lipid çekirdek oluşan plakların oluşumu ile karakterizedir ve kronik inflamatuar süreç çevre dokulara fibrozis. aterosklerozun başlaması, geliştirme ve sebat 1 doğuştan gelen bağışıklık yanıtının ve adaptif silah olarak katılıyor. 2, 3 Orada önemli bir kanıt gibi makrofajlar gibi bağışıklık hücreleri, farklı alt dendritik hücreler, T ve B lenfositleri, sağlıklı ve ateroskleroz eğilimli fareleri 4 aorta içinde mevcut. Ayrıca, bağışıklık hücrelerini çevreleyen aort adventisya aterogenezde bu doku önemli bir rol öneren bulunur. 2
Bir süredir, bağışıklık hücreleri, kendi aktivasyon durumu ve aort duvarının içinde hücresel bileşimi farklı türde kantitatif tespit ateroskleroz çalışması için RT-PCR ve immünhistokimyasal yöntemler ile sınırlıdır. Birkaç denemeden insan aorta kullanılarak flow sitometri gerçekleştirmek için yapılmıştır ve böyle yüksek bir otofloresans gibi bir dizi sorunlar, 5,6 bildirilmiştir. İnsan aterosklerotik plakların kollajenaz 1 ile sindirilir ve boş hücreleri CD14 için toplanan ve boyandı + / CD11c + türevi makrofaj köpük hücreleri vurgulamak için. Bu çalışmada, bir "alay" kanal yanlış pozitif boyanma önlemek için kullanılır oldu. Aort örneklerinde yüksek otofloresans üretir enkaz büyük miktarda artış, sindirim işlemi sırasında biriken 6 Nekrotik malzeme vermek . Bu sorunu gidermek için, negatif ve pozitif kontroller bir panel teklif oldu, fakat bu örnekler sadece çift boyama uygulanan olabilir. Biz bağışıklık hücre kompozisyon analiz ve aktivasyon, çoğalması, bağışıklık hücrelerinin sağlıklı ve ateroskleroz eğilimli aort farklılaşma karakterize etmek için yeni bir akım sitometri tabanlı bir yöntem 7 geliştirdik. Bu yöntem, aort duvarının bağışıklık hücre kompozisyon soruşturma sağlar ve bu hastalık bağışıklık yönlerini araştırmalar için geniş bir yelpazede immünolojik yöntemler kullanmak için imkanlar açılır.
Protokol
1. Fare aorta izolasyonu
Prosedürü Kurumsal IACUC komite onayı fare ile çalışmak gereklidir.
- Heparinzed PBS heparin sodyum 1000 adet 50 ml PBS ve karıştırmak için tersini tüp ekleyerek hazırlayın. Kan ve tahsil edilecek her aort PBS içeren bir toplama tüpü boş bir toplama tüpü hazırlayın. Tüm tüpler buz tutun.
- Heparinize çizim kan (1000 U / ml Heparin sodyum 0.1ml) için bir şırınga, cerrahi aletler (iki çift kavisli bir forseps, diseksiyon makas bir çift ve bir çift microshears) ve diseksiyon için bir diseksiyon sahne hazırlar.
- NIH ve kemirgen ötenazi ile ilgili kurumsal IACUC komite politikalar izleyerek onaylanmış bir odasında karbon dioksit kullanarak bir fare Euthanize. Diseksiyon aşamasına fare aktarmadan önce etkinliği için kontrol edin.
- Kısaca,% 70 etanol ile fare ıslatın ve diseksiyon aşamasına fare sıkın. Kalp ponksiyonu ile fare kan çizin.
- Karın ve göğüs boşluklarında açın. 25 g bir iğne ile 10 ml enjektör kullanılarak, tamamen PBS tamamen, kalp ponksiyon tarafından damarlarının kan kaldırmak için% 2 heparin içeren damarsal serpmek. Aort dokular içinde hiç kan olduğundan emin olun. Perfüzyon damar duvarındaki tüm plaklar sağlam kalmasını sağlamak için küçük bir basınç ile yavaş yavaş yapılmalıdır.
- Visseral organlar, genitoüriner organlar, diyafram ve dalak, böbrekler, kalp, aort zedelemeden inceleyin ve çıkarın.
- Dikkatle aort ve adventisya zedelemeden, adipoz doku ve para-aortik lenf nodlarının disseke aorta uzak. Arkus aorta dahil olmak üzere tüm aorta toplayın artan, göğüs ve karın kısımları azalan. PBS ile bir toplama tüpüne izole aort yerleştirin. Izolasyon prosedürü sırasında, geminin nemli tutmaya çalışın.
2. Tek hücre süspansiyonlarının hazırlanması
- 1X Aort Ayrılma Enzim stok Çözümü (ADES) (125 U / ml kollajenaz tip XI, 60 U / ml Hyaluronidase tip 1-s, 60 U / ml DNaz I, 450 U / ml kollajenaz tip I, 2.5 ml PBS, Galkina ark güncellenmiştir 7). Tüm enzimler Sigma-Aldrich. Buz üzerinde stok enzim çözeltisi koyun.
- PBS aort içeren toplama tüpünden çıkarın. Her aort 1X ADES 2.5 ml ekleyin. Enzimatik sindirimi kolaylaştırmak veya tüm aorta dokunmadığınızdan aorta küçük parçalar halinde kesin. 1 saat 37 1X enzim solüsyonu ile aorta ° C'de (yavaş sallayarak isteğe bağlıdır).
- 1 saat inkübasyondan sonra, aorta ayrı kesme ve onları 5ml polipropilen FACS tüpleri (BD Falcon), 70 mikron hücre süzgecinden geçen sindirilmiş aort tek hücre süspansiyonları hazırlamak. Pelet santrifüj hücreleri tarafından (400xg, 5 dakika, 4 ° C).
- FACS tamponu (PBS,% 1 BSA ve% 0.05 NaN 3 ile desteklenmiş) 1ml hücrelerin yeniden süspanse ve tripan mavi, bir hemasitometre ve ışık mikroskobu kullanılarak aort hücre süspansiyonu kaç hücreleri belirlemek . Sindirim sonra elde edilen hücrelerin toplam sayısı fare yaş ve diyet veya ateroskleroz şiddeti bağlıdır.
3. Flow sitometri boyama
- Yeni FACS tüpleri uygun bir numarası etiketi. Genel olarak, akış sitometri deneyler, tek renk tüpleri, uygun floresan-eksi denetimleri (FMO) 8, uygun izotip kontrolleri ve bir dizi deney tüpleri olmayan bir lekeli bir kontrol tüpü, olmalıdır. Izole edilebilir aort lökositlerin sınırlı sayıda olduğundan, dalak lökosit tek kontrol boyama gerçekleştirmek için kullanılabilir.
- Aort hücre süspansiyonları leke standart bir flow sitometri protokolünü kullanır. Kısaca, bir kısım FACS tüp (ler) içine bir aort hücre süspansiyonu 0.5-1x10 6 hücre transferi. Santrifüj yoluyla hücreler FACS tampon ve pelet 1 ml ekleyin. Şişeden pelet hücrelerden süpernatantı.
- Fc blok çözüm ve antikor kokteyller, deney tüpleri, eksi bir floresan tüpler ve izotip tüpleri hazırlayın. 100μl, tüm boru ve parmak hareketiyle veya hücrelerin tekrar süspansiyon yavaşça girdap Fc FACS tampon bloğu (14.2μg/ml, klon 2.4G2) ekleyin. Örnekleri oda sıcaklığında 15-20 dakika inkübe edin.
- Antikor boyama, izotipi boyama ya da FMO kontrol boyama kokteyller hazırlayın. Ön titrasyon deneylerinde antikor konsantrasyonu optimal belirleyin. Fc bloğun varlığı, numune tüpleri antikor kokteyller (100ul/0.5-1.0x10 6 hücreli) ekleyin. 20-30 dakika süreyle 4 ° C'de karanlıkta.
- Her tüpe 1 ml FACS tampon ekleyin, girdap santrifüj yoluyla hücrelerin karışımı, ve pelet için. Prosedürü bir kez daha tekrarlayın.
- Supernatant ve tekrar süspansiyon Durusu% 2 PFA 300μl pelet hücreleri. Bir akış sitometresinde örnekleri çalıştırın.
- Not: Genelde anti-CD45 antikor (yaygın lökosit antijen marker) + lökosit sonra kapı CD45 için tüm örneklerin eklenir 7 Buna ek olarak, CD45 FMO ve izotipi kontrolleri CD45 + lökosit kapısı olarak yerleştirmek için başlangıçta kullanılan olmalıdır. CD45 ifade lökosit arasında değişebilir.
- Not: düşük yoğunluklu yüzey antijenlerini ifade ya da düşük olay antijenleri saptamak için, Ar-Fikoeritrin (PE) veya Allophycocyanin (APC) gibi "parlak fluorochromes" kullanın. Buna ek olarak, birlikte birkaç eşleştirilmiş aorta havuzu nadir olaylar tespit edilebilir; ancak, bir milyondan fazla hücre kullanılması durumunda, test başına kullanılan antikorların miktarı orantılı artmıştır edilmelidir.
- Not: izole aorta minimal kan Bulaşmayı olmadığından emin olmak için ve dolayısıyla aort hücre süspansiyonu, bazı deneyler TER-119, 7 kırmızı kan hücreleri (RBC) tarafından ifade edilen bir antijen için ek boyama yapıldı . Kandaki beyaz kan hücreleri (WBC), eritrosit sayısı, yaklaşık 10x10 6 hücre / ml 8x10 3 hücre / ml. TER-119 aort örnekleri ifade dayanarak, örnek kan elde edilen beyaz kan hücrelerinin yüzdesi hesaplanır. Genelde biz aort örneklerinde% 0.02 daha az kan elde edilen WBC (Şekil 1 )
- Not: enzim tedavisi yüzey antijenlerini ifade etkileyebilir, enzim sindirimi direnç ilgi antijenler için tespit edilmelidir. Kısaca, periferik lenf nodu (PLN) veya dalak küçük parçalar 37 ° C veya enzim kokteyl olmadan 1 saat süreyle inkübe. 1 saat sonra, antijenlerin ifade flow sitometri ile belirlenir. Enzim kokteyli, birden fazla yüzey antijenleri (Şekil 2) 7 üzerinde herhangi bir etkisi vardır . Diğer bazı durumlarda, enzim tedavisi antijen ekspresyonunun önemli bir kayıp sonuçlandı. Bu sorun, alternatif hücre belirteçleri kullanarak atlatılabilmişlerdir olabilir.
- Not: Canlı / ölü hücre canlılığı boyama, istenirse adım 4'te sonra yapılabilir. Genellikle Live / Dead fixable Ölü Hücre Leke kiti (Invitrogen, Moleküler Problar) kullanın. Live / Dead boya hücreleri leke için, yeniden çözünmüş ölü / canlı boya karıştırmak için 1 ml PBS ve vorteks 1μl ekleyerek 1x Live / Dead çözüm oluşturmak. 1x Live / Dead boya 100-200 ul ölü / canlı tek, kokteyl, FMO ve izotip kontrol örnekleri ekleyin. Örnekleri oda sıcaklığında 10 dakika karanlıkta boya ile inkübe edin. Için tek bir kontrol tüpü Dead / Canlı 56 inkübe edilmelidir ° C ısı şok hücrelerini öldürmek için 10 dakika karanlık. 1 ml santrifüj yoluyla PBS ve pelet hücreleri hücrelerin yıkayın. 5. adımı protokol devam edin.
- Not: Hücre içi boyama, hücre içi antijenleri ve sitokinler için bu protokol ile uyumlu. - Kısaca ilgi antijenleri bağlı olarak, hücre içi boyama eBioscience BD Pharmingen, ya da Caltag laboratuvarlar hücre sabitleme / permeabilization reaktifler kullanarak olabilir. Düzeltmek ve intraselüler boyanması için hücreler permeabilize için, ekstrasellüler boyama adım sonra (bölüm 3 adım 5), üreticinin talimatları izleyerek, tespiti / permeabilization adım gerçekleştirmek. Hücre içi yıkama adım adım 6 (bölüm 3 adım 6) protokol devam.
4. Izole çevresindeki adventisya ve damar duvarında Flow sitometri analizi
Lökosit flow sitometri adventisyal ve aort lökosit incelemek için aort adventisya aort duvarının içindeki aterosklerotik plakların yanı sıra göç gibi bu iki anatomik sitelerinde flow sitometri izole etmek ve gerçekleştirmek için bir protokol geliştirilmiştir. 9 Kısaca, tüm aorta önce ADES (Bölüm 2, adım 2) aort adventisya kısmen sindirilmiş ve geminin geri kalanı kaldırılır sindirilir. Adventisya kaldırıldı ve bir kenara koyun sonra geri kalanı, aort damar duvarında lökosit kurtarmak için ADES sindirilir.
- Aort adventisya İzolasyon Protokolü
- 1X ADES (bölüm 2 Adım 1) hazırlanmasını takiben, 2.5 ml / 1X Aort adventisya sindirim enzim çözeltisi (AADES) (781,25 U kollajenaz II ve 2.5mls PBS (Worthington biyokimyasal Corp, Lakewood, NJ 14,0625 U elastaz aort hazırlamak kullanana kadar buz üzerinde)). 9 Place stok solüsyonu.
- PBS aort içeren toplama tüpünden çıkarın. Her aort 1X AADES 2.5 ml ekleyin. Aorta küçük parçalar halinde kesmeyin. 10-20 dakika boyunca 37 ° 1X adventisya enzim solüsyonu ile aorta inkübe ° C
- , 10-20 dakika sindirim sonra, taze PBS ile bir petri 1X AADES kısmen sindirilmiş aort dışarı aktarmak. Çok dikkatlice uzakta fr adventisyal tabakası kabuğu, iki çift kavisli bir forseps kullanarakom tek bir birim olarak aort.
- Not: Daha uzun sindirimi kolay adventisya kaldırmak için; Ancak, adventisya fazla sindirilir eğer gözyaşı olacak.
- Adventisya tamamen kaldırıldı, adventisya ve ayrı FACS tüplere aort aktarın. Adventisya tüp PBS 1ml ekleyin ve buz tüpü. Aorta tüp 2.5 ml 1X aort disosiasyon enzim çözeltisi ekleyin ve aort 40 dakika inkübe 37 ° C
- Not: enzimatik sindirimi kolaylaştırmak için, bu noktada küçük parçalar halinde aort kadar bölünmüş olabilir.
- , 40 dakika sindirim sonra, buz aorta tüp yeri ve dışında aorta ve adventisya kesme ve 5ml polipropilen FACS tüpleri (BD Falcon), 70 mikron hücre süzgecinden geçerek aort ve adventisya tek hücre süspansiyonları hazırlamak. Pelet santrifüj hücreleri tarafından (400xg, 5 dakika, 4 ° C). Bölüm 2 4. adıma dönün ve protokol devam.
5. Temsilcisi Sonuçlar
Burada bütün aorta bağışıklık bileşimi, aort damar duvarı ve çevre aort adventisya analiz etmek için boyama flow sitometri gösteren rakamlar bir dizi sunuyoruz. İlk olarak, tam kan ve izole aort hücre süspansiyonu (Şekil 1) TER-119 boyanma gösteren temsili bir FACS arsa göstermektedir. TER-119 pozitif kırmızı kan hücreleri aort hücre süspansiyonları izole hücrelerinin sadece% 0,014 kan kaynaklı olduğunu gösteren aort hücre süspansiyonu, hücrelerin% 18 oluşturmaktadır. Bu sindirilir damarları açıkça gösteren önemli bir kontrol deneyi, ancak aort hücre süspansiyonu analiz lökositlerin en için periferik kan dolaşan kaynağıdır. Buna ek olarak, yöntem doğrulamak için, biz splenocyte yüzey antijenlerini aort disosiasyon enzim kokteyli (Şekil 2) etkileri değerlendirildi. Enzim kokteyli dahil olmak üzere, çeşitli antijenler CD45, CD19, CD3, TCRαβ TCRγδ ve diğer bazı yüzey antijenlerini 7 ifadesi üzerinde herhangi bir etkileri vardır.
Dead / Canlı canlılığı boya ve uygun izotip kontrolleri ile birlikte CD45 boyanma tespit ve ilgi alt kapısı büyük bir nüfus ve analizi sırasında hücresel enkaz dışlamak için kullanılır. Şekil 3, canlı aort CD45 + lökosit IFN yüzdesini belirlemek için kapı vardı Υ iki genç ApoE toplanmış aorta içinde + T hücreleri - / - fareler. Şekil 3 sunulan yolluk düzeni kullanarak, bu yöntemin çok yönlülüğünü vurgulamak için, Şekil 4 iki ApoE CD68 + CD11b + makrofajlar ve IFNγ + TCRαβ + hücreler için temsili hücre içi boyama bulunan 12 - / - farelerde beslenen batı diyet hafta. / - Batı diyet beslenen ApoE beklenmektedir. Aorta, aort içinde lökosit çoğunluğu makrofajlar (40% CD68 + CD11b +) veya diğer miyeloid hücrelerin (CD11b + düşük CD68 ve CD11b + CD68-) Buna ek olarak, Th1 hücreleri TCRαβ T hücreleri (Şekil 4) infiltre aort önemli bir kısmını oluşturmaktadır. Aort lökositler ve lökosit alt kümelerini toplam yüzdesi, fare ve ateroskleroz şiddeti yaşına bağlı olarak değişir, ilgi büyük popülasyonlar için optimal yolluk strateji ampirik olarak tespit edilmelidir
Flow sitometri boyama için aort adventisya izole fizibilite göstermek için, biz temsilcisi CD45 mevcut + aort ve adventisyal hücre süspansiyonları lökosit boyama (Şekil 5). Kısaca, üç yaşlı apoE - / - fare aorta sindirilir ve yukarıda açıklandığı gibi (Bölüm 2 ve 4) bir araya toplanmış. CD45 + lökosit İnfiltratif adventisya hücre süspansiyonu (% 18) ve kalan aort hücre süspansiyonu (% 11) tespit edildi.
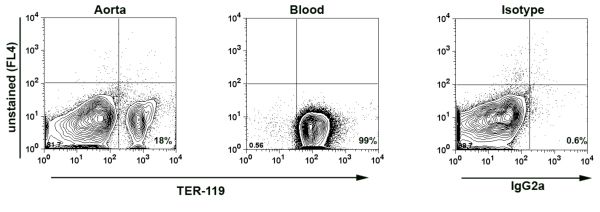
Şekil 1 sindirilir aort hücre süspansiyonu TER-119 boyanmasının. Aort PBS% 2 heparin içeren kardiyak ponksiyon ile perfüze edildi. Sonra aort 37 ° C 1 saat için enzim kokteyli ile sindirilir. Aort hücreleri süspansiyon ve kan örneği (Pozitif kontrol olarak) anti-TER-119-PE Abs ile boyanmış ve flow sitometri ile analiz edildi. % 18, aorta izole bütün lökositlerin sadece% 0,014, kan kökenli lökosit olması muhtemel olduğunu belirten aort hücre süspansiyonu tüm hücreler için TER-119-pozitif kırmızı kan hücreleri hesabı.

Şekil 2. Enzim-CD45 (üst) veya CD19 (alt) lenfositlerin ifade kokteyl tedavi etkileri vardır. tedavi edilmezse (A, B) ve enzim kokteyli (C, D) ile tedavi edilen hücre süspansiyonlar LN elde edilen ve APC-Cy7-konjuge anti-CD45 ve APC-konjuge anti-CD19 mAb ile boyandı. (A, C) numaraları R1 kapısı CD45 + lökosit yüzdelerini temsil eder. (B, D) numaraları CD45 + / CD19 + lenfosit yüzdeleri temsil eder. Profiller CD45 + lökosit kapılı.
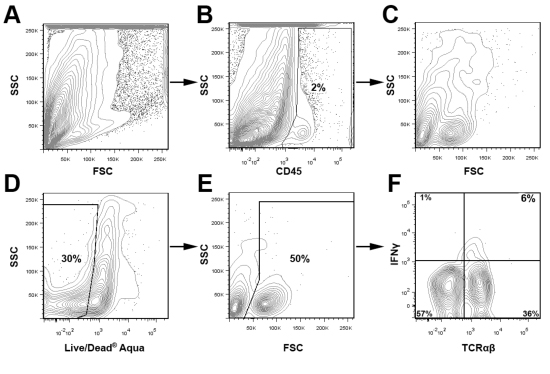
Şekil 3 aort lökosit analizi için Ayırıcı strateji aterosklerotik eğilimli ApoE iki aorta izole toplandı. / - Yukarıda açıklandığı gibi, fareler ve aort hücre süspansiyonları hazırlandı . Hücre süspansiyonları CD45 (PerCP), TCRαβ (FITC), IFNγ (eFluor 450), ve Ölü / Live Aqua boyanmış, ve BD FACS Calibur yükseltilmiş bir Cytek DXP 8 Renk kullanılarak analiz edildi. Kısaca, CD45 + lökosit kapılı (B) ve daha fazla (CF) analiz. Ölü hücreleri Dead / Canlı Aqua boyama (D) ve FSC araziler (E) dayalı analiz çıkarıldı. Canlı aort lökosit TCRαβ ve IFNγ ifade (F) incelendi.
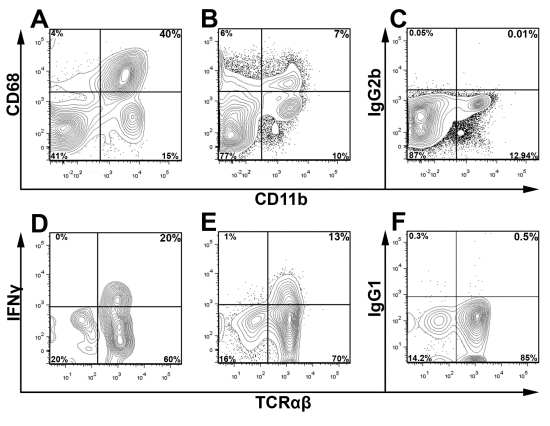
Açıklandığı gibi aorta ve dalak - / - Şekil 4, hücre içi antijenleri ve sitokinler için intrasellüler boyama Hücre süspansiyonları bir bütün ApoE hazırlanmıştır . Aort (A) ve (B, C) dalak hücre süspansiyonları, CD11b, CD45 ve CD68 veya BD Cytofix / Cytoperm ™ Kiti (BD Biosciences) kullanarak bir izotip kontrol için boyandı. Hücreler CD45 + lökosit kapılanan ve enkaz ileri ve yan dağılım profilleri çıkarılmıştır. Intrasellüler IFNγ boyama için, aort ve dalak hücre süspansiyonları daha önce açıklandığı gibi, Golgi durdurma, PMA, ve Ionomycin C ile desteklenmiş RPMI 1640 yılında beş saat için kültüre edildi. 9 hücre süspansiyonları tek aort (D) ve dalak (E, F) Uyarılmış veya izotip (IgG1-eF450, F); sonradan CD45 (PerCP), TCRαβ (FITC), CD3 (APC Cy7) ile boyandı, Live Ölü Aqua ve IFNγ (E eFluor 450). T hücreleri (DF) kapılı canlı CD45 + CD3 + lökosit (CD45 + Dead / Canlı Aqua-) ve TCRαβ ve IFNγ incelenir.
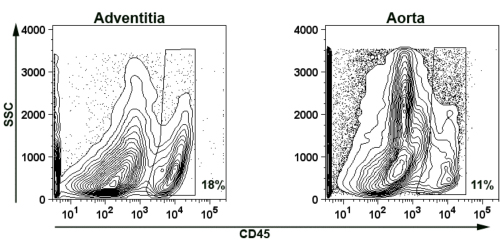
/ - Fareler Şekil 5 izole fare aort adventisya ve aort damar duvarında Temsilcisi görüntü Temsilcisi flow sitometri karşı komplo varlığı CD45 + yaşlı ApoE adventisya ve aort duvarının T hücreleri gösterir. SSC-yan dağılım. Enkaz ve nekrotik doku otofloresans ortadan kaldırmak için, araziler FSC> 750 kapılı. Kapıları da FSC <3500, SSC <3500 olarak belirlendi çiftlerin ek otofloresans önlemek için. Yüzdeleri kapıları CD45 + hücreler gösterir.
Tartışmalar
Burada, fare aorta bağışıklık hücre kompozisyon, soruşturma için bir akış sitometri tabanlı bir yöntem mevcut. Bu yöntemin en büyük avantajı, tek bir hücrenin düzeyde aort bağışıklık hücrelerinin analiz etmek ve aort lökositlerin aktivasyonu durumunu karakterize etmek için yeteneğidir. Bu yöntem, fare aorta sınırlı ve (yayınlanmamış veri) ve diğerleri 10 internal meme arter, aort kapakları ve koroner arterler olarak insan örnekleri analiz etmek için bu yaklaşım değildi...
Açıklamalar
Teşekkürler
PO1 HL55798 (KL) ve Amerikan Kalp Derneği Scientist Kalkınma Hibe 0525532U (EG): Bu çalışma Ulusal Sağlık hibe Enstitüleri tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Malzeme | Katalog Numarası | Şirket | |
| Kollajenaz XI. | C7657 | Sigma-Aldrich | |
| Hyaluronidase | H3506 | Sigma-Aldrich | |
| DNaz I, tip 2 | D4527 | Sigma-Aldrich | |
| Kollajenaz I | C0130 | Sigma-Aldrich | |
| Kollajenaz II. | LS004174 | Worthington Biyokimyasal Şirketi | |
| Elastaz | LS002292 | Worthington Biyokimyasal Şirketi |
Referanslar
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır