Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kalmodulin bağlayıcı Proteinler, Pull-down
Bu Makalede
Özet
Kalmodulin (CAM) açılan test CaM çeşitli proteinler ile etkileşimi araştırmak için etkili bir yoldur. Bu yöntem, etkili ve spesifik CaM-bağlayıcı proteinlerin analizi için CaM-sepharose boncuk kullanır. Bu hücresel fonksiyonları CaM sinyal keşfetmek için önemli bir araç sağlar.
Özet
Kalsiyum (Ca 2 +), çeşitli mekanizmalar aracılığıyla hücresel fonksiyonları düzenleyen hayati bir iyon . Ca 2 + sinyalizasyon kalmodulin (CaM) 1,2 olarak bilinen kalsiyum-bağlayıcı protein aracılığıyla. CaM apoptoz, metabolizma, düz kas kasılması, sinaptik plastisite, sinir büyüme, enflamasyon ve immün yanıt da dahil olmak üzere hemen hemen tüm hücresel süreçleri birden fazla seviyelerde yer almaktadır. Proteinlerin bir dizi CaM ile etkileşim yoluyla bu yollar düzenlenmesine yardımcı olurlar. Bu etkileşimlerin bir çoğu, Ca 2 +, Ca 2 +-devlet (ApoCaM) 3 karşı (Ca 2 +-CaM) bağlı farklı CaM, konformasyon bağlıdır .
Çoğu hedef proteinlere Ca 2 bağlama iken + CaM, bazı proteinler sadece ApoCaM bağlamak. Neuromodulin 4, neurogranin (Tr) 5, ve belirli Miyosinler de dahil olmak üzere kendi IQ etki alanı ile Bazı bağlama CaM fonksiyonu 7, 8 postsinaptik fonksiyonu, ve kas kasılması 9 önemli rol oynamaktadır gösterilmiştir . Bağlamak ve Ca 2 varlığı veya yokluğu CaM serbest + yeteneklerini kendi fonksiyonu çok önemlidir. Buna karşılık, birçok proteinler sadece Ca 2 +-CaM bağlamak ve onların aktivasyonu için bu bağlayıcı gerektirir. Örnekler miyozin hafif zincir kinaz 10, Ca 2 + / CaM-bağımlı kinazlar (CaMKs) 11 ve fosfatazlar (örneğin kalsinörin) 12 ve 14 doğrudan ve mansap etkileri bir çeşitlilik var spectrin kinaz 13, içerir.
Bu proteinlerin hücre fonksiyonu üzerinde etkileri genellikle CaM Ca 2 +-bağımlı bir şekilde bağlamak için yeteneklerini bağlıdır. Örneğin, farklı mutasyon bu bağlayıcı nasıl etkilediğini sinaptik fonksiyon Tr-CaM bağlama uygunluğu test edilmiş ve. Biz bir GFP etiketli Ng con oluşturulanNg, Ca 2 +-bağımlı bir şekilde CaM bağlamak yeteneğini değiştirmek istiyorsunuz IQ etki alanında belirli mutasyonları ile yapı . Sinaptik fonksiyon 8,15 yer alan önemli süreçler, bu farklı mutasyonlar çalışma bize büyük bir fikir verdi. Ancak, bu tür çalışmaların, mutasyona uğramış proteinler CaM beklenen değiştirilmiş bağlayıcı sahip olduklarını göstermeleri şarttır.
Burada, örnek olarak CaMKII ve Ng kullanarak, Ca 2 + varlığı ya da yokluğu CaM bağlamak için proteinlerin yeteneğini test etmek için bir yöntem sunar. Bu yöntem afinite kromatografisi CaM açılan test olarak adlandırılan bir form. CaM-sepharose boncuk CaM ve Ca 2 + bağlayıcı bir etkisi bağlayan proteinleri test etmek için kullanır. Bu verimli, çok daha fazla zaman ve kolon kromatografisi ve diğer testleri göre daha az protein gerektirir. Toplamda, bu Ca 2 + / CaM sinyalizasyon ve proteinlerin ki keşfetmek için değerli bir araç sağlarCaM ile teract.
Protokol
Homojenat prosedür başından temel bir şematik Şekil 1 bakın. Elüsyon CaM bağlı proteinler, hücre ekstreleri hazırlanması için tahmini süre yaklaşık altı-yedi saat.
1. Doku hazırlanması
- Organotipik hipokampal dilim ilgi rekombinant protein (bu örnekte, yeşil flüoresan protein (GFP) etiketli Ng) ve doku gecede protein ifade etmek için izin ifade eden bir plazmid içeren bir virüs enjekte edilir.
- Yaklaşık 12 ila 18 saat viral enjeksiyondan sonra (viral ifade bağlı olarak), doku toplamak için hazırlamak. Petri 1mL diseksiyonu tamponu (5% O 2 CO 2% 95 ile gaz verilerek 10mM glikoz, 4mm KCl, NaHCO3 26mm, 233mm sakaroz, 5mM MgCl 2, 1mm CaCl 2 ve% 0.1 fenol-kırmızı,) ekleyin. Petri kültür dokusu / eklemek aktarın ve doku batığın eklemek için 2mL diseksiyonu tampon ekleyin.
- Toplamat doku hafifçe bir neşter kullanılarak ekleme zarının serbest kazıma Organotipik hipokampal doku (5 ila 10 dilim). Özellikle ilgi belirli bir bölgede (örneğin CA1) kaldırmak da bir seçenektir. 1.5mL mikrosantrifüj tüp ters bir Pasteur pipeti kullanarak askıya alınan doku transferi.
- 1 dakika için 1500 RCF diseksiyonu tampon ayrı doku örnekleri santrifüjleyin. Aspirasyon ile süpernatantı dikkatlice çıkarın. Pelet rahatsız değil emin olun.
- Kullanılan her dilim için, homojenizasyon tampon (150mm NaCl, 20mm Tris pH 7.5, 1mm DTT, 1μg/mL leupeptin, 1μg/mL chemostatin, 1μg/mL antipain, 1μg/mL pepstatin ve% 1 Triton X 30 60 mcL ekleyin -100) doku ve havaneli ile iyice karıştırılır.
- Hücresel enkaz kaldırmak için, 10 dakika süreyle 1100 RCF kalan Homojenat santrifüj ve pelet gelen kirlilik kaçınarak dikkatle aspirasyon ile süpernatantı kaldırmak.
- Girişi (örnek 1) bir örnek olarak süpernatant% 10 atın. 3. adımda kullanmak için CaM-sepharose boncuk hazırlanması sırasında buz üzerinde kalan süpernatant saklayın.
Not: Burada kullanılan doku Organotipik hipokampal dilimleri. Ancak, bir ayrışmış nöron ya da başka herhangi bir hücre kültür sistemi kullanabilirsiniz. Böyle bir durumda, uygun bir şekilde doku toplama sonra 1.4 adım başlar.
2. Açılan boncuk hazırlanması
Boncuk işleme, boncuk boncuk tüp tarafta kurumasını engelleyerek kurtarma ve reaksiyonların verimliliği en üst düzeye çıkarmak için önemlidir. Bunu yapmak için, hemen santrifüj önce, çözüm tüpün duvarlarına boncuk ıslak izin, kendi taraflarında tüpler döndürmek için en iyisidir.
- Çünkü her açılan askıya Kalmodulin-sepharose boncuk, 2 mL mikrosantrifüj tüpe pipet 400 mcL nispeten flat-alt inkubasyon sırasında boncuklar ile çözümler yüzey alanı ve etkileşimi en üst düzeye çıkarmak için.
- 30 saniye boyunca 21.000 RCF boncuk Santrifüj ve dikkatli bir aspirasyon ile süpernatantı kaldırmak. Boncuk rahatsız değil emin olun.
- Boncuklar yıkamak için açılan Ca 2 +-Cam boncuklar için bağlayıcı proteinlerin ve 2 mM EDTA (Ca 2 bilinen + şelasyon) aşağı çekmek için kullanılan bu CaCl 2 2 mM ya içeren ilgili homojenizasyon tampon 100 mcL ekleyin ApoCaM bağlayıcı proteinlerin. 1 dakika için 1500 RCF yavaşça yeniden askıya boncuk ve santrifüj tüp dokunun. Boncuk rahatsız değil emin olun, aspirasyon ile süpernatantı dikkatlice çıkarın.
Not: tüm aspirasyon adımlar için, boncuk çıkarmadan çözüm çıkarılmasına olanak sağlayan güzel bir açılış (örneğin jel yükleme ipuçları) bir pipet kullanılması tavsiye edilir.
3. Proteinlerin CaM-sepharose bağlanma
- Bir eşit miktarda içeren iki koşula süpernatant Bölünmüş. Durumuna bağlı olarak, her biri için 2 mM konsantrasyon supernatant CaCl 2 veya EDTA uygun miktarda ekleyebilirsiniz.
- Ilgili homojenizasyon tamponunda yıkanan boncuk adım 1.7 'den süpernatant ekleyin. Yavaşça karıştırın tüp dokunun.
- 4 ° C 'de örnek bir çalkalayıcı üzerinde 3 saat süreyle inkübe edin. Bağlama verimliliğini artırmak için boncuklar her 30 dakikada bir ya da yeniden askıya alabilir.
- 3 dakika santrifüj tüpüne 1.500 RCF içeren örnekleri ve boncuklar.
- Süpernatant 50μL bağlanmamış protein (örnek 2) bir örnek olarak alın ve dikkatli bir aspirasyon ve atın geri kalan süpernatant kaldırmak.
- 100μL ilgili homojenizasyon tampon kullanarak adım 2.3 'de açıklandığı gibi boncuk üç kez yıkayın.
4. Elüsyon
- Tam tersi bir durum (10mM C içeren elüsyon tampon (50mm Tris-HCl, pH 7.5, ve 150mm NaCl) 50μL ekleboncuklar ACL 2 veya 10mM EDTA). Örneğin, Ca 2 içeren tampon homojenize ve bağlı idi örnek + EDTA ve tersi elüsyon tampon içeren kolonda sürüklenecektir.
İsteğe Bağlı: boncuk ekleyerek verimi artırabilir elüsyon tampon Isınma 37 ° C önce.
- Çalkalayıcı üzerinde 30 dakika süreyle oda sıcaklığında boncuklar ile inkübe edin çözüm. Her 5 dakikada yaklaşık tüp hafifçe dokunarak boncuk karıştırın.
- 3 dakika 1500 RCF boncuk Santrifüj ve dikkatli bir aspirasyon bağlı protein (Örnek 3) süpernatant 50μL kaldırmak. Boncuk rahatsız değil emin olun.
- Tüm örnekleri (yani homojenizatı bağlanmamış ve bağlı protein gibi bu hala boncuk bağlı) protein yükleme tamponu ekleyin.
Not: elüsyon (özellikle verimsiz elüsyon durumda) en üst düzeye çıkarmak için, ilgili elüsyon tampon 50μL (örneğin EDTA içeren tampon ekleyerek eklemekkalan bağlı protein ve 4.3 'te kalan bağlı proteinler kaldırmak için açıklanan adımları tekrarlayın Zehir yardımcı numune ısıtma öncesi boncuk) CaCl 2 bağlı boncuk ferin.
5. SDS-PAGE ve western blot
SDS-PAGE Davranış ve pozitif kontrol olarak tersi durumda CaM bağlamak için bilinen bir protein ilgi ve prob protein problama western blot ile analiz.
6. Temsilcisi Sonuçlar
Şekil 2B endojen Ng göre GFP etiketli Ng CaM bağlayıcı bir test CaM-pull-down testinin bir örnek gösterir. Bunu yapmak için, GFP-Ng gecede Organotipik hipokampal dilimler halinde aşırı eksprese edildiği ve doku homojenize edildi. Homojenat Ca 2 + veya EDTA varlığında CaM-sepharose boncuklar ile inkübe edildi. Homojenat giriş GFP-Ng endojen Ng ve Ca 2 + / CaM-bağımlı kinaz II ek ifade olduğunu gösterir(CaMKII). Olarak bilinen endojen Ng (Şekil 2A gösterildiği) bağlama göre beklenen Ng, Ca 2 + (EDTA bağlı protein) yokluğu ve Ca 2 + varlığında bağlanmamış (Şekil 2B) yıkandı, GFP- etiketli . Buna karşılık, kontrol, CaMKII, Ca 2 + (bağlı protein) varlığı sadece madde elde edilmiştir ve onun yokluğunda (EDTA) bağlanmamış. Bu CaM boncuk düzgün çalışıp çalışmadığını gösterir ve elutions verimli. En önemlisi de, GFP-Ng ApoCaM endojen formuna benzer bir şekilde bağlanır, bu gösteriler, GFP etiketi bizim rekombinant proteinin işlevini değiştirmek olmadığını düşündürmektedir.
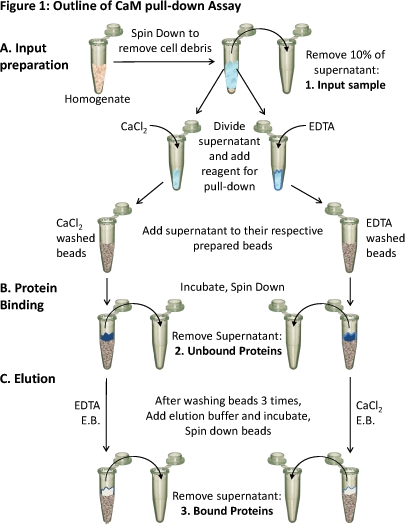
Şekil 1: CaM açılan tahlil. Anahat
(A) Doku Homojenat hücresel enkaz kaldırmak için aşağı döndüğünde. Süpernatant yaklaşık% 10'u girişi (1) bir örnek olarak alınır. Kalan süpernatant farklı eşit olarak bölünür.koşulları ve bu koşullara uygun reaktifler (CaCl 2 veya EDTA) bağlayıcı test etmek için eklenir. Her supernatant (CaCl 2 veya EDTA içeren) sırasıyla hazırlanmış CaM-sepharose boncuk yüklenir ve (B) bağlayıcı izin vermek inkübe. Unbound proteinler kaldırıldı (2) ve (C) bağlı proteinler (3) bağlayıcı olarak tam tersi bir durum içeren elüsyon tamponu (EB) kullanarak boncuk kolonda sürüklenecektir. Bu üç protein örneklerinin protein bileşimi, SDS-PAGE ve western blot analizi kullanılarak analiz edilebilir.
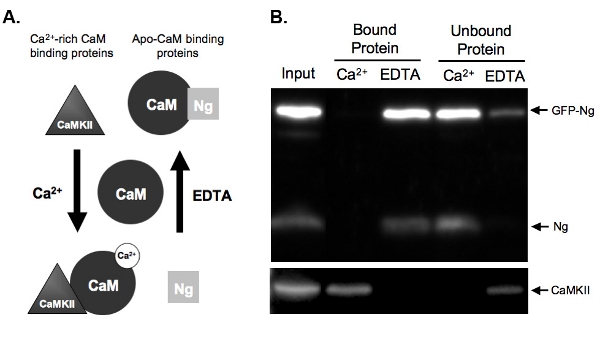
Şekil 2 Ca 2-pull test örnekleri A.) şematik +-bağımlı CaM bağlayıcı ve elüsyon iki tür protein bağlama CaM Ca 2 +-bağımlı bir şekilde verilmiştir. Neurogranin (Ng) bind apo-CaM ve CaMKII, Ca 2 + zengin bağlama proteinleri temsil ettiği proteinlerin temsil ederCaM. CaM Homojenat proteinleri ile inkübasyondan önce, ayrışmış durumda gösterilir. Bir kez + şelasyon, EDTA (2 mM), proteinler buna göre CaM bağlamak, yüksek Ca 2 + konsantrasyonu (2 mM) koşulları altında ya da Ca 2 varlığında inkübe edildi. Ng hiçbir Ca 2 + için biraz var gibi EDTA durumda CaM bağlanır ve Ca 2 + varlığında CaM-sepharose boncuk yıkandı, olurdu. Ancak CaMKII, Ca 2 yüksek miktarda varlığı CaM bağlamak + ve Ca 2 + şelatlı kez ayrıştırmaları.
B.) örnek CaM açılan tahlil sonuçları. Bu rakam bir CaM-sepharose beklenen Sonuçta Ng ve CaMKII için probed örnekleri ile aşağı çekme göstermektedir. Endojen Ng ve GFP-Ng EDTA varlığında CaM bağlı proteinlerin şerit mevcut. Örnekleri, Ca 2 + varlığında CaM ile inkübe edilir Hayır gösteren Ng, bağlı olduğu Ng sadece apo-CaM bağlar. Öte yandan, pozitif kontrol, CaMKII, sadece Ca 2 varlığında CaM bağlanır +.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Ca 2 +-CaM-bağlayıcı proteinlerin bağımlılığı araştırmak için sağlanan protokol CaM-sepharose boncuk kullanır. Çoğu protein, Ca 2 +-bağımlı bir şekilde CaM bağlanır . Bu etkileşimler CaM-bağlayıcı proteinlerin ve birçok sinyal yolakları kritik bir rol sayısı göz önüne alındığında büyük önem taşımaktadır. Bu protokol, CaM-sepharose boncuk CaM-bağlayıcı proteinlerin varlığı ya da yokluğu, Ca 2 + doku Homojenat ayırmak için kullanılır . ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, bu protokol optimize ona yardım Tiffany Kiraz teşekkür etmek istiyorum. Bu çalışma, Ulusal Yaşlanma Enstitüsü (AG032320) yanı sıra Sağlıklı Wisconsin ilerlemek tarafından finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Ürün | Şirket | Katalog numarası | Notlar |
| Kalmodulin-sepharose boncuk | GE Healthcare | 17-0529-01 | |
| Anti-CamKII alfa | Sigma-Aldrich | C6974 | |
| Anti-neurogranin | Millipore | 07-425 | |
| Jel Yükleniyor pipetleyin İpuçları | Balıkçı | 02-707-138 | Süpernatantlar aspirasyonu için kullanın. |
| Mikrosantrifüj tüpleri (2.0 ml) | Balıkçı | 05-408-146 | Kalmodulin-sepharose boncuklar içeren tüm adımları için kullanın |
Referanslar
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır