Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Merkezi sinir sisteminin transducing Hücreleri için lentiviral Vektörler Üretimi
Bu Makalede
Özet
Bu protokolü biz üretim, saflaştırma ve lentiviral vektörlerin titrasyonu açıklar. Biz primer kültürlerinde nöronlar ve astrositlerde lentiviral vektör aracılıklı gen aktarımının bir örnek oluşturmaktadır. Bizim yöntemleri diğer hücre türleri için de geçerli olabilir In vitro Ve In vivo.
Özet
Merkezi sinir sistemi (MSS) etkili gen teslim nörolojik hastalıklar modelleme ve tedavi yaklaşımların geliştirilmesinde, gen fonksiyonları okuyor önemlidir. Lentiviral vektörler ikisi de bölünmesi ve non-bölünen hücreleri, transgenlerin destek sürekli ifade transdüksiyonu olarak MSS nöronlar ve diğer hücre tipleri iletiminde çekici araçlar ve nispeten büyük paketleme kapasitesi ve düşük toksisite 1-3 var. Lentiviral vektörler başarılı bir in vitro 4-6 birçok sinir hücre tipleri transdüklenmesinden ve 7-10 hayvanlarda kullanılmıştır.
Büyük çabalar geliştirilmiş biyogüvenlik ve gen teslimatı için verimlilik ile lentiviral vektörler geliştirmek için yapılmıştır. Mevcut üçüncü nesil çoğaltma-arızalı ve kendini inaktive (SIN) lentiviral vektörler Şekil 1'de gösterilmiştir. Vektör paketleme için gerekli elemanları dört plazmidler ayrılır. Lentiviral transplazmid fer, 5 ', uzun terminali tekrarlama (LTR) içinde U3 bölge başka bir virüs kuvvetli bir promotör ile değiştirilir. Bu normal olarak modifikasyonu HIV gen ifadesi 11 için gerekli olan HIV-1 Tat protein vektörü sekansının transkripsiyon bağımsız sağlar. Ambalaj sinyali (Ψ) encapsidation ve Rev-duyarlı elementi (HKD) için gerekli olan yüksek titresi vektörler üretimi için gereklidir. Merkez polypurine yolu (cPPT) vektörü DNA Nükleer alma, non-bölünen hücre 12 transdüklenmesinden için gerekli bir özellik için önemlidir. 3 'LTR olarak, cis-düzenleyici sekanslar tamamen U3 bölgesi kaldırılır. Bu silme işlemi iki LTR transkripsiyonel inaktivasyonu sonucunda, ters transkripsiyon sonra 5 'LTR kopyalanır. Plazmid pMDLg / pRRE yapısal proteinler ve ters transkriptaz temin HIV-1 GAG / pol genler, içerir. pRSV-Rev çekirdekten verimli RNA ihracat için HKD bağlar Rev kodlar. pCMV-G kodlarHIV-1 Env yerini veziküler stomatit virüsü glikoprotein (VSV-G). VSV-G vektörlerin tropizmi genişler ve ultra-santrifüj ile 13 konsantrasyonu sağlar. Vif, VPR, VPU ve Nef gibi aksesuar proteinleri şifreleyen genler Bütün, ambalaj sistemi içinde tutulur. Lentiviral vektörlerin üretim ve manipülasyon rekombinant DNA (ilgili araştırma için NIH kurallarına göre yapılmalıdır http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf ). Bireysel Kurumsal Biyolojik ve Kimyasal Güvenlik Komitesinden bir onay lentiviral vektörler kullanmadan önce gerekli olabilir. Lentiviral vektörleri genellikle lentiviral transferi plazmid vektörü ve ambalaj için gerekli olan proteinleri şifreleyen plazmitler ile birlikte yardımcı 293T hücrelerinin kotransfeksiyonu ile üretilmektedir. Birçok lentiviral transferi ve plazmid helper plazmidler Addgene, bir non elde edilebilirKar plazmid deposu ( http://www.addgene.org/~~V ). Bazı stabil ambalaj hücre hatları geliştirilen, ancak zamanla bu sistemler üzerinden 14 daha az esneklik ve paketleme verimliliği genellikle azalır, 15 sunmak olmuştur. Piyasada bulunan transfeksiyon kitleri transfeksiyon 16 yüksek verimlilik desteği olabilir, ancak büyük ölçekli vektör hazırlıkları için çok pahalı olabilir. Kalsiyum fosfat çöktürme yöntemleri 293T hücrelerinin yüksek verimli transfeksiyon sağlamak ve böylece lentiviral vektör üretimi için güvenilir ve maliyet etkin bir yaklaşım sağlamak.
Bu protokolde, bir% 20 sukroz yastık yoluyla saflaştırma ve ultra-santrifüj ile konsantrasyon izledi kalsiyum fosfat çöktürme prensibine dayanan dört plazmit ile 293T hücrelerinin kotransfeksiyonu ile lentiviral vektörler üretirler. Vektör titreleri floresans aktive hücre sıralama (FACS) anal tarafından belirleniranalizden veya gerçek zamanlı qPCR tarafından. Bu protokolde lentiviral vektörlerin üretimi ve titrasyon 9 gün ile bitmiş olabilir. Biz nöron ve astrositlerine içeren fare neokortikal kültürleri içine bu vektörlerin transducing bir örnek sağlar. Biz lentiviral vektörler iletimi ve MSS primer kültürlerinde hücrelerinde hücre tipine özgü gen ekspresyonu yüksek verimlilik desteği göstermektedir.
Protokol
1. Lentiviral Vektörler Ambalaj
Lentiviral vektörlerin, bir lentiviral transferi vektör ve kalsiyum fosfat transfeksiyonu yöntemi ile 293T hücrelere ambalaj için gerekli olan diğer plasmidlerin kotransfeksiyonu ile üretilmektedir. Bu protokol 10 100-mm doku kültürü tabaklar kullanın. Bu büyütülüyor ya da aşağı uygulamalara bağlı olabilir. 293T hücre hattı% 10 fetal bovin serumu (FBS), 100 ünite / mL penisilin, 37 ° C'de 100 ug / ml streptomisin ile desteklenmiş, yüksek glikoz (4500 mg / L) ile Dulbecco'nun değiştirilmiş kartal besiyeri (DMEM) korunur % 5 CO2 inkübatör.
- Kültür ortamında 10 100-mm doku kültürü yemekleri (3 x 10 6 hücre / çanak)% 30-40 izdiham Tohum 293T hücreleri. Inkübatöre hücreleri dönün.
- 20-24 saat sonra kültür, hücre yoğunluğu kontrol. Hücrelerinin transfeksiyonu zamanda yaklaşık% 80 birleştiği olmalıdır.
- 50-ml tüp hazırlayın. 4.4 ml TE79/10 (1 mM TrisHCl, 0.1 mM eklemeEDTA, aşağıdaki plazmid DNA eksi toplam hacim pH 7,9). 100 ug lentiviral transferi plazmid (Şekil 1), 58 ug pMDLg / pRRE, 31 ug pCMV-G, 25 ug pRSV-Rev, 600 ul 2 M CaCI2. Ekleme Hafifçe karıştırın.
- Başka bir 50 ml tüp hazırlayın. 5 ml 2x HBS (0.05 M HEPES, 0.28 M NaCl, 1.5 mM Na 2 HPO 4, pH 7.12) ilave edilir.
- 10 ml pipet ile DNA-CaCI2 karışımı almak ve tüp vorteks ederken damla damla 2 x HBS içeren tüp eklemek.
- 30 dakika oda sıcaklığında (RT) azından çöktürme reaksiyon tutmak.
- Inkübatör gelen kültür kaplarına çıkarın. Vorteks tarafından iyi yağış reaksiyon karıştırın. Her 100 mm çanak içeren hücreler için süspansiyon 1 ml ekleyin. Süspansiyon hafifçe çanak orta dönen ederken yavaş yavaş, damla damla ilave edilmelidir. Inkübatör bu yemekleri dönün ve 5 saat bekletin.
- Kültürden orta çıkarın. 6 mM sodyum met içeren 6 ml taze kültür ortamı ekleHer çanak tyrate. Inkübatöre kültürleri dönün. Kurgunun bir floresan muhabir varsa gecede kültürü sonra, floresan mikroskop altında raportör gen ekspresyonu kontrol edin. Bir yerde organizatörü (örneğin CMV organizatörü) tarafından tahrik eğer Genellikle, hücrelerin% 80 'raportör gen ifade.
- İki gün (40-44 saat) transfeksiyon sonrasında, 2 adet 50 ml'lik tüplere-(yaklaşık 30 ml her biri tüp) içine 10 kaplarından supernatant toplamak. -80 ° C derin dondurucuda süpernatant dondurun veya bir sonraki adıma geçin.
2. Vektörler Konsantrasyon ve Arıtma
- Santrifüj taze süpernatant herhangi bir hücre artıkları çıkarmak için 10 dakika için 900 g (2000 rpm) toplanmış veya süpernatant çözülmüş.
- 0,2-um SFCA şırınga filtresi için bir 60 ml şırınga takın. Şırıngaya 50-ml tüpten süpernatan transfer edin. Bir polyallomer santrifüj tüpüne süpernatant filtreleme.
- Bir 5-pipetle ml kadar 5 ml% 20 sukroz (PBS içinde hazırlanmıştır) alır. EklemekSüpernatant içeren santrifüj tüpüne altına pipetle. Yavaşça vektör süpernatant altında sakaroz çözeltisini ekleyin. Başka bir tüpten süpernatan için bu adımları yineleyin.
- ° C'de 4 saat süreyle Beckman SW28 rotor salınım ile 11.000 rpm ve 4 de süpernatan santrifüjlenir.
- Süpernatantı. Her bir santrifüj tüpüne 150 ul% 4 laktoz (PBS içinde hazırlanmıştır) eklenir. Peletler tekrar süspansiyon.
- Tüm santrifüj tüplerine bir 1.5 ml tüp için konsantre vektör aktarın. 15 dakika süreyle buz üzerinde tüp bırakın.
- Pipetleme tarafından vektör süspansiyon karıştırın. 1 dakika boyunca tam hızda (yaklaşık 16000 g) 'de mikrosantrifüj ile Spin.
- Yeni 1.5-ml tüp için süpernatant aktarın. 20 ul kısma son örneği Böl ve -80 ° C derin dondurucuda onları saklanır.
3. Vektörler Titrasyon
- Tohum 5 x 10 4 / çukur% 10 FBS ile desteklenmiş 1 ml DMEM ortamı içinde 12-kuyulu plakalı in HT1080 hücre.
- Overnig sonraht kültürü, iyi birinden hücreleri saymak ve hücre sayıda gol.
- Kültür ortamı ile konsantre vektörü: 5-kat seri seyreltme (ve 1:625;; 1:125 25 1:05, 1) edin. Ayrı kuyu her seyreltilmiş vektör I ul ekleyin. Örnekleri doğruluğu artırmak için çoğaltılabilir.
- Her oyuğa içeren vektör içinde ve vektör olmadan bir kuyuya 1 ul 4 mg / ml Polybrene (Hexadimethrine Bromür) eklenir. Yavaşça plaka sallayarak karıştırın. 48 saat kuluçka dönün.
- Hücre kültürü kuyulardan orta çıkarın. PBS ile her iyi yıkayın. Hücrelere 250 ul 1x trypsine-EDTA solüsyonu eklenir. Hücrelerinin (3-5 dakika) ayrılır zaman, 1 ml kültür ortamına ilave edin. Pipet ile tekrar süspansiyon hücreleri. 1.5 ml santrifüj tüplerine hücre süspansiyonu aktarın.
- 6 dakika boyunca 900 g'de santrifüje. Bir floresan raportör gen (örn. GFP) ile vektörler için FACS analiz için 3.7 adıma geçin. Bir muhabir olmadan vektörler, gerçek zamanlı qPCR 3.8 adıma geçin.
- Bir fluo içeren vektörler içinflüoresan raportör gen, süpernatant kaldırmak ve PBS içinde% 3.7 formaldehit 300 ul pelletini. FACS analizi ile raportör pozitif hücrelerin yüzdesi belirlemek. Titresi mililitre konsantre vektör (TU / ml) başına iletim birimi olarak temsil edilecek.
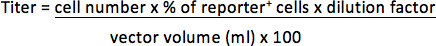
Örneğin, 1 x 10 hücre 5 1/25 ul (0.04 ul) vektörü ile% 30 hücreleri ile transdük edildi raportör pozitif, titresi olacaktır:
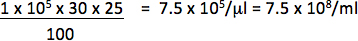
Sadece dilüsyonları pozitif hücrelerin yüzdesi ve titresi hesaplamak için eklenmiştir vektörün miktarı arasında doğrusal bir ilişki içinde kalan kullanabilir. Nihai titresi vektörü, en az 2, farklı miktarlarda transductions elde titreleri bir ortalama olmalıdır.
- Bir olmayan vektörler içinflüoresan raportör geni, üreticinin protokolüne göre QIAamp DNA Mini Kiti (Qiagen) kullanılarak HT1080 hücrelerinden genomik DNA özü. Primerleri (HIV-1 PBS / bölge 17 psi olarak) 5'-CCGTTGTCAGGCAACGTG-3 've 5'-AGCTGACAGGTGGTGGCAAT-3' ile ABI PRISM 7000 Serisi Detection System (Applied Biosystems) kullanılarak genomik DNA vektörü sekansı amplifiye ve TaqMan prob 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Genom içerisinde tek bir kopyası geni (2 kopya / hücre) Albumin geni de primerler 5'-TGAAACATACGTTCCCAAAGAGTTT-3 've 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3' ile büyütüldü ve prob 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-TAMRA-3 edildi 'iç kontrol gibi. Aşağıdaki programı ile üreticinin talimatlarına uygun olarak 96-kuyulu plakalı içerisinde kopyalama vektörünün numaraları ve PCR ile albümini belirlenmesi: 15 saniye 50 ° C'de 2 dakika, 95 ° 10 dakika ve 95 ile 35 döngü süresince C ° C ve 60 ° C'de 2 dakika süreyle. Bilinen konsantrasyon plazmidlerin on kat seri seyreltme (kopya olarak temsilnumarası) şablonu sekansları da bilinmeyen örneklerin ölçümü için standart bir eğri oluşturmak için amplifiye edilmelidir içeren. Titresi mililitre konsantre vektör (IU / ml) başına entegrasyon birimleri olarak temsil edilecektir.
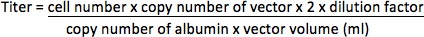
4. Neokortikal Kültürlerin İletimi
Nöronları ve glia hem içeren neokortikal kültürler, daha önce tarif edildiği gibi 18 iki aşamalı bir prosedür kullanılarak kaplama fare korteksleri hazırlanır. 14-16 gün gebe fetal farelerde elde Neocortices% 10 FBS, 24-sıra doku kültürü plakası 20 mM glukoz ve 2 mM glutamin ile desteklenmiş MEM daha önceden kurulan glial tek tabaka üzerine kaplanır.
- In vitro 5 gün sonra, neoc içinde 10 uM sitozin arabinozid (Ara-C) ilaveortical kültürü non-nöronal hücre bölünmesini inhibe etmek için. Kültürü 2 gün süreyle hücreleri devam etmektedir.
- 5-10 dakika için 37 sıcak kültür ortamı ° C su banyosu. Taze kültür ortamı (iyi 500 ul /) ile orta içeren Ara-C değiştirin.
- Kültüre; istenen MOI (hedef hücrelerin sayısı vektörü parçacıkların sayısı oranı enfeksiyon çokluğu) ile vektör ekleyin. 24 saat boyunca kültürün devam etmektedir. Biz birincil kortikal kültürlerde (genellikle 5) 1-10 MOI kullanın.
- Taze aracı madde ile kültür ortamı yerini alır. Kültürü devam edin. Vektör yapı bir raportör geni olması durumunda, 2 gün sonra transdüksiyon flüoresan mikroskop altında hücreleri kontrol. Muhabir gen ekspresyon vektör tasarım ve kullanılan doza bağlı olarak, transdüksiyon sonra nöronlar 2-7 görünür olacaktır.
5.. Temsilcisi Sonuçlar
Bu protokol aralığı ile üretilen lentiviral vektörlerin titreleri 10 8 -10 10 IU / ml, kavrayıĢh, in vitro ve in vivo hem de CNS gelen hücre tipleri çeşitli transdüksiyonu için uygundur. Tablo 1 ve Şekil 2, bu protokolü tarafından üretilen vektörler kullanılarak temsili bir sonucu göstermektedir. Biz transdük ifade lentiviral vektörler ile fare neokortikal kültürler yeşil floresan proteininin (GFP) synapsin (SYN) yükseltici ya da glial fibriller asidik protein (GFAP) organizatörü tarafından denetlenir. Yedi gün transdüksiyon sonra, sırasıyla, anti-neun ve anti-GFAP antikorlar ile etiket nöronlar ve astrositler için İmmünoboyama yapıldı. Tablo 1 ve Şek. 2A, nöronların% 90 (Neun + hücreler) üzerinden, synapsin organizatörü taşıyan vektör ile iletimi sonrasında ekspres GFP ve hiçbir astrositler (GFAP + hücreleri) bu muhabiri gen ifade. GFAP promotör astrositler yaklaşık% 80 (GFAP + hücreleri) ekspresyonunu, vektör yapı (Şek. 2B) kullanıldığı zamans GFP, tüm GFP + hücreler GFAP ile kolokalizasyon ve Neun-etiketli hücrelerde GFP yokluğunda tarafından onaylandıktan olarak astrositler vardır. Bu sonuçlar, lentiviral vektörler CNS ve hücre özel gen ifadesi ile hücrelere transgenlerin sağlamak için çok verimli olan uygun arttırıcılar kullanıldığı zaman elde edilebilir olduğunu göstermektedir.
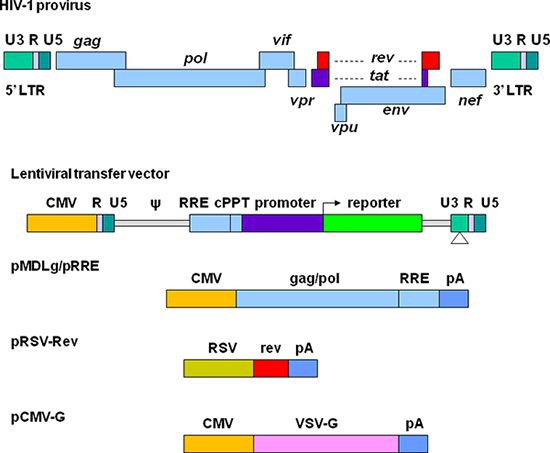
Şekil 1.. HIV tabanlı lentiviral vektörler ve ambalaj plazmid şematik gösterimi. HIV-1 provirus üst kısmında gösterilir. Vektör üretimi için elemanları dört farklı plazmidler ayrılır. Plazmid lentiviral transferi U3 bölgesi sitomegalovirüs (CMV) promotöründen, ambalaj sinyali (ψ), HKD sekansı, merkezi polypurine yolu (cPPT), ilgilenilen bir gen (örn. ile değiştirildiği bir hibrid 5 'LTR içerir Bir floresan tercih edilen bir promotörü ile birlikte raportör), ve 3 'LTR hangicis düzenleyici sekanslar tamamen U3 bölgesi kaldırılır. pMDLg / pRRE CMV arttırıcının kontrolü altında, HIV-1 den tıkaç ve pol genleri ve HKD sekansı içerir. pRSV-Rev RSV organizatörü tarafından tahrik Rev kodlama dizisi içerir. pCMV-G CMV arttırıcının kontrolü altında VSV-G-protein gen içerir. PA insan β-globin geni poliadenilasyon sinyali gösterir.
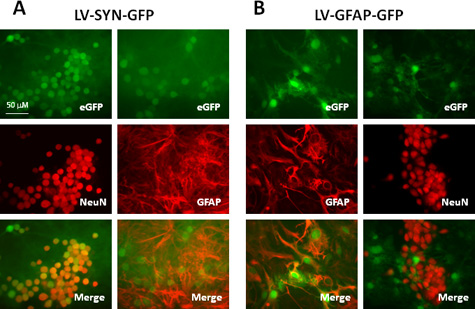
Şekil 2. Fare neokortikal karışık kültüründe haberci gen ifadesi hücre tipinde belirli bir arttırıcılar-taşıyan lentiviral vektörleri ile transdük. Kültürleri LV-SYN-GFP (A) veya (B) bir MOI 5 azından LV-GFAP-GFP vektörleri ile transdük edildi. Yedi gün transdüksiyon sonra, hücreler, anti-Neun veya anti-GFAP antikoru ile boyanmış edildi. Üst panelleri GFP floresans gösteren, orta panelleri immun göstermek ve alt paneller (GFP: yeşil; Neun veya GFAP: kırmızı) görüntüler birleştirilir.
| Vektör | Nöronlarda GFP + hücrelerin | Astrositlerde GFP + |
| LV-SYN-GFP | 92.2 ± 7.3 | 0 |
| LV-GFAP-GFP | 0 | 78.3 ± 11.5 |
Tablo 1. Mürin neokortikal kültürlerinde GFP tanımı karşılaştırılması farklı yükselticilerde bir taşıma lentiviral vektörleri ile transdük.
Bir Mürin neokortikal kültür (5 x 10 5 / iyi 24 de plaka), bir İçişleri Bakanlığı 5 at LV-SYN-GFP veya LV-GFAP-GFP ile transdük edildi. Transdüksiyon sonra yedi gün, kültürleri sabit ve Neun veya GFAP boyama yapıldı. GFP ve Neun / GFAP eksprese eden hücrelerin sayısı deneysel koşul başına 10 alan görüntüleri sayılmıştır. Değerleri veya nöron yüzdesi (Neun + hücreler) temsilAyrıca GFP raportör gen ifade astrositler (GFAP + hücreler). Gösterilen değerler aracı ± standart sapma, üç bağımsız deneyin gelmektedir.
Tartışmalar
Bu protokolde, bu neokortikal kültürlerde bu vektörlerin lentiviral vektörler ve uygulamanın üretimi göstermiştir. Bu yöntem tarafından üretilen vektörleri ile verimli ve hücre tipinde belirli bir transdüksiyon-göstermiştir. Synapsin promotör kullanıldığında, GFP tanımı katı nöron özgüdür. GFAP organizatörü kullanıldığında, GFP astrositlerde münhasıran. Herhangi bir hücre tipinde belirli-ifadesi gerekli ise, her yerde bulunan bir promotör kullanılabilir. Biz sahipleri neokortikal k...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Washington Üniversitesi, Programı Projesi Hibe NS032636 (BJS) ile NIH Neuroscience Blueprint Çekirdek hibe (P30 NS057105, BJS) tarafından ve Sinir Hastalıkları Umut Merkezi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Fetal sığır serumu | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-CM | |
| Tripsin-EDTA | Sigma-Aldrich | T3924 | |
| Sodyum butirat | Sigma-Aldrich | B5887 | |
| Hexadimethrine bromür (Polybrene) | Sigma-Aldrich | H9268 | |
| 293T hücreleri | ATCC | CRL-11268 | |
| HT1080 hücreleri | ATCC | CCL-121 | |
| Falcon 100 x 20 mm doku kültüre çanak | BD Biosciences | 353003 | |
| X 3 ½ polyallomoer santrifüj tüpünde 1 | Beckman-Coulter | 326823 | |
| 0.2-mikron şırınga filtresi | Corning | 431219 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 |
Referanslar
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır