Method Article
Subnormothermic Makine Perfüzyon Yoluyla Fonksiyonel İnsan Karaciğer Koruma ve Kurtarma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu subnormothermic sıcaklığında (21 ° C), insan karaciğer greft ex vivo makine perfüzyon için bir yöntem tarif eder.
Özet
There is currently a severe shortage of liver grafts available for transplantation. Novel organ preservation techniques are needed to expand the pool of donor livers. Machine perfusion of donor liver grafts is an alternative to traditional cold storage of livers and holds much promise as a modality to expand the donor organ pool. We have recently described the potential benefit of subnormothermic machine perfusion of human livers. Machine perfused livers showed improving function and restoration of tissue ATP levels. Additionally, machine perfusion of liver grafts at subnormothermic temperatures allows for objective assessment of the functionality and suitability of a liver for transplantation. In these ways a great many livers that were previously discarded due to their suboptimal quality can be rescued via the restorative effects of machine perfusion and utilized for transplantation. Here we describe this technique of subnormothermic machine perfusion in detail. Human liver grafts allocated for research are perfused via the hepatic artery and portal vein with an acellular oxygenated perfusate at 21 °C.
Giriş
Karaciğer transplantasyonu onlarca son dönem karaciğer hastalığı muzdarip hastaların binlerce tek küratif tedavi yöntemidir. Başarılı bir şekilde nakletmenin, bu graft hızlı bozulmasını önlemek için gerekli olan alıcı implante zamanına kadar donörden temin edilir zaman karaciğer en iyi şekilde korunabildiği kolaylaştırmak. Karaciğer korunması için güncel standart 'statik soğuk hava "olarak adlandırılmaktadır: Karaciğer ve böylece karaciğer metabolizmasını azaltma ve iskemi zararlı etkileri yavaşlatan bir buz-soğuk muhafaza çözeltisi içinde soğutulur. Bu soğuk hava deposu tekniği başarılı transplantasyon için izin olmasına rağmen, böyle sıcak iskemi veya yağlanma gösterisi alt hasta tarafından zarar DCD organları gibi marjinal kalitede organları 1 çıktıları. Kanıt hızla genişleyen gövde alternatif koruma yöntemi olarak karaciğer greft bu ex vivo makine perfüzyon can potansiyel im varBu marjinal organların 2,3 için sonuçları kanıtlamak.
Karaciğer transplantasyonu, kendi başarısının kurbanı haline gelmiştir. Çok daha hasta mevcut karaciğerleri vardır daha nakli için sevk edilir ve her yıl binlerce ABD'de bekleme listesinde ölür. Donör karaciğer yetersizliği gerçekliği ve muhtaç alıcılar için optimal kalite karaciğer greft artan kullanımı göz önüne alındığında, yaygın implantasyon öncesi karaciğer greft ex vivo makine perfüzyon karaciğer transplantasyonu bir paradigma kayması sözünü tuttuğu tutulur. Son yıllarda 4-8 bu konuda araştırma ilgi belirgin bir artış olmuştur. Çeşitli Avrupa ve Kuzey Amerika merkezlerinde hipotermik makine perfüzyon fizyolojik sıcaklıklarda bir klinik giriş 8 ve normotermik makine perfüzyon son zamanlarda atılan insan karaciğerinin uygulanmış ve klinik kullanım yanı sıra 9 tercüme ediliyor yaptı.Sürekli optimizasyon Optimum perfüzyon 10-12 parametreleri tanımlar ise kapsamlı gelişme, çeşitli protokollerin gelişmesine yol açmıştır. Marjinal kaliteli greft kullanımı daha fazla son on 13 üzerinden 10 kat artmıştır. Karaciğer korunması için mevcut standart (statik soğuk depo) ile karşılaştırıldığında, ex vivo makine perfüzyon organı havuzu çok ihtiyaç duyulan genişleme neden ve potansiyel transplantasyon sonrası komplikasyonların insidansı azalma hepsi çok sayıda potansiyel yararları sağlar. Özellikle şu anda naklinden sonra optimal kalite karaciğer greft veba safra komplikasyonlar önemli bir konu 14-18 kalır.
Subnormothermic koşullarda Makine perfüzyon bir zaman penceresi nakli 19 uygunluğuyla objektif greft fonksiyonunu değerlendirmek için sağlar. Karaciğer, bir ex vivo devrede perfüze edilirken hem perfüzyon birnd perfüzyon sırasında üretilen safra, organ fonksiyon belirteçlerinin ölçümü için numune alınabilir. Bu şekilde mevcut kriterler altında nakli için atılır karaciğerleri objektif nakli için uygunluk olarak değerlendirilebilir 'ciddi tehlikeye'. Bu birçok organı transplantasyon için kullanılması için Canlılık değerlendirme potansiyel sağlar. Makine perfüzyon bir eşit güçlü yarar onarım ve sıcak / soğuk iskemi zarar görmüş karaciğer gelişmedir. ATP sıcak ve soğuk iskemi sonrasında sırasında çok hızlı tükendiği ve önceki karaciğer 20 implantasyonu makine perfüzyon bir dönemde repleted edilebilir. Karaciğer, enerji mağazaları ve metabolik devlet doldurulan, ön şartlandırılmış ve alıcı implantasyon sonrası reperfüzyon hasarı zararlı etkileri daha hazırlıklı.
Bu çalışma, insan karaciğer graf ex vivo makine perfüzyon için bir yöntem tarif ederteknik ve ex vivo makine perfüzyon yararlı etkileri hem çalışmak isteyen araştırmacılar için faydalı olacaktır laboratuvarda, ts. Biz transplantasyon için reddedildi ve ardından araştırma amaçlı tahsis insan donör karaciğerinin faydalanmak.
Standart karaciğer tedarik tekniği beyin ölü donörlerden (DBD) veya başka bir yerde 20 daha detaylı olarak tarif dolaşım ölüm vericilerden (DCD), dolaşım tutuklanmasından sonra aort kros-klemp aşağıdaki karaciğer in situ arteriyel floş de içerir. Ayrıca, karaciğer buz vericinin karın boşluğunu doldurarak tedarik sırasında soğutulur. Gömme çözüm tercihleri Wisconsin veya Histidin-triptofan-ketoglutarat (HTK) çözeltisi Üniversitesi kullanarak alımlarda çoğunluğu ile, bölgeler arasında değişir. Portal ven bir ek arka-tablo floş artık kan arınma geliştirir. Karaciğerleri genellikle aort segmenti sur bırakarak tedarik edilirÇölyak gövde yuvarlama. safra kesesi safra aspire edilir, kazıma ve safra kanalı temizlendi. karaciğer buz soğuk koruma solüsyonu içeren steril torbalarda paketlenmiş ve belirlenen kutu veya soğutucularda taşınmaktadır. Temsilcisi sonuçları için sıcak ve soğuk iskemi süresi sırasıyla 60 dakika ve 12 saat, sınırlı olmalıdır. İnsan organları teslim sırasında bulaşıcı patojenler için rutin serolojik tarama rağmen, standart önlemler, insan organlarının elde edilen numuneler, ve herhangi bir atık ürünler alınmalıdır.
Protokol burada bir ticari olarak temin edilebilir karaciğer perfüzyon cihazı kullanılarak subnormothermic makine perfüzyon tarif etmektedir. Böyle bir cihazın kullanılması klinik ortamda ve araştırma grupları ve transplant merkezleri arasında farklı protokoller ve cihaz ayarları çapraz-doğrulama daha hızlı çeviri için izin verir.
Protokol
insan dokusunun kullanılması kurumsal inceleme kurulu (KİK) veya eşdeğeri tarafından gözden geçirilmelidir. Burada açıklanan çalışma onaylanmış ve Massachusetts Genel Hastanesi Kurumsal Değerlendirme Kurulu (No 2011P001496) tarafından muaf ilan edildi.
1. Çözüm hazırlanması
- Aseptik Tablo 1'de belirtildiği gibi kırmızı-ücretsiz Williams'ın 'orta E fenol için takviyeleri ekleyin. Çözelti kullanılmadan önce taze olarak hazırlanması gerekir. İnsülin kullanımdan hemen önce ilave edilmelidir.
Karaciğer 2. Geri Tablosu Hazırlama
- Steril, drape yüzeyi üzerinde bir buz dolu bir organ kase yerleştirin. Soğuk muhafaza solüsyonu torbaya bırakarak, kutudan karaciğer çıkarın. Çoğunlukla batık karaciğer tutun.
- Aort yama uzak yer alacak hepatik arter (HA), belirleyin. Metzenbaum makas kullanarak uzunluğu boyunca çeşitli kesim dalları ortaya çıkarmak için serbest arter disseke. Dikkatle dissect arterin tüm uzunluğu karaciğeri besleyen bir gemi kesilmesinin önlemek için. Kesmek veya görünür bir ucunu yoksa dalları kravat etmeyin.
- Kabın boyutuna bağlı olarak, boyut 0 dan 4-0 arasında ipek sütür kullanılarak karaciğer temin tüm atardamar dalları bağlayın. 7-0 prolen bir dikiş ile arter delikler kravat çok kısa ya da yakın şube. Kravat ve çölyak gövde kökenlerine yakın dalak ve sol gastrik arterler kesti.
- Yama altında doğrudan çölyak gövde keserek aort düzeltme ekini kaldırmak. Aort kanülü kullanılarak çölyak gövde cannulate.
- Portal ven (PV) belirlenmesi ve açık açık ücretsiz teşrih. Herhangi bir şubesi kapalı kravat ve boyutu 24 boru hazırlanan segment PV cannulate.
- Ven kendisi kesmeden, suprahepatik vena kava diyaframın bölümleri kaldırın. Doğrudan Organ odasına vena kava drene Çıkışlar.
- 2 tam çevresi ti Cutssue örnekleri koledok ucundan (2-3 mm uzunluk); ek (-80 ° C'de saklayın) sıvı azot içinde bir dondurma ve sırasıyla, doku ve histolojik analiz için% 10 tamponlu formalin içine diğer saklayın. Damar kanül ve membran oksijenatör borudan yapılmış bir drenaj borusu ile ortak safra kanalı cannulate.
- Belirleyin ve 0 ipek kravat ile kistik kanal Arter. sistik kanal koledok ve safra kesesi arasında bulunur.
- Tüm havayı kaldırarak Ringer (LR) solüsyon ve prime boru buz soğuk çanta, ayarlanmış gömme boru bağlayın.
- Yavaş damlamaya gömme boru akış regülatörü ayarlayın. Portal ven kanül aynı hizada boru bağlamadan önce, hilusta de parmakları ile portal ven tıkayan ve portal ven havayı çıkarmak için gömme ile kanül ve ven doldurun. Aşırı basınç önlemek için soğuk yıkama sırasında çantası karaciğer yüksekliği boyunca fazla 20 cm yükseltmesine etmeyinven.
- Floş kısaca sırasında düşük noktada PV tıkamak. Kaçakları için PV inceleyin. Yukarıda tarif edildiği gibi kap dal ayrılır ve kapatılabilir. Buz soğukluğunda LR 2 L bir toplam PV ile karaciğer yıkayın.
- Tekrar LR 1 L ile HA için 2.10, 2.11 adımları.
3. Hazırlama SNMP Sistemi
- Başbakan Organ kaseye perfüzat (21 ° C) 2 L ekleyerek ve başbakan boru cihazı başlayarak perfüzyon cihazı. 21 ° C sıcaklık ayarı, perfüzyon hazırlanmak için cihazın talimat izleyin. 3 mmHg ve sırasıyla PV ve HA, 30 mmHg basıncı ile başlayın. Gaz tankı açın ve 3 l / dk'lık bir akış ayarlanır.
- Örnek limanlarından 0.3 ml örnek çizim ve üreticinin talimatlarına göre kan gazı analizi makinede çalışan HA ve PV girişi hem de kan gazı örneği alın. Yeterli oksijenasyonu onaylayın (pO 2> 700 mmHg) ve pH (7.35-7.45).
- Bağlı olan karaciğer, -80 ° C'de, bir eppendorf tüpüne ve mağaza 0 ölçüm = itibariyle perfüzat içindeki bir 1.0 ml lik bir numuneyi almadan önce. Tek-kenarlı çelik bıçak kullanarak karaciğer iki ± 250 mg kama biyopsi kesin; Snap (-80 ° C'de mağaza) sıvı azot içinde bir dondurma ve% 10 tamponlu formalin diğer saklayın. Perfüzyon önce karaciğer tartılır.
4. İnsan Karaciğer Perfüzyon
- Cihaza karaciğer aktarın. Adım 2.10 olarak PV havayı çıkardıktan sonra, PV kanül PV girişi bağlayın. Benzer bir şekilde HA bağlayın. Set PV 3 ve 30 mmHg HA basıncı. Karaciğer neredeyse Perfüzat tarafından batık edilmelidir. Dehidratasyonu önlemek için ıslak steril gazlı bez ile, akış gemileri de dahil olmak üzere, herhangi bir kuru yüzeyleri Kapak
- Bir toplama kabına safra boru drenaj edelim. O safra çalışmasına izin vermek için safra drenaj açılış karaciğer düzeyinde olduğundan emin olun veya daha düşükserbestçe ut.
- Karaciğer 21 ° C'ye ısıtıldı sonra hedef akış hızları sırasıyla 275-325 ml / min.kg ve PV 50-100 ml / min.kg ve HA bulunmaktadır. Her karaciğer perfüzyon farklı tepki beri, ilk dakika boyunca yakından takip akışı. Artırın veya hedef debileri ulaşmış değilse gemilerin ya üzerindeki baskıyı azaltmak. HA 50 mmHg ve üzerinde PV 5 mmHg aşmayın.
- Örnekler araştırmacılar tercih karaciğer dokusu, perfüzat safra alınabilir. Biz perfüzyon sırasında en azından Aşağıdaki örnek toplama rejimi tavsiye ederiz.
- Doku biyopsileri, n = 2 x 250 mg, her saat. Depolama: -80 ° C, uzun vadede sıvı azot ve mağaza tane dondurma oturtun. Buna ek olarak, önceki ve perfüzyon sonra başka bir biyopsi almak ve% 10 tamponlu formalin içine sabitlemek (n = 1)
- Perfüzat örnekleri, n = 2 x 1 mi, ilk bir saat için her 15 dakikada bir ve daha sonra her 30 dakikada. PV inf örnekleri BeraberlikDüşük numune noktası. Depolama: -80 ° C, uzun vadeli.
- PV ve HA girişi ve vena kava çıkışı Kan gazı analizi. n = 3 x 0.3 mi, 30 dakikada. PV ve HA örnek limanlarından hem örnekleri çizin. Damar içine bir şırınga takarak vena kava 0.3 ml örnek çizin ve kan gazı analizörü çalıştırmak doğrudan. Yeterli oksijenasyonu ve pH sağlamak için çıkışını kullanın.
- Safra üretimi, n = 1 x 1 mi, her saat. Görme safra üretimi her saat ölçmek ve toplama kabından bir örnek almak. Örnekleme sonra kabı yenileyin. Depolama: Kuru buz ve -80 ° C uzun dönem.
- 3 saat boyunca perfüzyon devam edin. Basınç, pH ve oksijenasyonu İzleme ve genelinde örnek alma. Perfüzat sodyum bikarbonatın ilave edilmesi ile de pH ayarlayın.
- Karaciğer perfüze edilirken perfüzyon sonunda nihai numune almak. Karaciğer ayırın ve safra kanalı kanül kaldırın. 2 sonrası perfüzyon doku örnekleri al° C ve% 10 tamponlu formalin içine -80 ° C'de depolama için daha önce tarif edildiği gibi safra kanalı.
- Uygun biyolojik tehlike bertaraf yönergeleri izleyerek insan karaciğer atın.
Sonuçlar
Gözlem ve analizler bir dizi, akış oranları ve safra üretimi gibi doğrudan gerçek zamanlı gözlem de dahil olmak üzere, perfüzyon sırasında karaciğer üzerinde gerçekleştirilebilir; Böyle Perfüzat gaz analizi ve biyokimyasal Perfüzat analizi ve doku ve histolojik analiz de dahil olmak üzere numune toplama sonra yapılan post-hoc ölçümleri gibi gerçek zamanlı ölçümleri. Burada sözü Sonuçlar 22 perfüze insan karaciğerinden vardır. Karaciğerleri donör yaşı, aşırı sıcak iskemik süre, biyopsi sonuçları (steatoz, inflamasyon, fibrozis) ve lojistik nedenlerle dahil olmak üzere çeşitli nedenlerle nakli için reddedildi. 18 ciğeri beyin ölümünün ardından kalp ölümünden sonra temin ve 4 edildi. Her iki durumda da, donörler heparin 30,000 birim ile önceden muamele edilmiş ve in situ ve UW çözeltisi ile masaya temizlendi. Soğuk iskemik süresi ortalama 531 ± 237 (SD) dk ve ortalama sıcak iskemi süresi 27 ± 10 (SD) dk, hayatın geri çekilmesi ölçülenSoğuk floş destek. Gerçek zamanlı gözlem ve ölçümler post-hoc ölçümleri perfüzyon sonrasında ortaya ise, perfüzyon sırasında karaciğer değerlendirmek için de kullanılabilir.
Gerçek zamanlı gözlemler
Karaciğerden akış soğuk karaciğerde daha yüksek bir direncin bir sonucu olarak, hedef akış oranından daha düşük başlar. Hedef akışları genellikle karaciğer kez elde edilebilir HA üzerinde PV 3 mmHg ve 30 mmHg basınç kullanılarak 21 ısındıktan Perfüzyon (Şekil 1A) 60 dakika sonra ° C. Safra akım, genellikle perfüzyon 10 dakika içinde görülmektedir ve perfüzyon (Şekil 1B) sırasında sürekli olarak üretilir. Safra miktarı karaciğer kalitesine bağlıdır ve 18 ml / dak / kg, 0.3 ml / saat / kg karaciğere arasında değişir. Hatta daha istikrarlı ya da daha kısa sıcak iskemi süresi sonuçları artırırken uzun sıcak iskemik süre ile karaciğerlerinde, safra akışı, incelmek eğiliminde olacaktırsafra üretimi.
Gerçek zamanlı ölçümleri
Her iki deneysel amaçlar için gerekli kan gazı analizi ile perfüzat Doğrudan ve sık sık ölçüm yanı sıra muhafaza yeterli perfüzyon koşulları önemlisi oksijenlenme ve pH. Çözünmüş oksijen kısmi basıncı PV ve HA hem girişi üzerinde daha büyük 700 mmHg olmalıdır. Vena kava ölçülen Çıkışlar oksijen basıncı, genellikle artan oksijen alımını yansıtan, uzun perfüzyon azalır. T = 3 saat (Şekil 1C) 2,4-9,7 mi O2 / dk / kg perfüzyon başlangıcında, daha önce 13 tarif 0.5-2.2 mi O2 / dk / kg arasında değişmektedir olarak oksijen alım oranları hesaplanabilir. PH düşüşü esas olarak perfüzat laktat serbest bir sonucu olarak, ilk 30 dakika boyunca (Şekil 1D) görülmektedir. Bu% 8.4 sodyum bicarbo ile takviyesi tarafından desteklenenNate ve yaklaşık 90 dakika sonra, pH normal aralığı içine düşmektedir. Genel olarak,% 8.4 sodyum bikarbonat 30-50 mi gereklidir. Laktat konsantrasyonu, hızla ilk 15-30 dakika içinde artar, fakat ilk bir saat (Şekil 1E) sonra ı ölür başlar.
Post-hoc ölçümleri
ALT gibi karaciğer transaminaz Perfüzat ölçülebilir. İlk 30 dakika içinde ALT büyük bir artış genellikle iskemi (Şekil 1F) sırasında piyasaya sürüldü ALT arınma yansıtan görülmektedir. ALT sıcak iskemik süre 13 ile iyi bir korelasyon gösterilmiştir. Makine perfüzyon bir kurtarma enerji durumunu (Şekil 1G) yansıtan, ATP içeriğinize 2.8 kat artmıştır. H & E histolojik analiz makinesi perfüzyon (Şekil 1 H, I) sırasında sürekli ek yaralanma ortaya koymaktadır. Bu protokolde önerilen biyopsi rejimi res için olduğunu belirtmek gerekirAraması amaçları ve klinik amaçlar için geçerli olmayabilir.
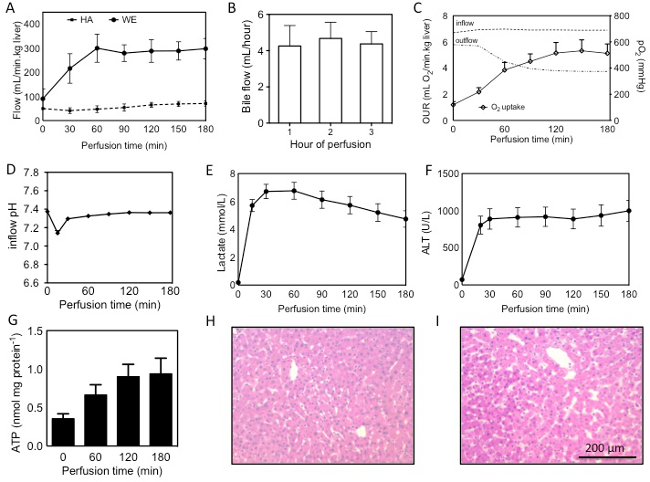
Şekil 1:. Makine perfüzyon sırasında insan karaciğerinde Değerlendirilmesi perfüzyonun (B) oksijen geliştirilmiş değeri oranı (OTH), girişi arasındaki farktan hesaplanmıştır (PV saat başına miktarı PV ve HA SNMP (A) boyunca, safra üretimi, içinden akış + HA) ve çıkış (vena kava), çizgiler perfüzat (F), ATP içine perfüzyon sırasında perfüzyon (C), pH ve laktat sırasında giriş ve çıkış kısmi oksijen basınçları (D, E), ALT salınımını göstermek kesintiye (H) ve sonra (I) 'perfüzyon önce karaciğer (54 yaşındaki DCD, 19 dakika sıcak iskemi, 559 dakika soğuk iskemi) saatlik biyopsi (G) ve H & E lekeleri doku ölçülen içeriği. Sonuçlar ortalama ± SEM olarak sunulmaktadır. bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
Tartışmalar
Iskemi sırasında yaralanan ciğeri kurtarmak için bir girişim soğuk depolama bir süre sonra kullanılabilir bir SNMP sistemi geliştirdi. Subnormothermic makine perfüzyon geleneksel soğuk depolama, yanı sıra hipotermik ve normotermik makine perfüzyon yöntemlerine bir alternatif sunuyor. Çeşitli farklı sistemler var; tüm farklı avantaj ve dezavantajları 3,9,20 sunuyoruz. SNMP 21 metabolik oksijen gerektirdiği gibi, bir oksijen taşıyıcı olmadan perfüzyon sağlar ° C Perfüzat aktif oksijenasyonu tarafından karşılanmaktadır.
Subnormothermic koşullarda düşmesine karşın, metabolizma önemli ve besin açısından zengin perfüzyon solüsyonu desteği gerektirir. Bu tür Belzer makine perfüzyon çözeltisi gibi geleneksel perfüzyon için solüsyonlar, bileşim içinde, genel olarak en az ve Soğuk perfüzyon için tasarlanmıştır. Williams Orta E yıllardır bir hepatosit kültür ortamı olarak kullanılabilir, ve c içermemektedirSıcak ex vivo koşullar altında, özellikle de hücre fonksiyonunu desteklemek için evrensel omponents.
Makine perfüzyon sırasında yapılan ölçümler organ fonksiyonu olarak yansıtıcı olmaktadırlar. Böyle safra üretimi ve oksijen alımı gibi doğrudan gözlemlenebilir parametreler karaciğer nakli öncesi değerlendirmek için kullanılabilecek gerçek zamanlı ölçümleri vardır. Benzer şekilde, hücresel yaralanma ve iskemi (K +, laktat sürüm) belirteçleri perfüzyon çözeltisi doğrudan ölçülebilir ve organ fonksiyonları 20 göstergesi olabilir. Makine perfüzyon tekniği daha geliştirir ve daha yaygın klinik uygulama elde gibi, ex vivo fonksiyon ve klinik sonuç arasında doğru ilişki yapılabilir ve perfüzyon parametreleri nakli veya marjinal kaliteli ciğeri reddetmek için kararlar yardım yararlı olacaktır. Ayrıca, bakım analitik araçlar peşin noktası olarak, daha sofistike analizler doğrudan perfu makine boyunca kullanılabilir olacaksion 21.
Bu çalışmada biz karaciğerleri histoloji ve ALT salınımı ile yansıyan, karaciğer minimal yaralanma ile SNMP sisteminde desteklenen edilebileceğini göstermektedir. Karaciğerin fonksiyonel iyileşme en iyi karaciğer canlılığı için ilişkili olduğu gösterilmiştir ve hayvan modellerinde nakli başarı kuvvetle düşündüren olan ATP tarafından yansıtılır 22. Ex vivo ve karaciğer greftlerinin nakil öncesi kurtarma donör önemli bir genişleme sağlayacak Karaciğer havuzu, arz ve nakli donör karaciğerinin talep arasındaki farkı düzeltme.
Açıklamalar
Dr. Uygun, K Uygun ve Yarmush Bu çalışmada (WO / 2011/002926), ve Dr alakalı bir bekleyen patent mucitleri BE. Uygun, K Uygun ve Yarmush Bu çalışmada (WO 2011 / / 35223) alakalı bir bekleyen patent mucitleri BE. Dr. K Uygun ve Bruinsma bu işle ilgili bir geçici patent uygulaması var. Dr K Uygun ve BE Uygun Organ Çözümleri mali ilgi var, bir şirketin organ koruma teknolojisi geliştirilmesi üzerinde duruldu. Dr K Uygun ve Uygun'un en faizler, faiz politikaları onların çatışma doğrultusunda MGH ve Ortakları HealthCare tarafından yönetilen BE.
Teşekkürler
ABD Ulusal Sağlık Enstitüleri Finansman, CIMIT Projesi No. 12-1732 ve minnetle kabul edilmektedir Çocuklar için Shriners Hastaneler (R01EB008678, R01DK096075, R01DK084053, R00DK088962 ve F32 DK103500 verir). Biz minnetle bu işi desteklemek için New England Organ Bankası kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Liver Assist perfusion device | Organ Assist B.V. | Liver Assist | |
| Liver Assist disposable set | Organ Assist B.V. | Liver Assist disposable | |
| Williams’ Medium E | Sigma | W1878–6x500ml | |
| Insulin | Eli Lilly & Co | Humulin R U-100 | |
| Penicillin/Streptomycin 5,000 U/ml | Life Technologies | 15070-063 | |
| L-glutamine | Invitrogen | 25030-156 | |
| Hydrocortisone | MGH pharmacy | 7750500 | |
| Carbogen gas tank 95% O2/5% CO2 | Airgas | ZO2OX9522000043 | |
| Specialty gas regulator | Airgas | Y11244D580 | |
| Lactated Ringer’s solution | Baxter | 2B2324X | |
| 10% neutral buffered formalin | Fischer Scientific | 316-155 | |
| Toothed Adson forceps | Roboz | RS-5234 | |
| Debakey tissue forceps, 7.75”, 2.25 mm | Roboz | RS-7562 | |
| Metzenbaum Scissors 7" Curved SureCut Tungsten | Roboz | RS-6965SC | |
| Castroviejo Needle holder 5.5–7” | Fine Science Tools | 12565-14 | |
| 0 blackbraided silk sutures | Ethicon | SA66G | |
| 4-0 nylon suture, Nurolon RB1 | Ethicon | C554D | |
| Blood gas analysis machine | Siemens | RapidPoint 500 | |
| Balance scale | Cole Parmer | EW-10000-12 | |
| Pressure display box | Medtronic | 66000 | |
| Disposable pressure display sets | Medtronic | 61000 | |
| Handheld thermocouple thermometer and probe | Cole Parmer | EW-91500-04 and EW-08516-55 | |
| Acorn-tipped vessel cannula, 4 mm | Medtronic | 30005 | |
| Irrigation set flush tubing | Hospira | 06543-01 | |
| Mixing bowl, 4 L | Cole Parmer | EW-07300-40 |
Referanslar
- Merion, R. M., Pelletier, S. J., Goodrich, N., Englesbe, M. J., Delmonico, F. L. Donation after cardiac death as a strategy to increase deceased donor liver availability. Ann Surg. 244 (4), 555-562 (2006).
- Guarrera, J. V., et al. Hypothermic machine preservation facilitates successful transplantation of 'orphan' extended criteria donor livers. Am J Transplant. 15, 161-169 (2015).
- Dutkowski, P., Schlegel, A., de Oliveira, M., Müllhaupt, B., Clavien, P. -. A. HOPE for human liver grafts obtained from donors after cardiac death. J Hepatol. 60 (4), 765-772 (2013).
- Dutkowski, P., Clavien, P. -. A. Solutions to Shortage of Liver Grafts for Transplantation. Br J Surg. 101 (7), 739-774 (2014).
- Vogel, T., Brockmann, J. G., Friend, P. J. Ex-vivo Normothermic Liver Perfusion: An Update. Curr Opin Organ Transplant. 15 (2), 167-172 (2010).
- Monbaliu, D., Brassil, J. Machine Perfusion of the Liver: Past, Present, and Future. Curr Opin Organ Transplant. 15 (2), 160-166 (2010).
- Matsuno, M., Uchida, K., Furukawa, H. Impact of Machine Perfusion Preservation of Liver Grafts From Donation After Cardiac Death. Transplant Proc. 46 (4), 1099-1103 (2014).
- Schlegel, A., Dutkowski, P. Role of hypothermic machine perfusion in liver transplantation. Transplant Int. , (2014).
- Op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am J Transplant. 13, 1327-1335 (2013).
- Bruinsma, B. G., et al. Antibiotic prophylaxis in (sub)normothermic organ preservation: In vitro efficacy and toxicity of cephalosporins. Transplantation. 95 (8), 1064-1069 (2013).
- Post, I. C., Dirkes, M. C., Heger, M., Bezemer, R., van't Leven, J., van Gulik, T. M. Optimal flow and pressure management in machine perfusion systems for organ preservation. Ann Biomed Eng. 40 (12), 2698-2707 (2012).
- Post, I. C., et al. Endothelial cell preservation at hypothermic to normothermic conditions using clinical and experimental organ preservation solutions. Exp Cell Res. 319 (17), 2501-2513 (2013).
- Klein, A. S., et al. Organ Donation and Utilization in the United States, 1999-2008. Am J Transplant. 10 (4), 973-986 (2010).
- Jay, C., et al. The Increased Costs of Donation After Cardiac Death Liver Transplantation. Ann Surg. 251 (4), 743-748 (2010).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary Complications After Liver Transplantation: Old Problems and New Challenges. Am J Transplant. 13, 253-265 (2013).
- Morrissey, P., Monaco, A. Donation After Circulatory Death: Current Practices, Ongoing Challenges and Potential Improvement. Transplantation. 97 (3), 258-264 (2014).
- Verdonk, R., Buis, C., Porte, R., Haagsma, E. Biliary complications after liver transplantation: A review. Scand J Gastroenterol. 41, 89-101 (2006).
- Pine, J., et al. Liver Transplantation Following Donation After Cardiac Death: An Analysis Using Matched Pairs. Liver Transpl. 15 (9), 1072-1082 (2009).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS One. 11, e110642 (2014).
- Bruinsma, B. G., et al. Subnormothermic Machine Perfusion for Ex Vivo Preservation and Recovery of the Human Liver for Transplantation. Am J Transplant. 14, 1400-1409 (2014).
- Bruinsma, B. G., Yarmush, M. L., Uygun, K. Organomatics and organometrics: Novel platforms for long-term whole-organ culture. Technology. 02 (1), 13-22 (2014).
- Berendsen, T. A., et al. A simplified subnormothermic machine perfusion system restores ischemically damaged liver grafts in a rat model of orthotopic liver transplantation. Transplant Res. 1 (1), 6 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır