Method Article
Protein Kalite Kontrol Sistemi incelenmesi
Bu Makalede
Özet
The social amoebae Dictyostelium discoideum has recently been established as a system to study protein misfolding and proteostasis. Here, we describe a new imaging-based methodology to study temperature-induced protein aggregation and the cellular stress response in D. discoideum.
Özet
The complex lifestyle of the social amoebae Dictyostelium discoideum makes it a valuable model for the study of various biological processes. Recently, we showed that D. discoideum is remarkably resilient to protein aggregation and can be used to gain insights into the cellular protein quality control system. However, the use of D. discoideum as a model system poses several challenges to microscopy-based experimental approaches, such as the high motility of the cells and their susceptibility to photo-toxicity. The latter proves to be especially challenging when studying protein homeostasis, as the phototoxic effects can induce a cellular stress response and thus alter to behavior of the protein quality control system.
Temperature increase is a commonly used way to induce cellular stress. Here, we describe a temperature-controllable imaging protocol, which allows observing temperature-induced perturbations in D. discoideum. Moreover, when applied at normal growth temperature, this imaging protocol can also noticeably reduce photo-toxicity, thus allowing imaging with higher intensities. This can be particularly useful when imaging proteins with very low expression levels. Moreover, the high mobility of the cells often requires the acquisition of multiple fields of view to follow individual cells, and the number of fields needs to be balanced against the desired time interval and exposure time.
Giriş
Diktiyostelyum diskodeyum fagositozu tarafından alınır bakteri ve diğer mikroorganizmaların, beslenen yalnız toprak yaşayan amipler vardır. Onun keşfinden 1 yılından bu yana araştırma önemli bir alan olmuştur eşsiz ve olağanüstü yaşam döngüsü vardır. Çok hücreli gelişim 2 ve kemotaksis 3 moleküler temeli erken faiz yakında hücre hareketi, hücre polarite, doğuştan bağışıklık odaklanarak çalışmalarla tamamlanmaktadır. Buna ek olarak, D. diskodeyum biyomedikal araştırma 4,5'ten için bir model sistem olarak tanıtıldı.
Son zamanlarda, biz D. kurdu diskodeyum protein kalitesi kontrolü (PQC) sistem 6,7 incelemek için yeni bir sistem olarak. Onun proteom protein kalite kontrolü 8 bir sorun teşkil etmektedir toplama eğilimli prion-benzeri proteinler, zenginleşmektedir. D. olup olmadığını araştırmak diskodeyum onun son derece ag kontrol etmek için özel moleküler mekanizmaları geliştirmiştirgregation eğilimli proteom, normal gelişim koşulları altında ve stres esnasında her iki çekiş eğilimli markör proteinlerin davranışı incelenmiştir. Bu tür ısı stres gibi stres koşulları, protein 9 yanlış katlayan oranını artırmak için kullanılabilir. Bu nedenle, biz sıcaklık değişikliklere neden ve aynı zamanda işaretleyici proteinlerin davranışını takip edebilecek bir sistem arıyordu. Bu amaçla, bir ısıl aşama uç (soğutma odası) kullanılarak Peltier kontrol ısıtılarak canlı hücre görüntüleme birleştirildi. Bu yöntem sürekli ve üniform bir sıcaklığı korumak hem de hızlı bir şekilde, ama kesin bir sıcaklık değişimine neden izin verdi.
Canlı hücre görüntüleme D. biyolojik süreçlerin çeşitli incelemek için kullanılır diskodeyum. Ancak, bu yaklaşım iki önemli sınırlamalar ile karşı karşıyadır. İlk olarak, hücreler böylece bireysel hücrelerin izleme, yüksek hareket kabiliyeti göstermek ve görüş alanının dışına göç eğilimi genellikle geniş bir alanın görüntüleme gerektirir. Hücre hareketlilik olabilirAgar bindirme 10 azaltılabilir, ancak bu koşullar nedeniyle canlılığı bir azalmaya ve uzun vadeli görüntüleme için uygun değildir. İkinci olarak, D. discoideum hücreler, hücre yuvarlama ve mitotik durması 11 sonuçlanan verilmedi-toksisite için özellikle yüksek bir duyarlılık göstermektedir. Önceki protokoller bir kök sürükleyici ve maruz kalma süreleri 12 azaltılması gibi askorbat ilave edilerek bu sorunu ele aldı. İlgili protein düşük seviyelerde sentezlendiği ve zayıf bir floresan sinyalini göstermektedir olan ikinci kritik öneme sahip olabilir. Yazarlar ayrıca, klimalı odada görüntüleme ya da nesnel ve mikroskop sahne 12 kapak sıcaklık kontrollü kuluçka kutuları kullanarak ya 21 ° C sabit sıcaklık sağlamak öneririz.
Burada, 23 ° C'de bir soğutma odası kullanılarak, geliştirilmiş sıcaklık kontrollü bir yöntem açıklanmaktadır. Bizim set-up görüntüleme sırasında önemli ölçüde foto-toksisite direncini artırır. Oyüksek pozlama süreleri ve daha yüksek uyarma ışık şiddetlerinin kullanımını sağlar. zaman aralıkları görüntülü pozisyonların sayısı ve kullanılan poz zamana karşı dikkatle dengelenmiş olması gerekir gibi bu, time-lapse görüntüleme sırasında özel bir önem taşımaktadır. görüntülü pozisyonların sayısının artırılması olanağı da daha geniş bir görüntüleme alanının kapsamı izin verir ve daha uzun bir süre boyunca tek tek hücrelerin izleme kolaylaştırır.
Protokol
1. Hücre Hazırlanması
- büyüyen hücreler
- D. büyümek doku kültür plakaları içinde ışık altında 23 ° C de AX ortam içinde discoideum hücreleri. % 75 confluency üzerinde yüksek yoğunluklarda hücreleri tutmaktan kaçının.
NOT: Optimal yanıtı sıcak stresine için, hücreler üstel büyüme fazında olması gerekir ve sabit faz ulaşmış olmamalıdır. - Görüntüleme önceki gün, 1 x 10 4 hücre / ml, alçak flüoresans ortamı (LFM) bölünmüş hücreleri.
NOT: Bu adım, AX maddeden kaynaklanan arka plan floresan azaltmak gereklidir. Kuluçka süresi, 2 saat, en az azaltılabilir. Bununla birlikte, AX ortam içinde alınmış veziküller de 2 saat sonra bir arka plan sinyali üretir.
- D. büyümek doku kültür plakaları içinde ışık altında 23 ° C de AX ortam içinde discoideum hücreleri. % 75 confluency üzerinde yüksek yoğunluklarda hücreleri tutmaktan kaçının.
- Mikroskopi için hazırlanıyor hücreler
- görüntüleme önce, LFM doku plaka hasat hücreleri ve cam alt yemeklerin içine hücrelerin yeterli sayıda aktarın.
NOT: Genellikle,1 x 10 5 hücre / ml yeterlidir; deney düzeneği (8 saat daha uzun) uzun görüntüleme dönemleri gerektiriyorsa, ancak, hücre sayıları dikkatle D. olarak, ayarlanması gerekebilir diskodeyum hücreleri gelişimsel döngüsü geçiş ve besin düşük ise hücre sayıları yüksek olup olmadığını akarsu ve agrega başlayacaktır. - Hücreler 20 dakika yerleşmek için izin verin. dikkatle taze ortam ile kullanılan ortamının değiştirilmesiyle olmayan yerleşmiş hücreleri çıkarmak.
- görüntüleme önce, LFM doku plaka hasat hücreleri ve cam alt yemeklerin içine hücrelerin yeterli sayıda aktarın.
2. Görüntüleme
NOT: protokol geniş alan sistemlerinin yanı sıra konfokal mikroskopi kurulumları kullanılabilir. hedefleri içeren ısı kontrollü bir inkübasyon kutusu ve mikroskop aşamasının kullanımı yararlı, henüz sıcaklık kontrolü için gerekli değildir. Isı stresi gerçekleştirilirse, inkübasyon kutusunun sıcaklığı 40 ° C'ye kadar, deney, örneğin, kullanılan yüksek sıcaklığa ayarlanır. Aksi takdirde, sıcaklık 25 ° C olarak ayarlanır6 ° C. Sıcaklık değişimleri görüntüleme sırasında sıcaklık değişimleri odağını etkiler gibi, sistem uyum sağlamak için önceden yapılmalıdır.
Not: görüntüleme sırasında, sıcaklık soğutma odası kullanılarak kontrol edilir. olmayan vurguladı hücrelerin görüntüleme için varsayılan sıcaklığı 23 ° C dir. Isı stresi koşulları için, sıcaklığı istenilen seviyeye buna göre artar. Soğutma odasındaki piezo elemanı sıcaklık kayması çok çabuk cevap verebilir. Ancak, görüntülerin odak (sıcaklık kayması bağlı en fazla 20 mm sapma olabilir) hafifçe değişecektir. kullanılan mikroskop donanım, oto-fokus ile donatılmış sürece Böylece manuel refocusing, görüntü alımı ilk dakika içinde gereklidir.
- Olmayan vurguladı koşullarda görüntü elde etme
- 23 ° C'de olmayan stresli koşullar altında görüntü hücreleri, bakış 6 alanlara (FOVs) en az kazanır.
NOT: Non-stres koşulu visualiz olabilired temsilcisi hareketsiz kısa bir zaman atlamalı (5-30 dk) ya da satın alma kaydederek ya. Her koşul veya hücre hattı için görüş 6 alanlara (FOVs) en az kazanır.
NOT: tek tek hücrelerin ilgi durumunda, FOV ortasında ilgili hücreleri konumlandırmak ve ortada ilgi hücreleri içeren FOV ile bir 3 x 3 kiremit serisi kayıt D.. diskodeyum hücreleri hareketli ve FOV dışarı göç olabilir. Ancak, 3 x 3 karo serisi potansiyel ilgi hücre tarafından keşfedilmeyi alanını arttırır ve ~ 6 saat zaman atlamalı dönemler için izlenebilir kalır. - Hücrenin tüm hacmini yakalamak için 1-0,25 mikron adımda maksimum 7 mikron z-yığınları elde edin.
- hücrelerin toplam sayısını değerlendirmek için bir referans parlak bir alan görüntü kazanır.
- 23 ° C'de olmayan stresli koşullar altında görüntü hücreleri, bakış 6 alanlara (FOVs) en az kazanır.
- Isı stresi için görüntü elde etme
- üreticinin talimatlarına uygun olarak 30 ° C'ye kadar soğutma odası sıcaklığı ayarlayın.
- sıcaklık göstergesi, istenen değere ulaştıktan sonra, parlak bir alan kanalda elle yönlendirmesi ve time-lapse başlamadan önce kaydedilen tüm FOVs kontrol edin.
- zaman noktaları arasında, 5-10 dakikalık bir zaman aralığı ile bir ısı stresi 4 saat bir zaman atlamalı başlatın. Doğru İlk iki zaman noktası alımı sırasında odaklama için kontrol edin.
- Kurtarma sırasında Görüntü edinimi
- Isı stresi sonra, geri 23 ° C'ye kadar sıcaklığını düşürmek ayarlayabilir ve elle yönlendirmesi için sıcaklık göstergesi bekleyin.
- 10-20 dakika zaman aralıklarında 8-10 saat kurtarma aşamasında kayıt time-lapse film. Doğru ilk kez noktasının yakalanması sırasında odaklama için kontrol edin.
3. Görüntü Analizi
NOT: sitozolik odak taşıyan hücrelerin sayısını ölçmek hücrelerin toplam sayısını ve her bir zaman sitosolik odağı olan hücre sayısını değerlendirmek içinçerçeve. Nedeniyle parlak bir alan görüntülerden hücrelerin segmentlere zorluğu, ölçümü elle yapılması gerekir. Aşağıda, veri analizi ücretsiz görüntü işleme paketi ((http://fiji.sc/Fiji). Bu "Hücre Sayım Cihazı" (http://fiji.sc/Cell_Counter) eklentisi gerektirir tarif edilmiştir.
- Hücrelerin sayısını değerlendirmek
- "Dosya" ve "Aç" linkine tıklayarak parlak alan görüntü yığınını (XYT) yükleyin.
- "Sayaç Cell" eklentisi (- "Hücre Sayım Cihazı" "Eklentiler") açın. "Initialize" tıklayarak Görüntü yığını yükleyin.
- uygun kutuyu işaretleyerek sayaçları uygun türü seçin.
NOT: Toplam hücre sayısı ve sitozolik odaklarla hücreleri için sayaç olarak tip 2 sayıcı olarak kullanılması tip 1. Tüm hücreleri saymak. - "Kaydet İşaretleyiciler" tıklayarak belirteçler kaydedin.
- Sitozolik odaklarla hücrelerin sayısını değerlendirilmesi
- floresan görüntü hyperstack (XZYT) ( "Dosya" - "Aç") yükleyin ve "Z-Projektör" (Resim / Yığınları) kullanarak maksimum yoğunluk projeksiyon yapmak.
- "Sayaç Cell" eklentisi açın. "Initialize" tıklayarak çıkan görüntü yığınını (XYT) yükleyin.
- "Yük İşaretleyiciler" tıklayarak belirteçler yükleyin.
DİKKAT: Referans görüntü ve floresan yığınının dosya adları aynı olmalıdır. Gerekirse, görüntü yığını başlatılırken önce buna göre yeniden adlandırın. - Uygun işaret türünü seçin (3.1.3) ve sitozolik odaklarla hücreleri saymak. Mevcut belirteçler tek tek hücrelerin konumu için bir yol gösterici olarak kullanılabilir.
- "Sonuçlar" butonuna tıklayarak dilim başına sayıyı almak ve sonraki hesaplamalar için başka bir yerde sayar kaydedin.
Sonuçlar
Açıklanan görüntüleme protokolü amip D. toplama eğilimli prion-benzeri proteinler davranışını analiz etmek için kullanılabilir Isı stresi esnasında discoideum. Şekil 1 30 ° C (Şekil 1B) ve stres iyileşme 6 saat sonra ve en ısı stresinin 2 saat sonra, normal büyüme koşullarında (Şekil 1A) altındaki hücrelerde GFP etiketli poliglutamin proteini Q103 dağılımını göstermektedir normal büyüme koşullarında (Şekil 1C) büyüme. 30 ° C, 23 ° C sıcaklık artışı üzerine, Q103-GFP işaretleyici yapıları noktalı bir yaygın dağıtım birleşir. normal sıcaklıkta stres sürüm ve büyüme üzerine, bu yapıların çözülür. Q103-GFP yeniden dağıtılması ve ısı stres kaynaklı sitosolik odak oluşumu görüntü analizi kullanılarak ölçülebilir. Şekil 2A, Fiji ve eklenti "C kullanılarak tek tek FOVs analizini göstermektedirell sayacı ". Şekil 2B ısı stres yanıtı niceliğini gösterir. Bu sürekli ısı stresi ile sayısındaki sitozolik Q103-GFP odakları artış. ısı stresi sırasında, protein kalitesi kontrolü (PQC) sistem böylece birikmesini, bunalmış olduğunu gösterir prion-benzeri protein, Q103 kadar yatkın proteinler sitosolik odaklarda artan toplam çözünebilir bir halde muhafaza edilemez ve. hücreler de karakteristik bir yuvarlama göstermektedir, Şekil 1B 'de gösterildiği üzere. stres çıkarılmasından sonra, sitosolik odaklar azaltılması toplu düşündürmektedir proteinler çözülmüştür.
Görüntü kalitesi başlangıçtaki hücre yoğunluğuna kadar hassastır. Şekil 3, uygun başlangıç hücre yoğunluğu (Şekil 3A) ve yüksek başlangıç hücre yoğunluğu (Şekil 3B) karşılaştırılması, stres iyileşme sonrası hücrelerin bir örneği göstermektedir. Başlangıçta hücre yoğunluğu, çok yüksek ise, hücreler yıldızŞekil 3b'de de görüldüğü gibi ted akışları oluşturmak üzere. hücreleri gibi sonraki ölçümü ile ilgili zorluklar getirmektedir hangi Bu odak düzlemi dışına taşındı.
tarif edilen yöntem, yukarıda tarif edildiği gibi sıcaklığa bağlı sıcaklık değişiklikleri izlemek için de kullanılabilir. Ayrıca, Şekil 4., Fizyolojik büyüme sıcaklığında görüntülerken, belirli verilmedi-toksisitesini azaltmak için kullanılan bir klima odasında sıcaklık kontrolü olmadan görüntülenmiş bir soğutma odası (Şekil 4A) 'de 23 ° C' de görüntülenmiştir hücre ve hücre bir karşılaştırmasını göstermektedir, ayarlanabilir 25 ° C'de (Şekil 4B). sıcaklık kontrollü koşullar altında görüntülendi değilken ikaz ışığı sürekli maruziyet üzerine, hücreler yuvarlak. Hücre şeklinde Bu değişiklik stres işaret etmektedir.
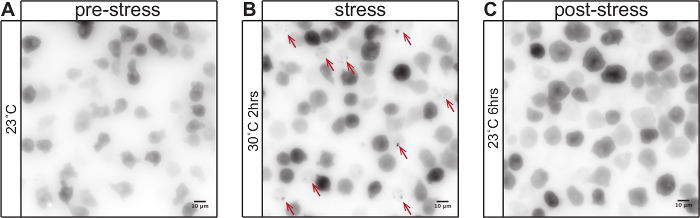
Şekil 1: Toplama eğilimli prion-benzeri proteinler ısı stresi sırasında hücresel dağılımı değişir. GFP etiketli poliglutamin zengin huntingtin ekson 1 (Q103) yapısal AX2-214 D'de ifade edilir diskodeyum hücreleri (ters gri skala arama tablosunda tasvir GFP sinyali). 23 ° C, Q103-GFP normal büyüme şartları altında, (A), diffüz sitoplazmada dağıtılır. 30 ° C ısı stresinin 2 saat sonra (B), Q103-GFP sitosolik odaklar (kırmızı oklar) içine birleşir. Hücreler karakteristik şekil değişikliği gösterir ve yuvarlak. 23 ° C'de gerilme serbest bırakılması ve büyümesi üzerine (C), sitozolik odakları eritilir. 6 saat sonra, herhangi bir sitosolik odakları gözlenebilir. Ölçek çubuğu = 10 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
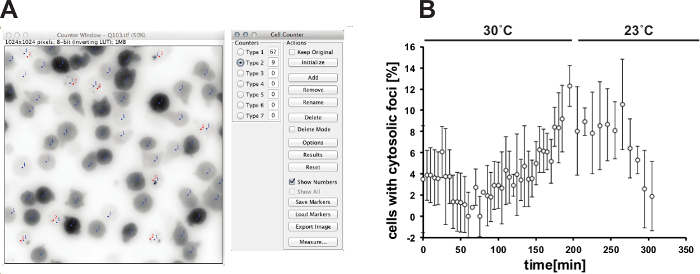
Şekil 2: ısı kaynaklı sitozolik odakları oluşumu Niceleme ücretsiz görüntü işleme paketi Fiji ve eklenti "Hücre Sayıcı" kullanarak hücrelerin (A) analizi.. hücrelerin toplam miktarı (tip 1, mavi sayaç işaretleri) parlak bir alan görüntüde belirlenir. belirteçler GFP-kanal ve belirlenir sitosolik odağı olan hücrelerin (tip 2 kırmızı karşı işaretleri) sayısı yüklenir. (B) odaklarının Niceleme 30 ° C'de ısı stresinin 3 saat ve 23 ° C'de stres toparlanma 3 saat sonra. (N = görüntüsü, hata bar = SD 4 alanlar) tıklayınız Bu daha büyük bir versiyonunu görmek için rakam.
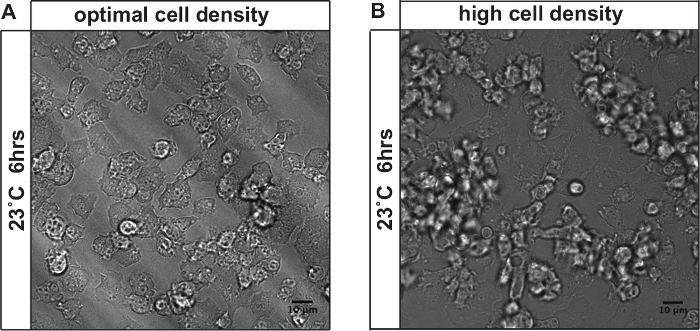
g> Şekil 3: Uzun vadeli time-lapse görüntüleme hücre yoğunluğunun etkisi ilk hücre yoğunlukları <10 5 hücre / ml görüntülü (A) Hücreler.. 30 ° C ısı stresi, 3 saat ve 23 ° C'de gerilme iyileşme 6 saat sonra, hücreler de bitkisel döngüsü ve bölme kalır. Sadece birkaç hücre odak düzlemi çıkın. (B) hücreler ilk hücre yoğunlukları> 10 6 hücre / ml'de görüntülenmiştir. görüntüleme (A gibi ayarlar) 9 saat sonra hücreler gelişimsel döngüsü girmiş ve akarsu ve bir araya başlamıştır. agrega Hücreler açıkça ayırt edilemez. hücrelerin büyük bir kısmı odak düzlemi çıkar ve analiz edilemez. Ölçek çubuğu = 10 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
.jpg "/>
Şekil 4:. Fototoksik etkilerini sıcaklık kontrolü etkisi (A) Hücreler, 23 ° C'de sıcaklık kontrollü, 10 dakika boyunca görüntülenmiş (0.5 uM, örnek kalınlığı 8 mikron aralığı) görünümü, z-yığın, zaman atlamalı 6 alanı (toplam süresi 10 dk, lapse 1 dk), GFP kanal (0.07 msn maruz kalma süresi,% 10 lazer yoğunluğu), RFP kanal (0.1 msn maruz kalma süresi,% 10 lazer yoğunluğu). Hücreler fototoksik stres ile ilişkili karakteristik morfolojik değişiklikler hiçbir belirti gösterir. (B) hücreler, (A ile aynı koşullar) sıcaklık kontrolü olmadan, 10 dakika boyunca görüntüsü alınmıştır. Hücreler stres belirten fototoksik kaynaklı yuvarlama belirtileri gösterirler. Ölçek çubuğu 10 mikron =. Hücreler 100x / 1.4 Sayısal açıklık (NA) amacı ile bir mikroskop dayalı bir sistemde görüntülendi. görüntüler 1 x 1 binning kullanarak 1024 x 1024 piksel dosyaları gibi bir CCD kamera ile toplanmıştır.4large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Tartışmalar
Burada açıklanan protokol ısı stresine yanıt olarak, ilgilenilen özel bir proteinin davranışını incelemek üzere kullanılabilir. 30 ° C sıcaklık artışı sıcaklık stresi yanıt tetiklemek için bildirilen ve D, bu koşullar altında yaşayabilirliği edilmiştir diskodeyum belirgin azalır.
Değişiklikler
Protokol, aynı stres koşulları altında farklı proteinler davranışını görmek için değiştirilebilir. Bu, aynı flüoresan etiketle farklı proteinler ifade eden hücreler, örneğin dört odacık tabaklar (bölüm 1.3.1) halinde, çok oyuklu tabaklara aktarılır. protokol, örneğin GFP veya RFP gibi farklı belirteçler, proteinler ko-eksprese eden hücreler üzerinde de uygulanabilir. Bu protein kalite kontrolü (PQC) sisteminin farklı bileşenleri davranışını izlemek için kullanılan, örneğin olabilir. GFP etiketli agregasyon Marker farklı TTT-etiketli PCQ bileşenleri ifade eden hücreler çok çukurlu kullanılarak gözlenebilirgörüntüleme için bombeli. Bu, aynı stres koşulları (sıcaklık artışı / azalması, sıcaklık artış / azalış süresi hız) sağlar ve karşılaştırmalı çalışmalar için izin verir.
Ayrıca protokol sıcaklık stresi yanıtına PQC sisteminin etkisini incelemek için kullanılabilir. Bileşenlerin etkinlik, knock-out veya aşırı ekspresyonu genetik araçlar kullanılarak ifade seviyeleri değiştirerek veya ticari olarak temin edilebilen özel inhibitörleri 6 ile modüle edilebilir. proteazom büyüme ortamına MG132 (100 uM) ya da Laktasistin (10 uM) ilave edilerek engellenebilmektedir. şaperon Hsp90 geldanamisin (6 uM) ya da radicicol (10 uM) kullanılarak inhibe edilebilir. Şimdiye kadar bizim deneysel ortamlarda inhibisyon etkinliğini teyit edemeyeceğini, ancak hastabakıcı Hsp70, VER-155088 ile inhibe edilebilir. İnhibitörler görüntüleme bir gün önce eklenmelidir ve hücreler 14 saat daha inkübe edilir.
great.Thanks Protokol çerçevesinde cal Adımlar
Isı kaynaklı pertürbasyonun değerlendirilmesi için kritik adım görüntüleme deney öncesinde hücrelerin durumudur. Mayada çalışmalar Hücreler durağan aşamaya 13 boyunca çevresel strese çeşitli direnci elde gösterdi. Biz de D. ise uygulanan ısı stresi minimum tepki gözlendi diskodeyum hücreleri önce görüntüleme sabit faz ulaşmıştı. Bu nedenle, sabit bir hücre sayısı elde <5 x 10 5 hücre / ml kritiktir.
Ayrıca, yüksek hücre sayısı D vejetatif döngüsü geçiş indükleyebilir böylece sıcak stresine farklı bir tepki yol açabilecek açlık yolları, tetikleme, gelişimsel döngüsüne diskodeyum. Yüksek hücre sayıları ısı stresi, akarsu sonrası iyileşme aşamasında ulaşılır ve hücreler odak dışında hareket olarak toplayarak hücreler veri analizi ile müdahale durumunda (bakınız Şekil 4).
içerik "> Tekniği Sınırlamasıodak kaybı protokolünün darboğaz olduğunu. sıcaklık değişimleri sırasında, odak düzlemi hemen sıcaklık değiştirdikten sonra bir süre içinde manuel odaklanma gerektirir, büyük ölçüde kayabilir. odak atlamak bazen zaman noktaları arasındaki zaman yüksek, özellikle yazılım otofokus tarafından üstesinden gelinmesi gereken çok aşırı olabilir. kullanılan mikroskop bir donanım otofokus ile donatılmış Ancak, bu darboğaz atlatılabilir.
Mevcut Yöntemlerine Göre Tekniği Önemi
Böyle klimalı odalarda, amaçlarını ve mikroskop sahne veya sıcaklık kontrollü aşamaları ve objektif yaka kapsayan sıcaklık kontrollü kuluçka kutuları kullanımı gibi mevcut kurulumları ile karşılaştırıldığında, bir soğutma odası kullanımı ortam daha hassas kontrol sağlar sıcaklık. soğutma bölmesi içinde Peltier parçası sabit ve muntazam bir TEM korumakdeney düzeneği boyunca lığı. Klasik kurulumları, yerel sıcaklık farklılıkları, değişik gözlem sonuçlarına yol açabilir. Klasik kurulumları özellikle sıcaklığının düşürülmesi, uyarılmış sıcaklık değişikliklerine çok yavaş adapte ederken Dahası, sıcaklık kaynaklı değişikliklere çabuk ve hızlı cevap verebilir. soğutma bölmesi içinde Peltier parçası, aynı zamanda, 15 ° C ya da 40 ° C olarak ulaşan sıcaklıklarda çok zor olan klasik kurulumları daha geniş bir sıcaklık aralığı (15-40 ° C) kapsayabilir.
Dictyostelium discoideum verilmedi-toksisiteye özellikle duyarlıdır. Önceki çalışmalar foto-toksisitesini azaltmak için süpürücü olarak askorbat kullanılır. Ancak, uzun görüntüleme süreleri ek takviyesi gerektirir. Ayrıca, askorbat kullanımı ilgi mekanizması antioksidan takviyesi etkilenmez çalışmalar sınırlıdır. O sıcaklık kontrollü bir görüntüleme alternatif yakl olarak kullanılabilir teklifoach verilmedi-toksisiteyi en aza indirmek için ve daha fazla toksisite azaltmak için askorbat eklenmesiyle birleştirilebilir.
Fototoksik etkilerini bir soğutma odası kullanılarak 23 ° C'lik bir sabit ve muntazam bir ısı sağlanarak en aza indirilebilir. Sıcaklık kontrolü kullanarak görüntülü hücreler daha uzun bir süre için foto-toksisite, hücre yuvarlama az belirtileri göstermektedir. Bu aynı zamanda yüksek şiddetlerde küçük zaman aralıkları veya görünümü (FOVs) daha fazla alanları ile görüntüleme sağlar.
Genel Başvuru
Daha yüksek sıcaklıklarda ısı stres farklı ısı stres yanıtı 14 tetiklemek için gösterilmiştir. Bu nedenle, 34 ° C ya da 37 ° C sıcaklığının artırılması başka bir yanıtı ortaya çıkarabilir. uygulanan sıcaklık stresine ilaveten, belli bir yük durumu süresi sıcak stresine hemen yanıt ya da uzun süreli uyum incelemek için modifiye edilebilir.
Genel olarak, açıklanan protokol olabilirgeniş bir uygulama seti genişletilmiş. Hassas sıcaklık kontrolü önemli verilmedi toksik etkilerini azalttığı için, iletişim kuralı, ya da kısa aralıklarla ile bir arada, düşük ekspresyon düzeyi ile protein görselleştirmek için, örneğin, yüksek etki süreleri ve / veya daha yüksek uyarım ışık şiddetleri, gerektiren işlerde kullanılır time-lapse görüntüleme sırasında görüntüleme, örneğin, arasındadır. Aynı zamanda tam hücre kapsayan nesneleri görüntüleme için avantajlı olabilir, örneğin, mikrotübül, bu ayarlar optik z bölümlerin yüksek sayıda gerektiren.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors have no Acknowledgements.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AX Medium | ForMedium | AXM0102 | |
| LoFlo medium | ForMedium | LF1001 | |
| MG132 | Sigma | C2211 | |
| Lactacystin | Sigma | L6785 | |
| Geldanamycin | Santa Cruz | sc-200617 | |
| Radicicol | Santa Cruz | sc-200620 | |
| MatTek disch 35 mm | MatTek corporation | P35G-1.5-14-C | glass bottom imaging dish |
| CellViell cell culture dish | Greiner | 627870 | 4-compartment glass-bottom imaging dish |
| Thermal Stage Heater/Cooler Insert | Warner Istruments | TB-3/CCD | |
| Bipolar temperature controller | Warner Istruments | CL-100 | |
| Liquid cooling System | Warner Instruments | LCS-1 |
Referanslar
- Bonner, J. T. Evidence for the Formation of Cell Aggregates by Chemotaxis in the Development of the Slime Mold Dictyostelium Discoideum. Journal of Experimental Zoology. 106 (1), 1-26 (1947).
- Loomis, W. F. Cell signaling during development of Dictyostelium. Developmental Biology. 391 (1), 1-16 (2014).
- Nichols, J. M. E., Veltman, D., Kay, R. R. Chemotaxis of a model organism: progress with Dictyostelium. Current Opinion in Cell Biology. 36, 7-12 (2015).
- Williams, J. G. Dictyostelium finds new roles to model. Genetics. 185 (3), 717-726 (2010).
- Müller-Taubenberger, A., Kortholt, A., Eichinger, L. Simple system - substantial share: The use of Dictyostelium in cell biology and molecular medicine. European Journal of Cell Biology. 92 (2), 45-53 (2013).
- Malinovska, L., Palm, S., Gibson, K., Verbavatz, J. M., Alberti, S. Dictyostelium discoideum has a highly Q/N-rich proteome and shows an unusual resilience to protein aggregation. Proc Natl Acad Sci U S A. 112 (20), E2620-E2629 (2015).
- Malinovska, L., Alberti, S. Protein misfolding in Dictyostelium: Using a freak of nature to gain insight into a universal problem. Prion. 9 (5), 339-346 (2015).
- Schneider, K., Bertolotti, A. Surviving protein quality control catastrophes - from cells to organisms. Journal of Cell Science. 128 (21), 3861-3869 (2015).
- Dobson, C. M. Protein folding and misfolding. Nature. 426 (6968), 884-890 (2003).
- Fukui, Y., Yumura, S., Yumura, T. K. Agar-overlay immunofluorescence: high-resolution studies of cytoskeletal components and their changes during chemotaxis. Methods in cell biology. 28, 347-356 (1987).
- Graf, R., Rietdorf, J., Zimmermann, T. Live cell spinning disk microscopy. Microscopy Techniques. 95, 57-75 (2005).
- Samereier, M., Meyer, I., Koonce, M. P., Graef, R. Live Cell-Imaging Techniques for Analyses of Microtubules in Dictyostelium. Methods in cell biology. 97, 341-357 (2010).
- Herman, P. K. Stationary phase in yeast. Current opinion in microbiology. 5 (6), 602-607 (2002).
- Loomis, W. F., Wheeler, S., Wheeler, S. Heat shock response of Dictyostelium. Developmental Biology. 79 (2), 399-408 (1980).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır