Method Article
Kurbağa Sinir Uçlarına Sinir Kütüğü Vasıtasıyla Kalsiyum Boyası Yükleme: Kurbağa Nöromüsküler Kavşağında Kalsiyum Geçici Kayıt
Bu Makalede
Özet
Burada, sinir uçlarına kurbağa sinir kütüğünden kalsiyuma duyarlı bir boya yüklemek için bir yöntem açıklıyoruz. Ayrıca, periferik sinir uçlarında hızlı kalsiyum geçişlerinin kaydedilmesi ve analizi için bir protokol de sunuyoruz.
Özet
Presinaptik sinir terminallerinde presinaptik kalsiyum düzeylerini ölçmenin en uygun yöntemlerinden biri optik kayıttır. Hücredeki serbest kalsiyum konsantrasyonuna bağlı olarak emisyon yoğunluğunu veya dalga boyunu değiştiren kalsiyuma duyarlı floresan boyaları kullanmaya dayanır. Kalsiyum boyaları ile hücreleri lekelemek için kullanılan çeşitli yöntemler vardır. En yaygın olanları, boyaların bir mikropipet ile yüklenmesi veya boyaların asetoksimetil ester formları ile ön-kuluçka işlemidir. Bununla birlikte, bu yöntemler ortaya çıkan metodolojik sorunlardan dolayı nöromüsküler kavşaklara (NMJ'ler) pek uygulanmaz. Bu yazıda kurbağa sinirinin kurbağa sinir kütüğü boyunca sinir uçlarına kalsiyuma duyarlı bir boya yüklemek için bir yöntem sunuyoruz. Harici kalsiyumun sinir terminallerine girişi ve bundan sonra kalsiyum boya bağlanması milisaniyedeki zaman ölçeğinde gerçekleştiğinden, bu etkileşimi kaydetmek için hızlı görüntüleme sistemi kullanmak gereklidirns. Burada, hızlı bir CCD kamerayla kalsiyum geçişini kaydetmek için bir protokolü açıklıyoruz.
Giriş
Kalsiyum iyonları (Ca 2+ ), mediatör salınımı 1 , 2 , 3 , 4 , 5'in başlatılması, bakımı ve plastisitesi dahil birçok sinirsel sinyalleme sürecine katılır. Aksiyon potansiyelinin gelmesinden sonra, hücre dışı Ca 2+ sinir terminaline girer ve nörotransmiter salınımı başlatır. Bazı sinapslarda, kalsiyum akımı doğrudan elektrofizyolojik yöntemlerle 6 , 7 , 8 ölçülebilir. Nöromüsküler kavşak (NMJ) durumunda, sinir uçlarının minik boyutundan dolayı direkt yama kelepçesi ve iki elektrotlu gerilim kelepçesi teknikleri kullanılamaz.
NMJ'deki sinir uçlarından içe Ca 2+ akımlarının kayıtları dolaylı elektrofizler ile yapılabilirİyonik yöntemler 9 , 10 . Bununla birlikte, bu yöntemler, sodyum ve potasyum iyon kanalı bloke edicileri tarafından sinapsın ön işleme tabi tutulmasını gerektirir. Optik yöntemler, iyonik akımların sinir terminalinde farmakolojik olarak ayrılmasını gerektirmez ve aksiyon potansiyelleri tarafından tetiklenen Ca 2 + akışı ve ardından axoplasm 11 Ca 2+ iyonlarının elevasyonu , 12 , 13 , 14'e izin verir . Bu yöntemler serbest Ca 2+ iyonlarının 15 , 16 , 17 , 18 , 19'unun bağlanması üzerine spesifik Ca 2+ -duyarlı boyaların flüoresanındaki değişikliklerin kayıtlarına dayanmaktadır.
Ca 2+ göstergeleri c içine yüklenebilirDeneyin amacına bağlı olarak çeşitli yöntemler vasıtasıyla basılmaktadır. Araştırmacılar yama pipeti 22 veya mikroenjeksiyon 23 , 24 , 25 ile yüklemeye devam eden membran geçirgen boya formları 20 , 21'in banyo uygulamasını kullanıyorlar. Bununla birlikte, tüm bu yöntemlerin sinaptik mimarlık özelliklerine bağlı olarak NMJ durumunda bazı sınırlamaları vardır. NMJ için en uygun ve başarılı yöntem, 26 , 27 , 28 , 29 ileri dolum yöntemi ile boyayı sinir güdüğü üzerinden yüklemektir. Bu teknik, periferik sinir uçlarına çeşitli fluoresan boyaları yüklemek için kullanılabilir. Bu yöntem Drosophila sinir terminalleri 28 , kertenkele motor siniri için başarıyla kullanılmıştır28 ve kurbağa motor sinir terminalleri 17 , 26 , 27 , 30 . Çalışma esnasındaki nesnelere bağlı olarak metodik ayrıntılar değişebilir. Larvaların küçük sinirleri için cam mikro-pipet kullanılabilir 28 . Birkaç araştırmacı, kasları sinirlendiren sinirin yeni kesilen ucunun bir boya ile önceden doldurulmuş bir kuyuya daldırıldığı bir yöntem 27 , 28'i tarif etmiştir. Bundan sonra, preparat boya ıslatmak için birkaç saat bırakılır. Boya aksonlar tarafından emilir ve sinir terminallerine taşınır. Bu yazıda, sinir kütüğü aracılığıyla kurbağa motoru sinir uçlarına bir floresan göstergesi yüklemek için bir yöntem açıklanmaktadır. Protokolümüz, bir boya ile dokunun kuluçka için plastik bir pipet kullanır. Ayrıca, Ca 2+ fluorescence tra'ı nasıl edinip analiz edeceğimizi de tarif ediyoruznsients.
Protokol
Deneyler Rana ridibunda kurbağasından muskulus kutanöz pektorisin izole edilmiş sinir-kas preparatları üzerinde gerçekleştirildi. Her iki cinsiyetteki hayvanların büyüklüğü yaklaşık 5-9 cm'dir. Deneysel prosedürler, NIH Laboratuar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak, Kazan Federal Üniversitesi ve Kazan Tıp Üniversitesi'ndeki laboratuar hayvanlarının kullanımına ilişkin esaslara uygun olarak gerçekleştirildi. Deneysel protokol Avrupa Toplulukları Konseyi 86/609 / EEC sayılı Direktifin gerekliliklerini karşıladı ve Kazan Tıp Üniversitesi Etik Kurulu tarafından onaylandı.
1. Çözümlerin Hazırlanması
- Ringer solüsyonunun hazırlanması.
- Ringer solüsyonunu hazırlayın: 113.0 mM NaCI, 2.5 mM KCI, 3.0 mM NaHC03 ve 1.8 mM CaCl2. PH'ı 7.2-7.4'e ayarlayın.
- Ringer solüsyonunu düşük bir Ca 2+ ile hazırlayın + içeriği: 113.0 mM NaCl, 2.5 mM KCI, 3.0 mM NaHC03, 6.0 mM MgCl2, 0.9 mM CaCl2. PH'ı 7.2-7.4'e ayarlayın.
- Boya yükleme çözeltisinin hazırlanması.
- HEPES-Na içeren su bazlı çözeltiyi 10 mM'de hazırlayın (pH 7.2-7.4).
- Boya 30 ile bir şişeye 14 uL HEPES çözeltisi ekleyin.
NOT: Ca 2+ gösterge boyası, 500 μL toz ile 500 μL'lik bir şişeye gelir. - Harca karıştırın ve karıştırarak iyice karıştırın.
- Ca 2+ göstergesinin nihai konsantrasyonunu 30 mM'ye düşürmek için çözeltiyi seyreltin. Işıktan kaçının ve -20 ° C'de saklayın.
2. Boya yükleme prosedürü
- Kutanöz pectoris kasını pektoralis proprius sinir parçasıyla ayırın .
NOT: Diseksiyon prosedürü mevcutturBlioch ve ark. Tarafından ücretsiz olarak indirilen bir makalede . , 1968 31 .- Diseksiyon prosedürü için iki ince forseps ve kornea makası kullanın ( Malzeme Tablosuna bakın). Diseksiyonlanmış dokuyu silikon elastomer kaplı bir Petri kabına, Ringer çözeltisi ile önceden doldurulmuş halde aktarın ve dokuyu hafifçe paslanmaz çelik iğnelerle, çanakta biraz gergin olacak şekilde düzeltin.
- Petrol kabını Ringer solüsyonunun taze bir miktarı ile tekrar doldurun. Bağ dokularını çıkarın. Sinire zarar vermeyin.
- Dolum pipetini hazırlayın: Tıraş bıçağı kullanarak, standart plastik 10 μL pipet ucunun konik kısmının ~ 2 mm uzunluğundaki parçasını kesin.
- Petri kabındaki dolum pipetini takmak için bir parça modelleme kili hazırlayın.
- Doldurma pipetinin arkasını bir plastik şırıngaya silikon boru ve plastik bağlantı adaptörleri aracılığıyla pipet uçlarından bağlayın.
- D önceY yükleme prosedürü, plastik bir pipet kullanarak Petrol kabından Ringer solüsyonunu çıkarın. Kas-sinir preparatını ince bir şırınga kullanarak kurutun; Bu dolum pipetinin daha sonra yüklenmesi üzerine Ca 2+ boyasının seyrelmesini önleyecektir.
- Ca 2+ gösterge şişesini dondurucudan çıkarın ve karanlık bir yerde oda sıcaklığında çözülmesine izin verin.
- Düşük büyütme (10 ×) ile stereomikroskop kontrolü altında, kas ve sinir arasındaki bağlantıyı tespit edin. İnce cımbız ve makasla, kas yüzeyinin yakınında pektoralis proprius siniri kesin (bkz. Adım 2.1). Yaklaşık 2 mm uzunluğunda bir sinir kütüğü bırakın.
- Modelleme kili kullanarak Petri kabındaki boruya ve şırıngaya tutturulmuş dolum pipetini düzeltin.
- Pipetin ucunu sinir kütüğü yakınına getirin.
- Çimdiklemeden, sinir kütüğünü dolum pipetinin ucu içine yavaşça aspire edin.
- Emme borusunu körelmeden çıkarınT Dolum pipetinin sonu.
- Uzun bir iğneli bir şırınga kullanarak aşırı miktardaki çözeltiyi dolum pipetinden dikkatlice çıkarın (Malzeme Tablosuna bakın). Sinir güdüklerini sıkmayın.
- Sinir kütüğü ucunda emilmiş tutarak, dolum pipetinin ucunu dikey olarak biraz yukarı kaldırın.
- Petrol jöle kullanarak dolum pipet ucunun dışından sinir kütüğünün aspire edilmiş bölümünü izole edin.
- Gerekirse dolum pipetinde yalıtılmış sinir güdükünü kurutun: uzun bir iğneli bir şırınga kullanarak dolum pipetinden aşırı miktarda solüsyonu aspire edin.
- Uzun pipet ucuyla bir pipet kullanarak boya yükleme çözeltisinin 0.5 μL'sini çizin (adım 1'e bakın).
- Dolum pipetine yükleme çözeltisiyle birlikte pipet ucu nazikçe yerleştirin. Karışımı doğrudan sinir güdüğü üzerine çıkarın.
- Dolum pipetinin açık ucunu petrol jeli ile kapatın.
- Ringer'in küçük bir parçasını ekleyin.Hazırlanışı ıslak tutmak için Petri kabında olution.
- Preparatı karanlık ve ıslak koşullar altında oda sıcaklığında 5 saat inkübe edin.
- Dolum pipetini yükleme çözeltisiyle çıkartın, hazırlığı Ringer solüsyonuyla durulayın ve gece boyunca 8 ° C'de buzdolabında saklayın.
3. Mikroskopi için Doku Hazırlama
- Preparatı silikon elastomer kaplı bölmeye monte edin ve biraz gerginleşecek şekilde çelik mikro iğnelerle sabitleyin.
- Dokuyu bir miktar taze Ringer solüsyonuyla durulayın.
- Siniri uyarmak için bir emme elektrodu kullanın; Elektrodun yapımı, Kazakov ve diğerleri tarafından kağıdın ücretsiz indirilmesiyle mümkündür . , 2015 32 . Elektrot ucunu sinirin kesik ucuna yakın konuma getirin ve sinir güdüğü elektrot deliğine aspire edin.
- Hazırlama bölmesini mikroskop sahnesine monte edin. PlacSıcaklık probu ve haznedeki giriş ve çıkış ateşleri.
- Güç kablosunu Peltier elemanına bağlayın.
- Hazırlığı süper kaynaştırmak için basit bir yerçekimi tahrikli sistem kullanın. Fazla çözeltiyi çıkarmak için perfüzyon emme pompasını açın.
- Termo kontrol ünitesini açın.
- Sıcaklık kontrolünü 20 ° C'ye ayarlayın.
- Ultraviyole koruma koruyucusunu takın.
- Uyarıcı tel elektrotunu elektrik stimülatörüne bağlayın ve 4x objektif lens ile mikroskop altında kas kasılmalarını izleyin.
- Perfüzyon sistemini düşük Ca 2+ ve yüksek Mg 2+ içerikli Ringer çözeltisi ile doldurun.
NOT: Bu çözüm, kas kasılmalarını önlemek için kullanılır. Dış kalsiyum konsantrasyonundaki azalma ve dış magnezyumun yükselmesi, Ca2 + geçişlerinin amplitüdünde azalmaya neden olur. Bununla birlikte, önceki tecrübelere dayanarak, 0.9 mM CaCI 2 ve 6 mM MgCl 2 , Ca 2+ geçici değerlerinin amplitüdünü güvenilir şekilde çözmek için hala yeterlidir. Örneğin Ca 2+ konsantrasyonunu azaltmadan kas kasılmalarını azaltmanın başka yollarının var olduğunu belirtmek gerekir. Örneğin, d-tubokurarin veya alfa-bungarotoksin, nikotinik asetilkolin reseptörlerinin spesifik bloke edicileri, kas kasılmalarını tamamen veya kısmen bloke eder 17 , 27 , 28 , 30. Bununla birlikte, bu toksinlerin ilavesi presinaptik kalsiyum girişini de etkileyebilir 33 . Bunu önlemek için, μ-konotoksin GIIIA kullanılabilir 27 . - Pompayı açın ve düşük Ca 2+ ve yüksek Mg 2+ ile Ringer solüsyonuyla preparat süperfüzyonuna başlayın.
- Mikroskopta 40 × objektif merceğine geçin.
- Açma t O monokromatör ( Malzeme Tablosuna bakınız).
- Monokromatör kontrol yazılımında 488 nm'lik bir emisyon dalga boyu ve sürekli aydınlatma modu seçin.
- Floresan modunda yüksek büyütme altında, sinir terminallerine boya yüklendiğinden emin olun.
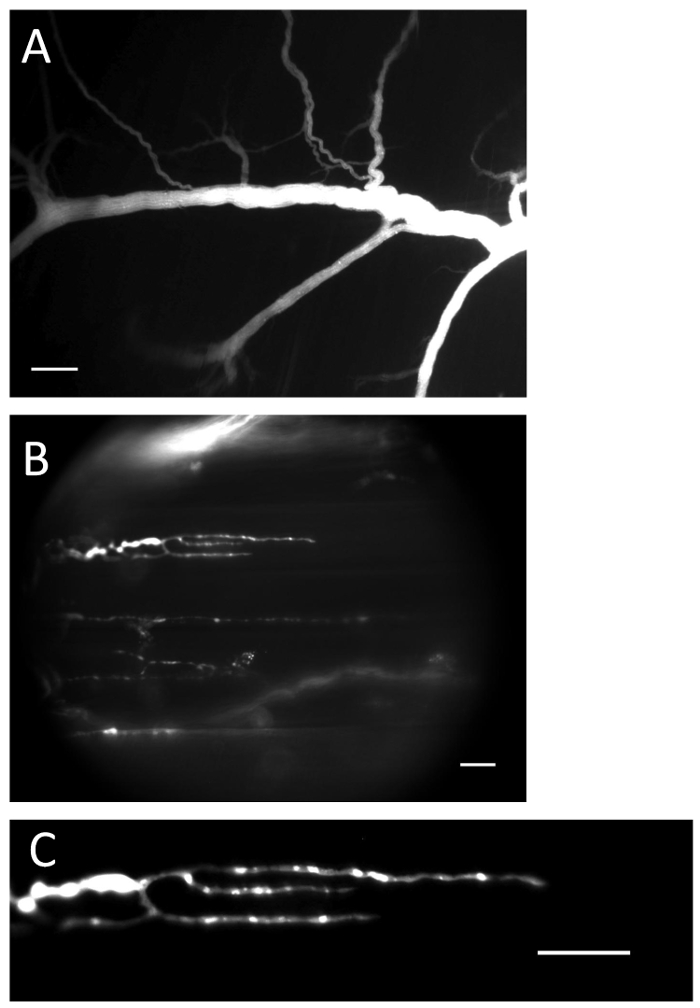
Şekil 1 : Ca 2+ göstergesi yüklü sinir ve terminaller. ( A ) Yükleme prosedüründen sonra Ca 2+ göstergesi ile dolu sinir. Ölçek çubuğu = 200 μm. ( B ) Ca 2+ göstergesi ile dolu sinir uçları. Ölçek çubuğu = 20 μm. ( C ) Ca 2+ -indikatör floresan, sinir bitiminde açıkça görülür. Ölçek çubuğu = 20 μm._blank "> Bu figürde daha büyük bir versiyonunu görmek için lütfen tıklayınız.
- Preparatın düşük Ca 2+ ve yüksek Mg 2+ solüsyonunda en az 30 dakika dengelenecek şekilde bırakın.
4. Dijital CCD Kamera ile Video Çekimi
Not: Flüoresan sinyallerini yakalama ayrıntıları her mikroskop ve kamera türü için özeldir, ancak en önemli husus görüntü yakalama hızıdır.
- NMJ'deki tek Ca 2+ geçici kayıtları için minimum yakalama frekansı olarak 1 kHz kullanın.
NOT: Hızlı dijital CCD kameralar floresan görüntüleme için gereklidir (Malzeme Tablosuna bakınız). Burada veri toplama sistemi ve yazılımı ( Malzeme Tablosuna bakınız) kamera, monokromatör ve uyarıcının senkronizasyonu için kullanıldı. Kısacası, bu protokol, verilerin dijital çıkışlarında senkronizasyon darbelerinin üretilmesine izin verirDeklanşörü açmak, video sinyalini yakalamak ve uyarımı başlatmak için görüntü toplama sistemi. Tüm geçici parametreler, protokollerde ve / veya cihazlarda ayarlanabilir. Tipik bir protokol, 1 kHz'de (80 x 80 piksel) elde edilen 500 çerçeve serisidir. Uyarma ışığı ile aydınlatma, Ca 2+ göstergesini beyazlatabilir ve hücre dokusunu fotodasajlayabilir. Bu nedenle, uyarma ışığına uzun süre maruz kalmaktan kaçının. Bu protokolde, deklanşör yalnızca videoyu çekmek için gereken süre boyunca açıktır. Belirli sinir terminali başına yirmi dizi elde edin. Buradaki amaç aynı bölgeleri kontrol grubunda ve ilaç dağıtımından sonra izlemektir. - Mikroskopun 4X nesnel objektifi altında kas ve sinir dallarını görselleştirmek için parlak alan rejimini kullanın.
- 40X nesnel objektife geçin ve epifloresan rejimi ve 488 nm'lik bir uyarılma dalga boyu kullanarak boya yüklü sinir uçları arayın. İlgi çeken bir sinir uçlu bölgeyi tanımlayın.
- Trinoküler tüp üzerindeF mikroskop, ışık yolu değişim seviyeleri seçin:% 100 kamera ışık.
- CCD kamera için satın alma yazılımını başlatın.
- "Canlı" modda ROI'yi bulun ve odağı ayarlayın.
- "Değiştir" menüsünü seçin.
- Saniyede 1.000 kare (fps), 80 x 80 çözünürlükte "Temel Yapılandırma" kullanın.
- Giriş karelerinin sayısını 500 olarak ayarlayın.
- Denemenin adını girin.
- "Harici Tetikleyici" yi seçin.
- Ön tetikleme süresini 10 ms olarak ayarlayın.
- Yineleme sayısını 20 olarak ayarlayın.
- Monokromatör kontrol yazılımında 488 nm'lik bir emisyon dalga boyu ve "harici tetik aydınlatma" modunu seçin.
- Veri toplama yazılımını çalıştırın.
- Uyarım protokolünü yükleyin.
- Videoyu kaydetmeden önce, video edinme yazılımını kullanarak karanlık çerçeveyi yakalayın.
- Uyarım protokolünü çalıştır.
- ROI ve chec'i seçinK kaydedilen sinyali.
5. Veri Analizi
NoOTE: Veri analizi için CCD kamera yazılımını ve ImageJ'yi kullanın; Veriler bir elektronik tablo programında eğri olarak gösterilir. CCD kamera yazılımında, ortalama 20 tekrarlar ve sonuçları bir ImageJ destek dosyasına aktarır. ImageJ'de ROI ve arka planı seçin. Arka planı YG'den çıkartın. Veriyi bir oran olarak gösterin: (ΔF / F 0 -1) x% 100, burada ΔF uyarılma esnasında flüoresansın yoğunluğudur ve F 0 istirahatte flüoresan yoğunluğudur.
- CCD kamera edinme yazılımında Dosya> Ortalama Dosyalar'ı tıklayın. Dosyaları seçin ve ortalamaları alın.
- "Fit dosyası olarak kaydet" i tıklayarak ortalama dosyayı bir .fit dosyası olarak kaydedin.
- ImageJ yazılımını çalıştırın. Aşağıdaki adımları uygulayın:
- Görüntü> ayarla> parlaklık / kontrast'ı tıklayın.
- Resim> yığınlar> araçlar>; Yığın sıralayıcı.
- Analiz> araçlar> ROI yöneticisi'ni tıklayın.
- Sürüklenen ve ortalama .fit dosyasını ImageJ penceresine bırakın.
- Daha iyi bir görüntü elde etmek için pencereyi yakınlaştırın.
- İmleci hareket ettirerek, son kareyi seçin ve silin (karanlık çerçeve budur)
- Arka plan olduğuna inanılan alan üzerinde dikdörtgen bir ROI seçin. ROI yöneticisine ekleyin
- Daha> Çok Ölçü'yi tıklayarak arka planı ölçün. MEAN'i not edin. Veriyi kopyalayın, bir elektronik tablo programına dışa aktarın ve bir oran için eşiğin ortalama değerini hesaplayın.
- İşlemi> Ana> Çıkar'ı tıklayarak eşiği yığınlardan çıkartın. Eşiğin ortalama değerini girin.
- Bir sinir terminalinin etrafında dikdörtgen bir ROI seçin. ROI yöneticisine ekleyin.
- Daha> Çok Ölçüm'ü tıklayarak ölçün. MEAN'i not edin. Kopyalayıp bir elektronik tablo programına dışa aktarın.
- Sinyallerin ofset ortalamasını.
NOT:Uyarılmadan baz renklendirme floresanını gösteren ilk birkaç düzine nokta; Dinlenme sırasındaki floresan budur. - Sinyalleri, dinlenme sırasındaki flüorüre göre bölün.
- "1" çıkarın ve% 100 çarpın.
- Sinyali çizin ve Ca 2+ geçici genlik hesaplayın.
Sonuçlar
Boya yükledikten ve motor sinir uyarımı üzerine, sinir terminallerinde floresan sinyalinin (Ca 2+ geçici) amplitüdünde bir artış tespit edilebilir (bkz. Şekil 2 ). Ca 2+ geçici parametreleri Tablo 1'de sunulmuştur. Nicel olarak, çalışmamızda ölçülen Ca 2+ geçici parametreleri, soğukkanlı hayvanların sinapslarındaki diğer bilim adamlarının elde ettiği verilere 15 , 34 yakındır. Ca 2+ geçici maddelerinin parametreleri, Ca 2+ ' nın boya ile bağlanma hızına ve ardından çözünme oranına bağlıdır. Sinir sonlanmasına, renkle etkileşime ve sitoplazmdaki difüzyona Ca 2+ girme oranı Ca 2+ geçiciinin yükselme zamanını etkiler. Floresan sinyalin bozulma süresi boya afınitesine,Hücre içi tamponlar ile Ca 2+ etkileşimi hızı ve iyon pompaları ile uzaklaştırılması 35 . Ca 2+ geçici maddelerin genlik analizi, çeşitli maddelerin nörotransmitter salınımına katılan kalsiyum girişi üzerindeki etkisini incelemek için kullanılabilir 33 .

Şekil 2 : Ortalama Ca 2+ Geçici NMJ kurbağasında ölçülür. Ca 2+ geçici, 13 kurbağa NMJ'sinin sinyal ortalamasına dayanarak hesaplandı. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
| ZirveΔF / F (%) | Yükseliş süresi% 20 -% 80 (ms) | Τ (ms) |
| 12,6 ± 1,1 (n = 13) | 4.6 ± 0.5 (n = 13) | 115.3 ± 8.3 (n = 13) |
Tablo 1: Ca 2+ geçici maddesinin ortalama parametreleri . Veriler ortalama ± SE olarak sunulmuştur; N farklı NMJ'lerdeki ölçümlerin sayısıdır. Zirve ΔF / F, ΔF / F'nin ortalama amplitüdidir.
Tartışmalar
Bu yazıda, sinir kütüğü aracılığıyla kurbağa sinir uçlarına Ca 2+ -duyarlı boya yükleme yöntemi uyguladık. Yükleme prosedürünün sonuna gelindiğinde, sinirin proksimal kısmındaki tüm terminallerin flüoresans düzeyleri belirgindir. Probun terminal içi konsantrasyonunun 40 ila 150 μM arasında değiştiği tahmin edilmektedir17.
Kuluçka prosedürü iki aşamada gerçekleştirilir: Oda sıcaklığında ve daha sonra bir buzdolabında daha düşük bir sıcaklıkta. Oda sıcaklığında boya ile doku inkübasyon süresini kontrol etmek önemlidir. Sinir güdükünün gerçek uzunluğuna, spesifik boyaya ve sıcaklığa bağlı olarak kuluçka süresi değişebilir. Aşırı maruz kaldıysa, proksimal kısımların sinir kütüğüne yakın terminalleri aşırı yüklenebilir. Bununla birlikte, sinirin orta kısmında tatmin edici yüklü terminaller bulmak hala mümkündür. Inci sırasındaBuzdolabında uzun süre inkübasyon yapılırsa, boya sinir uçlarına eşit olarak dağıtılır.
Kendi gözlemlerimiz 33 , 35 ve diğer araştırmacıların verileri 30 , yükleme prosedürünün postsinaptik yanıtın amplitüdünde veya minyatür son plak potansiyellerinin frekansı üzerinde kayda değer bir etkisinin bulunmadığını ispatlıyor. Yüklü müstahzarlarda iyi bir ömrü belgelenmiştir. Dikkat çekmek istediğimiz bazı önemli noktalar var. Boyanın kesik sinir aksonlarına girmesini sağlamak için eksizyon sonrası sinir kütüğünü boya yükleme çözeltisine yerleştirmek çok önemlidir; Gecikmeler muhtemelen sinir aksonlarının 27 , 36 nın tekrar kapanmasına bağlı olarak etkisiz yüklemeye neden olabilir. Bazı araştırmacılar, sinir güdükünü 100 mM EDTA (bir Ca 2+ - ve Mg 2+ -çelatör) Kesilen aksonların tekrar kapanmasını önlemek için sinirin çıkarılmasından hemen sonra. Tampon, 1-2 dakika sonra çıkarıldı ve bir boya yükleme çözeltisi 37 ile değiştirildi . Yükleme prosedürü için plastik hortum yerine bir petrol jeli kuyusu kullanılması daha kısa bir sinir kütüğü kullanımına izin verir. Bu yaklaşımı kullanırken sinir, boya ile HEPES çözeltisine daldırıldıktan sonra kesilir ve aksonlar boyar madde çözeltisinde iki değerlikli iyonların olmaması nedeniyle yeniden mühürlemezler 27,28.
Çalışmamızda, dekstran yerine Ca 2+ göstergesinin suda çözünen tuz formunu kullandık. Dekstran konjugatları aksonda tuz formlarından daha yavaş yayılır. Bununla birlikte, dekstran konjugatının kullanımı, boya bölümlendirmesini ve sinir ve NMJler tarafından taşınmasını azaltır. Kalsiyum yeşil 1-3.000 MW dekstran konjügatının iyi bir difüzyon hızı vardır ve azaltılmış bölümlendirmeyi gösterir Up class = "xref"> 38.
Dokunun uzun süre flüoresanla aydınlatılmasını önlemek çok önemlidir; çünkü bu durum, sağlığını ve sağkalımını etkiler. Sinir terminalleri aramak için görünür ışık kanalında Nomarski optik kullanıyoruz. Kayıt esnasında aydınlatılmış alanı bir diyafram ile sınırlıyoruz.
Dikkat çeken nokta, bu yükleme yönteminin yalnızca uzun inkübasyonlara dayanabilen preparatlara uygun olmasıdır. Daha kırılgan dokular üzerinde çalışmalar yapıldığında boya yükleme süresini azaltmak için ( örneğin, sıcakkanlı hayvanların sinapsları), sinir kütüğü uzunluğunu küçültmek ve 29 , 39 yüklemek için mikropipet kullanmak gereklidir.
Bu yükleme tekniği, hem tek sinir uyarımı hem de ritmik sinaptik aktivite altında flüoresan göstergeler ile sitosolik Ca 2+ görüntüleme değişiklikleri için çok uygundurEf "> 17 , 27 , 35 Ca 2+ -transient genlik analizi, nörotransmitter salınımına katılan kalsiyum girişi üzerindeki farklı maddelerin etkisini incelemek için kullanılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma, Rusya Hükümeti tarafından Kazan Federal Üniversitesi'nin Rekabetçi Büyüme Programı ve Rusya Temel Araştırma Vakfı tarafından yapıldı (16-04-01051; 16-34-00817; 15-04-02983). Makalenin daha önceki taslaklarında yararlı yorumlar sağlamaktan dört anonim gözden geçirene teşekkür ediyoruz. Ses kayıtları için Yuliya Aratskaya'ya şükranlarımızı sunarız. Victor Ilyin'e el yazmasının son düzenleme ile ilgili çok faydalı yorum ve yardım için minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
Referanslar
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır