Method Article
Elektrokonvülsif Terapi Sıçan Modelinde Hücre Sayılarını Tahmin Etmek İçin Optik Fraksiyonlama Tekniği
Bu Makalede
Özet
Burada, elektrokonvülsif uyarımı takiben sıçan hipokampusunda, yeni nöronların oluşumunu ve canlılığını ölçmek için kullanılan bir optik fraktatör olan stereolojik bir yöntemi sunuyoruz. Doğru şekilde uygulandığında, stereolojik yöntemlerin duyarlılığı ve verimliliği, sabit ve önceden belirlenmiş bir hassaslıkla doğru tahminler sağlar.
Özet
Sterolojik yöntemler, hücrelerin veya yapıların boyutu, şekli, yönelimi ve dağılımı hakkında kehanet parametrelerini tanımlamak için tasarlanmıştır. Bu yöntemler, hacimsel hücre popülasyonlarının elle sayılması çok yüksek olan memeli beyninin kantitatif analizi için devrim yarattı ve üç boyutlu niceliklerin tahminleri iki boyutlu ölçümlerle çıkarıldığında stereoloji şimdi tercih edilen tekniğe dönüştü bölümleri. Bütün stereolojik yöntemler prensipte yanlızdır; Ancak, ilgi yapısı ve doku özellikleri hakkında doğru bilgilere güvenirler. Stereoloji, duyarlılıkla ilgili olarak örneklemin en verimli seviyeye ayarlanarak, tüm yapının güvenilir, niceliksel bilgileri sağlayan Sistematik Tekbiçimli Rastgele Örneklemeye (SURS) dayanıyor. Burada BrdU immünohistokimyası ile birlikte optik fraksiyonatör sunmaktNöron oluşumunun en güçlü uyarıcıları arasında yer alan elektrokonvülsif uyarımı takiben, sıçan hipokampusunun granül hücre katmanında (alt granüler bölge de dahil olmak üzere) yeni oluşan nöronların üretimini ve hayatta kalmasını tahmin eder. Optik fraksiyonelatör tekniği, tam yapıdan örneklenen kalın kesitlerden toplam hücre sayısının tahminlerini sağlamak üzere tasarlanmıştır. Kalın bölümler, hücreleri tam 3B boyutlarında gözlemleme fırsatı sağlar ve böylece morfolojik kriterlere dayanan kolay ve sağlam hücre sınıflandırmasına izin verir. Doğru şekilde uygulandığında, optik fraksiyonelleştiricinin duyarlılığı ve verimliliği, sabit ve önceden belirlenmiş hassasiyetle doğru tahminler sağlar.
Giriş
Üç boyutlu (3 boyutlu) bir yapıdaki hücrelerin nicelendirilmesi, yansız ilkelere dayanan tahminlerin elde edilmesini gerektirebilir. Bugün bile çalışmalar üç boyutlu yapıların verilerini bildirmek için sıklıkla iki boyutlu (2-D) yöntemler kullanmaktadır. Bununla birlikte, bu yöntemler yapının heterojen niteliğini, hücrelerin şekli ve dağılımı açısından metodik sınırlamalara neden olarak düşünmemektedir; Ilgi konusu 3 boyutlu yapı hakkında varsayımlar yaparlar ve sonuçlar bütün yapıyı ifade etmez. Bu kısıtlamalar yöntemlerin hassasiyetini ve doğruluğunu azaltır ve aynı zamanda hatalar riskini artırır 1 .
Hücre sayımındaki önyargılar, belirli bir doku veya yapıdaki hücre sayısı hakkında niceliksel bilgi edinmek için genel olarak önem taşıyan tasarıma dayalı stereolojinin uygulanmasıyla önlenebilir. Stereoloji eskiden çok zaman alıcı bir yöntem olsa da, prosedürlerdeki ilerlemeler, yumuşakEşyalar ve görüntüleme, çok daha verimli ve yaygın bir hale getirdi. Stereoloji, istatistiksel örnekleme prensiplerini ve stokastik geometrik teoriyi, hacim, yüzey alanı, uzunluk ve 3 boyutlu yapıdaki nesnelerin sayısının tahmini için 2-B kesitlerde örnekleme yoluyla etkili araçlar sağlamayı gerektirir 2 . Böylece, stereoloji, doku kesitlerindeki yapısal değişikliklerle ilgili, yorucu bir analiz olmaksızın, gerçek sayıların ortalama tahminlerini veren tarafsız kantitatif verileri elde etmeyi sağlar 1 . Stereoloji, örneklenen bilgilerden geometrik parametrelerin istatistiksel çıkarımı olarak tanımlanır. Bu, tarafsız örnekleme, diğer bir deyişle tüm nesnelerin 3 sayılma olasılığının eşit olmasını sağlayan sayım kurallarının yanı sıra bölümlerin sistematik rasgele örneklemesi ile elde edilebilir. Stereolojik sonuçlar, hata katsayısı (CE) ile gösterilen hassaslık derecelerini değiştirebilirken, bu durum reklam olabilirGerekli örnekleme miktarını ayarlayarak, doğal biyolojik varyansa (varyans katsayısı (CV)) uymaya hak kazandı. 4 , 5 . Daha önceki birkaç stereolojik çalışmada kemirgenlerde hiperbolik plastisite üzerine elektrokonvülsif stimülasyon (ECS) 'nin kısa vadeli etkileri incelenmiş 6,7 . Bu çalışmalardan elde edilen veriler, tekrarlayan ECS'yi takiben sinaptik farklılaşmanın yanı sıra toplam nöron sayısında bir ilk artış olduğunu göstermektedir. Bununla birlikte, bu çalışmalar, hücre proliferasyonu için özel belirteçler kullanmadığı için nörojenezi doğrudan tahmin etmemektedir.
Burada, alt granüler bölge (SGZ) de dahil olmak üzere, sıçan hipokampal granül hücre tabakasında (GCL) yeni oluşan nöronların sayısının nicelleştirilmesi için optik fraksiyonator tekniği 8 , 9 olan stereolojik bir yöntemin bir uygulaması sunulmaktadır Onların uzun vadeli sUrvival 10 , 11 . Sıçanları, nörogenezis 12'nin en güçlü uyarıcılarından biri olan, ECS'nin klinikle ilişkili bir çizelgesine (haftada üç kez 3 hafta boyunca) tabi tuttuk. Kontrol hayvanları, aynı prosedür kullanılarak, ancak akım geçirmeden tedavi edildi. Deneyden 21 günün her birinde sıçanlara intraperitoneal olarak hücre bölünmesi sırasında timidin yerine DNA'ya karışan 5-bromo-2'-deoksiuridin (BrdU) enjekte edildi. Deneyden sonra, sıçanlara dört farklı zaman periyodunda (24 saat, 3 ay, 6 ay ve 12 ay) devam edildi. Kesirleme prensibini kullanarak, kesitlerin rastgele rastgele örneklenmesiyle hipokampüsün bilinen bir fraksiyonu elde edildi ve örneklenmiş ve immünostained kalın doku kesitlerine optik disektörler (3-D problar) uygulandı. Dondurulmuş bölümlerin genellikle işlem sırasında z eksende çöktüğü özellikle belirtilmektedirBu durumda, sayı ağırlıklı ortalama kesit kalınlığına dayalı optik disektörler kullanılmalıdır. 14 . Optik disektörlerin odak düzlemi, kesit boyunca bilinen bir mesafeye taşınırken, BrdU-pozitif nöronlar, ilgi konusu özelliklerinin açık bir şekilde fark edildiğinde sayıldı. Stereoloji alanında sayılması gereken toplam partikül sayısı hakkında bazı tartışmalar vardır; Uygun duyarlık elde etmek için, tipik olarak 150-200 nöron ilgi yapısında sayılır, yani % 7-8 katsayısı 8 . BrdU-pozitif nöronal sayımlar kamera ve aşağıdaki hedeflerle donatılmış standart bir mikroskop ile görüntüleme ile stereolojik yazılım kullanılarak tamamlandı: 2X, 4X ve 10X gibi 100X yağ daldırmalı objektif (numerik açıklık = 1.40) ve motorize bir aşama . Z-yönündeki hareketler bir dijital mikroçiratör ile ölçülmüştür. Nihai büyütme3000X oldu.
Protokol
Tüm hayvansal prosedürler, Danimarka Hayvan Deneme Müfettişliğinin kılavuzlarına uygun olarak ve Deney Hayvanları için yerel etik komitesince onaylanmış şekilde gerçekleştirildi.
1. Doku işleme
NOT: 4 ° C'de 0.2 M fosfat tamponu ile gece boyunca seyreltilmiş% 4 paraformaldehid (PFA) 'da transkardiyal perfüzyon ve fiksasyon sonrasında, beyinler fosfat tamponlu tuzlu suda (PBS)% 30 sakroza 4 ° C'de üç gün aktarılır. Bundan sonra, beyinleri toz kuru buz üzerinde donar ve kesitlendirilene kadar -80 ° C'de saklanır.
- Sağ ve sol hemisferleri bir bisturi kullanarak beynin orta hat boyunca ayırın ve daha sonra ilk beyinde rasgele bir veya diğer yarımküreyi seçin, bundan sonra sağ ve sol hemisfer arasında sistematik bir şekilde yer değiştirin ( Şekil 1A ). Örneklenen yarı küreyi, uzun ekseni diske dik olacak şekilde bir numune disk üzerine monte edinBir montaj aracı kullanarak.
- Kriyostatın ön soğutması için numaralı çok kaplı kaplar yerleştirin.
- Örnek diskini kriyostatın içine monte edin ve koronal planda ( Şekil 1B ) 80 μm kalınlığa sahip bölümlere hipokampusun tamamını (Bregma 1.80 - 7.04 16 ) kesin.
- Bölümlerin kesme sırası altında tutulmasını sağlamak için numunelenmiş tüm parçaları soğutmalı çok dişli kaplara ard aralıklarla yerleştirin.
- Bölümleri kriyoprotektanla tamamen örtün ve kapları daha ileri düzeyde kullanıma kadar -20 ° C'de tutun.
2. Bağışıklama
NOT: Boyama prosedürü boyunca tek tek bölümleri takip etmek için numunelenmiş bölümleri 25-iyi boyanmış ağlara yerleştirin. Her beşinci bölüme uygulayın, bağışıklık boyama ve daha sonra hücre sayımı için hipokampus başına ortalama 12 (8-16) kesit numarası verin.
- Bölüm 1 ile bölüm n arasında rasgele başlatma ( Şekil 1C ) ile her n inci bölüm alt örneklemeden önce kapları -20 ° C'den oda sıcaklığına (RT) aktarın.
- Numaralardaki bölümleri, PBS ile dolu petri kaplarına yerleştirilen 25-iyi boyama ağlarına aktarmak için örneğin bir fırça kullanın.
NOT: Bu noktadan itibaren, yörünge çubuklu bir çalkalayıcıya yerleştirilen eşleşen cam tabakalara yerleştirilen boyama ağlarındaki bölümleri saklayın (bölüm 2.3 ila 2.9). - Boyama ağları eşleşen cam yemekleri transfer ve 20 dakika boyunca damıtılmış suda (dH 2 O) seyreltilmiş% 3 hidrojen peroksit (H 2 O 2 ) inkübasyondan önce oda sıcaklığında PBS'de 10 dakika boyunca iki kez yıkayın.
- Bölümleri, 0.1 M sodyum tetraborat içinde nötralizasyondan önce üç farklı hidroklorik asit solüsyonuna (HC1) (1 dakika boyunca 0 ° C'de 10 dakika, RT'de 2 dakika süre ile 10 dakika ve 2 dakika boyunca 37 ° C'de 20 dakika) aktarın. birT RT 20 dakika boyunca.
- PBS (yıkama tamponu) içinde seyreltilmiş% 1 Triton X-100 içinde 3 × 10 dakika inkübasyondan sonra, bölümleri oda sıcaklığında 1 saat süreyle% 10 fetal sığır serumu içeren yıkama tamponuna (engelleme çözeltisi) aktarın.
- Kesitleri, fare anti-BrdU seyreltilmiş 1: 100 engelleme çözeltisi içinde 4 ° C'de 48 saat inkübe edin.
- Parçaları yıkama tamponunda 3 x 10 dakika yıkayın ve yıkama tamponunda 1:10 oranında seyreltilmiş at turp peroksidazında 48 saat inkübe edin.
- PBS'de PBS'ye 5 × 10 dakika boyunca aktarın ve sonra oda sıcaklığında 10 dakika boyunca% 0.02 H202 içeren benzer bir DAB solüsyonuna transfer edilmeden önce PBS içinde seyreltilmiş% 0.01 diaminobenzidin (DAB) içinde 7 dakika boyunca aktarın.
- Yıkama serisini tamamlayın (PBS içinde 2 × 10 dakika ve sodyum klorür eklenmeden fosfat tamponunda 2 × 10 dakika) tamamlayın ve mikroskop lamlarına sayısal sırada bölümleri monte edin.
- Kesitleri yaklaşık 30 dakika boyunca krezil ile lekelerek kurutunmenekşe.
- Mikroskop lamlarını bir slayt rafa yerleştirin.
- Bölümleri dH 2 O içeren slayt boyama yemekleri 10 dakika rehidrate ve daha sonra slaytlar dH 2 O 0,02% kreyl violet 15 dakika boyunca aktarın.
- Bölümler, etanol içerisinde üç kez dehidre edilmeden önce adım 2.12'yi tekrarlayın (5 dakika için% 96 ve 2 dakika boyunca% 99).
- Kesitleri 2 x 15 dakika boyunca ksilen içine yerleştirin ve montaj için hızlı bir kurutma ortamı kullanarak sürgüleri kaydırın.
- Son olarak, mikroskopi için kullanılmadan önce kapaklı kaydırakları yaklaşık 24 saat bırakın.
3. Optik fraktör kullanarak BrdU etiketli nöronların toplam sayısının tahmini
NOT: Analiz edilecek bölüm sayısı ve örneklenen bölümler içindeki optik disektör sayısı gibi optimum örnekleme parametrelerini belirlemek için birkaç hayvan içeren bir pilot çalışma yapın. Bu pilot ayrıca,Araştırmacı tarafından belirlenen tahminlerin tatmin edici bir kesinliğini elde etmek için ön CV (standart sapma / ortalama) ve CE'yi ayarlama imkanı (bkz. Bölüm 3.9.3). Aynı şekilde, aşağıdaki noktalara değinmek için bir z-dağılım analizi yapın: dokunun büzülmesi, bölüm boyunca lekelenme kalitesi ve hücrelerin z ekseni dağılımı 14 .
- Kesitlerdeki dokunun kalınlığını kontrol ederek optik fraktatörün kullanımına uygun olduklarını doğrulayın; örneğin koruyucu bölgeler dahil olmak üzere seçilen disektör yüksekliği için yeterince kalın (aşağıya bakın). NOT: Doku kalınlığı, ilgi bölgesi içindeki çeşitli yerlerde alınan önlemlerdir.
- Slaytları mikroskopun motorlu aşamasına yerleştirin ve tercih edilen stereolojik yazılımı açın.
- 100X yağ imm'e geçmeden önce düşük büyütmeli bir objektifle (2X veya 4X) ilgi alanını tanımlayınErsion hedefi (bakınız Şekil 2A ).
- Bir sayım çerçevesinin belirli bir noktasını kullanarak ( örneğin bir köşeye veya bitişik köşeye), kesitin bir bölümünde odak noktasında görünene kadar odak düzlemi boyunca ilerleyerek bölümün üst kısmını bulun. Bu z-pozisyonunu 0 olarak kaydedin (bakınız Şekil 2B ).
- Sayma çerçevesinin aynı spesifik noktası, odaklanan dokunun son z seviyesinde olana kadar odak düzlemini doku boyunca aşağıya hareket ettirin ve bu konumu işaretleyin. Lokal doku kalınlığı 0 dan bu son noktaya kadar tanımlanır ve z ekseni üzerinde okunabilir. Doku kalınlığını kaydedin (bkz. Şekil 2B ).
- Lekenin tam penetrasyonunu ve hücrelerin bölümün tam kalınlığına dağılımını belgeleyin.
NOT: BrdU etiketli nöronların dağılımı, gerekli koruma bölgelerinin belirlenmesinde rehber olarak kullanılır. Hücrelerin tek biçimli dağılımı kritik olmakla birlikteKayıp kapakların etkisini gösteren kesitin üst ve alt kısmına daha az hücre gözlemlemek kabul edilebilir (daha ayrıntılı bilgi için bkz. Dorf-Petersen ve ark., 2009).- BrdU etiketli nöronları örnekleyin ve her bir sayım çerçevesinin seçilen köşesinde ölçülen yerel kesit kalınlığı ile birlikte z konumlarını kaydedin.
- BrdU-pozitif nöronların sayısını, z-konumlarının bir fonksiyonu olarak çizin.
- Ortalama bölüm kalınlığı ve hücrelerin dağılımı temel alınarak disektörün ve koruma bölgelerinin yüksekliğini düzeltin (bkz. 3.1 ve 3.2).
NOT: Yüzeye yakın eserlerden kaçınmak için disektörün yüksekliği bölüm kalınlığından daha az olmalıdır. Bu risk, bölümün üst ve altına koruma bölgeleri dahil ederek engellenmektedir. - Hücre arasındaki basamak uzunluğunu belirleyin.
- Analiz edilecek tüm bölümlerde ilgi alanını tanımlayın ve alanları kaydedin.
- Bu alanları toplam ve sonra b'yi böl.Bu alana yerleştirilecek olan hekim sayısını.
NOT: Önceki deneyimlere dayanarak iyi bir başlangıç noktası 75 prob gerektirir. Bu, bölgenin ve ilgili örnekleme pozisyonlarının bir yaklaşıkımını sağlayacaktır (A adım ) (daha ayrıntılı bilgi için bkz. West, 2012). - X adımını sağlayacak bir adımın karekökünü alın.
- Sayma çerçevesinin boyutunu belirleyin.
- Sayma çerçevesinin boyutunu keyfi bir birime ayarlayın ve Bölüm 3.3 ve 3.4'te elde edilen parametreleri kullanarak BrdU-pozitif nöronların pilot örneklemesini yapın.
NOT: Boyut ampirik olarak deneme yanılma ile belirlenmelidir, ancak disektör başına 2-3 hücre örneklemesi yapılabilmesi için ayarlanması önerilir 8 .
- Sayma çerçevesinin boyutunu keyfi bir birime ayarlayın ve Bölüm 3.3 ve 3.4'te elde edilen parametreleri kullanarak BrdU-pozitif nöronların pilot örneklemesini yapın.
- Pilot çalışmanın bu son adımının ardından hücre örneklemeye başlanır.
NOT: Elde edilen örnekleme parametreleri, yaklaşık 150-200 hücreye iHer bir hayvan verimli bir stereolojik tasarım elde etmeye yeterlidir 8 . - BrdU-pozitif nöronları, 100 × yağ daldırmalı objektif ve 2000-3000 × nihai büyütme oranı ile sayın. Her optik disektörde, ilgi konusu özellik (bu çalışmada, kriter BrdU etiketli nöronun ön kenarı ilk kez odaklaştığında olduğu zaman) tarafından açıkça tanınan BrdU etiketli nöronları tanımlar, yer alırlar Sayma çerçevesinin içinde veya ekleme çizgilerine dokunun ( Şekil 2B ). BrdU pozitif nöronları, disektör yüksekliğindeki ilgi unsuru tarafından açıkça fark edildiğinde, hariç tutma çizgilerine dokunan sayılmaz. Bu sayma kurallarının bütün stereolojik kantifikasyon boyunca titizlikle uyulması kritik öneme sahiptir.
NOT: BrdU tüm bölünen hücrelere dahil olduğu için morfoloji, nöronları ve diğer hücre tiplerini ayırt etmek için kullanılır. NeuRon özellikleri, nötr bir sitoplazma ve koyu renkli bir nucleolus ile açıkça tanımlanmış bir çekirdektir. BrdU-pozitif hücreler, glial hücrelere kıyasla nispeten daha büyük boyutlara dayanan yeni oluşan nöronlar olarak tanınırlar. Kısa vadeli proliferasyon çalışmalarında (örneğin <24 saat) olgunlaşmamış nöronal belirteçleri kullanarak çift boyamanın ön koşul olabileceğini belirtmek gerekir 17 . - Sayılan toplam hücre sayısını (Σ Q - ) çarpılarak, her beyindeki BrdU-pozitif nöronların toplam sayısını, karşılık gelen örnekleme fraksiyonlarıyla tahmin edin:

için
nerede Q- , sayı ağırlıklı ortalama kesit kalınlığı, h , disektörün yüksekliği, asf , alan örnekleme fraksiyonu, ssf , kesitin sKesir çarpanı ve t i , i. Sayma çerçevesindeki bölüm kalınlığı olup, hücre sayısı
Q- , sayı ağırlıklı ortalama kesit kalınlığı, h , disektörün yüksekliği, asf , alan örnekleme fraksiyonu, ssf , kesitin sKesir çarpanı ve t i , i. Sayma çerçevesindeki bölüm kalınlığı olup, hücre sayısı  Diskteki 14 , 18 .
Diskteki 14 , 18 . - Sistematik tekbiçimli rassal örneklemede (SURS) BrdU-pozitif nöronların örnekleme varyansı olan hata katsayısını (CE) hesaplayın.
- İlk olarak, sayılan BrdU-pozitif nöronların toplam sayısına eşit olan gürültüyü hesaplayın:

- Sonra, SURS'deki varyansı hesaplayın:
NOT: Hipokampustaki alan ve hücre sayıları, kesitten kesime düzgün şekilde geçmesi için yargılar ve sonuç olarak "pürüzsüzlük sınıfı" m = 1 (1/240) 8 , 19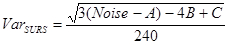
nerede
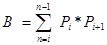

P i , i inci bölgede nesne için sayılan puanların sayısıdır ve n, bölüm 4 , 20'nin sayısıdır. - Son olarak, tahminin CE'sini hesaplayın:
NOT: Genel olarak optimal doğruluk, OC değeri gözlemlenen CV'nin yarısından az olduğunda OCV 2 = ICV 2 + CE 2 olarak bulunur , burada OCV gözlemlenen CV'dir ve ICV özünde bulunan CV 4'tür .
- İlk olarak, sayılan BrdU-pozitif nöronların toplam sayısına eşit olan gürültüyü hesaplayın:
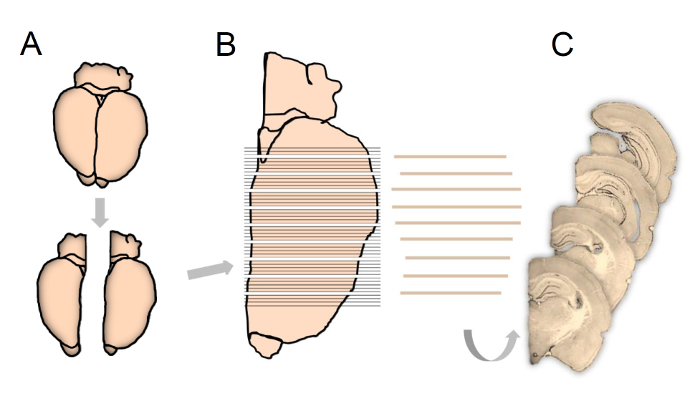
FŞekil 1: Bu çalışmada kullanılan fraksiyonator prensiplerine göre doku işlemeyi gösteren şematik gösterim.
Deneyden sonra hemisferler ayrılır ve sağ veya sol hemisfer sistematik ve rasgele seçilir (A). Tüm hipokampustan uzanan tam beyin 80 um kalınlıkta koronal kesitlere (B) kesilir, bunun üzerine her 5 bölüm son örnekleme ve stereolojik nicelik (C) için bölüm 1 ile 5 arasında rasgele başlayarak alt örneklenir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 2: Optik disektörleri kullanarak stereolojik örnekleme prosedürünü gösteren illüstrasyon.
(A) Histolojik işleme tabi tutulduktan sonra hIppocampal GCL / SGZ, bölgeye düzgün ve rastgele uygulanan çizik ve optik disektörlerdir. (B) Optik disektörlerde (solda), BrdU pozitif nöronları, yalnızca ilgi konusu özelliklerin disektör yüksekliği içinde açıkça tanınması ve sayım çerçevesinin içinde bulunduğu veya kapsama çizgisine (sağ) dokunması durumunda sayılmıştır. Hariç tutma çizgisine dokunan nöronlar sayılmadı. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Sonuçlar
Örnekleme parametreleri
Bir pilot çalışmada z-dağılımını analiz ederek ( Şekil 3 ), disektör yüksekliğinde BrdU-pozitif nöronların tek biçimli bir dağılımı bulduk. Kesitlerin büzülmesi ölçülmüştür; Başlangıçtaki ortalama kalınlık orijinal olarak 80 μm'de kesilen kesitlerdeki 26.4 μm (19.0-32.0 μm) idi. BrdU etiketli nöronların doku kalınlığı ve dağılımı temel alınarak, disektör yüksekliği 10 μm olarak ayarlandı ve kesitin üstündeki ve altındaki koruma bölgeleri sırasıyla 5 μm ve 4-17 μm olarak ayarlandı. Hücrelerin yoğunluğuna bağlı olarak, sayım çerçevelerinin alanı 1414 veya 5210 μm2 idi. Adım uzunluğu hem x hem de y yönlerinde 220 um idi ve hücre sayımı, hayvan başına ortalama 12 (dağılım 8-16) kesit uygulanmıştır. Bu örnekleme parametreleri ortalama 133 (dağılım 33-372) BrdUPozitif hücreler, her beyin yarıküresindeki 173 (107-204) hekime dahil edildi.
Örnek olarak, ECS ile tedavi edilen sıçanlarda BrdU-pozitif nöronal tahminler için aşağıdaki CV ve CE değerlerini elde ettik: 24 saat: CV = 0.59, CE = 0.11; 3 ay: CV = 0.34, CE = 0.12; 6 ay: CV = 0.43, CE = 0.09; 12 ay: CV = 0.22, CE = 0.09.
Bir BrdU boyama tekniği 10 , 11 ile birlikte optik fraktatörü kullanarak, ECS'yi takiben sıçan hipokampusunda yeni oluşan nöronların toplam sayısını ve uzun süreli sağkalımlarını niceleydik. Nihai sonuçlar, kontrol gruplarının dört grubunda bazal bir nevrojenez gösterdi; bu, hayatta kalma süresinin bir fonksiyonu olarak önemli ölçüde farklı değildi ( Şekil 3 ). Dahası, ECS, BrdU-pozitif nöronların toplam sayısının 24Deneyleri takiben, kontrol hayvanlarına kıyasla, saatler (% 259, p <0.0001), 3 (% 229, p <0.001), 6 (% 152, p <0.05) ve 12 ay (% 162, p <0.05).
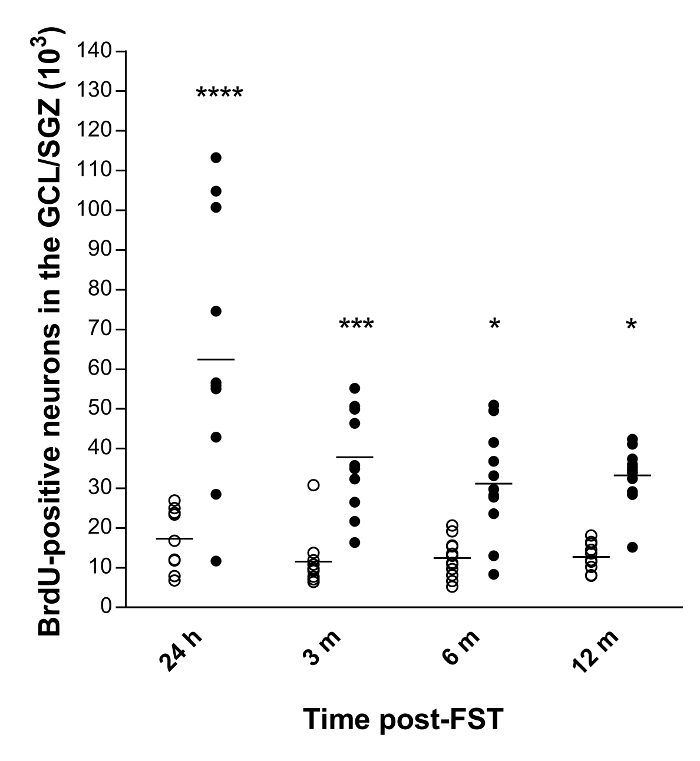
Şekil 3: Sıçan hipokampusunun GCL / SGZ'sindeki BrdU-pozitif nöronların toplam sayısının niceliksel verileri 10 , 11 .
Yatay çubuklar ortalama değerleri temsil eder. Kısaltmalar: GCL, granül hücre tabakası; SGZ, alt granüler bölge; Saat, saat; M, ay. **** p <0.0001, *** p <0.001 ve * p <0.05 kontrolle karşılaştırıldığında (grup başına n = 11-12). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Tartışmalar
Nörojenezi indüklemek için bir metodoloji olarak ECS'yi kullanarak, hipokampusta yeni BrdU-pozitif nöronların oluşumunda% 260'luk bir artışa rastlıyoruz. Akut olarak üretilen nöronların bu havuzunda, yeni oluşturulmuş nöronların yaklaşık% 50'si tedaviyi takiben en az 12 ay hayatta kalan, 1 ila 3 ay arasında% 40 oranında yıpranma tespit ettik. BrdU etiketli nöronların sayımı sıkı bir örnekleme planı izledi; böylece tüm hipokampüs 80 um kalınlıktaki kesitlere bölündü ve bunu her beşinci bölümün altınal örneklemesi, bölüm 1 ile bölüm beş arasında rasgele örnekleme başlattı. Bu kesitlerin sistematik bir şekilde rastgele seçilmesi şartıyla, ayrıntılı sonuç vermeden 1 nihai sonucun varyansını azaltmak için mükemmel bir yöntem olduğu açıktır. Bu örnekleme şeması, BrdU-pozitif nöronları ortalama 12 (8-16) hipokampüs içinde saymamızı sağladı.Her bir sıçan beynindeki kesitler,% 9-11'lik kesin hassasiyetle.
Fraksiyonator yöntemini kullanırken, histolojik işleme sırasında sıklıkla doku küçülmesi ve deformasyonu oluştuğundan, saymanın gerçekleştirildiği kesit yüksekliğinin kesimini bilmek önemlidir. Gerçekten de, bu çalışmada kalınlık önemli ölçüde azalma gördük. Ayrıca, Dorph-Petersen ve ark.'nda da belirtildiği gibi, farklı doku küçülmesi oluşabileceği unutulmamalıdır. Ancak, ilgilenilen bütün yapı analiz için mevcut olduğu sürece, bu kısıtlamalar, BrdU-pozitif nöronlar gibi partiküllerin toplam sayısına bir önyargı ile sonuçlanmaz. Doku çekmesinin belirli bir konudaki çalışmalarda, sonuçların deforme olmuş dokuda elde edildiği daima belirtilmelidir. Bu çalışmada, 10 μm'lik bir disektör yüksekliğinde sayılmıştır. Bu çalışmanın bölümleri nihai ortalama kalınlığı 26 μm, 5 μm'likKoruma bölgesi ve bölümün tabanında 11 μm'lik (ortalama) koruma bölgesi. Koruyucu bölgeler örneklenen parçacıkların yaklaşık çapı olması gerektiği için bu parametreler kabul edilebilir.
GCL / SGZ'nin tasvirini takiben, disektörler belirgin bir şekilde rasgele çizili alana yerleştirildi. Hâlbazlar, araştırmacı tarafından belirlenen kesinlikli tahminleri verimli bir şekilde elde etmek için örneklemeyi ve saymayı optimize eden sabit bir adım uzunluğunda yerleştirilmelidir. Optimal hassasiyet, tipik olarak, her bir yapıda 150-200 hücreye kadar sayım yaparak elde edilir 5 . Bu çalışmada, her sıçan hipokampusunda ortalama 133 (dağılım 33-372) BrdU-pozitif nöron saydık. Kontrol hayvanlarının bazılarında düşük hücre sayıları nedeniyle, BrdU-pozitif nöronların sayımları uygun hassasiyet elde etmek için gerekli genel kabul edilebilir hücre sayısının altına düştü ve bu durumlar için nispeten yüksek CE değerleri elde edildi. 'HBununla birlikte, CV değerlerinin yarısından azında CE değerleri elde ettiğimiz için (örnek sonuç bölümüne bakınız) ilave numune alma ve sayma gerekli değildi. Yüksek CV değerleri, gözlemlenen varyasyona en büyük katkıyı yapan kişinin biyolojik çeşitlemeden kaynaklandığını göstermektedir. Gerçekten de, bu çalışmada sayılan BrdU pozitif nöronların ortalama sayısının gerekli olandan fazla olduğunu iddia edebiliriz. Örneğin, bir grup sıçanda,% 9'luk bir CE değeri elde ettik ve% 43'lük bir CV değeri gördük. Bu özel durumda, yaklaşık% 20'lik bir kesinlik hedefleyebilirdik. Özetle, bu çalışmadaki BrdU-pozitif nöronların toplam sayısının hassasiyeti, parçacıkların gerçek sayısı üzerinde gerçek tedavi etkileri yakalaması açısından yeterlidir. Bazı hayvan gruplarında oldukça büyük biyolojik çeşitlilik nedeniyle, aynı tahminler daha az harcama yapılmasına rağmen kabul edilebilir bir hassasiyetle elde edilebilirdi. Gruplar içindeki yüksek biyolojik varyasyonlar yalnızcaHayvan sayısını arttırarak telafi edilmelidir.
Kişi, tam hücre sayılarını elde etmek için altın standardın, ilgilenen tüm nesnelerin kapsamlı sayılmasını gerektirdiğini iddia edebilir. Bununla birlikte, beynin çoğunda yapılan çalışmalarda, bu çok sayıda hücre yüzünden bir olasılık değildir. Kapsamlı hücre sayımından çok daha verimli olmakla birlikte, opsiyonel fraksiyonatör, doğru sayıda hücre gerekli olmadığında tercih edilen hücre sayılarındaki farklılıkların basitçe taranmasına nispeten zaman alıcıdır. Deneyimlerimiz,% 20-30'un üzerinde farklılıkların yalnızca tarama prosedürleri ile tespit edilebileceğidir.
Doğru gerçekleştirilirse, tasarıma dayalı stereolojiyi kullanarak örnekleme, tarafsız ve kesin tahminleri verimli bir şekilde sağlar 1 . Stereolojinin tarafsız özelliği, tekrarlandığında gerçek nüfus ortalamasını yaklaşık olarak tahmin eden ve bunun tekrarlanabilirliğini artıran tahminler üretir.Tahmin 21 . Başlangıçta, tüm yapıların (bu çalışmada hipokampal GCL / SGZ) temsili bir örnek alınmalı ve istatistiksel olarak geçerli olan 4. bölümlerin alt kümelerindeki tahminler yapılmalıdır. Uygun sayıda bölüm elde etmek ve sondaları saymak için, tesadüfi örnekleme 8'e kıyasla varyansı azaltan SURS uyguluyoruz. Ayrıca, SURS yapısı içindeki ilgi konusu parçacıkların yapıdaki boyutlarından, şeklinden, oryantasyonundan ve dağılımından bağımsız olarak aynı olasılıklarla örneklenmesini sağlar. Kesin ve tarafsız tahminler elde etmek için bu tür bir stereoloji önerilirse, projenin merkezi bir yönüdür.
Açıklamalar
Yazarların rekabette finansal çıkarları yoktur.
Teşekkürler
Susanne Sørensen'e yetenekli teknik yardım için teşekkür ederiz. Bu çalışma Velux Vakfı tarafından sağlanan hibelerle desteklendi; Jascha Vakfı; Aase ve Ejnar Danielsens Vakfı; Hartmann Brothers Vakfı; Yönetmen Jacob Madsen ve eşi Olga Madsens Vakfı; Doktor Sofus Carl Emil Friis ve eşi Doris Friis'in Güveni; 1870 Vakfı; Torben ve Alice Frimodts Vakfı ve Nörolojik Araştırma Vakfı. El yazması düzenleme Inglewood Biyomedikal Düzenlemesi tarafından yapıldı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 5'-bromo-2'deoxyuridine - BrdU | Sigma-Aldrich | 19-160 | |
| Cresyl Violet | Sigma-Aldrich | C5042 | Contains the following materials for 1 L: 0.2 g cresyl violet; 2.0 g sodiumacetate, 3 H2O; 3 ml glacial acetic acid; 1000 ml destilled water |
| Cryoprotectant | Capital Region Pharmacy, DK | 861334 | Contains the following materials: Sucrose; polyvinylpyrrolidon PVP 40; sodiumphosphatebuffer (0.2 M); ethylenglycol; demineralized water. |
| dH2O | Capital Region Pharmacy, DK | 817205 | |
| Diaminobenzidine – DAB | Sigma-Aldrich | D5637 | |
| Envision-HRP | DAKO | K4001 | Peroxidase labeled polymer conjugated to goat anti-mouse immunoglobulins |
| Ethanol - 70 % | Plum A/S | 201098 | |
| Ethanol - 96 % | Plum A/S | 201104 | |
| Ethanol - 99.9 % | Plum A/S | 201111 | |
| Fetal Bovine Serum | In Vitro | BI-04-003-1A | |
| H2O2 30% | Capital Region Pharmacy, DK | 896456 | |
| HCl | J. T. Baker | 6081 | |
| Mounting medium | Sakura | 4583 | Tissue Tek |
| Mouse-anti-BrdU | Becton-Dickinson | 347580 | |
| PBS buffer | Capital Region Pharmacy, DK | 853436 | pH = 7.4 |
| PFA | VWR | 28,794,295 | pH = 7.4 |
| Phosphate buffer | Capital Region Pharmacy, DK | 866533 | 0.1 mol/l, pH 7.4 |
| Rapid drying mounting medium | Histolab Products AB | 801 | Pertex |
| Sodium Tetraborate | Merck A/S | 1,063,080,500 | |
| Sucrose | Merck A/S | 1,076,515,000 | |
| Triton X-100 | Merck A/S | 1,086,031,000 | |
| Xylene | VWR | 28,973,363 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Cover slips | Menzel-Gläser | 24x50 mm #0 | |
| Cryostat | Leica | CM1860 | |
| Digital Microcator | Heidenhain | VRZ 401 | |
| Glass dishes | Brain Resaerch Laboratories | 1256 | |
| Microscope | Nikon | Eclipse 80i | |
| Microscope camera | Olympus | DP72 | |
| Microscope slides | VWR | 48311-703 | SuperFrost+ |
| Motorized stage | Prior | H101A | |
| Multidish Containers | Sigma-Aldrich | D6315-1CS | Nuclon 12-wells |
| New-Cast software | Visiopharm | ver. 4.5.6.440 | |
| Objective 2x | Nikon | CFI Plan UW 2X | |
| Objective 4x | Nikon | CFI Plan Fluor 4X | |
| Objective 10x | Nikon | CFI Plan Fluor 10X | |
| Objective 100x oil immersion | Nikon | CFI Plan Apo Lambda DM 100X Oil | Numerical aperture 1.40 |
| Orbital shaker | Gemini BV | CM-9 | Sarstedt |
| Slide rack | Sakura | 4465 | |
| Slide staining dishes | Sakura | 4457 | Tissue-Tek |
| Specimen disc | Leica | 14037008637 | |
| Staining nets | Brain Research Laboratories | 2512 | 25-wells |
Referanslar
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: Introduction to basic concepts and practical approaches for estimation of cell number. Toxicol. Pathol. 38 (7), 1011-1025 (2010).
- West, M. J. Introduction to stereology. 2012 (8), Cold Spring Harb. Protoc. 843-851 (2012).
- West, M. J. Stereological methods for estimating the total number of neurons and synapses: issues of precision and bias. Trends Neurosci. 22 (2), 51-61 (1999).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. J. Microsc. 147 (Pt 3), 229-263 (1987).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in the subdivisions of the rat hippocampus using the optical fractionator. Anat. Rec. 231 (4), 482-497 (1991).
- Kaae, S. S., Chen, F., Wegener, G., Madsen, T. M., Nyengaard, J. R. Quantitative hippocampal structural changes following electroconvulsive seizure treatment in a rat model of depression. Synapse. 66 (8), 667-676 (2012).
- Chen, F., Madsen, T. M., Wegener, G., Nyengaard, J. R. Repeated electroconvulsive seizures increase the total number of synapses in adult male rat hippocampus. Eur Neuropsychopharmacol. 19 (5), 329-338 (2009).
- Gundersen, H. J., Jensen, E. B. V., Kiëu, K., Nielsen, J. The efficiency of systematic sampling in stereology - reconsidered. J.Microsc. 193 (3), 199-211 (1999).
- West, M. J. Design based stereological methods for estimating the total number of objects in histological material. Folia Morphol.(Warsz). 60 (1), 11-19 (2001).
- Olesen, M. V., Wörtwein, G., Pakkenberg, B. Electroconvulsive stimulation, but not chronic restraint stress, causes structural alterations in adult rat hippocampus - a stereological study. Hippocampus. 25 (1), 72-80 (2015).
- Olesen, M. V., Wortwein, G., Folke, J., Pakkenberg, B. Electroconvulsive stimulation results in long-term survival of newly generated hippocampal neurons in rats. Hippocampus. 27 (1), 52-60 (2017).
- Madsen, T. M., et al. Increased neurogenesis in a model of electroconvulsive therapy. Biol Psychiat. 47 (12), 1043-1049 (2000).
- Cameron, H. A., Mckay, R. D. G. Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus. J.Comp. Neurol. 435 (4), 406-417 (2001).
- Dorph-Petersen, K. A., Nyengaard, J. R., Gundersen, H. J. G. Tissue shrinkage and unbiased stereological estimation of particle number and size. J.Microsc. 204 (3), 232-246 (2001).
- Schmitz, C., Hof, P. R. Recommendations for straightforward and rigorous methods of counting neurons based on a computer simulation approach. J Chem. Neuroanat. 20 (1), 93-114 (2000).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , 2nd edn, Academic Press. Sydney. (1986).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. 130 (2), 391-399 (2003).
- Fabricius, K., Wortwein, G., Pakkenberg, B. The impact of maternal separation on adult mouse behaviour and on the total neuron number in the mouse hippocampus. Brain Struct. Funct. 212 (5), 403-416 (2008).
- Dorph-Petersen, K. A., et al. Volume and neuron number of the lateral geniculate nucleus in schizophrenia and mood disorders. Acta neuropathologica. 117 (4), 369-384 (2009).
- Eriksen, N., et al. Application of stereological estimates in patients with severe head injuries using CT and MR scanning images. Br. J. Radiol. 83 (988), 307-317 (2010).
- Gundersen, H. J. Stereology: the fast lane between neuroanatomy and brain function--or still only a tightrope? Acta Neurol. Scand. Suppl. 137, 8-13 (1992).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır