Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
In Situ Biyoproseslerde Tek Hücreli Morfolojinin Gerçek Zamanlı Tayini İçin Mikroskopi
Bu Makalede
Özet
Bir foto-optik in situ mikroskopi cihazı doğrudan hücre süspansiyon tek hücrelerin boyutunu izlemek için geliştirilmiştir. Gerçek zamanlı ölçüm, foto-optik sterilize edilebilir probun otomatik görüntü analizine dahil edilerek gerçekleştirilir. Morfolojik değişiklikler büyüme durumuna ve yetiştirme koşullarına bağımlılıkla birlikte ortaya çıkmaktadır.
Özet
Mikrobiyal biyoproseslerde yerinde izleme çoğunlukla ortamın kimyasal ve fiziksel özellikleriyle sınırlıdır(örn.pH değeri ve çözünmüş oksijen konsantrasyonu). Bununla birlikte, hücrelerin morfolojisi en uygun koşullar için uygun bir gösterge olabilir, çünkü büyüme durumuna bağımlılık ile değişir, ürün birikimi ve hücre stresi. Ayrıca, tek hücreli boyut dağılımı sadece yetiştirme koşulları hakkında değil, aynı zamanda nüfus heterojenliği hakkında da bilgi sağlar. Bu tür bilgileri elde etmek için, biyoreaktörlerde tek hücreli boyut dağılımının doğrudan hücre süspansiyonunda izlenmesini sağlamak için situ mikroskopi cihazı1 foto-optik geliştirilmiştir. Otomatik görüntü analizi, kullanıcı açıklamalı görüntülerle eğitilmiş bir sinir ağı modeline dayalı mikroskopiile birleştirilir. Mikroskobun ele geçirilmesinden elde edilen çeşitli parametreler, metabolik aktivite gibi hücrelerin ilgili özellikleriyle ilişkilidir. Şimdiye kadar, ipliksi mantar süspansiyonlarında pelet boyutunu ölçmek için situ mikroskopi prob serisi sunulmuştur. Mikroalg yetiştiriciliğinde tek hücreli boyutu ayırt etmek ve lipid birikimi ile ilişkilendirmek için kullanılmıştır. Hücresel parçacıkların şekli maya kültürleri tomurcuklanma ile ilgiliydi. Mikroskopi analizi genellikle üç adıma ayrılabilir: (i) görüntü edinimi, (ii) parçacık tanımlama ve (iii) veri analizi, sırasıyla. Tüm adımlar organizmaya adapte edilmelidir ve bu nedenle güvenilir sonuçlar elde etmek için özel açıklamalı bilgi gereklidir. Hücre morfolojisindeki değişiklikleri doğrudan satır veya satır (by-pass olarak) izleme yeteneği, süreç geliştirme de ve üretim ölçeğinde izleme ve kontrol için gerçek zamanlı değerler sağlar. Çevrimdışı veriler gerçek zamanlı verilerle ilişkiliyse, hücre boyutu üzerinde bilinmeyen etkilere sahip geçerli sıkıcı çevrimdışı ölçümler gereksiz hale gelir.
Giriş
Hücrelerin morfolojik özellikleri genellikle fizyolojik durum ile ilgilidir, form ve fonksiyon arasında bir bağlantı birçok uygulama için var. Tek bir hücrenin morfolojisi büyüme durumu, hücrenin yaşı, ozmotik ve diğer potansiyel hücre gerilmeleri veya ürün birikimi nden etkilenir. Hücrelerin morfolojik değişiklikleri genellikle bir kültürün büyüme canlılığının bir ölçüsüdür. Hücre içi ürün sentezi, yosunlarda lipid birikimi ve bakterilerde dahil vücut oluşumu, diğerlerinin yanı sıra, hücre büyüklüğü ile de ilişkilidir. Hücre aglomerasyonu son zamanlarda özetlendiği gibi araştırmaya değer başka bir faktör olabilir2.
Popülasyon heterojeniteleri tek tek hücrelerin morfolojik özelliklerine göre ölçülebilir. Çalışmalar bir kültür içinde heterojenlik önemli olabileceğini gösterdi, örneğin,büyük ölçekli üretim koşulları altında3 genel verim alt popülasyonların düşük bir performans etkilenebilir4.
Genellikle, hücrelerin morfolojik özelliklerinin değerlendirilmesi manuel örnekleme veya bir foto-optik cihaza bağlı bir by-pass akış odası ile gerçekleştirilir. Bu çeşitli kısıtlamalara yol açar: elde edilen verilerin sınırlı miktarda neredeyse istatistiksel olarak güvenilir ölçümler sağlayabilir; örnekleme arasındaki zaman gecikmesi ve sonuçların erişilebilirliği sürecin dinamiklerine kıyasla çok uzun olabilir; ve en önemlisi, örnekleme prosedürü (numune portunun konumu, ölçümden önce numunenin ön işlemesi, örnekleme veya bypass tüpündeki elverişsiz koşullar) örnekleme işleminin kendisi hücreyi etkileyebileceğinden önyargılı bir hatayı tetikleyebilir Morfolojisi. Son olarak, numune alma sırasında veya by-pass çözeltilerinde sterilize edilebilen çözeltilerde her zaman yüksek kontaminasyon riski vardır.
in situ mikroskopi (ISM) uygulaması bu sorunların birkaçını atlatabilir. Hücreler otomatik olarak algılanırsa, morfolojik özelliklerinin doğru bir şekilde tanımlanması5. Şimdiye kadar, bu yöntemin ana sınırlamaları (i) yerinde uygulamalar için çok uzun olan görüntülerin değerlendirme süresi ve (ii) görüntülerin kötü çözünürlüğü, özellikle yüksek hücre yoğunluklarında idi. ISM'nin ilk çözümleri mekanik örnekleme dahil olmasına rağmen, prob seyreltme, ya da bir by-pass sistemi ile sınırlı ydı6,7, daha fazla yaklaşımlar doğrudan hücre süspansiyon yakalama sağlar8.
ISM'deki son gelişmeler, tek hücreli olarak hücrelerin satır içi veya satır da izlenmesine olanak sağlar, bu da morfolojik parametrelerin gerçek zamanlı olarak doğrudan hücre süspansiyonlarında önemli ölçüde yüksek hücre konsantrasyonlarında dağılımını sağlar. Hücrelerin anahtar parametrelerinin çevrimdışı analizleri sayesinde, birleşen otomatik hücre tespiti ve ISM tarafından sağlanan bilgilerle korelasyon lar tanımlanabilir. Daha sonra, tek hücreli morfolojisi ile ölçülemez bir parametrenin tahmin edildiği yeni yumuşak sensör tasarımları elde edilir.
Bu raporda, ISM otomatik bir görüntü analizi için bir foto-optik prob kaplayarak yapılır. ISM, yüksek çözünürlüklü CCD kamera [MM-Ho = CCD GT2750 (2750x2200) ve MM 2.1 = CMOS G507c (2464x2056)]] ile ayarlanabilir bir ölçüm boşluğunda bilinen bir odak aralığındaki görüntülerin yakalanmasını sağlayan tek çubuklu bir sensör probundan oluşur. Flaş ışığı aydınlatması iletim ile gerçekleştirilir. Bu nedenle, ışık kamera9 karşı tarafında kaynaklanır ve yoğunluğu ayarlanabilir. Hücreler sıvı akışı ile bu boşluktan sürekli olarak geçerler. Bu nedenle, temsili bir örnek popülasyon elde edilir. Prob doğrudan biyoreaktöre monte edilebilir, böylece hücre süspansiyonuna ulaşır veya sterilize edilebilir bir by-pass'ta kullanılabilir. Sensör kabuğu sterilizasyondan önce sisteme bağlanır, optik parçalar daha sonra kabuk içine monte edilir.
Şimdiye kadar, ilgili endüstriyel mikroorganizmalar, örneğin,ipliksi mantarlar (çapı 200 μm'ye kadar), heterotrofik mikroalg Crypthecodinium cohnii (ortalama hücre çapı 20 μm) ve maya Saccharomyces cerevisiae (ortalama hücre çapı 5 μm), kısa bir süre açıklanan bu veya benzeri cihazlarla incelenmiştir.
Filamentöz mantarlar belirli yetiştirme koşulları altında pelet oluşturma eğilimindedir. Bunlar birkaç yüz μm boyutundadır. Mantar hücrelerinin hyphae sıvı fazhidrodinamik strese bağımlılık farklı uzunluklarda geliştirmek. Bu metabolik ve büyüme aktivitesi üzerinde bir etkisi vardır, substrat alımı ve ürün salınımı. ISM pelet boyutu dağılımı ve pelet kenarlarında düşük biyokütle yoğunluğu bölgelerin in genişliğini belirlemek için uygulandı (kendi yayınlanmamış veri).
C. cohnii boyutu hücreleri azot sınırlaması altında çoklu doymamış yağ asidi dokosaheksaenoik asit (DHA) birikir zaman 15 ve 26 μm arasında değişir. Bu biyoteknolojik DHA üretim süreci iki bölümden oluşur, büyüme aşaması, hangi hücrelerin bölmek ve küçülür, ve üretim aşaması, hangi hücrelerin ürün birikir ve böylece daha büyük olur. Bu nedenle, hücre boyutu, büyüme veya DHA üretiminin olumlu olduğu işlem durumunu belirlemek için kullanılmıştır. Son olarak, hücre boyutu ve DHA içeriği arasında bir korelasyon bulundu. Bu durumda ISM, hücre içi DHA birikimini örnekleme, hücre bozulması ve ortak gaz kromatografisi analizi10gerekkalmadan gerçek zamanlı olarak izlemenizi sağlar.
Tomurcuklanan maya genellikle 3 ila 8 μm arasında bir boyuttadır. Tomurcuklanma indeksi (BI) ile açıklandığı gibi, bir anda olgunlaşma durumunda olan hücrelerin oranı, büyüme canlılığı hakkında bilgi sağlar11,12, ve hatta rekombinant protein salgısı ile bir ilişkikanıtlanmıştır 13. ISM yardımıyla, tomurcuklanan ve tomurcuklanmayan maya hücreleri (tomurcuklu ve tomurcuksuz hücreler)14ayırt edildi. Stres koşulları da bir maya popülasyoniçinde hücre boyutunun daha geniş bir varyasyon yol açabilir, son zamanlarda küçültülmüş ekimleri gösterildiği gibi, hangi büyük ölçekli besin sınırlı beslenen-toplu yetiştirme koşulları taklit edildi3.
Bu nedenle, ISM optimum yetiştirme koşullarının belirlenmesi için bir biyosürecin tüm aşamalarında tek hücre düzeyinde büyüme canlılığı ve ürün oluşumunu izlemek için potansiyele sahiptir, ya da süreç kontrolü amacıyla. Burada açıklanan yöntemler tek hücreli mikrobiyal uygulamalara odaklanmıştır, ancak insan ve hayvan hücreleri, hücre aglomeraları ve ipliksi organizmaların peletleri gibi daha büyük parçacıklar için de geçerlidir.
Protokol
NOT: Parametreleri ilgili mikroorganizma ve kültür koşullarına uyarlamak için aşağıdaki adımlar gereklidir. Sonda ayarlarının ayarını deneyimli bir kullanıcı için yaklaşık 20 dakika sürer. Araç ve adımların ayrıntılı bir açıklaması SOPAT GmbH'nin ilgili prob kılavuzunda verilmiştir. Genel olarak, aşağıdaki protokolde sunulan araçlara ihtiyaç vardır: (i) Prob ayarlamaları ve görüntü edinimi için Prob Denetleyicisi; (ii) Elde edilen görüntülerle ilgili ek açıklamalar için Fiji (ImageJ); (iii) yapay sinir ağı (ANN) eğitimi ve iş akışı oluşturma için SOPAT desteği; (iv) İş akışı ile zaten edinilmiş görüntüleri kullanarak veri toplu işleme için Batcher; (v) Toplu işlenmiş görüntülerde sonuç görselleştirme ve değerlendirme için Sonuç Analizörü; ve (vi) Otomatik gerçek zamanlı ölçüm ve sonuç görselleştirme için monitör.
1. Donanım Parametrelerinin Ayarlanması
- Deney veya santrifüj sırasında elde edilebilen en yüksek hücre konsantrasyonuna sahip bir kültür hazırlayın ve bu konsantrasyonu elde etmek için peleti yeniden askıya alın. Bu durumda S. cerevisiae yetiştiriciliği için kuru biyokütle konsantrasyonunun 65 g L-1'i seçilmiştir.
- Beklenen aralığın tam olarak kapsanması için en yüksekten en düşük konsantrasyona kadar değişen farklı seyreltmeler hazırlayın. En az 4 farklı konsantrasyon önerilir.
- Konvansiyonel mikroskop ile mikroorganizmanın hücre büyüklüğü aralığını belirleyin. İlgili hücrelerin beklenen maksimum çapını (dmax)tanımlayın. Bu değer S. cerevisiaedurumunda 8 μm olarak ayarlanır.
- Hücrelerin beklenen dmax 5x ve 10x iki ölçüm boşlukları seçin.
- Maksimum stroboskop yoğunluğunu seçin. En yüksek hücre konsantrasyonuna sahip her iki boşluk için stroboskop yoğunluklarını seçin, böylece hücreler en düşük ışık yoğunluğuna (en koyu görüntüler) sahip görüntülerde hala görünür.
- Minimum stroboskop yoğunluğunu seçin ve hücrelerin en yüksek ışık yoğunluğuna (en parlak görüntüler) sahip görüntülerde hala görünür olması için her iki boşluk için stroboskop yoğunluklarını seçin. Büyük olasılıkla ölçüm döneminde görünen en düşük hücre konsantrasyonu kullanın.
- Hem stroboskop yoğunlukları hem de test edilmesi gereken konsantrasyon aralığı için her ölçüm boşluğu için en keskin görüntüleri sağlayan bir odak pozisyonu seçin (odaklama hakkında ayrıntılar için adım 2'ye bakın). Görüntü verilerinin daha sonra açıklamaek açıklanabilmesi için hücreleri uygun şekilde odakla (bkz. adım 4).
- Hücre konsantrasyonunun önceden hazırlanmış seyreltme serisini (bkz. adım 2) hem boşluk genişlikleri hem de stroboskop yoğunlukları ile ölçün.
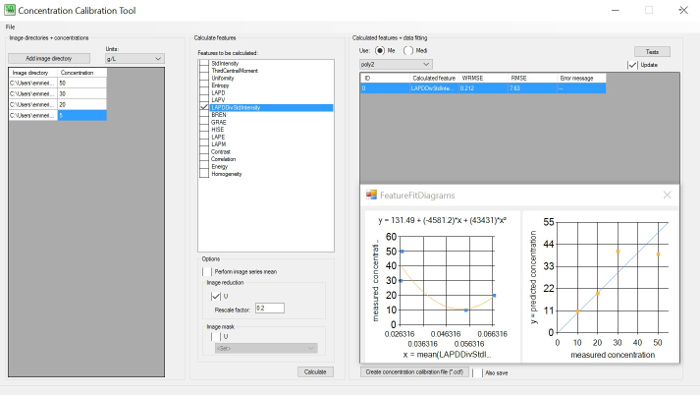
Şekil 1: Konsantrasyon kalibrasyon aracı. Sol GUI: bilinen konsantrasyonları ile görüntü dizinleri (en az 3) ayarlayın; merkezi GUI: görüntü dizininde hesaplanacak özellikleri seçin; sağ GUI: minimum belirlemek için ağırlıklı kök ortalama kare hata (WRMSE) seçin. WRMSE ve herhangi bir görüntü özelliği ve hücre konsantrasyonu arasındaki en iyi korelasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Seyreltme serisi deneyi değerlendirin.
- Çıkarılan görüntü özellikleri (parlaklık veya netlik) ile kullanıcı tarafından sağlanan daha önce ölçülen konsantrasyonlar (örn.kuru biyokütle veya hücre sayıları) arasındaki en iyi korelasyonu belirlemek için Konsantrasyon Kalibrasyonu (CoCa) Aracını (bkz. Şekil 1'ebakın). Daha fazla bilgi için yazılım kılavuzundaki talimatları izleyin.
- Herhangi bir çevrimdışı ölçümle karşılaştırıldığında çeşitli konsantrasyonlarda görüntü özelliklerinden çıkarılan bilgiler arasındaki en iyi ilişkiyi belirleyin. Şekil 1efsanesine bakın.
- En küçük ağırlıklı kök ortalama kare hatasına (WRMSE) neden olan özelliklerle konsantrasyon korelasyon eğrisi göz önünde bulundurularak en makul ölçüm boşluğu ve stroboskop yoğunluklarını seçin.
NOT: Ölçüm boşluğu deney sırasında sabitlenirken, strobokop yoğunluğu hücre konsantrasyonuna göre uyarlanabilir.
2. Off Line Ölçüm
- Bir kalınlık göstergesi yardımıyla adım 1'e göre istenilen ölçüm boşluğunu ayarlayın.
- SOPAT panosunda grafik kullanıcı arabirimi Probe Control'u açın.
- İstenilen sondayı yazılım alt bölümündeki amplifikatöre bağlayın ve Bağlan'abasın.
- Akışı başlatmak için Oynat düğmesine basın (Canlı Görünüm).
- Boşluğa etanol püskürterek ölçüm boşluğunu temizleyin ve herhangi bir toz veya kiri optik bir kağıtla dikkatlice silin. CamControl'deki Live View ile sensörün camının parçacıklardan arındırılmış olup olmadığını kontrol edin.
NOT: Parçacıklar ve toz ölçümleri ve otomatik hücre tanımlamasını bozar. - Ölçüm boşluğuna kuru optik bir kağıt yerleştirin. Sonda sekmesini açın ve kağıdı görselleştirmek için stroboskop yoğunluğunu ayarlayın. Kağıdın tek lifleri açıkça görülene kadar bağlama vidasını çevirin.
- Bir tüpü kültür suyuyla doldurun. Mikroskobu kültür suyuna batırın, böylece boşluk hücre süspansiyonuyla tamamen kaplanır. Sekme Sonda denetimini açın ve istenen stroboskop yoğunluğunu bölüm 1'e göre ayarlayın. Odak bağlama vidasını ince ayarlayarak hücrelere odaklanın. Odak artık deneme sırasında değiştirilmemelidir
NOT: Ölçüm boşluğunu yeterince yüzdürmek için 50 mL konik santrifüj tüpe 5-6 mL kültür suyu eklenir. - Tetikleyici başına GUI Çerçeveleri tetikleme menüsünde kullanıcı arabiriminde zaman noktası başına kare [-] başına kare sayısını tanımlayın. Kare sayısını tetik başına 200 kare olarak ayarlayın.
NOT: Kare sayısı istatistiksel olarak güvenilir bir sonuç için gerekli olan en düşük değere düşürülebilir. Bu, temsili morfolojik hücre boyutu dağılımı elde etmek için gereken örnek boyutuna bağlıdır (ayrıca bkz. adım 5). - GUI Frame hızında Tetikleme menüsündeki kare hızını [Hz] tanımlayın. Önceki çerçeveden parçacıkların hareket ettirilmesinin aşağıdaki çerçevede görünmeyeceğini garanti eden bir kare hızı seçin.
NOT: Bu 200 kare ile bir test tetikleyici ile kanıtlanabilir. Görüntüleri, tekrar tekrar yakalanan parçacıklar için inceleyin. Bu durumda, kare hızını azaltın. Çevrimdışı ölçümler için 1 Hz önerilir. - Edinilen görüntülerin kaydedileceği dizini Genelmenüsünde ayarlayın.
- Başlat görüntü tetikleyici edinme düğmesini etkinleştirerek görüntü edinimi gerçekleştirin. Ölçüm boşluğundan bir akış sağlamak için tüpü yavaşça yukarı ve aşağı hareket ettirin.
- Her ölçümden sonra adım 2.5'i tekrarlayın.
- Edinilen görüntüleri kontrol edin. Hücreler ek açıklama için yeterince keskin olmalıdır. Görüntüleri, tekrar tekrar yakalanan parçacıklar için inceleyin. Bu durumda, kare hızını azaltın.
- Aşağıdaki yolu seçerek ayarları kaydedin: C:\Program Files\SOPAT GmbH\monitoringPrograms\camcontrol ve Kaydettuşuna basın.
3. Parçacık Tanımlama
- Yapay sinir ağı (ANN) (eğitim seti) eğitimi için parçacıklar açıklama.
- Edindiği görüntüleri ana açıklama aracına yükleyin "Fiji, ImageJ" dosyayı sürükleyip Ana "ImageJ" penceresine bırakarak (bkz.ŞEKIL 2'deki GUI "Fiji" aracı )
- Yatırım Getirisi Yöneticisi'ni seçerek açın: Analiz et | Araçlar | YRK Yöneticisi.
- Bir seçim aracı seçin. Değnek (izleme) aracı, serbest, oval veya eliptik seçimler önerilir.
- Daha önce belirtilen seçim araçları yla açıklamalacak parçacığın etrafına bir daire çizin ve fırça aletiyle hassaslaştırın.
- [t]ekle tuşuna basarak YG Yöneticisine ek açıklama ekleyin.
- Yaklaşık 15 görüntüde ilgi çekici tüm nesneleri (tanımlanacak hücreler) işaretleyin.
NOT: Gerekli tüm bilgileri, yani farklı şekilleri, boyutları, hücre konsantrasyonu, parlaklık, vb.kapsayacak şekilde, başlangıçtan itibaren beş görüntü, aradan beş görüntü ve deneyin sonundan itibaren beş görüntü kullanın. - Hücrelerin şekillerine(örneğin,hücre döngüsünün farklı evreleri) bağlı olarak farklı alt sınıflarda sınıflandırılması gerekip gerekmeden veya tüm hücrelerin aynı sınıfta olup olmadığına karar verin.
- Seçilen her parçacıkların adını buna göre değiştirin. Her sınıf için bir ad veya kısaltma ve sınıfın her parçacığı için bir sayaç(örn.cell_1, cell_2, vb.ayarlayın). Sınıf başına en az 50 partiküle açıklama ek.
- Gaz kabarcıkları veya çözünmemiş ortam bileşenleri gibi diğer parçacıklar gibi işlemle ilgili olmadıklarından, algılanmaması gereken nesnelere açıklama koymayın.
NOT: Bu etkinlikler ANN eğitim prosedürüne dahil edilmeyecek ve arka plan olarak kabul edilecektir. - Odak dışında olan hücrelere açıklama yapmayın.
- Görüntüleri mümkün olduğunca tutarlı bir şekilde açıklama olarak verin. Şüpheler varsa, Yoksay etiketi uygulanabilir. ANN yalnızca etiketli yapıları tanıyacağı için kullanımını kötüye kullanmaması önerilir.

Şekil 2: Fiji aracı kullanıcı arabirimi. Açıklamalı görüntülerle bir eğitim kümesi oluşturulur. İki sınıftan oluşan bir manuel ek açıklama tasvir edilir, açıklamalı parçacıkların listesi YG Yöneticisi'nde gösterilir. Farklı sınıflar için farklı adlar ve renkler ayarlanabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Açıklamalı nesneleri ve görüntüyü ZIP biçimine kaydedin ve dosyayı platforma yükleme yoluyla veya zip dosyasını e-posta yoluyla göndererek eğitim ağına gönderin.
NOT: Genellikle, resimlerdeki sınıflandırılmış nesnelerin yeterli tahminlerini belirlemek için bir dizi yinelemeli eğitim turu alır. Her eğitim turu, program tarafından döndürülen bir iş akışına yol açar. - Panoda başlatılabilen veri toplu işleme programı Batcher ile test görüntülerini analiz etmek için eğitilmiş nesne tanıma algoritmasıyla iş akışını (*.wf) kullanın.
- Yanlış pozitif ve negatif olayların nicelikselleştirilmesi yoluyla test görüntüleri üzerinde nesne algılamasını kontrol edin.
- Yanlış pozitif olayların algılanmasını ölçer: hatalı olarak hücre olarak algılanan parçacıklar, doğru sınıflandırılmamış hücreler ve konturun iyi tanımlanmadığı hücreler.
- Yanlış negatif olayları (bu şekilde tanınmayan hücreler) ölçün.
- Panelinde programı başlatarak aracı Sonuç çözümleyicisi sonuçları görselleştirin.
- İstenilen sonuç dosyalarını Dosya ile alma | Dosya veya Dosyayı alma | Klasörleri içe aktar.
- Sonuçları Grafiğe Göre Görselleştir | Gui Grafiklerinde grafik oluşturun.
- Aşağıdaki seçeneklerden birini seçin: Dağıtım grafiği, Duyarlılık çizimi, zaman içinde karakteristik, anket noktaları üzerinde karakteristik ve Özellik vs. özelliği.
NOT: Sonuç Çözümleyicisi'nin kullanımına ilişkin bir kılavuz sistemle birlikte gelir ve destekten de temin edilebilir. - Sonuçlar kabul edilebilirse, iş akışını Batcher'da denemenin tüm elde edilen görüntülerinde çalıştırın. Aynı zamanda izleme programı, Probe Controller'dan (*.pcfg) kaydedilen ayarları iş akışıyla (*.wf) birleştirerek oluşturulabilir, ayrıca kılavuza bakın.
NOT: İş akışı, bu kültür ortamı için gelecekteki denemeleri izlemek için de kullanılabilir. - Sonuçlar kabul edilemezse, eğitim setindeki ek açıklamayı kontrol edin ve/veya başka bir yinelemeli eğitim turuna devam edin (bkz. adım 4.2).
4. Örnek Boyutu Niceleme
- Algılanan parçacıklar arasında kabul edilebilir standart sapmayı (σ) ayarlayın.
NOT: Standart sapma hücre büyüklüğü homojenliğine paralel olarak değişir. Maksimum standart sapma, en yüksek boyut heterojenliğine sahip örneği gösterir. - Güven aralığının genliğini veya ölçümlerin beklenen varyansı (e)ile ilgili olarak istenilen doğruluğu ayarlayın.
- Kabul edilen hatayı (α) %5 (z1-α/2 = 1,96) ile %10 (z1-α/2 = 1,64) arasında ayarlayın.
- Denklem 1'den her sınıftan tanımlanacak hücre sayısını hesaplayın.
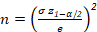 [Denklem 1]
[Denklem 1]
NOT: Hücre sayısına bağlı olarak, her veri noktası için elde edilmesi gereken görüntü sayısı tanımlanabilir. - N parçacıklarının analizinin ortalama Feret çapının ve Dv90'ın %5'ten daha az bir değişkenliğe yol açtığını kontrol etmek için deneyin rasgele zaman noktaları üzerinde bir duyarlılık analizi yapın. Sonuç Çözümleyicisi'ndeotomatik olarak hesaplanabilir.
5. Satırda (By-Pass) veya Satır Da Ölçümü
- Donanım ve yazılım ayarlarını organizmanın ve sürecin (konsantrasyon veya ortam) bir fonksiyonu olarak ayarlamak için önce çevrimdışı ölçüm prosedürünü (bkz. adım 2) gerçekleştirin.
- Yükle düğmesini seçerek önceki bölümden kaydedilen ayarları yükleyin ve aşağıdaki yolu seçin: C:\Program Files\SOPAT GmbH\monitoringPrograms\camcontrol.
- Sondayı akış hücresine ya da biyoreaktöre bağlayın.
NOT: Yerinde ölçümler bir tutam flanş ile yapılabilir. - Sterilizasyon yapın.
NOT: Sadece aletin sondalı malzeme buhar sterilizasyonu ile sterilize edilebilir. Prob ıslak uzunluğu 6 ila 222 mm(Şekil 3)arasında gidebilir.
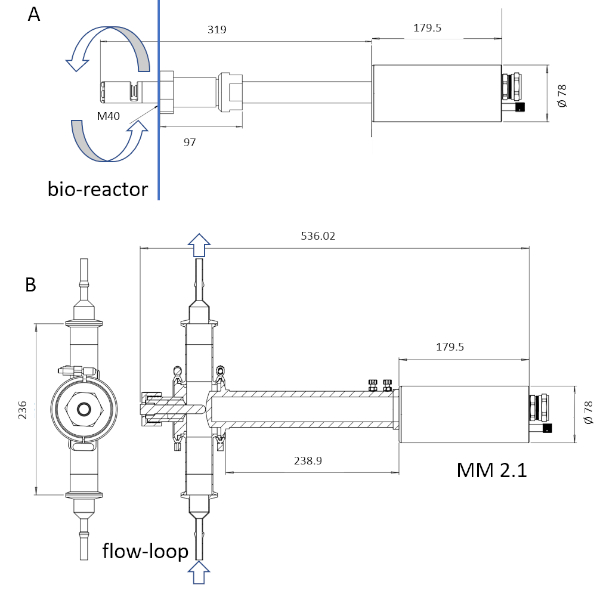
Şekil 3: ISM cihazlarının çizimi. MM-Ho (A) probu doğrudan biyoreaktöre monte edilebilirken, MM 2.1 (B) probu by-pass olarak kullanılabilir. Kültür suyu dolaşımı her resimde oklarla işaretlenir. Dönüştürme faktörleri MM-Ho için 0,166 μm pix-1 ve MM 2,1 için 0,087 μm pix-1'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Alan Tetikleme aralığındaGUI Tetikleme görüntü alma oranını tanımlayın [s] .
NOT: İşlem dinamikleri bağlı olarak, görüntü edinme oranı uyarlanabilir. Örneğin, 3 saatlik bir gecikme evresi bekleniyorsa, bir metabolizma değişimi veya bir ürünün birikimi nin izlenmesinden daha düşük satın alma oranı daha düşük olabilir. Genellikle, bu dakika aralığında çok daha kısa bir edinme süresi gerektirir. Örneğin, bir toplu maya ekimi sırasında 5 ile 10 dk arasında bir görüntü edinme dizisi, işlem dinamiklerini yakalamak için yeterli bilgi sağlar. - 2.10 adımda açıklandığı gibi kare hızını tanımlayın.
NOT: Hat ve hat ölçümlerinde, mekanik karıştırma boşluktan akış hızını artırabileceğinden, kare hızı artırılabilir. - Seçili sondanın akışını başlat düğmesini etkinleştirerek görüntü edinimi başlatın.
- Deneme, seçili sondanın akışını durdurdüğmesiyle tamamlandığında edinmeyi durdurun.
NOT:1. çalışma için, kültürün aşılanmasından hemen önce edinimi başlatın ve 4. Aşağıdaki çalıştırmalar için panoda program İzleme'yi açın ve oluşturulan iş akışını seçin (bkz. adım 4). Play butonuna basarak kültürün aşılanmasından hemen önce izlemeyi başlatın.
Sonuçlar
Ism ile maya kültürlerde hücre büyüklüğü algılama ve tomurcuklanma yanran olmayan hücreleri ayırt etmek için otomatik görüntü algılama başarıyla yapılmıştır. Hem strobkop yoğunluğu hem de ölçüm boşluğu seçimi, parçacık tanımlamasının etkilenmediği bir tolerans aralığına sahiptir. Örneğin, S. cerevisiae hücreleri 4 g L-1kuru biyokütle konsantrasyonunda %11'lik bir varyasyon aralığında çeşitli stroboskop yoğunlukları ile ...
Tartışmalar
Burada aynı veya çok benzer cihazlarla sunulan ISM, mantarların, mikroalgların ve maya hücrelerinin morfolojik dinamiklerini ölçmek için kullanılmış, bu da büyüme aktivitesinin belirlenmesini ve alglerin hücre içi ürün birikimine yol açarak sağlanmıştır. Sensörün hareketli parçaları yoktur ve standart bir bağlantı noktası üzerinden veya sterilize edilebilir bir by-pass'ta herhangi bir standart karıştırılan tank biyoreaktöründe doğrudan uygulanabilir. Maya yosun çok daha küçük oldu...
Açıklamalar
Yazarların beyan etmek için hiçbir şeyi yok.
Teşekkürler
Yazarlar çerçevesinde ZIM-Koop, proje "Akıllı Süreç Denetimi" kapsamında Almanya Federal Ekonomi ve Enerji Bakanlığı desteği için müteşekkir, hibe hayır. ZF 4184201CR5.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sensor MM 2.1 - MFC | SOPAT GmbH, Germany | n.a. | Inline Monocular Microscopic probe Version 2.1 with a Mirco Flow Cell |
| Sofware version v1R.003.0092 | SOPAT GmbH, Germany | n.a. | |
| Thickness gauge | n.n. | It can be any supplier, DIN 2275:2014-03 | |
| Ethanol 70% | n.n. | It can be any supplier | |
| SOPAT manual Version 2.0.5 | SOPAT GmbH, Germany | ||
| Optical lense paper | VWR | 470150-460 | |
| Fiji, ImageJ | open source | ||
| 50 mL conical centrifuge tubes | It can be any supplier |
Referanslar
- Maaß, S., Rojahn, J., Hänsch, R., Kraume, M. Automated drop detection using image analysis for online particle size monitoring in multiphase systems. Computers & Chemical Engineering. 45, 27-37 (2012).
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., Junne, S. Tools for the determination of population heterogeneity caused by inhomogeneous cultivation conditions. Journal of biotechnology. 251, 84-93 (2017).
- Marbà-Ardébol, A. M., Bockisch, A., Neubauer, P., Junne, S. Sterol synthesis and cell size distribution under oscillatory growth conditions in Saccharomyces cerevisiae scale-down cultivations. Yeast. 35 (2), 213-223 (2017).
- Xiao, Y., Bowen, C. H., Liu, D., Zhang, F. Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis. Nature chemical biology. 12 (5), 339-344 (2016).
- Beutel, S., Henkel, S. In situ sensor techniques in modern bioprocess monitoring. Applied microbiology and biotechnology. 91 (6), 1493 (2011).
- Belini, V. L., Wiedemann, P., Suhr, H. In situ microscopy: A perspective for industrial bioethanol production monitoring. Journal of microbiological methods. 93 (3), 224-232 (2013).
- Havlik, I., et al. Monitoring of microalgal cultivations with on-line, flow-through microscopy. Algal Research. 2 (3), 253-257 (2013).
- Suhr, H., Herkommer, A. M. In situ microscopy using adjustment-free optics. Journal of biomedical optics. 20 (11), 116007 (2015).
- Panckow, R. P., Reinecke, L., Cuellar, M. C., Maaß, S. Photo-Optical In-Situ Measurement of Drop Size Distributions: Applications in Research and Industry. Oil Gas Sci. Technol. - Rev. IFP Energies. 72 (3), 14 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Neubauer, P., Junne, S. Single-cell-based monitoring of fatty acid accumulation in Crypthecodinium cohnii with three-dimensional holographic and in situ microscopy. Process Biochemistry. 52, 223-232 (2017).
- Porro, D., Vai, M., Vanoni, M., Alberghina, L., Hatzis, C. Analysis and modeling of growing budding yeast populations at the single cell level. Cytometry. Part A : the journal of the International Society for Analytical Cytology. 75 (2), 114-120 (2009).
- Brauer, M. J., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular biology of the cell. 19 (1), 352-367 (2008).
- Puxbaum, V., Gasser, B., Mattanovich, D. The bud tip is the cellular hot spot of protein secretion in yeasts. Applied microbiology and biotechnology. 100 (18), 8159-8168 (2016).
- Marbà-Ardébol, A. M., Emmerich, J., Neubauer, P., Junne, S. Vol. P2. Prozessmesstechnik. , 222-225 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Muthig, M., Neubauer, P., Junne, S. Real-time monitoring of the budding index in Saccharomyces cerevisiae batch cultivations with in situ microscopy. Microbial cell factories. 17 (1), 73 (2018).
- Marquard, D., Schneider-Barthold, C., Düsterloh, S., Scheper, T., Lindner, P. Online monitoring of cell concentration in high cell density Escherichia coli cultivations using in situ Microscopy. Journal of biotechnology. 259, 83-85 (2017).
- Marquard, D., et al. In situ microscopy for online monitoring of cell concentration in Pichia pastoris cultivations. Journal of biotechnology. 234, 90-98 (2016).
- Camisard, V., Brienne, J., Baussart, H., Hammann, J., Suhr, H. Inline characterization of cell concentration and cell volume in agitated bioreactors using in situ microscopy: application to volume variation induced by osmotic stress. Biotechnology and bioengineering. 78 (1), 73-80 (2002).
- Böhm, A., Ücker, A., Jäger, T., Ronneberger, O., Falk, T. ISOODL: Instance segmentation of overlapping biological objects using deep learning. , 1225-1229 (2018).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Applied and environmental microbiology. 77 (16), 5571-5576 (2011).
- Lodolo, E. J., Kock, J. L., Axcell, B. C., Brooks, M. The yeast Saccharomyces cerevisiae-the main character in beer brewing. FEMS yeast research. 8 (7), 1018-1036 (2008).
- Albertin, W., et al. Population size drives industrial Saccharomyces cerevisiae. alcoholic fermentation and is under genetic control. Applied and environmental microbiology. 77 (8), 2772-2784 (2011).
- Gomes, J., Chopda, V. R., Rathore, A. S. Integrating systems analysis and control for implementing process analytical technology in bioprocess development. Journal of Chemical Technology and Biotechnology. 90 (4), 583-589 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır