Method Article
Yetişkin Farelerin Dentat Girusunda Tüm Hücre Kaydı ve Nöronal Rekonstrüksiyon için Dorsal Hipokampustan Akut Dilimlerin Hazırlanması
Bu Makalede
Özet
Farelerin dorsal-ara hipokampusundan akut dilimler hazırlamak için bir protokol sunuyoruz. Bu transversal preparatı, kayıtların kalitesi ve kaydedilen nöronların morfolojik özelliklerinin korunması açısından koronal dilimleme ile karşılaştırıyoruz.
Özet
Hipokampüsün genel mimarisi boyuna ekseni boyunca benzer olsa da, son çalışmalar rostro-kaudal kapsamı boyunca farklı alt devrelere bölünmeyi öneren moleküler, anatomik ve fonksiyonel kriterlerde belirgin farklılıklar ortaya çıkarmıştır. Diferansiyel bağlantı ve işlev nedeniyle en temel ayrım, sırasıyla mekansal ve duygusal işlemede tercihen yer alan sırt ve ventral hipokampus arasında yapılır. Buna göre, mekansal bellek oluşumu ile ilgili in vivo çalışmalar dorsal hipokampus üzerinde yoğunlaşmıştır.
Buna karşılık, elektro-fizyolojik in vitro kayıtlar tercihen orta-ventral hipokampus üzerinde gerçekleştirilmiştir ve büyük ölçüde dilim uygulanabilirliği ve devre bütünlüğü gibi faktörlerle motive edilmiştir. Uzaysal işlemeye ilişkin in vivo verilerin in vitro verilerle doğrudan korelasyonuna izin vermek için, dentat girustaki ana hücrelerin ve internöronların uzun süreli kayıtları için dorsal-ara hipokampustan son derece uygulanabilir enine beyin dilimleri elde etmek için önceki kesit yöntemlerini uyarladık. Yetişkin farelerde mekansal davranış rutin olarak analiz edildiğinden, bu transversal dilimleme prosedürünü olgun hayvanlardan beyin dokusunun canlılığını artırmak için koruyucu çözeltilerin kullanımıyla birleştirdik. Bu yaklaşımı yaklaşık 3 aylık fareler için kullanıyoruz. Yöntem, dorsal hipokampus üzerine in vitro çalışmalar için sıklıkla kullanılan koronal preparat için iyi bir alternatif sunmaktadır. Bu iki hazırlığı kayıtların kalitesi ve kaydedilen nöronların morfolojik özelliklerinin korunması açısından karşılaştırıyoruz.
Giriş
Hipokampus, öğrenme ve hafızanın, mekansal navigasyonun yanı sıra duygunun farklı yönlerindeki önemli rolü için kapsamlı bir şekilde çalışılmıştır. Yaygın olarak "trisynaptik devre" olarak adlandırılan hipokampüsün temel devresi, enine eksende büyük ölçüde uzunlamasına eksen1boyunca korunan bir lamel ağıdır. Hipokampüsün çeşitli bilişsel ve duygusal davranışlara katkıları muhtemelen bu temel devrenin diğer birkaç beyin bölgesi ile dorsoventral eksen boyunca yaptığı çeşitli bağlantılardan kaynaklanmaktadır2,3. Bununla birlikte, farklı ve efferent bağlantının ötesinde, giderek artan sayıda çalışma hipokampüsün septo-zamansal ekseni boyunca daha fazla farklılığa işaret ediyor. Bu farklılıklar iç mimari ve bağlantının yanı sıra gen ekspresyon kalıpları ve nöronal morfoloji4, 5,6,7,8'deki farklılıklarla ilgilidir.
Temel devrelerde bu tür farklılıkların varlığı göz önüne alındığında, ele alınan sorulara göre araştırılacak spesifik hipokampal alt devrenin seçilmesi mantıklıdır. Örneğin, soru mekansal işlemede yer alan nöronal mekanizmalarla ilgiliyse, ventral hipokampus yerine dorsal ilgi çekicidir, ancak ikisi hipokampal uzunlamasına bağlantı nedeniyle bağımsız olarak in vivo hareket etmese de9,10,11. Bu hatlar boyunca sadece boyuna eksen boyunca farklılıklar göz önünde bulundurulmamalıdır, aynı zamanda yerel ve uzun menzilli devrelerin mümkün olduğunca korunmasına da özen gösterilmelidir. Lif yollarının korunması ve bağlantı için beynin bölümlendirileceği açı esastır.
Literatürde bildirilen ilk yöntem trysinaptik devreyi içermek için önce hipokampusu beyinden izole etti ve daha sonra bir doku helikopteri12 ve bir vibratom13kullanarak enine dilimler (boyuna eksenlere dik) yaptı. Daha sonra fizyologlar hipokampusa bağlı bitişik beyin yapılarını korumak için tüm beyin bloğundan dilimler elde etmeyi tercih ettiler. Bu blok preparatları için, hipokampus ile ilgili olarak koronal dilim hazırlama14 veya hipokampal-entorhinal korteks bağlantılarını korumak için HEC dilimi adlı yatay bir dilim preparatı gibi farklı kesit açıları geliştirilmiştir15,16,17.
İkinci hazırlıkta parietal lob, bloğun tabanını oluşturmak için rostro-kaudal eksen boyunca yatay düzleme ile ilgili olarak 0 ° veya 12 ° açı ile kesilir. Dilimler daha sonra beynin ventral yüzeyinden başlayarak toplanır, böylece esas olarak orta-ventral hipokampal bölgenin hasatını sağlar. Bu yöntem fizyolojik çalışmalar için en popüler seçim haline gelmiştir ve yayınlanan birkaç protokol18 , 19,20'yi izleyerek güvenilir bir şekilde gerçekleştirilebilir.
Bununla birlikte, araştırma ilgisi mekansal öğrenmenin belirli yönleriyle ilgiliyse, dorsal hipokampus daha uygun bir araştırma bölgesi olabilir ve bu hipokampal bölge için benzer kalitede bir dilimleme prosedürü bulmak yararlı olacaktır. Çok rostral direğe odaklanan birkaç protokol geliştirilmiştir, bu talebi karşılayabilir 21,22.
Bu protokolde, bunun yerine, daha önce yatay preparatlar için açıklanan kesit açısını kullanan dorsal-ara hipokampustan uygulanabilir enine dilimler elde etmek için bir yaklaşım açıklıyoruz18,19 ( Şekil1A& B). Bu hazırlıktaki elektrofizyolojik kayıtları ve morfolojik rekonstrüksiyonları koronal dilimlerde elde edilenlerle karşılaştırarak bu protokolün kalitesini ortaya koyuyoruz. Bu protokol özellikle yetişkin farelerde (bizim durumumuzda üç aylık) anatomik ve davranışsal deneylerle kombinasyon için uygundur.
Protokol
Deney hayvanlarını içeren tüm prosedürler Alman Hayvan Refahı Yasası'na uygundu ve Kiel Üniversitesi etik komitesi tarafından onaylandı. Parvalbumin-Cre (Pvalb-IRES-Cre) fare23 (Jackson laboratuvarları, Depo numarası 008069) heterozit koloniler olarak muhafaza edildi veya Ai9 Cre muhabiri fareler24 (Jackson laboratuvarları, Depo numarası 007909) ile geçti. P40-P90 arasında dişi ve erkek fareler kullanıldı. Fareler standart grup muhafaza koşullarında 12 saat açık-karanlık bir döngüde muhafaza edildi ve yiyecek ve su ad libitumile sağlandı.
1. Çözümlerin hazırlanması
NOT: Ultra saf su (UPW) (25 °C 18,2 MΩcm'de direnç) kullanarak her deneysel gün için taze çözümler hazırlayın. Çözeltiler maksimum bir gün boyunca 4 °C'de saklanabilir. Magnezyum ve kalsiyum çözeltileri 1 M stok çözeltileri olarak ayrı ayrı saklanabilir. Kullanımdan önce ve kullanım sırasında optimum oksijenasyon ve pH bakımı için tüm çalışma çözümleri karbojen (%95 O2:5% CO2)ile doyurulmalıdır.
- Kesme çözeltisini hazırlayın (fare başına 500 mL) (mM olarak): 92 NMDG, 2,5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glikoz, 5 Na-askorbat, 4 Na-pyruvate, 0.5 CaCl2·2H2O ve 10 MgSO4·7H 2O. Titrate to pH 7.4 kimyasal bir başlık altında 4-5 mL%16 hidroklorik asit. Bu, MGSO4yağışını önleyecektir.
NOT: KCl ve NaH2PO4, 4°C'de 10x çözeltiler olarak saklanabilir. biz kesme çözümü iki ayrı parti yapmak. Biri kayıt gününden bir gün önce (ezilmiş buz üretmek için gece boyunca bir dondurucuda saklanır) ve diğeri kayıt gününde. - Depolama çözümünü hazırlayın (fare başına 250 mL) (mM olarak): 92 NaCl, 2,5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glikoz, 5 Na-askorbat, 4 Na-pyruvate,2CaCl 2 ·2H2O ve 2 MgSO4·7H2O. Titrate için pH 7.3-7.4 ile 1 N NaOH.
NOT: NaCl, KCl ve NaH2PO4, 4 °C'de 10x çözelti olarak stoklanabilir. - ACSF'yi kayıt için hazırlayın (mM): 122 NaCl, 2,5 KCl, 1,25 NaH2PO4, 24 NaHCO3, 12,5 glikoz, 2 CaCl2·2H 2O ve 2 MgSO4·7H2O, 2 Na-ascorbate, 4 Na-pyruvate. Titrate pH için 7.3-7.4 ile 1 N NaOH.
NOT: NaCl, KCl ve NaH2PO4, 4°C'de 10x stok çözeltisinde birleştirilebilir.
2. Kürsunun dilimleme için hazırlanması
- Buz üzerinde bir beher (150 mL) ve iki cam Petri kabı (10 cm çapında) hazırlayın ve taze kesme çözeltisi ile doldurun. Çözeltiyi bir karbojen köpürme cihazı (delikli bir tüp veya karbojen sistemine bağlı bir hava taşı) ile oksijenli tutun.
NOT: Beherdeki çözelti perfüzyon için, Petri tabakları ise kesme işlemi sırasında kullanılacaktır. - Ameliyat bankını paslanmaz çelik bıçak, yuvarlak uçlu cımbız, ince uçlu cımbız, büyük makas, küçük makas, büyük metal spatula, ince metal spatula, fırça, vibratom plaka ve siyanoakrilat yapıştırıcı veya daha az toksik n-butil-ester siyanoakrilat yapıştırıcı ile donatın. Buz üzerindeki cam Petri tabaklarından birinde paslanmaz çelik bir bıçak ve bir parça filtre kağıdı ıslatır. Bu Petri beyni kesmek için kullanılacak. Plastik bir Petri kabının altına üç paralel çizgi çizin ve bu kabı cerrahi aletlere yakın konumlandırın.
- Yayınlanan protokollere göre trans-kardiyak perfüzyon için kurulumu hazırlayın25.
- Vibratomu hazırlayın, bıçak tutucusuna yeni bir bıçak monte edin ve kesme parametrelerini ayarlayın (bıçağın yatay düzlemden açısı 17°, bıçak salınım genliği 1,5 mm, bıçak ileri hareket hızı yaklaşık 2 mm dk-1, Salınım frekansı 90 Hz, kesit kalınlığı 350 μm). Vibratom tepsisini buz gibi kesme çözeltisi ile doldurun ve sürekli oksijenasyon altında tutun.
NOT: Sıcaklığı düşük tutmak için ilk kesim çözeltisinden yapılan ezilmiş buzu soğutulmuş taze kesme çözeltisine ekliyoruz. Dilimlerken buzu bıçaktan uzak tutmaya dikkat edin. - Sabit oksijenasyon altında kesme çözeltisi ile dolu bir kuluçka odası hazırlayın. Odayı önceden ısıtılmış bir su banyosuna (35 °C) yerleştirin.
NOT: Kuluçka odası için bir örnek Edwards ve Konnerth (1992)26'dabulunabilir. - Depolama çözeltisi ile dolu bir dilim saklama odası hazırlayın ve oda sıcaklığında ve sabit oksijenasyon altında tutun. Dokunun floresan bir proteini veya ışıkla aktive edilmiş bir opsin ifade etmesi durumunda, odanın karanlıkta, örneğin bir kutunun içinde tutulması tavsiye edilir.
NOT: Birden fazla bağımsız kuyuya sahip bir depolama odası, Hipokampus'un dorsoventral ekseni boyunca dilimlerin seviyesini ayırt etmek için yararlıdır. Özel yapım bir oda inşa edilebilir (Şekil 1D). 81x kriyojenik şişe saklama kutusundan bir parça şişe ara ızgarası alın ve altını naylon bir ağa yapıştırın. 5mL pipet plastik ucun üst üçte birini bu ızgaranın ortasına yerleştirin, böylece altta yaklaşık 3 cm dışarı çıkar. Bu plastik uç ızgaranın standı olarak hizmet eder ve daha sonra oksijenlenme için hava tüpünü tutar. Izgarayı standı olan silindirik plastik bir kutuya (örneğin şırınga filtrelerinin ambalajı) eğik veya sallanamayacak şekilde yerleştirin. Bu rezervuar 250 mL depolama çözeltisi tutacaktır.
3. Hipokampal dilimlerin hazırlanması
- Kaputun altındaki izofluran (yaklaşık 0,5 mL) kullanarak fareyi bir kutu odasında uyuşturun. Nefes alma yavaş ve düzenli olana kadar fareyi dinlendirin (yaklaşık 2-3 dakika). Parmak sıkışmaları ile ağrı yanıtlarının yokluğunu test edin.
- Yayınlanan protokoller 25,27'yitakiben buz üzerindeki beherden25mL karbonatlı kesme çözeltisi kullanarak trans-kardiyal perfüzyon gerçekleştirin. Bu adım, nöronal metabolizmayı hızlı bir şekilde yavaşlatmak için beyni hızla soğutmanız önerilir.
- Büyük makası kullanarak hayvanın kafasını koparın ve başı kesme çözeltisini içeren buz üzerindeki soğutulmuş Petri kabına yerleştirin.
- Kafatasını ortaya çıkarmak için ince makasla cildi açın. Foramen magnum'un her iki tarafındaki kafatasının tabanına küçük yanal kesiler yapın. Daha sonra, koku ampulünün üzerindeki naso-frontal dikişe ulaşana kadar foramen magnum'dan başlayarak sagittal dikiş boyunca kesin. Alttaki beyin dokusunun zarar görmesini önlemek için sagittal kesim sırasında makası yukarı çekin.
NOT: Başı kesme çözeltisine batırmak, kandan temizlenmesine yardımcı olur ve sıcaklığı düşük tutar. - Beyni açığa çıkarmak için parietal kemikleri yukarı çekmek için yuvarlak uçlu cımbızı kullanın. Menenjitleri de ele geçirmek ve çıkarmak için dikkat edin. Bırakılırsa, ekstraksiyon sırasında beyne zarar verebilirler.
- Beyni yavaşça ikinci Petri kabına çıkarmak için küçük spatulayı kullanın.
- Önceden soğutulmuş bıçağı kullanarak beyni boyuna yarıklar halinde kesin.
- Bir yarımküreyi kesme çözeltisinin dışına ve plastik Petri kabına kaldırmak için büyük spatulayı kullanın. Yarımküre medial yüzeyinde yatarken, parietal korteksi Şekil 1B'degösterildiği gibi ikinci kesim için bir referansa sahip olmak için paralel çizgilerden biriyle hizalayın.
- İkinci kesimi, daha sonra beyni numune tutucusuna yapıştırmak için kullanılan yüzeyi elde etmek için bıçağı çizgilere paralel olarak konumlandırarak yarımkürenin ventral kısmında gerçekleştirin (bir sonraki adıma bakın), Şekil 1B'degösterildiği gibi. Yarımküreyi cam petri kabının oksijenli kesme çözeltisine geri döndürün ve ikinci yarımkürede aynı işlemi uygulayın.
- Yarımküreleri taze kesilmiş ventral tarafıyla yapıştırıcıyı yapıştırarak vibratom numune tutucusuna yapıştırın. Tutkalını katılaştırmak ve numune tutucuyu vibratom tepsisine taşımak için yarımkürelere birkaç damla kesme çözeltisi koyun. Bu şekilde dilimleme sırttan ventral hipokampusa doğru ilerleyecek.
- İlk bir veya iki transversal olmayan dilimi (Şekil 1C,ii-iii) ilgi alanı görünene kadar çıkarın ve sonra dilimleri toplamaya başlayın.
NOT: Dorsal hipokampustan dilimleme prosedürünün başında transversal olmayan ancak kullanılabilir, sağlıklı dilimler elde edilebilir (Şekil 1C,ii-iii). Her dilimin toplanması yaklaşık 3-4 dakika gerektirir. Ventral hipokampus yerine sırttan kesmeye başlayarak yaklaşık 10 dakika tasarruf ediyoruz, bu da sırt dilimlerinin canlılığını artırıyor. - Plastik bir pipetle (ucun dar ucunu kesin) her dilimi kuluçka odasına aktarın (35 ° C'de kesme çözeltisi içeren) ve 12 dakika dinlendirin. Sıcak kesme çözeltisinde kısa iyileşme süresi, Ting ve ark.'da bildirildiği gibi ilk nöronal şişliği büyük ölçüde azaltır. Daha sonra bir fırça kullanarak dilimi depolama odasına aktarın (RT'de depolama çözeltisi içeren) ve denemenin başlangıcına kadar dinlenmesine izin verin.
4. Tüm hücre kaydı ve biyositin dolumu
NOT: Tam hücreli yama kelepçesi kaydının açıklaması burada sadece iyi biyositin dolgusu elde etmeye yardımcı olan önemli adımlara indirgenir ve genellikle ACSF'deki nöronlar için geçerlidir. Elektrofizyolojik kayıtların prosedürleri ile ilgili ayrıntılar için, diğer birkaç protokole danışılabilir29,30.
- Kaydedilecek parametrelere göre uygun bir hücre içi çözelti seçin. Örnek olarak, mevcut kelepçe ölçümleri için potasyum glukonat bazlı bir çözelti kullanılabilir (mM cinsinden): 135 K-Glukonat, 3 KCl, 10 HEPES, 0.2 EGTA, 10 fosfokreatin-Na2, 4 MgATP, 0.3 Na2-GTP. 1 M KOH ile pH'ı 7,3'e ayarlayın. 3-5 mg/mL biyositin eklendikten sonra osmolalite yaklaşık 285-290 mOsmol / kg olmalıdır.
NOT: Kayıt sırasında nöronun şeklini izlemek için hücre içi çözeltiye 0.3-0.5 μL/mL 1 mM Alexa Flor Hydrazide eklenebilir. Bu durumda, Alexa boya rengini streptavidin ile birleştirilmiş floresan probla eşleştirmek için biyositin vahiyini hatırlayın. - Kalın duvarlı borosilikat kılcal damarlardan ≤1 μm uç çapında ve 3-5 MΩ dirençte patch-kelepçe elektrotları hazırlayın.
- Yama kelepçesi kurulumunun perfüzyon sistemini RT veya 35-37 °C'de 2,5-3 mL/dk hız ile başlatın ve U şeklinde bir ankrajla hazneye bir dilim sabitleyin.
- İlgi çekici beyin bölgesini tanımlayın ve dilimin yüzeyinin en az 30-50 μm altında soma ile sağlıklı bir nöron seçin.
NOT: Sağlıklı bir nöronun soması pürüzsüz bir yüzeye sahiptir ve zar kenarlıkları biraz zıttır. Sağlıksız nöronun soması küçülmüş ve oldukça zıt veya şişmiş ve yarı saydam görünür. - AgCl elektrotunun ucu kaplanana kadar hücre içi çözelti ile bir cam pipet yükleyin. Pipeti kayıt odasının çözeltisine taşıyın, cam elektrodun ucunu temiz tutmak için hafif bir pozitif basınç uygulayın.
NOT: Çözelti bir Alexa boyası içeriyorsa, basınç uçtan salınan floresan çözelti miktarını görsel olarak ayarlayarak kontrol edilebilir. Minimum basınç, hücrenin etrafındaki dokunun lekelenerek lekelenerek oluşmasını önler. - Hücreye eğik bir açıdan yaklaşın ve giga contasını oluştururken soma yüzeyinin ilk üçte biri içinde temas kurun. Basıncı serbest bırakın, tutma potansiyelini yavaşça 65 mV'ye taşıyın ve giga-conta oluşumunu kolaylaştırmak için ağızdan hafif bir emiş uygulayın.
- Tüm hücre konfigürasyonunu oluşturmak için, zarı kırmak için güçlü ve kısa emiş uygulayın. Nöronun 50 mV'den daha depolarize edilmiş bir membran potansiyeli varsa, tutma akımı 100 pA'nın üzerine çıkarsa veya erişim direnci 30 MΩ'nin üzerine çıkarsa kaydı atın.
- Kayıt sonrası (somata ve dendritlerin en az 15 dk yeterli doldurulması için önerilir; karmaşık aksonların bir saate kadar doldurulması için belkide 31gereklidir) elektrodu dikkatlice çıkarın. Bu amaçla tutma potansiyelini 0 mV olarak ayarlayın ve pipeti yavaşça yaklaşımın tersi yönde geri çekerek bir giga-seal oluşturmaya çalışın, örneğin dışarıdan bir yama yapılandırması elde etmek için.
NOT: Hücre içi çözeltilerde Alexa boyasının bulunması, pipetlerin nöronal yüzeyden görsel olarak yönlendirilmesine yardımcı olur. Hücrenin çekirdeği pipet ucuyla temas etmiyorsa, contayı reforme etmek için hızlı bir yöntem pipeti dokudan çapraz ve yukarı doğru yüksek hızda çekmektir. Çekirdeğin veya zarın bir kısmı ucun içinde yer alırsa, plazma zarının kırılma tehlikesi vardır. Bu durumda hafif bir pozitif basınç uygulaması ve yanal hareket yardımcı olabilir. - Hücrenin konumuna ve dilimin yönüne dikkat edin. Sabitlemeden sonra dilimin tam yönü ve dolu hücrenin bütünlüğü floresan mikroskop altında kontrol edilebilir.
5. İmmünasyon, görüntü edinme ve morfolojik rekonstrüksiyon
- Kayıttan sonra, dilimleri 0,1 M fosfat tamponlu salinde (PBS) % 4 paraformaldehitte (PFA) sabitlemek için 24 kuyulu bir tabağa aktarın. Kullanılan birincil antikorların hassasiyetine göre RT'de 60 dakika veya 4 °C'de bir gecede kuluçkaya yatırın. Dilimler 0.1 M PBS ve% 0.02 NaN3'tesaklanabilir.
DİkKAT: PFA toksiktir. Kaputun altında kullan. - Belirlenen protokollere göre kayıt olduktan sonraki bir hafta içinde immünostaining ve biositin vahiy gerçekleştirin32,33.
NOT: Dendritik ve aksonal süreçlerin bütünlüğünü korumak için dilimin yeniden bölümlenerek yapılmasını önleyen bir yordam kullanırız. Bununla birlikte, antikorların dokuya nüfuz etmesi gerektiğinden, bu prosedür daha uzun kuluçka süreleri gerektirir. Deneyi yapmadan önce antikorların dokuya en uygun şekilde nüfuz etme süresini test etmeyi öneriyoruz. - Z yığını ve döşeme tarama işlevine sahip bir konfokal mikroskop kullanarak görüntüler elde edin.
- Fiji imageJ34kullanarak morfolojik rekonstrüksiyon gerçekleştirin.
NOT: Bio-format eklentisi kullanılarak programa birkaç görüntü dosyası formatı aktarılabilir. Dendritlerin ve aksonun yeniden inşası için Simple Neurite Tracer (STN)eklentisi 35'in kullanılmasını öneririz. https://imagej.net/SNT ve http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/ basit ve net bir öğretici mevcuttur. İzleme verilerini (.traces) içeren dosya, sıkıştırılmamış olarak kaydedilirse, bir metin dosyasına dönüştürülebilir ve Matlab veya metin veri işleme için başka bir yazılımla açılabilir.
Sonuçlar
Bu protokolde hipokampüsün dorsal-ara kısmından akut hipokampal dilimlerin nasıl hazırlanacağını açıklıyoruz (Şekil 1A). Protokol özellikle mekansal öğrenmede yer alan mekanizmaları araştıran deneyler için uygundur ve dorsal hipokampus35'tedavranışsal çalışma veya viral etiketleme veya manipülasyon stratejileri ile birleştirilebilir. Burada açıklanan kesitleme prosedürünü, farklı Bregma koordinatlarındaki Pvalb-IRES-Cre farelerinin dorsal hipokampusuna adeno ilişkili virüsü (AAV-FLEX-GFP) ifade eden Cre-dependent GFP ile enjekte edilen hayvanlara uygulamak, ML ± 0.5-2 mm, derinlik-1.25-2.25 mm hipokampal formasyonun farklı bölgelerini hedeflemek için36 enfekte bölgeleri içeren en az üç transversal dilim elde edebildik (Hipokampüsün 3D modelindeŞekil 1A açık yeşil renklendirme). Ek olarak, dorsal hipokampüsün daha rostral kısımlarından birkaç transversal olmayan ancak sağlıklı dilim elde edilebilir (Şekil 1C).
Dilimlerimizin kalitesini ve canlılığını göstermek için Pvalb-IRES-Cre dentat girusunda granül hücrelerin ve tdTomato etiketli Parvalbumin pozitif (PV+) internöronların temel elektro-fizyolojik ve morfolojik parametrelerini kaydettik; Ai9 transgenik fareler (7-12 haftalık) ve bunları standart bir protokolle elde edilen aynı bölgenin koronal dilimlerinden elde edilen kayıtlarla karşılaştırdı.
Kızıl ötesi diferansiyel girişim kontrastı (IR-DIC) mikroskobu altında yapılan görsel incelemede, transversal ve koronal dilimimiz arasında net farklılıklar olduğunu fark ettik. Koronal dilimlerdeki ana hücre tabakasının nöronları genellikle kaba ortaya çıkar ve güçlü bir şekilde zıt anahatlar gösterirken, transversal dilimdeki nöronlar çoğunlukla pürüzsüz yüzeyler ve sadece hafifçe zıt kenarlıklar gösterdi, daha iyi hücresel canlılığın göstergesi (Şekil 2A). Koronal ve transversal dilimler arasındaki hücre canlılığındaki bu farklılıkların nedeni, fiber yollara göre kesit düzleminin yöneliminde yatabilir. Bunlar koronal bölümlerde paralel olmadığı için aksonlar ve dendritler kesilecektir. Bu varsayım doğrultusunda, dilimler içinde granül hücre tabakası ve hilus yüzey düzlemlerinin koronalde transversal dilimden daha fazla süreksizlik gösterdiğini gördük (yüzey düzlemlerinde adım boyutu: 41.40 ± 3.28 μm vs 25.60 ± 2.94 μm, Ortalama ± SEM, Eşleşmemiş t-test P = 0.023), koronal dilimde daha büyük bir doku kopukluğu olduğunu düşündürmektedir (Şekil 2B). Bu, patch-clamp kayıtları için uygun hücrelerin yalnızca koronal dilimler için granül hücre katmanının daha derin düzlemlerinde bulunacağı ve bunun da yama kelepçesi kayıtlarının verimini azaltabileceği anlamına gelir. Gerçekten de, transversal dilimdeki oluşumu mühürleme süresi koronal dilimlere göre daha hızlıydı (granül hücreler: 12.64± 1.50 sn, n=Koronal'da 11 ile 8.40 ± 0.75 sn, transversal dilimlerde n=14, Ortalama ± SEM, P= 0.0335 Mann-Whitney testi; PV+ internöronlar: 31.11 ± 2.60 sn, n=9 koronal ve 22.00 ± 2.18, n=7 transversal dilimlerde, Ortalama ± SEM, P= 0.0283 Mann-Whitney testi) (Şekil 2C). Daha sonra hücre bütünlüğü ve sağlığı için bir proxy olarak, hem granül hücrelerde hem de koronal vs'deki PV+ internöronlarda önemli ölçüde daha depolarize edilen granül hücrelerin ve PV+ internöronların dinlenme zarı potansiyellerini (RMP) kaydettik. transversal dilimler (granül hücreler:-62,55 ± 3,54 mV, n=11 koronal vs.-71,06 ± 2,31 mV, n=14 transversal dilimlerde, Ortalama ± SEM, P=0,0455 Mann-Whitney testi; PV+ internöronlar:-52.75 ± 1.66 mV, n=7 koronal vs.-59.36 ± 2.25 mV, n=6 transversal dilimlerde Ortalama ± SEM,, P= 0.0271 Mann-Whitney testi) (Şekil 2D). Bu veriler, transversalda koronal dilim hazırlığına karşı daha fazla sayıda sağlıklı nöron olduğunu göstermektedir. Gerçekten de, kabul edilebilir RMP için bir kesmenin başlatılması (granül hücreler için -55 mV;PV + internöronlar için 45 mV), koronaldeki dışlanmış hücrelerin transversal dilimlere göre daha yüksek bir yüzdesiyle sonuçlandı (39.67 ±% 8.37, n=3 deneysel Seans ve 23.00 ± %3.85, n=4 deneysel Oturumlar) (Şekil 2E). Ayrıca, kaydedilen granül hücrelerden nöronal morfolojinin yeniden yapılandırılması, beklendiği gibi transversal dilimdeki granül hücreler için tam bir aksonal arborizasyon alma şansının çok daha iyi olduğunu belirtmiştir (Şekil 3A,B). Ek olarak, PV+ internöronlarının transversal dilimlerde morfolojik rekonstrüksiyonu, dendritik dikenler35( Şekil3C)gibi küçük ayrıntıların görselleştirilmesi de dahil olmak üzere kapsamlı aksonal ve dendritik arborizasyonların tasvir edilmesine izin verdi.
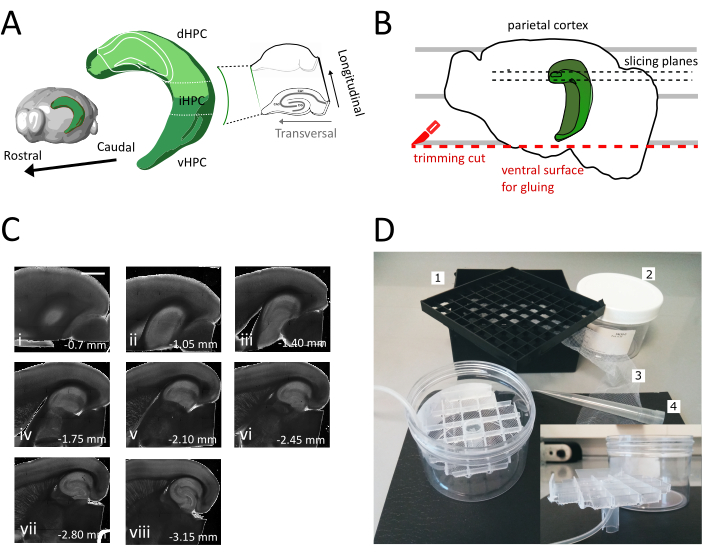
Şekil 1: Dorsal-ara hipokampustan dilim elde etmek için kesit prosedürünün gösterimi. (A) Beyindeki mekansal yönelimini gösteren hipokampal oluşumun üç boyutlu gösterimi (Beyin Gezgini, Allen Enstitüsü'nden değiştirilmiştir)37. Dong ve ark. (2009)7'yegöre hipokampüsün (dHPC, iHPC, vHPC) dorsal, orta ve ventral bölümleri belirtilmiştir. Dorsal-ara hipokampüsün dilimlenecek kısmı açık yeşil ile belirtilir. Sağdaki inset, başvuru eksenlerinin yönünü gösterir. (B) Parietal korteksin Petri kabındaki paralel çizgilerle hizalamasını gösteren bir beyin yarımküre karikatürü. Kırmızı noktalı çizgi, yarımküreyi numune tutucusuna yapıştırmak için yüzey oluşturmak için kırpma kesiminin (protokoldeki nokta 3.9) nerede gerçekleştirileceğimizi gösterir. Siyah noktalı çizgiler dilimlerin nerede toplandığını gösterir. (C) Bu işlemden sonra elde edilen hipokampal dilimlerin parlak alan görüntü serisi. Pial yüzeyden, dorsaldan ventrala: (i) 0,70 mm, (ii) 1,05 mm, (iii) 1,40 mm, (iv) 1,75 mm, (v) 2,10 mm, (vi) 2,45 mm (vii) 2,80 mm, (viii) 3,15 mm. Ölçek çubuğu= 1 mm. (D) Saklama odasının ve montajı için gerekli malzemenin fotoğrafı. 1. 81x kriyojenik şişe depolama kutusundan şişe ara ızgarası, 2. Silindirik plastik kutu. 3. Naylon ağ, 4. Pipet ucu. Ankastre. Silindirik kutuya takmak için ızgaranın ve tüp tutucunun yanal görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Transversal dilim, koronal dilime kıyasla gelişmiş dilim canlılığını gösterir. (A) Transversal ve koronal dilimlerde nöronal somatanın sağlıklı (siyah oklar) ve sağlıksız (beyaz oklar) örneklerini gösteren DIC-IR mikrografiler. Hil=hilus, gcl=granül hücre tabakası, ml= moleküler tabaka. Ölçek çubuğu = 50 μm. (B) Her iki kesit prosedürü de granül hücre tabakasının yüzeyi ile hilus (ok başlıkları ile gösterilir) arasında bir adım üretir. Adımın yüksekliği doku kopukluğu boyutunun göstergesidir ve transversal bölümlerde koronalden anlamlı olarak daha düşüktür (n=5 transversal ve n=5 koronal dilimler, Ortalama±SEM, P=0.0238 Mann-Whitney testi). (C) Granül hücrelerde giga-ohm conta oluşum zamanı (transversalda n=14 hücre, n=11 hücre koronal; Ortalama±SEM, P= 0.0355, Mann-Whitney testi) ve PV+ IN'ler (transversalda n=7 hücre, koronal dilimlerde n=9 hücre, Ortalama±SEM, P= 0.0283 Mann-Whitney testi) dilimleri. (D) Yamalı hücrelerin dinlenen membran potansiyeli (RMP) (sırasıyla, n= 14 ve n=11 granül hücreler). Ortalama±SEM, P=0.0455 Mann-Whitney testi. n=7 PV+ IN ve n=10 PV+ IN, P= 0,0271 Mann-Whitney testi). (E) Deneysel bir seans içinde atılan hücrelerin yüzdesi, (n=Koronal dilimli 3 seans, transversal dilimli n=4, Ortalama±SEM). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
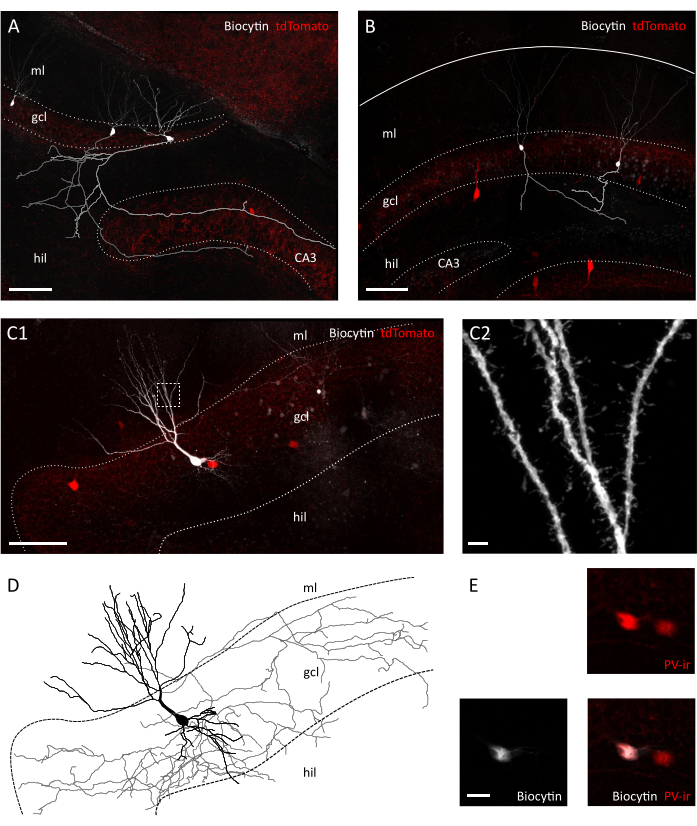
Şekil 3: Transversal dilimdeki granül hücrelerin ve internöronların morfolojik olarak korunması. Biyosit dolu granül hücrelerini bir transversal dilimde (A) ve Pvalb-IRES-Cre'nin koronal dilimlerinde (B) gösteren konfokal görüntüler; Ai9 transgenik fareler. İlgili aksonlar gri ve açık-gri olarak yeniden inşa edilmiştir. Hazırlıklar arasındaki akson uzunluğu ve karmaşıklığı arasındaki farka dikkat edin. Ölçek çubuğu=100 μm. (C1) Biyokimya dolgulu tdTomato pozitif internöron gösteren konfokal görüntü. Hil=hilus, gcl=granül hücre katmanları, ml= moleküler tabaka. Ölçek çubuğu=50 μm. (C2) C1'deki kutulu alanın büyütmesi, dendritik dikenleri gösterir. Ölçek çubuğu=2 μm (D) C1'de biyostin dolgulu internöronun akson ve dendritlerinin morfolojik rekonstrüksiyonu (gride akson, soma ve siyah dendritler). (E) Biyositin ve Parvalbumin-immünreaktivitenin (PVir) kolokalizasyonunu gösteren C1'de tasvir edilen hücrelerin somatasının yakın çekimi. Ölçek çubuğu=20 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Dorsal hipokampus, esas olarak davranış deneyleri, anatomik izleme ve bölgeye özgü manipülasyonlar yoluyla mekansal öğrenme ve navigasyondaki rolü için kapsamlı bir şekilde incelenmiştir. Dilim-elektro-fizyolojik sorguları bu tekniklerle birleştirmek için, hipokampüsün orta-ventral bölgesi için değiştirilmiş yatay dilimleme ile benzer bir kesit açısı kullanan, ancak dorsal-ara bölgeden erken dilimler elde etmek için ters dilimleme sırası kullanan bir protokol oluşturduk. Bu yaklaşım hipokampüsün dorsal bölgesini dilimleme ve toplamak için gereken süreyi azaltır, böylece dilimlerin canlılığını artırır.
Bu yöntemi kullanarak, şekil 1C'degösterildiği gibi, dorsal hipokampal bölgenin yarımküresi başına pial yüzeyden 1,4 mm-2,4 mm arasında rutin olarak yaklaşık üç dilim alabiliyoruz. Hipokampüsün çok septal kutbundan transversal dilimler elde etmek bu işlemle mümkün olmasa da, septal direkten yarımküre başına yaklaşık iki ek uygulanabilir transversal olmayan dilim toplamak mümkündür (Şekil 1C ii,iii). Hipokampüsün septal kutbu birincil araştırma odağı ise, özellikle hipokampüsün çok septal kutbundan transversal dilimlerin toplanmasına izin veren diğer protokoller21,32. Mekansal navigasyon ve öğrenme üzerine davranışsal deneyler tercihen tamamen gelişmiş nöronal bağlantıya sahip olgun farelerde gerçekleştirilir. Sonuç olarak, esnek yavru hazırlığından daha strese karşı daha hassas olan yetişkin hayvanların beyinlerine (üç aylık fareler için burada gösterilmiştir) uygulanması için dilimleme prosedürümüzü optimize ettik. Bu amaçla, beynin ekstraksiyon ve dilimlerin oksijenli ACSF'ye yerleştirilmesi arasındaki sürede maruz kaldığı hipoksik stresi azaltan çeşitli stratejileri birleştirdik. Koruyucu kesme çözeltisi, NMDA reseptörlerinin aktivasyonu nedeniyle eksotoksik hasarı ve hücre şişmesini azaltmak için düşük Na+ ve Ca2+ ile NMDG tabanlı bir ACSF25,27,28, ancak yüksek Mg2+ 'dır. Ek olarak, HEPES kararlı tamponlama sağlar ve askorbat ve piruvat gibi bileşikler oksidatif stresi azaltır. Soğutulmuş ve oksijenli koruyucu kesme çözeltisi ile trans-kardiyak perfüzyon, beyin dokusundaki metabolik talebi ve glutamat kaynaklı eksototoksisiteyi hızlı ve homojen bir şekilde azaltmak için beyne sağlayan son derece yoğun kılcal ağdan yararlanır. Daha sonra kafa kesmeyi takip eden hemen hemen tüm adımlar, metabolizmayı ve oksijen yoksunluğunu tüm prosedür boyunca minimumda tutmak için soğutulmuş ve oksijenli çözeltiler içinde gerçekleştirilir. Dilimleme sırasında beyin hasarını azaltmaya yönelik diğer stratejiler vardır ve eşit derecede geçerli olabilir38. Hazırlığımızın kalitesini göstermek için, dorsal hipokampustan kaydetmek için yaygın olarak kullanılan bir koronal dilim preparatı ile karşılaştırıyoruz. Koronal dilimler dentat girusunda iyi yama-kelepçe kaydı elde etmek için kullanılabilse de, sağlıksız ve bağlantısız nöronların sayısı transversal dilimden daha yüksektir. Ek olarak, aksonal ve dendritik arborizasyonların bütünlüğü transversal dilimde daha iyi korunur. Nitekim hipokampüsün boyuna eksenine ortogonal olarak çalışan granül hücre aksonlarının bütünlüğü (Şekil 3A), transversal dilimleme düzleminin bir göstergesi olarak hizmet eder1.
Yamalı nöronların doldurulması için 3 ila 5 MΩ arasında bir elektrot direnci öneriyoruz. Ucun yaklaşık 1 μm'lik bir çapı, kayıt sırasında iyi bir sızdırmazlık direncinin eldeılmasına ve elektrot geri çekilmesi üzerine iyi bir yeniden sızdırmazlık sağlar. En önemli ayrıntı, soma veya çekirdeğin parçalarının pipet içine emilmesini önlemektir. Bu nedenle, mümkün olduğunda hücre içi çözeltiye bir Alexa boyası dahil ederim. Boya, kayıt ve yeniden sızdırmazlık sırasında hücre şeklinin izlenmesini sağlar. Ayrıca, başarısız dolgu durumlarında immünhistokimya zamanından tasarruf edebilecek fiksasyondan sonra yamalı hücrenin bütünlüğünü değerlendirmeye izin eder. Alexa boyaları uzun fiksasyon süresi ile söndürüldüğü için, mümkünse kısa fiksasyon öneriyoruz.
Sonraki immünostaining için, dilimin yeniden bölümlenilmesini gerektirmeyen bir protokol kullanıyoruz. Fiksasyondan sonraki bir hafta içinde lekelenmeyi yapmanızı öneririz. Dilimler buzdolabında ne kadar uzun süre kalırsa, doku bozulması olasılığı o kadar yüksektir. Uzun bir depolama alanı önlenemezse, PBS'deki NaN3 konsantrasyonu% 0.05'e çıkarmanızı ve haftalık olarak yenilemeyi öneririz. Tüm dilimin immünostainasyonu, primer ve sekonder antikorlarla inkübasyon sürelerinin arttığı anlamına gelir. Genellikle, biyositin ortaya çıkarmak için, 4 ° C'de bir gece kuluçka yeterlidir, ancak diğer proteinler için boyama ile birleştirilirse, tüm boyama prosedürü çok daha uzun sürebilir. Permeabilizasyon engelleme ve anti-vücut inkübasyonunun ayrı ayrı optimize edilmesi gerekir. Genellikle, primer antikor için iki gün yeterlidir, bir gün ikincil için yeterli olabilir. Arka planın artmasını önlemek için yıkama adımlarının süresinin daha uzun antikor inkübasyonları ile birlikte artırılmasını öneririz.
Bu protokolde, yetişkin dokusunun nöronal canlılığını koruyan transversal veya neredeyse transversal hipokampal dilimler elde etmek için bir dilimleme yöntemi ve yamalı nöronların morfolojisini ve nörokimyasal kimliğini kurtarmak için pratik bir yaklaşım sunduk. Bu yöntem, hipokampüsün orta-dorsal kısmına odaklanan anatomik ve davranışsal çalışmalarla elektro-fizyolojik sonuçları eşleştirmek için kolayca yapılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Kerstin Kronenbitter ve Didier Gremelle'e teknik yardım için teşekkür ederiz. Grafik yazılım konusunda yardım için Umberto Morelli'ye ve videografi ve video düzenleme için Mathias Hoppe'a teşekkür ederiz. Laboratuvarımızdaki çalışmalar Deutsche Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Project-ID 434434223) ve GRK2154, Tıbbi Araştırma Konseyi G1100546/2 ve Kiel Üniversitesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Referanslar
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır