Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Uçucu yağların nano-bitkisel kapsüllemesini kullanan bir antimikrobiyal kumaş
Bu Makalede
Özet
Antimikrobiyal laboratuvar önlükleri, patojen birikiminin çapraz kontaminasyonunu ve kazara biyo-dökülmelerini önler. Burada, laboratuvar önlüğünün tipik kullanımı için etkinliği ve uygunluğu tam olarak değerlendirmek için nano-bitkisel kapsülleme ve modifiye standart testler kullanarak cilt dostu bir antimikrobiyal kumaş geliştirme protokolünü açıklıyoruz.
Özet
Laboratuvar önlükleri, biyolojik tehlike laboratuvarlarında ve sağlık tesislerinde, patojenlere, dökülmelere ve yanıklara doğrudan maruz kalmayı önlemek için koruyucu giysiler olarak yaygın olarak kullanılmaktadır. Bu pamuk bazlı koruyucu kaplamalar, gözenekli yapıları, nem tutma kapasiteleri ve kullanıcının vücudundaki sıcaklığın korunması nedeniyle mikrobiyal büyüme ve bağlantı bölgeleri için ideal koşullar sağlar. Birçok çalışma, hastane giysileri ve laboratuvar önlükleri üzerinde patojenik bakterilerin hayatta kaldığını ve mikrobiyal bulaşmanın vektörleri olarak işlev gördüğünü göstermiştir.
Bu sorunları çözmek için yaygın bir yaklaşım, tekstil terbiyesinde antimikrobiyal ajanların uygulanmasıdır, ancak birçok sentetik kimyasalın toksisitesi ve çevresel etkileri nedeniyle endişeler ortaya çıkmıştır. Devam eden pandemi, etkili antimikrobiyallerin ve çevre dostu ve toksik içermeyen formülasyonların araştırılması için de bir pencere açmıştır. Bu çalışma, kitosan nanopartiküllerinde kapsüllenmiş iki doğal biyoaktif bileşik olan karvakrol ve timol kullanır ve bu da 4 log'a kadar bir azalma (% 99.99) ile dört insan patojenine karşı etkili korumayı garanti eder. Bu patojenler sıklıkla biyolojik tehlike laboratuvarlarında kullanılan laboratuvar önlüklerinde tespit edilir.
İşlenmiş kumaşlar ayrıca% 90 mikrobiyal azalma ile 10 yıkama döngüsüne kadar direnç gösterdi, bu da kullanım amacı için yeterli. Laboratuvar önlüğü kullanımının tipik senaryolarını daha iyi temsil etmek için mevcut standart kumaş testlerinde değişiklikler yaptık. Bu iyileştirmeler, antimikrobiyal laboratuvar önlüklerinin etkinliğinin daha doğru bir şekilde değerlendirilmesine ve kısa sürede nötralize edilmesi gereken herhangi bir kazara mikrobiyal dökülmenin kaderinin simülasyonuna olanak tanır. Normal koruyucu paltolara kıyasla antimikrobiyal laboratuvar önlüklerinde patojenlerin zamanla birikmesini araştırmak için daha ileri çalışmalar önerilmektedir.
Giriş
Koruyucu beyaz önlük, mikrobiyoloji laboratuvarlarında ve sağlık tesislerinde zorunlu bir kişisel koruyucu ekipman (KKD) öğesidir ve patojenlere, dökülmelere ve yanıklara doğrudan maruz kalmaktan korur. Bu pamuklu paltolar birçok faktörden dolayı mikrobiyal büyümeyi teşvik eder - dokuma kumaş bağlantı yerleri ve havalandırma sağlar, üretim sürecinde kullanılan pamuk ve nişasta, kullanıcıdan pul pul dökülmüş epitel hücreleri ile birlikte besin sağlar ve kullanıcıya yakınlık sıcaklık ve nem verir. Tekstil ürünlerinde mikrop birikmesi de alerji ve hastane enfeksiyonu, hoş olmayan kokular ve kumaş bozulması gibi sağlık sorunlarına neden olabilir1.
Normal kıyafetlerin aksine, koruyucu paltolar birçok araştırmada bulunduğu gibi nadiren yıkanır veya dezenfekte edilir 2,3. Birçok çalışma, mikrobiyal bulaşmanın bir vektörü olarak işlev gören laboratuvar önlüklerinin kanıtlarını ve sağlık hizmeti ortamında hastane enfeksiyonları riskinigöstermektedir 2,4, özellikle metisilin dirençli Staphylococcus aureus (MRSA) gibi dirençli suşlar3; Bu nedenle, mikrobiyal kontaminasyondan korunmak için tasarlanan KKD'nin sağlık endişelerini gündeme getirmektedirler. Biyogüvenlik Seviye 2 (BSL-2) tesisleri veya mikrobiyoloji öğretim laboratuvarları bağlamında laboratuvar önlüğü ile ilişkili enfeksiyonlar hakkında yeterli kesitsel çalışma yoktur, ancak birçok düzenleyici otorite laboratuvar önlüklerinin kullanımını muhafaza seviyesi içinde kısıtlamaktadır. Bununla birlikte, Kuzey Amerika'daki birçok akademik kurum, aklama ve tesis içinde depolama gibi pratik kısıtlamalar nedeniyle gereksinimleri karşılamakta zorlanmaktadır, kafeteryalar ve kütüphaneler gibi halka açık alanlarda laboratuvar önlüğü giyme olayları yaygındır. Bu sorunlara pratik bir çözüm, tekstil terbiyesinde antimikrobiyal ajanların uygulanmasıdır.
Antimikrobiyal kumaşlar, esas olarak vücut kokusunu azaltmayı amaçlayan spor giyim, aktif giyim ve çoraplarda artan popülerlik kazanmaktadır. Bununla birlikte, bu kumaşların kullanımı, bazı gümüş kaplı pamuklu maskeler ve sağlık giysileri hariç, KKD geliştirmede yaygın değildir5. BSL-2 laboratuvarlarında bulunan yaygın patojenleri inhibe eden ve yaygın patojenlerin çapraz kontaminasyonuna karşı etkili koruma sağlayan laboratuvar önlükleri için antimikrobiyal bir kumaşın geliştirilmesini bildiriyoruz.
Şu anda, piyasada çeşitli antimikrobiyal kumaşlar ve kaplamalar mevcuttur, ancak bunların çoğu ağır metal kolloidal parçacıkları (örneğin, gümüş, bakır, çinko), organometalikler veya triklosan ve kuaterner amonyum bileşikleri gibi sentetik kimyasallar kullanır, bunlar çevre dostu değildir1 ve cilt tahrişi ve alerjiler gibi sağlık sorunlarına yol açabilir6. Bazı sentetik formülasyonlar, normal flora veya indükleyici antimikrobiyal direnç (AMR) gibi hedef olmayan mikroplar nedeniyle endişe yaratmaktadır. ABD Gıda ve İlaç Dairesi (FDA), kullanıcı için toksik olmaması ve eko-toksisite içermemesi gereken ticari antimikrobiyal kumaşları düzenler. Bu nedenle, geniş bir mikrop spektrumunu inhibe eden doğal biyositlere dayanan antimikrobiyal kumaşlar tercih edilir. Esansiyel yağlar (EO'lar) antimikrobiyal ve terapötik ajanlar olarak yaygın olarak kullanılmaktadır, ancak antimikrobiyal terbiyede kullanımları dayanıklılıkları nedeniyle sınırlıdır 6,7,8. Nano-bitkisel terbiye8 hakkındaki bilgi birikimimize ve pazar araştırmamıza dayanarak, bitkisel bazlı antimikrobiyal kumaş ticari olarak temin edilemez. Bunun nedeni, sentetik kaplamaların üretiminin kolay olması ve uzun ömürlü olmasıdır. Sadece araştırma amacıyla bildirilen birkaç nano-bitkisel kaplı tekstil arasında neem7, moringa 9 ve köri yaprakları9 bulunmaktadır.
Bu çalışma, kekik EO'larından ekstrakte edilen iki biyoaktif bileşeni kullanmaktadır: karvakrol ve timol, çok çeşitli bakteriyel patojenlere ve virüslere karşı etkilidir, ancak genellikle insanlar için güvenli olarak kabul edilmektedir10. Bununla birlikte, bu biyoaktif bileşenler uçucudur ve bu nedenle doğrudan kumaşa uygulandığında antimikrobiyal potansiyelleri kısa ömürlüdür. Nano-bitkisel kapsülleme, biyoaktif bileşenlerin veya ilaçların, çekirdeği çevresel bozulmadan koruyan ve böylece raf ömrünü artıran polimerik bir kabuğun içine yüklendiği bir işlemdir. Ek olarak, genellikle 10 nm ila 100 nm arasında değişen polimerik parçacıkların küçük boyutu, uygulamanın etkinliğini arttırır ve biyoaktif bileşiklerin kumaş üzerine salınmasını yavaşlatır. Bu biyoaktif bileşikler, gıda koruma10 gibi çeşitli amaçlar için kullanılır, ancak tekstil kaplaması için kullanılmaz.
Birçok polimerik kapsülleyici arasında kitosan, toksisite olmaması, biyolojik olarak parçalanabilirlik, mukoadezisite ve biyouyumluluk11 gibi birçok özelliği nedeniyle çekici bir adaydır. Deniz kabuklarında ve mantar hücre duvarlarında bulunan kitinden deasetilasyon işlemi ile elde edilen doğal bir polisakkarittir. İlaç veya protein dağıtımı 11,12,13, kontrollü salınım 14 ve antimikrobiyal filmler 10 gibi biyokimyasal ve gıda koruma uygulamalarında kullanılır. Kitosan suda kolayca çözünmez, ancak asidik ortamda kolloidal bir süspansiyon oluşturur. Biyoaktif moleküller, basit bir iki aşamalı iyonik jelasyon yöntemi 14,15,16 ile kitosan nanopartiküllerine (NP'ler) yüklenir. Bu süreçte, karvakrol ve timol gibi hidrofobik biyoaktif bileşikler, bir yüzey aktif madde olan Tween 80 tarafından desteklenen bir su içinde yağ emülsiyonu oluşturur. Daha sonra, polianyonik bir bileşik olan pentasodyum tripolifosfat (TPP), kompleksi stabilize etmek için polikatyonik polimer molekülleri boyunca amino grupları ile TPP moleküllerinin fosfat grupları arasındaki çapraz bağları oluşturmak için kullanılır. Bu kompleksleşme işlemi, kitosan matrisi içindeki biyoaktif bileşikleri katılaştırır, bu da daha sonra saflaştırılır ve antimikrobiyal kumaş üretmek için pamuk örnekleri üzerine kaplanır.
Nano formülasyonlar, kumaşa uygulanmadan önce emülsiyon formunda antimikrobiyal etkinlik açısından test edilmelidir. Bu, Kirby-Bauer disk difüzyonu, kuyu difüzyonu ve silindir plakası testi gibi kalitatif bir yöntemle rahatlıkla değerlendirilebilir. Bununla birlikte, silindir plakası testi17 , formülasyonun değişen hacimlerini yükleme ve boşluk bölgesini karşılaştırma esnekliği sağlar. Bu yöntemde, antimikrobiyal formülasyonlar paslanmaz çelik silindirlere yüklenir ve test mikroorganizması veya patojeni ile aşılanan yumuşak bir agar tabakasına yerleştirilir. Test organizmasına karşı üretilen klirens bölgesinin çapı, antimikrobiyal formülasyonun inhibitör potansiyeli ile orantılıdır ve bu nedenle et suyu seyreltme yöntemlerine alternatif olarak kullanılabilir. Bununla birlikte, açık bölgelerin boyutu, belirli standartlar korunmadıkça, yalnızca belirli bir plaka içindeki karşılaştırmalı veya nitel bir ölçüdür. Antimikrobiyal ajanlar, sırasıyla minimum inhibitör konsantrasyon (MIC) ve minimum bakterisidal konsantrasyon (MBC) ile ölçülebilen hücreleri öldürerek (biyostatik) veya büyümelerini inhibe ederek (biyostatik) veya hücreleri öldürerek patojenlere karşı etki eder. Bununla birlikte, biyoaktif kimyasalların etkinliği ve davranışı, formülasyonlarında (sıvı hal) ve kumaş18 gibi bir substrat üzerine kaplandığında farklıdır. Bunun nedeni, antimikrobiyal ajanların kumaşa yapışmasının stabilitesi, nem içeriği, substrat tipi ve mikropların yapışması gibi birçok faktörün etkinlikte rol oynamasıdır. Amaçlanan amaç sadece bakteriyostatik aktivite ise, "Paralel Çizgi Yöntemi"19 gibi kalitatif bir tahlil, difüzyon edilebilir antimikrobiyal formülasyonun nispeten hızlı ve kolay bir değerlendirmesini sağlayabilir. Bununla birlikte, bakterisidal etkiler belirlenecekse, çivili patojenin kütüğünün azaltılmasını sağlayan "Tekstil Malzemeleri Üzerindeki Antibakteriyel Yüzeylerin Değerlendirilmesi"20 kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Nanopartiküllerin hazırlanması
- Nano-bitkisel kapsülleme
- 50 mL% 1 (v / v) asetik asit hazırlayın.
DİKKAT: Buzul asetik asit, ciddi cilt yanıklarına ve göz hasarına neden olabilen tahriş edici bir maddedir. Tam uzunlukta bir laboratuvar önlüğü, nitril eldiven ve gözlük giyin ve duman davlumbazının altında çalışın. - 0.6 g kitosan gevreğini (orta moleküler ağırlıkta) 50 mL% 1 asetik asit içinde (yukarıda hazırlanan) çözerek kitosan çözeltisi (% 1.2 w / v) hazırlayın. Homojen bir emülsiyon elde etmek için gece boyunca (O / N) oda sıcaklığında (R / T) çalkalayın.
- 0,5 g Tween 80 ekleyin ve homojen bir çözelti elde etmek için 60 ° C'de 2 saat karıştırın (1.000 rpm). Biyoaktif bileşikler (karvakrol veya timol) eklemeden önce çözeltiyi R / T'ye getirin.
- Karışımı R / T'de 20 dakika karıştırırken (1.000 rpm) damla damla veya kademeli olarak 0.75 g karvakrol (veya timol) ekleyin. Kitosanın biyoaktif bileşiğe ağırlık oranı 1: 1.25'tir.
- R / T'de karıştırırken karışıma damla damla 50 mL (% 0,5 w / v) TPP ekleyin. homojen bir emülsiyon elde etmek için 30 dakika karıştırmaya devam edin.
- Aynı prosedürü izleyerek, ancak biyoaktif bileşiklerin eklenmesi olmadan negatif bir kontrol hazırlayın.
- 50 mL% 1 (v / v) asetik asit hazırlayın.
- Arıtma
- Emülsiyonu 4 ° C'de 30 dakika boyunca 10.000 × g'da santrifüj edin ve süpernatanı boşalttıktan sonra oluşan NP'leri (pelet) toplayın. Kapsülleme etkinliğini test etmek için süpernatantı ayırın.
- Parçacıkları (adım 1.2.1'den itibaren) sulu Tween 80 (% 1 v / v) kullanarak, bağlanmamış veya serbest biyoaktif bileşikleri çıkarmak için oluşturulan pelet hacminin iki katı ile yıkayın. Her yıkama adımında homojen bir çözelti oluşana kadar peletleri vorteksleyerek rahatsız ettiğinizden emin olun.
- Safsızlıklardan kurtulmak için parçacıkları (adım 1.2.2'den itibaren) deiyonize suyla iki kez yıkayın.
- Pelet (adım 1.2.3'ten itibaren) 30 mL deiyonize suda yeniden askıya alınarak NP'leri yeniden oluşturun. NP'leri 6 aya kadar 4 °C'de saklayın.
NOT: Deneme bu aşamada duraklatılabilir.
- Karakterizasyonu
- NP'leri deiyonize suda, 250 ila 400 nm arasındaki ultraviyole görünür (UV-Vis) okumalar aralığın içine düşene kadar seyreltin (absorbans >1).
- NP'lerin UV-Vis absorpsiyon spektrumlarını bir UV-Vis spektrofotometresi kullanarak 250 ila 400 nm arasında değişen dalga boyları üzerinden kaydedin.
- Bir aliquot (1 mL) NP'yi R / T'de bir dizi süre boyunca (örneğin, 1 ila 6 ay) saklayın ve antimikrobiyal etkiyi yeni bir numune ile birlikte silindir plakası yöntemiyle test edin.
- Kumaş üzerine kaplama
- NP'leri dokuma pamuklu bir kumaş üzerine ped-kuru-kür yöntemi 7,21 kullanarak uygulayın.
- Kumaş örneklerini, ıslatılana kadar 3 dakika boyunca bir kumaş bağlayıcı ile karıştırılmış NP'ler içeren çözeltiye daldırın. Ardından, fazla sıvıyı gidermek için renk örneklerini iki silindirli bir laboratuvar dişeğinden geçirin.
- Renk örneklerini 100 ° C'de 30 dakika boyunca fırında kurutun ve 10 dakika boyunca 130 ° C'de kürleyin.
- Son olarak, bağlanmamış NP'leri çıkarmak için renk örneklerini ultrason banyosunda 15 dakika yıkayın.
NOT: Alternatif olarak, aşağıda açıklanan basitleştirilmiş yöntemi izleyin.
- Pamuklu kumaşı (veya laboratuvar önlüğü renk örneklerini) 10 cm x 10 cm kareler halinde kesin.
- Kesilen parçaları, sentezlenmiş NP'nin 2 mL'sine (% 10) plastik bir kaba (12 cm x 12 cm) R/T'de 2 dakika daldırın.
- NP'leri bağlamak için 3 dakika boyunca 100 ° C'de ısıtın.
- Sulu Tween 80'de (%2 w/v) durulayarak bağlanmamış NP'leri çıkarın ve fırında 100 °C'de 30 dakika kurutun.
NOT: Bu antimikrobiyal kumaş R / T'de 2 yıl saklanabilir.
- NP'leri dokuma pamuklu bir kumaş üzerine ped-kuru-kür yöntemi 7,21 kullanarak uygulayın.
- Yıkama dayanıklılığı
- Kumaşı 50 mm x 50 mm kare renk örnekleri halinde kesin.
- Renk örneklerini 50 mL ılık musluk suyuna (40 °C) cam/plastik bir kaba koyun ve iki damla normal deterjan (antimikrobiyal olmayan) ekleyin.
- Sallanan bir platform çalkalayıcı veya manyetik karıştırıcı üzerinde 30 dakika durulayın.
- Hava ile kurutun veya 60 ° C'de 2 saat boyunca inkübe edin ve antimikrobiyal etkinliği test edin.
2. Nanopartiküllerin taranması için silindir plakası testi
- Üreticilerin talimatlarına göre triptikaz soya agar (TSA), triptikaz soya suyu (TSB), antibiyotik baz agar (ABA) ve antibiyotik tohum agarını (ASA) hazırlayın ve 121 ° C'de 15 psi'de 15 dakika boyunca otoklavlayarak ortamı sterilize edin.
- Etkinlik testlerinin yapıldığı ilgili mikropları (stoktan) yeni hazırlanmış TSA plakaları (veya herhangi bir uygun ortam) üzerinde üç yönlü çizgi plaka yöntemiyle alt kültüre alın ve saflık plakaları üretmek için inkübe edin. (Önerilen türler: S. aureus, E. coli, P. aeruginosa ve C. albicans.)
- Kültürleri TSB'de (10 mL tüpler) taze saflıkta plakalardan 35 ° C O / N'de orta derecede çalkalama (100-200 rpm) ile aşılayın.
- Test tüplerinin her birinde erimiş ASA'nın 5.0 mL'sini aliquot. Tüp sayısı, test edilen mikroorganizmaların sayısına karşılık gelir.
- Taban tabakasını oluşturmak için her Petri plakasına (100 mm x 20 mm) aseptik olarak 20 mL önceden sterilize edilmiş erimiş ABA dökün. Agar plakalarının sayısı, test edilecek mikroorganizmaların sayısına karşılık gelir. Medya katılaşana kadar bekleyin.
- Baz tabakasının katılaşmasından sonra, her erimiş ASA'yı adım 2.3'ten (1.0 mL, önceden 35 ° C'ye ısıtılmış) bir gece kültürü ile aşılayın ve içeriği (ASA ve kültür karışımı) derhal bir ABA plakasının yüzeyine aktarın. Erimiş agar tabakasını eşit şekilde dağıtmak için plakayı döndürün. Tohum tabakasının pürüzsüz ve çarpma veya kabarcıklardan arındırılmış göründüğünden emin olun.
- Bir çift steril cımbız kullanarak agar plakası başına altıgen bir desen üzerinde eşit aralıklarla yerleştirilmiş altı adede kadar paslanmaz çelik silindir (6 mm x 6 mm x 10 mm; preotoklavlanmış) yerleştirin (Şekil 1).
- Silindirleri, antimikrobiyal etkiler açısından taranmak üzere farklı hacimlerde (30 μL, 50 μL, 75 μL ve 100 μL) sentezlenmiş NP'lerle yükleyin. Negatif kontrol, herhangi bir biyoaktif bileşik içermeyen kontroldür.
- Yaygın bakteriyel patojenleri (örneğin, E. coli, S. aureus, P. aeruginosa) 24 saat boyunca 35 ° C'de ve mantar türlerini (örneğin, C. albicans) 3 gün boyunca R / T'de inkübe edin.
- Berrak bölgenin çapını ölçün ve sentezlenen NP'lerin etkinliğini karşılaştırın.
NOT: Bu test, kumaş üzerine kaplanacak en iyi NP'leri ön elemek için kullanılabilir.
3. Paralel çizgi yöntemi (AATCC 147'den modifiye edilmiştir)
- Malzeme hazırlama
- NP ile işlenmiş kumaşı 50 mm x 25 mm renk örnekleri halinde kesin.
- Mueller-Hinton agar (MHA), TSA ve TSB'yi üreticilerin talimatlarına göre hazırlayın ve 121 ° C'de 15 psi'de 15 dakika boyunca otoklavlayarak ortamı sterilize edin.
- Etkinlik testlerinin yapıldığı ilgili mikropları (stoktan) üç çizgi plaka yöntemiyle taze hazırlanmış TSA plakaları (veya uygun herhangi bir ortam) üzerinde alt kültüre alın ve bakteri lekeleri için 2 gün boyunca 35 ° C'de ve mantar suşları için 5 gün boyunca R / T'de saflık plakaları üretmek için inkübe edin. (Önerilen türler: S. aureus, E. coli, P. aeruginosa ve C. albicans.)
- Mikrobiyal kültürlerin yükselmesi
- Kültürleri TSB'de (10 mL tüpler) taze saflıkta plakalardan 35 ° C O / N'de orta derecede çalkalama (100-200 rpm) ile aşılayın.
- O / N kültürlerini 1.5 × 108 koloni oluşturan birim (CFU) / mL'ye veya 0.5 McFarland standardının bulanıklığına karşılık gelen (çoğu sağlıklı kültür için genellikle 1/10 ila 1/20 seyreltme) seyreltin.
- Yukarıdaki seyreltilmiş kültürü aşağıdaki gibi 4 mm'lik steril bir döngü kullanarak aşılayın. Bir döngü dolusu et suyu kültürü yükleyin ve Şekil 2'ye göre, her biri 6 cm uzunluğunda ve 1 cm aralıklarla beş paralel çizgi oluşturarak MHA agar plakasının yüzeyine aktarın. Döngüyü yeniden doldurmayın.
- Kumaş örneğini beş çizgi boyunca steril bir spatula kullanarak hafifçe bastırın, böylece kumaş merkezdedir ve beş çizgi çizgisinin tümüne dokunur. 24 saat boyunca 35 ° C'de inkübe edin.
- Antimikrobiyal etkinliğin kalitatif değerlendirilmesi
- İnkübe edilmiş plakayı, kumaşın kenarlarının ötesindeki çizgiler boyunca büyümenin kesilmesi açısından inceleyin (açık bölge, büyümenin inhibisyonunu gösterir).
- Denklemi (1) kullanarak kumaş örneğinin her iki tarafındaki çizgi çizgisi (W) boyunca bir inhibisyon bölgesinin ortalama genişliğini hesaplayın.
G = (T - D)/2 (1)
W = açık bölgenin genişliği; T = renk örneği genişliği de dahil olmak üzere net bölgenin toplam uzunluğu; D = kumaş örneğinin genişliği (25 mm).
4. Kantitatif günlük azaltma yöntemi (AATCC 100'den modifiye edilmiştir)
- Deneysel hazırlık
- Kumaşı 50 mm x 50 mm kare renk örnekleri halinde kesin.
- TSA, TSB, Letheen suyu ve fosfat tamponlu salin (PBS), üreticilerin talimatlarına göre hazırlayın ve ortamı otoklavlayarak sterilize edin.
- Steril TSB'deki saflık plakalarından izole kolonileri aşılayarak ve 18-24 saat boyunca 35 ° C'de inkübe ederek, etkinlik testlerinin yapıldığı ilgili mikropların O / N kültürlerini hazırlayın. (Önerilen türler: S. aureus, E. coli, P. aeruginosa ve C. albicans.)
- Mikrobiyal kültürlerin yükselmesi
- O / N kültürlerini 1,5 × 108 CFU / mL'ye veya 0,5 McFarland standardının bulanıklığına karşılık gelen (çoğu sağlıklı kültür için genellikle 1/10 ila 1/20 seyreltme) seyreltin.
- Kumaşın sıvı tutma kapasitesini aşağıdaki gibi ölçerek çivileme için uygun kültür hacmini belirleyin.
- Seyreltilmiş et suyu kültürünün bir dizi hacmini (örneğin, 100-500 μL) kumaş renk örneklerine (ayrı Petri plakalarında) ekleyin ve kumaş örneğinin suyu tamamen emeceği ve kalıntı/serbest sıvı bırakmayacağı şekilde hacmi seçin. Sıvı tutma kapasitesi, kumaşın türünden ve kalınlığından farklıdır. Normal pamuklu laboratuvar önlükleri için, kabaca 200 μL'dir.
- Her kültürün hacmini (yukarıda belirlenen sıvı tutma kapasitesi [örneğin, 200 μL]) steril Petri plakalarına yerleştirilen renk örneklerinin üzerine yerleştirin. Renk örneklerinin sayısı, test sayısına (örneğin, hemen ve yıkandıktan sonra test edilen kumaş [ve test edilen yıkama döngüleri]) ve temas süresi boyunca test edilen antimikrobiyal etkilere (belirli bir saat/günden sonra [örneğin, 30 dakika, 2 saat, Gün 1-3]) karşılık gelir.
NOT: Renk örnekleri üzerindeki kültürleri eşit dağılımla aşılamak için aerosol filtre uçlarına sahip bir mikropipet kullanın (sonraki kullanımlarda pipetin kirlenmesini önlemek için). - Negatif kontrol için, aynı tür işlenmemiş kumaş örneklerini kullanın. Karşılık gelen her test-mikrobiyal tür, temas süresi, farklı kumaşlar ve yıkama döngüleri için negatif kontrolü gerçekleştirin.
- Canlı plaka sayımları ile mikropların geri kazanılması
- Test edilecek gerekli temas süreleri/süreleri için (örneğin, 0 dakika, 30 dakika, 60 dakika, vb. veya hatta uzun vadeli etkiler için günler) aşılanmış renk örneklerinin (hem işlenmiş hem de işlenmemiş) R/T'de Petri plakalarının (kapaklar aralık) içinde hava ile kurumasına izin verin. Anında bir etkiyi ve nötralize edici etkinliği temsil etmek için her zaman bir "0 dakika" ekleyin.
- Renk örneklerini steril santrifüj tüplerini (50 mL) ayırmak için aseptik olarak aktarın ve kapakları sıkıca vidalayın.
- 1/100 seyreltme yapmak için Letheen suyu (ilgili nötralize edici tamponlar) ekleyin (örneğin, 200 μL'lik bir inokülum için 19.8 mL).
- Santrifüj tüplerini vidalı kapaklarla sıkıca kapatın ve orta hızda 1 dakika boyunca girdap yapın.
- Süspansiyonu, sonraki 1/10 seyreltmelerde steril PBS ile seri olarak seyreltin, böylece "işlenmemiş" grubun koloni sayıları sayılamayacak kadar düşük olur (TLTC).
- Seyreltmeleri (0.1 mL), mikroorganizmanın büyümesini destekleyen uygun ortam plakalarına (örneğin, bakteriler için TSA veya mantarlar için Sabouraud dekstroz agar [SDA]) veya büyümeyi optimize eden ve koloni sayımını doğru hale getirmek için iyi kontrast sağlayan herhangi bir ortama yapıştırın.
- Bakteri plakalarını 2 gün boyunca 35 ° C'de ve mantar plakalarını 5 gün boyunca R / T'de inkübe edin.
- Uygun CFU'ları doğrudan bir koloni sayacı kullanarak veya görüntüleme yazılımı (örneğin, CFU AI) kullanarak sayın.
- Denklemi kullanarak antimikrobiyal kumaş nedeniyle mikrobiyal log azalmasını ( R ) hesaplayın ( R ):
R =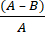 × 100 (2)
× 100 (2)
A = işlenmemiş kumaştan geri kazanılan CFU sayısının günlük değeri; B = işlenmiş kumaştan geri kazanılan CFU sayısının günlük değeri.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Sentezlenen NP'lerin ilk taraması
İki aşamalı su içinde yağ emülsiyon tekniği16'yı takiben, biyoaktif bileşikler (karvakrol ve timol) kitosan içinde başarıyla kapsüllenmiştir. Bu, herhangi bir biyoaktif bileşik içermeyen kitosan NP'ler olan kontrollere kıyasla, ilgili biyoaktif bileşiklerin tepe emilimi için UV-Vis spektrofotometrisi ile doğrulanmıştır. Oluşturulan NP'ler 4 ° C'de 12 ay boyunca homojen ve stabildi. Antimikrobiyal etkinliğin ilk taram...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Biyositlerin antimikrobiyal etkinliği, bakterilerin 24 saat boyunca bir antimikrobiyal sıvıya daldırıldığı minimum inhibitör konsantrasyon (MIC) ve minimum bakterisidal konsantrasyon (MBC) gibi kantitatif testlerle geleneksel olarak test edilir. Bununla birlikte, bu analizler, sıvı arayüzün eksik olduğu ve biyositlerin kumaş lifleri boyunca yavaşça yayıldığı kaplamalı kumaşlar için uygun değildir. Bu nedenle, AATCC 147, ISO 20645, AATCC 100 ve JIS L 1902 gibi birçok standart kumaş testi oluştu...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Bu çalışma "Uygulamalı Araştırma, İnovasyon ve Girişimcilik Hizmetleri" (ARIES), Centennial College, Kanada tarafından finanse edilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Referanslar
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır